Электросудорожная терапия: Электросудорожная терапия
Электросудорожная терапия как корректор некоторых побочных эффектов антипсихотической терапии | Быков
1. Kadiyala PK, Kadiyala LD. Anaesthesia for electroconvulsive therapy: An overview with an update on its role in potentiating electroconvulsive therapy. Indian J Anaesth. 2017; 61(5): 373-380. doi: 10.4103/ija.IJA_132_17
2. Sundsted KK, Burton MC, Shah R, Lapid MI. Preanesthesia medical evaluation for electroconvulsive therapy: a review of the literature. J ECT. 2014; 30: 35-42. doi: 10.1097/YCT.0b013e3182a3546f
3. Bartolommei N, Lattanzi L, Callari A, Cosentino L, Luchini F, Mauri M. Catatonia: a critical review and therapeutic recommendations. Journal of Psychopathology. 2012; 18: 234-246.
4. Hoirisch-Clapauch S, Mezzasalma MA, Nardi AE. Pivotal role of tissue plasminogen activator in the mechanism of action of electroconvulsive therapy. J Psychopharmacol. 2014; 28(2): 99105. doi: 10.1177/0269881113507639
5. Medda P, Toni C, Perugi G. The mood-stabilizing effects of electroconvulsive therapy. J ECT. 2014; 30: 275-282. doi: 10.1097/YCT.0000000000000160
J ECT. 2014; 30: 275-282. doi: 10.1097/YCT.0000000000000160
6. Lambrecq V, Villega F, Marchal C, Michel V, Guehl D, Rotge JY, Burbaud P. Refractory status epilepticus: electroconvulsive therapy as a possible therapeutic strategy. Seizure. 2012; 21(9): 661-664. doi: 10.1016/j.seizure.2012.07.010
7. Марыныч И.Н., Быков Ю.В, Нежинский Б.В. Использование электросудорожной терапии для коррекции аффективных расстройств у больных алкоголизмом с целью стабилизации ремиссии. [Электронный ресурс]. URL: https://psychoreanimatology.org/modules/articles/article.php?id=43
8. Марыныч И.Н., Быков Ю.В., Нежинский Б.В. Применение электросудорожной и атропинокоматозной терапии в комплексном лечении тяжёлых форм алкогольной зависимости. [Электронный ресурс]. URL: https://psychoreanimatology.org/modules/articles/article.php?id=51
9. Марыныч И.Н., Быков Ю.В., Нежинский Б.В. Терапевтическая эффективность электросудорожной терапии в раннем постабстинентном периоде у больных алкоголизмом. [Электронный ресурс]. URL: https://psychoreanimatology.org/modules/articles/article.php?id=44
[Электронный ресурс]. URL: https://psychoreanimatology.org/modules/articles/article.php?id=44
10. Tharyan P, Adams CE. Electroconvulsive therapy for schizophrenia. Cochrane Database Syst Rev. 2005; 2: CD000076. doi: 10.1002/14651858.CD000076.pub2
11. Singh A, Kar SK. How electroconvulsive therapy works?: Understanding the neurobiological mechanisms. Clin Psychopharmacol Neurosci. 2017; 15(3): 210-221. doi: 10.9758/cpn.2017.15.3.210
12. Нельсон А.И. Электросудорожная терапия в психиатрии, наркологии и неврологии. М.: БИНОМ. Лаборатория знаний; 2005.
13. Malhotra AK, Litman RE, Pickar D. Adverse effects of antipsychotic drugs. Drug Saf. 1993; 9(6): 429-436. doi: 10.2165/00002018-199309060-00005
14. Saltz BL, Robinson DG, Woerner MG. Recognizing and managing antipsychotic drug treatment side effects in the elderly. Prim Care Companion. J Clin Psychiatry. 2004; 6(Suppl 2): 14-19.
15. Carlson HE, Correll CU. Adverse effects of antipsychotics and mood stabilizers. Psychiatric times. 2007; 25(1). URL: https://www.psychiatrictimes.com/adverse-effects-antipsychotics-and-mood-stabilizers
Psychiatric times. 2007; 25(1). URL: https://www.psychiatrictimes.com/adverse-effects-antipsychotics-and-mood-stabilizers
16. Morrison P, Meehan T, Stomski NJ. Australian case managers> perceptions of mental health consumers use of antipsychotic medications and associated side-effects. Int J Ment Health Nurs. 2015; 24(2): 104-111. doi: 10.1111/inm.12118
17. McEvoy JP, Meyer JM, Goff DC, Nasrallah HA, Davis SM, Sullivan L, et al. Prevalence of the metabolic syndrome in patients with schizophrenia: baseline results from the Clinical Antipsychotic Trials of Intervention Effectiveness (CATIE) schizophrenia trial and comparison with national estimates from NHANES III. Schizophr Res. 2005; 80(1): 19-32. doi: 10.1016/j.schres.2005.07.014
18. Miranda PJ, DeFronzo RA, Califf RM, Guyton JR. Metabolic syndrome: definition, pathophysiology, and mechanisms. Am Heart J. 2005; 149(1): 33-45. doi: 10.1016/j.ahj.2004.07.013
19. Stomski NJ, Morrison P, Meyer A. Antipsychotic medication side effect assessment tools: A systematic review. Aust N Z J Psychiatry. 2016; 50(5): 399-409. doi: 10.1177/0004867415608244
Aust N Z J Psychiatry. 2016; 50(5): 399-409. doi: 10.1177/0004867415608244
20. Lader M. Some adverse effects of antipsychotics: Prevention and treatment: Current concepts and future prospects. J Clin Psychiatry Suppl. 1999; 60(S12): S18-S21.
21. Ascher-Svanum H, Zhu B, Faries DE, Lacro JP, Dolder CR, Peng X. Adherence and persistence to typical and atypical antipsychotics in the naturalistic treatment of patients with schizophrenia. Patient Prefer Adherence. 2008; 2: 67-77. doi: 10.2147/ppa.s2940
22. Chapman SC, Horne R. Medication nonadherence and psychiatry. Curr Opin Psychiatry. 2013; 26(5): 446-452. doi: 10.1097/YCO.0b013e3283642da4
23. Carlini ELDA, Nappo SA. The pharmacovigilance of psychoactive medications in Brazil. Braz J Psychiatry. 2003; 25(4): 200-205. doi: 10.1590/s1516-44462003000400004
24. Hamer S, Haddad PM. Adverse effects of antipsychotics as outcome measures. Br J Psychiatry Suppl. 2007; 191(S50): s64-s70. doi: 10.1192/bjp.191.50.s64
25. Stahl SM. Stahl’s Essential Psychopharmacology: Neuroscientific Basis and Practical Applications. 4th edition. Cambridge, United Kingdom: Cambridge University Press; 2013.
Stahl SM. Stahl’s Essential Psychopharmacology: Neuroscientific Basis and Practical Applications. 4th edition. Cambridge, United Kingdom: Cambridge University Press; 2013.
26. Stahl SM. Stahl’s Essential Psychopharmacology: Case studies. Volume 2. Cambridge, United Kingdom: Cambridge university press; 2015.
27. Stahl SM. Stahl’s Essential Psychopharmacology: Prescriber’s Guide. Cambridge, United Kingdom: Cambridge University Press; 2017.
28. Mukherjee S, Debsikdar V. Absence of neuroleptic-induced parkinsonism in psychotic patients receiving adjunctive electroconvulsive therapy. Convuls Ther. 1994; 10(1): 53-58.
29. Factor SA, Molho ES, Brown DL. Combined clozapine and electroconvulsive therapy for the treatment of drug-induced psychosis in Parkinson>s disease. J Neuropsychiatry Clin Neurosci. 1995; 7(3): 304-307. doi: 10.1176/jnp.7.3.304
30. Vela L, Jimenez Moron D, Sanchez C, Pareja JA, Baron M. Camptocormia induced by atypical antipsychotics and resolved by electroconvulsive therapy.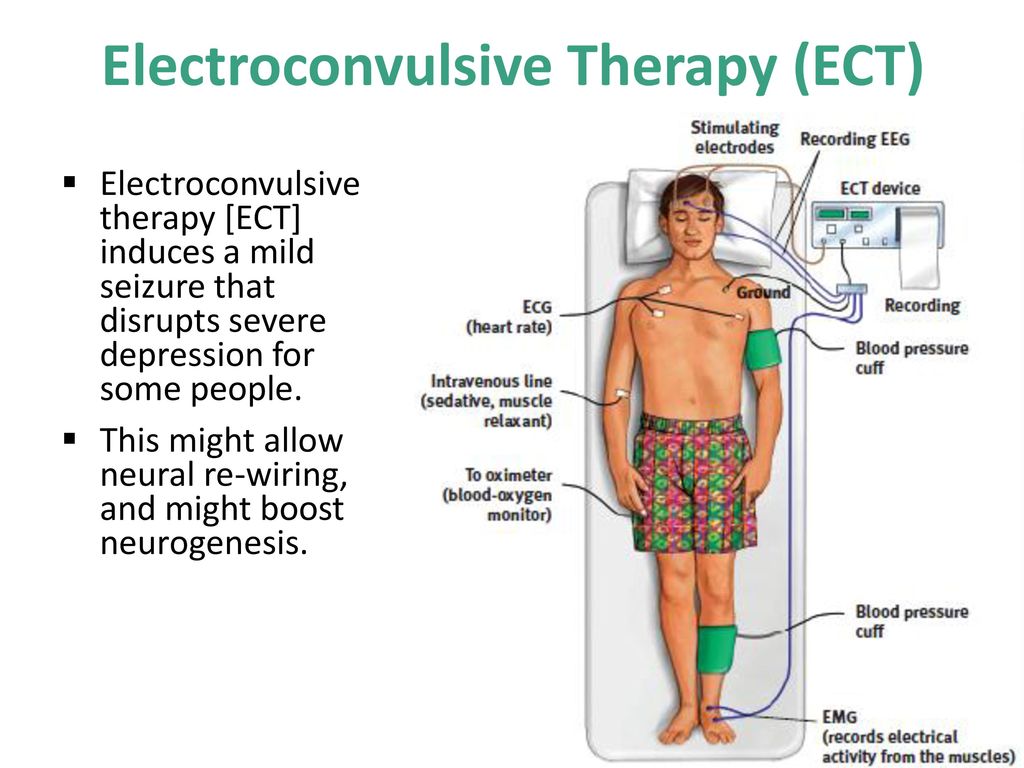 Mov Disord. 2006; 21(11): 1977-1980. doi: 10.1002/mds.21101
Mov Disord. 2006; 21(11): 1977-1980. doi: 10.1002/mds.21101
31. Baez MA, Avery J. Improvement in drug-induced parkinsonism with electroconvulsive therapy. Am J Geriatr Pharmacother. 2011; 9(3): 190-193. doi: 10.1016/j.amjopharm.2011.04.005
32. Беккер Р.А., Быков Ю.В. Акатизия: клинический анализ патологии с рекомендациями и обзором литературы. [Электронный ресурс]. URL: https://con-med.ru/upload/iblock/eaa/psi_akatisia2.pdf
33. Hermesh H, Aizenberg D, Friedberg G, Lapidot M, Munitz H. Electroconvulsive therapy for persistent neuroleptic-induced akathisia and parkinsonism: A case report. Biol Psychiatry. 1992; 31(4): 407-411. doi: 10.1016/0006-3223(92)90235-r
34. Caspi N, Levine J. Treatment of resistant akathisia with ECT: a case report. Isr J Psychiatry Relat Sci. 1993; 30(3): 175-178.
35. Van Harten PN, Kahn RS. Tardive dystonia. Schizophrenia Bull. 1999; 25(4): 741-748. doi: 10.1093/oxfordjournals.schbul.a033415
36. Havaki-Kontaxaki BJ, Kontaxakis VP, Margariti MM, Paplos KG, Christodoulou GN. Treatment of severe neuroleptic-induced tardive torticollis. Ann Gen Hosp Psychiatry. 2003; 2(1): 9. doi: 10.1186/1475-2832-2-9
Treatment of severe neuroleptic-induced tardive torticollis. Ann Gen Hosp Psychiatry. 2003; 2(1): 9. doi: 10.1186/1475-2832-2-9
37. Besson JAO, Palin AN. Tardive dyskinesia, depression and ECT. Br J Psychiatry. 1991; 159(3): 446. doi: 10.1192/bjp.159.3.446a
38. Gupta S, Mosnik D, Black DW, Berry S, Masand PS. Tardive dyskinesia: review of treatments past, present, and future. Ann Clin Psychiatry. 1999; 11(4): 257-266. doi: 10.1023/a:1022369614773
39. Kennedy R, Mittal D, O>Jile J. Electroconvulsive therapy in movement disorders: an update. J Neuropsychiatry Clin Neurosci. 2003; 15(4): 407-421. doi: 10.1176/jnp.15.4.407
40. Byne W, White L, Parella M, Adams R, Harvey PD, Davis KL. Tardive dyskinesia in a chronically institutionalized population of elderly schizophrenic patients: prevalence and association with cognitive impairment. Int J Geriatr Psychiatry. 1998; 13(7): 473-479. doi: 10.1002/(sici)1099-1166(199807)13:7<473::aid-gps800>3.0.co;2-z
41. Woerner MG, Alvir JMJ, Saltz BL, Lieberman JA, Kane JM. Prospective study of tardive dyskinesia in the elderly: rates and risk factors. Am J Psychiatry. 1998; 155(11): 1521-1528. doi: 10.1176/ajp.155.11.1521
Woerner MG, Alvir JMJ, Saltz BL, Lieberman JA, Kane JM. Prospective study of tardive dyskinesia in the elderly: rates and risk factors. Am J Psychiatry. 1998; 155(11): 1521-1528. doi: 10.1176/ajp.155.11.1521
42. Yasui-Furukori N, Kikuchi A, Katagai H, Kaneko S. The effects of electroconvulsive therapy on tardive dystonia or dyskinesia induced by psychotropic medication: a retrospective study. Neuro-psychiatr Dis Treat. 2014; 10: 1209-1212. doi: 10.2147/NDT.S62490.
43. Chacko RC, Root L. ECT and tardive dyskinesia: two cases and a review. J Clin Psychiatry. 1983; 44(7): 265-266.
44. Gosek E, Weller R. Improvement of tardive dyskinesia associated with electroconvulsive therapy. J Nerv Ment Dis. 1988; 176(2): 120-122. doi: 10.1097/00005053-198802000-00009
45. Malek-Ahmadi P, Weddige R. Tardive dyskinesia and electroconvulsive therapy. Convuls Ther. 1988; 4(4): 328-331.
46. Roth SD, Mukherjee S, Sackeim HA. Electroconvulsive therapy in a patient with mania, parkinsonism, and tardive dyskinesia. Convuls Ther. 1988; 4(1): 92-97.
Convuls Ther. 1988; 4(1): 92-97.
47. Hay DP, Hay L, Blackwell B, Spiro HR. ECT and tardive dyskinesia. J Geriatr Psychiatry Neurol. 1990; 3(2): 106-109. doi: 10.1177/089198879000300209
48. Sandyk R. The relationship between ECT responsiveness and subtypes of tardive dyskinesia in bipolar patients. Int J Neurosci. 1990; 54(3-4): 315-319. doi: 10.3109/00207459008986650
49. Hanin B, Lerner Y, Srour N. An unusual effect of ECT on drug-induced parkinsonism and tardive dystonia. Convuls Ther. 1995; 11(4): 271-274.
50. Ufok A, Ufok G. Maintenance ECT in a patient with catatonic schizophrenia and tardive dyskinesia. Convuls Ther. 1996; 12(2): 108-112.
51. Nobuhara K, Matsuda S, Okugawa G, Tamagaki C, Kinoshita T. Successful electroconvulsive treatment of depression associated with a marked reduction in the symptoms of tardive dyskinesia. J ECT. 2004; 20(4): 262-263. doi: 10.1097/00124509200412000-00014
52. Sienaert P, Peuskens J. Remission of tardive dystonia (blepharospasm) after electroconvulsive therapy in a patient with treatment-refractory schizophrenia. J ECT. 2005; 21(2): 132-134. doi: 10.1097/01.yct.0000167464.79327.0d
J ECT. 2005; 21(2): 132-134. doi: 10.1097/01.yct.0000167464.79327.0d
53. Sharma A, Hammer S, Egbert M, Sorrell JH. Electroconvulsive therapy and ocular dystonia. J ECT. 2007; 23(3): 181-182. doi: 10.1097/YCT.0b013e31806548e4
54. Delay J, Pichot P, Lemperiere T, Elissalde B, Peigne F. A non-phenothiazine and non-reserpine major neuroleptic, haloperidol, in the treatment of psychoses. Ann Med Psychol. 1960; 118(1): 145-152.
55. Беккер РА, Быков ЮВ, Морозов ПВ. Выдающиеся психиатры ХХ века. М.: ИД «Городец»; 2019.
56. Ruiz P. Addressing co-occurring disorders. Focus (Am Psychiatr Publ). 2017; 15(4): 9s-10s. doi: 10.1176/appi.focus.154S11
57. Wysokinski A. Intensive electroconvulsive therapy in drug resistant neuroleptic malignant syndrome — case report. Psychiatr Danub. 2012; 24(2): 219-222.
58. Strawn JR, Keck PE Jr, Caroff SN. Neuroleptic malignant syndrome. Am J Psychiatry. 2007; 164 (6): 870-876. doi: 10.1176/ajp.2007.164.6.870
59. Caroff SN, Mann SC, Campbell EC. Atypical antipsychotics and neuroleptic malignant syndrome. Psychiatric Annals. 2000; 30(5): 314-321. doi: 10.3928/0048-5713-20000501-09
Atypical antipsychotics and neuroleptic malignant syndrome. Psychiatric Annals. 2000; 30(5): 314-321. doi: 10.3928/0048-5713-20000501-09
60. Caroff SN, Mann SC. Neuroleptic malignant syndrome. Psychopharmacol Bull. 1988; 24(1): 25-29.
61. Caroff SN, Mann SC. Neuroleptic malignant syndrome. Med Clin North Am. 1993; 77(1): 185-202. doi: 10.1016/s0025-7125(16)30278-4
62. Stubner S, Rustenbeck E, Grohmann R, Wagner G, Engel R, Neundorfer G, et al. Severe and uncommon involuntary movement disorders due to psychotropic drugs. Pharmacopsychiatry. 2004; 37(Suppl 1): S54-64. doi: 10.1055/s-2004-815511
63. Caroff SN, Mann SC, Lazarus A. Neuroleptic malignant syndrome. Arch Gen Psychiatry. 1987; 44(9): 838-840. doi: 10.1001/archpsyc.1987.01800210090015
64. Harland CC, O>Leary MM, Winters R, Owens J, Hayes B, Melikian V. Neuroleptic malignant syndrome: a case for electroconvulsive therapy. Postgrad Med J. 1990; 66(771): 49-51. doi: 10.1136/pgmj.66.771.49
65. Verwiel JM, Verwey B, Heinis C, Thies JE, Bosch FH. Successful electroconvulsive therapy in a pregnant woman with neuroleptic malignant syndrome. Ned Tijdschr Geneeskd. 1994; 138(4): 196-199.
Successful electroconvulsive therapy in a pregnant woman with neuroleptic malignant syndrome. Ned Tijdschr Geneeskd. 1994; 138(4): 196-199.
66. McKinney P, Kellner C. Multiple ECT late in the course of neuroleptic malignant syndrome. Convuls Ther. 1997; 13(4): 269-273.
67. Trollor JN, Sachdev PS. Electroconvulsive treatment of neuroleptic malignant syndrome: a review and report of cases. Aust N Z J Psychiatry. 1999; 33(5): 650-659. doi: 10.1080/j.1440-1614.1999.00630.x
68. Nisijima K, Ishiguro T. Electroconvulsive therapy for the treatment of neuroleptic malignant syndrome with psychotic symptoms: a report of five cases. J ECT. 1999; 15(2): 158-163.
69. Kucia K, Warchala A. The application of electroconvulsive therapy in neuroleptic malignant syndrome treatment in a patient with catatonic schizophrenia. Wiad Lek. 2005; 58(9-10): 572-574.
70. Pandya HN, Keyes MJ, Christenson BC. Electroconvulsive therapy in a schizophrenic patient with neuroleptic malignant syndrome and pulmonary embolism: a case report. Psychiatry (Edgmont). 2007; 4(4): 21.
Psychiatry (Edgmont). 2007; 4(4): 21.
71. Patel AL, Shaikh WA, Khobragade AK, Soni HG, Joshi AS, Sahastrabuddhe GS. Electroconvulsive therapy in drug resistant neuroleptic malignant syndrome. J Assoc Physicians India. 2008; 56: 49-50.
72. San Gabriel MC, Eddula-Changala B, Tan Y, Longshore CT. Electroconvulsive in a schizophrenic patient with neuroleptic malignant syndrome and rhabdomyolysis. J ECT. 2015; 31(3): 197-200. doi: 10.1097/YCT.0000000000000184
73. Foguet-Boreu Q, Coll-Negre M, Serra-Millas M, Cavalleria-Verdaguer M. Neuroleptic malignant syndrome: a case responding to electroconvulsive therapy plus bupropion. Clin Pract. 2018; 8(1): 1044. doi: 10.4081/cp.2018.1044
74. Hill SK, Bishop JR, Palumbo D, Sweeney JA. Effect of second-generation antipsychotics on cognition: current issues and future challenges. Expert Rev Neurother. 2010; 10(1): 43-57. doi: 10.1586/ern.09.143
75. Biedermann F, Pfaffenberger N, Baumgartner S, Kem-mler G, Fleischhacker WW, Hofer A. Combined clozapine and electroconvulsive therapy in clozapine-resistant schizophrenia: clinical and cognitive outcomes. J ECT. 2011; 27(4): e61-e62. doi: 10.1097/YCT.0b013e31821a8f05
Combined clozapine and electroconvulsive therapy in clozapine-resistant schizophrenia: clinical and cognitive outcomes. J ECT. 2011; 27(4): e61-e62. doi: 10.1097/YCT.0b013e31821a8f05
76. Rayikanti R, Lentowicz I, Birur B, Li L. Combined antipsychotics and electroconvulsive therapy in an acutely psychotic patient with treatment-resistant schizophrenia. Psychopharmacol Bull. 2017; 47(2): 57-62.
77. Pawetczyk A, Kotodziej-Kowalska E, Pawetczyk T, Rabe-Jabtonska J. Is there a decline in cognitive functions after combined electroconvulsive therapy and antipsychotic therapy in treatmentrefractory schizophrenia? J Nerv Ment Dis. 2015; 203(3): 182-186. doi: 10.1097/NMD.0000000000000259
78. Vuksan Cusa B, Klepac N, Jaksic N, Bradas Z, Bozicevic M, Palac N, et al. The effects of electroconvulsive therapy augmentation of antipsychotic treatment on cognitive functions in patients with treatment-resistant schizophrenia. J ECT. 2018; 34(1): 31-34. doi: 10.1097/YCT.0000000000000463
79. Buckley NA, Sanders P. Cardiovascular adverse effects of antipsychotic drugs. Drug Saf. 2000; 23(3): 215-228. doi: 10.2165/00002018-200023030-00004
Buckley NA, Sanders P. Cardiovascular adverse effects of antipsychotic drugs. Drug Saf. 2000; 23(3): 215-228. doi: 10.2165/00002018-200023030-00004
80. Nahshoni E, Manor N, Bar F, Stryjer R, Zalsman G, Weiz-man A. Alterations in QT dispersion in medicated schizophrenia patients following electroconvulsive therapy. Eur Neuropsychophar-macol. 2004; 14(2): 121-125. doi: 10.1016/S0924-977X(03)00098-1
81. Gambhir S, Sandersfeld N, D’Mello D. A case of severe, refractory antipsychotic-induced orthostatic hypotension. Medical Student Research Journal. 2014; 4(Fall): 15-17. doi: 10.3402/msrj.v3i0.201337
Электросудорожная терапия (ЭСТ) — процедура, показания, результаты
Электросудорожная терапия (альтернативное название ЭСТ, электрошоковая терапия, ЭШТ) — это лечебная процедура, выполняемая под общей анестезией, при которой небольшие электрические токи пропускаются через мозг, намеренно вызывая короткий эпилептический припадок.
Содержание
Такая манипуляция, похоже, вызывает изменения в химии мозга и помогает быстро обратить вспять симптомы определенных психических заболеваний, например:
- шизофрению
- тяжелую депрессию
- психоз и мысли покончить жизнь самоубийством
- биполярное расстройство
- тяжелую манию
- состояние интенсивной эйфории, возбуждение или гиперактивность, которое возникает как часть биполярного расстройства
- злоупотребление психоактивными веществами
- кататонию, характеризующейся отсутствием движения, быстрыми или странными движениями, отсутствием речи
- агрессию у людей с деменцией.

Показания для электросудорожной терапии
ЭСТ может быть хорошим вариантом лечения, когда лекарства не переносятся или другие формы терапии не работают. В некоторых случаях она используется:
- во время беременности, когда лекарства нельзя принимать, потому что они могут нанести вред плоду
- у пожилых людей, которые не могут переносить побочные эффекты от психотропных препаратов.
Последствия
Большая часть стигмы, связанной с электрошоковой терапией, основана на ранних методах лечения, при которых высокие дозы электричества вводились без анестезии, что приводило к потере памяти, перелому костей и другим серьезным побочным эффектам. Современная электросудорожная терапия намного безопаснее. Хотя ЭСТ все еще может вызывать некоторые побочные эффекты, теперь она использует электрические токи в контролируемой среде для достижения максимальной выгоды с наименьшим количеством возможных рисков.
Осложнения после лечения электросудорожной терапией могут включать в себя:
- Путаница сознания. Сразу после лечения вы можете столкнуться с путаницей сознания, которая может длиться от нескольких минут до нескольких часов. Возможно, вы не знаете, где вы находитесь. Редко у пожилых людей путаница может длиться несколько дней.
- Потеря памяти. Некоторым людям трудно вспомнить события, которые произошли непосредственно перед лечением или за недели или месяцы до лечения. Это состояние называется ретроградной амнезией. У вас также могут возникнуть проблемы с воспоминаниями о событиях, которые произошли в течение нескольких недель до лечения. Для большинства людей эти проблемы с памятью обычно улучшаются в течение нескольких месяцев после окончания терапии.
- Физические побочные эффекты. В дни лечения ЭСТ некоторые люди испытывают тошноту, головную боль, боль в челюсти или боль в мышцах.
- Медицинские осложнения. Как и в случае с любым типом медицинской процедуры, особенно с анестезией, существует риск медицинских осложнений.
 Во время ЭСТ частота сердечных сокращений и артериального давления повышаются, а в редких случаях это может привести к серьезным проблемам с сердцем.
Во время ЭСТ частота сердечных сокращений и артериального давления повышаются, а в редких случаях это может привести к серьезным проблемам с сердцем.
Проведение электросудорожной терапии
Подготовка
Перед первым лечением электросудорожной терапии вам понадобится пройти комплексное обследование:
- Психиатрическая оценка
- Базовые анализы крови
- Рентген легких
- Электрокардиограмма
- УЗИ сердца
- МРТ головного мозга.
Чтобы подготовиться к электросудорожной терапии, следует выполнить диетические ограничения перед процедурой. Как правило, это означает отсутствие еды или воды за 12 часов до терапии.
Процедура электрошоковой терапии
Процедура ЭСТ занимает от 5 до 10 минут, с дополнительным временем для подготовки и восстановления. Она может быть выполнена во время госпитализации или в качестве амбулаторной процедуры. В начале терапии пациенту введут анестезию через внутривенную капельницу и мышечный релаксант, помогающий свести к минимуму припадок и предотвратить травмы.
В начале терапии пациенту введут анестезию через внутривенную капельницу и мышечный релаксант, помогающий свести к минимуму припадок и предотвратить травмы.
- Затем врач устанавливает ряд датчиков:
- Манжета артериального давления, расположенная вокруг одной лодыжки, останавливает попадание мышечного релаксанта в ногу и воздействия на мышцы. Когда начнется процедура, врач может контролировать активность судорог, наблюдая за движением в стопе.
- Специальные датчики проверяют состояние головного мозга, сердце, артериальное давление и подачу кислорода в легкие.
- Капа во рту поможет защитить зубы и язык от травм.
Следующим шагом пациента погружают в сон. Когда он спит и мышцы расслаблены, врач нажимает кнопку на аппарате ЭСТ. Это приводит к тому, что небольшое количество электрического тока проходит через электроды в мозг, вызывая эпилептический припадок, который обычно длится менее 60 секунд. Единственным наружным признаком того, что у пациента возник мини-судорожный приступ, может быть ритмичное движение стопы. В результате электрошока активность в мозгу резко возрастает. Это регистрируется электроэнцефалограммой. Внезапная повышенная активность ЭЭГ сигнализирует о начале судорог, за которым следует стабилизация мозговой активности.
В результате электрошока активность в мозгу резко возрастает. Это регистрируется электроэнцефалограммой. Внезапная повышенная активность ЭЭГ сигнализирует о начале судорог, за которым следует стабилизация мозговой активности.
Лечение электросудорожной терапии обычно проводится 2-3 раза в неделю в течение 3-4 недель, и курс в общей сложности занимает от 6 до 12 процедур. Некоторые врачи используют более новую форму терапии, называемую односторонней сверхбыстрой шоковой терапией, которая обычно проводится ежедневно 5 дней в неделю.
Как правило, пациент может вернуться к нормальной деятельности через несколько часов после процедуры. Тем не менее некоторым людям может быть рекомендовано не возвращаться на работу, не принимать юридические решения 1-3 недели после последней электрошоковой терапии.
Результаты
Ученые пока точно не знает, как ЭСТ помогает лечить тяжелую депрессию и другие психические заболевания. Однако известно, что многие химические аспекты функции мозга меняются во время и после судорог. Эти химические изменения могут основываться друг на друге, каким-то образом уменьшая симптомы. Многие пациенты начинают замечать улучшение своих симптомов после примерно 6 процедур электросудорожной терапии. Даже после того, как симптомы улучшатся, пациенту все равно понадобится постоянное лечение, чтобы предотвратить рецидив состояния. Поддерживающее лечение может включать ЭСТ с меньшей частотой, но чаще всего оно включает в себя антидепрессанты, психотропные лекарства или психологическое консультирование.
Эти химические изменения могут основываться друг на друге, каким-то образом уменьшая симптомы. Многие пациенты начинают замечать улучшение своих симптомов после примерно 6 процедур электросудорожной терапии. Даже после того, как симптомы улучшатся, пациенту все равно понадобится постоянное лечение, чтобы предотвратить рецидив состояния. Поддерживающее лечение может включать ЭСТ с меньшей частотой, но чаще всего оно включает в себя антидепрессанты, психотропные лекарства или психологическое консультирование.
Поделиться:
Список литературы:
- Банщиков В.Н., Рапопорт A.M. «Электросудорожная терапия в психоневрологических больницах СССР» // Журнал неврологии и психиатрии им С.С. Корсакова. 1952. — Т.52. — № 3. — с. 67-81.
- Венцовский Е.И. «Электросудорожная терапия» // В кн. «Руководство по психиатрии. Т.2. Под ред. Г.В.
 Морозова». Москва, 1988. — с. 535-542.
Морозова». Москва, 1988. — с. 535-542. - Гречко В.Е., Пузин М.Н., Авруцкий Г.Я. и др. «Электросудорожная терапия в лечении больных невралгиями тройничного нерва» // Журнал неврологии и психиатрии им. С.С.Корсакова. 1990. — Т.90. — №2. — с. 109-114.
- Ильина В.Н. «Клинико экспериментальные данные к разработке методик облегченной электросудорожной терапии» // Автореф. дисс.канд.мед. наук. Ярославль, 1953. — 14 стр.
- Комиссаров А.Г. «Эффективность электросудорожной терапии у пациента с инволюционным психозом» // Психиатрия. — 2003а. — Т.4. № 4. — с.69-71.
Электросудорожная терапия в XXI в.
«Это было блестящее лекарство, но мы потеряли пациента», – отметил Эрнест Хемингуэй после получения электросудорожной терапии депрессии в 1961 г.
«Для пациентов с резистентной к лечению депрессией, ЭСТ является жизненно важным вариантом лечения, который больше не должен относится к методу последнего выбора»,
Доктор Чарльз Келлнер в статье для Psychiatric Times в 2013 г. [9]
[9]
Несмотря на то, что электросудорожная терапия (ЭСТ) является эффективным и безопасным средством лечения многих психических расстройств [1], использование данного метода все еще вызывает ряд противоречий. В разное время ЭСТ воспринимали и как форму насилия в отношении женщин [2], и как небезопасный метод терапии пациентов, и даже как небезопасный метод для самих психиатров [3]. Кинематограф тоже подливал масла в огонь: ЭСТ в драматических целях был негативно изображён в таких известных фильмах, как «Пролетая над гнездом кукушки», «Дом на призрачном холме» и «Реквием по мечте» [4]. Однако, несмотря на все эти обвинения, ЭСТ одобряется для лечения тяжёлых психических расстройств в клинических рекомендациях таких стран, как США, Австрия, Канада, Австралия, Дания, Германия и Россия [5].
Эра судорожной терапии началась с инъекции камфоры, поставленной пациенту с кататонической шизофренией венгерским неврологом L.J. Meduna в 1934 г., а уже через 4 года итальянский психиатр L. Bini впервые провёл электрическую индукцию судорожных приступов у пациента с кататонией – метод продемонстрировал положительный лечебный эффект [6]. С 1940 г. при проведении ЭСТ врачи-исследователи стали использовать миорелаксант кураре для того, чтобы избежать вывихов и растяжения мышц в процессе судорожного приступа [6]. Постепенно начинали проводиться первые научные исследования, где изучалась эффективность ЭСТ в сравнении с плацебо, и уже в 1978 Американская психиатрическая ассоциация опубликовала первый отчет Целевой группы по ЭСТ с целью установления стандартов информированного согласия для пациентов, а также технических и клинических аспектов поведения ЭСТ. В 1985 г. Национальный институт психического здоровья (США) одобрил включение ЭСТ в клинические стандарты [6].
Bini впервые провёл электрическую индукцию судорожных приступов у пациента с кататонией – метод продемонстрировал положительный лечебный эффект [6]. С 1940 г. при проведении ЭСТ врачи-исследователи стали использовать миорелаксант кураре для того, чтобы избежать вывихов и растяжения мышц в процессе судорожного приступа [6]. Постепенно начинали проводиться первые научные исследования, где изучалась эффективность ЭСТ в сравнении с плацебо, и уже в 1978 Американская психиатрическая ассоциация опубликовала первый отчет Целевой группы по ЭСТ с целью установления стандартов информированного согласия для пациентов, а также технических и клинических аспектов поведения ЭСТ. В 1985 г. Национальный институт психического здоровья (США) одобрил включение ЭСТ в клинические стандарты [6].
Механизм действия ЭСТ полностью не известен. ЭСТ влияет на несколько компонентов центральной нервной системы, включая гормоны, нейропептиды, нейротрофические факторы и нейромедиаторы [7]. Так, почти каждая нейромедиаторная система головного мозга подвержена действию ЭСТ, в т. ч. серотонинергическая, холинергическая, дофаминергическая и др [6]. Кроме того, имеются данные, что при проведении курса ЭСТ изменяется уровень нейротрофического фактора мозга (BDNF) [8] и эндогенных опиоидов [7].
ч. серотонинергическая, холинергическая, дофаминергическая и др [6]. Кроме того, имеются данные, что при проведении курса ЭСТ изменяется уровень нейротрофического фактора мозга (BDNF) [8] и эндогенных опиоидов [7].
ЭСТ имеет показания к применению при таких психических расстройствах, как депрессия, биполярное аффективное расстройство (БАР), шизофрения и шизоаффективное расстройство.
Депрессия
ЭСТ может рассматриваться в качестве выбора в острой фазе депрессивного расстройства тяжёлой степени, которое сопровождается психотическими или кататоническими симптомами [10] ЭСТ также может быть предпочтительным методом терапии для пациентов с актуальными суицидальными идеями [10].
Биполярное аффективное расстройство
Показанием для проведения ЭСТ в рамках БАР можно рассматривать тяжелые или устойчивые к лечению маниакальные или смешанные эпизоды, а также БАР с быстрыми циклами. ЭСТ является методом выбора при лечении беременных женщин в маниакальной или депрессивной фазах БАР [12].
Для пациентов с выраженным изнурением организма, которое возникло из-за недостаточного потребления пищи и воды, суицидными тенденциями [11] или психотическими симптомами в рамках БАР, ЭСТ является разумным альтернативным методом лечения [12].
Шизофрения
ЭСТ эффективна при симптомах острой шизофрении, но не эффективна при хронической шизофрении [13] В сочетании с антипсихотическими препаратами ЭСТ может рассматриваться у пациентов с тяжелым психозом, резистентным к терапии [14]. Так, наибольший терапевтический эффект ЭСТ приобретает именно в сочетании с антипсихотической терапией [15].
Стоит отдельно отметить, что согласно критериям Американской психиатрической ассоциации терапевтическая резистентность при шизофрении рассматривается как незначительное снижение выраженности психотической симптоматики или полное отсутствие положительной динамики в течение 6-8 недель при проведении терапии двумя и более антипсихотиками из разных фармакологических групп в среднетерапевтических или максимальных дозах [14].
Клинические исследования продемонстрировали, что ЭСТ особенно эффективна для купирования позитивных и аффективных симптомов [16]. ЭСТ также следует применять у пациентов с выраженными кататоническими симптомами, которые до этого не отреагировали на адекватный курс бензодиазепинов [14]. В ремиссии ЭСТ также может применяться у пациентов, для которых данный метод оказался эффективным в острой фазе и для которых фармакологическая профилактика неэффективна или невозможна из-за побочных эффектов [14].
ЭСТ не имеет абсолютных противопоказаний. Однако многие медицинские состояния требуют более тщательного мониторинга со стороны лечащего врача при проведении курса ЭСТ [13].
Неврологические заболевания
Врачу следует соблюдать осторожность с пациентами с объемными внутричерепными процессами, так как эти люди имеют повышенный риск развития отека и вклинения головного мозга после ЭСТ [20]. ЭСТ увеличивает внутричерепное давление и приток крови к мозгу, поэтому пациенты с повышенным внутримозговым давлением или повышенным риском развития инсульта (напр. , пациенты с аневризмой) имеют дополнительные риски осложнений.
, пациенты с аневризмой) имеют дополнительные риски осложнений.
Кардиологические заболевания
Пациенты с кардиологическими заболеваниями перед проведением курса ЭСТ должны в обязательном порядке быть обследованы кардиологом [1]. Так, ЭСТ способна осложнить течение нестабильной стенокардии, декомпенсированной застойной сердечной недостаточности, неконтролируемой артериальной гипертензии, атриовентрикулярной блокады, а также симптоматических желудочковых аритмий у пациентов с данными заболеваниями [6].
Психические расстройства
ЭСТ не рекомендуется для лечения обсессивно-компульсивного расстройства (ОКР), но может рассматриваться для лечения сопутствующих расстройств, таких как депрессивное расстройство, мания и шизофрения у пациентов с ОКР [17].
Другие состояния
Пациенты с заболеваниями, связанными с вегетативной недостаточностью (например, клинически выраженный гипертиреоз, феохромоцитома), с изменённой чувствительностью к анестезии (например, боковой амиотрофический склероз, порфирия, дефицит псевдохолинэстеразы) могут потребовать более тщательного лабораторного и клинического обследования и более тщательного мониторинга во время ЭСТ [21].
Пациенты с диабетом, метаболическими нарушениями (например, гиперкалиемией, гипокалиемией, гипонатриемией), хронической обструктивной болезнью легких, гиперкоагулянтными состояниями, глаукомой и почечной недостаточностью также требуют тщательного мониторинга во время ЭСТ [22]. Пациенты с гастроэзофагеальной рефлюксной болезнью могут испытывать ухудшение симптомов во время ЭСТ, из-за стимуляции блуждающего нерва. [20]
Побочные эффекты ЭСТ включают потерю памяти (лакунарная, ретроградная амнезия), синусовую тахикардию, продлённый судорожный приступ, гипертонический приступ, головные боли, манию, расстройства сна, а также непродолжительный делирий [18].
В настоящее время ЭСТ проводится под общей анестезией (в США самый используемый анестетик – метогекситал [1]) с применением миорелаксантов и мониторингом ЭЭГ и мышечных движений. Обычно электроды размещают либо униполярно (область виска не ведущего полушария), либо биполярно (бифронтально или битемпорально) (См. Рис 1). Параметры электрического тока: длительность импульса 0,3-2,0 мс при 20-120 Гц в течение 0,5-8 с при токе 500-800 мА. Курс ЭСТ включает около 10 сеансов, которые проводятся 2-3 раза в неделю. ЭСТ можно проводить в амбулаторных условиях, если пациент имеет ухаживающее лицо в домашних условиях [19].
Рис 1). Параметры электрического тока: длительность импульса 0,3-2,0 мс при 20-120 Гц в течение 0,5-8 с при токе 500-800 мА. Курс ЭСТ включает около 10 сеансов, которые проводятся 2-3 раза в неделю. ЭСТ можно проводить в амбулаторных условиях, если пациент имеет ухаживающее лицо в домашних условиях [19].
Рис. 1 Вычислительная модель ЭСТ. (а) Типичные места размещения электродов, используемые в клинической практике: бифронтальное размещение (BF), битемпоральное размещение (BT) и правое одностороннее размещение (RUL).«A» и «B» – метки размещения для отдельных электродов. (b) величина плотности внеклеточного тока в головном мозге через 0,4 миллисекунды после начала стимуляции электрическим током. Адаптировано Bai et al. (2012) [19].
Материал подготовлен при поддержки клиники Доктор САН – ведущей частной психиатрической клиники и одним из лучших наркологических стационаров на территории Северо-Западного региона.
Подготовил: Касьянов Е. Д.
Д.
Библиография:
1 – American Psychiatric Association. The Practice of Electroconvulsive Therapy: Recommendations for Treatment, Training, and Privileging. A Task Force Report of the American Psychiatric Association. 2nd ed. American Psychiatric Publishing; 2001.
2 – Burstow B. Electroshock as a form of violence against women. Violence Against Women. 2006 Apr. 12(4):372-92.
3 – Burstow B. Electroshock as a form of violence against women. Violence Against Women. 2006 Apr. 12(4):372-92.
4 – McDonald A, Walter G. The portrayal of ECT in American movies. J ECT. 2001 Dec. 17(4):264-74
5 – Ottosson JO, Fink M. Ethics in Electroconvulsive Therapy. New York: Routledge; 2004.
6 – Sadock BJ, Sadock VA. Brain Stimulation Methods. Kaplan & Sadock’s Synopsis of Psychiatry: Behavioral Sciences/Clinical Psychiatry. 10th ed. Lippincott Williams & Wilkins; 2007. Chapter 36.37.
Chapter 36.37.
7 – Wahlund B, von Rosen D. ECT of major depressed patients in relation to biological and clinical variables: a brief overview. Neuropsychopharmacology. 2003 Jul. 28 Suppl 1:S21-6.
8 – Marano CM, Phatak P, Vemulapalli UR, et al. Increased plasma concentration of brain-derived neurotrophic factor with electroconvulsive therapy: a pilot study in patients with major depression. J Clin Psychiatry. 2007 Apr. 68(4):512-7.
9 – Sicher S et al. Electroconvulsive therapy: Promoting awareness among primary care physicians.Int J Psychiatry Med. 2016 Apr;51(3):278-83.
10 – American Psychiatric Association. Guideline Watch: Practice Guideline for the Treatment of Patients with Major Depressive Disorder, Second Edition. American Psychiatric Association Practice Guidelines.
11 – American Psychiatric Association. Practice Guideline for the Assessment and Treatment of Patients With Suicidal Behaviors. American Psychiatric Association Practice Guidelines.
American Psychiatric Association Practice Guidelines.
12 – American Psychiatric Association. Practice Guideline for the Treatment of Patients With Bipolar Disorder, Second Edition. American Psychiatric Association Practice Guidelines.
13 – American Psychiatric Association. Electroconvulsive Therapy (ECT) Position Statement. December 2007. Accessed February 4, 2009.
14 – American Psychiatric Association. Practice Guideline for the Treatment of Patients With Schizophrenia, Second Edition. American Psychiatric Association Practice Guidelines.
15 – Painuly N, Chakrabarti S. Combined use of electroconvulsive therapy and antipsychotics in schizophrenia: the Indian evidence. A review and a meta-analysis. J ECT. 2006 Mar. 22(1):59-66.
16 – Chanpattana W, Andrade C. ECT for treatment-resistant schizophrenia: a response from the far East to the UK. NICE report. J ECT. 2006 Mar. 22(1):4-12
17 – American Psychiatric Association. Practice Guideline for the Treatment of Patients With Obsessive-Compulsive Disorder. American Psychiatric Association Practice Guidelines.
Practice Guideline for the Treatment of Patients With Obsessive-Compulsive Disorder. American Psychiatric Association Practice Guidelines.
18 – Leroy A. et al. Is electroconvulsive therapy an evidence-based treatment for catatonia? A systematic review and meta-analysis. Eur Arch Psychiatry Clin Neurosci. 2017 Jun 21. doi: 10.1007/s00406-017-0819-5
19 – Juri D. Kropotov. Electroconvulsive Therapy. Functional Neuromarkers for Psychiatry. 2016, Pages 267–271
20 – Taylor S. Electroconvulsive therapy: a review of history, patient selection, technique, and medication management. South Med J. 2007 May. 100(5):494-8.
21 – Pandya M, Pozuelo L, Malone D. Electroconvulsive therapy: what the internist needs to know. Cleve Clin J Med. 2007 Sep. 74(9):679-85
22 – Cohen SD, Norris L, Acquaviva K, Peterson RA, Kimmel PL. Screening, diagnosis, and treatment of depression in patients with end-stage renal disease. Clin J Am Soc Nephrol. 2007 Nov. 2(6):1332-42
Clin J Am Soc Nephrol. 2007 Nov. 2(6):1332-42
Электросудорожная терапия: жестокая пытка или эффективный метод?
Человек среди людей
Электросудорожная терапия (ЭСТ) — очень эффективный метод для лечения тяжелых психических болезней. И применяют его не «в странах третьего мира, где есть проблемы с лекарствами», а в США, Австрии, Канаде, Германии и других благополучных государствах.
Этот метод широко известен в кругах психиатров и в России. Но до пациентов правдивая информация о нем доходит не всегда. Вокруг ЭСТ столько предрассудков и мифов, что люди не особенно готовы изучать другие точки зрения.
Кто это придумал?
В 1938 году итальянские психиатры Лучо Бини и Уго Черлетти попробовали лечить кататонию (психопатологический синдром) электричеством. И получили хорошие результаты. Потом было множество разных экспериментов, отношение к электрошоковой терапии менялось. Поначалу на метод возлагали большие надежды. Затем, с 1960-х годов, интерес к нему уменьшился, стала активно развиваться психофармакология. А к 1980-м годам ЭСТ «реабилитировали» и продолжили исследовать его эффективность.
А к 1980-м годам ЭСТ «реабилитировали» и продолжили исследовать его эффективность.
Когда это необходимо?
Сейчас показаниями для ЭСТ могут быть многие заболевания.
Например, шизофрения. Конечно, сразу после постановки диагноза никто не будет бить человека током. Это как минимум неэтично. Для начала назначают курс лекарств. Но если таблетки не помогают, то вполне можно и даже нужно попробовать этот метод. Но, конечно, строго определенным способом и под наблюдением специалистов. В мировой практике для этого нужно получить информированное согласие пациента. Исключения делают только в особо тяжелых и срочных случаях.
Чаще всего ЭСТ помогает при галлюцинациях и бреде. Что такое галлюцинации, я думаю, вы знаете. При шизофрении они обычно появляются в виде голосов. Но не всегда. Могут быть и ощущения прикосновений, и вкусовые галлюцинации, и даже зрительные, когда человек видит то, чего на самом деле нет (не путать с иллюзиями, когда мы в темноте принимаем куст за демоническую собаку).
Бред — это нарушение мышления. Например, человеку начинает казаться, что он член секретного отдела правительства и за ним следят шпионы. Вся его жизнь постепенно подчиняется такому мышлению. И дальше он обычно попадает в больницу. С этими симптомами ЭСТ работает очень эффективно. Но, повторюсь, на процедуру обычно можно попасть, только если таблетки не оказали нужного действия.
Электросудорожная терапия проводится под наркозом. Человек ничего не чувствует
При биполярном аффективном расстройстве тоже иногда применяется электросудорожная терапия. Если вкратце, это заболевание с разными фазами. Человек то целыми днями погружен в депрессивные переживания, ничто его не радует и не интересует. То, наоборот, у него появляется куча сил и энергии, с которыми практически не возможно совладать.
Люди бесконечно меняют партнеров по сексу, берут кредиты на ненужные покупки или уезжают на Бали, никому не сказав и не оставив записки. И как раз маниакальные фазы не всегда легко поддаются лечению медикаментами. В этом случае на помощь может снова прийти ЭСТ.
И как раз маниакальные фазы не всегда легко поддаются лечению медикаментами. В этом случае на помощь может снова прийти ЭСТ.
Некоторые граждане романтизируют эти состояния, сопровождающие биполярное расстройство, но на самом деле они очень тяжелые. И всегда заканчиваются жесткой депрессией, в которой уж точно нет ничего хорошего.
А еще ЭСТ используют, если мания развилась на фоне беременности. Потому что стандартные для такой терапии препараты почти всегда полностью противопоказаны.
При тяжелых депрессиях ЭСТ тоже может использоваться, но делают это не так часто.
Как это происходит
Электросудорожная терапия проводится под наркозом. Человек ничего не чувствует. Одновременно всегда применяются миорелаксанты, чтобы пациент не вывихнул ноги или руки. Подключают электроды, несколько раз пускают ток — и все. Человек просыпается, и через 3 дня процедура повторяется. Курс обычно включает 10 сеансов.
Назначают ЭСТ далеко не всем, для некоторых пациентов есть противопоказания. Обычно это тяжелые проблемы с сердцем, некоторые неврологические заболевания и даже некоторые психические заболевания (например, обсессивно-компульсивное расстройство). Но об этом каждому обязательно расскажет врач и для начала отправит на анализы.
Обычно это тяжелые проблемы с сердцем, некоторые неврологические заболевания и даже некоторые психические заболевания (например, обсессивно-компульсивное расстройство). Но об этом каждому обязательно расскажет врач и для начала отправит на анализы.
Об авторе
Кирилл Сычев — врач-психиатр, когнитивно-поведенческий психотерапевт, основатель центра клинической психологии «Доктор Сычев». Его блог.
Источник фотографий:Getty Images
Новое на сайте
«Как отучить мужа контролировать меня в быту?»
3 секрета, чтобы стать лучшими бабушкой и дедушкой
Почему опасно быть милым: 6 причин
Гештальт должен быть закрыт: что это значит
Тест: Какую зависть вы испытываете чаще — белую или черную?
«За всю мою жизнь ни один мужчина не захотел от меня ребенка. Что со мной не так?»
Планирование беременности: что важно знать
Каким секс будет завтра? Обсуждают психолог, сексолог и суррогатный партнер
✚ Электросудорожная терапия .
 Нейропсихиатрическая клиника профессора Минутко. Статья №9747
Нейропсихиатрическая клиника профессора Минутко. Статья №9747 Определение и показания
Электросудорожная терапия (ЭСТ) — это терапевтическая процедура , направленная на индукцию судорожных припадков с помощью эпикраниальных электродов, размещенных в одностороннем или двустороннем порядке — является одной из наиболее эффективных стратегий лечения рекуррентной депресии, демонстрирующей превосходную эффективность по сравнению с антидепрессантами. Одним из основных показаний для ЭСТ является резистентная к лечению депрессия, при которой этот метод лечения может достигать уровня ремиссии до 50%. Кроме того, поскольку начало действия намного быстрее, чем у обычных антидепрессантов, ЭСТ может быть подходящим выбором для пациентов с высоким риском самоубийства. Имеются указания на то, что использование ЭСТ «не по назначению» может быть полезным при других психоневрологических расстройствах, включая биполярное аффективное расстройство шизофрению, болезнь Паркинсона и болезнь Хантингтона, кататония и злокачественный нейролептический синдром Это может объяснить диапазон эффектов ЭСТ, так как все расстройства, о которых сообщалось, что они улучшаются под влиянием этого метода терапии, были связаны с нарушением регуляции иммунитета и / или нейротрофическим дефицитом.
Влияние электросудорожной терапии на гиппокамп
Субгранулярная зона гиппокампа является одним из немногих участков мозга взрослого млекопитающего, где происходит нейрогенез. Несколько линий доклинических данных связывают рекуррентную депрессию с нарушением нейрогенеза. Например, исследования магнитно-резонансной томографии показали уменьшение объема гиппокампа у пациентов с этим психическим расстройством , что коррелировало с продолжительностью болезни. Кроме того, имеются данные о дисфункции гиппокампа при рекуррентном депрессивном расстройстве, что приводит к ухудшению памяти. Нейрогенная теория рекуррентной депрессии дополнительно подкрепляется тем фактом, что эффекты антидепрессантов на поведение в значительной степени зависят от их способности стимулировать нейрогенез гиппокампа на моделях животных.
Доклинические исследования также показывают, что хроническое введение ЭСТ связано с увеличением числа гранулярных клеток гиппокампа и прорастанием мшистых волокон гранулярных клеток.
Нейротрофический фактор мозга
Нейрогенез гиппокампа регулируется различными нейротрофическими факторами . Одним из наиболее изученных нейротрофических факторов является нейротрофический фактор мозга (BDNF). «Нейротрофическая гипотеза» депрессии постулирует, что рекууррентная может быть результатом вызванного стрессом снижения BDNF и гомологичных факторов в сетях ЦНС, вовлеченных в патогенез и / или лечение психического расстройства. Действительно, антидепрессанты повышают уровни BDNF в гиппокампе, и считается, что это увеличение имеет решающее значение для их терапевтического эффекта. Кроме того, введение BDNF в гиппокамп индуцирует нейрогенез и оказывает антидепрессивное действие на животных моделях депрессии. Эти антидепрессантоподобные эффекты могут быть опосредованы измененной чувствительностью к стрессу, поскольку было показано, что чувствительность к вызванному стрессом депрессивному поведению связана с экспрессией BDNF в гиппокампе у мышей с измененной экспрессией глюкокортикоидного рецептора. Несколько линий доказательств демонстрируют, что ЭСТ изменяет уровни BDNF и / или передачу сигналов BDNF, подтверждая, что этот нейротрофин может быть также вовлечен в антидепрессантные эффекты ЭСТ. У грызунов ECS увеличивает мРНК и белок BDNF в областях коры и гиппокампа. В дополнение к BDNF, ECS усиливает экспрессию мРНК рецептора BDNF, TrkB (тирозин-рецепторная киназа B), в нескольких областях коры и гиппокампа, а также внутриклеточных сигнальных каскадах, активируемых TrkB, таких как Ras-Raf путь -MEK-ERK и путь PI3K / Akt. Эти пути стимулируют различные внутриклеточные процессы, включая процессы, участвующие в регуляции пролиферации и выживания. Интересно, что многочисленные клинические исследования продемонстрировали снижение периферических уровней BDNF у нелеченных пациентов с MDD по сравнению как с пациентами, получавшими антидепрессант, так и со здоровыми контролями. Исследования на животных показали, что на периферии введенный BDNF быстро поглощается тканями ЦНС и оказывает как нейрогенное, так и антидепрессантоподобное действие.
Несколько линий доказательств демонстрируют, что ЭСТ изменяет уровни BDNF и / или передачу сигналов BDNF, подтверждая, что этот нейротрофин может быть также вовлечен в антидепрессантные эффекты ЭСТ. У грызунов ECS увеличивает мРНК и белок BDNF в областях коры и гиппокампа. В дополнение к BDNF, ECS усиливает экспрессию мРНК рецептора BDNF, TrkB (тирозин-рецепторная киназа B), в нескольких областях коры и гиппокампа, а также внутриклеточных сигнальных каскадах, активируемых TrkB, таких как Ras-Raf путь -MEK-ERK и путь PI3K / Akt. Эти пути стимулируют различные внутриклеточные процессы, включая процессы, участвующие в регуляции пролиферации и выживания. Интересно, что многочисленные клинические исследования продемонстрировали снижение периферических уровней BDNF у нелеченных пациентов с MDD по сравнению как с пациентами, получавшими антидепрессант, так и со здоровыми контролями. Исследования на животных показали, что на периферии введенный BDNF быстро поглощается тканями ЦНС и оказывает как нейрогенное, так и антидепрессантоподобное действие.
У пациентов в нескольких исследованиях наблюдалось повышение уровня BDNF в сыворотке или плазме после ЭСТ, тогда как в других исследованиях были обнаружены неизмененные или сниженные уровни. Разница в результатах может быть связана с разницей во времени между лечением и забором крови. В целом, в исследованиях, в которых было обнаружено повышение уровня BDNF при ЭСТ, этот временной лаг был больше, чем в исследованиях, в которых не было обнаружено такого эффекта, что указывает на то, что, хотя ЭСТ действительно повышает периферические уровни BDNF, эти уровни могут достигать своего максимума только в кровообращении от одной недели до одного месяца после завершения терапии.
Интересно, что BDNF и соответствующий ему рецептор TrkB широко экспрессируются лимфоидными органами и практически всеми основными подгруппами иммунокомпетентных клеток. Что наиболее важно, литература из области нейроиммунологии указывает на общее увеличение доступности гуморальных нейротрофинов, включая BDNF, в ответ на иммунную стимуляцию.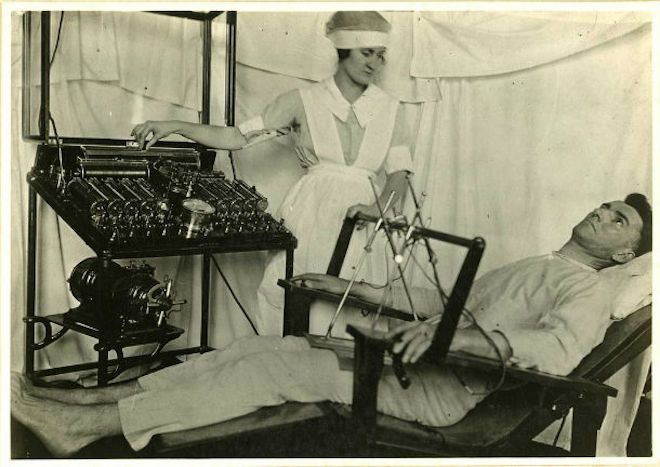 . Например, мононуклеарные клетки периферической крови человека и грызунов (то есть лимфоциты, естественные клетки-киллеры, моноциты) постоянно транскрибируют мРНК BDNF и секретируют нейроактивный белок BDNF, в то же время продуцируя значительно повышенные уровни нейротрофина как при антигенспецифической, так и при неспецифической стимуляции. Кроме того, IL-6 и FNO-α способны стимулировать секрецию BDNF из моноцитов человека в зависимости от дозы. Соответственно, недавно было показано, что положительная связь между периферическим IL-6 и BDNF существует в подгруппе пациентов с MDD. Интересно, что BDNF, полученный из иммунных клеток, играет защитную роль при нейроиммунологических расстройствах, таких как рассеянный склероз и повреждение ЦНС. Действительно, клинические данные указывают на то, что экспрессия гена BDNF в лейкоцитах снижается у пациентов с MDD, тогда как восстановление BDNF в сыворотке и клиническое улучшение у этих пациентов сопровождаются увеличением экспрессии BDNF в лейкоцитах после лечения антидепрессантами.
. Например, мононуклеарные клетки периферической крови человека и грызунов (то есть лимфоциты, естественные клетки-киллеры, моноциты) постоянно транскрибируют мРНК BDNF и секретируют нейроактивный белок BDNF, в то же время продуцируя значительно повышенные уровни нейротрофина как при антигенспецифической, так и при неспецифической стимуляции. Кроме того, IL-6 и FNO-α способны стимулировать секрецию BDNF из моноцитов человека в зависимости от дозы. Соответственно, недавно было показано, что положительная связь между периферическим IL-6 и BDNF существует в подгруппе пациентов с MDD. Интересно, что BDNF, полученный из иммунных клеток, играет защитную роль при нейроиммунологических расстройствах, таких как рассеянный склероз и повреждение ЦНС. Действительно, клинические данные указывают на то, что экспрессия гена BDNF в лейкоцитах снижается у пациентов с MDD, тогда как восстановление BDNF в сыворотке и клиническое улучшение у этих пациентов сопровождаются увеличением экспрессии BDNF в лейкоцитах после лечения антидепрессантами.
В настоящее время неизвестно, стимулирует ли ECT / ECS специфическую регуляцию экспрессии BDNF в лейкоцитах периферической крови. Тем не менее, заманчиво предположить, что общая иммунная стимуляция, вызванная этим лечением имеет место. Отметим, что транскраниальная магнитная стимуляция в равной степени влияет на ЦНС и периферические лейкоциты. Хотя повторяющаяся транскраниальная магнитная стимуляция была гораздо менее инвазивной, чем ЭСТ, она могла усиливать передачу сигналов BDNF-TrkB в ЦНС, а также в периферических лимфоцитах ( Wang H., et. al., 2011). Следует отметить, что это исследование еще раз подтвердило, что индуцированная транскраниальной магнитной стимуляцией активация BDNF в плазме не управляется центральным распространением BDNF на периферию.
Несмотря на свое название, нейротрофины также могут рассматриваться как мощные аутокринные или паракринно-действующие иммунотрофины с множественными функциями в кровообращении, а также в лимфоидных органах. Например, BDNF может модулировать экспрессию цитокинов в мононуклеарных клетках периферической крови человека, а также в микросреде костного мозга. Кроме того, было показано, что BDNF увеличивает выживаемость предшественников тимоцитов мыши. Аналогичным образом , нарушение развития В — клеток наблюдалось у BDNF-дефицитных мышей и условное удаление BDNF в Т — клеток и макрофагов привело к снижению активации Т-клеток и продукции цитокинов.
Кроме того, было показано, что BDNF увеличивает выживаемость предшественников тимоцитов мыши. Аналогичным образом , нарушение развития В — клеток наблюдалось у BDNF-дефицитных мышей и условное удаление BDNF в Т — клеток и макрофагов привело к снижению активации Т-клеток и продукции цитокинов.
Иммуностимулирующие свойства нейротрофинов можно также наблюдать в ЦНС грызунов, поскольку полученный из микроглии BDNF может оказывать положительный аутокринный эффект, способствуя дальнейшей активации микроглии. Однако, полученный из нейронов BDNF отрицательно влияет на антигенпрезентирующий потенциал микроглии, подтверждая, что центральные иммунные эффекты нейротрофинов жестко регулируются in vivo .
Фактор роста эндотелия сосудов
Другим фактором, который, как полагают, играет важную роль в индуцированном ЭСТ нейрогенезе, является фактор роста эндотелия сосудов (VEGF). VEGF стимулирует пролиферацию нейронов через свой рецептор, киназу печени плода 1 (Flk-1). Инфузии VEGF непосредственно увеличивают количество нейрональных клеток-предшественников в гиппокампе крыс. Важно, что пролиферация нейронов, индуцированная ECS, может блокироваться ингибированием передачи сигналов VEGF-Flk1, что указывает на то, что VEGF необходим для нейрогенеза, индуцированного ECS. Исследования на животных также показали, что VEGF обладает антидепрессантоподобными свойствами. Однако неясно, связаны ли эти антидепрессантоподобные свойства с нейрогенными эффектами VEGF. Альтернативно, VEGF-индуцированные антидепрессантоподобные эффекты могут быть связаны с нейрональной пластичностью. Действительно, было продемонстрировано, что связанные с памятью эффекты VEGF опосредованы синаптической пластичностью, а не нейрогенезом. Поскольку считается, что снижение синаптической пластичности также связано с симптомами депрессии способность VEGF стимулировать нейрональную пластичность может играть роль в его антидепрессантоподобных эффектах. VEGF также является мощным стимулятором ангиогенеза.
Инфузии VEGF непосредственно увеличивают количество нейрональных клеток-предшественников в гиппокампе крыс. Важно, что пролиферация нейронов, индуцированная ECS, может блокироваться ингибированием передачи сигналов VEGF-Flk1, что указывает на то, что VEGF необходим для нейрогенеза, индуцированного ECS. Исследования на животных также показали, что VEGF обладает антидепрессантоподобными свойствами. Однако неясно, связаны ли эти антидепрессантоподобные свойства с нейрогенными эффектами VEGF. Альтернативно, VEGF-индуцированные антидепрессантоподобные эффекты могут быть связаны с нейрональной пластичностью. Действительно, было продемонстрировано, что связанные с памятью эффекты VEGF опосредованы синаптической пластичностью, а не нейрогенезом. Поскольку считается, что снижение синаптической пластичности также связано с симптомами депрессии способность VEGF стимулировать нейрональную пластичность может играть роль в его антидепрессантоподобных эффектах. VEGF также является мощным стимулятором ангиогенеза. Это представляет интерес, так как ангиогенез гиппокампа тесно связан с нейрогенезом. На самом деле считается, что большинство нейротрофических факторов обладают по меньшей мере некоторыми ангиогенными свойствами. Ангиогенез может иметь важное значение для снабжения питательными веществами и другими переносимыми кровью факторами роста, необходимыми для индуцированного ЭСТ нейрогенеза. Также возможно, что пролиферирующие эндотелиальные клетки являются дополнительным не нейронным источником факторов роста во время ЭСТ. У пациентов было показано, что сывороточный VEGF увеличивается при ЭСТ, и это увеличение коррелирует с клиническим улучшением.
Это представляет интерес, так как ангиогенез гиппокампа тесно связан с нейрогенезом. На самом деле считается, что большинство нейротрофических факторов обладают по меньшей мере некоторыми ангиогенными свойствами. Ангиогенез может иметь важное значение для снабжения питательными веществами и другими переносимыми кровью факторами роста, необходимыми для индуцированного ЭСТ нейрогенеза. Также возможно, что пролиферирующие эндотелиальные клетки являются дополнительным не нейронным источником факторов роста во время ЭСТ. У пациентов было показано, что сывороточный VEGF увеличивается при ЭСТ, и это увеличение коррелирует с клиническим улучшением.
Повышенная мобилизация цитокинов в периферической крови, например повышенные уровни фактора некроза опухоли-альфа (TNF-α) и интерлейкина-6 (IL-6), является распространенной иммунологической находкой у пациентов с большим депрессивным расстройство (MDD). Было также обнаружено, чтогены, связанные с воспалением, активируются в посмертной лобной коре пациентов с MDD без лекарств, что указывает на очаговые воспалительные процессы в ЦНС.
Многочисленные доклинические исследования на грызунах, а также клинические исследования у пациентов, проходящих лечение интерфероном-альфа, позволяют предположить роль воспалительных цитокинов при MDD. Однако следует иметь в виду, что интенсивность эндогенного воспаления, наблюдаемого в периферической крови пациентов с депрессией , сравнительно гораздо менее выражена, чем при классических воспалительных, аутоиммунных или интерфероновых расстройствах.
Влияние электросудорожной терапии на цитокины
Возможно, одиночная ЭСТ индуцирует кратковременное (15–30 мин) увеличение экспрессии провоспалительных цитокинов, таких как TNF-α, IL-1β и IL-6. Также было обнаружено, что «острый эффект» ЭСТ делает моноциты периферической крови пациентов с большим депрессивным расстройством более чувствительными к пролиферирующему стимулу (липополисахариду), о чем свидетельствует более высокая секреция TNF-α и IL-6 из этих клеток. Важно отметить, что эти повышения цитокинов наблюдались в моноцитах пациентов как на пятом, так и на одиннадцатом из серии сеансов ЭСТ, что позволяет предположить, что этот краткосрочный провоспалительный компонент ЭСТ является неотъемлемой частью каждого сеанса и не смягчается во время повторного лечения. Однако, некоторые авторы показали, что, хотя ЭСТ действительно увеличивает TNF-α через 1 ч после первого сеанса, повторное лечение постепенно снижает уровни TNF-α. Для правильной интерпретации следует отметить, что наблюдаемое снижение плазменного TNF-α в этом исследовании было наиболее выраженным через 1 неделю после последнего сеанса ЭСТ, что исключало острые эффекты электростимула на показатели цитокинов. Кроме того, к этому моменту большинство пациентов клинически реагировали на ЭСТ.
Однако, некоторые авторы показали, что, хотя ЭСТ действительно увеличивает TNF-α через 1 ч после первого сеанса, повторное лечение постепенно снижает уровни TNF-α. Для правильной интерпретации следует отметить, что наблюдаемое снижение плазменного TNF-α в этом исследовании было наиболее выраженным через 1 неделю после последнего сеанса ЭСТ, что исключало острые эффекты электростимула на показатели цитокинов. Кроме того, к этому моменту большинство пациентов клинически реагировали на ЭСТ.
Таким образом, в целом, отдельные сеансы ЭСТ резко активируют циркулирующие воспалительные цитокины, что предполагает немедленную и сильную индукцию системных врожденных иммунных реакций, возможно, связанных с сильными соматическими манипуляциями. С другой стороны, мультисессионная ЭСТ может со временем привести к нормализации показателей цитокинов периферической крови.
Изменения иммунной системы при электросудорожной терапиии
Что касается параметров клеточного иммунитета, в прошлом многочисленные клинические исследования показали, что у пациентов с большим депрессивным расстройством может наблюдаться относительно повышенное количество нейтрофильных гранулоцитов (нейтрофилия), а также признаки функциональной иммуносупрессии, что подтверждается снижением митоген-индуцированной пролиферации Т-клеток и снижением цитотоксичности натуральных клеток-киллеров. S. Fluitman et al. ( 2011 ) показали, что острая ЭСТ (через 15–30 мин после электростимула) вызывает лейкоцитоз у пациентов с MDD, обусловленный значительным увеличением абсолютного количества гранулоцитов, моноцитов и естественных клеток-киллеров. Напротив, Т-клетки были уменьшены в абсолютном количестве. Сходная картина лейкоцитов полиморфноядерного лейкоцитоза и относительной лимфопении наблюдалась через 2 часа после однократной ЭСТ. При использовании более длинного интервала митоген-индуцированные пролиферативные ответы лимфоцитов также обнаруживали снижение после повторной ЭСТ.
S. Fluitman et al. ( 2011 ) показали, что острая ЭСТ (через 15–30 мин после электростимула) вызывает лейкоцитоз у пациентов с MDD, обусловленный значительным увеличением абсолютного количества гранулоцитов, моноцитов и естественных клеток-киллеров. Напротив, Т-клетки были уменьшены в абсолютном количестве. Сходная картина лейкоцитов полиморфноядерного лейкоцитоза и относительной лимфопении наблюдалась через 2 часа после однократной ЭСТ. При использовании более длинного интервала митоген-индуцированные пролиферативные ответы лимфоцитов также обнаруживали снижение после повторной ЭСТ.
Несмотря на то, что общее снижение количества лимфоцитов и пролиферативных реакций, по-видимому, связано с ЭСТ, процентное и абсолютное количество активированных Т-клеток было обнаружено после завершения другого исследования ЭСТ у пациентов с большим депрессивным расстройством. Кроме того, существуют признаки того, что активность естественных клеток-киллеров временно, но значительно повышается у пациентов с большим депрессивным расстройством при однократном и повторном ЭСТ.
Исследования на животных, кажется, повторяют некоторые наблюдения человеческих исследований, особенно стимулирующее воздействие на компартменты моноцитов и нейтрофилов. Например, было показано, что хроническое лечение ECS вызывает устойчивое увеличение пролиферации и метаболической активности перитонеальных макрофагов крыс, а также стимулированных липополисахаридами смешанных спленоцитов. Заметное повышение фагоцитарной активности было также очевидно у крыс после очаговой повторной электрической стимуляции гиппокампа. Интересно отметить, что врожденный клеточный ответ на электрическую стимуляцию ЦНС наблюдается не только в периферических тканях, но и в сосудистой сети ЦНС, так как увеличенный перенос макрофагов, происходящих из крови (но без инфильтрации ЦНС), наблюдается в сосудах гиппокампа после повторной ECS у крыс.
Эффекты ЭСТ на микроглию
Микроглия — резидентные макрофаги ЦНС — отвечают за активный иммунный надзор за здоровым мозгом и соответственно реагируют на изменения в микроокружении. Поэтому они считаются наиболее чувствительными датчиками изменений гомеостаза ЦНС. Соответственно, можно ожидать повышенной чувствительности этих клеток к ЭСТ. Действительно, исследования на грызунах последовательно показали, что ECS увеличивает глиальную пролиферацию в нескольких областях мозга, включая гиппокамп, миндалину, префронтальную кору и гипоталамус. Хотя большинство исследований показали, что эти клетки остаются в неактивном состоянии, два исследования продемонстрировали изменения, свидетельствующие о повышении активности микроглии после ECS. Исследователи показали увеличение количества активированной микроглии уже через 2 часа после последней серии ECS. Активация микроглии была временной в большинстве областей ЦНС; однако в гиппокампе число активированных клеток микроглии оставалось увеличенным до 4 недель после ECS. Эти результаты совпадают с исследованиями Jinno и Kosaka ( 2008), которые обнаружили снижение плотности микроглиальных процессов в гиппокампе через 24 часа после однократной или повторной ECS.
Поэтому они считаются наиболее чувствительными датчиками изменений гомеостаза ЦНС. Соответственно, можно ожидать повышенной чувствительности этих клеток к ЭСТ. Действительно, исследования на грызунах последовательно показали, что ECS увеличивает глиальную пролиферацию в нескольких областях мозга, включая гиппокамп, миндалину, префронтальную кору и гипоталамус. Хотя большинство исследований показали, что эти клетки остаются в неактивном состоянии, два исследования продемонстрировали изменения, свидетельствующие о повышении активности микроглии после ECS. Исследователи показали увеличение количества активированной микроглии уже через 2 часа после последней серии ECS. Активация микроглии была временной в большинстве областей ЦНС; однако в гиппокампе число активированных клеток микроглии оставалось увеличенным до 4 недель после ECS. Эти результаты совпадают с исследованиями Jinno и Kosaka ( 2008), которые обнаружили снижение плотности микроглиальных процессов в гиппокампе через 24 часа после однократной или повторной ECS. Через один месяц после ЭСТ плотность микроглиального процесса все еще снижалась в группе с повторной ЭСТ. Ретракция микроглиальных процессов обычно связана с активацией микроглии, и, следовательно, эти результаты, вероятно, указывают на увеличение активности микроглии.
Через один месяц после ЭСТ плотность микроглиального процесса все еще снижалась в группе с повторной ЭСТ. Ретракция микроглиальных процессов обычно связана с активацией микроглии, и, следовательно, эти результаты, вероятно, указывают на увеличение активности микроглии.
Провоспалительный эффект электрических полей, распространяющихся в ЦНС, также был продемонстрирован на крысиной модели транскраниальной стимуляции постоянным током. В частности, увеличение пролиферирующих клеток и активация микроглии в коре, ипсилатеральной к месту стимуляции, были очевидны после ежедневного введения транскраниальной стимуляции постоянным током в течение 5 последовательных дней. Важно, что этот ранний врожденный иммунный ответ не был связан с повреждениями коры или астроглиотическим рубцеванием.
Следует отметить, что полученный из микроглии BDNF, как было показано, стимулирует регенерацию аксонов в контексте экспериментального повреждения спинного мозга или оказывает длительную нейропротекцию посредством устойчивого нейрогенеза в модели инсульта на животных. Однако длительное или непропорциональное воздействие активации микроглии может проложить путь для опосредованной воспалением нейродегенерации. Этот амбивалентный характер активации микроглии, по-видимому, продиктован степенью потребностей, возникающих в микросреде. Например, Lai и Todd ( 2008) продемонстрировали, что первичная микроглия стимулировала выживание нейронов после воздействия сред, нейронами с умеренными повреждениями. Этот эффект не наблюдался после воздействия сред со слабыми или сильно поврежденными нейронами. Интересно, что классические провоспалительные цитокины активируются микроглией только в ответ на легкое повреждение, тогда как BDNF активируется в ответ на все степени повреждения нейронов.
Однако длительное или непропорциональное воздействие активации микроглии может проложить путь для опосредованной воспалением нейродегенерации. Этот амбивалентный характер активации микроглии, по-видимому, продиктован степенью потребностей, возникающих в микросреде. Например, Lai и Todd ( 2008) продемонстрировали, что первичная микроглия стимулировала выживание нейронов после воздействия сред, нейронами с умеренными повреждениями. Этот эффект не наблюдался после воздействия сред со слабыми или сильно поврежденными нейронами. Интересно, что классические провоспалительные цитокины активируются микроглией только в ответ на легкое повреждение, тогда как BDNF активируется в ответ на все степени повреждения нейронов.
Полезный потенциал активации микроглии в контексте MDD был недавно продемонстрирован в трансляционно значимом исследовании, в котором использовалась хроническая непредсказуемая парадигма стресса у грызунов. В частности, было показано, что после первоначального короткого периода активации микроглии хронический стресс приводит к последующему апоптозу микроглии в гиппокампе, снижению числа клеток и дистрофической морфологии. Кроме того, более высокое подавление микроглиального компартмента после хронического стресса было связано с более высоким подавлением нейрогенеза и более депрессивным поведением. Поразительно, что периферическая индуцированная активация микроглии (например, острой внутрибрюшинной инъекцией липополисахарида) имеет драматический нейрогенный эффект в гиппокампе, приводила к общему увеличению числа клеток микроглии и обращала к депрессивно-подобному фенотипу животных с хроническим стрессом. Весьма вероятно, что нейрогенные и антидепрессантоподобные последствия стимуляции микроглии были, по крайней мере частично, опосредованы активированным фенотипом нейропротективной микроглии.
Кроме того, более высокое подавление микроглиального компартмента после хронического стресса было связано с более высоким подавлением нейрогенеза и более депрессивным поведением. Поразительно, что периферическая индуцированная активация микроглии (например, острой внутрибрюшинной инъекцией липополисахарида) имеет драматический нейрогенный эффект в гиппокампе, приводила к общему увеличению числа клеток микроглии и обращала к депрессивно-подобному фенотипу животных с хроническим стрессом. Весьма вероятно, что нейрогенные и антидепрессантоподобные последствия стимуляции микроглии были, по крайней мере частично, опосредованы активированным фенотипом нейропротективной микроглии.
Воспаление — как механизм терапевтического эффекта ЭСТ
Перспектива антидепрессантоподобных эффектов, опосредованных воспалительной стимуляцией хронически зараженной ЦНС, подтверждается как доклиническими, так и клиническими исследованиями, показывающими, что широко используемые нестероидные противовоспалительные препараты могут отрицательно влиять на способ действия и эффективность клинически используемых антидепрессивных стратегий, такие как антидепрессивные препараты первой линии и глубокая электростимуляция мозга. Однако, потенцирование — а не подавление — провоспалительных реакций может иметь терапевтическое значение для пациентов с хронической депрессией. Следует отметить, что хроническая болезнь связана с более высоким эндогенным воспалением и метаболической дисрегуляцией у пациентов с MDD, получавших антидепрессанты. Учитывая, что ЭСТ, как правило, является вмешательством второй линии, зарезервированным для рефрактерной депрессии, вполне возможно, что пациенты, поддающиеся этому лечению, несмотря на периферическое воспаление, находятся в состоянии длительного подавления микроглии, вызванного хронической болезнью. Более выраженное периферическое воспаление у пациентов с хронической депрессией может быть переосмыслено как аллостатическая попытка периферической врожденной иммунной системы стимулировать репарацию микроглии и эффективность антидепрессантов по отношению к ЦНС. Это, однако, неизбежно произойдет за счет соматического здоровья.
Однако, потенцирование — а не подавление — провоспалительных реакций может иметь терапевтическое значение для пациентов с хронической депрессией. Следует отметить, что хроническая болезнь связана с более высоким эндогенным воспалением и метаболической дисрегуляцией у пациентов с MDD, получавших антидепрессанты. Учитывая, что ЭСТ, как правило, является вмешательством второй линии, зарезервированным для рефрактерной депрессии, вполне возможно, что пациенты, поддающиеся этому лечению, несмотря на периферическое воспаление, находятся в состоянии длительного подавления микроглии, вызванного хронической болезнью. Более выраженное периферическое воспаление у пациентов с хронической депрессией может быть переосмыслено как аллостатическая попытка периферической врожденной иммунной системы стимулировать репарацию микроглии и эффективность антидепрессантов по отношению к ЦНС. Это, однако, неизбежно произойдет за счет соматического здоровья.
В последнее время исследования на животных показали, что электросудорожные припадки вызывают структурные изменения в мозге на клеточном и молекулярном уровнях. Особый интерес представляет наблюдение, что как ECS ( модель ЭСТ на животных ), так и ECT вызывают несколько изменений в нейротрофинах и иммунных сигналах, как в центральной нервной системе (ЦНС), так и в периферических тканях.
Особый интерес представляет наблюдение, что как ECS ( модель ЭСТ на животных ), так и ECT вызывают несколько изменений в нейротрофинах и иммунных сигналах, как в центральной нервной системе (ЦНС), так и в периферических тканях.
Слабое воспаление обычно наблюдается в периферической крови у пациентов с большим депрессивным расстройством (MDD), особенно у пациентов с рефрактерными и хроническими заболеваниями. Однако электросудорожная терапия (ЭСТ) — наиболее радикальное вмешательство, для этих пациентов, тесно связана с усилением гематогенного, а также нейровоспалительного иммунного ответа, о чем свидетельствуют исследования как на людях, так и на животных.
Поддержание тканей организма зависит от степени выраженности воспалительных реакций — то, что выгодно отличает от патологического воспаления, — это интенсивность и сроки его появления. Это особенно важно для поддержания пластичности ЦНС как во время болезни, так и при заболеваниях. Результаты, упомянутые выше, хорошо соответствуют нейропротекторным свойствам воспаления, которые были подробно описаны в общей нейроиммунологии.
Создается впечатление, что ЭСТ тесно связана с усилением врожденного нейровоспалительного, а также гематогенного иммунного ответа. Связанный набор экспериментальных данных далее показывает, что иммунная стимуляция усиливает экспрессию нейротрофинов и, возможно, наоборот, предлагая тем самым один из возможных путей, с помощью которых приступы воспаления могут мобилизовать эндогенную нейропротекцию. Однако мы далеки от понимания того, как такой эффект может быть «изолирован» от пагубных последствий воспаления.
Перед первым сеансом ЭСТ у пациентов с депрессией отмечается снижение уровня нейротрофинов. Аллостатическая воспалительная реакция, таким образом, запускается эндогенно, главным образом на периферии, обеспечивая субоптимальную воспалительную стимуляцию для мозга.
Каждый сеанс ЭСТ сильно активирует врожденную иммунную систему в течение короткого периода времени (от нескольких минут до нескольких часов после сеанса) и тем самым дополнительно мобилизует экспрессию нейротрофинов. Однако для достижения оптимальной доступности нейротрофинов необходимы со временем многочисленные воспалительные приступы (межсессионные интервалы от нескольких дней до нескольких недель). После ремиссии эндогенное воспаление не имеет аллостатической цели и поэтому проходит.
Однако для достижения оптимальной доступности нейротрофинов необходимы со временем многочисленные воспалительные приступы (межсессионные интервалы от нескольких дней до нескольких недель). После ремиссии эндогенное воспаление не имеет аллостатической цели и поэтому проходит.
Общий анализ крови при электросудорожной терапии
ЭСТ является старейшей и наиболее эффективной терапией для лечения тяжелой депрессии. Несмотря на то, что полный анализ крови является частью оценки состояния больного перед использованием электросудорожной терапии (ЭСТ), нет известных гематологических противопоказаний для этой процедуры. Через 2 часа после электросудорожной терапии были выявлены значительные изменения в общем количестве лейкоцитов, проценте полиморфных клеток, лимфоцитов и гемоглобина. В исследовании M. ASOĞLU et.al. ( 2018 ) три параметра (RBC — снижение от 4,9 до 4,7 ; Hb — снижение с 13,35 до 12,95 g/dL , MCH — увеличение от 27,4 до 27,8 g/dL) также показали отклонения от нормальных величин. Отметим, что пациенты с биполярной депрессией имеют самый высокий процент аномальных результатов для эритроцитов (19,7%) и для MCH (22,2%). Однако, по мнению некоторых авторов по большому счету, существенных изменений гемограммы после ЭСТ не выявлено.
Отметим, что пациенты с биполярной депрессией имеют самый высокий процент аномальных результатов для эритроцитов (19,7%) и для MCH (22,2%). Однако, по мнению некоторых авторов по большому счету, существенных изменений гемограммы после ЭСТ не выявлено.
Информация об изменении количества лейкоцитов после ЭСТ все же противоречива . По-мнению одних исследователей , сразу после ЭСТ наблюдается увеличение количества лейкоцитов, которое затем значительно уменьшается через 1 ч и 2 ч после процедуры . Chaturvedi et al. , напротив , показали снижение процента полиморфных лейкоцитов сразу после ЭСТ, которое затем увеличилось через 1 ч и 2 ч после ЭСТ.
Fluitman et al. показали, что острая ЭСТ (через 15-30 мин после электростимула) изменяет концентрацию гемоглобина , вызывает лейкоцитоз у пациентов с большим депрессивным расстройством, обусловленный значительным увеличением абсолютного количества гранулоцитов, моноцитов и натуральных клеток-киллеров. Сходная картина лейкоцитов полиморфноядерного лейкоцитоза и относительной лимфопении наблюдалась через 2 часа после однократной ЭСТ.
F. Canan et.al. ( 2021 ) не обнаружили различий в NLR ( соотношение нейтрофилов / лимфоцитов) между повторными курсами ЭСТ до (2,27±2,54) и после (2,49±1,65). Кроме того, серия ЭСТ не изменила NLR в отдельных диагностических группах.
Вы должны включить JavaScript чтобы использовать эту форму.
Ваше имя *
Ваш телефон (конфиденциальность гарантируется) *
Основная жалоба *
Предположительный диагноз
Прием препарата
Электронная почта
Согласие на обработку персональных данных *
На обработку персональных данных согласен, с политикой конфиденциальности ознакомлен
24.6. Электросудорожная терапия
ВВЕДЕНИЕ
Электросудорожная
терапия (ЭСТ) является одним из наиболее
эффективных способов лечения, существующих
в психиатрии; тем
не менее этот метод лечения в настоящее
время вызывает противоречивые
мнения. Существует по меньшей мере две
причины этого. Во-первых, ЭСТ требует
применения электричества, которое
вызывает судорожные припадки, и всех
это пугает. Во-вторых,
имеется несколько неточных сообщений,
что ЭСТ всегда вызывает
нарушения функции мозга. Хотя эти
сообщения в значительной
степени опровергнуты, этот аспект все
еще остается.
Существует по меньшей мере две
причины этого. Во-первых, ЭСТ требует
применения электричества, которое
вызывает судорожные припадки, и всех
это пугает. Во-вторых,
имеется несколько неточных сообщений,
что ЭСТ всегда вызывает
нарушения функции мозга. Хотя эти
сообщения в значительной
степени опровергнуты, этот аспект все
еще остается.
Решение предложить больному ЭСТ, как и все рекомендации, касающиеся лечения, должны основываться как на оптимальности выбора, так и на рассмотрении обоих полюсов: риск и преимущества. Основной альтернативой к ЭСТ обычно является фармакотерапия и психотерапия, причем оба эти вида лечения связаны
179
как
с риском, так и с преимуществами. В
настоящее время многие психиатры
начинают понимать, что метод ЭСТ сильно
недооценивается
как метод безопасной и эффективной
терапии депрессии. И
наоборот, часть психиатров и официальных
представителей службы здоровья
по-прежнему считают, что ЭСТ следует
применять,
только если другого выхода нет. По
отношению к тем больным,
для которых ЭСТ являлась эффективным
методом в прошлом,
врачу не следует из-за своего предубеждения
лишать больного
эффективного метода лечения.
По
отношению к тем больным,
для которых ЭСТ являлась эффективным
методом в прошлом,
врачу не следует из-за своего предубеждения
лишать больного
эффективного метода лечения.
ИСТОРИЯ
В
апреле 1938 г. в Риме Ugo
Cerletti и Lucio Bini провели в первый раз
электросудорожную
терапию. Вначале она называлась
электрошоковой терапией (ЭШТ),
позже — ЭСТ. Хотя Cerletti и Bini проводили
исследования на модели животных
с эпилепсией, на людях они осуществили
это лечение под большим влиянием
Lazlo von Meduna из Будапешта. В 1934 г. Meduna сообщил
об успешном лечении
кататонии и других острых симптомов
шизофрении с помощью припадков, вызванных
фармакологическими препаратами. Meduna
начал с внутримышечных инъекций
масляной суспензии камфоры, но затем
быстро перешел к внутривенному
введению пентиленететразола. Meduna
применил этот метод лечения на основании
двух наблюдений. Во-первых, было клинически
показано, что симптомы шизофрении
часто уменьшаются после припадка. Такие
припадки часто появлялись
у психически больных в результате
несчастного случая или возникали
ятро-генно;
они были вторичны по отношению к
абстиненции, вызванной отменой лекарств
(например, барбитуратов). Во-вторых,
господствовало неверное представление,
что шизофрения и эпилепсия не могут
сосуществовать у одного и того же
больного.
Отсюда делали вывод, что вызывание у
больного припадков могло помочь
больному излечиться от шизофрении.
Припадки, вызванные пентилепететра-золом
можно использовать как эффективное
лечение; это было высказано за 4 года
до того, как были внедрены электросудорожные
припадки.
Такие
припадки часто появлялись
у психически больных в результате
несчастного случая или возникали
ятро-генно;
они были вторичны по отношению к
абстиненции, вызванной отменой лекарств
(например, барбитуратов). Во-вторых,
господствовало неверное представление,
что шизофрения и эпилепсия не могут
сосуществовать у одного и того же
больного.
Отсюда делали вывод, что вызывание у
больного припадков могло помочь
больному излечиться от шизофрении.
Припадки, вызванные пентилепететра-золом
можно использовать как эффективное
лечение; это было высказано за 4 года
до того, как были внедрены электросудорожные
припадки.
Основным
недостатком ЭСТ являлся дискомфорт,
испытываемый больным при
этой процедуре, являющийся результатом
двигательной активности во время
припадков.
Эти проблемы были преодолены тем, что
давалась общая анестезия и
обеспечивалась мышечная релаксация во
время этого лечения. Представляет
интерес,
что развитию данного метода способствовало
экстрагирование американским
психиатром А.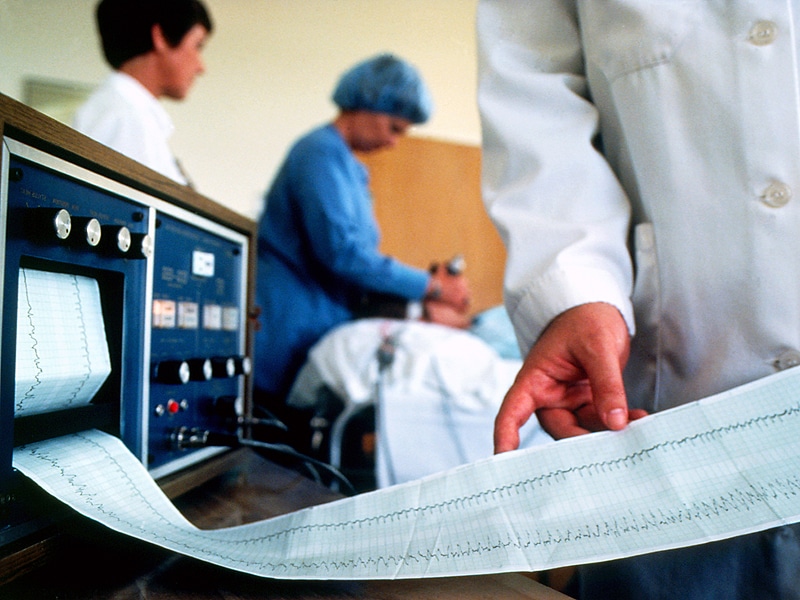 Е. Bennett
кураре из растений, содержащих это
вещество. Bennett предложил применять
спинальную анестезию во время ЭСТ, а
также и кураре для
того, чтобы вызвать паралич мышц, что,
в свою очередь, предупреждало переломы.
В 1951 г. был введен сукцинилхолин, который
стал наиболее часто применяться как
мышечный релаксант для ЭСТ. В 1957 г. стали
давать гексафлуорини-рованный
диэтилэфир (ГД) в качестве фармакологического
вещества, вызывающего
припадки; это вещество являлось составной
частью даваемого больному газа. Отсутствие
преимуществ этого метода привело к
тому, что в 1950-х годах ГД перестал
поступать на рынок и число больных,
которым делали ЭСТ, снизилось.
Е. Bennett
кураре из растений, содержащих это
вещество. Bennett предложил применять
спинальную анестезию во время ЭСТ, а
также и кураре для
того, чтобы вызвать паралич мышц, что,
в свою очередь, предупреждало переломы.
В 1951 г. был введен сукцинилхолин, который
стал наиболее часто применяться как
мышечный релаксант для ЭСТ. В 1957 г. стали
давать гексафлуорини-рованный
диэтилэфир (ГД) в качестве фармакологического
вещества, вызывающего
припадки; это вещество являлось составной
частью даваемого больному газа. Отсутствие
преимуществ этого метода привело к
тому, что в 1950-х годах ГД перестал
поступать на рынок и число больных,
которым делали ЭСТ, снизилось.
КЛАССИФИКАЦИЯ
Расположение
электродов при электросудорожной
терапии может быть либо билатеральным,
либо унилатеральным. Билатеральные
электроды, которые были предложены
первыми, накладывались
с одним стимулирующим электродом над
обоими полушариями
мозга. При унилатеральной ЭСТ оба
электрода накладываются
над субдоминантным полушарием. Билатеральная
Билатеральная
180
ЭСТ считается несколько более эффективной, особенно для более тяжелых больных, хотя мнения об этом противоречивы. Однако при биполярной ЭСТ также наблюдается больше побочных действий, прежде всего когнитивных нарушений. Другим видом классификации ЭСТ является подразделение ее по форме электрического стимула, когда он выводится на осциллоскоп. Двумя основными видами является синусоволновая ЭСТ и короткий импульс. Метод стимуляции с помощью короткого импульса вызывает припадки меньшей силы, чем метод с помощью синусоволновых импульсов. Применение более слабого электрического тока вызывает меньший когнитивный эффект, поэтому метод, в котором применяется короткий электрический стимул, является предпочтительным методом.
Двумя
другими вариантами лечения ЭСТ являются:
1) применение пороговой дозы и 2)
расположение обоих электродов на одном
полушарии. Оба варианта предназначены
для снижения когнитивных нарушений,
обусловленных лечением. Пороговая
доза рассчитана так, что сила электрического
тока лишь слегка превышает ту, которая
необходима для возникновения припадков.
Так как эта сила возрастает по мере
увеличения числа процедур ЭСТ, вначале
следует выбирать низкую силу тока,
а затем увеличивать ее в курсе лечения.
Вопрос о том, является ли эта схема
лечения столь же эффективной, как и
схема с применением постоянной величины
силы тока, а также о том, уменьшается ли
с применением этой схемы число побочных
эффектов, остается открытым и в настоящее
время исследуется. К
сожалению, расположение обоих электродов
на одном полушарии не вызывает снижения
побочных эффектов.
Пороговая
доза рассчитана так, что сила электрического
тока лишь слегка превышает ту, которая
необходима для возникновения припадков.
Так как эта сила возрастает по мере
увеличения числа процедур ЭСТ, вначале
следует выбирать низкую силу тока,
а затем увеличивать ее в курсе лечения.
Вопрос о том, является ли эта схема
лечения столь же эффективной, как и
схема с применением постоянной величины
силы тока, а также о том, уменьшается ли
с применением этой схемы число побочных
эффектов, остается открытым и в настоящее
время исследуется. К
сожалению, расположение обоих электродов
на одном полушарии не вызывает снижения
побочных эффектов.
МЕХАНИЗМ ДЕЙСТВИЯ
Появление билатеральных генерализованных припадков вызывает как полезный, лечебный, так и побочные эффекты. Два основных исследовательских подхода к обнаружению связи между этими припадками и редукцией психических нарушений представляют собой нейрохимический и нейрофизиологический.
Нейрохимическая
гипотеза постулирует, что клиническое
улучшение, наблюдающееся
в результате сеансов ЭСТ, наступает в
результате изменения нейро-трансмиттерной
функции. Под влиянием серии ЭСТ возникает
снижение функции постсинаптических
Р-адренергических рецепторов, такое же
изменение рецепторов имеет
место при хроническом лечении
антидепрессантами. При проведении ЭСТ
наблюдается
усиление функции постсинаптических
5-НТ2-рецепторов;
однако направление
этих изменений противоположно тому,
которое характерно для некоторых
антидепрессантов. ЭСТ снижает также
число мускариновых ацетилхолиновых
рецепторов.
Некоторые исследователи предполагают,
что важен баланс между но-радренергической,
серотонинергической и холинергической
передачей, а не изменение
какой-либо одной нейротрансмиттерной
системы. Имеются некоторые данные,
что ЭСТ может снижать синтез и высвобождение
ГАБА, а также повышать эндогенную
опиоидную активность.
Под влиянием серии ЭСТ возникает
снижение функции постсинаптических
Р-адренергических рецепторов, такое же
изменение рецепторов имеет
место при хроническом лечении
антидепрессантами. При проведении ЭСТ
наблюдается
усиление функции постсинаптических
5-НТ2-рецепторов;
однако направление
этих изменений противоположно тому,
которое характерно для некоторых
антидепрессантов. ЭСТ снижает также
число мускариновых ацетилхолиновых
рецепторов.
Некоторые исследователи предполагают,
что важен баланс между но-радренергической,
серотонинергической и холинергической
передачей, а не изменение
какой-либо одной нейротрансмиттерной
системы. Имеются некоторые данные,
что ЭСТ может снижать синтез и высвобождение
ГАБА, а также повышать эндогенную
опиоидную активность.
С
позиций нейрофизиологического подхода
к идиопатической эпилепсии, имеются
данные о том, что области мозга, которые
являются метаболически гиперактивными
во время припадка, сразу же после него
становятся гипоактивны-ми.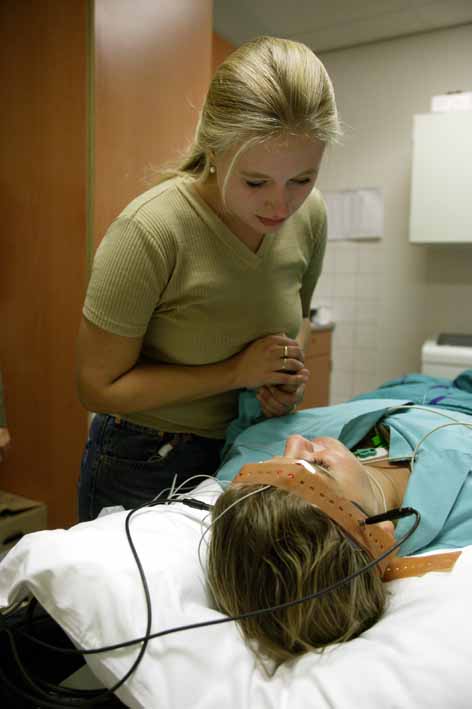 Эти изменения продемонстрированы с
помощью сканирования на ПЭТ и данных
о церебральном кровотоке и находятся
в соответствии с картами мозга,
составляемыми по ЭЭГ. Тот факт, что
ЭСТ действует как противосудорожное
средство,
т. е. что под влиянием ЭСТ фактически
повышается порог судорожной активности
у данного субъекта, возможно, является
связующим звеном между нейрохимическими
и нейрофизиологическими данными.
Эти изменения продемонстрированы с
помощью сканирования на ПЭТ и данных
о церебральном кровотоке и находятся
в соответствии с картами мозга,
составляемыми по ЭЭГ. Тот факт, что
ЭСТ действует как противосудорожное
средство,
т. е. что под влиянием ЭСТ фактически
повышается порог судорожной активности
у данного субъекта, возможно, является
связующим звеном между нейрохимическими
и нейрофизиологическими данными.
181
ПОКАЗАНИЯ
Тяжелая депрессия
Наиболее
частым показанием для применения ЭСТ
является тяжелая депрессия.
Более 80% больных, которым производится
ЭСТ в США, имеют этот диагноз. Больные
с тяжелой депрессией обнаруживают
реакцию на ЭСТ в 80—90%, что
по меньшей мере соответствует (а возможно,
и превосходит ее) реакции на антидепрессанты.
Лечение с помощью ЭСТ дает более быстрый
эффект и меньше побочных
действий, чем лечение антидепрессантами.
ЭСТ эффективна как при униполярной,
так и при биполярной депрессии и одинаково
эффективна у мужчин и
женщин. Больные с бредовой или психотической
депрессией обнаруживают особенно
хорошую реакцию на ЭСТ, тогда как лечению
только антидепрессантами эти
расстройства поддаются слабо. Депрессии
с чертами меланхолии (например, с
особенно тяжелыми нарушениями,
психомоторной ретардацией, слишком
ранними
пробуждениями по утрам, суточными
колебаниями настроения, которое хуже
по утрам, понижением аппетита и потерей
массы тела, а также ажитацией) особенно
хорошо поддаются лечению ЭСТ. Хорошую
реакцию на ЭСТ можно также ожидать
у больных, у которых отсутствует
подавление дексаметазона и притуплена
реакция щитовидной железы на введение
тиреотропного гормона. Пожилые больные
реагируют на ЭСТ более медленно, чем
молодые. Следует, однако, помнить,
что ЭСТ представляет собой способ
лечения депрессивного приступа и не
обеспечивает
профилактики. Вопрос о поддерживающем
лечении с помощью ЭСТ для
сохранения клинической ремиссии еще
не нашел ответа.
Больные с бредовой или психотической
депрессией обнаруживают особенно
хорошую реакцию на ЭСТ, тогда как лечению
только антидепрессантами эти
расстройства поддаются слабо. Депрессии
с чертами меланхолии (например, с
особенно тяжелыми нарушениями,
психомоторной ретардацией, слишком
ранними
пробуждениями по утрам, суточными
колебаниями настроения, которое хуже
по утрам, понижением аппетита и потерей
массы тела, а также ажитацией) особенно
хорошо поддаются лечению ЭСТ. Хорошую
реакцию на ЭСТ можно также ожидать
у больных, у которых отсутствует
подавление дексаметазона и притуплена
реакция щитовидной железы на введение
тиреотропного гормона. Пожилые больные
реагируют на ЭСТ более медленно, чем
молодые. Следует, однако, помнить,
что ЭСТ представляет собой способ
лечения депрессивного приступа и не
обеспечивает
профилактики. Вопрос о поддерживающем
лечении с помощью ЭСТ для
сохранения клинической ремиссии еще
не нашел ответа.
Другие показания
Шизофрения. Приблизительно
15—20% больных, получающих ЭСТ, страдают
шизофренией. Наиболее хороший эффект
отмечается при острой, аффективной
или кататонической симптоматике.
Эффективность ЭСТ у таких больных
приблизительно равна эффективности
антипсихотиков; однако ЭСТ эффективна
только
у 5—10% хронических больных.
Приблизительно
15—20% больных, получающих ЭСТ, страдают
шизофренией. Наиболее хороший эффект
отмечается при острой, аффективной
или кататонической симптоматике.
Эффективность ЭСТ у таких больных
приблизительно равна эффективности
антипсихотиков; однако ЭСТ эффективна
только
у 5—10% хронических больных.
Мания. Количество наблюдений, полученных в клинических исследованиях с хорошим контролем относительно эффективности лечения острой мании с помощью ЭСТ, все время возрастает. Поскольку лечение фармакологическими препаратами эффективно и относительно безопасно, ЭСТ применяется только в тех случаях, когда к фармакологическому методу имеются определенные противопоказания.
Другие
виды применения и обоснование их. В
других странах, кроме США, ЭСТ применяется
с хорошим эффектом при лечении белой
горячки и конверсионных расстройств.
ЭСТ, по-видимому, является самым безопасным
методом лечения при
определенных обстоятельствах, например,
при беременности, у пожилых людей
и при наличии симптомов, требующих
немедленного лечения. ЭСТ можно спокойно
проводить во время беременности. У
соматических больных и у пожилых людей
ЭСТ вызывает меньшую кардиотоксичность,
чем применяемые в настоящее
время фармакологические препараты.
ЭСТ можно спокойно
проводить во время беременности. У
соматических больных и у пожилых людей
ЭСТ вызывает меньшую кардиотоксичность,
чем применяемые в настоящее
время фармакологические препараты.
УКАЗАНИЯ К КЛИНИЧЕСКОМУ ПРИМЕНЕНИЮ
Больные и члены их семей часто боятся ЭСТ, поэтому надо им объяснить ее положительные и отрицательные эффекты, а также альтернативные подходы к лечению. Этот процесс получения информации должен быть подкреплен документально, для этого в истории болезни каждого больного делается соответствующая врачебная запись. Насильно ЭСТ в настоящее время проводится редко, и только тем больным, которые по состоянию нуждаются в срочном лечении, и только если юридически опекуны согласны на этот вид лечения. Всегда надо действовать в соответствии с местными законами для данной области, штата или федерации.
182
Оценка состояния перед лечением
Оценка
состояния перед лечением должна
основываться на стандартном исследовании
физического статуса и медицинской
истории болезни, анализе крови и мочи,
рентгеновского исследования грудной
клетки и электрокардиограммы.![]() При
определенных обстоятельствах рекомендуется
сделать снимок позвоночника и
черепа, компьютерную томографию,
ядерно-магнитный резонанс или ЭЭГ.
При
определенных обстоятельствах рекомендуется
сделать снимок позвоночника и
черепа, компьютерную томографию,
ядерно-магнитный резонанс или ЭЭГ.
Следует тщательно рассмотреть получаемое больным в настоящее время лечение, поскольку может возникнуть взаимодействие между получаемыми препаратами и вспомогательными веществами, используемыми при ЭСТ. Офтальмологические растворы антихолинэстеразы, ингибиторы моноаминоксидазы и литий могут нарушать метаболизм сукцинилхолина. Имеются данные о гипотензивных коллапсах при лечении резерпином и последующее возрастающее действие на ЦНС при лечении литием. Седативно-снотворные препараты и просудорожные средства влияют на электрические свойства, которые обусловливают припадки. Вопрос о том, стоит ли продолжать лечение больных антидепрессантами или ан-типсихотиками во время ЭСТ, остается открытым. Большинство врачей, однако, отменяет антидепрессанты перед назначением ЭСТ.
Премедикация, анестезия и мышечная релаксация
За
тридцать минут до начала лечения вводят
антихолинергическое вещество (например,
атропин) для того, чтобы свести к минимуму
секрецию и вызвать легкую
тахикардию, что предотвращает развитие
брадикардии в процессе лечения. Некоторые
центры по лечению ЭСТ отказались от
предварительного введения
ан-тихолинергических веществ. Их
использование показано только больным,
находящимся
на лечении (3-адренергическими блокаторами
и у больных с желудочковой эктопической
систолой.
Некоторые
центры по лечению ЭСТ отказались от
предварительного введения
ан-тихолинергических веществ. Их
использование показано только больным,
находящимся
на лечении (3-адренергическими блокаторами
и у больных с желудочковой эктопической
систолой.
Применение ЭСТ требует общей анестезии, мышечной релаксации или паралича и оксигенации. Больным, находящимся на ЭСТ, кислород обычно дают с начала анестезии до возобновления адекватного спонтанного дыхания, за исключением коротких интервалов электрической стимуляции.
Глубина
анестезии должна быть небольшой не
только для того, чтобы свести к
минимуму побочные эффекты, но также для
того, чтобы избежать повышения судорожного
порога, которое возникает при применении
многих анестетиков. В большинстве
случаев используются метогекситал
(Brevital)
или тиопентал (Pentothal). Первый является
предпочтительным, так как он вызывает
меньше случаев сердечной аритмии
при ЭСТ. Типичная доза метогекситала
для взрослого человека средней комплекции
60 мг, хотя диапазон включает от 30 до 160
мг./031-3.jpg)
Вслед
за началом анестетического эффекта,
обычно в течение 1 мин, в/в вводится
мышечный релаксант. Сукцинилхолин,
очень быстродействующее деполяризующее
блокирующее средство, универсален для
этой цели. Оптимальная доза сукцинилхолина
обеспечивает достаточную релаксацию
для того, чтобы прекратить
большинство, хотя и не все, крупных
иктальных движений тела. Обычно начальной
дозой ддя взрослого человека средних
размеров является 60 мг. Поскольку
сукцинилхолин
является деполяризующим блокирующим
веществом, его действие связано
с мелкими подергиваниями мышц в
ростро-каудальном направлении.
Исчезновение этих движений показывает,
что достигнута максимальная релаксация.
Если наличие заболеваний скелетной
мускулатуры или сердца требует получения
полной
релаксации, можно добавить кураре (3—6
мг в/в) за несколько минут перед
анестезией, вместе с повышением дозы
сукцинилхолина. Если надо, можно
использовать стимулятор периферических
нервов для получения полного
нервно-мышечного
блока.
Из-за короткого полупериода жизни сукцинилхолина продолжительность апноэ после его введения обычно меньше, чем задержка в возвращении сознания после анестезии и постиктального состояния. В случаях врожденных или приобретенных состояний, связанных с дефицитом псевдохолинэстеразы, или когда мета-
183
болизм сукцинилхолина прерывается в результате взаимодействия лекарств, может появиться продолжительное апноэ, и лечащий врач должен быть всегда наготове, чтобы справиться с этой проблемой.
Расположение стимулирующих электродов
Как
уже отмечалось, электроды располагаются
двумя способами, билатеральным и
унилатеральным. Поскольку унилатеральная
ЭСТ связывается с меньшим
числом побочных когнитивных эффектов,
некоторые врачи продолжают по традиции
назначать ЭСТ с унилатеральным
расположением электродов, переходя к
билатеральному после пяти — шести
сеансов неудачного лечения.
Традиционное, билатеральное расположение электродов для ЭСТ — бифронтотемпоральное, каждый электрод имеет центр приблизительно на 2,5 см выше срединной локализации по воображаемой линии, проводимой от козелка ушной раковины до внешнего угла глазной щели. При унилатеральной ЭСТ один стимулирующий электрод обычно располагается над субдоминантной фронтотем-поральной областью. Хотя для второго стимулирующего электрода предложено несколько локализаций, локализация на субдоминантной, центропариетальной области, чуть латеральнее от средней линии на уровне вертекса обеспечивает наиболее низкий порог припадков.
Какое
из полушарий является доминирующим,
определяется рядом простых заданий
на выполнение какой-либо деятельности
(например, право- или левору-кость,
определение доминантной ноги,
предпочтительность, с которой говорит
больной). Реакции правой половины
тела коррелируют в высокой степени с
доминированием
левого полушария. Если реакции носят
смешанный характер или если они
отчетливо указывают на доминирование
левой половины тела, следует чередовать
полярность унилатеральной стимуляции
во время последовательных серий лечения. Следует также оценивать время, в течение
которого к больному возвращается
сознание и он начинает отвечать на
простые вопросы, касающиеся ориентировки
и имени. Сторона, стимуляция которой
вызывает менее быстрое возвращение
сознания и восстановление функции,
считается доминантной.
Следует также оценивать время, в течение
которого к больному возвращается
сознание и он начинает отвечать на
простые вопросы, касающиеся ориентировки
и имени. Сторона, стимуляция которой
вызывает менее быстрое возвращение
сознания и восстановление функции,
считается доминантной.
Электрический стимул
В
аппаратах для ЭСТ используются либо
стимулы постоянного тока, либо постоянного
напряжения. Неясно, какой тип следует
считать предпочтительным. Двумя
основными типами стимуляции являются
синусоволновые и короткие электрические
стимулы. Метод с короткими стимулами
может вызвать припадок с силой,
приблизительно равной ‘/з тои
силы, которая нужна для того, чтобы
вызвать припадок,
используя метод с синусоволновой
стимуляцией. Сейчас в США предпочитается
метод с применением короткого стимула.
Точная характеристика стимула зависит
от аппарата и индивидуального судорожного
порога данного субъекта. Припадок
должен продолжаться от 30 до 60 с. Припадки,
длящиеся дольше 60 с, иногда связаны с
тем, что применяется надпороговая сила
стимула и ее можно уменьшить
в последующих сеансах. В других случаях,
однако, даже небольшое понижение
интенсивности стимула может привести
к полному отсутствию припадка. Если
в течение 20 с припадков не наблюдается,
нужно увеличить интенсивность стимула.
Если слишком долго ждать перед тем, как
увеличить силу стимула, можно
дождаться того, что снизится действие
анестезии или мышечной релаксации.
Припадки,
длящиеся дольше 60 с, иногда связаны с
тем, что применяется надпороговая сила
стимула и ее можно уменьшить
в последующих сеансах. В других случаях,
однако, даже небольшое понижение
интенсивности стимула может привести
к полному отсутствию припадка. Если
в течение 20 с припадков не наблюдается,
нужно увеличить интенсивность стимула.
Если слишком долго ждать перед тем, как
увеличить силу стимула, можно
дождаться того, что снизится действие
анестезии или мышечной релаксации.
Вызванные припадки
Одновременно с поступлением электрического тока, независимо от того, появляются ли припадки, возникает кратковременное мышечное сокращение, наиболее сильное у челюсти. Первым поведенческим признаком припадка часто является разгибание стопы, которое продолжается от 10 до 20 с и характеризует тоническую фазу. Затем за этой фазой следуют ритмические (т. е. клонические) со-
184
крашения,
которые уменьшаются по частоте и в конце
концов исчезают. При тонической
фазе наблюдается высокочастотная,
острая электроэнцефалографическая
активность, на которую могут накладываться
даже еще более высокочастотные мышечные
артефакты. Во время клонической фазы
могут появляться вспышки по-лиспайковой
активности одновременно с мышечными
сокращениями, но обычно они
остаются на несколько секунд дольше,
чем продолжаются клонические движения.
Часто имеет место кратковременное
постиктальное подавление, а иногда
даже полное отсутствие фоновой
ЭЭГ-активности. Такое подавление намного
реже возникает
при унилатеральной ЭСТ, в частности, на
субдоминантном полушарии.
При тонической
фазе наблюдается высокочастотная,
острая электроэнцефалографическая
активность, на которую могут накладываться
даже еще более высокочастотные мышечные
артефакты. Во время клонической фазы
могут появляться вспышки по-лиспайковой
активности одновременно с мышечными
сокращениями, но обычно они
остаются на несколько секунд дольше,
чем продолжаются клонические движения.
Часто имеет место кратковременное
постиктальное подавление, а иногда
даже полное отсутствие фоновой
ЭЭГ-активности. Такое подавление намного
реже возникает
при унилатеральной ЭСТ, в частности, на
субдоминантном полушарии.
Важно
объективно убедиться в том, что после
стимуляции действительно имеют место
билатеральные генерализованные припадки.
Врач должен наблюдать
либо тонически-клонические движения,
либо обнаружить электрофизиологические
доказательства судорожной активности
по ЭЭГ или ЭМГ. Припадки при унилатеральной
ЭСТ асимметричны, выявляют более высокую
ЭЭГ-амплитуду над стимулируемым
полушарием. Иногда возникают унилатеральные
припадки, и
по этой причине важно, чтобы по меньшей
мере одна пара ЭЭГ электродов была
помещена
над контралатеральным полушарием при
использовании унилатеральной
ЭСТ.
Иногда возникают унилатеральные
припадки, и
по этой причине важно, чтобы по меньшей
мере одна пара ЭЭГ электродов была
помещена
над контралатеральным полушарием при
использовании унилатеральной
ЭСТ.
Длительные припадки (припадки, длящиеся более 5 мин) или эпилептический статус можно снять дополнительными дозами анестетика или внутривенным введением диазепама. Эти осложнения могут заканчиваться интубацией, так как воздушный путь через рот недостаточен для адекватного внешнего дыхания в течение обширного периода апноэ. В клинической практике более частую проблему представляет возможность вызвать припадок. Эту проблему можно разрешить с помощью гипервентиляции, уменьшения анестезии, воздействия стимулами малой интенсивности перед воздействием стимулами высокой интенсивности или применением дополнительных стимулирующих веществ (например, кофеина).
Число и промежутки между сеансами ЭСТ
Длительность
курса лечения ЭСТ должна определяться
не фиксированным числом сеансов, а
клинической реакцией больного. Больные,
которые лечатся от депрессии,
обычно выздоравливают медленно; первые
признаки улучшения появляются
после нескольких сеансов, а максимальное
улучшение наблюдается через 5—10 сеансов.
Депрессивным больным обычно назначается
2—3 сеанса в неделю. Маниакальным
больным и больным шизофренией может
потребоваться более частое
назначение сеансов (иногда ежедневно)
и более длительный курс (вплоть до 25
сеансов).
Больные,
которые лечатся от депрессии,
обычно выздоравливают медленно; первые
признаки улучшения появляются
после нескольких сеансов, а максимальное
улучшение наблюдается через 5—10 сеансов.
Депрессивным больным обычно назначается
2—3 сеанса в неделю. Маниакальным
больным и больным шизофренией может
потребоваться более частое
назначение сеансов (иногда ежедневно)
и более длительный курс (вплоть до 25
сеансов).
Поддерживающая терапия
Активный курс ЭСТ вызывает ремиссию, но сам по себе не предотвращает рецидива. Всегда надо проводить поддерживающую терапию после ЭСТ. В основном это бывает фармакологическая терапия, поскольку вопрос об эффективности поддерживающей терапии ЭСТ еще не решен.
ПОБОЧНЫЕ ЭФФЕКТЫ
Противопоказания
К
ЭСТ нет абсолютных противопоказаний,
бывают только ситуации повышенного
риска. Ухудшение после ЭСТ, как правило,
наступает у больных с опухолью
мозга и перенесших инсульт, поскольку
в результате ЭСТ наблюдается
кратковременная
поломка гематоэнцефалического барьера
и повышение внутричерепного
давления. ЭСТ таким больным должна
проводиться с необходимыми кон-
ЭСТ таким больным должна
проводиться с необходимыми кон-
185
трольными измерениями и средствами (например, антигипертензивными, стероидами), предназначенными для минимизации этих потенциальных побочных эффектов. Перенесенный недавно инфаркт миокарда увеличивает риск дальнейшей сердечной декомпенсации при ЭСТ, поскольку при этой процедуре наблюдается усиление кардиоваскулярных нарушений. Тяжелая гипертония также может явиться противопоказанием, поскольку ЭСТ значительно повышает кровяное давление. В этих случаях перед ЭСТ необходимо нормализовать кровяное давление.
Смертность
Смертность при ЭСТ колеблется между 1 на 1000 и 1 на 10000 больных, что приблизительно соответствует смертности от самой кратковременной общей анестезии. Смерть обычно наступает от сердечно-сосудистых нарушений и, как правило, у больных, которые уже страдали сердечными заболеваниями.
Побочные эффекты со стороны ЦНС
Особенно
боятся при ЭСТ побочных действий на
ЦНС, в частности на функцию памяти,
как профессионалы, так и не профессионалы. Хотя нарушения памяти в курсе лечения
ЭСТ являются почти правилом, последующие
данные показывают, что практически
все больные возвращаются к своему
исходному когнитивному
уровню через 6 мес. Некоторые больные,
однако, продолжают жаловаться на
нарушение памяти. Степень когнитивных
нарушений и время, необходимое для
возвращения к исходному уровню, частично
связаны с электростимуляцией, используемой
во время лечения.
Хотя нарушения памяти в курсе лечения
ЭСТ являются почти правилом, последующие
данные показывают, что практически
все больные возвращаются к своему
исходному когнитивному
уровню через 6 мес. Некоторые больные,
однако, продолжают жаловаться на
нарушение памяти. Степень когнитивных
нарушений и время, необходимое для
возвращения к исходному уровню, частично
связаны с электростимуляцией, используемой
во время лечения.
Побочные действия на различные системы организма
Иногда
во время ЭСТ наблюдается кратковременная
сердечная аритмия, правда
незначительная, особенно у больных, у
которых уже отмечались заболевания
сердца. Эта аритмия обычно является
побочным продуктом кратковременной
постиктальной
брадикардии, и поэтому ее можно
предупредить повышением дозы
антихолинергической
премедикации. В других случаях аритмия
может быть вторичной по отношению к
тахикардии, имеющейся во время припадков:
она может также
появиться в период времени, когда к
больному возвращается сознание. В
этих случаях может помочь профилактическое
введение пропранолола. Как уже отмечалось,
состояние апноэ может быть пролонгированным,
если нарушен метаболизм
сукцинилхолина. Токсические или
аллергические реакции на фармакологические
вещества, используемые в курсе ЭСТ,
наблюдаются редко.
В
этих случаях может помочь профилактическое
введение пропранолола. Как уже отмечалось,
состояние апноэ может быть пролонгированным,
если нарушен метаболизм
сукцинилхолина. Токсические или
аллергические реакции на фармакологические
вещества, используемые в курсе ЭСТ,
наблюдаются редко.
СПИСОК ЛИТЕРАТУРЫ
Abrams R., Taylor M. A., Volavka J. ECT-induced EEG asymmetry and therapeutic response in melancholia: Relation to treatment electrode placement.— Am. J. Psych., 1987, 144, 327.
American Psychiatric Association Task Force on ЕСТ: Task Force Report 14: Electro-convulsive Therapy. American Psychiatric Association, Washington, DC, 1978.
Blain J.D.,-Clark S.M., editors Report of the NIMH-NIH consensus development conference on electroconvulsive therapy.— Psychopharm. Bull., 1986, 22, 445.
Fink
M. Meduna
and the origins of convulsive therapy.—
Am. J. Psychiatry, 1984,
141, 1034.
Home R. L., Pettinati H. M., Sugerman A. A.. Varga E. Comparing bilateral to unilateral electroconvulsive therapy in a randomized study with EEG monitoring.— Arch. Gen. Psychiatry, 1985, 42, 1087.
Hyram V., Palmer L.H., Cernik J. ЕСТ: The search for the perfect stimulus.— Biol. Psychiatry, 1985, 20, 634.
Kanamatsu Т., McGinty J. F., Mitchell C. L. Dynorphin and enkephalin-like immunorea-cxivity is altered in limbic-basal ganglia regions of rat brain after repeated electroconvulsive shock.— J. Neurosci, 1986, 6, 644.
186
Lerer B. Studies on the role of brain cholinergic systems on the therapeutic mechanisms and adverse effects of ЕСТ and lithium.-—Biol. Psychiatry, 1985, 20.
‘falitz
S., Sackeim H.A., editors:
Electroconvulsive Therapy: Clinical and Basic Research Issues.
Annals of the New York Academy of Sciences, 1986,
1, 462./s3/tark/NH/201011/09/1407531.jpg) ackheim
H., Decina P., Prohovnik I., Malitz S. Seizure
threshold in electroconvulsive therapy.—Arch.
Gen. Psych., 1987,
44, 355.
ackheim
H., Decina P., Prohovnik I., Malitz S. Seizure
threshold in electroconvulsive therapy.—Arch.
Gen. Psych., 1987,
44, 355.
Squire L.R., Zouzounis J.A. ЕСТ and memory: Brief pulse vers s sinewave.— Am. J. Psychiatry, 1986, 143, 596.
Thompson J. W., Blaine J. D. Use of ЕСТ in the United States in 1975 and 1980.— Am. J. Psych., 1987, 144, 557.
iVeiner R.D. Does electroconvulsive therapy cause brain damage?—Behav. Brain Sci, 1984, 7, 1.
Электросудорожная терапия — StatPearls — NCBI Bookshelf
Непрерывное обучение
У пациента, находящегося под внутривенной седацией или общей анестезией, электросудорожная терапия (ЭСТ) использует электрический ток для создания генерализованного церебрального приступа. Хотя он в основном используется для лечения пациентов с тяжелой депрессией, он также может принести пользу пациентам с шизофренией, шизоаффективным расстройством, кататонией, злокачественным нейролептическим синдромом и биполярным расстройством. В этом мероприятии описываются показания, противопоказания и осложнения ЭСТ, а также подчеркивается роль межпрофессиональной команды в лечении пациентов с психическими расстройствами.
В этом мероприятии описываются показания, противопоказания и осложнения ЭСТ, а также подчеркивается роль межпрофессиональной команды в лечении пациентов с психическими расстройствами.
Цели:
-
Объясните, как действует электрошоковая терапия.
-
Обсудите возможные применения электрошоковой терапии.
-
Рассмотреть дезинформацию, связанную с электрошоковой терапией.
-
Опишите электрошоковую терапию и рассмотрите роль межпрофессиональной бригады в лечении пациентов, перенесших ЭСТ.
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Введение
У пациента, находящегося под внутривенной седацией или общей анестезией, электросудорожная терапия (ЭСТ) использует электрический ток для создания генерализованного церебрального приступа. Хотя он в основном используется для лечения пациентов с тяжелой депрессией, он также может принести пользу пациентам с шизофренией, шизоаффективным расстройством, кататонией, злокачественным нейролептическим синдромом и биполярным расстройством.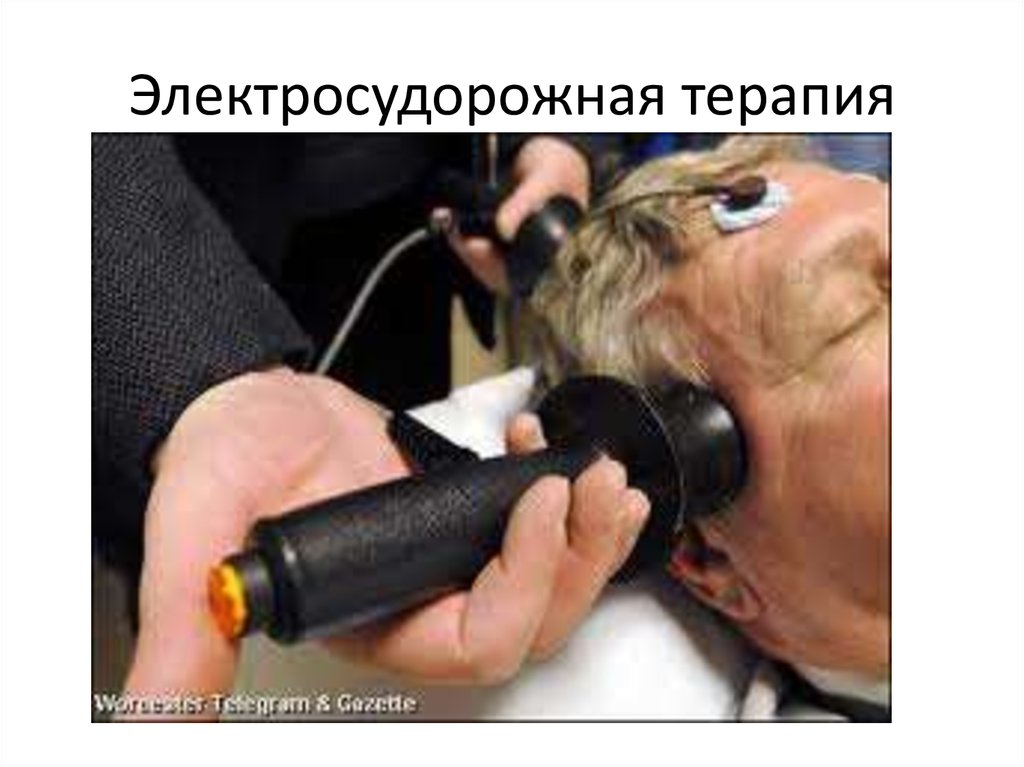 Однако к этой практике приковано клеймо из-за дезинформации о процедурной методологии.
Однако к этой практике приковано клеймо из-за дезинформации о процедурной методологии.
Анатомия и физиология
У пациентов с тяжелой депрессией обнаруживаются различные патофизиологические изменения в областях мозга. К ним относятся снижение активности и объемные сокращения в дорсальных областях лобных долей. Области вентральной и орбитальной лобной коры изменили обработку эмоциональных стимулов. В дополнение к лобной доле, функциональные изменения и уменьшение объема очевидны в гиппокампе, парагиппокампальных извилинах и миндалевидном теле. Ось гипоталамо-гипофизарно-надпочечниковая (ГГН) становится гиперчувствительной к стрессорам, проявляет хронически повышенный уровень гормонов стресса и нарушение регуляции обратной связи. [3] Мезокортиколимбическая дофаминовая система, а также ось HPA активируются у пациентов со стрессом. Считается, что функция дофамина нарушена у пациентов с депрессией, вызывая нарушение основных функций, включая концентрацию, мотивацию и получение удовольствия. [4] Антидепрессивные эффекты ЭСТ отражают изменения в упомянутых выше системах.
[4] Антидепрессивные эффекты ЭСТ отражают изменения в упомянутых выше системах.
Показания
ЭСТ показана пациентам с резистентной к терапии депрессией или тяжелой большой депрессией, нарушающей повседневную деятельность. Определение резистентной к лечению депрессии — это депрессия, не поддающаяся многочисленным испытаниям антидепрессантов.[5] Есть также предложения использовать ЭСТ для лечения суицидальных наклонностей, тяжелого психоза, отказа от еды, вторичного по отношению к депрессии, и кататонии.[6][7] Пациенты с биполярной депрессией и манией также могут получать лечение с помощью ЭСТ.[8] ЭСТ может иметь более безопасный профиль, чем антидепрессанты или нейролептики, у ослабленных, пожилых, беременных и кормящих пациентов. Суицидальные мысли быстро исчезают после ЭСТ, и полное разрешение наблюдалось у 38% пациентов через одну неделю, у 61% пациентов через две недели и у 81% пациентов после завершения ЭСТ [9].] ЭСТ также рекомендуется пациентам, у которых ранее наблюдался благоприятный ответ на ЭСТ.
Противопоказания
Возникший в результате ЭСТ припадок может вызвать временное повышение артериального давления, потребления кислорода миокардом, частоты сердечных сокращений и внутричерепного давления. Необходим уход за пациентами с сердечно-сосудистой, легочной или центральной нервной системой. Феохромоцитома и повышенное внутричерепное давление с масс-эффектом являются абсолютными противопоказаниями к ЭСТ. Относительные противопоказания включают повышенное внутричерепное давление без масс-эффекта, дефекты сердечно-сосудистой проводимости, беременность с высоким риском, аневризмы аорты и головного мозга [10].
Оборудование
Зоны лечения и восстановления ЭСТ должны включать стандартные мониторы Американского общества анестезиологов (ASA). Должны присутствовать стетоскоп, монитор артериального давления, монитор электрокардиографии (ЭКГ), пульсоксиметр, аспиратор и система доставки кислорода. Должны быть доступны средства для индукции анестезии и лекарства, а также оборудование для искусственной вентиляции легких и реанимации.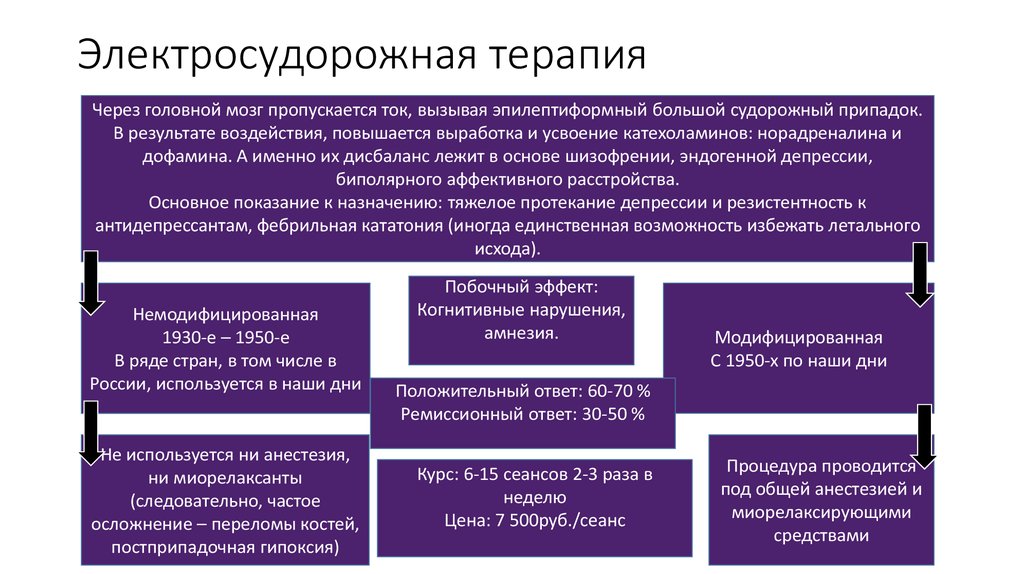 Должны быть в наличии назальная канюля или лицевая маска для подачи дополнительного кислорода, маска с клапаном мешка, нейростимулятор для оценки нервно-мышечной блокады, электроды для электромиографа (ЭМГ), электроэнцефалографии (ЭЭГ) и несколько манжет для измерения артериального давления.
Должны быть в наличии назальная канюля или лицевая маска для подачи дополнительного кислорода, маска с клапаном мешка, нейростимулятор для оценки нервно-мышечной блокады, электроды для электромиографа (ЭМГ), электроэнцефалографии (ЭЭГ) и несколько манжет для измерения артериального давления.
Персонал
ЭСТ проводится бригадой, в которую обычно входят анестезиолог, психиатр и медсестра.
Подготовка
Полный анамнез и физикальное обследование могут выявить значительные факторы риска, включая сердечную ишемию или аритмию, сердечную недостаточность или внутричерепную патологию.[11] В анамнезе также следует учитывать использование растительных препаратов, таких как гинкго билоба, женьшень, зверобой, валериана и кава, которые могут мешать ЭСТ. Существует риск развития эпилептического статуса у пациентов, получающих теофиллин.[12] Внутривенные бета-блокаторы короткого действия могут снижать гипертензию и тахикардию, связанные с ЭСТ, но также могут сокращать продолжительность приступов и снижать эффективность ЭСТ. Кардиологические препараты, включая аспирин, статины, антигипертензивные препараты, антиангинальные препараты и клопидогрел, следует продолжать принимать в день процедуры. Уровни глюкозы в сыворотке требуют проверки как до операции, так и в послеоперационной палате, поскольку лечение ЭСТ может повышать уровень глюкозы в крови. Хотя ЭСТ кажется безопасной для пациента с дефибриллятором, режим детекции следует отключить во время процедуры, а оборудование для наружной дефибрилляции должно быть доступно у постели пациента. У беременных рекомендуется неинвазивный мониторинг плода после 14-16 недель и нестрессовый тест с токометром после 24 недель.
Кардиологические препараты, включая аспирин, статины, антигипертензивные препараты, антиангинальные препараты и клопидогрел, следует продолжать принимать в день процедуры. Уровни глюкозы в сыворотке требуют проверки как до операции, так и в послеоперационной палате, поскольку лечение ЭСТ может повышать уровень глюкозы в крови. Хотя ЭСТ кажется безопасной для пациента с дефибриллятором, режим детекции следует отключить во время процедуры, а оборудование для наружной дефибрилляции должно быть доступно у постели пациента. У беременных рекомендуется неинвазивный мониторинг плода после 14-16 недель и нестрессовый тест с токометром после 24 недель.
ЭСТ использует общую анестезию. Используемые препараты для индукции анестезии включают барбитураты, такие как тиопентал и метогекситал, и небарбитураты, такие как пропофол и этомидат. Припадок, вызванный ЭСТ, должен длиться более 30 секунд. Метогекситал является наиболее часто используемым индуктором из-за его быстрого начала действия, эффективности, низкой стоимости и минимального влияния на продолжительность приступа. Было показано, что пропофол и тиопентал сокращают продолжительность приступов. Этомидат коррелирует с миоклонусом и увеличением продолжительности припадков.
Было показано, что пропофол и тиопентал сокращают продолжительность приступов. Этомидат коррелирует с миоклонусом и увеличением продолжительности припадков.
Техника
ЭСТ обычно проводится в специально отведенном отделении, отделении посленаркозного ухода или в амбулаторном хирургическом отделении, чаще всего в амбулаторных условиях. Пациенты с тяжелой инвалидностью, включая серьезное соматическое или психическое заболевание, могут начать лечение в стационаре и перейти на амбулаторное лечение по мере необходимости. Пациенты должны быть соответственно нулевыми per os (NPO) для процедуры, которая включает отказ от легкой пищи в течение шести часов, отказ от жирной пищи в течение восьми часов и отказ от прозрачных жидкостей за два часа до анестезии.
Жизненно важные показатели, включая насыщение крови кислородом, ЭКГ и активность ЭЭГ, записываются непрерывно. ЭМГ регистрируется на правой ноге для измерения двигательного компонента судорожной активности. Стимулятор нервов используется для мониторинга сукцинилхолина, деполяризующего миорелаксанта, используемого для уменьшения тонико-клонических сокращений во время процедуры. В качестве альтернативы ЭМГ на лодыжку пациента надувают манжету для измерения артериального давления, чтобы предотвратить попадание сукцинилхолина в стопу, что позволяет визуально контролировать судорожную активность с измерением тонико-клонических сокращений. После внутривенной индукции устанавливается накусочная пластина для защиты языка и зубов пациента. Начало и окончание церебрального припадка отслеживают с помощью ЭЭГ, регистрируемой в правой и левой лобной и сосцевидной позициях. Индукция припадка осуществляется с помощью двух электродов, расположенных битемпорально, или правого одностороннего электрода; оба из них позволяют электрическому току проходить в кожу головы. Метаанализ 2017 года многочисленных рандомизированных исследований 792 пациента специально сравнивали двустороннюю ЭСТ средней дозы с правосторонней односторонней ЭСТ высокой дозы, и ремиссия была сопоставимой.[14] Односторонняя правосторонняя ЭСТ используется преимущественно для минимизации ретроградной амнезии.
В качестве альтернативы ЭМГ на лодыжку пациента надувают манжету для измерения артериального давления, чтобы предотвратить попадание сукцинилхолина в стопу, что позволяет визуально контролировать судорожную активность с измерением тонико-клонических сокращений. После внутривенной индукции устанавливается накусочная пластина для защиты языка и зубов пациента. Начало и окончание церебрального припадка отслеживают с помощью ЭЭГ, регистрируемой в правой и левой лобной и сосцевидной позициях. Индукция припадка осуществляется с помощью двух электродов, расположенных битемпорально, или правого одностороннего электрода; оба из них позволяют электрическому току проходить в кожу головы. Метаанализ 2017 года многочисленных рандомизированных исследований 792 пациента специально сравнивали двустороннюю ЭСТ средней дозы с правосторонней односторонней ЭСТ высокой дозы, и ремиссия была сопоставимой.[14] Односторонняя правосторонняя ЭСТ используется преимущественно для минимизации ретроградной амнезии.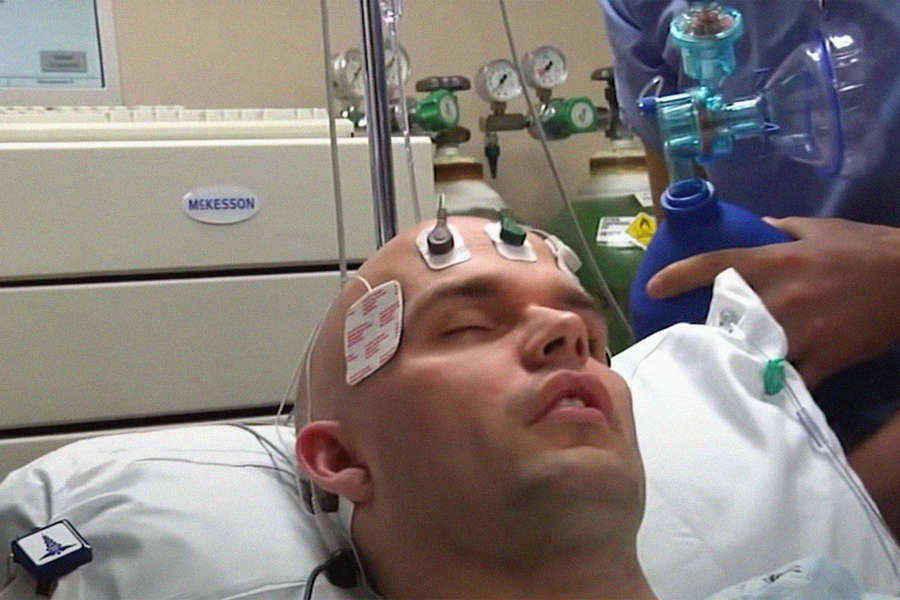
Стимул ЭСТ представляет собой либо короткий импульс (от 0,5 до 2,0 мс), либо ультракороткий импульс (менее 0,5 мс). В то время как короткий пульс считается стандартным, ультракороткий считается более приемлемым.[15] Доза электричества влияет на эффективность, скорость реакции и неблагоприятные когнитивные эффекты. Порог судорог устанавливается методом проб и ошибок путем постепенного повышения дозы тока во время основного сеанса лечения. После расчета первоначальной дозы доза при последующих сеансах ЭСТ для двусторонней ЭСТ в 1,5–2 раза превышает порог судорожной готовности, а для правосторонней односторонней — в шесть раз превышает порог судорожной готовности. Во время курса лечения ЭСТ порог судорожной готовности обычно повышается по мере того, как у пациента развивается толерантность.
Как и при любой другой процедуре, цель анестезиолога во время ЭСТ состоит в том, чтобы облегчить пациенту безопасный и безболезненный опыт.[18] Преоксигенация пациента через назальную канюлю или лицевую маску сопровождается введением анестетика и параличом.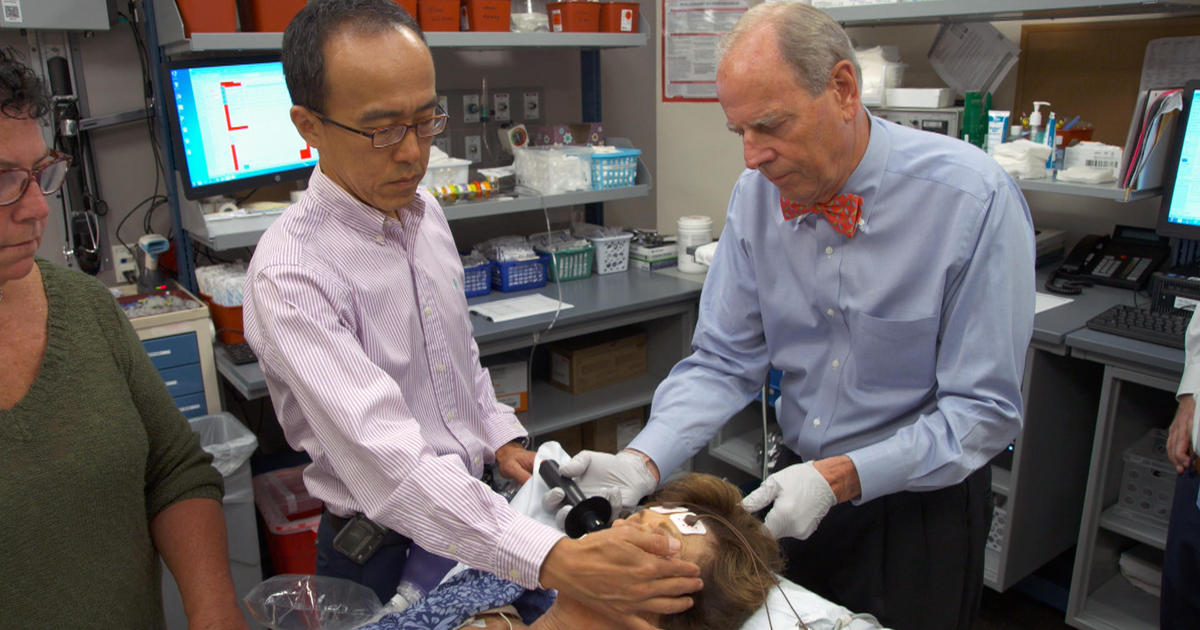 Введение антихолинергических препаратов перед ЭСТ может предотвратить такие аритмии, как брадикардия или асистолия, а также чрезмерное выделение слюны из полости рта. Чтобы вызвать церебральную вазоконстрикцию посредством гипокарбии, пациенту часто проводят гипервентиляцию через маску с мешком перед подачей электрического стимула для увеличения интенсивности припадков [19].] Золотым стандартом для индукции анестезии является метогекситал в дозе от 0,75 до 1 мг/кг.[18] Метогекситал предпочтительнее пропофола, потому что мета-анализ двух рандомизированных исследований показал, что при приеме пропофола продолжительность припадков была короче [20]. Расслабление скелетных мышц во время ЭСТ необходимо для минимизации двигательных припадков и предотвращения травм опорно-двигательного аппарата. Деполяризующий нервно-мышечный релаксант сукцинилхолин используется в дозе от 0,75 до 1 мг/кг с периодом полувыведения 41 секунда.[21][22] В случаях, когда сукцинилхолин противопоказан, включая нервно-мышечное заболевание или травму, ожоговую травму, дефицит псевдохолинэстеразы или гиперкалиемию, предпочтительным вариантом являются недеполяризующие нервно-мышечные релаксанты.
Введение антихолинергических препаратов перед ЭСТ может предотвратить такие аритмии, как брадикардия или асистолия, а также чрезмерное выделение слюны из полости рта. Чтобы вызвать церебральную вазоконстрикцию посредством гипокарбии, пациенту часто проводят гипервентиляцию через маску с мешком перед подачей электрического стимула для увеличения интенсивности припадков [19].] Золотым стандартом для индукции анестезии является метогекситал в дозе от 0,75 до 1 мг/кг.[18] Метогекситал предпочтительнее пропофола, потому что мета-анализ двух рандомизированных исследований показал, что при приеме пропофола продолжительность припадков была короче [20]. Расслабление скелетных мышц во время ЭСТ необходимо для минимизации двигательных припадков и предотвращения травм опорно-двигательного аппарата. Деполяризующий нервно-мышечный релаксант сукцинилхолин используется в дозе от 0,75 до 1 мг/кг с периодом полувыведения 41 секунда.[21][22] В случаях, когда сукцинилхолин противопоказан, включая нервно-мышечное заболевание или травму, ожоговую травму, дефицит псевдохолинэстеразы или гиперкалиемию, предпочтительным вариантом являются недеполяризующие нервно-мышечные релаксанты.
После того, как пациент потеряет сознание, следует введение миорелаксанта, а также искусственная вентиляция легких 100-процентным кислородом. Нервный стимулятор используется для определения адекватности мышечной релаксации наряду с клинической оценкой подошвенных рефлексов и фасцикуляций в икрах и левой стопе. Надутая манжета для измерения артериального давления предотвращает попадание миорелаксанта в правую стопу. Миорелаксанты не предотвращают сокращение жевательных мышц от электрического импульса, что требует установки прикусной пластины для защиты языка и зубов.
Хотя большинство терапевтических приступов ЭСТ длятся от 15 до 70 секунд, запись ЭЭГ длится примерно на 25 процентов дольше, чем двигательный приступ.[23] Приступы продолжительностью менее 15 секунд могут быть клинически неэффективными, в то время как длительные приступы могут вызвать когнитивные нарушения. Пропущенный или короткий припадок должен сопровождаться коротким периодом гипервентиляции и рестимуляции более высоким электрическим током. Если у пациента наблюдается продолжительный припадок продолжительностью более двух минут, индуцирующие агенты, такие как пропофол или метогекситал, назначают либо в половинной дозе, либо бензодиазепин, чтобы подавить судорожную активность и избежать неврологического повреждения. У пациента с многочисленными пропущенными припадками [24][12] могут быть полезны анестетики для индукции, такие как этомидат или кетамин, поскольку они проявляют меньшее противосудорожное действие по сравнению с метогекситалом. Хотя кофеин ранее вводили для продления припадков, он больше не является рекомендацией из-за его неопределенного профиля безопасности для этой цели.
Если у пациента наблюдается продолжительный припадок продолжительностью более двух минут, индуцирующие агенты, такие как пропофол или метогекситал, назначают либо в половинной дозе, либо бензодиазепин, чтобы подавить судорожную активность и избежать неврологического повреждения. У пациента с многочисленными пропущенными припадками [24][12] могут быть полезны анестетики для индукции, такие как этомидат или кетамин, поскольку они проявляют меньшее противосудорожное действие по сравнению с метогекситалом. Хотя кофеин ранее вводили для продления припадков, он больше не является рекомендацией из-за его неопределенного профиля безопасности для этой цели.
Беременным пациенткам, получающим ЭСТ [25, 26], следует избегать гипервентиляции, поскольку она может уменьшить плацентарный кровоток, вызывая гипоксию плода. Минимизация времени NPO и адекватная внутривенная гидратация жидкости необходимы для предотвращения обезвоживания и преждевременных сокращений матки. У женщин со сроком гестации более 20 недель боковое смещение матки влево необходимо для оптимизации материнского венозного возврата и поддержания оптимального маточного кровотока. При сроке беременности более 24 недель, считающемся жизнеспособным, частота сердечных сокращений плода и активность матки должны подвергаться непрерывному мониторингу за 30 минут до и после каждого лечения акушером, который может оказать неотложную акушерскую и неонатальную помощь. Поскольку беременные пациенты подвержены более высокому риску аспирационного пневмонита из-за состояния полного желудка, следует избегать антихолинергических препаратов, снижающих тонус нижнего пищеводного сфинктера, поскольку они могут усилить рефлюкс [27, 25, 28]. В этом случае антациды, не содержащие частиц, такие как цитрат натрия, более безопасны для профилактики аспирации.
При сроке беременности более 24 недель, считающемся жизнеспособным, частота сердечных сокращений плода и активность матки должны подвергаться непрерывному мониторингу за 30 минут до и после каждого лечения акушером, который может оказать неотложную акушерскую и неонатальную помощь. Поскольку беременные пациенты подвержены более высокому риску аспирационного пневмонита из-за состояния полного желудка, следует избегать антихолинергических препаратов, снижающих тонус нижнего пищеводного сфинктера, поскольку они могут усилить рефлюкс [27, 25, 28]. В этом случае антациды, не содержащие частиц, такие как цитрат натрия, более безопасны для профилактики аспирации.
Осложнения
Двусторонняя или битемпоральная ЭСТ вызывает больше когнитивных нарушений, чем односторонняя ЭСТ, хотя этот эффект носит временный характер. Метаанализ 1415 пациентов с депрессией, получавших ЭСТ, показал, что общее познание, вербальная память и автобиографическая память ухудшались при двустороннем лечении через три дня после лечения [29].
По данным Американской психиатрической ассоциации, пациенты, получающие ЭСТ, подвергаются более высокому риску, если у них есть признаки нестабильного или тяжелого сердечно-сосудистого заболевания, объемное внутричерепное поражение с признаками повышенного внутричерепного давления, история острого мозгового кровоизлияния или инсульта, нестабильная сосудистая аневризма, тяжелое заболевание легких или квалификация Американского общества анестезиологов (ASA) класса 4 или 5.
Физиологически во время тонической фазы припадка возникает 15–20-секундная парасимпатическая разрядка, которая может привести к брадиаритмиям, включая преждевременные сокращения предсердий и желудочков, атриовентрикулярную блокаду и асистолию. Пациенты с субсудорожными припадками имеют более высокий риск развития асистолии [30]. Как это ни парадоксально, у пациентов с блокадой сердца или сопутствующими аритмиями вероятность развития асистолии меньше. Клоническая фаза припадка коррелирует с всплеском катехоламинов, вызывающим тахикардию и гипертензию, которые длятся во времени с длительностью припадка. [31] Артериальная гипертензия и тахикардия проходят в течение 10–20 минут после приступа, хотя у некоторых пациентов наблюдается персистирующая артериальная гипертензия, требующая медицинского вмешательства.
[31] Артериальная гипертензия и тахикардия проходят в течение 10–20 минут после приступа, хотя у некоторых пациентов наблюдается персистирующая артериальная гипертензия, требующая медицинского вмешательства.
Хотя пациенты с заболеванием сердца на исходном уровне подвергаются более высокому риску после лечения, фракция выброса может уменьшаться после ЭСТ и у здоровых пациентов.[32] В исследовании 53 взрослых, перенесших ЭСТ, у семи развилась новая глобальная систолическая дисфункция левого желудочка (ЛЖ) и у восьми развились региональные нарушения движения стенки. [33] Из этих пациентов не было неблагоприятных исходов у пациентов с дисфункцией ЛЖ. В проспективном когортном исследовании 100 пациентов, перенесших ЭСТ, повышенные уровни сердечных тропонинов были обнаружены у восьми пациентов, и только у двоих были другие признаки ишемии или инфаркта миокарда. [34] Мозговой кровоток и внутричерепное давление увеличиваются при терапии ЭСТ. Клинически у пациентов могут наблюдаться спутанность сознания, делирий, дезориентация и потеря памяти. Согласно рекомендациям AHA-ACC, ЭСТ классифицируется как процедура с низким риском, поскольку она хорошо переносится и демонстрирует только преходящую гемодинамическую лабильность и низкую смертность. [35][36][37]
Согласно рекомендациям AHA-ACC, ЭСТ классифицируется как процедура с низким риском, поскольку она хорошо переносится и демонстрирует только преходящую гемодинамическую лабильность и низкую смертность. [35][36][37]
Клиническое значение
ЭСТ — это относительно безопасная процедура с низким уровнем риска, которая помогает при лечении депрессии, суицидальных наклонностей, тяжелого психоза, отказа от еды на фоне депрессии и кататонии. Это требует межпрофессиональной координации помощи между анестезиологами, психиатрами и медсестрами. Большинству пациентов требуется несколько сеансов, чтобы увидеть стойкий эффект. Стигма, связанная с ЭСТ, в значительной степени связана с отсутствием анестезии при раннем лечении, что приводит к серьезным травмам и серьезной потере памяти. Антидепрессивный эффект проявляется относительно быстро и может длиться до нескольких лет. В целом уровень смертности при ЭСТ, проводимой в контролируемых условиях, очень низок, но она продолжает вызывать легкую потерю памяти в долгосрочной перспективе.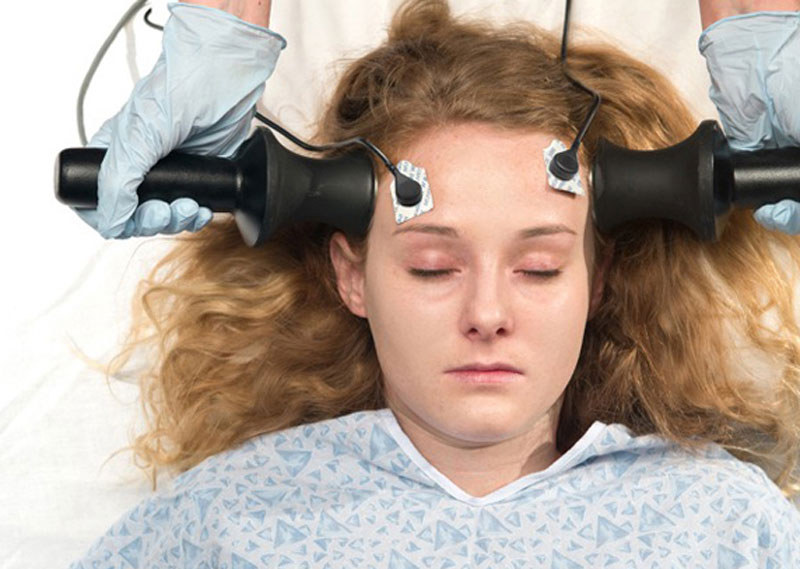 ЭСТ обычно используется у беременных и пожилых людей, чтобы избежать побочных эффектов психотропных препаратов. Хотя механизм действия многофакторен, ЭСТ вызывает изменения мозгового кровотока и регионарного метаболизма.
ЭСТ обычно используется у беременных и пожилых людей, чтобы избежать побочных эффектов психотропных препаратов. Хотя механизм действия многофакторен, ЭСТ вызывает изменения мозгового кровотока и регионарного метаболизма.
Улучшение результатов медицинского обслуживания
Сегодня ЭСТ часто используется для лечения различных психических расстройств, помимо депрессии. Процедура относительно безопасна и действительно работает. Однако для проведения ЭСТ требуется межпрофессиональная команда, в которую входят медсестра, анестезиолог, психиатр и невролог. Преимущества ЭСТ видны после нескольких сеансов, а результаты устойчивы. Ключевым моментом является информирование пациента и его семьи об ЭСТ, потому что эта процедура связана со многими ложными и нелогичными убеждениями. Антидепрессивный эффект проявляется относительно быстро и может длиться до нескольких лет. В целом уровень смертности при ЭСТ, проводимой в контролируемых условиях, очень низок, но она продолжает вызывать легкую потерю памяти в долгосрочной перспективе. ЭСТ обычно используется у беременных и пожилых людей, чтобы избежать побочных эффектов психотропных препаратов. Хотя механизм действия многофакторен, ЭСТ вызывает изменения мозгового кровотока и регионарного метаболизма. Большинство пациентов, перенесших ЭСТ, имеют положительный ответ без каких-либо неблагоприятных последствий. [38](Уровень V)
ЭСТ обычно используется у беременных и пожилых людей, чтобы избежать побочных эффектов психотропных препаратов. Хотя механизм действия многофакторен, ЭСТ вызывает изменения мозгового кровотока и регионарного метаболизма. Большинство пациентов, перенесших ЭСТ, имеют положительный ответ без каких-либо неблагоприятных последствий. [38](Уровень V)
Контрольные вопросы
-
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
-
Комментарий к этой статье.
Ссылки
- 1.
-
Mayberg HS, Lewis PJ, Regenold W, Wagner HN. Паралимбическая гипоперфузия при униполярной депрессии. Дж Нукл Мед. 1994 июнь; 35 (6): 929-34. [PubMed: 8195877]
- 2.
-
Боттерон К.Н., Райхл М.Е., Древец В.К., Хит А.С., Тодд Р.Д. Объемное уменьшение в левой субгенуальной префронтальной коре при ранней депрессии. Биол психиатрия. 2002 15 февраля; 51 (4): 342-4. [В паблике: 11958786]
- 3.

-
de Kwaasteniet B, Ruhe E, Caan M, Rive M, Olabarriaga S, Groefsema M, Heesink L, van Wingen G, Denys D. Связь между структурной и функциональной связью при большом депрессивном расстройстве. Биол психиатрия. 2013 01 июля; 74 (1): 40-7. [PubMed: 23399372]
- 4.
-
Ригуччи С., Серафини Г., Помпили М., Коцалидис Г.Д., Татарелли Р. Анатомические и функциональные корреляты при большом депрессивном расстройстве: вклад исследований нейровизуализации. Всемирная биологическая психиатрия. 2010 март; 11 (2 часть 2): 165-80. [В паблике: 19670087]
- 5.
-
Американская психиатрическая ассоциация. Целевая группа по электросудорожной терапии. Практика ЭСТ: рекомендации по лечению, обучению и предоставлению привилегий. Судороги Тер. 1990 июнь; 6 (2): 85-120. [PubMed: 11659302]
- 6.
-
Хусейн М.М., Раш А.Дж., Финк М., Кнапп Р., Петридес Г., Румманс Т., Биггс М.М., О’Коннор К., Расмуссен К., Литл М., Чжао В., Бернштейн Х.
 Дж. , Смит Г., Мюллер М., МакКлинток С.М., Бейлин С.Х., Келлнер Ч.Х. Скорость ответа и ремиссии при большом депрессивном расстройстве с острой электросудорожной терапией (ЭСТ): отчет Консорциума по исследованиям в области ЭСТ (CORE). Дж. Клин Психиатрия. 2004 г., апрель; 65 (4): 485-9.1. [PubMed: 15119910]
Дж. , Смит Г., Мюллер М., МакКлинток С.М., Бейлин С.Х., Келлнер Ч.Х. Скорость ответа и ремиссии при большом депрессивном расстройстве с острой электросудорожной терапией (ЭСТ): отчет Консорциума по исследованиям в области ЭСТ (CORE). Дж. Клин Психиатрия. 2004 г., апрель; 65 (4): 485-9.1. [PubMed: 15119910] - 7.
-
Келлнер Ч., Кнапп Р., Хусейн М.М., Расмуссен К., Сэмпсон С., Каллум М., МакКлинток С.М., Тобиас К.Г., Мартино С., Мюллер М., Бейлин С.Х., Финк М. , Петридес Г. Бифронтальное, битемпоральное и правое одностороннее размещение электродов при ЭСТ: рандомизированное исследование. Бр Дж. Психиатрия. 2010 март; 196(3):226-34. [Бесплатная статья PMC: PMC2830057] [PubMed: 20194546]
- 8.
-
Финк М. Показания к применению ЭСТ. Психофармаколь Булл. 1994;30(3):269-75; обсуждение 276-80. [PubMed: 7878176]
- 9.
-
Kellner CH, Fink M, Knapp R, Petrides G, Husain M, Rummans T, Mueller M, Bernstein H, Rasmussen K, O’Connor K, Smith G, Rush AJ , Biggs M, McClintock S, Bailine S, Malur C.
 Облегчение выраженных суицидальных намерений с помощью ЭСТ: консорциум по исследованиям в области ЭСТ. Am J Психиатрия. 2005 май; 162(5):977-82. [Бесплатная статья PMC: PMC3684568] [PubMed: 15863801]
Облегчение выраженных суицидальных намерений с помощью ЭСТ: консорциум по исследованиям в области ЭСТ. Am J Психиатрия. 2005 май; 162(5):977-82. [Бесплатная статья PMC: PMC3684568] [PubMed: 15863801] - 10.
-
Тейлор С. Электросудорожная терапия: обзор анамнеза, отбор пациентов, техника и медикаментозное лечение. South Med J. 2007 Май; 100 (5): 494-8. [PubMed: 17534086]
- 11.
-
Тесс А.В., Сметана Г.В. Медицинское обследование пациентов, подвергающихся электросудорожной терапии. N Engl J Med. 2009 02 апреля; 360 (14): 1437-44. [PubMed: 19339723]
- 12.
-
Devanand DP, Decina P, Sackeim HA, Prudic J. Эпилептический статус после ЭСТ у пациента, получающего теофиллин. J Clin Psychopharmacol. 1988 г., апрель; 8 (2): 153. [PubMed: 3372714]
- 13.
-
Bjølseth TM, Engedal K, Benth JŠ, Dybedal GS, Gaarden TL, Tanum L. Клиническая эффективность основанной на формуле бифронтальной и правосторонней односторонней электросудорожной терапии (ЭСТ) при лечении большая депрессия среди пожилых пациентов: прагматическое, рандомизированное, слепое, контролируемое исследование.
] J Аффективное расстройство. 2015 01 апреля; 175:8-17. [В паблике: 255
J Аффективное расстройство. 2015 01 апреля; 175:8-17. [В паблике: 255 - 14.
-
Колшус Э., Желовац А., Маклафлин Д.М. Битемпоральная и высокодозная правосторонняя односторонняя электросудорожная терапия депрессии: систематический обзор и метаанализ рандомизированных контролируемых исследований. Психомед. 2017 фев; 47 (3): 518-530. [PubMed: 27780482]
- 15.
-
Sienaert P, Spaans HP, Kellner CH. Ширина импульса в электросудорожной терапии: насколько кратка кратка? ЭКСТ. 2018 июнь;34(2):73-74. [PubMed: 29489561]
- 16.
-
Петридес Г., Финк М. Стратегия стимуляции половинного возраста для дозирования ЭСТ. Судороги Тер. 1996 сен; 12 (3): 138-46. [PubMed: 8872401]
- 17.
-
Петридес Г., Брага Р.Дж., Финк М., Мюллер М., Кнапп Р., Хусейн М., Румманс Т., Бейлин С., Малур С., О’Коннор К., Келлнер С., CORE (Консорциум по исследованиям в области ЭСТ) Group. Порог судорожного припадка в большой выборке: последствия для стратегий дозирования стимулов при двусторонней электросудорожной терапии: отчет CORE.
 ЭКСТ. 2009 г.Декабрь; 25 (4): 232-7. [Бесплатная статья PMC: PMC2792571] [PubMed: 19972637]
ЭКСТ. 2009 г.Декабрь; 25 (4): 232-7. [Бесплатная статья PMC: PMC2792571] [PubMed: 19972637] - 18.
-
Bryson EO, Aloysi AS, Farber KG, Kellner CH. Индивидуальное анестезиологическое обеспечение пациентов, подвергающихся электросудорожной терапии: обзор современной практики. Анест Анальг. 2017 июнь; 124 (6): 1943-1956. [PubMed: 28277323]
- 19.
-
Bergsholm P, Gran L, Bleie H. Продолжительность приступа при односторонней электросудорожной терапии. Эффект гипокапнии, индуцированной гипервентиляцией, и эффект вентиляции кислородом. Acta Psychiatr Scand. 1984 февраля; 69(2):121-8. [PubMed: 6422704]
- 20.
-
Lihua P, Su M, Ke W, Ziemann-Gimmel P. Различные схемы внутривенного введения седативных или снотворных средств для электросудорожной терапии (ЭСТ) у взрослых пациентов с депрессией. Cochrane Database Syst Rev. 2014 Apr 11;(4):CD009763. [Статья бесплатно PMC: PMC6464335] [PubMed: 24723301]
- 21.
-
Брайсон Э.
 О., Келлнер К.Х., Ли Э.Х., Алоизи А.С., Майеске М. Чрезвычайная вариабельность дозы сукцинилхолина для мышечной релаксации при электросудорожной терапии. Австралийская психиатрия. 2018 Авг;26(4):391-393. [PubMed: 29504412]
О., Келлнер К.Х., Ли Э.Х., Алоизи А.С., Майеске М. Чрезвычайная вариабельность дозы сукцинилхолина для мышечной релаксации при электросудорожной терапии. Австралийская психиатрия. 2018 Авг;26(4):391-393. [PubMed: 29504412] - 22.
-
Торда Т.А., Грэм Г.Г., Уорик Н.Р., Донохью П. Фармакокинетика и фармакодинамика суксаметония. Интенсивная терапия Анест. 1997 июнь; 25 (3): 272-8. [PubMed: 9209610]
- 23.
-
Майур П.М., Гангадхар Б.Н., Джанакирамайа Н., Суббакришна Д.К. Мониторинг двигательных припадков во время электросудорожной терапии. Бр Дж. Психиатрия. 1999 март; 174: 270-2. [PubMed: 10448455]
- 24.
-
Datto C, Rai AK, Ilivicky HJ, Caroff SN. Увеличение индукции судорог при электросудорожной терапии: клиническая переоценка. ЭКСТ. 2002 г., сен; 18 (3): 118–25. [В паблике: 12394529]
- 25.
-
Миллер Л.Дж. Применение электросудорожной терапии во время беременности. Общественная психиатрия Хосп.
 1994 г., май; 45(5):444-50. [PubMed: 8045538]
1994 г., май; 45(5):444-50. [PubMed: 8045538] - 26.
-
Рабхеру К. Использование электросудорожной терапии у особых групп пациентов. Can J Психиатрия. 2001 г., октябрь; 46 (8): 710-9. [PubMed: 11692973]
- 27.
-
Yonkers KA, Wisner KL, Stowe Z, Leibenluft E, Cohen L, Miller L, Manber R, Viguera A, Suppes T, Altshuler L. Управление биполярным расстройством во время беременности и послеродовой период. Am J Психиатрия. 2004 г., апрель; 161(4):608-20. [В паблике: 15056503]
- 28.
-
Андерсон Э.Л., Рети И.М. ЭСТ при беременности: обзор литературы с 1941 по 2007 год. Psychosom Med. 2009 г., февраль; 71 (2): 235–42. [PubMed: 151]
- 29.
-
Семковска М., Кин Д., Бабалола О., Маклафлин Д.М. Односторонняя короткоимпульсная электросудорожная терапия и познание: эффекты размещения электродов, дозировка стимула и время. J Psychiatr Res. 2011 июнь; 45 (6): 770-80. [PubMed: 21109254]
- 30.

-
Кауфман К.Р. Асистолия при электросудорожной терапии. J Интерн Мед. 1994 марта; 235 (3): 275-7. [PubMed: 8120525]
- 31.
-
Ларсон Г., Шварц С., Абрамс Р. Продолжительность тахикардии, вызванной ЭСТ, как мера продолжительности приступа. Am J Психиатрия. 1984 г., октябрь; 141 (10): 1269-71. [PubMed: 6486265]
- 32.
-
Fuenmayor AJ, el Fakih Y, Moreno J, Fuenmayor AM. Влияние электросудорожной терапии на сердечную функцию у пациентов без сердечных заболеваний. Кардиология. 1997 г., май-июнь; 88(3):254-7. [PubMed: 46]
- 33.
-
Маккалли Р.Б., Карон Б.Л., Румманс Т.А., Блэк Дж.Л., Андрин К.М., О Дж.К., Сьюард Дж.Б., Таджик А.Дж. Частота дисфункции левого желудочка после электросудорожной терапии. Ам Джей Кардиол. 2003 г. 01 мая; 91 (9): 1147-50. [PubMed: 12714169]
- 34.
-
Дума А., Пал С., Джонстон Дж., Хельвани М.А., Бхат А., Гилл Б., Розенквист Дж., Картмилл С., Браун Ф.
 , Миллер Дж.П., Скотт М.Г., Санчес-Конде Ф. , Джарвис М., Фарбер Н.Б., Зорумски С.Ф., Конвей С., Нагеле П. Повышение уровня высокочувствительного сердечного тропонина после электросудорожной терапии: проспективное обсервационное когортное исследование. Анестезиология. 2017 Апрель; 126 (4): 643-652. [Бесплатная статья PMC: PMC5350051] [PubMed: 28166110]
, Миллер Дж.П., Скотт М.Г., Санчес-Конде Ф. , Джарвис М., Фарбер Н.Б., Зорумски С.Ф., Конвей С., Нагеле П. Повышение уровня высокочувствительного сердечного тропонина после электросудорожной терапии: проспективное обсервационное когортное исследование. Анестезиология. 2017 Апрель; 126 (4): 643-652. [Бесплатная статья PMC: PMC5350051] [PubMed: 28166110] - 35.
-
Зелински Р.Дж., Руз С.П., Девананд Д.П., Вудринг С., Сакейм Х.А. Сердечно-сосудистые осложнения ЭСТ у пациентов с депрессией и сердечными заболеваниями. Am J Психиатрия. 1993 г., июнь; 150 (6): 904-9. [PubMed: 8494067]
- 36.
-
Райс Э.Х., Сомбротто Л.Б., Марковиц Дж.К., Леон А.С. Сердечно-сосудистые заболевания у пациентов с высоким риском во время ЭСТ. Am J Психиатрия. 1994 ноябрь; 151(11):1637-41. [PubMed: 7943453]
- 37.
-
Абрамс Р. Смертность при ЭСТ. Судороги Тер. 1997 сент.; 13(3):125-7. [PubMed: 9342128]
- 38.
-
Бенсон Н.
 М., Сейнер С.Дж., Болтон П., Фицморис Г., Мейснер Р.К., Пирс С., Буш А.Б. Результаты лечения острой фазы электросудорожной терапии у подростков и молодых людей. ЭКСТ. 2019 сен; 35 (3): 178-183. [Бесплатная статья PMC: PMC6581623] [PubMed: 30562200]
М., Сейнер С.Дж., Болтон П., Фицморис Г., Мейснер Р.К., Пирс С., Буш А.Б. Результаты лечения острой фазы электросудорожной терапии у подростков и молодых людей. ЭКСТ. 2019 сен; 35 (3): 178-183. [Бесплатная статья PMC: PMC6581623] [PubMed: 30562200]
Электросудорожная терапия — StatPearls — NCBI Bookshelf
Continuing Education Activity
У пациента, находящегося под внутривенной седацией или общей анестезией, электросудорожная терапия (для ЭСТ) вызвать генерализованный мозговой припадок. Хотя он в основном используется для лечения пациентов с тяжелой депрессией, он также может принести пользу пациентам с шизофренией, шизоаффективным расстройством, кататонией, злокачественным нейролептическим синдромом и биполярным расстройством. В этом задании описываются показания, противопоказания и осложнения ЭСТ, а также подчеркивается роль межпрофессиональной команды в лечении пациентов с психическими расстройствами.
Цели:
-
Объясните, как действует электрошоковая терапия.

-
Обсудите возможные применения электрошоковой терапии.
-
Рассмотреть дезинформацию, связанную с электрошоковой терапией.
-
Опишите электрошоковую терапию и рассмотрите роль межпрофессиональной бригады в лечении пациентов, перенесших ЭСТ.
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Введение
У пациента, находящегося под внутривенной седацией или общей анестезией, электросудорожная терапия (ЭСТ) использует электрический ток для создания генерализованного церебрального приступа. Хотя он в основном используется для лечения пациентов с тяжелой депрессией, он также может принести пользу пациентам с шизофренией, шизоаффективным расстройством, кататонией, злокачественным нейролептическим синдромом и биполярным расстройством. Однако к этой практике приковано клеймо из-за дезинформации о процедурной методологии.
Анатомия и физиология
У пациентов с тяжелой депрессией обнаруживаются различные патофизиологические изменения в областях мозга. К ним относятся снижение активности и объемные сокращения в дорсальных областях лобных долей. Области вентральной и орбитальной лобной коры изменили обработку эмоциональных стимулов. В дополнение к лобной доле, функциональные изменения и уменьшение объема очевидны в гиппокампе, парагиппокампальных извилинах и миндалевидном теле. Ось гипоталамо-гипофизарно-надпочечниковая (ГГН) становится гиперчувствительной к стрессорам, проявляет хронически повышенный уровень гормонов стресса и нарушение регуляции обратной связи. [3] Мезокортиколимбическая дофаминовая система, а также ось HPA активируются у пациентов со стрессом. Считается, что функция дофамина нарушена у пациентов с депрессией, вызывая нарушение основных функций, включая концентрацию, мотивацию и получение удовольствия.[4] Антидепрессивные эффекты ЭСТ отражают изменения в упомянутых выше системах.
К ним относятся снижение активности и объемные сокращения в дорсальных областях лобных долей. Области вентральной и орбитальной лобной коры изменили обработку эмоциональных стимулов. В дополнение к лобной доле, функциональные изменения и уменьшение объема очевидны в гиппокампе, парагиппокампальных извилинах и миндалевидном теле. Ось гипоталамо-гипофизарно-надпочечниковая (ГГН) становится гиперчувствительной к стрессорам, проявляет хронически повышенный уровень гормонов стресса и нарушение регуляции обратной связи. [3] Мезокортиколимбическая дофаминовая система, а также ось HPA активируются у пациентов со стрессом. Считается, что функция дофамина нарушена у пациентов с депрессией, вызывая нарушение основных функций, включая концентрацию, мотивацию и получение удовольствия.[4] Антидепрессивные эффекты ЭСТ отражают изменения в упомянутых выше системах.
Показания
ЭСТ показана пациентам с резистентной к терапии депрессией или тяжелой большой депрессией, нарушающей повседневную деятельность. Определение резистентной к лечению депрессии — это депрессия, не поддающаяся многочисленным испытаниям антидепрессантов.[5] Есть также предложения использовать ЭСТ для лечения суицидальных наклонностей, тяжелого психоза, отказа от еды, вторичного по отношению к депрессии, и кататонии.[6][7] Пациенты с биполярной депрессией и манией также могут получать лечение с помощью ЭСТ.[8] ЭСТ может иметь более безопасный профиль, чем антидепрессанты или нейролептики, у ослабленных, пожилых, беременных и кормящих пациентов. Суицидальные мысли быстро исчезают после ЭСТ, и полное разрешение наблюдалось у 38% пациентов через одну неделю, у 61% пациентов через две недели и у 81% пациентов после завершения ЭСТ [9].] ЭСТ также рекомендуется пациентам, у которых ранее наблюдался благоприятный ответ на ЭСТ.
Определение резистентной к лечению депрессии — это депрессия, не поддающаяся многочисленным испытаниям антидепрессантов.[5] Есть также предложения использовать ЭСТ для лечения суицидальных наклонностей, тяжелого психоза, отказа от еды, вторичного по отношению к депрессии, и кататонии.[6][7] Пациенты с биполярной депрессией и манией также могут получать лечение с помощью ЭСТ.[8] ЭСТ может иметь более безопасный профиль, чем антидепрессанты или нейролептики, у ослабленных, пожилых, беременных и кормящих пациентов. Суицидальные мысли быстро исчезают после ЭСТ, и полное разрешение наблюдалось у 38% пациентов через одну неделю, у 61% пациентов через две недели и у 81% пациентов после завершения ЭСТ [9].] ЭСТ также рекомендуется пациентам, у которых ранее наблюдался благоприятный ответ на ЭСТ.
Противопоказания
Возникший в результате ЭСТ припадок может вызвать временное повышение артериального давления, потребления кислорода миокардом, частоты сердечных сокращений и внутричерепного давления. Необходим уход за пациентами с сердечно-сосудистой, легочной или центральной нервной системой. Феохромоцитома и повышенное внутричерепное давление с масс-эффектом являются абсолютными противопоказаниями к ЭСТ. Относительные противопоказания включают повышенное внутричерепное давление без масс-эффекта, дефекты сердечно-сосудистой проводимости, беременность с высоким риском, аневризмы аорты и головного мозга [10].
Необходим уход за пациентами с сердечно-сосудистой, легочной или центральной нервной системой. Феохромоцитома и повышенное внутричерепное давление с масс-эффектом являются абсолютными противопоказаниями к ЭСТ. Относительные противопоказания включают повышенное внутричерепное давление без масс-эффекта, дефекты сердечно-сосудистой проводимости, беременность с высоким риском, аневризмы аорты и головного мозга [10].
Оборудование
Зоны лечения и восстановления ЭСТ должны включать стандартные мониторы Американского общества анестезиологов (ASA). Должны присутствовать стетоскоп, монитор артериального давления, монитор электрокардиографии (ЭКГ), пульсоксиметр, аспиратор и система доставки кислорода. Должны быть доступны средства для индукции анестезии и лекарства, а также оборудование для искусственной вентиляции легких и реанимации. Должны быть в наличии назальная канюля или лицевая маска для подачи дополнительного кислорода, маска с клапаном мешка, нейростимулятор для оценки нервно-мышечной блокады, электроды для электромиографа (ЭМГ), электроэнцефалографии (ЭЭГ) и несколько манжет для измерения артериального давления.
Персонал
ЭСТ проводится бригадой, в которую обычно входят анестезиолог, психиатр и медсестра.
Подготовка
Полный анамнез и физикальное обследование могут выявить значительные факторы риска, включая сердечную ишемию или аритмию, сердечную недостаточность или внутричерепную патологию.[11] В анамнезе также следует учитывать использование растительных препаратов, таких как гинкго билоба, женьшень, зверобой, валериана и кава, которые могут мешать ЭСТ. Существует риск развития эпилептического статуса у пациентов, получающих теофиллин.[12] Внутривенные бета-блокаторы короткого действия могут снижать гипертензию и тахикардию, связанные с ЭСТ, но также могут сокращать продолжительность приступов и снижать эффективность ЭСТ. Кардиологические препараты, включая аспирин, статины, антигипертензивные препараты, антиангинальные препараты и клопидогрел, следует продолжать принимать в день процедуры. Уровни глюкозы в сыворотке требуют проверки как до операции, так и в послеоперационной палате, поскольку лечение ЭСТ может повышать уровень глюкозы в крови. Хотя ЭСТ кажется безопасной для пациента с дефибриллятором, режим детекции следует отключить во время процедуры, а оборудование для наружной дефибрилляции должно быть доступно у постели пациента. У беременных рекомендуется неинвазивный мониторинг плода после 14-16 недель и нестрессовый тест с токометром после 24 недель.
Хотя ЭСТ кажется безопасной для пациента с дефибриллятором, режим детекции следует отключить во время процедуры, а оборудование для наружной дефибрилляции должно быть доступно у постели пациента. У беременных рекомендуется неинвазивный мониторинг плода после 14-16 недель и нестрессовый тест с токометром после 24 недель.
ЭСТ использует общую анестезию. Используемые препараты для индукции анестезии включают барбитураты, такие как тиопентал и метогекситал, и небарбитураты, такие как пропофол и этомидат. Припадок, вызванный ЭСТ, должен длиться более 30 секунд. Метогекситал является наиболее часто используемым индуктором из-за его быстрого начала действия, эффективности, низкой стоимости и минимального влияния на продолжительность приступа. Было показано, что пропофол и тиопентал сокращают продолжительность приступов. Этомидат коррелирует с миоклонусом и увеличением продолжительности припадков.
Техника
ЭСТ обычно проводится в специально отведенном отделении, отделении посленаркозного ухода или в амбулаторном хирургическом отделении, чаще всего в амбулаторных условиях. Пациенты с тяжелой инвалидностью, включая серьезное соматическое или психическое заболевание, могут начать лечение в стационаре и перейти на амбулаторное лечение по мере необходимости. Пациенты должны быть соответственно нулевыми per os (NPO) для процедуры, которая включает отказ от легкой пищи в течение шести часов, отказ от жирной пищи в течение восьми часов и отказ от прозрачных жидкостей за два часа до анестезии.
Пациенты с тяжелой инвалидностью, включая серьезное соматическое или психическое заболевание, могут начать лечение в стационаре и перейти на амбулаторное лечение по мере необходимости. Пациенты должны быть соответственно нулевыми per os (NPO) для процедуры, которая включает отказ от легкой пищи в течение шести часов, отказ от жирной пищи в течение восьми часов и отказ от прозрачных жидкостей за два часа до анестезии.
Жизненно важные показатели, включая насыщение крови кислородом, ЭКГ и активность ЭЭГ, записываются непрерывно. ЭМГ регистрируется на правой ноге для измерения двигательного компонента судорожной активности. Стимулятор нервов используется для мониторинга сукцинилхолина, деполяризующего миорелаксанта, используемого для уменьшения тонико-клонических сокращений во время процедуры. В качестве альтернативы ЭМГ на лодыжку пациента надувают манжету для измерения артериального давления, чтобы предотвратить попадание сукцинилхолина в стопу, что позволяет визуально контролировать судорожную активность с измерением тонико-клонических сокращений. После внутривенной индукции устанавливается накусочная пластина для защиты языка и зубов пациента. Начало и окончание церебрального припадка отслеживают с помощью ЭЭГ, регистрируемой в правой и левой лобной и сосцевидной позициях. Индукция припадка осуществляется с помощью двух электродов, расположенных битемпорально, или правого одностороннего электрода; оба из них позволяют электрическому току проходить в кожу головы. Метаанализ 2017 года многочисленных рандомизированных исследований 792 пациента специально сравнивали двустороннюю ЭСТ средней дозы с правосторонней односторонней ЭСТ высокой дозы, и ремиссия была сопоставимой.[14] Односторонняя правосторонняя ЭСТ используется преимущественно для минимизации ретроградной амнезии.
После внутривенной индукции устанавливается накусочная пластина для защиты языка и зубов пациента. Начало и окончание церебрального припадка отслеживают с помощью ЭЭГ, регистрируемой в правой и левой лобной и сосцевидной позициях. Индукция припадка осуществляется с помощью двух электродов, расположенных битемпорально, или правого одностороннего электрода; оба из них позволяют электрическому току проходить в кожу головы. Метаанализ 2017 года многочисленных рандомизированных исследований 792 пациента специально сравнивали двустороннюю ЭСТ средней дозы с правосторонней односторонней ЭСТ высокой дозы, и ремиссия была сопоставимой.[14] Односторонняя правосторонняя ЭСТ используется преимущественно для минимизации ретроградной амнезии.
Стимул ЭСТ представляет собой либо короткий импульс (от 0,5 до 2,0 мс), либо ультракороткий импульс (менее 0,5 мс). В то время как короткий пульс считается стандартным, ультракороткий считается более приемлемым.[15] Доза электричества влияет на эффективность, скорость реакции и неблагоприятные когнитивные эффекты. Порог судорог устанавливается методом проб и ошибок путем постепенного повышения дозы тока во время основного сеанса лечения. После расчета первоначальной дозы доза при последующих сеансах ЭСТ для двусторонней ЭСТ в 1,5–2 раза превышает порог судорожной готовности, а для правосторонней односторонней — в шесть раз превышает порог судорожной готовности. Во время курса лечения ЭСТ порог судорожной готовности обычно повышается по мере того, как у пациента развивается толерантность.
Порог судорог устанавливается методом проб и ошибок путем постепенного повышения дозы тока во время основного сеанса лечения. После расчета первоначальной дозы доза при последующих сеансах ЭСТ для двусторонней ЭСТ в 1,5–2 раза превышает порог судорожной готовности, а для правосторонней односторонней — в шесть раз превышает порог судорожной готовности. Во время курса лечения ЭСТ порог судорожной готовности обычно повышается по мере того, как у пациента развивается толерантность.
Как и при любой другой процедуре, цель анестезиолога во время ЭСТ состоит в том, чтобы облегчить пациенту безопасный и безболезненный опыт.[18] Преоксигенация пациента через назальную канюлю или лицевую маску сопровождается введением анестетика и параличом. Введение антихолинергических препаратов перед ЭСТ может предотвратить такие аритмии, как брадикардия или асистолия, а также чрезмерное выделение слюны из полости рта. Чтобы вызвать церебральную вазоконстрикцию посредством гипокарбии, пациенту часто проводят гипервентиляцию через маску с мешком перед подачей электрического стимула для увеличения интенсивности припадков [19]. ] Золотым стандартом для индукции анестезии является метогекситал в дозе от 0,75 до 1 мг/кг.[18] Метогекситал предпочтительнее пропофола, потому что мета-анализ двух рандомизированных исследований показал, что при приеме пропофола продолжительность припадков была короче [20]. Расслабление скелетных мышц во время ЭСТ необходимо для минимизации двигательных припадков и предотвращения травм опорно-двигательного аппарата. Деполяризующий нервно-мышечный релаксант сукцинилхолин используется в дозе от 0,75 до 1 мг/кг с периодом полувыведения 41 секунда.[21][22] В случаях, когда сукцинилхолин противопоказан, включая нервно-мышечное заболевание или травму, ожоговую травму, дефицит псевдохолинэстеразы или гиперкалиемию, предпочтительным вариантом являются недеполяризующие нервно-мышечные релаксанты.
] Золотым стандартом для индукции анестезии является метогекситал в дозе от 0,75 до 1 мг/кг.[18] Метогекситал предпочтительнее пропофола, потому что мета-анализ двух рандомизированных исследований показал, что при приеме пропофола продолжительность припадков была короче [20]. Расслабление скелетных мышц во время ЭСТ необходимо для минимизации двигательных припадков и предотвращения травм опорно-двигательного аппарата. Деполяризующий нервно-мышечный релаксант сукцинилхолин используется в дозе от 0,75 до 1 мг/кг с периодом полувыведения 41 секунда.[21][22] В случаях, когда сукцинилхолин противопоказан, включая нервно-мышечное заболевание или травму, ожоговую травму, дефицит псевдохолинэстеразы или гиперкалиемию, предпочтительным вариантом являются недеполяризующие нервно-мышечные релаксанты.
После того, как пациент потеряет сознание, следует введение миорелаксанта, а также искусственная вентиляция легких 100-процентным кислородом. Нервный стимулятор используется для определения адекватности мышечной релаксации наряду с клинической оценкой подошвенных рефлексов и фасцикуляций в икрах и левой стопе. Надутая манжета для измерения артериального давления предотвращает попадание миорелаксанта в правую стопу. Миорелаксанты не предотвращают сокращение жевательных мышц от электрического импульса, что требует установки прикусной пластины для защиты языка и зубов.
Надутая манжета для измерения артериального давления предотвращает попадание миорелаксанта в правую стопу. Миорелаксанты не предотвращают сокращение жевательных мышц от электрического импульса, что требует установки прикусной пластины для защиты языка и зубов.
Хотя большинство терапевтических приступов ЭСТ длятся от 15 до 70 секунд, запись ЭЭГ длится примерно на 25 процентов дольше, чем двигательный приступ.[23] Приступы продолжительностью менее 15 секунд могут быть клинически неэффективными, в то время как длительные приступы могут вызвать когнитивные нарушения. Пропущенный или короткий припадок должен сопровождаться коротким периодом гипервентиляции и рестимуляции более высоким электрическим током. Если у пациента наблюдается продолжительный припадок продолжительностью более двух минут, индуцирующие агенты, такие как пропофол или метогекситал, назначают либо в половинной дозе, либо бензодиазепин, чтобы подавить судорожную активность и избежать неврологического повреждения. У пациента с многочисленными пропущенными припадками [24][12] могут быть полезны анестетики для индукции, такие как этомидат или кетамин, поскольку они проявляют меньшее противосудорожное действие по сравнению с метогекситалом. Хотя кофеин ранее вводили для продления припадков, он больше не является рекомендацией из-за его неопределенного профиля безопасности для этой цели.
Хотя кофеин ранее вводили для продления припадков, он больше не является рекомендацией из-за его неопределенного профиля безопасности для этой цели.
Беременным пациенткам, получающим ЭСТ [25, 26], следует избегать гипервентиляции, поскольку она может уменьшить плацентарный кровоток, вызывая гипоксию плода. Минимизация времени NPO и адекватная внутривенная гидратация жидкости необходимы для предотвращения обезвоживания и преждевременных сокращений матки. У женщин со сроком гестации более 20 недель боковое смещение матки влево необходимо для оптимизации материнского венозного возврата и поддержания оптимального маточного кровотока. При сроке беременности более 24 недель, считающемся жизнеспособным, частота сердечных сокращений плода и активность матки должны подвергаться непрерывному мониторингу за 30 минут до и после каждого лечения акушером, который может оказать неотложную акушерскую и неонатальную помощь. Поскольку беременные пациенты подвержены более высокому риску аспирационного пневмонита из-за состояния полного желудка, следует избегать антихолинергических препаратов, снижающих тонус нижнего пищеводного сфинктера, поскольку они могут усилить рефлюкс [27, 25, 28]. В этом случае антациды, не содержащие частиц, такие как цитрат натрия, более безопасны для профилактики аспирации.
В этом случае антациды, не содержащие частиц, такие как цитрат натрия, более безопасны для профилактики аспирации.
Осложнения
Двусторонняя или битемпоральная ЭСТ вызывает больше когнитивных нарушений, чем односторонняя ЭСТ, хотя этот эффект носит временный характер. Метаанализ 1415 пациентов с депрессией, получавших ЭСТ, показал, что общее познание, вербальная память и автобиографическая память ухудшались при двустороннем лечении через три дня после лечения [29].
По данным Американской психиатрической ассоциации, пациенты, получающие ЭСТ, подвергаются более высокому риску, если у них есть признаки нестабильного или тяжелого сердечно-сосудистого заболевания, объемное внутричерепное поражение с признаками повышенного внутричерепного давления, история острого мозгового кровоизлияния или инсульта, нестабильная сосудистая аневризма, тяжелое заболевание легких или квалификация Американского общества анестезиологов (ASA) класса 4 или 5.
Физиологически во время тонической фазы припадка возникает 15–20-секундная парасимпатическая разрядка, которая может привести к брадиаритмиям, включая преждевременные сокращения предсердий и желудочков, атриовентрикулярную блокаду и асистолию. Пациенты с субсудорожными припадками имеют более высокий риск развития асистолии [30]. Как это ни парадоксально, у пациентов с блокадой сердца или сопутствующими аритмиями вероятность развития асистолии меньше. Клоническая фаза припадка коррелирует с всплеском катехоламинов, вызывающим тахикардию и гипертензию, которые длятся во времени с длительностью припадка.[31] Артериальная гипертензия и тахикардия проходят в течение 10–20 минут после приступа, хотя у некоторых пациентов наблюдается персистирующая артериальная гипертензия, требующая медицинского вмешательства.
Пациенты с субсудорожными припадками имеют более высокий риск развития асистолии [30]. Как это ни парадоксально, у пациентов с блокадой сердца или сопутствующими аритмиями вероятность развития асистолии меньше. Клоническая фаза припадка коррелирует с всплеском катехоламинов, вызывающим тахикардию и гипертензию, которые длятся во времени с длительностью припадка.[31] Артериальная гипертензия и тахикардия проходят в течение 10–20 минут после приступа, хотя у некоторых пациентов наблюдается персистирующая артериальная гипертензия, требующая медицинского вмешательства.
Хотя пациенты с заболеванием сердца на исходном уровне подвергаются более высокому риску после лечения, фракция выброса может уменьшаться после ЭСТ и у здоровых пациентов.[32] В исследовании 53 взрослых, перенесших ЭСТ, у семи развилась новая глобальная систолическая дисфункция левого желудочка (ЛЖ) и у восьми развились региональные нарушения движения стенки. [33] Из этих пациентов не было неблагоприятных исходов у пациентов с дисфункцией ЛЖ. В проспективном когортном исследовании 100 пациентов, перенесших ЭСТ, повышенные уровни сердечных тропонинов были обнаружены у восьми пациентов, и только у двоих были другие признаки ишемии или инфаркта миокарда. [34] Мозговой кровоток и внутричерепное давление увеличиваются при терапии ЭСТ. Клинически у пациентов могут наблюдаться спутанность сознания, делирий, дезориентация и потеря памяти. Согласно рекомендациям AHA-ACC, ЭСТ классифицируется как процедура с низким риском, поскольку она хорошо переносится и демонстрирует только преходящую гемодинамическую лабильность и низкую смертность. [35][36][37]
В проспективном когортном исследовании 100 пациентов, перенесших ЭСТ, повышенные уровни сердечных тропонинов были обнаружены у восьми пациентов, и только у двоих были другие признаки ишемии или инфаркта миокарда. [34] Мозговой кровоток и внутричерепное давление увеличиваются при терапии ЭСТ. Клинически у пациентов могут наблюдаться спутанность сознания, делирий, дезориентация и потеря памяти. Согласно рекомендациям AHA-ACC, ЭСТ классифицируется как процедура с низким риском, поскольку она хорошо переносится и демонстрирует только преходящую гемодинамическую лабильность и низкую смертность. [35][36][37]
Клиническое значение
ЭСТ — это относительно безопасная процедура с низким уровнем риска, которая помогает при лечении депрессии, суицидальных наклонностей, тяжелого психоза, отказа от еды на фоне депрессии и кататонии. Это требует межпрофессиональной координации помощи между анестезиологами, психиатрами и медсестрами. Большинству пациентов требуется несколько сеансов, чтобы увидеть стойкий эффект. Стигма, связанная с ЭСТ, в значительной степени связана с отсутствием анестезии при раннем лечении, что приводит к серьезным травмам и серьезной потере памяти. Антидепрессивный эффект проявляется относительно быстро и может длиться до нескольких лет. В целом уровень смертности при ЭСТ, проводимой в контролируемых условиях, очень низок, но она продолжает вызывать легкую потерю памяти в долгосрочной перспективе. ЭСТ обычно используется у беременных и пожилых людей, чтобы избежать побочных эффектов психотропных препаратов. Хотя механизм действия многофакторен, ЭСТ вызывает изменения мозгового кровотока и регионарного метаболизма.
Стигма, связанная с ЭСТ, в значительной степени связана с отсутствием анестезии при раннем лечении, что приводит к серьезным травмам и серьезной потере памяти. Антидепрессивный эффект проявляется относительно быстро и может длиться до нескольких лет. В целом уровень смертности при ЭСТ, проводимой в контролируемых условиях, очень низок, но она продолжает вызывать легкую потерю памяти в долгосрочной перспективе. ЭСТ обычно используется у беременных и пожилых людей, чтобы избежать побочных эффектов психотропных препаратов. Хотя механизм действия многофакторен, ЭСТ вызывает изменения мозгового кровотока и регионарного метаболизма.
Улучшение результатов медицинского обслуживания
Сегодня ЭСТ часто используется для лечения различных психических расстройств, помимо депрессии. Процедура относительно безопасна и действительно работает. Однако для проведения ЭСТ требуется межпрофессиональная команда, в которую входят медсестра, анестезиолог, психиатр и невролог. Преимущества ЭСТ видны после нескольких сеансов, а результаты устойчивы. Ключевым моментом является информирование пациента и его семьи об ЭСТ, потому что эта процедура связана со многими ложными и нелогичными убеждениями. Антидепрессивный эффект проявляется относительно быстро и может длиться до нескольких лет. В целом уровень смертности при ЭСТ, проводимой в контролируемых условиях, очень низок, но она продолжает вызывать легкую потерю памяти в долгосрочной перспективе. ЭСТ обычно используется у беременных и пожилых людей, чтобы избежать побочных эффектов психотропных препаратов. Хотя механизм действия многофакторен, ЭСТ вызывает изменения мозгового кровотока и регионарного метаболизма. Большинство пациентов, перенесших ЭСТ, имеют положительный ответ без каких-либо неблагоприятных последствий. [38](Уровень V)
Ключевым моментом является информирование пациента и его семьи об ЭСТ, потому что эта процедура связана со многими ложными и нелогичными убеждениями. Антидепрессивный эффект проявляется относительно быстро и может длиться до нескольких лет. В целом уровень смертности при ЭСТ, проводимой в контролируемых условиях, очень низок, но она продолжает вызывать легкую потерю памяти в долгосрочной перспективе. ЭСТ обычно используется у беременных и пожилых людей, чтобы избежать побочных эффектов психотропных препаратов. Хотя механизм действия многофакторен, ЭСТ вызывает изменения мозгового кровотока и регионарного метаболизма. Большинство пациентов, перенесших ЭСТ, имеют положительный ответ без каких-либо неблагоприятных последствий. [38](Уровень V)
Контрольные вопросы
-
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
-
Комментарий к этой статье.
Ссылки
- 1.
-
Mayberg HS, Lewis PJ, Regenold W, Wagner HN.
 Паралимбическая гипоперфузия при униполярной депрессии. Дж Нукл Мед. 1994 июнь; 35 (6): 929-34. [PubMed: 8195877]
Паралимбическая гипоперфузия при униполярной депрессии. Дж Нукл Мед. 1994 июнь; 35 (6): 929-34. [PubMed: 8195877] - 2.
-
Боттерон К.Н., Райхл М.Е., Древец В.К., Хит А.С., Тодд Р.Д. Объемное уменьшение в левой субгенуальной префронтальной коре при ранней депрессии. Биол психиатрия. 2002 15 февраля; 51 (4): 342-4. [В паблике: 11958786]
- 3.
-
de Kwaasteniet B, Ruhe E, Caan M, Rive M, Olabarriaga S, Groefsema M, Heesink L, van Wingen G, Denys D. Связь между структурной и функциональной связью при большом депрессивном расстройстве. Биол психиатрия. 2013 01 июля; 74 (1): 40-7. [PubMed: 23399372]
- 4.
-
Ригуччи С., Серафини Г., Помпили М., Коцалидис Г.Д., Татарелли Р. Анатомические и функциональные корреляты при большом депрессивном расстройстве: вклад исследований нейровизуализации. Всемирная биологическая психиатрия. 2010 март; 11 (2 часть 2): 165-80. [В паблике: 19670087]
- 5.
-
Американская психиатрическая ассоциация.
 Целевая группа по электросудорожной терапии. Практика ЭСТ: рекомендации по лечению, обучению и предоставлению привилегий. Судороги Тер. 1990 июнь; 6 (2): 85-120. [PubMed: 11659302]
Целевая группа по электросудорожной терапии. Практика ЭСТ: рекомендации по лечению, обучению и предоставлению привилегий. Судороги Тер. 1990 июнь; 6 (2): 85-120. [PubMed: 11659302] - 6.
-
Хусейн М.М., Раш А.Дж., Финк М., Кнапп Р., Петридес Г., Румманс Т., Биггс М.М., О’Коннор К., Расмуссен К., Литл М., Чжао В., Бернштейн Х.Дж. , Смит Г., Мюллер М., МакКлинток С.М., Бейлин С.Х., Келлнер Ч.Х. Скорость ответа и ремиссии при большом депрессивном расстройстве с острой электросудорожной терапией (ЭСТ): отчет Консорциума по исследованиям в области ЭСТ (CORE). Дж. Клин Психиатрия. 2004 г., апрель; 65 (4): 485-9.1. [PubMed: 15119910]
- 7.
-
Келлнер Ч., Кнапп Р., Хусейн М.М., Расмуссен К., Сэмпсон С., Каллум М., МакКлинток С.М., Тобиас К.Г., Мартино С., Мюллер М., Бейлин С.Х., Финк М. , Петридес Г. Бифронтальное, битемпоральное и правое одностороннее размещение электродов при ЭСТ: рандомизированное исследование. Бр Дж. Психиатрия. 2010 март; 196(3):226-34.
 [Бесплатная статья PMC: PMC2830057] [PubMed: 20194546]
[Бесплатная статья PMC: PMC2830057] [PubMed: 20194546] - 8.
-
Финк М. Показания к применению ЭСТ. Психофармаколь Булл. 1994;30(3):269-75; обсуждение 276-80. [PubMed: 7878176]
- 9.
-
Kellner CH, Fink M, Knapp R, Petrides G, Husain M, Rummans T, Mueller M, Bernstein H, Rasmussen K, O’Connor K, Smith G, Rush AJ , Biggs M, McClintock S, Bailine S, Malur C. Облегчение выраженных суицидальных намерений с помощью ЭСТ: консорциум по исследованиям в области ЭСТ. Am J Психиатрия. 2005 май; 162(5):977-82. [Бесплатная статья PMC: PMC3684568] [PubMed: 15863801]
- 10.
-
Тейлор С. Электросудорожная терапия: обзор анамнеза, отбор пациентов, техника и медикаментозное лечение. South Med J. 2007 Май; 100 (5): 494-8. [PubMed: 17534086]
- 11.
-
Тесс А.В., Сметана Г.В. Медицинское обследование пациентов, подвергающихся электросудорожной терапии. N Engl J Med. 2009 02 апреля; 360 (14): 1437-44. [PubMed: 19339723]
- 12.

-
Devanand DP, Decina P, Sackeim HA, Prudic J. Эпилептический статус после ЭСТ у пациента, получающего теофиллин. J Clin Psychopharmacol. 1988 г., апрель; 8 (2): 153. [PubMed: 3372714]
- 13.
-
Bjølseth TM, Engedal K, Benth JŠ, Dybedal GS, Gaarden TL, Tanum L. Клиническая эффективность основанной на формуле бифронтальной и правосторонней односторонней электросудорожной терапии (ЭСТ) при лечении большая депрессия среди пожилых пациентов: прагматическое, рандомизированное, слепое, контролируемое исследование. J Аффективное расстройство. 2015 01 апреля; 175:8-17. [В паблике: 255
] - 14.
-
Колшус Э., Желовац А., Маклафлин Д.М. Битемпоральная и высокодозная правосторонняя односторонняя электросудорожная терапия депрессии: систематический обзор и метаанализ рандомизированных контролируемых исследований. Психомед. 2017 фев; 47 (3): 518-530. [PubMed: 27780482]
- 15.
-
Sienaert P, Spaans HP, Kellner CH.
 Ширина импульса в электросудорожной терапии: насколько кратка кратка? ЭКСТ. 2018 июнь;34(2):73-74. [PubMed: 29489561]
Ширина импульса в электросудорожной терапии: насколько кратка кратка? ЭКСТ. 2018 июнь;34(2):73-74. [PubMed: 29489561] - 16.
-
Петридес Г., Финк М. Стратегия стимуляции половинного возраста для дозирования ЭСТ. Судороги Тер. 1996 сен; 12 (3): 138-46. [PubMed: 8872401]
- 17.
-
Петридес Г., Брага Р.Дж., Финк М., Мюллер М., Кнапп Р., Хусейн М., Румманс Т., Бейлин С., Малур С., О’Коннор К., Келлнер С., CORE (Консорциум по исследованиям в области ЭСТ) Group. Порог судорожного припадка в большой выборке: последствия для стратегий дозирования стимулов при двусторонней электросудорожной терапии: отчет CORE. ЭКСТ. 2009 г.Декабрь; 25 (4): 232-7. [Бесплатная статья PMC: PMC2792571] [PubMed: 19972637]
- 18.
-
Bryson EO, Aloysi AS, Farber KG, Kellner CH. Индивидуальное анестезиологическое обеспечение пациентов, подвергающихся электросудорожной терапии: обзор современной практики. Анест Анальг. 2017 июнь; 124 (6): 1943-1956.
 [PubMed: 28277323]
[PubMed: 28277323] - 19.
-
Bergsholm P, Gran L, Bleie H. Продолжительность приступа при односторонней электросудорожной терапии. Эффект гипокапнии, индуцированной гипервентиляцией, и эффект вентиляции кислородом. Acta Psychiatr Scand. 1984 февраля; 69(2):121-8. [PubMed: 6422704]
- 20.
-
Lihua P, Su M, Ke W, Ziemann-Gimmel P. Различные схемы внутривенного введения седативных или снотворных средств для электросудорожной терапии (ЭСТ) у взрослых пациентов с депрессией. Cochrane Database Syst Rev. 2014 Apr 11;(4):CD009763. [Статья бесплатно PMC: PMC6464335] [PubMed: 24723301]
- 21.
-
Брайсон Э.О., Келлнер К.Х., Ли Э.Х., Алоизи А.С., Майеске М. Чрезвычайная вариабельность дозы сукцинилхолина для мышечной релаксации при электросудорожной терапии. Австралийская психиатрия. 2018 Авг;26(4):391-393. [PubMed: 29504412]
- 22.
-
Торда Т.А., Грэм Г.Г., Уорик Н.Р., Донохью П. Фармакокинетика и фармакодинамика суксаметония.
 Интенсивная терапия Анест. 1997 июнь; 25 (3): 272-8. [PubMed: 9209610]
Интенсивная терапия Анест. 1997 июнь; 25 (3): 272-8. [PubMed: 9209610] - 23.
-
Майур П.М., Гангадхар Б.Н., Джанакирамайа Н., Суббакришна Д.К. Мониторинг двигательных припадков во время электросудорожной терапии. Бр Дж. Психиатрия. 1999 март; 174: 270-2. [PubMed: 10448455]
- 24.
-
Datto C, Rai AK, Ilivicky HJ, Caroff SN. Увеличение индукции судорог при электросудорожной терапии: клиническая переоценка. ЭКСТ. 2002 г., сен; 18 (3): 118–25. [В паблике: 12394529]
- 25.
-
Миллер Л.Дж. Применение электросудорожной терапии во время беременности. Общественная психиатрия Хосп. 1994 г., май; 45(5):444-50. [PubMed: 8045538]
- 26.
-
Рабхеру К. Использование электросудорожной терапии у особых групп пациентов. Can J Психиатрия. 2001 г., октябрь; 46 (8): 710-9. [PubMed: 11692973]
- 27.
-
Yonkers KA, Wisner KL, Stowe Z, Leibenluft E, Cohen L, Miller L, Manber R, Viguera A, Suppes T, Altshuler L.
 Управление биполярным расстройством во время беременности и послеродовой период. Am J Психиатрия. 2004 г., апрель; 161(4):608-20. [В паблике: 15056503]
Управление биполярным расстройством во время беременности и послеродовой период. Am J Психиатрия. 2004 г., апрель; 161(4):608-20. [В паблике: 15056503] - 28.
-
Андерсон Э.Л., Рети И.М. ЭСТ при беременности: обзор литературы с 1941 по 2007 год. Psychosom Med. 2009 г., февраль; 71 (2): 235–42. [PubMed: 151]
- 29.
-
Семковска М., Кин Д., Бабалола О., Маклафлин Д.М. Односторонняя короткоимпульсная электросудорожная терапия и познание: эффекты размещения электродов, дозировка стимула и время. J Psychiatr Res. 2011 июнь; 45 (6): 770-80. [PubMed: 21109254]
- 30.
-
Кауфман К.Р. Асистолия при электросудорожной терапии. J Интерн Мед. 1994 марта; 235 (3): 275-7. [PubMed: 8120525]
- 31.
-
Ларсон Г., Шварц С., Абрамс Р. Продолжительность тахикардии, вызванной ЭСТ, как мера продолжительности приступа. Am J Психиатрия. 1984 г., октябрь; 141 (10): 1269-71. [PubMed: 6486265]
- 32.

-
Fuenmayor AJ, el Fakih Y, Moreno J, Fuenmayor AM. Влияние электросудорожной терапии на сердечную функцию у пациентов без сердечных заболеваний. Кардиология. 1997 г., май-июнь; 88(3):254-7. [PubMed: 46]
- 33.
-
Маккалли Р.Б., Карон Б.Л., Румманс Т.А., Блэк Дж.Л., Андрин К.М., О Дж.К., Сьюард Дж.Б., Таджик А.Дж. Частота дисфункции левого желудочка после электросудорожной терапии. Ам Джей Кардиол. 2003 г. 01 мая; 91 (9): 1147-50. [PubMed: 12714169]
- 34.
-
Дума А., Пал С., Джонстон Дж., Хельвани М.А., Бхат А., Гилл Б., Розенквист Дж., Картмилл С., Браун Ф., Миллер Дж.П., Скотт М.Г., Санчес-Конде Ф. , Джарвис М., Фарбер Н.Б., Зорумски С.Ф., Конвей С., Нагеле П. Повышение уровня высокочувствительного сердечного тропонина после электросудорожной терапии: проспективное обсервационное когортное исследование. Анестезиология. 2017 Апрель; 126 (4): 643-652. [Бесплатная статья PMC: PMC5350051] [PubMed: 28166110]
- 35.

-
Зелински Р.Дж., Руз С.П., Девананд Д.П., Вудринг С., Сакейм Х.А. Сердечно-сосудистые осложнения ЭСТ у пациентов с депрессией и сердечными заболеваниями. Am J Психиатрия. 1993 г., июнь; 150 (6): 904-9. [PubMed: 8494067]
- 36.
-
Райс Э.Х., Сомбротто Л.Б., Марковиц Дж.К., Леон А.С. Сердечно-сосудистые заболевания у пациентов с высоким риском во время ЭСТ. Am J Психиатрия. 1994 ноябрь; 151(11):1637-41. [PubMed: 7943453]
- 37.
-
Абрамс Р. Смертность при ЭСТ. Судороги Тер. 1997 сент.; 13(3):125-7. [PubMed: 9342128]
- 38.
-
Бенсон Н.М., Сейнер С.Дж., Болтон П., Фицморис Г., Мейснер Р.К., Пирс С., Буш А.Б. Результаты лечения острой фазы электросудорожной терапии у подростков и молодых людей. ЭКСТ. 2019 сен; 35 (3): 178-183. [Бесплатная статья PMC: PMC6581623] [PubMed: 30562200]
Электросудорожная терапия — StatPearls — NCBI Bookshelf
Continuing Education Activity
У пациента, находящегося под внутривенной седацией или общей анестезией, электросудорожная терапия (для ЭСТ) вызвать генерализованный мозговой припадок. Хотя он в основном используется для лечения пациентов с тяжелой депрессией, он также может принести пользу пациентам с шизофренией, шизоаффективным расстройством, кататонией, злокачественным нейролептическим синдромом и биполярным расстройством. В этом задании описываются показания, противопоказания и осложнения ЭСТ, а также подчеркивается роль межпрофессиональной команды в лечении пациентов с психическими расстройствами.
Хотя он в основном используется для лечения пациентов с тяжелой депрессией, он также может принести пользу пациентам с шизофренией, шизоаффективным расстройством, кататонией, злокачественным нейролептическим синдромом и биполярным расстройством. В этом задании описываются показания, противопоказания и осложнения ЭСТ, а также подчеркивается роль межпрофессиональной команды в лечении пациентов с психическими расстройствами.
Цели:
-
Объясните, как действует электрошоковая терапия.
-
Обсудите возможные применения электрошоковой терапии.
-
Рассмотреть дезинформацию, связанную с электрошоковой терапией.
-
Опишите электрошоковую терапию и рассмотрите роль межпрофессиональной бригады в лечении пациентов, перенесших ЭСТ.
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Введение
У пациента, находящегося под внутривенной седацией или общей анестезией, электросудорожная терапия (ЭСТ) использует электрический ток для создания генерализованного церебрального приступа. Хотя он в основном используется для лечения пациентов с тяжелой депрессией, он также может принести пользу пациентам с шизофренией, шизоаффективным расстройством, кататонией, злокачественным нейролептическим синдромом и биполярным расстройством. Однако к этой практике приковано клеймо из-за дезинформации о процедурной методологии.
Хотя он в основном используется для лечения пациентов с тяжелой депрессией, он также может принести пользу пациентам с шизофренией, шизоаффективным расстройством, кататонией, злокачественным нейролептическим синдромом и биполярным расстройством. Однако к этой практике приковано клеймо из-за дезинформации о процедурной методологии.
Анатомия и физиология
У пациентов с тяжелой депрессией обнаруживаются различные патофизиологические изменения в областях мозга. К ним относятся снижение активности и объемные сокращения в дорсальных областях лобных долей. Области вентральной и орбитальной лобной коры изменили обработку эмоциональных стимулов. В дополнение к лобной доле, функциональные изменения и уменьшение объема очевидны в гиппокампе, парагиппокампальных извилинах и миндалевидном теле. Ось гипоталамо-гипофизарно-надпочечниковая (ГГН) становится гиперчувствительной к стрессорам, проявляет хронически повышенный уровень гормонов стресса и нарушение регуляции обратной связи. [3] Мезокортиколимбическая дофаминовая система, а также ось HPA активируются у пациентов со стрессом. Считается, что функция дофамина нарушена у пациентов с депрессией, вызывая нарушение основных функций, включая концентрацию, мотивацию и получение удовольствия.[4] Антидепрессивные эффекты ЭСТ отражают изменения в упомянутых выше системах.
[3] Мезокортиколимбическая дофаминовая система, а также ось HPA активируются у пациентов со стрессом. Считается, что функция дофамина нарушена у пациентов с депрессией, вызывая нарушение основных функций, включая концентрацию, мотивацию и получение удовольствия.[4] Антидепрессивные эффекты ЭСТ отражают изменения в упомянутых выше системах.
Показания
ЭСТ показана пациентам с резистентной к терапии депрессией или тяжелой большой депрессией, нарушающей повседневную деятельность. Определение резистентной к лечению депрессии — это депрессия, не поддающаяся многочисленным испытаниям антидепрессантов.[5] Есть также предложения использовать ЭСТ для лечения суицидальных наклонностей, тяжелого психоза, отказа от еды, вторичного по отношению к депрессии, и кататонии.[6][7] Пациенты с биполярной депрессией и манией также могут получать лечение с помощью ЭСТ.[8] ЭСТ может иметь более безопасный профиль, чем антидепрессанты или нейролептики, у ослабленных, пожилых, беременных и кормящих пациентов. Суицидальные мысли быстро исчезают после ЭСТ, и полное разрешение наблюдалось у 38% пациентов через одну неделю, у 61% пациентов через две недели и у 81% пациентов после завершения ЭСТ [9].] ЭСТ также рекомендуется пациентам, у которых ранее наблюдался благоприятный ответ на ЭСТ.
Суицидальные мысли быстро исчезают после ЭСТ, и полное разрешение наблюдалось у 38% пациентов через одну неделю, у 61% пациентов через две недели и у 81% пациентов после завершения ЭСТ [9].] ЭСТ также рекомендуется пациентам, у которых ранее наблюдался благоприятный ответ на ЭСТ.
Противопоказания
Возникший в результате ЭСТ припадок может вызвать временное повышение артериального давления, потребления кислорода миокардом, частоты сердечных сокращений и внутричерепного давления. Необходим уход за пациентами с сердечно-сосудистой, легочной или центральной нервной системой. Феохромоцитома и повышенное внутричерепное давление с масс-эффектом являются абсолютными противопоказаниями к ЭСТ. Относительные противопоказания включают повышенное внутричерепное давление без масс-эффекта, дефекты сердечно-сосудистой проводимости, беременность с высоким риском, аневризмы аорты и головного мозга [10].
Оборудование
Зоны лечения и восстановления ЭСТ должны включать стандартные мониторы Американского общества анестезиологов (ASA). Должны присутствовать стетоскоп, монитор артериального давления, монитор электрокардиографии (ЭКГ), пульсоксиметр, аспиратор и система доставки кислорода. Должны быть доступны средства для индукции анестезии и лекарства, а также оборудование для искусственной вентиляции легких и реанимации. Должны быть в наличии назальная канюля или лицевая маска для подачи дополнительного кислорода, маска с клапаном мешка, нейростимулятор для оценки нервно-мышечной блокады, электроды для электромиографа (ЭМГ), электроэнцефалографии (ЭЭГ) и несколько манжет для измерения артериального давления.
Должны присутствовать стетоскоп, монитор артериального давления, монитор электрокардиографии (ЭКГ), пульсоксиметр, аспиратор и система доставки кислорода. Должны быть доступны средства для индукции анестезии и лекарства, а также оборудование для искусственной вентиляции легких и реанимации. Должны быть в наличии назальная канюля или лицевая маска для подачи дополнительного кислорода, маска с клапаном мешка, нейростимулятор для оценки нервно-мышечной блокады, электроды для электромиографа (ЭМГ), электроэнцефалографии (ЭЭГ) и несколько манжет для измерения артериального давления.
Персонал
ЭСТ проводится бригадой, в которую обычно входят анестезиолог, психиатр и медсестра.
Подготовка
Полный анамнез и физикальное обследование могут выявить значительные факторы риска, включая сердечную ишемию или аритмию, сердечную недостаточность или внутричерепную патологию.[11] В анамнезе также следует учитывать использование растительных препаратов, таких как гинкго билоба, женьшень, зверобой, валериана и кава, которые могут мешать ЭСТ. Существует риск развития эпилептического статуса у пациентов, получающих теофиллин.[12] Внутривенные бета-блокаторы короткого действия могут снижать гипертензию и тахикардию, связанные с ЭСТ, но также могут сокращать продолжительность приступов и снижать эффективность ЭСТ. Кардиологические препараты, включая аспирин, статины, антигипертензивные препараты, антиангинальные препараты и клопидогрел, следует продолжать принимать в день процедуры. Уровни глюкозы в сыворотке требуют проверки как до операции, так и в послеоперационной палате, поскольку лечение ЭСТ может повышать уровень глюкозы в крови. Хотя ЭСТ кажется безопасной для пациента с дефибриллятором, режим детекции следует отключить во время процедуры, а оборудование для наружной дефибрилляции должно быть доступно у постели пациента. У беременных рекомендуется неинвазивный мониторинг плода после 14-16 недель и нестрессовый тест с токометром после 24 недель.
Существует риск развития эпилептического статуса у пациентов, получающих теофиллин.[12] Внутривенные бета-блокаторы короткого действия могут снижать гипертензию и тахикардию, связанные с ЭСТ, но также могут сокращать продолжительность приступов и снижать эффективность ЭСТ. Кардиологические препараты, включая аспирин, статины, антигипертензивные препараты, антиангинальные препараты и клопидогрел, следует продолжать принимать в день процедуры. Уровни глюкозы в сыворотке требуют проверки как до операции, так и в послеоперационной палате, поскольку лечение ЭСТ может повышать уровень глюкозы в крови. Хотя ЭСТ кажется безопасной для пациента с дефибриллятором, режим детекции следует отключить во время процедуры, а оборудование для наружной дефибрилляции должно быть доступно у постели пациента. У беременных рекомендуется неинвазивный мониторинг плода после 14-16 недель и нестрессовый тест с токометром после 24 недель.
ЭСТ использует общую анестезию. Используемые препараты для индукции анестезии включают барбитураты, такие как тиопентал и метогекситал, и небарбитураты, такие как пропофол и этомидат. Припадок, вызванный ЭСТ, должен длиться более 30 секунд. Метогекситал является наиболее часто используемым индуктором из-за его быстрого начала действия, эффективности, низкой стоимости и минимального влияния на продолжительность приступа. Было показано, что пропофол и тиопентал сокращают продолжительность приступов. Этомидат коррелирует с миоклонусом и увеличением продолжительности припадков.
Припадок, вызванный ЭСТ, должен длиться более 30 секунд. Метогекситал является наиболее часто используемым индуктором из-за его быстрого начала действия, эффективности, низкой стоимости и минимального влияния на продолжительность приступа. Было показано, что пропофол и тиопентал сокращают продолжительность приступов. Этомидат коррелирует с миоклонусом и увеличением продолжительности припадков.
Техника
ЭСТ обычно проводится в специально отведенном отделении, отделении посленаркозного ухода или в амбулаторном хирургическом отделении, чаще всего в амбулаторных условиях. Пациенты с тяжелой инвалидностью, включая серьезное соматическое или психическое заболевание, могут начать лечение в стационаре и перейти на амбулаторное лечение по мере необходимости. Пациенты должны быть соответственно нулевыми per os (NPO) для процедуры, которая включает отказ от легкой пищи в течение шести часов, отказ от жирной пищи в течение восьми часов и отказ от прозрачных жидкостей за два часа до анестезии.
Жизненно важные показатели, включая насыщение крови кислородом, ЭКГ и активность ЭЭГ, записываются непрерывно. ЭМГ регистрируется на правой ноге для измерения двигательного компонента судорожной активности. Стимулятор нервов используется для мониторинга сукцинилхолина, деполяризующего миорелаксанта, используемого для уменьшения тонико-клонических сокращений во время процедуры. В качестве альтернативы ЭМГ на лодыжку пациента надувают манжету для измерения артериального давления, чтобы предотвратить попадание сукцинилхолина в стопу, что позволяет визуально контролировать судорожную активность с измерением тонико-клонических сокращений. После внутривенной индукции устанавливается накусочная пластина для защиты языка и зубов пациента. Начало и окончание церебрального припадка отслеживают с помощью ЭЭГ, регистрируемой в правой и левой лобной и сосцевидной позициях. Индукция припадка осуществляется с помощью двух электродов, расположенных битемпорально, или правого одностороннего электрода; оба из них позволяют электрическому току проходить в кожу головы. Метаанализ 2017 года многочисленных рандомизированных исследований 792 пациента специально сравнивали двустороннюю ЭСТ средней дозы с правосторонней односторонней ЭСТ высокой дозы, и ремиссия была сопоставимой.[14] Односторонняя правосторонняя ЭСТ используется преимущественно для минимизации ретроградной амнезии.
Метаанализ 2017 года многочисленных рандомизированных исследований 792 пациента специально сравнивали двустороннюю ЭСТ средней дозы с правосторонней односторонней ЭСТ высокой дозы, и ремиссия была сопоставимой.[14] Односторонняя правосторонняя ЭСТ используется преимущественно для минимизации ретроградной амнезии.
Стимул ЭСТ представляет собой либо короткий импульс (от 0,5 до 2,0 мс), либо ультракороткий импульс (менее 0,5 мс). В то время как короткий пульс считается стандартным, ультракороткий считается более приемлемым.[15] Доза электричества влияет на эффективность, скорость реакции и неблагоприятные когнитивные эффекты. Порог судорог устанавливается методом проб и ошибок путем постепенного повышения дозы тока во время основного сеанса лечения. После расчета первоначальной дозы доза при последующих сеансах ЭСТ для двусторонней ЭСТ в 1,5–2 раза превышает порог судорожной готовности, а для правосторонней односторонней — в шесть раз превышает порог судорожной готовности. Во время курса лечения ЭСТ порог судорожной готовности обычно повышается по мере того, как у пациента развивается толерантность.
Как и при любой другой процедуре, цель анестезиолога во время ЭСТ состоит в том, чтобы облегчить пациенту безопасный и безболезненный опыт.[18] Преоксигенация пациента через назальную канюлю или лицевую маску сопровождается введением анестетика и параличом. Введение антихолинергических препаратов перед ЭСТ может предотвратить такие аритмии, как брадикардия или асистолия, а также чрезмерное выделение слюны из полости рта. Чтобы вызвать церебральную вазоконстрикцию посредством гипокарбии, пациенту часто проводят гипервентиляцию через маску с мешком перед подачей электрического стимула для увеличения интенсивности припадков [19].] Золотым стандартом для индукции анестезии является метогекситал в дозе от 0,75 до 1 мг/кг.[18] Метогекситал предпочтительнее пропофола, потому что мета-анализ двух рандомизированных исследований показал, что при приеме пропофола продолжительность припадков была короче [20]. Расслабление скелетных мышц во время ЭСТ необходимо для минимизации двигательных припадков и предотвращения травм опорно-двигательного аппарата. Деполяризующий нервно-мышечный релаксант сукцинилхолин используется в дозе от 0,75 до 1 мг/кг с периодом полувыведения 41 секунда.[21][22] В случаях, когда сукцинилхолин противопоказан, включая нервно-мышечное заболевание или травму, ожоговую травму, дефицит псевдохолинэстеразы или гиперкалиемию, предпочтительным вариантом являются недеполяризующие нервно-мышечные релаксанты.
Деполяризующий нервно-мышечный релаксант сукцинилхолин используется в дозе от 0,75 до 1 мг/кг с периодом полувыведения 41 секунда.[21][22] В случаях, когда сукцинилхолин противопоказан, включая нервно-мышечное заболевание или травму, ожоговую травму, дефицит псевдохолинэстеразы или гиперкалиемию, предпочтительным вариантом являются недеполяризующие нервно-мышечные релаксанты.
После того, как пациент потеряет сознание, следует введение миорелаксанта, а также искусственная вентиляция легких 100-процентным кислородом. Нервный стимулятор используется для определения адекватности мышечной релаксации наряду с клинической оценкой подошвенных рефлексов и фасцикуляций в икрах и левой стопе. Надутая манжета для измерения артериального давления предотвращает попадание миорелаксанта в правую стопу. Миорелаксанты не предотвращают сокращение жевательных мышц от электрического импульса, что требует установки прикусной пластины для защиты языка и зубов.
Хотя большинство терапевтических приступов ЭСТ длятся от 15 до 70 секунд, запись ЭЭГ длится примерно на 25 процентов дольше, чем двигательный приступ. [23] Приступы продолжительностью менее 15 секунд могут быть клинически неэффективными, в то время как длительные приступы могут вызвать когнитивные нарушения. Пропущенный или короткий припадок должен сопровождаться коротким периодом гипервентиляции и рестимуляции более высоким электрическим током. Если у пациента наблюдается продолжительный припадок продолжительностью более двух минут, индуцирующие агенты, такие как пропофол или метогекситал, назначают либо в половинной дозе, либо бензодиазепин, чтобы подавить судорожную активность и избежать неврологического повреждения. У пациента с многочисленными пропущенными припадками [24][12] могут быть полезны анестетики для индукции, такие как этомидат или кетамин, поскольку они проявляют меньшее противосудорожное действие по сравнению с метогекситалом. Хотя кофеин ранее вводили для продления припадков, он больше не является рекомендацией из-за его неопределенного профиля безопасности для этой цели.
[23] Приступы продолжительностью менее 15 секунд могут быть клинически неэффективными, в то время как длительные приступы могут вызвать когнитивные нарушения. Пропущенный или короткий припадок должен сопровождаться коротким периодом гипервентиляции и рестимуляции более высоким электрическим током. Если у пациента наблюдается продолжительный припадок продолжительностью более двух минут, индуцирующие агенты, такие как пропофол или метогекситал, назначают либо в половинной дозе, либо бензодиазепин, чтобы подавить судорожную активность и избежать неврологического повреждения. У пациента с многочисленными пропущенными припадками [24][12] могут быть полезны анестетики для индукции, такие как этомидат или кетамин, поскольку они проявляют меньшее противосудорожное действие по сравнению с метогекситалом. Хотя кофеин ранее вводили для продления припадков, он больше не является рекомендацией из-за его неопределенного профиля безопасности для этой цели.
Беременным пациенткам, получающим ЭСТ [25, 26], следует избегать гипервентиляции, поскольку она может уменьшить плацентарный кровоток, вызывая гипоксию плода. Минимизация времени NPO и адекватная внутривенная гидратация жидкости необходимы для предотвращения обезвоживания и преждевременных сокращений матки. У женщин со сроком гестации более 20 недель боковое смещение матки влево необходимо для оптимизации материнского венозного возврата и поддержания оптимального маточного кровотока. При сроке беременности более 24 недель, считающемся жизнеспособным, частота сердечных сокращений плода и активность матки должны подвергаться непрерывному мониторингу за 30 минут до и после каждого лечения акушером, который может оказать неотложную акушерскую и неонатальную помощь. Поскольку беременные пациенты подвержены более высокому риску аспирационного пневмонита из-за состояния полного желудка, следует избегать антихолинергических препаратов, снижающих тонус нижнего пищеводного сфинктера, поскольку они могут усилить рефлюкс [27, 25, 28]. В этом случае антациды, не содержащие частиц, такие как цитрат натрия, более безопасны для профилактики аспирации.
Минимизация времени NPO и адекватная внутривенная гидратация жидкости необходимы для предотвращения обезвоживания и преждевременных сокращений матки. У женщин со сроком гестации более 20 недель боковое смещение матки влево необходимо для оптимизации материнского венозного возврата и поддержания оптимального маточного кровотока. При сроке беременности более 24 недель, считающемся жизнеспособным, частота сердечных сокращений плода и активность матки должны подвергаться непрерывному мониторингу за 30 минут до и после каждого лечения акушером, который может оказать неотложную акушерскую и неонатальную помощь. Поскольку беременные пациенты подвержены более высокому риску аспирационного пневмонита из-за состояния полного желудка, следует избегать антихолинергических препаратов, снижающих тонус нижнего пищеводного сфинктера, поскольку они могут усилить рефлюкс [27, 25, 28]. В этом случае антациды, не содержащие частиц, такие как цитрат натрия, более безопасны для профилактики аспирации.
Осложнения
Двусторонняя или битемпоральная ЭСТ вызывает больше когнитивных нарушений, чем односторонняя ЭСТ, хотя этот эффект носит временный характер. Метаанализ 1415 пациентов с депрессией, получавших ЭСТ, показал, что общее познание, вербальная память и автобиографическая память ухудшались при двустороннем лечении через три дня после лечения [29].
Метаанализ 1415 пациентов с депрессией, получавших ЭСТ, показал, что общее познание, вербальная память и автобиографическая память ухудшались при двустороннем лечении через три дня после лечения [29].
По данным Американской психиатрической ассоциации, пациенты, получающие ЭСТ, подвергаются более высокому риску, если у них есть признаки нестабильного или тяжелого сердечно-сосудистого заболевания, объемное внутричерепное поражение с признаками повышенного внутричерепного давления, история острого мозгового кровоизлияния или инсульта, нестабильная сосудистая аневризма, тяжелое заболевание легких или квалификация Американского общества анестезиологов (ASA) класса 4 или 5.
Физиологически во время тонической фазы припадка возникает 15–20-секундная парасимпатическая разрядка, которая может привести к брадиаритмиям, включая преждевременные сокращения предсердий и желудочков, атриовентрикулярную блокаду и асистолию. Пациенты с субсудорожными припадками имеют более высокий риск развития асистолии [30]. Как это ни парадоксально, у пациентов с блокадой сердца или сопутствующими аритмиями вероятность развития асистолии меньше. Клоническая фаза припадка коррелирует с всплеском катехоламинов, вызывающим тахикардию и гипертензию, которые длятся во времени с длительностью припадка.[31] Артериальная гипертензия и тахикардия проходят в течение 10–20 минут после приступа, хотя у некоторых пациентов наблюдается персистирующая артериальная гипертензия, требующая медицинского вмешательства.
Как это ни парадоксально, у пациентов с блокадой сердца или сопутствующими аритмиями вероятность развития асистолии меньше. Клоническая фаза припадка коррелирует с всплеском катехоламинов, вызывающим тахикардию и гипертензию, которые длятся во времени с длительностью припадка.[31] Артериальная гипертензия и тахикардия проходят в течение 10–20 минут после приступа, хотя у некоторых пациентов наблюдается персистирующая артериальная гипертензия, требующая медицинского вмешательства.
Хотя пациенты с заболеванием сердца на исходном уровне подвергаются более высокому риску после лечения, фракция выброса может уменьшаться после ЭСТ и у здоровых пациентов.[32] В исследовании 53 взрослых, перенесших ЭСТ, у семи развилась новая глобальная систолическая дисфункция левого желудочка (ЛЖ) и у восьми развились региональные нарушения движения стенки. [33] Из этих пациентов не было неблагоприятных исходов у пациентов с дисфункцией ЛЖ. В проспективном когортном исследовании 100 пациентов, перенесших ЭСТ, повышенные уровни сердечных тропонинов были обнаружены у восьми пациентов, и только у двоих были другие признаки ишемии или инфаркта миокарда. [34] Мозговой кровоток и внутричерепное давление увеличиваются при терапии ЭСТ. Клинически у пациентов могут наблюдаться спутанность сознания, делирий, дезориентация и потеря памяти. Согласно рекомендациям AHA-ACC, ЭСТ классифицируется как процедура с низким риском, поскольку она хорошо переносится и демонстрирует только преходящую гемодинамическую лабильность и низкую смертность. [35][36][37]
[34] Мозговой кровоток и внутричерепное давление увеличиваются при терапии ЭСТ. Клинически у пациентов могут наблюдаться спутанность сознания, делирий, дезориентация и потеря памяти. Согласно рекомендациям AHA-ACC, ЭСТ классифицируется как процедура с низким риском, поскольку она хорошо переносится и демонстрирует только преходящую гемодинамическую лабильность и низкую смертность. [35][36][37]
Клиническое значение
ЭСТ — это относительно безопасная процедура с низким уровнем риска, которая помогает при лечении депрессии, суицидальных наклонностей, тяжелого психоза, отказа от еды на фоне депрессии и кататонии. Это требует межпрофессиональной координации помощи между анестезиологами, психиатрами и медсестрами. Большинству пациентов требуется несколько сеансов, чтобы увидеть стойкий эффект. Стигма, связанная с ЭСТ, в значительной степени связана с отсутствием анестезии при раннем лечении, что приводит к серьезным травмам и серьезной потере памяти. Антидепрессивный эффект проявляется относительно быстро и может длиться до нескольких лет. В целом уровень смертности при ЭСТ, проводимой в контролируемых условиях, очень низок, но она продолжает вызывать легкую потерю памяти в долгосрочной перспективе. ЭСТ обычно используется у беременных и пожилых людей, чтобы избежать побочных эффектов психотропных препаратов. Хотя механизм действия многофакторен, ЭСТ вызывает изменения мозгового кровотока и регионарного метаболизма.
В целом уровень смертности при ЭСТ, проводимой в контролируемых условиях, очень низок, но она продолжает вызывать легкую потерю памяти в долгосрочной перспективе. ЭСТ обычно используется у беременных и пожилых людей, чтобы избежать побочных эффектов психотропных препаратов. Хотя механизм действия многофакторен, ЭСТ вызывает изменения мозгового кровотока и регионарного метаболизма.
Улучшение результатов медицинского обслуживания
Сегодня ЭСТ часто используется для лечения различных психических расстройств, помимо депрессии. Процедура относительно безопасна и действительно работает. Однако для проведения ЭСТ требуется межпрофессиональная команда, в которую входят медсестра, анестезиолог, психиатр и невролог. Преимущества ЭСТ видны после нескольких сеансов, а результаты устойчивы. Ключевым моментом является информирование пациента и его семьи об ЭСТ, потому что эта процедура связана со многими ложными и нелогичными убеждениями. Антидепрессивный эффект проявляется относительно быстро и может длиться до нескольких лет. В целом уровень смертности при ЭСТ, проводимой в контролируемых условиях, очень низок, но она продолжает вызывать легкую потерю памяти в долгосрочной перспективе. ЭСТ обычно используется у беременных и пожилых людей, чтобы избежать побочных эффектов психотропных препаратов. Хотя механизм действия многофакторен, ЭСТ вызывает изменения мозгового кровотока и регионарного метаболизма. Большинство пациентов, перенесших ЭСТ, имеют положительный ответ без каких-либо неблагоприятных последствий. [38](Уровень V)
В целом уровень смертности при ЭСТ, проводимой в контролируемых условиях, очень низок, но она продолжает вызывать легкую потерю памяти в долгосрочной перспективе. ЭСТ обычно используется у беременных и пожилых людей, чтобы избежать побочных эффектов психотропных препаратов. Хотя механизм действия многофакторен, ЭСТ вызывает изменения мозгового кровотока и регионарного метаболизма. Большинство пациентов, перенесших ЭСТ, имеют положительный ответ без каких-либо неблагоприятных последствий. [38](Уровень V)
Контрольные вопросы
-
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
-
Комментарий к этой статье.
Ссылки
- 1.
-
Mayberg HS, Lewis PJ, Regenold W, Wagner HN. Паралимбическая гипоперфузия при униполярной депрессии. Дж Нукл Мед. 1994 июнь; 35 (6): 929-34. [PubMed: 8195877]
- 2.
-
Боттерон К.Н., Райхл М.Е., Древец В.К., Хит А.С., Тодд Р.Д. Объемное уменьшение в левой субгенуальной префронтальной коре при ранней депрессии.
 Биол психиатрия. 2002 15 февраля; 51 (4): 342-4. [В паблике: 11958786]
Биол психиатрия. 2002 15 февраля; 51 (4): 342-4. [В паблике: 11958786] - 3.
-
de Kwaasteniet B, Ruhe E, Caan M, Rive M, Olabarriaga S, Groefsema M, Heesink L, van Wingen G, Denys D. Связь между структурной и функциональной связью при большом депрессивном расстройстве. Биол психиатрия. 2013 01 июля; 74 (1): 40-7. [PubMed: 23399372]
- 4.
-
Ригуччи С., Серафини Г., Помпили М., Коцалидис Г.Д., Татарелли Р. Анатомические и функциональные корреляты при большом депрессивном расстройстве: вклад исследований нейровизуализации. Всемирная биологическая психиатрия. 2010 март; 11 (2 часть 2): 165-80. [В паблике: 19670087]
- 5.
-
Американская психиатрическая ассоциация. Целевая группа по электросудорожной терапии. Практика ЭСТ: рекомендации по лечению, обучению и предоставлению привилегий. Судороги Тер. 1990 июнь; 6 (2): 85-120. [PubMed: 11659302]
- 6.
-
Хусейн М.М., Раш А.Дж., Финк М., Кнапп Р.
 , Петридес Г., Румманс Т., Биггс М.М., О’Коннор К., Расмуссен К., Литл М., Чжао В., Бернштейн Х.Дж. , Смит Г., Мюллер М., МакКлинток С.М., Бейлин С.Х., Келлнер Ч.Х. Скорость ответа и ремиссии при большом депрессивном расстройстве с острой электросудорожной терапией (ЭСТ): отчет Консорциума по исследованиям в области ЭСТ (CORE). Дж. Клин Психиатрия. 2004 г., апрель; 65 (4): 485-9.1. [PubMed: 15119910]
, Петридес Г., Румманс Т., Биггс М.М., О’Коннор К., Расмуссен К., Литл М., Чжао В., Бернштейн Х.Дж. , Смит Г., Мюллер М., МакКлинток С.М., Бейлин С.Х., Келлнер Ч.Х. Скорость ответа и ремиссии при большом депрессивном расстройстве с острой электросудорожной терапией (ЭСТ): отчет Консорциума по исследованиям в области ЭСТ (CORE). Дж. Клин Психиатрия. 2004 г., апрель; 65 (4): 485-9.1. [PubMed: 15119910] - 7.
-
Келлнер Ч., Кнапп Р., Хусейн М.М., Расмуссен К., Сэмпсон С., Каллум М., МакКлинток С.М., Тобиас К.Г., Мартино С., Мюллер М., Бейлин С.Х., Финк М. , Петридес Г. Бифронтальное, битемпоральное и правое одностороннее размещение электродов при ЭСТ: рандомизированное исследование. Бр Дж. Психиатрия. 2010 март; 196(3):226-34. [Бесплатная статья PMC: PMC2830057] [PubMed: 20194546]
- 8.
-
Финк М. Показания к применению ЭСТ. Психофармаколь Булл. 1994;30(3):269-75; обсуждение 276-80. [PubMed: 7878176]
- 9.
-
Kellner CH, Fink M, Knapp R, Petrides G, Husain M, Rummans T, Mueller M, Bernstein H, Rasmussen K, O’Connor K, Smith G, Rush AJ , Biggs M, McClintock S, Bailine S, Malur C.
 Облегчение выраженных суицидальных намерений с помощью ЭСТ: консорциум по исследованиям в области ЭСТ. Am J Психиатрия. 2005 май; 162(5):977-82. [Бесплатная статья PMC: PMC3684568] [PubMed: 15863801]
Облегчение выраженных суицидальных намерений с помощью ЭСТ: консорциум по исследованиям в области ЭСТ. Am J Психиатрия. 2005 май; 162(5):977-82. [Бесплатная статья PMC: PMC3684568] [PubMed: 15863801] - 10.
-
Тейлор С. Электросудорожная терапия: обзор анамнеза, отбор пациентов, техника и медикаментозное лечение. South Med J. 2007 Май; 100 (5): 494-8. [PubMed: 17534086]
- 11.
-
Тесс А.В., Сметана Г.В. Медицинское обследование пациентов, подвергающихся электросудорожной терапии. N Engl J Med. 2009 02 апреля; 360 (14): 1437-44. [PubMed: 19339723]
- 12.
-
Devanand DP, Decina P, Sackeim HA, Prudic J. Эпилептический статус после ЭСТ у пациента, получающего теофиллин. J Clin Psychopharmacol. 1988 г., апрель; 8 (2): 153. [PubMed: 3372714]
- 13.
-
Bjølseth TM, Engedal K, Benth JŠ, Dybedal GS, Gaarden TL, Tanum L. Клиническая эффективность основанной на формуле бифронтальной и правосторонней односторонней электросудорожной терапии (ЭСТ) при лечении большая депрессия среди пожилых пациентов: прагматическое, рандомизированное, слепое, контролируемое исследование.
] J Аффективное расстройство. 2015 01 апреля; 175:8-17. [В паблике: 255
J Аффективное расстройство. 2015 01 апреля; 175:8-17. [В паблике: 255 - 14.
-
Колшус Э., Желовац А., Маклафлин Д.М. Битемпоральная и высокодозная правосторонняя односторонняя электросудорожная терапия депрессии: систематический обзор и метаанализ рандомизированных контролируемых исследований. Психомед. 2017 фев; 47 (3): 518-530. [PubMed: 27780482]
- 15.
-
Sienaert P, Spaans HP, Kellner CH. Ширина импульса в электросудорожной терапии: насколько кратка кратка? ЭКСТ. 2018 июнь;34(2):73-74. [PubMed: 29489561]
- 16.
-
Петридес Г., Финк М. Стратегия стимуляции половинного возраста для дозирования ЭСТ. Судороги Тер. 1996 сен; 12 (3): 138-46. [PubMed: 8872401]
- 17.
-
Петридес Г., Брага Р.Дж., Финк М., Мюллер М., Кнапп Р., Хусейн М., Румманс Т., Бейлин С., Малур С., О’Коннор К., Келлнер С., CORE (Консорциум по исследованиям в области ЭСТ) Group. Порог судорожного припадка в большой выборке: последствия для стратегий дозирования стимулов при двусторонней электросудорожной терапии: отчет CORE.
 ЭКСТ. 2009 г.Декабрь; 25 (4): 232-7. [Бесплатная статья PMC: PMC2792571] [PubMed: 19972637]
ЭКСТ. 2009 г.Декабрь; 25 (4): 232-7. [Бесплатная статья PMC: PMC2792571] [PubMed: 19972637] - 18.
-
Bryson EO, Aloysi AS, Farber KG, Kellner CH. Индивидуальное анестезиологическое обеспечение пациентов, подвергающихся электросудорожной терапии: обзор современной практики. Анест Анальг. 2017 июнь; 124 (6): 1943-1956. [PubMed: 28277323]
- 19.
-
Bergsholm P, Gran L, Bleie H. Продолжительность приступа при односторонней электросудорожной терапии. Эффект гипокапнии, индуцированной гипервентиляцией, и эффект вентиляции кислородом. Acta Psychiatr Scand. 1984 февраля; 69(2):121-8. [PubMed: 6422704]
- 20.
-
Lihua P, Su M, Ke W, Ziemann-Gimmel P. Различные схемы внутривенного введения седативных или снотворных средств для электросудорожной терапии (ЭСТ) у взрослых пациентов с депрессией. Cochrane Database Syst Rev. 2014 Apr 11;(4):CD009763. [Статья бесплатно PMC: PMC6464335] [PubMed: 24723301]
- 21.
-
Брайсон Э.
 О., Келлнер К.Х., Ли Э.Х., Алоизи А.С., Майеске М. Чрезвычайная вариабельность дозы сукцинилхолина для мышечной релаксации при электросудорожной терапии. Австралийская психиатрия. 2018 Авг;26(4):391-393. [PubMed: 29504412]
О., Келлнер К.Х., Ли Э.Х., Алоизи А.С., Майеске М. Чрезвычайная вариабельность дозы сукцинилхолина для мышечной релаксации при электросудорожной терапии. Австралийская психиатрия. 2018 Авг;26(4):391-393. [PubMed: 29504412] - 22.
-
Торда Т.А., Грэм Г.Г., Уорик Н.Р., Донохью П. Фармакокинетика и фармакодинамика суксаметония. Интенсивная терапия Анест. 1997 июнь; 25 (3): 272-8. [PubMed: 9209610]
- 23.
-
Майур П.М., Гангадхар Б.Н., Джанакирамайа Н., Суббакришна Д.К. Мониторинг двигательных припадков во время электросудорожной терапии. Бр Дж. Психиатрия. 1999 март; 174: 270-2. [PubMed: 10448455]
- 24.
-
Datto C, Rai AK, Ilivicky HJ, Caroff SN. Увеличение индукции судорог при электросудорожной терапии: клиническая переоценка. ЭКСТ. 2002 г., сен; 18 (3): 118–25. [В паблике: 12394529]
- 25.
-
Миллер Л.Дж. Применение электросудорожной терапии во время беременности. Общественная психиатрия Хосп.
 1994 г., май; 45(5):444-50. [PubMed: 8045538]
1994 г., май; 45(5):444-50. [PubMed: 8045538] - 26.
-
Рабхеру К. Использование электросудорожной терапии у особых групп пациентов. Can J Психиатрия. 2001 г., октябрь; 46 (8): 710-9. [PubMed: 11692973]
- 27.
-
Yonkers KA, Wisner KL, Stowe Z, Leibenluft E, Cohen L, Miller L, Manber R, Viguera A, Suppes T, Altshuler L. Управление биполярным расстройством во время беременности и послеродовой период. Am J Психиатрия. 2004 г., апрель; 161(4):608-20. [В паблике: 15056503]
- 28.
-
Андерсон Э.Л., Рети И.М. ЭСТ при беременности: обзор литературы с 1941 по 2007 год. Psychosom Med. 2009 г., февраль; 71 (2): 235–42. [PubMed: 151]
- 29.
-
Семковска М., Кин Д., Бабалола О., Маклафлин Д.М. Односторонняя короткоимпульсная электросудорожная терапия и познание: эффекты размещения электродов, дозировка стимула и время. J Psychiatr Res. 2011 июнь; 45 (6): 770-80. [PubMed: 21109254]
- 30.

-
Кауфман К.Р. Асистолия при электросудорожной терапии. J Интерн Мед. 1994 марта; 235 (3): 275-7. [PubMed: 8120525]
- 31.
-
Ларсон Г., Шварц С., Абрамс Р. Продолжительность тахикардии, вызванной ЭСТ, как мера продолжительности приступа. Am J Психиатрия. 1984 г., октябрь; 141 (10): 1269-71. [PubMed: 6486265]
- 32.
-
Fuenmayor AJ, el Fakih Y, Moreno J, Fuenmayor AM. Влияние электросудорожной терапии на сердечную функцию у пациентов без сердечных заболеваний. Кардиология. 1997 г., май-июнь; 88(3):254-7. [PubMed: 46]
- 33.
-
Маккалли Р.Б., Карон Б.Л., Румманс Т.А., Блэк Дж.Л., Андрин К.М., О Дж.К., Сьюард Дж.Б., Таджик А.Дж. Частота дисфункции левого желудочка после электросудорожной терапии. Ам Джей Кардиол. 2003 г. 01 мая; 91 (9): 1147-50. [PubMed: 12714169]
- 34.
-
Дума А., Пал С., Джонстон Дж., Хельвани М.А., Бхат А., Гилл Б., Розенквист Дж., Картмилл С., Браун Ф.
 , Миллер Дж.П., Скотт М.Г., Санчес-Конде Ф. , Джарвис М., Фарбер Н.Б., Зорумски С.Ф., Конвей С., Нагеле П. Повышение уровня высокочувствительного сердечного тропонина после электросудорожной терапии: проспективное обсервационное когортное исследование. Анестезиология. 2017 Апрель; 126 (4): 643-652. [Бесплатная статья PMC: PMC5350051] [PubMed: 28166110]
, Миллер Дж.П., Скотт М.Г., Санчес-Конде Ф. , Джарвис М., Фарбер Н.Б., Зорумски С.Ф., Конвей С., Нагеле П. Повышение уровня высокочувствительного сердечного тропонина после электросудорожной терапии: проспективное обсервационное когортное исследование. Анестезиология. 2017 Апрель; 126 (4): 643-652. [Бесплатная статья PMC: PMC5350051] [PubMed: 28166110] - 35.
-
Зелински Р.Дж., Руз С.П., Девананд Д.П., Вудринг С., Сакейм Х.А. Сердечно-сосудистые осложнения ЭСТ у пациентов с депрессией и сердечными заболеваниями. Am J Психиатрия. 1993 г., июнь; 150 (6): 904-9. [PubMed: 8494067]
- 36.
-
Райс Э.Х., Сомбротто Л.Б., Марковиц Дж.К., Леон А.С. Сердечно-сосудистые заболевания у пациентов с высоким риском во время ЭСТ. Am J Психиатрия. 1994 ноябрь; 151(11):1637-41. [PubMed: 7943453]
- 37.
-
Абрамс Р. Смертность при ЭСТ. Судороги Тер. 1997 сент.; 13(3):125-7. [PubMed: 9342128]
- 38.
-
Бенсон Н.
 М., Сейнер С.Дж., Болтон П., Фицморис Г., Мейснер Р.К., Пирс С., Буш А.Б. Результаты лечения острой фазы электросудорожной терапии у подростков и молодых людей. ЭКСТ. 2019 сен; 35 (3): 178-183. [Бесплатная статья PMC: PMC6581623] [PubMed: 30562200]
М., Сейнер С.Дж., Болтон П., Фицморис Г., Мейснер Р.К., Пирс С., Буш А.Б. Результаты лечения острой фазы электросудорожной терапии у подростков и молодых людей. ЭКСТ. 2019 сен; 35 (3): 178-183. [Бесплатная статья PMC: PMC6581623] [PubMed: 30562200]
Электросудорожная терапия — StatPearls — NCBI Bookshelf
Continuing Education Activity
У пациента, находящегося под внутривенной седацией или общей анестезией, электросудорожная терапия (для ЭСТ) вызвать генерализованный мозговой припадок. Хотя он в основном используется для лечения пациентов с тяжелой депрессией, он также может принести пользу пациентам с шизофренией, шизоаффективным расстройством, кататонией, злокачественным нейролептическим синдромом и биполярным расстройством. В этом задании описываются показания, противопоказания и осложнения ЭСТ, а также подчеркивается роль межпрофессиональной команды в лечении пациентов с психическими расстройствами.
Цели:
-
Объясните, как действует электрошоковая терапия.

-
Обсудите возможные применения электрошоковой терапии.
-
Рассмотреть дезинформацию, связанную с электрошоковой терапией.
-
Опишите электрошоковую терапию и рассмотрите роль межпрофессиональной бригады в лечении пациентов, перенесших ЭСТ.
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Введение
У пациента, находящегося под внутривенной седацией или общей анестезией, электросудорожная терапия (ЭСТ) использует электрический ток для создания генерализованного церебрального приступа. Хотя он в основном используется для лечения пациентов с тяжелой депрессией, он также может принести пользу пациентам с шизофренией, шизоаффективным расстройством, кататонией, злокачественным нейролептическим синдромом и биполярным расстройством. Однако к этой практике приковано клеймо из-за дезинформации о процедурной методологии.
Анатомия и физиология
У пациентов с тяжелой депрессией обнаруживаются различные патофизиологические изменения в областях мозга. К ним относятся снижение активности и объемные сокращения в дорсальных областях лобных долей. Области вентральной и орбитальной лобной коры изменили обработку эмоциональных стимулов. В дополнение к лобной доле, функциональные изменения и уменьшение объема очевидны в гиппокампе, парагиппокампальных извилинах и миндалевидном теле. Ось гипоталамо-гипофизарно-надпочечниковая (ГГН) становится гиперчувствительной к стрессорам, проявляет хронически повышенный уровень гормонов стресса и нарушение регуляции обратной связи. [3] Мезокортиколимбическая дофаминовая система, а также ось HPA активируются у пациентов со стрессом. Считается, что функция дофамина нарушена у пациентов с депрессией, вызывая нарушение основных функций, включая концентрацию, мотивацию и получение удовольствия.[4] Антидепрессивные эффекты ЭСТ отражают изменения в упомянутых выше системах.
К ним относятся снижение активности и объемные сокращения в дорсальных областях лобных долей. Области вентральной и орбитальной лобной коры изменили обработку эмоциональных стимулов. В дополнение к лобной доле, функциональные изменения и уменьшение объема очевидны в гиппокампе, парагиппокампальных извилинах и миндалевидном теле. Ось гипоталамо-гипофизарно-надпочечниковая (ГГН) становится гиперчувствительной к стрессорам, проявляет хронически повышенный уровень гормонов стресса и нарушение регуляции обратной связи. [3] Мезокортиколимбическая дофаминовая система, а также ось HPA активируются у пациентов со стрессом. Считается, что функция дофамина нарушена у пациентов с депрессией, вызывая нарушение основных функций, включая концентрацию, мотивацию и получение удовольствия.[4] Антидепрессивные эффекты ЭСТ отражают изменения в упомянутых выше системах.
Показания
ЭСТ показана пациентам с резистентной к терапии депрессией или тяжелой большой депрессией, нарушающей повседневную деятельность. Определение резистентной к лечению депрессии — это депрессия, не поддающаяся многочисленным испытаниям антидепрессантов.[5] Есть также предложения использовать ЭСТ для лечения суицидальных наклонностей, тяжелого психоза, отказа от еды, вторичного по отношению к депрессии, и кататонии.[6][7] Пациенты с биполярной депрессией и манией также могут получать лечение с помощью ЭСТ.[8] ЭСТ может иметь более безопасный профиль, чем антидепрессанты или нейролептики, у ослабленных, пожилых, беременных и кормящих пациентов. Суицидальные мысли быстро исчезают после ЭСТ, и полное разрешение наблюдалось у 38% пациентов через одну неделю, у 61% пациентов через две недели и у 81% пациентов после завершения ЭСТ [9].] ЭСТ также рекомендуется пациентам, у которых ранее наблюдался благоприятный ответ на ЭСТ.
Определение резистентной к лечению депрессии — это депрессия, не поддающаяся многочисленным испытаниям антидепрессантов.[5] Есть также предложения использовать ЭСТ для лечения суицидальных наклонностей, тяжелого психоза, отказа от еды, вторичного по отношению к депрессии, и кататонии.[6][7] Пациенты с биполярной депрессией и манией также могут получать лечение с помощью ЭСТ.[8] ЭСТ может иметь более безопасный профиль, чем антидепрессанты или нейролептики, у ослабленных, пожилых, беременных и кормящих пациентов. Суицидальные мысли быстро исчезают после ЭСТ, и полное разрешение наблюдалось у 38% пациентов через одну неделю, у 61% пациентов через две недели и у 81% пациентов после завершения ЭСТ [9].] ЭСТ также рекомендуется пациентам, у которых ранее наблюдался благоприятный ответ на ЭСТ.
Противопоказания
Возникший в результате ЭСТ припадок может вызвать временное повышение артериального давления, потребления кислорода миокардом, частоты сердечных сокращений и внутричерепного давления. Необходим уход за пациентами с сердечно-сосудистой, легочной или центральной нервной системой. Феохромоцитома и повышенное внутричерепное давление с масс-эффектом являются абсолютными противопоказаниями к ЭСТ. Относительные противопоказания включают повышенное внутричерепное давление без масс-эффекта, дефекты сердечно-сосудистой проводимости, беременность с высоким риском, аневризмы аорты и головного мозга [10].
Необходим уход за пациентами с сердечно-сосудистой, легочной или центральной нервной системой. Феохромоцитома и повышенное внутричерепное давление с масс-эффектом являются абсолютными противопоказаниями к ЭСТ. Относительные противопоказания включают повышенное внутричерепное давление без масс-эффекта, дефекты сердечно-сосудистой проводимости, беременность с высоким риском, аневризмы аорты и головного мозга [10].
Оборудование
Зоны лечения и восстановления ЭСТ должны включать стандартные мониторы Американского общества анестезиологов (ASA). Должны присутствовать стетоскоп, монитор артериального давления, монитор электрокардиографии (ЭКГ), пульсоксиметр, аспиратор и система доставки кислорода. Должны быть доступны средства для индукции анестезии и лекарства, а также оборудование для искусственной вентиляции легких и реанимации. Должны быть в наличии назальная канюля или лицевая маска для подачи дополнительного кислорода, маска с клапаном мешка, нейростимулятор для оценки нервно-мышечной блокады, электроды для электромиографа (ЭМГ), электроэнцефалографии (ЭЭГ) и несколько манжет для измерения артериального давления.
Персонал
ЭСТ проводится бригадой, в которую обычно входят анестезиолог, психиатр и медсестра.
Подготовка
Полный анамнез и физикальное обследование могут выявить значительные факторы риска, включая сердечную ишемию или аритмию, сердечную недостаточность или внутричерепную патологию.[11] В анамнезе также следует учитывать использование растительных препаратов, таких как гинкго билоба, женьшень, зверобой, валериана и кава, которые могут мешать ЭСТ. Существует риск развития эпилептического статуса у пациентов, получающих теофиллин.[12] Внутривенные бета-блокаторы короткого действия могут снижать гипертензию и тахикардию, связанные с ЭСТ, но также могут сокращать продолжительность приступов и снижать эффективность ЭСТ. Кардиологические препараты, включая аспирин, статины, антигипертензивные препараты, антиангинальные препараты и клопидогрел, следует продолжать принимать в день процедуры. Уровни глюкозы в сыворотке требуют проверки как до операции, так и в послеоперационной палате, поскольку лечение ЭСТ может повышать уровень глюкозы в крови. Хотя ЭСТ кажется безопасной для пациента с дефибриллятором, режим детекции следует отключить во время процедуры, а оборудование для наружной дефибрилляции должно быть доступно у постели пациента. У беременных рекомендуется неинвазивный мониторинг плода после 14-16 недель и нестрессовый тест с токометром после 24 недель.
Хотя ЭСТ кажется безопасной для пациента с дефибриллятором, режим детекции следует отключить во время процедуры, а оборудование для наружной дефибрилляции должно быть доступно у постели пациента. У беременных рекомендуется неинвазивный мониторинг плода после 14-16 недель и нестрессовый тест с токометром после 24 недель.
ЭСТ использует общую анестезию. Используемые препараты для индукции анестезии включают барбитураты, такие как тиопентал и метогекситал, и небарбитураты, такие как пропофол и этомидат. Припадок, вызванный ЭСТ, должен длиться более 30 секунд. Метогекситал является наиболее часто используемым индуктором из-за его быстрого начала действия, эффективности, низкой стоимости и минимального влияния на продолжительность приступа. Было показано, что пропофол и тиопентал сокращают продолжительность приступов. Этомидат коррелирует с миоклонусом и увеличением продолжительности припадков.
Техника
ЭСТ обычно проводится в специально отведенном отделении, отделении посленаркозного ухода или в амбулаторном хирургическом отделении, чаще всего в амбулаторных условиях. Пациенты с тяжелой инвалидностью, включая серьезное соматическое или психическое заболевание, могут начать лечение в стационаре и перейти на амбулаторное лечение по мере необходимости. Пациенты должны быть соответственно нулевыми per os (NPO) для процедуры, которая включает отказ от легкой пищи в течение шести часов, отказ от жирной пищи в течение восьми часов и отказ от прозрачных жидкостей за два часа до анестезии.
Пациенты с тяжелой инвалидностью, включая серьезное соматическое или психическое заболевание, могут начать лечение в стационаре и перейти на амбулаторное лечение по мере необходимости. Пациенты должны быть соответственно нулевыми per os (NPO) для процедуры, которая включает отказ от легкой пищи в течение шести часов, отказ от жирной пищи в течение восьми часов и отказ от прозрачных жидкостей за два часа до анестезии.
Жизненно важные показатели, включая насыщение крови кислородом, ЭКГ и активность ЭЭГ, записываются непрерывно. ЭМГ регистрируется на правой ноге для измерения двигательного компонента судорожной активности. Стимулятор нервов используется для мониторинга сукцинилхолина, деполяризующего миорелаксанта, используемого для уменьшения тонико-клонических сокращений во время процедуры. В качестве альтернативы ЭМГ на лодыжку пациента надувают манжету для измерения артериального давления, чтобы предотвратить попадание сукцинилхолина в стопу, что позволяет визуально контролировать судорожную активность с измерением тонико-клонических сокращений. После внутривенной индукции устанавливается накусочная пластина для защиты языка и зубов пациента. Начало и окончание церебрального припадка отслеживают с помощью ЭЭГ, регистрируемой в правой и левой лобной и сосцевидной позициях. Индукция припадка осуществляется с помощью двух электродов, расположенных битемпорально, или правого одностороннего электрода; оба из них позволяют электрическому току проходить в кожу головы. Метаанализ 2017 года многочисленных рандомизированных исследований 792 пациента специально сравнивали двустороннюю ЭСТ средней дозы с правосторонней односторонней ЭСТ высокой дозы, и ремиссия была сопоставимой.[14] Односторонняя правосторонняя ЭСТ используется преимущественно для минимизации ретроградной амнезии.
После внутривенной индукции устанавливается накусочная пластина для защиты языка и зубов пациента. Начало и окончание церебрального припадка отслеживают с помощью ЭЭГ, регистрируемой в правой и левой лобной и сосцевидной позициях. Индукция припадка осуществляется с помощью двух электродов, расположенных битемпорально, или правого одностороннего электрода; оба из них позволяют электрическому току проходить в кожу головы. Метаанализ 2017 года многочисленных рандомизированных исследований 792 пациента специально сравнивали двустороннюю ЭСТ средней дозы с правосторонней односторонней ЭСТ высокой дозы, и ремиссия была сопоставимой.[14] Односторонняя правосторонняя ЭСТ используется преимущественно для минимизации ретроградной амнезии.
Стимул ЭСТ представляет собой либо короткий импульс (от 0,5 до 2,0 мс), либо ультракороткий импульс (менее 0,5 мс). В то время как короткий пульс считается стандартным, ультракороткий считается более приемлемым.[15] Доза электричества влияет на эффективность, скорость реакции и неблагоприятные когнитивные эффекты. Порог судорог устанавливается методом проб и ошибок путем постепенного повышения дозы тока во время основного сеанса лечения. После расчета первоначальной дозы доза при последующих сеансах ЭСТ для двусторонней ЭСТ в 1,5–2 раза превышает порог судорожной готовности, а для правосторонней односторонней — в шесть раз превышает порог судорожной готовности. Во время курса лечения ЭСТ порог судорожной готовности обычно повышается по мере того, как у пациента развивается толерантность.
Порог судорог устанавливается методом проб и ошибок путем постепенного повышения дозы тока во время основного сеанса лечения. После расчета первоначальной дозы доза при последующих сеансах ЭСТ для двусторонней ЭСТ в 1,5–2 раза превышает порог судорожной готовности, а для правосторонней односторонней — в шесть раз превышает порог судорожной готовности. Во время курса лечения ЭСТ порог судорожной готовности обычно повышается по мере того, как у пациента развивается толерантность.
Как и при любой другой процедуре, цель анестезиолога во время ЭСТ состоит в том, чтобы облегчить пациенту безопасный и безболезненный опыт.[18] Преоксигенация пациента через назальную канюлю или лицевую маску сопровождается введением анестетика и параличом. Введение антихолинергических препаратов перед ЭСТ может предотвратить такие аритмии, как брадикардия или асистолия, а также чрезмерное выделение слюны из полости рта. Чтобы вызвать церебральную вазоконстрикцию посредством гипокарбии, пациенту часто проводят гипервентиляцию через маску с мешком перед подачей электрического стимула для увеличения интенсивности припадков [19]. ] Золотым стандартом для индукции анестезии является метогекситал в дозе от 0,75 до 1 мг/кг.[18] Метогекситал предпочтительнее пропофола, потому что мета-анализ двух рандомизированных исследований показал, что при приеме пропофола продолжительность припадков была короче [20]. Расслабление скелетных мышц во время ЭСТ необходимо для минимизации двигательных припадков и предотвращения травм опорно-двигательного аппарата. Деполяризующий нервно-мышечный релаксант сукцинилхолин используется в дозе от 0,75 до 1 мг/кг с периодом полувыведения 41 секунда.[21][22] В случаях, когда сукцинилхолин противопоказан, включая нервно-мышечное заболевание или травму, ожоговую травму, дефицит псевдохолинэстеразы или гиперкалиемию, предпочтительным вариантом являются недеполяризующие нервно-мышечные релаксанты.
] Золотым стандартом для индукции анестезии является метогекситал в дозе от 0,75 до 1 мг/кг.[18] Метогекситал предпочтительнее пропофола, потому что мета-анализ двух рандомизированных исследований показал, что при приеме пропофола продолжительность припадков была короче [20]. Расслабление скелетных мышц во время ЭСТ необходимо для минимизации двигательных припадков и предотвращения травм опорно-двигательного аппарата. Деполяризующий нервно-мышечный релаксант сукцинилхолин используется в дозе от 0,75 до 1 мг/кг с периодом полувыведения 41 секунда.[21][22] В случаях, когда сукцинилхолин противопоказан, включая нервно-мышечное заболевание или травму, ожоговую травму, дефицит псевдохолинэстеразы или гиперкалиемию, предпочтительным вариантом являются недеполяризующие нервно-мышечные релаксанты.
После того, как пациент потеряет сознание, следует введение миорелаксанта, а также искусственная вентиляция легких 100-процентным кислородом. Нервный стимулятор используется для определения адекватности мышечной релаксации наряду с клинической оценкой подошвенных рефлексов и фасцикуляций в икрах и левой стопе. Надутая манжета для измерения артериального давления предотвращает попадание миорелаксанта в правую стопу. Миорелаксанты не предотвращают сокращение жевательных мышц от электрического импульса, что требует установки прикусной пластины для защиты языка и зубов.
Надутая манжета для измерения артериального давления предотвращает попадание миорелаксанта в правую стопу. Миорелаксанты не предотвращают сокращение жевательных мышц от электрического импульса, что требует установки прикусной пластины для защиты языка и зубов.
Хотя большинство терапевтических приступов ЭСТ длятся от 15 до 70 секунд, запись ЭЭГ длится примерно на 25 процентов дольше, чем двигательный приступ.[23] Приступы продолжительностью менее 15 секунд могут быть клинически неэффективными, в то время как длительные приступы могут вызвать когнитивные нарушения. Пропущенный или короткий припадок должен сопровождаться коротким периодом гипервентиляции и рестимуляции более высоким электрическим током. Если у пациента наблюдается продолжительный припадок продолжительностью более двух минут, индуцирующие агенты, такие как пропофол или метогекситал, назначают либо в половинной дозе, либо бензодиазепин, чтобы подавить судорожную активность и избежать неврологического повреждения. У пациента с многочисленными пропущенными припадками [24][12] могут быть полезны анестетики для индукции, такие как этомидат или кетамин, поскольку они проявляют меньшее противосудорожное действие по сравнению с метогекситалом. Хотя кофеин ранее вводили для продления припадков, он больше не является рекомендацией из-за его неопределенного профиля безопасности для этой цели.
Хотя кофеин ранее вводили для продления припадков, он больше не является рекомендацией из-за его неопределенного профиля безопасности для этой цели.
Беременным пациенткам, получающим ЭСТ [25, 26], следует избегать гипервентиляции, поскольку она может уменьшить плацентарный кровоток, вызывая гипоксию плода. Минимизация времени NPO и адекватная внутривенная гидратация жидкости необходимы для предотвращения обезвоживания и преждевременных сокращений матки. У женщин со сроком гестации более 20 недель боковое смещение матки влево необходимо для оптимизации материнского венозного возврата и поддержания оптимального маточного кровотока. При сроке беременности более 24 недель, считающемся жизнеспособным, частота сердечных сокращений плода и активность матки должны подвергаться непрерывному мониторингу за 30 минут до и после каждого лечения акушером, который может оказать неотложную акушерскую и неонатальную помощь. Поскольку беременные пациенты подвержены более высокому риску аспирационного пневмонита из-за состояния полного желудка, следует избегать антихолинергических препаратов, снижающих тонус нижнего пищеводного сфинктера, поскольку они могут усилить рефлюкс [27, 25, 28]. В этом случае антациды, не содержащие частиц, такие как цитрат натрия, более безопасны для профилактики аспирации.
В этом случае антациды, не содержащие частиц, такие как цитрат натрия, более безопасны для профилактики аспирации.
Осложнения
Двусторонняя или битемпоральная ЭСТ вызывает больше когнитивных нарушений, чем односторонняя ЭСТ, хотя этот эффект носит временный характер. Метаанализ 1415 пациентов с депрессией, получавших ЭСТ, показал, что общее познание, вербальная память и автобиографическая память ухудшались при двустороннем лечении через три дня после лечения [29].
По данным Американской психиатрической ассоциации, пациенты, получающие ЭСТ, подвергаются более высокому риску, если у них есть признаки нестабильного или тяжелого сердечно-сосудистого заболевания, объемное внутричерепное поражение с признаками повышенного внутричерепного давления, история острого мозгового кровоизлияния или инсульта, нестабильная сосудистая аневризма, тяжелое заболевание легких или квалификация Американского общества анестезиологов (ASA) класса 4 или 5.
Физиологически во время тонической фазы припадка возникает 15–20-секундная парасимпатическая разрядка, которая может привести к брадиаритмиям, включая преждевременные сокращения предсердий и желудочков, атриовентрикулярную блокаду и асистолию. Пациенты с субсудорожными припадками имеют более высокий риск развития асистолии [30]. Как это ни парадоксально, у пациентов с блокадой сердца или сопутствующими аритмиями вероятность развития асистолии меньше. Клоническая фаза припадка коррелирует с всплеском катехоламинов, вызывающим тахикардию и гипертензию, которые длятся во времени с длительностью припадка.[31] Артериальная гипертензия и тахикардия проходят в течение 10–20 минут после приступа, хотя у некоторых пациентов наблюдается персистирующая артериальная гипертензия, требующая медицинского вмешательства.
Пациенты с субсудорожными припадками имеют более высокий риск развития асистолии [30]. Как это ни парадоксально, у пациентов с блокадой сердца или сопутствующими аритмиями вероятность развития асистолии меньше. Клоническая фаза припадка коррелирует с всплеском катехоламинов, вызывающим тахикардию и гипертензию, которые длятся во времени с длительностью припадка.[31] Артериальная гипертензия и тахикардия проходят в течение 10–20 минут после приступа, хотя у некоторых пациентов наблюдается персистирующая артериальная гипертензия, требующая медицинского вмешательства.
Хотя пациенты с заболеванием сердца на исходном уровне подвергаются более высокому риску после лечения, фракция выброса может уменьшаться после ЭСТ и у здоровых пациентов.[32] В исследовании 53 взрослых, перенесших ЭСТ, у семи развилась новая глобальная систолическая дисфункция левого желудочка (ЛЖ) и у восьми развились региональные нарушения движения стенки. [33] Из этих пациентов не было неблагоприятных исходов у пациентов с дисфункцией ЛЖ. В проспективном когортном исследовании 100 пациентов, перенесших ЭСТ, повышенные уровни сердечных тропонинов были обнаружены у восьми пациентов, и только у двоих были другие признаки ишемии или инфаркта миокарда. [34] Мозговой кровоток и внутричерепное давление увеличиваются при терапии ЭСТ. Клинически у пациентов могут наблюдаться спутанность сознания, делирий, дезориентация и потеря памяти. Согласно рекомендациям AHA-ACC, ЭСТ классифицируется как процедура с низким риском, поскольку она хорошо переносится и демонстрирует только преходящую гемодинамическую лабильность и низкую смертность. [35][36][37]
В проспективном когортном исследовании 100 пациентов, перенесших ЭСТ, повышенные уровни сердечных тропонинов были обнаружены у восьми пациентов, и только у двоих были другие признаки ишемии или инфаркта миокарда. [34] Мозговой кровоток и внутричерепное давление увеличиваются при терапии ЭСТ. Клинически у пациентов могут наблюдаться спутанность сознания, делирий, дезориентация и потеря памяти. Согласно рекомендациям AHA-ACC, ЭСТ классифицируется как процедура с низким риском, поскольку она хорошо переносится и демонстрирует только преходящую гемодинамическую лабильность и низкую смертность. [35][36][37]
Клиническое значение
ЭСТ — это относительно безопасная процедура с низким уровнем риска, которая помогает при лечении депрессии, суицидальных наклонностей, тяжелого психоза, отказа от еды на фоне депрессии и кататонии. Это требует межпрофессиональной координации помощи между анестезиологами, психиатрами и медсестрами. Большинству пациентов требуется несколько сеансов, чтобы увидеть стойкий эффект. Стигма, связанная с ЭСТ, в значительной степени связана с отсутствием анестезии при раннем лечении, что приводит к серьезным травмам и серьезной потере памяти. Антидепрессивный эффект проявляется относительно быстро и может длиться до нескольких лет. В целом уровень смертности при ЭСТ, проводимой в контролируемых условиях, очень низок, но она продолжает вызывать легкую потерю памяти в долгосрочной перспективе. ЭСТ обычно используется у беременных и пожилых людей, чтобы избежать побочных эффектов психотропных препаратов. Хотя механизм действия многофакторен, ЭСТ вызывает изменения мозгового кровотока и регионарного метаболизма.
Стигма, связанная с ЭСТ, в значительной степени связана с отсутствием анестезии при раннем лечении, что приводит к серьезным травмам и серьезной потере памяти. Антидепрессивный эффект проявляется относительно быстро и может длиться до нескольких лет. В целом уровень смертности при ЭСТ, проводимой в контролируемых условиях, очень низок, но она продолжает вызывать легкую потерю памяти в долгосрочной перспективе. ЭСТ обычно используется у беременных и пожилых людей, чтобы избежать побочных эффектов психотропных препаратов. Хотя механизм действия многофакторен, ЭСТ вызывает изменения мозгового кровотока и регионарного метаболизма.
Улучшение результатов медицинского обслуживания
Сегодня ЭСТ часто используется для лечения различных психических расстройств, помимо депрессии. Процедура относительно безопасна и действительно работает. Однако для проведения ЭСТ требуется межпрофессиональная команда, в которую входят медсестра, анестезиолог, психиатр и невролог. Преимущества ЭСТ видны после нескольких сеансов, а результаты устойчивы. Ключевым моментом является информирование пациента и его семьи об ЭСТ, потому что эта процедура связана со многими ложными и нелогичными убеждениями. Антидепрессивный эффект проявляется относительно быстро и может длиться до нескольких лет. В целом уровень смертности при ЭСТ, проводимой в контролируемых условиях, очень низок, но она продолжает вызывать легкую потерю памяти в долгосрочной перспективе. ЭСТ обычно используется у беременных и пожилых людей, чтобы избежать побочных эффектов психотропных препаратов. Хотя механизм действия многофакторен, ЭСТ вызывает изменения мозгового кровотока и регионарного метаболизма. Большинство пациентов, перенесших ЭСТ, имеют положительный ответ без каких-либо неблагоприятных последствий. [38](Уровень V)
Ключевым моментом является информирование пациента и его семьи об ЭСТ, потому что эта процедура связана со многими ложными и нелогичными убеждениями. Антидепрессивный эффект проявляется относительно быстро и может длиться до нескольких лет. В целом уровень смертности при ЭСТ, проводимой в контролируемых условиях, очень низок, но она продолжает вызывать легкую потерю памяти в долгосрочной перспективе. ЭСТ обычно используется у беременных и пожилых людей, чтобы избежать побочных эффектов психотропных препаратов. Хотя механизм действия многофакторен, ЭСТ вызывает изменения мозгового кровотока и регионарного метаболизма. Большинство пациентов, перенесших ЭСТ, имеют положительный ответ без каких-либо неблагоприятных последствий. [38](Уровень V)
Контрольные вопросы
-
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
-
Комментарий к этой статье.
Ссылки
- 1.
-
Mayberg HS, Lewis PJ, Regenold W, Wagner HN.
 Паралимбическая гипоперфузия при униполярной депрессии. Дж Нукл Мед. 1994 июнь; 35 (6): 929-34. [PubMed: 8195877]
Паралимбическая гипоперфузия при униполярной депрессии. Дж Нукл Мед. 1994 июнь; 35 (6): 929-34. [PubMed: 8195877] - 2.
-
Боттерон К.Н., Райхл М.Е., Древец В.К., Хит А.С., Тодд Р.Д. Объемное уменьшение в левой субгенуальной префронтальной коре при ранней депрессии. Биол психиатрия. 2002 15 февраля; 51 (4): 342-4. [В паблике: 11958786]
- 3.
-
de Kwaasteniet B, Ruhe E, Caan M, Rive M, Olabarriaga S, Groefsema M, Heesink L, van Wingen G, Denys D. Связь между структурной и функциональной связью при большом депрессивном расстройстве. Биол психиатрия. 2013 01 июля; 74 (1): 40-7. [PubMed: 23399372]
- 4.
-
Ригуччи С., Серафини Г., Помпили М., Коцалидис Г.Д., Татарелли Р. Анатомические и функциональные корреляты при большом депрессивном расстройстве: вклад исследований нейровизуализации. Всемирная биологическая психиатрия. 2010 март; 11 (2 часть 2): 165-80. [В паблике: 19670087]
- 5.
-
Американская психиатрическая ассоциация.
 Целевая группа по электросудорожной терапии. Практика ЭСТ: рекомендации по лечению, обучению и предоставлению привилегий. Судороги Тер. 1990 июнь; 6 (2): 85-120. [PubMed: 11659302]
Целевая группа по электросудорожной терапии. Практика ЭСТ: рекомендации по лечению, обучению и предоставлению привилегий. Судороги Тер. 1990 июнь; 6 (2): 85-120. [PubMed: 11659302] - 6.
-
Хусейн М.М., Раш А.Дж., Финк М., Кнапп Р., Петридес Г., Румманс Т., Биггс М.М., О’Коннор К., Расмуссен К., Литл М., Чжао В., Бернштейн Х.Дж. , Смит Г., Мюллер М., МакКлинток С.М., Бейлин С.Х., Келлнер Ч.Х. Скорость ответа и ремиссии при большом депрессивном расстройстве с острой электросудорожной терапией (ЭСТ): отчет Консорциума по исследованиям в области ЭСТ (CORE). Дж. Клин Психиатрия. 2004 г., апрель; 65 (4): 485-9.1. [PubMed: 15119910]
- 7.
-
Келлнер Ч., Кнапп Р., Хусейн М.М., Расмуссен К., Сэмпсон С., Каллум М., МакКлинток С.М., Тобиас К.Г., Мартино С., Мюллер М., Бейлин С.Х., Финк М. , Петридес Г. Бифронтальное, битемпоральное и правое одностороннее размещение электродов при ЭСТ: рандомизированное исследование. Бр Дж. Психиатрия. 2010 март; 196(3):226-34.
 [Бесплатная статья PMC: PMC2830057] [PubMed: 20194546]
[Бесплатная статья PMC: PMC2830057] [PubMed: 20194546] - 8.
-
Финк М. Показания к применению ЭСТ. Психофармаколь Булл. 1994;30(3):269-75; обсуждение 276-80. [PubMed: 7878176]
- 9.
-
Kellner CH, Fink M, Knapp R, Petrides G, Husain M, Rummans T, Mueller M, Bernstein H, Rasmussen K, O’Connor K, Smith G, Rush AJ , Biggs M, McClintock S, Bailine S, Malur C. Облегчение выраженных суицидальных намерений с помощью ЭСТ: консорциум по исследованиям в области ЭСТ. Am J Психиатрия. 2005 май; 162(5):977-82. [Бесплатная статья PMC: PMC3684568] [PubMed: 15863801]
- 10.
-
Тейлор С. Электросудорожная терапия: обзор анамнеза, отбор пациентов, техника и медикаментозное лечение. South Med J. 2007 Май; 100 (5): 494-8. [PubMed: 17534086]
- 11.
-
Тесс А.В., Сметана Г.В. Медицинское обследование пациентов, подвергающихся электросудорожной терапии. N Engl J Med. 2009 02 апреля; 360 (14): 1437-44. [PubMed: 19339723]
- 12.

-
Devanand DP, Decina P, Sackeim HA, Prudic J. Эпилептический статус после ЭСТ у пациента, получающего теофиллин. J Clin Psychopharmacol. 1988 г., апрель; 8 (2): 153. [PubMed: 3372714]
- 13.
-
Bjølseth TM, Engedal K, Benth JŠ, Dybedal GS, Gaarden TL, Tanum L. Клиническая эффективность основанной на формуле бифронтальной и правосторонней односторонней электросудорожной терапии (ЭСТ) при лечении большая депрессия среди пожилых пациентов: прагматическое, рандомизированное, слепое, контролируемое исследование. J Аффективное расстройство. 2015 01 апреля; 175:8-17. [В паблике: 255
] - 14.
-
Колшус Э., Желовац А., Маклафлин Д.М. Битемпоральная и высокодозная правосторонняя односторонняя электросудорожная терапия депрессии: систематический обзор и метаанализ рандомизированных контролируемых исследований. Психомед. 2017 фев; 47 (3): 518-530. [PubMed: 27780482]
- 15.
-
Sienaert P, Spaans HP, Kellner CH.
 Ширина импульса в электросудорожной терапии: насколько кратка кратка? ЭКСТ. 2018 июнь;34(2):73-74. [PubMed: 29489561]
Ширина импульса в электросудорожной терапии: насколько кратка кратка? ЭКСТ. 2018 июнь;34(2):73-74. [PubMed: 29489561] - 16.
-
Петридес Г., Финк М. Стратегия стимуляции половинного возраста для дозирования ЭСТ. Судороги Тер. 1996 сен; 12 (3): 138-46. [PubMed: 8872401]
- 17.
-
Петридес Г., Брага Р.Дж., Финк М., Мюллер М., Кнапп Р., Хусейн М., Румманс Т., Бейлин С., Малур С., О’Коннор К., Келлнер С., CORE (Консорциум по исследованиям в области ЭСТ) Group. Порог судорожного припадка в большой выборке: последствия для стратегий дозирования стимулов при двусторонней электросудорожной терапии: отчет CORE. ЭКСТ. 2009 г.Декабрь; 25 (4): 232-7. [Бесплатная статья PMC: PMC2792571] [PubMed: 19972637]
- 18.
-
Bryson EO, Aloysi AS, Farber KG, Kellner CH. Индивидуальное анестезиологическое обеспечение пациентов, подвергающихся электросудорожной терапии: обзор современной практики. Анест Анальг. 2017 июнь; 124 (6): 1943-1956.
 [PubMed: 28277323]
[PubMed: 28277323] - 19.
-
Bergsholm P, Gran L, Bleie H. Продолжительность приступа при односторонней электросудорожной терапии. Эффект гипокапнии, индуцированной гипервентиляцией, и эффект вентиляции кислородом. Acta Psychiatr Scand. 1984 февраля; 69(2):121-8. [PubMed: 6422704]
- 20.
-
Lihua P, Su M, Ke W, Ziemann-Gimmel P. Различные схемы внутривенного введения седативных или снотворных средств для электросудорожной терапии (ЭСТ) у взрослых пациентов с депрессией. Cochrane Database Syst Rev. 2014 Apr 11;(4):CD009763. [Статья бесплатно PMC: PMC6464335] [PubMed: 24723301]
- 21.
-
Брайсон Э.О., Келлнер К.Х., Ли Э.Х., Алоизи А.С., Майеске М. Чрезвычайная вариабельность дозы сукцинилхолина для мышечной релаксации при электросудорожной терапии. Австралийская психиатрия. 2018 Авг;26(4):391-393. [PubMed: 29504412]
- 22.
-
Торда Т.А., Грэм Г.Г., Уорик Н.Р., Донохью П. Фармакокинетика и фармакодинамика суксаметония.
 Интенсивная терапия Анест. 1997 июнь; 25 (3): 272-8. [PubMed: 9209610]
Интенсивная терапия Анест. 1997 июнь; 25 (3): 272-8. [PubMed: 9209610] - 23.
-
Майур П.М., Гангадхар Б.Н., Джанакирамайа Н., Суббакришна Д.К. Мониторинг двигательных припадков во время электросудорожной терапии. Бр Дж. Психиатрия. 1999 март; 174: 270-2. [PubMed: 10448455]
- 24.
-
Datto C, Rai AK, Ilivicky HJ, Caroff SN. Увеличение индукции судорог при электросудорожной терапии: клиническая переоценка. ЭКСТ. 2002 г., сен; 18 (3): 118–25. [В паблике: 12394529]
- 25.
-
Миллер Л.Дж. Применение электросудорожной терапии во время беременности. Общественная психиатрия Хосп. 1994 г., май; 45(5):444-50. [PubMed: 8045538]
- 26.
-
Рабхеру К. Использование электросудорожной терапии у особых групп пациентов. Can J Психиатрия. 2001 г., октябрь; 46 (8): 710-9. [PubMed: 11692973]
- 27.
-
Yonkers KA, Wisner KL, Stowe Z, Leibenluft E, Cohen L, Miller L, Manber R, Viguera A, Suppes T, Altshuler L.
 Управление биполярным расстройством во время беременности и послеродовой период. Am J Психиатрия. 2004 г., апрель; 161(4):608-20. [В паблике: 15056503]
Управление биполярным расстройством во время беременности и послеродовой период. Am J Психиатрия. 2004 г., апрель; 161(4):608-20. [В паблике: 15056503] - 28.
-
Андерсон Э.Л., Рети И.М. ЭСТ при беременности: обзор литературы с 1941 по 2007 год. Psychosom Med. 2009 г., февраль; 71 (2): 235–42. [PubMed: 151]
- 29.
-
Семковска М., Кин Д., Бабалола О., Маклафлин Д.М. Односторонняя короткоимпульсная электросудорожная терапия и познание: эффекты размещения электродов, дозировка стимула и время. J Psychiatr Res. 2011 июнь; 45 (6): 770-80. [PubMed: 21109254]
- 30.
-
Кауфман К.Р. Асистолия при электросудорожной терапии. J Интерн Мед. 1994 марта; 235 (3): 275-7. [PubMed: 8120525]
- 31.
-
Ларсон Г., Шварц С., Абрамс Р. Продолжительность тахикардии, вызванной ЭСТ, как мера продолжительности приступа. Am J Психиатрия. 1984 г., октябрь; 141 (10): 1269-71. [PubMed: 6486265]
- 32.

-
Fuenmayor AJ, el Fakih Y, Moreno J, Fuenmayor AM. Влияние электросудорожной терапии на сердечную функцию у пациентов без сердечных заболеваний. Кардиология. 1997 г., май-июнь; 88(3):254-7. [PubMed: 46]
- 33.
-
Маккалли Р.Б., Карон Б.Л., Румманс Т.А., Блэк Дж.Л., Андрин К.М., О Дж.К., Сьюард Дж.Б., Таджик А.Дж. Частота дисфункции левого желудочка после электросудорожной терапии. Ам Джей Кардиол. 2003 г. 01 мая; 91 (9): 1147-50. [PubMed: 12714169]
- 34.
-
Дума А., Пал С., Джонстон Дж., Хельвани М.А., Бхат А., Гилл Б., Розенквист Дж., Картмилл С., Браун Ф., Миллер Дж.П., Скотт М.Г., Санчес-Конде Ф. , Джарвис М., Фарбер Н.Б., Зорумски С.Ф., Конвей С., Нагеле П. Повышение уровня высокочувствительного сердечного тропонина после электросудорожной терапии: проспективное обсервационное когортное исследование. Анестезиология. 2017 Апрель; 126 (4): 643-652. [Бесплатная статья PMC: PMC5350051] [PubMed: 28166110]
- 35.

-
Зелински Р.Дж., Руз С.П., Девананд Д.П., Вудринг С., Сакейм Х.А. Сердечно-сосудистые осложнения ЭСТ у пациентов с депрессией и сердечными заболеваниями. Am J Психиатрия. 1993 г., июнь; 150 (6): 904-9. [PubMed: 8494067]
- 36.
-
Райс Э.Х., Сомбротто Л.Б., Марковиц Дж.К., Леон А.С. Сердечно-сосудистые заболевания у пациентов с высоким риском во время ЭСТ. Am J Психиатрия. 1994 ноябрь; 151(11):1637-41. [PubMed: 7943453]
- 37.
-
Абрамс Р. Смертность при ЭСТ. Судороги Тер. 1997 сент.; 13(3):125-7. [PubMed: 9342128]
- 38.
-
Бенсон Н.М., Сейнер С.Дж., Болтон П., Фицморис Г., Мейснер Р.К., Пирс С., Буш А.Б. Результаты лечения острой фазы электросудорожной терапии у подростков и молодых людей. ЭКСТ. 2019 сен; 35 (3): 178-183. [Бесплатная статья PMC: PMC6581623] [PubMed: 30562200]
ЭСТ, ТМС и другие методы стимуляции мозга
доступны ли другие варианты. Психиатр может предложить электросудорожную терапию (ЭСТ) или другие формы стимуляции мозга. Терапия стимуляции мозга включает в себя стимуляцию мозга напрямую с помощью электричества, магнитов или имплантатов.
Терапия стимуляции мозга включает в себя стимуляцию мозга напрямую с помощью электричества, магнитов или имплантатов.
Электросудорожная терапия (ЭСТ)
ЭСТ — это неинвазивная медицинская терапия, которая чаще всего используется у лиц с серьезными психическими заболеваниями, такими как большая депрессия или биполярное расстройство. Он проводится под анестезией и включает в себя использование небольших электрических токов, чтобы вызвать кратковременный контролируемый припадок в мозгу. ЭСТ, по-видимому, создает изменения в химическом составе мозга, которые могут быстро улучшить некоторые симптомы психического здоровья.
Хотя ЭСТ эффективна, она недостаточно используется в качестве варианта лечения. Возможно, это связано с такими факторами, как стигматизация и дезинформация, отсутствие доступности или опасения по поводу побочных эффектов. Реальность лечения с помощью ЭСТ сильно отличается от той, что была несколько десятилетий назад, когда она находилась на ранних стадиях развития. Как и в случае с любым подходом к лечению, цель состоит в том, чтобы обеспечить максимальную пользу с наименьшим риском, и с тех пор ЭСТ стала безопасным и эффективным вариантом.
Как и в случае с любым подходом к лечению, цель состоит в том, чтобы обеспечить максимальную пользу с наименьшим риском, и с тех пор ЭСТ стала безопасным и эффективным вариантом.
Лечение ЭСТ проводится последовательно, обычно пару раз в неделю. Люди спят во время процедуры и просыпаются примерно через 5-10 минут после ее окончания. Они могут возобновить нормальную деятельность примерно через час. Некоторые люди время от времени получают «поддерживающую ЭСТ» после завершения начальной серии. От 70 до 90% людей, получающих ЭСТ, сообщают об улучшении депрессии.
Побочные эффекты ЭСТ обычно легкие и могут включать:
- Головные боли, болезненность мышц или тошнота
- Кратковременная потеря памяти (может возникнуть во время лечения и имеет тенденцию быть кратковременной)
- Долговременная потеря памяти (редко постоянная)
Узнайте больше об ЭСТ и послушайте личные истории тех, кто использовал этот вариант лечения.
Транскраниальная магнитная стимуляция (ТМС)
ТМС — это неинвазивный метод лечения, при котором магнитные поля используются для стимуляции нервных клеток головного мозга. ТМС безопасна и эффективна и используется для лечения ряда состояний психического и физического здоровья, включая депрессию, обсессивно-компульсивное расстройство, посттравматическое стрессовое расстройство, боли и расстройства, связанные с употреблением психоактивных веществ, и другие. Это может быть особенно важно для людей, которым другие методы лечения не помогли. Например, 30-64% пациентов сообщают об улучшении симптомов депрессии.
ТМС безопасна и эффективна и используется для лечения ряда состояний психического и физического здоровья, включая депрессию, обсессивно-компульсивное расстройство, посттравматическое стрессовое расстройство, боли и расстройства, связанные с употреблением психоактивных веществ, и другие. Это может быть особенно важно для людей, которым другие методы лечения не помогли. Например, 30-64% пациентов сообщают об улучшении симптомов депрессии.
Во время ТМС электромагнитная катушка помещается на кожу головы человека возле лба. Короткие магнитные импульсы безболезненно направляются в область мозга, отвечающую за настроение. Врач, проводящий лечение, определит количество магнитной энергии, необходимой во время первого сеанса лечения. Лечение ТМС обычно длится от 40 до 60 минут. ТМС не требует использования анестезии, и человек остается в сознании во время лечения. Как и при ЭСТ, несколько сеансов проводятся в течение нескольких недель. Быстро вводимые импульсы называются повторяющейся ТМС (рТМС) и могут вызывать более длительные изменения активности мозга. Вы можете увидеть лечение, которое взаимозаменяемо называют ТМС или рТМС.
Вы можете увидеть лечение, которое взаимозаменяемо называют ТМС или рТМС.
Сообщалось о нескольких побочных эффектах ТМС, которые обычно слабо выражены и уменьшаются в течение курса лечения. Наиболее частым побочным эффектом является головная боль. Реже люди жалуются на боль в коже головы или подергивание лица. Наиболее серьезным риском ТМС являются судороги, однако имеющиеся данные свидетельствуют о том, что риск судорог очень редок (около 0,03%), без признаков необратимого повреждения.
Другие методы стимуляции мозга
ЭСТ и ТМС являются наиболее широко используемыми методами стимуляции мозга, но есть еще два доступных варианта: стимуляция блуждающего нерва и глубокая стимуляция мозга [VNS и DBS]. Исследования продолжают накапливаться, предлагая понимание этих вариантов лечения.
Стимуляция блуждающего нерва (ВНС)
Блуждающий нерв передает сообщения между вашим мозгом и другими областями вашего тела, контролируя такие важные функции, как частота сердечных сокращений, пищеварение, иммунный ответ и настроение. Лечение ВНС включает использование генератора импульсов размером с секундомер, который помещается в верхнюю левую часть грудной клетки для стимуляции блуждающего нерва.
Лечение ВНС включает использование генератора импульсов размером с секундомер, который помещается в верхнюю левую часть грудной клетки для стимуляции блуждающего нерва.
VNS изменяет нервную активность в организме, посылая слабые электрические импульсы через блуждающий нерв в ствол мозга. Затем этот импульс рассылается по всему мозгу, чтобы изменить способ функционирования клеток мозга, подобно кардиостимулятору. ВНС десятилетиями использовался для лечения судорожных расстройств, а также для лечения резистентной депрессии.
Исторически ВНС при резистентной к лечению депрессии не покрывалась страховыми компаниями, что делало этот вариант лечения недоступным для большинства людей. Однако в 2019 году Центр услуг Medicare и Medicaid начал предоставлять страховое покрытие для участников в рамках рандомизированного контролируемого исследования в 100 исследовательских центрах по всей территории США.
Стимуляция обычно происходит незаметно для человека, но иногда она может вызывать покалывание кожи, легкий кашель, изменение голоса или охриплость при активной стимуляции. Побочные эффекты, которые вызывают беспокойство, можно устранить, изменив настройки стимуляции.
Побочные эффекты, которые вызывают беспокойство, можно устранить, изменив настройки стимуляции.
Необходимы дополнительные исследования эффективности ВНС при резистентной к лечению депрессии, учитывая, что другие формы стимуляции, такие как ТМС и ЭСТ, предоставили дополнительные подтверждающие исследования их эффективности. Тем не менее, текущие результаты исследования VNS кажутся многообещающими, с оценками, колеблющимися в пределах 50-70% частоты ответов.
Также исследуется неинвазивная версия ВНС, известная как чрескожная аурикулярная ВНС или таВНС. Одно такое устройство уже одобрено FDA для лечения мигрени и кластерных головных болей. Еще одна версия taVNS получила от FDA статус прорывного устройства для лечения посттравматического стрессового расстройства.
Глубокая стимуляция мозга (DBS)
Глубокая стимуляция мозга (DBS) используется для лечения симптомов двигательных расстройств, таких как тремор, связанный с болезнью Паркинсона, и таких состояний, как дистония и резистентная к лечению эпилепсия. DBS также используется для лечения тяжелого обсессивно-компульсивного расстройства (ОКР), которое не поддается традиционному лечению. Хотя DBS используется реже при ОКР, исследования показывают, что он может быть эффективен при изнурительных симптомах.
DBS также используется для лечения тяжелого обсессивно-компульсивного расстройства (ОКР), которое не поддается традиционному лечению. Хотя DBS используется реже при ОКР, исследования показывают, что он может быть эффективен при изнурительных симптомах.
В последнее время DBS изучается как потенциальное средство лечения синдрома Туретта, а также психических состояний, таких как резистентная к лечению депрессия, связанная с большой депрессией и биполярным расстройством. Необходима дополнительная информация о его эффективности при этих состояниях, хотя обнадеживают исследования, связанные с тяжелой и резистентной к лечению депрессией. Многообещающая область исследований сосредоточена на использовании DBS для воздействия на определенные симптомы и схемы мозга для разработки уникальных методов лечения, адаптированных к потребностям пациентов. Этот подход частично привел к повышению эффективности лечения других состояний, включая ОКР.
DBS включает в себя одну или несколько крошечных проволок или электродов, которые хирургическим путем помещаются в мозг. Эти электроды подключены к очень маленькому генератору импульсов, который помещается в грудь. Возможны побочные эффекты от операции или от самой стимуляции. Хирургические побочные эффекты могут включать инфекцию, головную боль, спутанность сознания или аппаратные осложнения. Побочные эффекты, связанные со стимуляцией, могут включать онемение или покалывание, напряжение мышц лица или рук, проблемы с речью, нежелательные изменения настроения или головокружение. Когда устройство готово к использованию для стимуляции, поставщики медицинских услуг работают с людьми, чтобы установить настройки устройства и внести дополнительные коррективы. Этот процесс может занять от нескольких недель до нескольких месяцев и призван помочь найти наилучший уровень стимуляции для облегчения симптомов, а также для уменьшения любых возникающих побочных эффектов.
Эти электроды подключены к очень маленькому генератору импульсов, который помещается в грудь. Возможны побочные эффекты от операции или от самой стимуляции. Хирургические побочные эффекты могут включать инфекцию, головную боль, спутанность сознания или аппаратные осложнения. Побочные эффекты, связанные со стимуляцией, могут включать онемение или покалывание, напряжение мышц лица или рук, проблемы с речью, нежелательные изменения настроения или головокружение. Когда устройство готово к использованию для стимуляции, поставщики медицинских услуг работают с людьми, чтобы установить настройки устройства и внести дополнительные коррективы. Этот процесс может занять от нескольких недель до нескольких месяцев и призван помочь найти наилучший уровень стимуляции для облегчения симптомов, а также для уменьшения любых возникающих побочных эффектов.
Электросудорожная терапия Информация | Гора Синай
Шоковая терапия; Шоковая терапия; ЭСТ; Депрессия — ЭСТ; Биполярный — ECT
Электросудорожная терапия (ЭСТ) использует электрический ток для лечения депрессии и некоторых других психических заболеваний.
Описание
Во время ЭСТ электрический ток вызывает припадок в мозгу. Врачи считают, что судорожная активность может помочь мозгу «перестроиться», что помогает облегчить симптомы. ЭСТ в целом безопасна и эффективна.
ЭСТ чаще всего проводится в больнице, когда вы спите и не испытываете боли (общая анестезия):
- Вы получаете лекарство для расслабления (миорелаксант).
 Вы также получите другое лекарство (анестетик короткого действия), которое ненадолго усыпит вас и предотвратит чувство боли.
Вы также получите другое лекарство (анестетик короткого действия), которое ненадолго усыпит вас и предотвратит чувство боли. - На кожу головы накладывают электроды. Два электрода контролируют активность вашего мозга. Еще два электрода используются для подачи электрического тока.
- Когда вы спите, к вашей голове подается небольшое количество электрического тока, вызывающего судорожную активность в мозгу. Он длится около 40 секунд. Вы получаете лекарство, чтобы предотвратить распространение приступа по всему телу. В результате ваши руки или ноги двигаются лишь незначительно во время процедуры.
- ЭСТ обычно назначают один раз каждые 2–5 дней, всего от 6 до 12 сеансов. Иногда требуется больше сеансов.
- Через несколько минут после процедуры вы просыпаетесь. Вы НЕ помните лечение. Вы попадаете в зону восстановления. Там команда здравоохранения внимательно следит за вами. Когда ты выздоровеешь, ты сможешь вернуться домой.
- Вам нужен взрослый, который отвезет вас домой.
 Обязательно договоритесь об этом заранее.
Обязательно договоритесь об этом заранее.
Зачем проводится процедура
ЭСТ является высокоэффективным средством лечения депрессии, чаще всего тяжелой депрессии. Это может быть очень полезно для лечения депрессии у людей, которые:
- имеют бред или другие психотические симптомы во время депрессии
- беременны и находятся в тяжелой депрессии
- склонны к суициду
- не могут принимать антидепрессанты
- не ответили полностью к антидепрессантам
Реже ЭСТ используется при таких состояниях, как мания, кататония и психоз, которые НЕ улучшаются в достаточной степени с помощью других методов лечения.
Риски
ЭСТ получил негативную оценку в прессе, отчасти из-за того, что он может вызывать проблемы с памятью. С тех пор, как в 1930-х годах была введена ЭСТ, доза электричества, используемая в процедуре, значительно уменьшилась. Это значительно уменьшило побочные эффекты этой процедуры, включая потерю памяти.
С тех пор, как в 1930-х годах была введена ЭСТ, доза электричества, используемая в процедуре, значительно уменьшилась. Это значительно уменьшило побочные эффекты этой процедуры, включая потерю памяти.
Однако ЭСТ все еще может вызывать некоторые побочные эффекты, в том числе:
- Спутанность сознания, которая обычно длится лишь короткий период времени
- Головная боль
- Низкое кровяное давление (гипотония) или высокое кровяное давление (гипертония)
- Потеря памяти (постоянная потеря памяти после процедуры встречается гораздо реже, чем в прошлом)
- Болезненность мышц
- Тошнота
- Учащенное сердцебиение (тахикардия) или другие проблемы с сердцем
Некоторые заболевания подвергают людей большему риску побочных эффектов ЭСТ. Обсудите свое состояние здоровья и любые опасения со своим врачом при принятии решения о том, подходит ли вам ЭСТ.
Перед процедурой
Поскольку для этой процедуры используется общая анестезия, вас попросят не есть и не пить перед ЭСТ.
Спросите своего врача, следует ли вам принимать какие-либо ежедневные лекарства утром перед ЭСТ.
После процедуры
После успешного курса ЭСТ вы будете получать лекарства или менее частые ЭСТ, чтобы снизить риск повторного эпизода депрессии.
Outlook (Прогноз)
Некоторые люди сообщают о легком замешательстве и головной боли после ЭСТ. Эти симптомы должны длиться недолго.
Hermida AP, Glass OM, Shafi H, McDonald WM. Электросудорожная терапия при депрессии: современная практика и будущее направление. Психиатрическая клиника North Am . 2018;41(3):341-353. PMID: 30098649 pubmed.ncbi.nlm.nih.gov/30098649/.
Электросудорожная терапия при депрессии: современная практика и будущее направление. Психиатрическая клиника North Am . 2018;41(3):341-353. PMID: 30098649 pubmed.ncbi.nlm.nih.gov/30098649/.
Перуги Г., Медда П., Барбути М., Нови М., Триподи Б. Роль электросудорожной терапии в лечении тяжелого биполярного смешанного состояния. Психиатрическая клиника North Am . 2020;43(1):187-197. PMID: 32008684, pubmed.ncbi.nlm.nih.gov/32008684/.
Сиу AL; Целевая группа по профилактическим услугам США (USPSTF), Bibbins-Domingo K, et al. Скрининг депрессии у взрослых: Рекомендательное заявление Рабочей группы профилактических служб США. ДЖАМА . 2016;315(4):380-387. PMID: 26813211, pubmed.ncbi.nlm.nih.gov/26813211/.
Уэлч, Калифорния. Электрошоковой терапии. В: Стерн Т.А., Фава М., Виленс Т.Е., Розенбаум Дж.Ф., ред. Общая клиническая психиатрия Массачусетской больницы общего профиля . 2-е изд. Филадельфия, Пенсильвания: Elsevier; 2016: глава 45.


