Эпигенетическая теория развития: Эпигенетическая теория развития личности Эриксона
Эпигенетическая теория развития личности Эриксона — Студопедия
Поделись
В последние десятилетия усиливается тенденция к интегрированному, целостному рассмотрению личности с позиций разных теорий и подходов, и здесь намечается также интегративная концепция развития, принимающая во внимание согласованное, системное формирование и взаимозависимое преобразование всех тех сторон личности, акцент на которые делался в русле различных подходов и теорий. Одной из таких концепций стала теория, принадлежащая американскому психологу Э.Эриксону, в которой, более чем в других, данная тенденция оказалась выраженной.
Опираясь на представления З.Фрейда о психосексуальном развитии человека, Эриксон разработал теорию, в которой акцентируются социальные аспекты этого развития. Оно рассматривается как процесс интеграции индивидуальных биологических факторов с факторами воспитания и социокультурного окружения.
Э.Эриксон в своих взглядах на развитие придерживался так называемого эпигенетического принципа: генетической предопределенности стадий, которые в своем личностном развитии обязательно проходит человек от рождения до конца своих дней.
Наиболее существенный вклад Э.Эриксона в теорию личностного развития состоит в выделении и описании восьми жизненных психологических психосоциальных кризисов, неизбежно наступающих у каждого человека. Они специфичны для каждого возраста, благоприятный или неблагоприятный исход которых определяет возможность последующего расцвета личности.
Первый кризис (кризис «доверия-недоверия») человек переживает на первом году жизни. Он связан с тем, удовлетворяются или нет основные физиологические потребности ребенка ухаживающим за ним человеком. В первом случае у ребенка развивается чувство глубокого доверия к окружающему его миру, а во втором, наоборот, — недоверие к нему.
Второй кризис (автономия в противоположность сомнениям и стыду-2-3 года)связан с первым опытом обучения, особенно с приучением ребенка к чистоплотности. Если родители понимают ребенка и помогают ему контролировать естественные отправления, ребенок получает опыт
автономии. Напротив, слишком строгий или слишком непоследовательный внешний контроль приводит к развитию у ребенка стыда или сомнений, связанных главным образом со страхом потерять контроль над собственным организмом.
Напротив, слишком строгий или слишком непоследовательный внешний контроль приводит к развитию у ребенка стыда или сомнений, связанных главным образом со страхом потерять контроль над собственным организмом.
Третий кризис (появление инициативности в противовес чувству вины-от 3 до 6 лет)соответствует второму детству. В этом возрасте происходит самоутверждение ребенка. Планы, которые он постоянно строит и которые ему позволяют осуществить, способствуют развитию у него чувства инициативы. Наоборот, переживание повторных неудач и безответственности могут привести его к покорности и чувству вины.
Четвертый кризис (трудолюбие в противоположность комплексу неполноценности-с 7 до 12 лет)

Пятый кризис (личностное самоопределение в противоположность индивидуальной серости и конформизму- с 12 до 18 лет)переживают подростки обоего пола в поисках идентификаций (усвоения образцов поведения значимых для подростка других людей). Этот процесс предполагает объединение прошлого опыта подростка, его потенциальных возможностей и выбора, который он должен сделать. Неспособность подростка к идентификации или связанные с ней трудности могут привести к ее «распылению» или же к путанице ролей, которые подросток играет или будет играть в аффективной, социальной и профессиональной сферах.
Шестой кризис (интимность и общительность в противовес личностной психологической изолированности-около 20 лет) свойствен молодым взрослым людям. Он связан с поиском близости с любимым человеком, вместе с которым ему предстоит совершать цикл «работа — рождение детей — отдых», чтобы обеспечить своим детям надлежащее развитие. Отсутствие подобного опыта приводит к изоляции человека и его замыканию на самом себе.
Седьмой кризис (забота о воспитании нового поколения в противоположность «погружению в себя»- между 30 и 60 годами) переживается человеком в сорокалетнем возрасте. Он характеризуется развитием чувства сохранения рода
Восьмой кризис (удовлетворенность прожитой жизнью в противоположность отчаянию – старше 60 лет)переживается во время старения. Он знаменует собой завершение предшествующего жизненного пути, а разрешение зависит от того, как этот путь был пройден. Достижение человеком цельности основывается на подведение им итогов своей прошлой жизни и осознании ее как единого целого, в котором уже ничего нельзя изменить.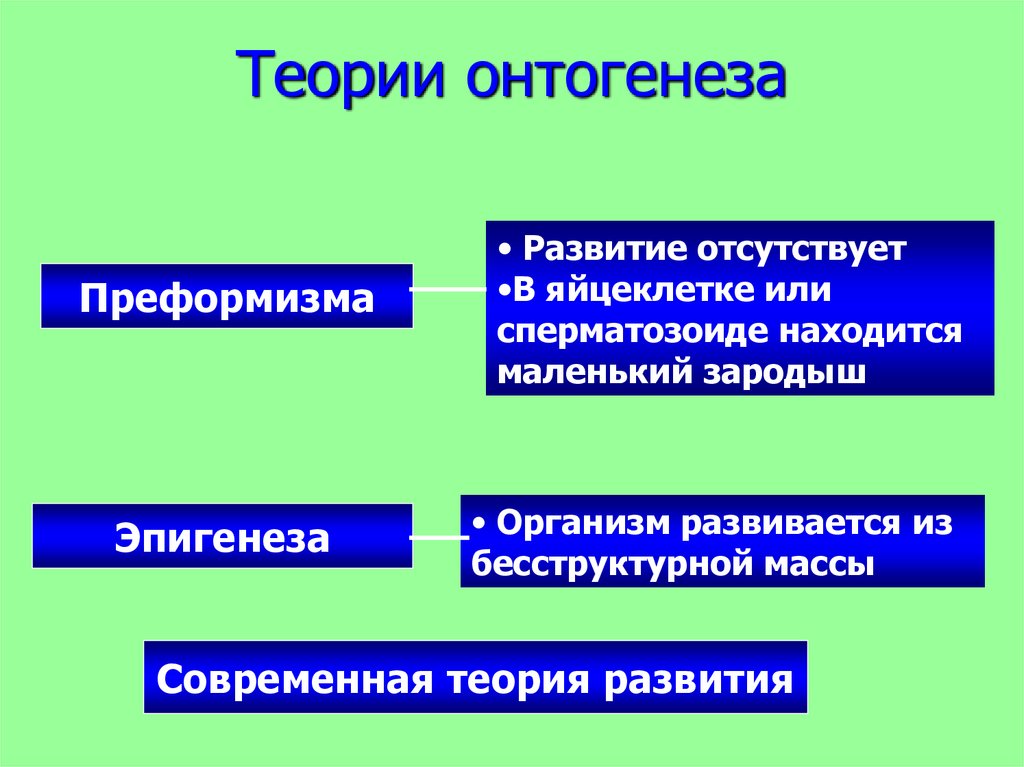 Если человек не может свести свои прошлые поступки в единое целое, он завершает свою жизнь в страхе перед смертью и в отчаянии от невозможности начать жизнь заново.
Если человек не может свести свои прошлые поступки в единое целое, он завершает свою жизнь в страхе перед смертью и в отчаянии от невозможности начать жизнь заново.
Э.Эриксон выделил восемь стадий развития, один к одному соотносимых с описанными выше кризисами возрастного развития.
Стадии процесса социализации личности по Э.Эриксону. Эпигенетическая теория развития личности Э.Эриксона. Бесплатный доступ к реферату
Стадии процесса социализации личности по Э.Эриксону. Эпигенетическая теория развития личности Э.Эриксона.docЗарегистрируйся в два клика и получи неограниченный доступ к материалам, а также промокод на новый заказ в Автор24. Это бесплатно.
Введение
Социализация представляет собой один из ключевых аспектов и вопросов социологии.
В процессе социализации происходит усвоение индивидом определенных норм и правил поведения, которые приняты в данном обществе, причем эти нормы поведения не просто механически усваиваются, а происходит их встраивание в систему ценностей индивида, кроме того в процессе социализации человек усваивает определенные формы и способы взаимодействия с окружающей его социальной средой.
Таким образом, социализация — это одновременно и процесс научения навыкам социального взаимодействия, и процесс культурной адаптации и интериоризации.
Процесс социализации является предметом исследования социальной педагогики, психологии и социологии. Социализация личности — сложный, длительный процесс, протекающий на протяжении всей жизни человека. Существуют различные подходы к выделению этапов социализации: по ведущему виду деятельности, ведущему институту социализации, возрастной периодизации и т.д.
Следовательно, социализация — это двусторонний процесс: с одной стороны, человек в процессе социализации изменяется, усваивает социальный опыт, погружаясь в систему социальных связей, с другой — сами социальные связи могут изменяться за счёт активных действий этого человека.
Теория Эриксона о том, что в своем развитии психика человека проходит восемь стадий является крупнейшим вкладом в развитие психоанализа и психологии в целом.
Согласно данной теории, характер человека начинает формироваться в детстве, но продолжает свое развитие в течение всей жизни, причем изменения могут носить значительный характер.

В частности, разработанная Эриксоном теория «кризиса идентификации» у подростков в дальнейшем получила широкое распространение и за пределами профессиональных кругов.
Цель работы состоит в изучении стадий процесса социализации личности по Э. Эриксону, а также его эпигенетическую теорию развития личности.
1. Понятие социализации
Социализация является длительным процессом, в ходе которого усваиваются и развиваются в дальнейшем те культурные и социальные нормы поведения, которые приняты в обществе на конкретном этапе его развития.
Существуют два типа социализации – первичный и вторичный.

При первичной социализации, которая начинается с рождения человека, ребенок получает первичный набор базовых социальных навыков, которые позволяют ему встроиться в систему общества.
Все дальнейшие изменения в жизни человека, которые обкусловлены переходом из одной социальной группы в другую сопровождаются уже вторичной социализацией.
Наше общество структурировано в зависимости как от возраста его граждан, так и от выполняемых ими функций.
В зависимости от своих психологических особенностей и ожиданий окружающих каждый из членов общества играет ряд социальных ролей, которые облегчают взаимодействие между членами общества, способствуя возникновению социальных связей между людьми и облегчая процессы коммуникации.
В отсутствии социализации человек не может встроится ни в одну социальную группу, поскольку не знает как себя вести, что в этой группе является неприемлемым в плане поведения, а что наоборот – одобряемым. Поэтому не происходит образования социальных внутригрупповых связей и человек становится изгоем.

Таким образом, социализация представляет собой непрерывный процесс усвоения индивидом принятых в обществе норм и правил поведения, который продолжается на протяжении все жизни, в зависимости от смены ролевых установок или места жительства, а также в зависимости от социального статуса и его динамики [2].
Следовательно, в процессе становления личности человека в детском, подростковом и юношеском возрасте является сложным взаимодействием как биологических, так и социо-культурных факторов. Однако процесс социализации не ограничивается только молодым возрастом человека и не прекращается по достижению им зрелого возраста. Несомненно, что именно в раннем возрасте происходит своеобразная закладка фундамента духовного развития личности, значительную роль в котором играет семья и образовательные учреждения [2].

Социализация и культурное воспитание молодого поколения должны рассматриваться в неразрывной связи с теми особенностями действительности, которые характерны для каждого конкретного общества
Зарегистрируйся, чтобы продолжить изучение работы
и получи доступ ко всей экосистеме Автор24
Введение
Социализация представляет собой один из ключевых аспектов и вопросов социологии.
В процессе социализации происходит усвоение индивидом определенных норм и правил поведения, которые приняты в данном обществе, причем эти нормы поведения не просто механически усваиваются, а происходит их встраивание в систему ценностей индивида, кроме того в процессе социализации человек усваивает определенные формы и способы взаимодействия с окружающей его социальной средой.
Таким образом, социализация — это одновременно и процесс научения навыкам социального взаимодействия, и процесс культурной адаптации и интериоризации.
Процесс социализации является предметом исследования социальной педагогики, психологии и социологии. Социализация личности — сложный, длительный процесс, протекающий на протяжении всей жизни человека. Существуют различные подходы к выделению этапов социализации: по ведущему виду деятельности, ведущему институту социализации, возрастной периодизации и т.д.
Следовательно, социализация — это двусторонний процесс: с одной стороны, человек в процессе социализации изменяется, усваивает социальный опыт, погружаясь в систему социальных связей, с другой — сами социальные связи могут изменяться за счёт активных действий этого человека.
Теория Эриксона о том, что в своем развитии психика человека проходит восемь стадий является крупнейшим вкладом в развитие психоанализа и психологии в целом.
Согласно данной теории, характер человека начинает формироваться в детстве, но продолжает свое развитие в течение всей жизни, причем изменения могут носить значительный характер.
В частности, разработанная Эриксоном теория «кризиса идентификации» у подростков в дальнейшем получила широкое распространение и за пределами профессиональных кругов.
Цель работы состоит в изучении стадий процесса социализации личности по Э. Эриксону, а также его эпигенетическую теорию развития личности.
1. Понятие социализации
Социализация является длительным процессом, в ходе которого усваиваются и развиваются в дальнейшем те культурные и социальные нормы поведения, которые приняты в обществе на конкретном этапе его развития.
В ходе социализации, таким образом, происходит передача социального и культурного опыта от старшего поколения поколению подрастающему. В этом плане социализация и воспитание во многом являются очень схожими процессами, которые преследуют одну и ту же цель, а именно — сформировать личность человека как активного участника социальной жизни, подчиняющегося принятым в этом обществе нормам морали, нравственности и поведения в целом [3].
Существуют два типа социализации – первичный и вторичный.
При первичной социализации, которая начинается с рождения человека, ребенок получает первичный набор базовых социальных навыков, которые позволяют ему встроиться в систему общества.
Все дальнейшие изменения в жизни человека, которые обкусловлены переходом из одной социальной группы в другую сопровождаются уже вторичной социализацией.
Наше общество структурировано в зависимости как от возраста его граждан, так и от выполняемых ими функций.
В зависимости от своих психологических особенностей и ожиданий окружающих каждый из членов общества играет ряд социальных ролей, которые облегчают взаимодействие между членами общества, способствуя возникновению социальных связей между людьми и облегчая процессы коммуникации.
В отсутствии социализации человек не может встроится ни в одну социальную группу, поскольку не знает как себя вести, что в этой группе является неприемлемым в плане поведения, а что наоборот – одобряемым. Поэтому не происходит образования социальных внутригрупповых связей и человек становится изгоем.
Таким образом, социализация представляет собой непрерывный процесс усвоения индивидом принятых в обществе норм и правил поведения, который продолжается на протяжении все жизни, в зависимости от смены ролевых установок или места жительства, а также в зависимости от социального статуса и его динамики [2].
Невозможно стать полноценным членом социума без социализации, агентами которой является семья, ближайшее окружение и те общественные институты, с которыми человек сталкивается на протяжение всей своей жизни.
Следовательно, в процессе становления личности человека в детском, подростковом и юношеском возрасте является сложным взаимодействием как биологических, так и социо-культурных факторов. Однако процесс социализации не ограничивается только молодым возрастом человека и не прекращается по достижению им зрелого возраста. Несомненно, что именно в раннем возрасте происходит своеобразная закладка фундамента духовного развития личности, значительную роль в котором играет семья и образовательные учреждения [2].
Социализация и культурное воспитание молодого поколения должны рассматриваться в неразрывной связи с теми особенностями действительности, которые характерны для каждого конкретного общества
. Это правило верно и в отношении российского общества.
Те кардинальные изменения, которые претерпело наше общество в последние десятилетия, отразились абсолютно на всех сферах жизни россиян, затронув и систему образования, воспитания и социализации подрастающего поколения.
2. Развитие теории личности Э. Эриксона
Теория развития личности, которая была разработана Э. Эриксоном охватывает все жизненное пространство человека (о момента младенчества до старости).
Эриксон тесно связывает процесс психического развития ребенка и становления его личности с тем социальным и культурным окружением, в котором находится ребенок на конкретном этапе своего развития.
Формирование эго ребенка (его Я) является неизбежным процессом, особенности которого продиктованы условиями социальной среды. Это связано с тем, что Я ребенка представляет собой автономную систему, которая постоянно взаимодействует с реальным миром посредством таких процессов как восприятие, мышление, внимание и память.
В своем исследовании Эриксон уделяет пристальное внимание адаптивным функциям Я, поскольку считает, что человек, взаимодействуя с окружением в процессе своего развития, постоянно повышает собственную компетентность [5].
Связывая процесс социализации человека развитием особенностей его характера, Эриксон привлекает внимание к вопросу о способности человека преодолевать жизненные трудности психосоциального характера. . Теория развития личности Эриксона основным моментом в развитии человека называет качества Я, то есть те достоинства, которые постепенно раскрываются и реализуются в разные периоды жизни человека.
. Теория развития личности Эриксона основным моментом в развитии человека называет качества Я, то есть те достоинства, которые постепенно раскрываются и реализуются в разные периоды жизни человека.
Для понимания концепции Эриксона об организации и развитии личности стоит оптимистическое положение о том, что каждый личный и социальный кризис представляет собой своего рода вызов, приводящий индивидуума к личностному росту и преодолению жизненных препятствий.
Знание того, как человек справлялся с каждой из значимых жизненных проблем или как неадекватное разрешение ранних проблем лишило его возможности справляться с дальнейшими проблемами, составляет, по мнению Эриксона, единственный ключ к пониманию его жизни.
Эриксон считает, что стадии развития человека, а, следовательно, и процесс становления его характера является предопределенным, а порядок прохождения этих стадий одинаков для всех.
В соответствии с этим, Эриксон подразделяет всю жизнь человека на восемь отдельных стадий психосоциального развития Я, которые получил название «восемь возрастов человека» [6].
Прохождение каждой из психосоциальных стадий развития заканчивается кризисом, который отражает переломный момент в развитии и переход количественных изменений в качественные. Наступление кризиса свидетельствует о том, что человек достиг определенного уровня психологической зрелости и соответствует социальным требованиям, которые предъявляет общество человеку на конкретной стадии его развития.
Любой из психосоциальных кризисов нельзя рассматривать только с отрицательной или положительной точек зрения. В каждом из кризисов присутствуют и положительные и отрицательные компоненты [4].
В том случае, когда конфликт разрешен удовлетворительно (то есть на предыдущей стадии Я обогатилось новыми положительными качествами), то теперь Я вбирает в себя новый позитивный компонент (в частности, базальное доверие и самостоятельность). Разрешение конфликта в ходе кризиса приводит к дальнейшему здоровому развитию личности человека.
Однако в том случае, когда конфликт не разрешается в ходе кризиса или разрешается не полностью, то развивающемуся Я, тем самым, наносится вред и в него встраивается негативный компонент (в частности, базальное недоверие, стыд и сомнение).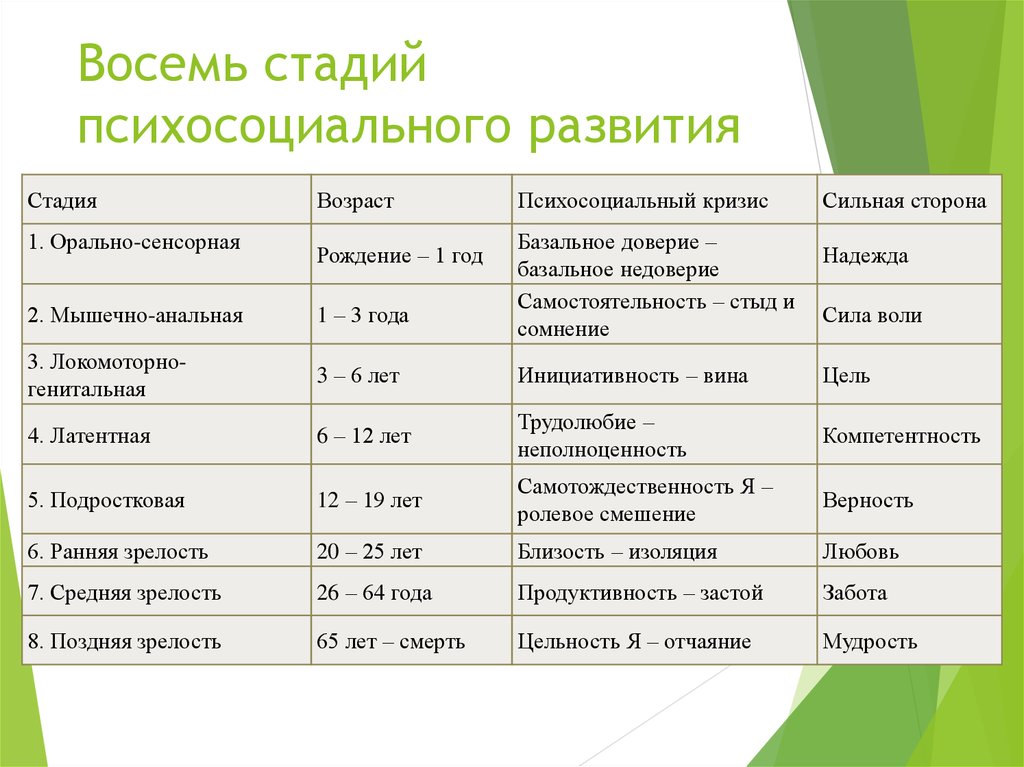
Эриксон подчеркивает, что жизнь представляет собой непрерывную смену всех ее аспектов, и что успешное решение проблемы на одной стадии еще не гарантирует человека от возникновения новых проблем на других этапах жизни или появление новых решений для старых, уже решенных, казалось бы проблем.
Задача состоит в том, чтобы каждый в отдельности индивид адекватно разрешал каждый кризис, и тогда, у него будет возможность подойти к следующей стадии более адаптивной и зрелой личностью.
3. Эпигенетическая теория развития личности Э. Эриксона
Теория развития личности Э. Эриксона берет свое начало в практике психоанализа, однако ее отличие состоит в том, что автор считает основой человеческого «я» в первую очередь именно социальную организации общества, отводя второстепенное место индивидуальным особенностям психики.
На каждой стадии развития человека общество предъявляет к нему ряд требований, которые человек или оправдывает или нет. В зависимости от этого и процесс социализации и психического развития также может быть успешным или нет – человек или становится полноценной частью социума или изгоем.
Эти идеи Эриксона легли в основу двух важных понятий его концепции — «групповой идентичности» и «эго-идентичности»
Магазин работ
Посмотреть все
РефератРазвитие личности в эго-психологии Э.Эриксона
280 ₽
ПрезентацииСтадии развития личности по Эрику Эриксону
300 ₽
РефератСтадии развития личности по Э.
 Эриксону
Эриксону
300 ₽
Посмотреть все
Не нашел ответ на свой вопрос?
Опиши, с чем тебе нужна помощь. Эксперты Автор24 бесплатно ответят тебе в течение часа
Выбери предметАвиационная и ракетно-космическая техникаАвтоматизация технологических процессовАвтоматика и управлениеАгрохимия и агропочвоведениеАктерское мастерствоАнализ хозяйственной деятельностиАнглийский языкАнтикризисное управлениеАрхеологияАрхитектура и строительствоАстрономияБазы данныхБанковское делоБезопасность жизнедеятельностиБиблиотечно-информационная деятельностьБизнес-планированиеБиологияБиотехнологияБухгалтерский учет и аудитВетеринарияВнешнеэкономическая деятельностьВодные биоресурсы и аквакультураВоенное делоВоспроизводство и переработка лесных ресурсовВысшая математикаГеографияГеодезияГеологияГеометрияГидравликаГидрометеорологияГостиничное делоГосударственное и муниципальное управлениеДеловой этикетДеньгиДетали машинДизайнДокументоведение и архивоведениеЕстествознаниеЖелезнодорожный транспортЖурналистикаЗемлеустройство и кадастрИздательское делоИнвестицииИнженерные сети и оборудованиеИнновационный менеджментИнформатикаИнформационная безопасностьИнформационные технологииИскусствоИсторияКартография и геоинформатикаКитайский языкКонфликтологияКраеведениеКредитКриминалистикаКулинарияКультурологияЛитератураЛогикаЛогистикаМаркетингМатериаловедениеМашиностроениеМедицинаМеждународные отношенияМеждународные рынкиМенеджментМенеджмент организацииМеталлургияМетрологияМеханикаМикро-, макроэкономикаМикропроцессорная техникаМорская техникаМузыкаНалогиНаноинженерияНачертательная геометрияНемецкий языкНефтегазовое делоОрганизационное развитиеПарикмахерское искусствоПедагогикаПожарная безопасностьПолиграфияПолитологияПочвоведениеПраво и юриспруденцияПриборостроение и оптотехникаПриродообустройство и водопользованиеПрограммированиеПроизводственный маркетинг и менеджментПромышленный маркетинг и менеджментПроцессы и аппаратыПсихологияРабота на компьютереРадиофизикаРежиссураРеклама и PRРелигияРусский языкРынок ценных бумагСадоводствоСварка и сварочное производствоСвязи с общественностьюСельское и рыбное хозяйствоСервисСопротивление материаловСоциальная работаСоциологияСтандартизацияСтатистикаСтрановедениеСтратегический менеджментСтрахованиеТаможенное делоТеатроведениеТекстильная промышленностьТелевидениеТеоретическая механикаТеория вероятностейТеория игрТеория машин и механизмовТеория управленияТеплоэнергетика и теплотехникаТехнологические машины и оборудованиеТехнология продовольственных продуктов и товаровТовароведениеТорговое делоТранспортные средстваТуризмУправление качествомУправление персоналомУправление проектамиФармацияФизикаФизическая культураФилософияФинансовый менеджментФинансыФранцузский языкХимияХирургияХолодильная техникаЦенообразование и оценка бизнесаЧертежиЧерчениеЭкологияЭконометрикаЭкономикаЭкономика предприятияЭкономика трудаЭкономическая теорияЭкономический анализЭлектроника, электротехника, радиотехникаЭнергетическое машиностроениеЭтикаЯдерная энергетика и теплофизикаЯдерные физика и технологииЯзыки (переводы)Языкознание и филологияEVIEWSSPSSSTATAДругоеПрикрепить файл
Твой вопрос отправлен
Скоро мы пришлем ответ экпертов Автор24 тебе на почту
Помощь эксперта
Нужна помощь по теме или написание схожей работы?
Свяжись напрямую с автором и обсуди заказ.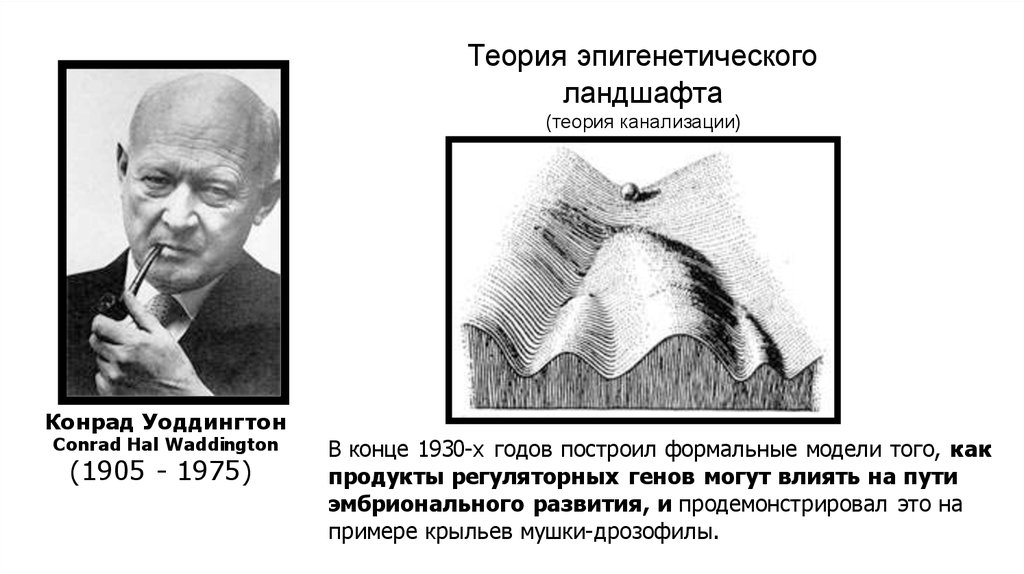
5
Янко
Психология 2871 заказ
Отправить письмо схожим авторам, которые сейчас на сайте
Регистрация прошла успешно!
Теперь вам доступен полный фрагмент работы, а также
открыт доступ ко всем сервисам
экосистемы
Скачивание началось
В файле вы найдете полный фрагмент работы доступный на сайте, а также промокод referat200 на новый заказ в Автор24.
Введи почту
Зарегистрируйся через почту и получи неограниченный доступ к материалам. Это бесплатно.
Читать тексты на сайте можно без ограничений.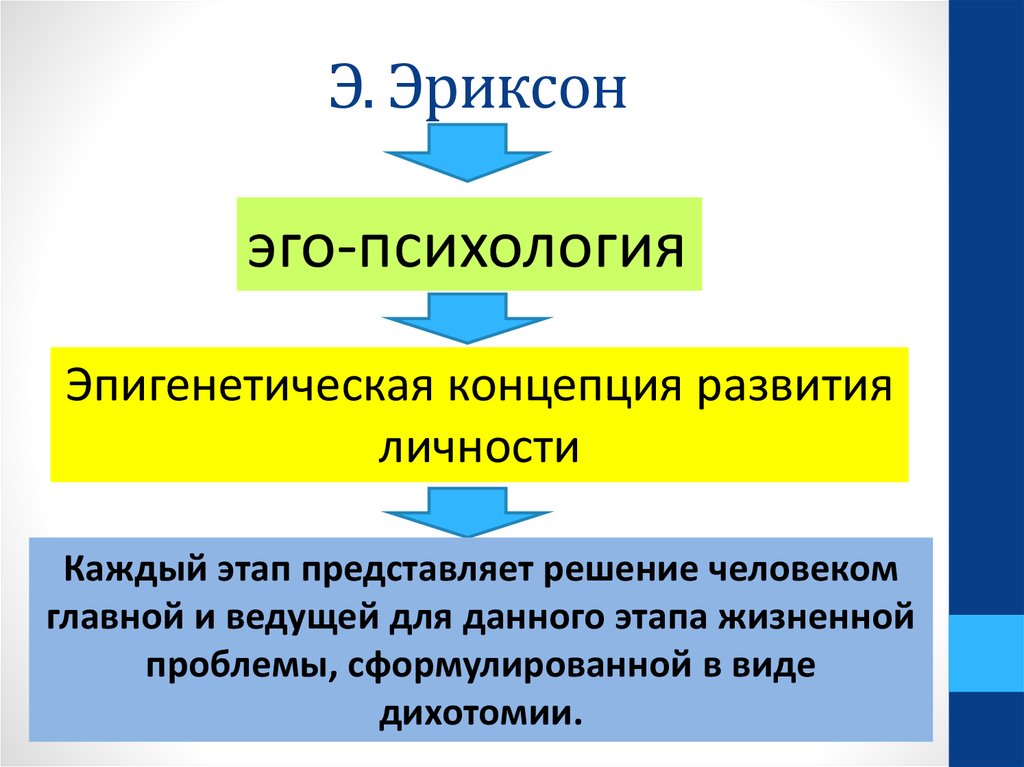 Однако для копирования и использования работ нужно
зарегистрироваться в экосистеме Автор24.
Это бесплатно.
Однако для копирования и использования работ нужно
зарегистрироваться в экосистеме Автор24.
Это бесплатно.
Эпигенетическая теория личности Эрика Эриксона
План
1. Эпигенетическая теория личности Эрика Эриксона………………………..3
2. Воспитание характера………………………………………………………
Список используемой литературы ………………….……………………..
1Эпигенетическая теория личности Эрика Эриксона
1.Теория развития личности.
Эпигенетическая теория развития личности Эрика Эриксона – одна из наиболее авторитетных, зарекомендовавших себя теорий развития личности. Важно при этом понять, какой подход она реализует, на какие вопросы она отвечает, а на какие – нет.
Развитие личности интересно не только для психологов. Развитие личности важно и для педагогов, развивающих личность детей разного возраста, развитие личности важно для бизнесменов, заинтересованных в развитии личности своих сотрудников, развитие личности важно и просто для людей, которые хотят развивать свою личность.
Концепция Эриксона почти полностью находится в психологическом поле, в малой степени ориентируясь на педагогические запросы.
Как писал А.В.Петровский: «Следует различать собственно психологический подход к развитию личности и строящуюся на его основе периодизацию возрастных этапов и собственно педагогический подход к последовательному вычленению социально обусловленных задач формирования личности на этапах онтогенеза»1.
В своей психологии Эриксон основывался на постулате социокультурной обусловленности психики человека. Разработал понятие психосоциальной идентичности как основного фактора психического здоровья. В условиях существенных социальных подвижек эта идентичность может быть нарушена, поэтому для ее восстановления необходимы особые психотерапевтические мероприятия. Разработал теорию стадиального развития личности, предполагающую прохождение ребенком восьми стадий развития.
С позиций Эриксона, Эго составляет основу поведения и функционирования человека и является автономной личностной структурой, основным направлением развития которой можно назвать социальную адаптацию.
Эго взаимодействует с реальностью при помощи восприятия, мышления, внимания и памяти, способствуя возрастанию компетентности человека.
Развитие Эго неизбежно связано с социокультурным контекстом и охватывает все жизненное пространство от рождения до смерти.
Человек в процессе жизни проходит восемь универсальных для всего человечества стадий, восемь возрастов.
Эпигенетическая концепция развития базируется на представлении о том, что каждая стадия жизненного цикла наступает в определенное для нее время (критический период), а также о том, что полноценно функционирующая личность формируется только путем прохождения в своем развитии последовательно всех стадий.
Каждая психосоциальная стадия сопровождается кризисом — поворотным моментом в жизни человека, возникающим как следствие достижения определенного уровня психологической зрелости.
Любой кризис представляет собой своего рода вызов, приводящий человека к личностному росту и преодолению жизненных препятствий.
На очередной фазе жизненного цикла личность решает специфичную для данного этапа развития эволюционную задачу. Кризис содержит позитивный и негативный компоненты.
Основные стадии развития личности:
Первая стадия развития человека соответствует оральной фазе классического психоанализа и обычно охватывает первый год жизни.
В этот период, считает Эриксон, развивается параметр социального взаимодействия, положительным полюсом которого служит доверие, а отрицательным — недоверие.
Благоприятное разрешение этого конфликта — надежда.
Вторая стадия охватывает второй и третий год жизни, совпадая с анальной фазой фрейдизма — самостоятельность (автономия) и нерешительность (стыд и сомнения). В этот период, считает Эриксон, у ребенка развивается самостоятельность на основе развития его моторных и психических способностей. На этой стадии ребенок осваивает различные движения, учится не только ходить, но и лазать, открывать и закрывать, толкать и тянуть, держать, отпускать и бросать — у него появляется самостоятельность.
Благоприятное разрешение этого конфликта — воля.
Третья стадия – предприимчивость (инициативность) и чувство вины (в другом переводе — неадекватность) обычно приходится на возраст от четырех до пяти лет. Социальный параметр этой стадии, говорит Эриксон, развивается между предприимчивостью на одном полюсе и чувством вины на другом. От того, как в этой стадии реагируют родители на затеи ребенка, во многом зависит, какое из этих качеств перевесит в его характере. Дети, которым предоставлена инициатива в выборе моторной деятельности, которые по своему желанию бегают, борются, возятся, катаются на велосипеде, на санках, на коньках, вырабатывают и закрепляют предприимчивость. Закрепляет ее и готовность родителей отвечать на вопросы ребенка (интеллектуальная предприимчивость) и не мешать, ему фантазировать и затевать игры.
Благоприятное разрешение этого конфликта — цель.
Четвертая стадия (умелость и неполноценность творчество и комплекс неполноценности) — возраст от шести до одиннадцати лет, годы начальной школы. Классический психоанализ называет их латентной фазой.
Классический психоанализ называет их латентной фазой.
Эриксон говорит, что психосоциальный параметр этой стадии характеризуется умелостью с одной стороны и чувством неполноценности — с другой.
Благоприятное разрешение этого конфликта — уверенность.
Пятая стадия (идентификация личности и путаница ролей).
При переходе на эту стадию (12-18 лет, кризис подросткового возраста) ребенок сталкивается, как утверждает классический психоанализ, с пробуждением «любви и ревности» к родителям. Успешное решение этой проблемы зависит от того, найдет ли он предмет любви в собственном поколении. Эриксон не отрицает возникновения этой проблемы у подростков, но указывает, что существуют и другие. Подросток созревает физиологически и психически, и в добавление к новым ощущениям и желаниям, которые появляются в результате этого созревания, у него развиваются и новые взгляды на вещи, новый подход к жизни. Важное место в новых особенностях психики подростка занимает его интерес к мыслям других людей, к тому, что они сами о себе думают.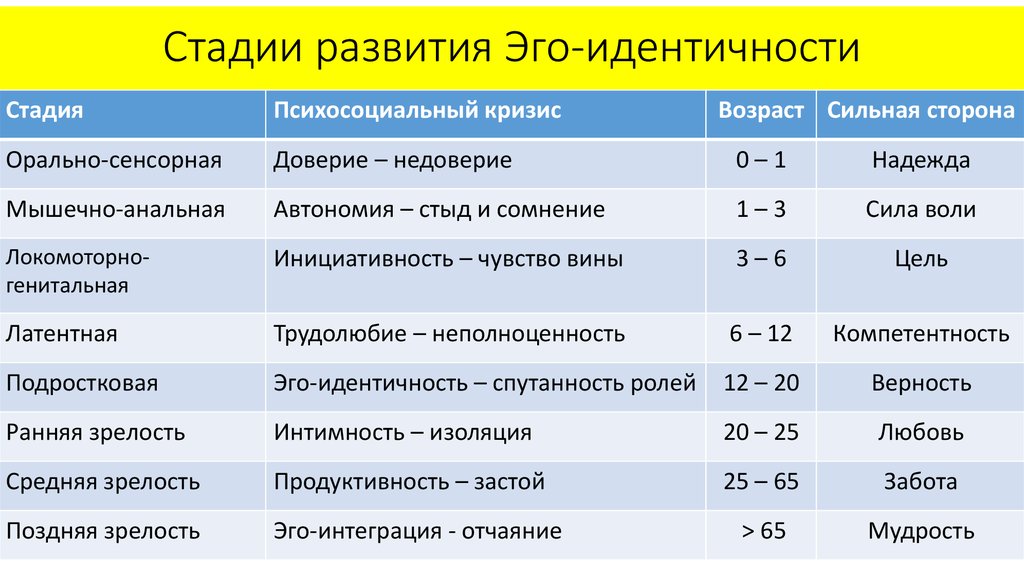 Подросток способен вырабатывать или перенимать теории и мировоззрения, которые сулят примирить все противоречия и создать гармоническое целое. Короче говоря, подросток — это нетерпеливый идеалист, полагающий, что создать идеал на практике не труднее, чем вообразить его в теории.
Подросток способен вырабатывать или перенимать теории и мировоззрения, которые сулят примирить все противоречия и создать гармоническое целое. Короче говоря, подросток — это нетерпеливый идеалист, полагающий, что создать идеал на практике не труднее, чем вообразить его в теории.
Эриксон считает, что возникающий в этот период параметр связи с окружающим колеблется между положительным полюсом идентификации «Я» и отрицательным полюсом путаницы ролей.
Эриксон больше всех других психологов-теоретиков подчеркивает, что жизнь представляет собой непрерывную смену всех ее аспектов и что успешное решение проблем на одной стадии еще не гарантирует человека от возникновения новых проблем на других этапах жизни или появление новых решений для старых, уже решенных, казалось, проблем.
Благоприятное разрешение этого конфликта — верность.
Шестой стадией жизненного цикла является начало зрелости — иначе говоря, период ухаживания и ранние годы семейной жизни, то есть от конца юности до начало среднего возраста. Об этой стадии и следующей за ней классический психоанализ не говорит ничего нового или, иначе, ничего важного. Но Эриксон, учитывая уже совершившееся на предыдущем этапе опознание «Я» и включение человека в трудовую деятельность, указывает на специфический для этой стадии параметр, который заключен между положительным полюсом близости и отрицательным — одиночества.
Об этой стадии и следующей за ней классический психоанализ не говорит ничего нового или, иначе, ничего важного. Но Эриксон, учитывая уже совершившееся на предыдущем этапе опознание «Я» и включение человека в трудовую деятельность, указывает на специфический для этой стадии параметр, который заключен между положительным полюсом близости и отрицательным — одиночества.
Под близостью Эриксон понимает не только физическую близость. В это понятие он включает способность заботиться о другом человеке и делиться с ним всем существенным без боязни потерять при этом себя. Но если ни в браке, ни в дружбе человек не достигает близости, тогда, по мнению Эриксона, уделом его становится одиночество — состояние человека, которому не с кем разделить свою жизнь и не о ком заботиться.
Благоприятное разрешение этого конфликта — любовь.
Седьмая стадия — зрелый возраст (появление чувства репродуктивности и застой), то есть уже тот период, когда дети стали подростками, а родители прочно связали себя с определенным родом занятий. На этой стадии появляется новый параметр личности с общечеловечностью на одном конце шкалы и самопоглощенностью — на другом.
На этой стадии появляется новый параметр личности с общечеловечностью на одном конце шкалы и самопоглощенностью — на другом.
Общечеловечностью Эриксон называет способность человека интересоваться судьбами людей за пределами семейного круга, задумываться над жизнью грядущих поколений, формами будущего общества и устройством будущего мира. Такой интерес к новым поколениям не обязательно связан с наличием собственных детей — он может существовать у каждого, кто активно заботится о молодежи и о том, чтобы в будущем людям легче жилось и работалось. Тот же, у кого это чувство сопричастности человечеству не выработалось, сосредоточивается на самом себе и главной его заботой становится удовлетворение своих потребностей и собственный комфорт.
Благоприятное разрешение этого конфликта — забота.
Восьмая стадия — в ней по классификации Эриксона приходится период, когда основная работа жизни закончилась и для человека наступает время размышлений. Психосоциальный параметр этого периода заключен между цельностью и безнадежностью. Ощущение цельности, осмысленности жизни возникает у того, кто, оглядываясь на прожитое, ощущает удовлетворение. Тот же, кому прожитая жизнь представляется цепью упущенных возможностей и досадных промахов, осознает, что начинать все сначала уже поздно и упущенного не вернуть. Такого человека охватывает отчаяние при мысли о том, как могла бы сложиться, но не сложилась его жизнь.
Ощущение цельности, осмысленности жизни возникает у того, кто, оглядываясь на прожитое, ощущает удовлетворение. Тот же, кому прожитая жизнь представляется цепью упущенных возможностей и досадных промахов, осознает, что начинать все сначала уже поздно и упущенного не вернуть. Такого человека охватывает отчаяние при мысли о том, как могла бы сложиться, но не сложилась его жизнь.
Благоприятное разрешение этого конфликта — мудрость.
Обществу и человеку придается равное значение в формировании личности на всем протяжении жизни.
Результаты первых четырех стадий развития практически полностью детерминированы влиянием социума, а разрешение конфликтов на более поздних возрастных этапах становится все более зависимым от внутренних факторов.
2 ВОСПИТАНИЕ ХАРАКТЕРА
В переводе с греческого языка характер означает – «чеканка, отпечаток».
В психологии под характером понимают совокупность индивидуально-своеобразных психических свойств, которые проявляются у личности в типичных условиях и выражаются в присущих ей способах деятельности в подобных условиях.
Характер формируется, развивается и изменяется в практической деятельности человека, отражает условия и образ его жизни.
Формирование характера начинается с раннего детства. Уже в дошкольном
возрасте обрисовываются первые контуры характера, начинает складываться
привычный образ поведения, определенные отношения к действительности.
Проявления коллективизма, настойчивости, выдержки, смелости в дошкольном возрасте формируются, прежде всего, в игре, особенно в сюжетных коллективных играх с правилами.
Большое значение имеют простейшие виды доступной дошкольнику трудовой деятельности. Выполняя некоторые несложные обязанности, ребенок приучается уважать и любить труд, чувствовать ответственность за порученное дело. Под влиянием требований родителей и воспитателей, их личного примера у ребенка постепенно складываются понятия о том, что можно и чего нельзя, и это начинает определять его поведение, закладывает основы чувства долга, дисциплины, выдержки; ребенок приучается давать оценку собственному поведению.
С поступлением в школу начинается новый этап формирования характера. Ребенок первые сталкивается с рядом строгих правил и школьных обязанностей, определяющих все его поведение в школе, дома, в общественных местах.
Эти правила, обязанности развивают у школьника организованность, систематичность, целеустремленность, настойчивость, аккуратность, дисциплинированность, трудолюбие. Исключительно важную роль в формировании характера играет школьный коллектив. В школе ребенок вступает в новые для него отношения с учителями, в отношения содружества и взаимопомощи с товарищами. У него развивается сознание долга и ответственности перед коллективом своего класса, школы, чувство товарищества, коллективизм.
Особенно интенсивно развиваются черты характера у подростков. Подросток в значительно мере, чем младший школьник, участвует в жизни взрослых, к нему предъявляют более высокие требования. Подросток в своей учебной и общественной деятельности уже гораздо больше начинает руководствоваться мотивами общественного порядка — чувством долга и ответственности перед коллективом, желанием поддержать честь школы, класса.
Решающее влияние на характер ребенка оказывает воспитание.
Не существует детей, характер которых нельзя было бы перевоспитать, и которым нельзя было бы привить определенные положительные качества, устранив даже как будто бы уже укоренившиеся у них отрицательные черты.
Каковы же пути воспитания характера?
Необходимым условием воспитания характера является формирование мировоззрения, убеждений, и идеалов.
Мировоззрением определяется направленность человека, его жизненные цели, устремления, из мировоззрения вытекают моральные установки, которыми люди руководствуются в своих поступках. Задача формирования мировоззрения, убеждений должна решаться в единстве с воспитанием определенных форм поведения, в которых могла бы воплотиться система отношений человека к действительности. Поэтому для воспитания общественно ценных черт характера необходима такая организация игровой, учебной, трудовой деятельности ребенка, при которой он бы мог накопить опыт правильного поведения.
Free Powerpoint Templates ВОПРОС 36 Эпигенетическая теория развития личности Э
Вы можете изучить и скачать доклад-презентацию на тему Free Powerpoint Templates ВОПРОС 36 Эпигенетическая теория развития личности Э. Презентация на заданную тему содержит 53 слайдов. Для просмотра воспользуйтесь проигрывателем, если материал оказался полезным для Вас — поделитесь им с друзьями с помощью социальных кнопок и добавьте наш сайт презентаций в закладки!
Презентации» Образование» Free Powerpoint Templates ВОПРОС 36 Эпигенетическая теория развития личности Э
Слайды и текст этой презентации
Слайд 1
Описание слайда:
Слайд 2
Описание слайда:
Слайд 3
Описание слайда:
Слайд 4
Описание слайда:
Слайд 5
Описание слайда:
Работы Э. Эриксона знаменуют собой начало нового пути исследования психики — психоисторического метода, который представляет собой применение психоанализа к истории.
Этот метод требует равного внимания как к психологии индивида, так и к характеру общества, в котором живет человек
Эриксона знаменуют собой начало нового пути исследования психики — психоисторического метода, который представляет собой применение психоанализа к истории.
Этот метод требует равного внимания как к психологии индивида, так и к характеру общества, в котором живет человек
Слайд 6
Описание слайда:
Слайд 7
Описание слайда:
Важные понятия концепции Эриксона — групповая идентичность и эгоидентичность.
Групповая идентичность формируется благодаря тому, что с первого дня жизни воспитание ребенка ориентировано на включение его в данную социальную группу, на выработку присущего данной группе мироощущения.
Эго-идентичность формируется параллельно с групповой и создает у субъекта чувство устойчивости и непрерывности своего «Я» несмотря на те изменения, которые происходят с человеком в процессе его роста и развития.
Слайд 8
Описание слайда:
Основные положения теории Эрика Эриксона 1.Наряду с описанными Фрейдом фазами психосексуального развития (оральной, анальной, фаллической и генитальной), в ходе которого меняется направленность влечения (от аутоэротизма до влечения к внешнему объекту), существуют и психологические стадии развития «Я», в ходе которого индивид устанавливает основные ориентиры по отношению к себе и своей социальной среде. 2.Становление личности не заканчивается в подростковом возрасте, но растягивается на весь жизненный цикл. 3.Каждой стадии присущи свои собственные параметры развития, способные принимать положительные и отрицательные значения
Слайд 9
Описание слайда:
Слайд 10
Описание слайда:
Задача младенческого возраста — формирование базового доверия к миру, преодоление чувства разобщенности и отчуждения – НАДЕЖДА Задача раннего возраста -борьба против чувства стыда и сильного сомнения в своих действиях за собственную независимость и самостоятельность – ВОЛЯ Задача игрового возраста — развитие активной инициативы и в то же время переживание чувства вины и моральной ответственности за свои желания-ЦЕЛЬ В период обучения в школе встает новая задача — формирование трудолюбия и умения обращаться с орудиями труда, чему противостоит осознание собственной неумелости и бесполезности -УВЕРЕННОСТЬ
Слайд 11
Описание слайда:
В подростковом и раннем юношеском возрасте появляется задача первого цельного осознания себя и своего места в мире; отрицательный полюс в решении этой задачи — неуверенность в понимании собственного «Я» («диффузия идентичности») -ВЕРНОСТЬ Задача конца юности и начала зрелости — поиск спутника жизни и установление близких дружеских связей, преодолевающих чувство одиночества- ЛЮБОВЬ Задача зрелого периода — борьба творческих сил человека против косности и застоя — ЗАБОТА Период старости характеризуется становлением окончательного цельного представления о себе, своем жизненном пути в противовес возможному разочарованию в жизни и нарастающему отчаянию МУДРОСТЬ
Слайд 12
Описание слайда:
ВОПРОС № 1 Естественно-научная и гуманитарная парадигмы в психологии
Слайд 13
Описание слайда:
Всю историю развития психологии можно охарактеризовать как взаимоотношения двух противоположных подходов — естественнонаучного и гуманитарного, причем в последние десятилетия наблюдается постепенное вытеснение первого вторым.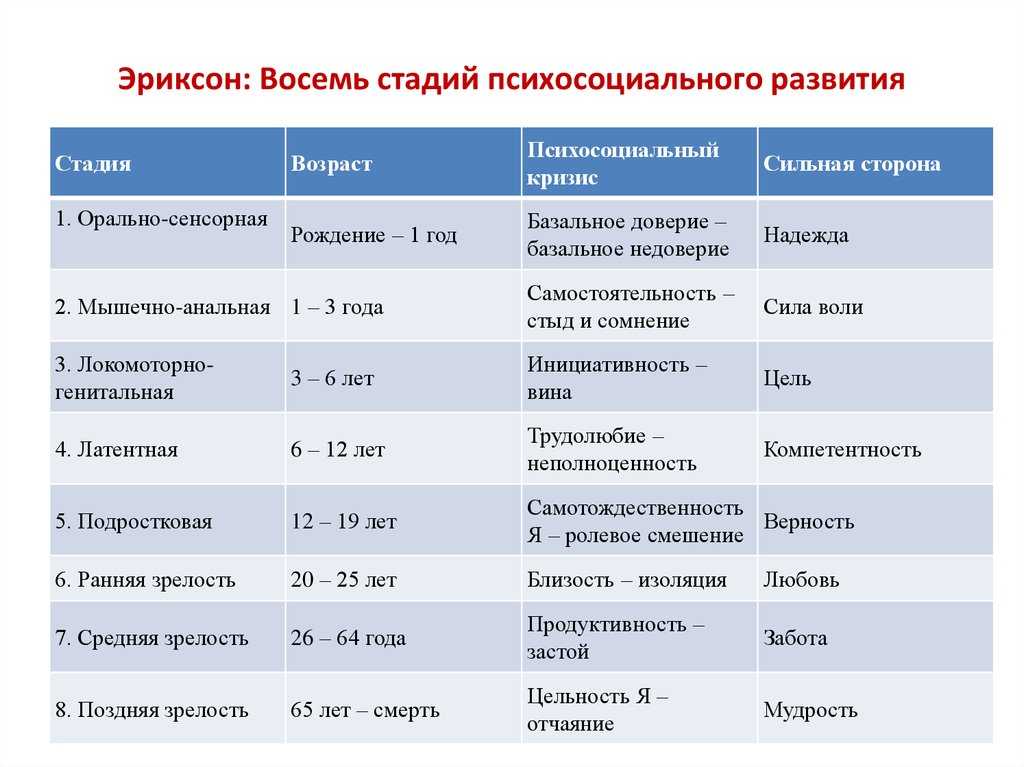
Слайд 14
Описание слайда:
Слайд 15
Описание слайда:
Естественно научная парадигма берет в качестве такого образца науки о природе. Из этого следует, прежде всего, познавательное отношение к психологическим объектам, отражение которых в соответствующих категориях и понятиях, выявление сущности (закономерности) поведения исследуемых явлений составляет важнейший, а порой и единственный смысл существования данной ориентации. «Чтобы знать».
Слайд 16
Описание слайда:
Основные принципы
естественнонаучной парадигмы :
1.Принцип опоры на эмпирические факты
2.Принцип рациональности
3.Принцип редукции
4.Принцип идеализации
5.Принцип простоты
6. Принцип независимой проверяемости.
Принцип независимой проверяемости.
Слайд 17
Описание слайда:
Гуманитарная парадигма в науке представляет собой познание природы, общества, самого человека с антропологической, человековедческой позиции; она вносит «человеческое измерение» во все сферы общественной жизни.
Слайд 18
Описание слайда:
Современные гуманитарные дисциплины ориентированы на общие критерии научности:
Слайд 19
Описание слайда:
Слайд 20
Описание слайда:
Естественнонаучная и гуманитарная парадигмы в психологии .
Слайд 21
Описание слайда:
Практическая парадигма
Слайд 22
Описание слайда:
Описание. Его необходимость связана с тем, что общение человека в контексте повседневной реальности, ставшей само-собой-разумеющейся, приводит к псевдоясности
Интерпретация предполагает включение материала описания в более масштабное целое. Завершение такого акта может быть названо пониманием. В этом усматривается генетическая связь понимания и интерпретации (но не отождествления). Возможность включения картины описания в разные контексты – принципиальное условие более глубокого понимания
Антропологическое изучение Антропологическое изучение предполагает анализ философско-антропологических определений человека, его образов, по отношению к которым осуществляется критическая процедура соотношения с тем, чтобы не перечеркнуть беспрецедентных его возможностей. Понятно, что ответственность за выбор несет сам создатель теории.
Становление теорий практики
проходит несколько этапов
по Болльнову
Его необходимость связана с тем, что общение человека в контексте повседневной реальности, ставшей само-собой-разумеющейся, приводит к псевдоясности
Интерпретация предполагает включение материала описания в более масштабное целое. Завершение такого акта может быть названо пониманием. В этом усматривается генетическая связь понимания и интерпретации (но не отождествления). Возможность включения картины описания в разные контексты – принципиальное условие более глубокого понимания
Антропологическое изучение Антропологическое изучение предполагает анализ философско-антропологических определений человека, его образов, по отношению к которым осуществляется критическая процедура соотношения с тем, чтобы не перечеркнуть беспрецедентных его возможностей. Понятно, что ответственность за выбор несет сам создатель теории.
Становление теорий практики
проходит несколько этапов
по Болльнову
Слайд 23
Описание слайда:
Слайд 24
Описание слайда:
!НО… встаёт ряд вопросов
Слайд 25
Описание слайда:
С философско-мировоззренческой точки зрения человек — существо безмерное, а это значит, что познать окончательно его невозможно, его нельзя описать единой формулой и к этому не нужно стремиться. С психологической точки зрения человек — существо многомерное, т.е. он имеет различные проявления. Различным проявлениям человека адекватны различные методы
С психологической точки зрения человек — существо многомерное, т.е. он имеет различные проявления. Различным проявлениям человека адекватны различные методы
Слайд 26
Описание слайда:
Продуктивное решение проблемы изучения психологии человека предложил Б. С. Братусь Необходимо различать человека как безмерное существо и личность как способ организации человеческой сущности. Предметом же психологического исследования следует сделать не готовые, сложившиеся свойства личности, а механизмы их формирования, становления.
Слайд 27
Описание слайда:
методы психологии методы объяснительной (естественнонаучной, академической) психологии методы описательной (гуманитарной, понимающей) психологии методы практической психологии, или психотерапевтической практики
Слайд 28
Описание слайда:
Вопрос №59.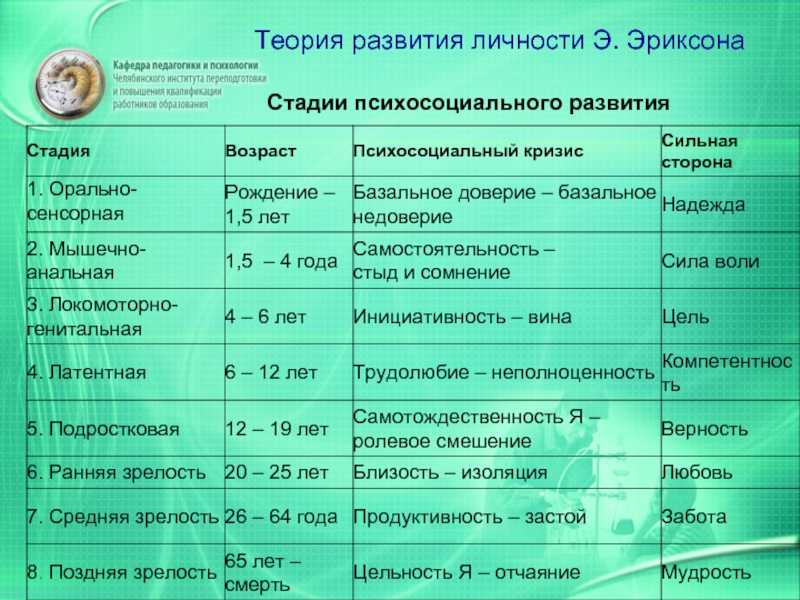 Вербальное и невербальное общение
Вербальное и невербальное общение
Слайд 29
Описание слайда:
Вербальное общение
Слайд 30
Описание слайда:
Лексика – это совокупность слов, входящих в состав какого-либо языка. Синтаксис – это характерные для конкретных языков средства и правила создания речевых единиц.
Слайд 31
Описание слайда:
Речь – это язык в действии, форма обобщенного отражения действительности, форма существования мышления
Слайд 32
Описание слайда:
Передача информации с помощью
речи происходит по такой схеме:
Коммуникатор (говорящий) отбирает слова, необходимые для выражения мысли; связывает их по правилам грамматики, используя принципы лексики и синтаксиса; произносит эти слова благодаря артикуляции органов речи.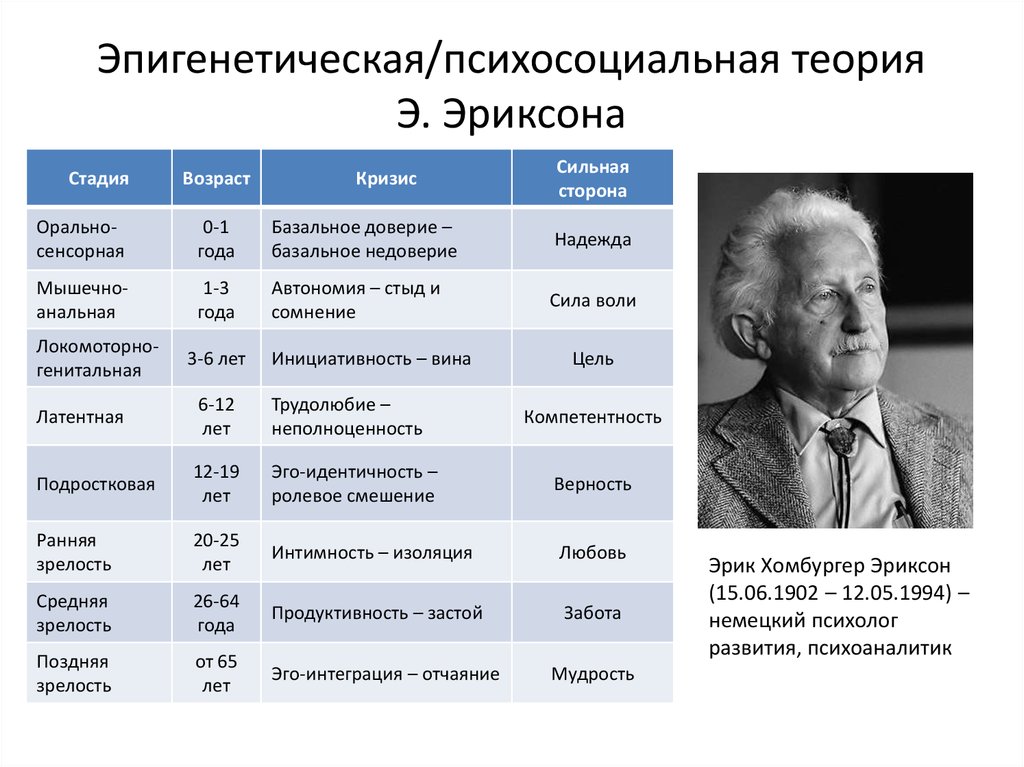 Реципиент (слушающий) воспринимает речь, декодирует речевые единицы для правильного понимания выраженной в ней мысли.
Реципиент (слушающий) воспринимает речь, декодирует речевые единицы для правильного понимания выраженной в ней мысли.
Слайд 33
Описание слайда:
Речь выполняет две функции – сигнификативную и коммуникативную
Слайд 34
Описание слайда:
Слайд 35
Описание слайда:
В речи реализуется и через нее посредством высказываний выполняет свою коммуникативную функцию язык
Слайд 36
Описание слайда:
К основным функциям языка в процессе коммуникации относятся:
Слайд 37
Описание слайда:
Слайд 38
Описание слайда:
Невербальное общение
Слайд 39
Описание слайда:
Совокупность этих средств призвана выполнять следующие функции:
дополнение речи и замещение речи;
репрезентация эмоциональных состояний партнеров по коммуникативному процессу, обнаружение намерений собеседника;
создание и поддержка психологического контакта, его регулирование в процессе общения;
придание новых смысловых оттенков сообщаемой информации, направление процесса истолкования слов и выражений в нужную сторону;
выражение принятой роли, смысла ситуации;
усиление вербального воздействия и др.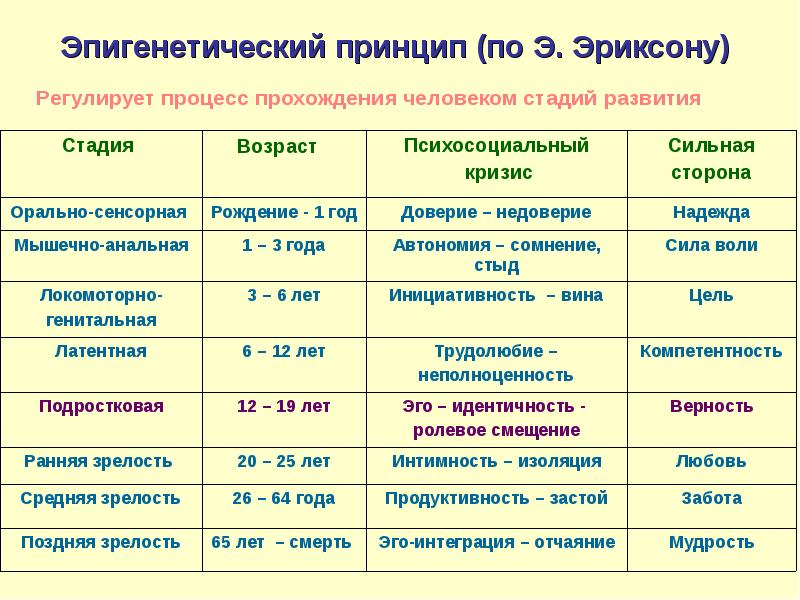
Слайд 40
Описание слайда:
Большинство исследователей сходятся во мнении, что с помощью слов передается в основном информация, а с помощью жестов – различное отношение к этой информации, а иногда жесты могут заменять и слова
Слайд 41
Описание слайда:
Оптико-кинетическая система знаков включает в себя : жесты – движения, передающие психическое состояние говорящего или думающего про себя человека; мимику – движения мышц лица, отражающие внутреннее эмоциональное состояние; пантомимику — динамическое состояние позы в конкретный момент общения; контакт глаз – интенсивность, длительность, частота обмена взглядами со стороны собеседников.
Слайд 42
Описание слайда:
Жесты при общении несут массу информации. В языке жестов, как и в речевом, есть свои “слова”, “предложения”. Богатейший “алфавит” жестов по их функциям можно разбить на 5 групп:
В языке жестов, как и в речевом, есть свои “слова”, “предложения”. Богатейший “алфавит” жестов по их функциям можно разбить на 5 групп:
Слайд 43
Описание слайда:
Слайд 44
Описание слайда:
Слайд 45
Описание слайда:
Слайд 46
Описание слайда:
Слайд 47
Описание слайда:
Слайд 48
Описание слайда:
Слайд 49
Описание слайда:
Слайд 50
Описание слайда:
Слайд 51
Описание слайда:
Слайд 52
Описание слайда:
Слайд 53
Описание слайда:
Tags Free Powerpoint Templates ВОПРОС 36 Эпигенетическая теория развития личности Э
Похожие презентации
Презентация успешно отправлена!
Ошибка! Введите корректный Email!
ВЫСТУПЛЕНИЕ-ПРЕЗЕНТАЦИЯ НА РОДИТЕЛЬСКОМ СОБРАНИИ ШКОЛЫ.
 Тема «Эпигенетическая теория развития личности Э. Эриксона.» | Презентация к уроку (5 класс) по теме:
Тема «Эпигенетическая теория развития личности Э. Эриксона.» | Презентация к уроку (5 класс) по теме:Слайд 1
ГБОУ СОШ №405 День открытых дверей
Слайд 2
Эпигенетическая теория развития личности Э. Эриксона (от греч. epi — после, поверх; genesis — происхождение, возникновение)
Слайд 3
Рассмотреть жизнь личности целиком , от рождения до смерти, как психологическую драму. Становление личности не заканчивается в подростковом возрасте, но растягивается на весь жизненный цикл. Фрейд рассматривал стадии развития личности до периода полового созревания. Фрейд «выводил» жизненный сценарий человека из того, как у того складывалось детство. Эрик Эриксон З. Фрейд
Слайд 4
Основные стадии развития личности по Эрику Эриксону
Слайд 5
1. Доверие или недоверие первый год жизни В этот период, считает Эриксон , развивается параметр социального взаимодействия, положительным полюсом которого служит доверие, а отрицательным — недоверие.
Слайд 6
Степень доверия, которым ребенок проникается к окружающему миру, к другим людям и к самому себе, в значительной степени зависит от проявляемой к нему заботы .
Слайд 7
Младенец, который получает все, что хочет, потребности которого быстро удовлетворяются, который никогда долго не испытывает недомогания, которого баюкают и ласкают, с которым играют и разговаривают, чувствует, что мир, в общем, место уютное, а люди—существа отзывчивые и услужливые. Если же ребенок не получает должного ухода, не встречает любовной заботы, то в нем вырабатывается недоверие — боязливость и подозрительность по отношению к миру вообще, к людям в частности, и это недоверие он несет с собой в свою жизнь.
Слайд 8
Вопрос о том, какое начало одержит верх, не решается раз и навсегда, а возникает заново на каждой последующей стадии развития.
Слайд 9
Ребенок, который приходит в школу с чувством настороженности, может постепенно проникнуться доверием к какой-нибудь учительнице, не допускающей несправедливости по отношению к детям и может преодолеть первоначальную недоверчивость.
Слайд 10
Но зато и ребенок, выработавший в младенчестве доверчивый подход к жизни, может проникнуться к ней недоверием скажем, в случае развода родителей.
Слайд 11
2. Самостоятельность или нерешительность (уверенность в успешности результатов своих действий или стыд и сомнения) от 1 года до 3 лет
Слайд 12
На этой стадии ребенок осваивает различные движения, учится не только ходить, но и лазать, открывать и закрывать, толкать и тянуть, держать, отпускать и бросать. Малыши наслаждаются и гордятся своими новыми способностями и стремятся все делать сами: разворачивать леденцы, доставать витамины из пузырька, спускать в туалете воду и т.д.
Слайд 13
Если родители предоставляют ребенку делать то, на что он способен, а не торопят его, у ребенка вырабатывается ощущение, что он владеет своими мышцами, своими побуждениями, самим собой и в значительной мере своей средой — то есть у него появляется самостоятельность.
Слайд 14
Если воспитатели проявляют нетерпение и спешат сделать за ребенка то, на что он и сам способен , у него развивается стыдливость и нерешительность. Конечно, не бывает родителей, которые ни при каких условиях не торопят ребенка, но не так уж неустойчива детская психика, чтобы реагировать на редкие события. Только в том случае, если в стремлении оградить ребенка от усилий, родители проявляют постоянное усердие, неразумно и неустанно браня его за «несчастные случаи», будь то мокрая постель, запачканные штанишки, разбитая чашка или пролитое молоко, у ребенка закрепляется чувство стыда перед другими людьми и неуверенность в своих способностях управлять собой и окружением.
Конечно, не бывает родителей, которые ни при каких условиях не торопят ребенка, но не так уж неустойчива детская психика, чтобы реагировать на редкие события. Только в том случае, если в стремлении оградить ребенка от усилий, родители проявляют постоянное усердие, неразумно и неустанно браня его за «несчастные случаи», будь то мокрая постель, запачканные штанишки, разбитая чашка или пролитое молоко, у ребенка закрепляется чувство стыда перед другими людьми и неуверенность в своих способностях управлять собой и окружением.
Слайд 15
Если из этой стадии ребенок выйдет с большой долей неуверенности, то это неблагоприятно отзовется в дальнейшем на самостоятельности и подростка, и взрослого человека. И наоборот, ребенок, вынесший из этой стадии гораздо больше самостоятельности, чем стыда и нерешительности, окажется хорошо подготовлен к развитию самостоятельности в дальнейшем. И опять-таки соотношение между самостоятельностью, и стыдливостью и неуверенностью, может быть изменено в ту или другую сторону последующими событиями.
Слайд 16
3. Предприимчивость и чувство вины (в другом переводе — неадекватность) от четырех до пяти лет Дошкольник уже приобрел множество физических навыков, он умеет и на трехколесном велосипеде ездить, и бегать, и резать ножом, и камни швырять. Он начинает сам придумывать себе занятия , а не просто отвечать на действия других детей или подражать им. Изобретательность его проявляет себя и в речи, и в способности фантазировать. Социальный параметр этой стадии, говорит Эриксон , развивается между предприимчивостью на одном полюсе и чувством вины на другом.
Слайд 17
От того, как в этой стадии реагируют родители на затеи ребенка, во многом зависит, какое из этих качеств перевесит в его характере. Дети, которым предоставлена инициатива в выборе моторной деятельности, которые по своему желанию бегают, борются, возятся, катаются на велосипеде, на санках, на коньках, вырабатывают и закрепляют предприимчивость.
Слайд 19
Закрепляет ее и готовность родителей отвечать на вопросы ребенка (интеллектуальная предприимчивость) и не мешать ему фантазировать и затевать игры. Но если родители показывают ребенку, что его моторная деятельность вредна и нежелательна, что вопросы его назойливы, а игры бестолковы, он начинает чувствовать себя виноватым и уносит это чувство вины в дальнейшие стадии жизни.
Но если родители показывают ребенку, что его моторная деятельность вредна и нежелательна, что вопросы его назойливы, а игры бестолковы, он начинает чувствовать себя виноватым и уносит это чувство вины в дальнейшие стадии жизни.
Слайд 20
4. Умелость или неполноценность. (Творчество или комплекс неполноценности) от 6 до 11 лет В этот период у ребенка развивается способность к организованным играм и регламентированным занятиям. Только теперь, дети учатся как и где следует надо соблюдать очередность. Эта стадия характеризуется умелостью с одной стороны и чувством неполноценности — с другой.
Слайд 21
В этот период у ребенка обостряется интерес к тому, как вещи устроены, как их можно освоить , приспособить к чему-нибудь. Этому возрасту понятен и близок Робинзон Крузо; ребенку понятен энтузиазм и интерес к трудовым навыкам , с которым Робинзон описывает во всех подробностях свои занятия.
Слайд 22
от 6 до 11 лет Когда детей поощряют мастерить что угодно, строить шалаши и авиамодели, варить, готовить и рукодельничать, когда им разрешают довести начатое дело до конца . Хвалят и награждают за результаты , тогда у ребенка вырабатывается умелость и способности к техническому творчеству.
Хвалят и награждают за результаты , тогда у ребенка вырабатывается умелость и способности к техническому творчеству.
Слайд 23
Напротив, родители, которые видят в трудовой деятельности детей одно «баловство» и «пачкотню», способствуют развитию у них чувства неполнценности .
Слайд 24
В этом возрасте, однако, окружение ребенка уже не ограничивается домом. Пребывание ребенка в школе и отношение, которое он там встречает, оказывает влияние на уравновешенность его психики. Ребенок, не отличающийся сметливостью, в особенности может быть травмирован школой, даже если его усердие и поощряется дома.
Слайд 25
Он не так туп, но он усваивает учебный материал медленнее, чем сверстники, и не может с ними соревноваться. Непрерывное отставание в классе развивает у него чувство неполноценности.
Слайд 26
Зато ребенок, склонность которого мастерить что-нибудь заглохла из-за вечных насмешек дома, может оживить ее в школе благодаря советам и помощи чуткого и опытного учителя. Таким образом, развитие этого параметра зависит не только от родителей, но и от отношения других взрослых.
Таким образом, развитие этого параметра зависит не только от родителей, но и от отношения других взрослых.
Слайд 27
5. Идентификация личности и путаница ролей 12-18 лет, кризис подросткового возраста Успешное решение этой проблемы зависит от того , найдет ли он предмет любви в собственном поколении. Но существуют и другие проблемы . Подросток созревает физиологически и психически, и в добавление к новым ощущениям и желаниям, которые появляются в результате этого созревания, у него развиваются и новые взгляды на вещи, новый подход к жизни.
Слайд 28
Важное место в новых особенностях психики подростка занимает его интерес к мыслям других людей, к тому, что они сами о себе думают. Подростки могут создавать себе мысленный идеал семьи, религии, общества, по сравнению с которым весьма проигрывают далеко несовершенные, но реально существующие семьи, религии и общества. Подросток способен вырабатывать или перенимать теории и мировоззрения, которые сулят примирить все противоречия и создать гармоническое целое. Короче говоря, подросток — это нетерпеливый идеалист, полагающий, что создать идеал на практике не труднее, чем вообразить его в теории.
Короче говоря, подросток — это нетерпеливый идеалист, полагающий, что создать идеал на практике не труднее, чем вообразить его в теории.
Слайд 29
Перед подростком, встает задача объединить все, что он знает о себе самом как о школьнике, сыне, спортсмене, друге, музыканте, газетчике и так далее. Все эти роли он должен собрать в единое целое, осмыслить, связать с прошлым и проецировать в будущее. Если молодой человек успешно справится с этой задачей — психосоциальной идентификацией, то у него появится ощущение того, кто он есть, где находится и куда идет.
Слайд 30
Влияние родителей, в этом вопросе более косвенное. Если благодаря родителям подросток уже выработал доверие, самостоятельность, предприимчивость и умелость, то есть на опознание собственной индивидуальности, значительно увеличиваются. Поэтому подготовка к всесторонней психосоциальной идентификации в подростковом возрасте должна начинаться, по сути, с момента рождения.
Слайд 31
Если из-за неудачного детства или тяжелого быта подросток не может решить задачу идентификации и определить свое «Я», то он начинает проявлять симптомы путаницы ролей и неуверенность в понимании того, кто он такой и к какой среде принадлежит. Но иногда лучше идентифицировать себя с «хиппи», с «малолетним преступником», даже с «наркоманом», чем вообще не обрести своего «Я».
Но иногда лучше идентифицировать себя с «хиппи», с «малолетним преступником», даже с «наркоманом», чем вообще не обрести своего «Я».
Слайд 33
Однако тот, кто в подростковом возрасте не приобретает ясного представления о своей личности, еще не обречен оставаться неприкаянным до конца жизни. А тот, кто опознал свое «Я» еще подростком, обязательно будет сталкиваться на жизненном пути с фактами, противоречащими или даже угрожающими сложившемуся у него представлению о себе.
Слайд 34
Подростковый бунт – пубертатный кризис Пубертатный кризис носит крайне сложный, определяясь как гормональной, так и коренной перестройкой психической сферы. Именно психика в пубертатном периоде наиболее ранима. Это определяется переходным характером ее развития, подросток внутренне уже не удовлетворяется пассивной ролью опекаемого ребенка, а внешнее окружение отрицает его право на принятие ответственных ролей взрослого, на каждом шагу давая ему почувствовать и его социальную незрелость, и экономическую зависимость.
Слайд 35
Отмечая неопределенность юридических граней перехода от детства к взрослости и еще большую неопределенность этих граней «в общественном мнении, которое зачастую и двадцатилетнего человека не считает за взрослого», И. С. Кон (1966) подчеркивает, что в современном обществе «правовая и моральная неопределенность юности отражает сдвиги в реальном положении вещей, и прежде всего удлинение периода юности за счет более позднего социального созревания».
Слайд 37
6. Близость или одиночество от конца юности до начало среднего возраста 18-25 лет Под близостью Эриксон понимает не только физическую близость. В это понятие он включает способность заботиться о другом человеке и делиться с ним всем существенным без боязни потерять при этом себя.
Слайд 38
С близостью дело обстоит так же, как с идентификацией: успех или провал на этой стадии зависит не прямо от родителей, но лишь от того, насколько успешно человек прошел предыдущие стадии.
Слайд 39
Это понятие не обязательно связано с сексуальным влечением, оно распространяется и на дружбу. Между однополчанами, сражавшимися бок о бок в тяжелых боях, очень часто образуются такие тесные связи, которые могут служить образчиком близости в самом широком смысле этого понятия.
Между однополчанами, сражавшимися бок о бок в тяжелых боях, очень часто образуются такие тесные связи, которые могут служить образчиком близости в самом широком смысле этого понятия.
Слайд 40
Но если ни в браке, ни в дружбе человек не достигает близости, тогда, по мнению Эриксона , уделом его становится одиночество — состояние человека, которому не с кем разделить свою жизнь и не о ком заботиться.
Марина Хилько, Мария ТкачеваВозрастная психология. Конспект лекцийНепосредственной сдаче экзамена или зачета по любой учебной дисциплине всегда предшествует краткий период, когда студент должен сосредоточиться, систематизировать свои знания. Выражаясь компьютерным языком, он должен «вывести информацию из долговременной памяти в оперативную», сделать ее готовой к немедленному и эффективному использованию. Специфика периода подготовки к экзамену или зачету заключается в том, что студент уже ничего не изучает (для этого просто нет времени): он лишь вспоминает и систематизирует изученное.  Предлагаемое пособие поможет студентам в решении именно этой задачи применительно к курсу «Возрастная психология». Предлагаемое пособие поможет студентам в решении именно этой задачи применительно к курсу «Возрастная психология».
Издательство: Юрайт, 2010г.
ОглавлениеТема 1. ВОЗРАСТНАЯ ПСИХОЛОГИЯ КАК НАУКА 1.1. Предмет и задачи возрастной психологии 1.2. Факторы, определяющие развитие возрастной психологии 1.3. Методы исследования в возрастной психологии 1.4. Исторический анализ понятия «детство» Тема 2. ТЕОРИИ ПСИХИЧЕСКОГО РАЗВИТИЯ 2.1. Биогенетические и социогенетические концепции 2.2. Теория конвергенции двух факторов детского развития 2.3. Психоаналитические теории детского развития 2.4. Эпигенетическая теория личности Эрика Эриксона 2.5. Теория социального научения 2.6. Проблема развития мышления в ранних работах Жана Пиаже 2.7. Теория когнитивного развития (концепция Ж. Пиаже) 2.8. Культурно-историческая концепция 2.9. Концепция психического развития ребенка Д. Тема 3. ПСИХОЛОГИЧЕСКИЕ ПРОБЛЕМЫ РАЗВИТИЯ ЛИЧНОСТИ 3.1. Особенности процесса развития 3.2. Движущие силы, условия и источники развития личности 3.3. Закономерности психического развития 3.4. Механизмы развития личности 3.5. Самосознание личности 3.6. Структурные звенья самосознания. Их генезис Тема 4. ПЕРИОДИЗАЦИЯ ПСИХИЧЕСКОГО РАЗВИТИЯ 4.1. Подходы к периодизации психического развития в возрастной психологии 4.2. Понятие возраста 4.3. Параметры возраста 4.4. Понятие сензитивности. Критические и кризисные периоды Тема 5. ПСИХИЧЕСКОЕ РАЗВИТИЕ НОВОРОЖДЕННОГО, МЛАДЕНЦА 5.1. Кризис новорожденности 5.2. Психическое развитие ребенка в период новорожденности 5.3. Новообразования периода новорожденности 5.4. Кризис первого года жизни 5.5. Ведущий вид деятельности 5.6. Новообразования младенческого возраста Тема 6. 6.1. Социальная ситуация развития 6.2. Развитие познавательной сферы ребенка 6.3. Личностные образования 6.4. Кризис трех лет 6.5. Ведущий вид деятельности в раннем детстве Тема 7. ДОШКОЛЬНОЕ ДЕТСТВО (от 3 до 6–7 лет) 7.1. Социальная ситуация развития 7.2. Ведущий вид деятельности 7.3. Игра и игрушки 7.4. Психическое развитие дошкольника 7.5. Новообразования дошкольного возраста 7.6. Психологическая готовность к школе Тема 8. МЛАДШИЙ ШКОЛЬНЫЙ ВОЗРАСТ (ОТ 6–7 ДО 10–11 ЛЕТ) 8.1. Социальная ситуация развития 8.2. Учебная деятельность. Другие виды деятельности 8.3. Новообразования младшего школьного возраста 8.4. Кризис семи лет 8.5. Проблемы перехода от младшего школьного возраста к подростковому Тема 9. ПОДРОСТКОВЫЙ ВОЗРАСТ (ОТ 10–11 ДО 14–15 ЛЕТ) 9.1. Социальная ситуация развития 9. 9.3. Психологические изменения 9.4. Кризис подросткового возраста 9.5. Ведущая деятельность в подростковом возрасте 9.6. Новообразования подросткового возраста Тема 10. ЮНОШЕСТВО (ОТ 15–16 ДО 20 ЛЕТ) 10.1. Когнитивные изменения 10.2. Учебно-профессиональная деятельность 10.3. Процесс становления самосознания 10.4. Взаимоотношения с окружающими Тема 11. ПСИХОЛОГИЧЕСКИЕ ОСНОВЫ УЧЕБНО-ВОСПИТАТЕЛЬНОЙ РАБОТЫ С ДЕТЬМИ, ОБНАРУЖИВАЮЩИМИ ОТКЛОНЕНИЯ В УМСТВЕННОМ РАЗВИТИИ 11.1. Дети с отклонениями в развитии 11.2. Психология умственно отсталого ребенка 11.3. Психологические особенности одаренных детей Тема 12. РАЗВИТИЕ ЛИЧНОСТИ В ЭКСТРЕМАЛЬНЫХ СИТУАЦИЯХ И СИТУАЦИЯХ ДЕПРИВАЦИИ Тема 13. МЕТОДЫ РАЗВИВАЮЩЕЙ РАБОТЫ ПСИХОЛОГА 13.1. Содержание и организация развивающей и коррекционной работы 13.2. Традиционные формы групповой коррекционно-развивающей работы (тренинги) 13. 13.4. Индивидуальная работа психолога Тема 14. ПСИХОЛОГИЯ ВЗРОСЛОГО ЧЕЛОВЕКА 14.1. Ранняя взрослость (20–40 лет) 14.2. Средняя взрослость (от 40 до 60 лет) 14.3. Период поздней взрослости (60 лет и старше) Использованная литература Каталог: book -> age psychology Скачать 2,28 Mb. Поделитесь с Вашими друзьями: |
Что такое эпигенетика? Ответ на спор о природе и воспитании
Инфографика
Скачать PDF
Для получения дополнительной информации об эпигенетике прокрутите вниз инфографику.
Просмотрите полный текст рисунка ниже.
Новое научное исследование показывает, что влияние окружающей среды может влиять на то, экспрессируются ли гены и как. На самом деле ученые обнаружили, что ранний опыт может определять, как включаются и выключаются гены и даже экспрессируются ли некоторые из них вообще. Таким образом, были опровергнуты старые представления о том, что гены «высечены в камне» или что только они определяют развитие. Природа против воспитания больше не является спором — это почти всегда и то, и другое!
Природа против воспитания больше не является спором — это почти всегда и то, и другое!
Дополнительная информация об эпигенетике
Глубокое погружение: взаимодействие генов и окружающей среды
Узнайте больше о физических и химических процессах, происходящих при создании эпигенома.Рабочий документ 10: Ранний опыт может изменить экспрессию генов и повлиять на долгосрочное развитие
В этом подробном рабочем документе объясняется, как взаимодействуют гены и окружающая среда, и даются рекомендации о том, как лица, осуществляющие уход, и политики могут эффективно реагировать на научные данные.
Во время развития ДНК, из которой состоят наши гены, накапливает химические метки, определяющие степень экспрессии генов. Этот набор химических меток известен как «эпигеном». Различный опыт детей перестраивает эти химические метки. Это объясняет, почему генетически идентичные близнецы могут демонстрировать разное поведение, навыки, здоровье и достижения.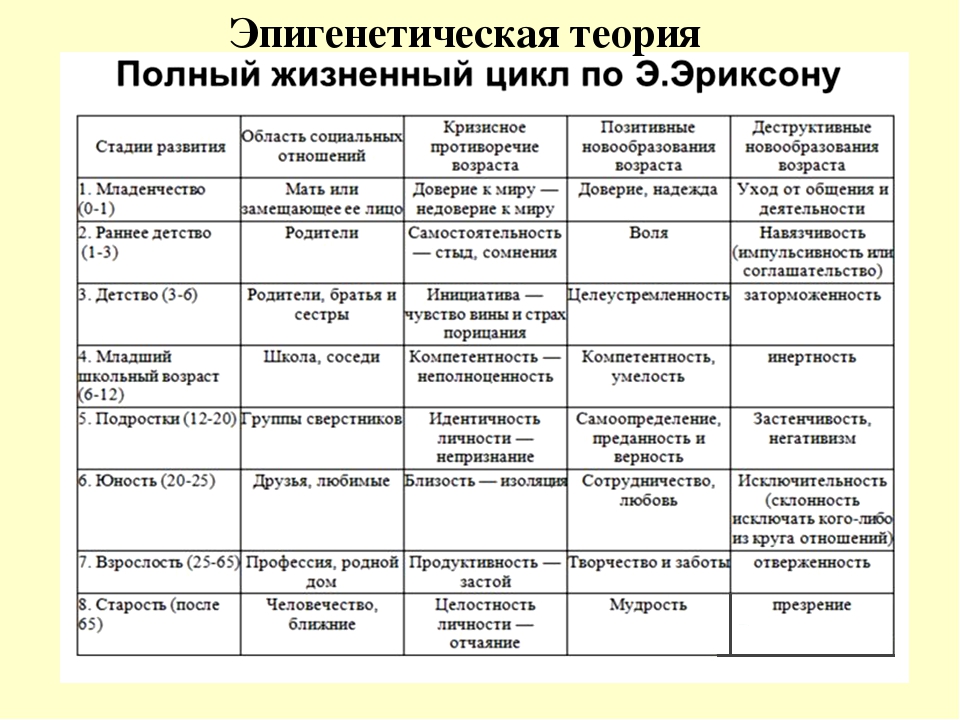
Исправление распространенных заблуждений о науке
До недавнего времени считалось, что влияние генов установлено, а влияние детского опыта и окружающей среды на архитектуру мозга и долгосрочные результаты физического и психического здоровья оставались загадкой. Это непонимание привело к нескольким вводящим в заблуждение выводам о степени, в которой негативные и позитивные факторы и опыт окружающей среды могут влиять на развивающийся плод и маленького ребенка. Следующие заблуждения особенно важно исправить.
- Вопреки распространенному мнению, гены, унаследованные от родителей, не определяют будущее развитие ребенка.
Различия в последовательностях ДНК у разных людей, безусловно, влияют на способ экспрессии генов и на то, как будут функционировать белки, кодируемые этими генами. Но это только часть истории: среда, в которой человек развивается до и вскоре после рождения, дает мощный опыт, который химически модифицирует определенные гены, которые, в свою очередь, определяют, в какой степени и когда они проявляются. Таким образом, в то время как генетические факторы оказывают мощное влияние, факторы окружающей среды обладают способностью изменять унаследованные гены.
Таким образом, в то время как генетические факторы оказывают мощное влияние, факторы окружающей среды обладают способностью изменять унаследованные гены. - Несмотря на то, что неблагоприятные переживания плода и раннего детства часто понимают неправильно, они могут привести и приводят к физическим и химическим изменениям в мозге, которые могут сохраняться на протяжении всей жизни.
Вредные переживания, такие как недоедание, воздействие химических токсинов или наркотиков и токсический стресс до рождения или в раннем детстве, не «забываются», а скорее встраиваются в архитектуру развивающегося мозга посредством эпигенома. «Биологические воспоминания», связанные с этими эпигенетическими изменениями, могут воздействовать на многие системы органов и повышать риск не только ухудшения физического и психического здоровья, но и ухудшения способности к обучению и поведения в будущем. - Несмотря на некоторые маркетинговые заявления об обратном, способность так называемых программ обогащения улучшать развитие мозга, которое в остальном было бы здоровым, неизвестна.

Хотя родители и политики могут надеяться, что прослушивание записей Моцарта для новорожденных вызовет эпигенетические изменения, которые улучшат когнитивное развитие, нет абсолютно никаких научных доказательств того, что такое воздействие сформирует эпигеном или улучшит работу мозга. Исследования показали, что специфические эпигенетические модификации действительно происходят в клетках мозга по мере развития когнитивных навыков, таких как обучение и память, и что повторная активация мозговых цепей, предназначенных для обучения и памяти, посредством взаимодействия с окружающей средой, такого как взаимное взаимодействие «обслуживание и возврат». у взрослых способствует этим позитивным эпигенетическим модификациям. Мы также знаем, что здоровое питание матери и плода в сочетании с положительной социально-эмоциональной поддержкой детей в их семье и обществе снизит вероятность негативных эпигенетических модификаций, которые повышают риск последующих нарушений физического и психического здоровья.
На эпигеном могут воздействовать положительный опыт, такой как поддерживающие отношения и возможности для обучения, или негативные влияния, такие как токсины окружающей среды или стрессовые жизненные обстоятельства, которые оставляют уникальную эпигенетическую «подпись» на генах. Эти сигнатуры могут быть временными или постоянными, и оба типа влияют на то, насколько легко включаются или выключаются гены. Недавние исследования показывают, что могут быть способы обратить вспять определенные негативные изменения и восстановить здоровое функционирование, но это требует гораздо больше усилий, может не сработать для изменения всех аспектов сигнатур и является дорогостоящим. Таким образом, самая лучшая стратегия состоит в том, чтобы поддерживать отзывчивые отношения и снижать стресс, чтобы с самого начала развивать сильный мозг, помогая детям вырасти здоровыми и продуктивными членами общества.
Для получения дополнительной информации: Ранний опыт может изменить экспрессию генов и повлиять на долгосрочное развитие: рабочий документ № 10.
Полный текст рисунка
«Эпигенетика» — это новая область научных исследований, которая показывает, как влияние окружающей среды — детский опыт — на самом деле влияет на экспрессию их генов.
Это означает, что старая идея о том, что гены «высечены в камне», опровергнута. Природа против воспитания больше не дискуссия. Почти всегда и то, и другое!
Во время развития ДНК, из которой состоят наши гены, накапливает химические метки, определяющие, насколько экспрессированы гены. Этот набор химических меток известен как «эпигеном». Различный опыт детей перестраивает эти химические метки. Это объясняет, почему генетически идентичные близнецы могут демонстрировать разное поведение, навыки, здоровье и достижения.
Эпигенетика объясняет, как ранний опыт может иметь последствия на всю жизнь.
Гены, которые дети наследуют от своих биологических родителей, предоставляют информацию, которая направляет их развитие. Например, какого роста они могли бы в конечном итоге стать или какой темперамент у них мог бы быть.
Когда события во время развития изменяют эпигенетические метки, управляющие экспрессией генов, они могут изменить то, высвобождают ли гены информацию, которую они несут, и как.
Таким образом, на эпигеном могут воздействовать положительный опыт, такой как поддерживающие отношения и возможности для обучения, или негативные влияния, такие как токсины окружающей среды или
стрессовые жизненные обстоятельства, которые оставляют уникальную эпигенетическую «подпись» на генах. Эти сигнатуры могут быть временными или постоянными, и оба типа влияют на то, насколько легко включаются или выключаются гены. Недавние исследования показывают, что могут быть способы обратить вспять определенные негативные изменения и восстановить здоровое функционирование. Но самая лучшая стратегия — поддерживать отзывчивые отношения и снижать стресс, чтобы с самого начала укрепить мозги.
Молодой мозг особенно чувствителен к эпигенетическим изменениям.
Опыт в самом начале жизни, когда мозг развивается наиболее быстро, вызывает эпигенетическую адаптацию, влияющую на то, выдают ли, когда и как гены свои инструкции по формированию будущих способностей к здоровью, навыкам и устойчивости. Вот почему так важно обеспечить поддержку и заботу о маленьких детях в самые ранние годы.
Вот почему так важно обеспечить поддержку и заботу о маленьких детях в самые ранние годы.
Такие услуги, как высококачественное медицинское обслуживание для всех беременных женщин, младенцев и детей ясельного возраста, а также поддержка молодых родителей и опекунов, могут — в буквальном смысле — влиять на химию генов детей. Поддерживающие отношения и богатый опыт обучения генерируют положительные эпигенетические сигнатуры, которые активируют генетический потенциал.
Подпишитесь на нашу рассылку Запросите разрешение на повторную публикацию этого ресурса
Просмотр связанных ресурсов
Эпигенетика раннего развития ребенка
Введение
Тесная связь между качеством жизни в раннем возрасте и психическим здоровьем в более позднем возрасте давно известна (Gluckman et al., 2008). Многие исследования на людях, приматах и грызунах показывают, что аспекты окружающей среды в раннем возрасте могут привести к резким изменениям в физическом и умственном развитии, ставя под угрозу сердечно-сосудистые и метаболические заболевания, изменение когнитивных функций, настроения и поведения. В частности, неблагоприятные условия в ранние периоды развития могут формировать индивидуальные различия в уязвимости к расстройствам, связанным со стрессом, на протяжении всей жизни (см. обзор Heim and Nemeroff, 2002) в зависимости от степени «совпадения» и «несоответствия» между ранним и более поздние жизненные среды.
В частности, неблагоприятные условия в ранние периоды развития могут формировать индивидуальные различия в уязвимости к расстройствам, связанным со стрессом, на протяжении всей жизни (см. обзор Heim and Nemeroff, 2002) в зависимости от степени «совпадения» и «несоответствия» между ранним и более поздние жизненные среды.
Эти результаты поднимают интригующий вопрос о том, как эти переживания включаются на клеточном и молекулярном уровне в структуру мозга, что приводит к долгосрочным изменениям различных функций, что в конечном итоге приводит к повышенному риску психических заболеваний. Пластичность развития определяет способность организма адаптироваться к окружающей среде в раннем возрасте и осуществлять длительные изменения в наборах ключевых биологических программ, исходя из предположения, что условия окружающей среды в этот ранний период будут сохраняться на протяжении всей последующей жизни (обзор см. Hochberg et al. ., 2010). Неблагоприятный материнский опыт в раннем возрасте может сильно повлиять на зависимое от опыта созревание структур, лежащих в основе эмоциональных функций и эндокринных реакций на стресс, таких как система гипоталамо-гипофизарно-надпочечниковая (ГГН) — неотъемлемый компонент реакции организма на стресс, что приводит к усилению стрессоустойчивость во взрослом возрасте (см. обзор Seckl and Meaney, 2004). Действительно, депрессивные пациенты с историей жестокого обращения или пренебрежения в детстве часто характеризуются гиперактивностью оси HPA (для обзора см. Heim and Nemeroff, 2002).
обзор Seckl and Meaney, 2004). Действительно, депрессивные пациенты с историей жестокого обращения или пренебрежения в детстве часто характеризуются гиперактивностью оси HPA (для обзора см. Heim and Nemeroff, 2002).
Чтобы понять взаимодействие генов и окружающей среды в человеческих популяциях и выяснить пути, посредством которых опосредовано программирование в ответ на ранний жизненный опыт, исследователи в области неврологии полагаются на модели животных, в которых ранней средой можно управлять контролируемым образом. . Текущая работа предполагает, что так называемые эпигенетические механизмы регуляции генов, которые изменяют активность генов без изменения порядка их последовательности ДНК, могут объяснить, как ранний жизненный опыт может оставлять неизгладимые химические следы в мозгу и влиять как на физическое, так и на психическое здоровье позже. в жизни, даже когда первоначальный триггер уже давно ушел (см. обзор Dudley et al., 2011).
В этом обзоре мы освещаем недавние исследования на животных и людях, посвященные эпигенетической регуляции экспрессии генов в поддержании последствий раннего жизненного опыта. Таким образом, мы сосредоточимся на клинических исследованиях и исследованиях на животных, в которых изучалось, как биологические стрессовые системы, особенно ось HPA, формируются под воздействием неблагоприятных обстоятельств, а затем даем описание того, что мы знаем о функциях эпигенетических систем и их роли в развитии мозга и заболеваниях. Динамическая природа эпигенетических механизмов может иметь важное значение при рассмотрении возможности терапевтических вмешательств, поэтому мы делаем вывод о текущих доказательствах этой новой области исследований для лечения психических заболеваний.
Таким образом, мы сосредоточимся на клинических исследованиях и исследованиях на животных, в которых изучалось, как биологические стрессовые системы, особенно ось HPA, формируются под воздействием неблагоприятных обстоятельств, а затем даем описание того, что мы знаем о функциях эпигенетических систем и их роли в развитии мозга и заболеваниях. Динамическая природа эпигенетических механизмов может иметь важное значение при рассмотрении возможности терапевтических вмешательств, поэтому мы делаем вывод о текущих доказательствах этой новой области исследований для лечения психических заболеваний.
Детство решает
Зигмунд Фрейд постулировал, что травма рождения – нарушение физического симбиоза между плодом и матерью – становится центральной силой в нашей взрослой жизни. Этот страх и опыт покинутости — глубоко укоренившаяся тема в психологии. По мнению Боулби (1982), процессы привязанности занимают центральное место в понимании тревожности, о чем свидетельствуют его многолетние исследования детей и их привязанностей к тем, кто за ними ухаживает, когда младенцы демонстрируют дистресс в связи с надвигающимся уходом матери, как только они становятся достаточно взрослыми, чтобы чувствовать признаки того, что она уходит – около 6–9месяцев (Сартр, 1964).
Было высказано предположение, что внешняя регуляция матерью развивающихся незрелых эмоциональных систем младенца в отдельные критические периоды может представлять собой существенный фактор, влияющий на зависимый от опыта рост областей и структур мозга, важных для регуляции настроения и поведения. Следовательно, поведение привязанности можно рассматривать как биологическую систему, взаимосвязанную с системой страха и стресса, развившуюся специально для увеличения вероятности близости младенца и родителя, что, в свою очередь, обеспечивает повышенные шансы младенца на выживание. Действительно, система привязанности активизируется особенно во время стресса, и доступность объекта привязанности, такого как мать, оказывает большое влияние на снижение страха ребенка (обзор см. в Schore, 2000). Однако частые или длительные приступы отказа могут привести к тому, что стресс станет частью личности младенца, а затем и взрослого человека. К сожалению, такие ситуации слишком распространены, когда младенцы не могут сформировать привязанность либо из-за того, что их воспитывают без стимуляции и внимания со стороны постоянного опекуна, либо из-за жестокого обращения или крайнего пренебрежения; по самым скромным оценкам, каждый год в Соединенных Штатах более 1 000 000 детей подвергаются таким условиям (Sedlak and Broadhurst, 19). 96). Возможными краткосрочными последствиями этого являются гнев, отчаяние, отчужденность и временная задержка интеллектуального развития, в то время как долгосрочные последствия могут включать психосоматические расстройства и повышенный риск депрессии или тревоги.
96). Возможными краткосрочными последствиями этого являются гнев, отчаяние, отчужденность и временная задержка интеллектуального развития, в то время как долгосрочные последствия могут включать психосоматические расстройства и повышенный риск депрессии или тревоги.
Исследования детей, воспитанных в специализированных учреждениях, сыграли важную роль в понимании долгосрочных последствий социальной депривации в детстве и выявили наличие когнитивного, социального и физического дефицита (например, Rutter, 1998), что дает веские основания рассматривать эмоциональную запущенность как основной провоцирующий фактор (см. обзор Tarullo and Gunnar, 2006). Эти наблюдения согласуются с мнением о том, что ранние социальные взаимодействия играют значительную роль в развитии основных аффективных процессов, поддерживая обучение через связи между сигналами, ситуациями и эмоциональными переживаниями. В подтверждение этому, постинституционализированные дети демонстрируют значительные трудности с сопоставлением соответствующих выражений лица со сценариями счастья, грусти и страха (Fries and Pollak, 2004).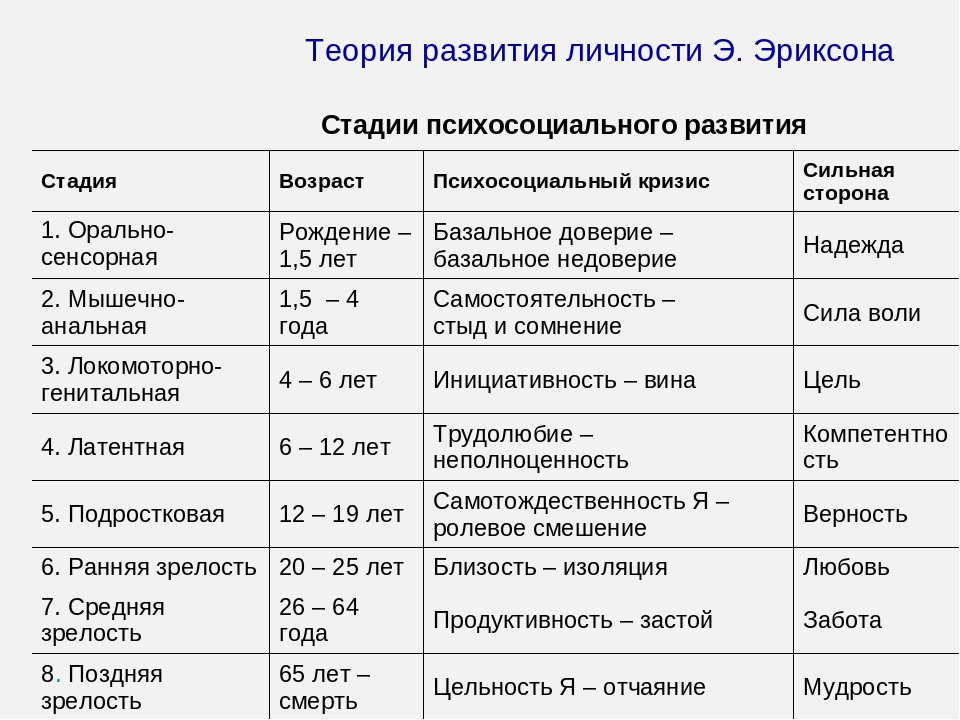 Отчеты о постинституционализированных детях из Румынии показывают развитие трудностей в формировании эмоциональной привязанности к приемным опекунам, что обеспечивает дополнительное подтверждение конструкции расстройства привязанности; кроме того, у этих детей наблюдаются нерегулярные скорости метаболизма глюкозы в областях мозга, контролирующих когнитивные и эмоциональные функции, и повышенная активность оси HPA, связанная с продолжительностью пребывания в постнатальной среде такого типа (например, O’Connor and Rutter, 2000). Эти результаты подтверждаются лонгитюдными исследованиями жестокого обращения и пренебрежения, которые указывают на повышенный риск когнитивных нарушений, социальных и эмоциональных трудностей, а также риск психических и соматических заболеваний, при этом у тех, кто позже проявляет посттравматическое стрессовое расстройство, обнаруживаются меньшие мозжечковые и церебральные объемы, коррелирующие с более ранним началом и увеличение продолжительности жестокого обращения (например, De Bellis and Kuchibhatla, 2006).
Отчеты о постинституционализированных детях из Румынии показывают развитие трудностей в формировании эмоциональной привязанности к приемным опекунам, что обеспечивает дополнительное подтверждение конструкции расстройства привязанности; кроме того, у этих детей наблюдаются нерегулярные скорости метаболизма глюкозы в областях мозга, контролирующих когнитивные и эмоциональные функции, и повышенная активность оси HPA, связанная с продолжительностью пребывания в постнатальной среде такого типа (например, O’Connor and Rutter, 2000). Эти результаты подтверждаются лонгитюдными исследованиями жестокого обращения и пренебрежения, которые указывают на повышенный риск когнитивных нарушений, социальных и эмоциональных трудностей, а также риск психических и соматических заболеваний, при этом у тех, кто позже проявляет посттравматическое стрессовое расстройство, обнаруживаются меньшие мозжечковые и церебральные объемы, коррелирующие с более ранним началом и увеличение продолжительности жестокого обращения (например, De Bellis and Kuchibhatla, 2006). Кроме того, во взрослом возрасте опыт жестокого обращения или пренебрежения в детстве тесно связан с повышенной активностью оси HPA (например, Carpenter et al., 2010).
Кроме того, во взрослом возрасте опыт жестокого обращения или пренебрежения в детстве тесно связан с повышенной активностью оси HPA (например, Carpenter et al., 2010).
Невзгоды в раннем возрасте формируют ось HPA
При воздействии стрессора организм активирует системы стресса, чтобы подготовиться к событиям, которые могут угрожать благополучию или выживанию. Вегетативная нервная система инициирует быструю и относительно кратковременную реакцию «сражайся или беги», в то время как гипоталамо-гипофизарно-надпочечниковая система работает медленнее, вызывая более продолжительную реакцию. Таким образом, ось HPA является ядром долгосрочной регуляции систем, контролирующих реакцию на стресс.
После воздействия стрессора нейропептиды кортикотропин-рилизинг-гормон (CRH) и аргинин-вазопрессин (AVP) высвобождаются из паравентрикулярного ядра (PVN) гипоталамуса в систему портальных сосудов. Эти нейропептиды связываются и активируют специфические рецепторы (рецепторы CRHR1 и V1b для CRH и AVP соответственно) на кортикотрофных клетках передней доли гипофиза, стимулируя высвобождение адренокортикотропного гормона (АКТГ), который затем действует на кору надпочечников, синтезируя и высвобождая глюкокортикоидные гормоны (кортизол). у приматов и кортикостерона у крыс). Глюкокортикоиды мобилизуют глюкозу из запасов энергии и повышают тонус сердечно-сосудистой системы, среди других широко распространенных эффектов. Петли обратной связи, в первую очередь опосредованные PVN и кортикотрофными клетками гипофиза, через глюкокортикоидные рецепторы (GR) сдерживают реакцию системы HPA, чтобы сбросить систему к исходной активности (рис. 1; для обзора см. De Kloet et al., 19).98). Короче говоря, прямая петля подготавливает организм к предвидению угрозы и оптимальному реагированию на нее, в то время как обратная связь обеспечивает эффективное возвращение к гомеостатическому равновесию, когда ему больше не угрожают.
у приматов и кортикостерона у крыс). Глюкокортикоиды мобилизуют глюкозу из запасов энергии и повышают тонус сердечно-сосудистой системы, среди других широко распространенных эффектов. Петли обратной связи, в первую очередь опосредованные PVN и кортикотрофными клетками гипофиза, через глюкокортикоидные рецепторы (GR) сдерживают реакцию системы HPA, чтобы сбросить систему к исходной активности (рис. 1; для обзора см. De Kloet et al., 19).98). Короче говоря, прямая петля подготавливает организм к предвидению угрозы и оптимальному реагированию на нее, в то время как обратная связь обеспечивает эффективное возвращение к гомеостатическому равновесию, когда ему больше не угрожают.
Рисунок 1. Гипоталамо-гипофизарно-надпочечниковая ось стресса . Нейропептиды кортикотропин-рилизинг-гормон (CRH) и аргинин-вазопрессин (AVP) экспрессируются в парвоцеллюарных нейронах паравентрикулярного ядра гипоталамуса. Совместное высвобождение КРГ и АВП в портальные сосуды приводит к мощной стимуляции секреции АКТГ передней доли гипофиза и, в свою очередь, кортикостерона из надпочечников. Активационному эффекту оси HPA противодействует ингибирующее действие глюкокортикоидных рецепторов, выраженных в гиппокампе, гипоталамусе и передней доле гипофиза.
Активационному эффекту оси HPA противодействует ингибирующее действие глюкокортикоидных рецепторов, выраженных в гиппокампе, гипоталамусе и передней доле гипофиза.
После периодов продолжительного стресса контроль гипоталамо-гипофизарно-надпочечниковой оси с отрицательной обратной связью может стать нерегулируемым, что может лежать в основе развития таких расстройств, как большая депрессия (обзор см. в Holsboer, 2000). Действительно, изменение активности этого контура является одним из наиболее часто наблюдаемых нейроэндокринных симптомов у пациентов, страдающих большим депрессивным расстройством (БДР), а нарушение регуляции секреции кортизола может быть обнаружено у 80% пациентов с депрессией, если субъекты относятся к разным возрастам. диапазоны (Heuser et al., 1994).
В клинических исследованиях было показано, что стресс в раннем возрасте является сильным прогностическим фактором нарушения тормозной обратной связи оси HPA (Heim et al., 2008), что было установлено тестами с дексаметазоном / CRH. Клинические данные дают веские основания предполагать, что депрессия характеризуется гипоталамическим перенапряжением систем КРГ и/или АВП. Посмертные исследования ткани головного мозга выявляют повышенный уровень КРГ (Raadsheer et al., 1994) и АВП (например, Meynen et al., 2006) в гипоталамусе людей с депрессией. Сообщалось, что повышенные концентрации КРГ в спинномозговой жидкости связаны с депрессией, посттравматическим стрессовым расстройством и обсессивно-компульсивным расстройством (например, Bremner et al., 19).97;), в то время как более высокие уровни АВП в плазме отмечаются при депрессии (например, Goekoop et al., 2006). Рецепторы к гормонам также, по-видимому, изменяются при депрессии, при этом в лобной коре обнаруживается уменьшение участков связывания КРГ (Nemeroff et al., 1988) и сниженный ответ АКТГ на КРГ (Rupprecht et al., 1989). Недавнее исследование также показало, что вариации в гене рецептора CRH1 смягчают влияние жестокого обращения в детстве на реакцию кортизола на тест дексаметазон/CRH (Tyrka et al.
Клинические данные дают веские основания предполагать, что депрессия характеризуется гипоталамическим перенапряжением систем КРГ и/или АВП. Посмертные исследования ткани головного мозга выявляют повышенный уровень КРГ (Raadsheer et al., 1994) и АВП (например, Meynen et al., 2006) в гипоталамусе людей с депрессией. Сообщалось, что повышенные концентрации КРГ в спинномозговой жидкости связаны с депрессией, посттравматическим стрессовым расстройством и обсессивно-компульсивным расстройством (например, Bremner et al., 19).97;), в то время как более высокие уровни АВП в плазме отмечаются при депрессии (например, Goekoop et al., 2006). Рецепторы к гормонам также, по-видимому, изменяются при депрессии, при этом в лобной коре обнаруживается уменьшение участков связывания КРГ (Nemeroff et al., 1988) и сниженный ответ АКТГ на КРГ (Rupprecht et al., 1989). Недавнее исследование также показало, что вариации в гене рецептора CRH1 смягчают влияние жестокого обращения в детстве на реакцию кортизола на тест дексаметазон/CRH (Tyrka et al. , 2009).), а скрининг мутаций связал полиморфизмы в генах V1b и AVP с депрессией, начинающейся в детстве (например, Dempster et al., 2009), подтверждая предыдущую доклиническую работу, в которой селективное инбридинг грызунов с высоким уровнем тревожноподобного поведения непреднамеренно обогащает для изменения в гене AVP (Murgatroyd et al., 2004; Kessler et al., 2007; Bunck et al., 2009).
, 2009).), а скрининг мутаций связал полиморфизмы в генах V1b и AVP с депрессией, начинающейся в детстве (например, Dempster et al., 2009), подтверждая предыдущую доклиническую работу, в которой селективное инбридинг грызунов с высоким уровнем тревожноподобного поведения непреднамеренно обогащает для изменения в гене AVP (Murgatroyd et al., 2004; Kessler et al., 2007; Bunck et al., 2009).
Исследования на моделях грызунов показывают, что воздействие хронического стресса может резко изменить баланс между AVP и CRH, контролирующими ось HPA. Например, повторное воздействие стрессора приводит к усилению экспрессии AVP в PVN, увеличению числа нейронов, содержащих CRH, коэкспрессирующих AVP, и повышению уровня мРНК рецептора V1b в гипофизе — данные согласуются с гипотезой о том, что при В условиях устойчивого стресса АВП становится движущей силой в регуляции оси HPA (Aguilera and Rabadan-Diehl, 2000). В качестве дополнительной поддержки in vitro исследований показали, что стимуляция высвобождения АКТГ с помощью АВП менее чувствительна к отрицательной обратной связи глюкокортикоидов по сравнению с реакцией АКТГ на КРГ (например, Bilezikjian et al. , 1987). Таким образом, эти данные свидетельствуют о снижении чувствительности ГР-опосредованной регуляции гипоталамо-гипофизарно-надпочечниковой оси при депрессии, что, по-видимому, является результатом сдвига в сторону увеличения секреции АВП.
, 1987). Таким образом, эти данные свидетельствуют о снижении чувствительности ГР-опосредованной регуляции гипоталамо-гипофизарно-надпочечниковой оси при депрессии, что, по-видимому, является результатом сдвига в сторону увеличения секреции АВП.
Моделирование раннего неблагоприятного опыта
Учитывая, что стресс в раннем возрасте может привести к устойчивому нарушению регуляции оси HPA и тесная связь между дисфункцией HPA и большой депрессией, было высказано предположение, что стресс в раннем возрасте может предрасполагать людей к психическим заболеваниям в более позднем возрасте. Очевидно, существуют этические ограничения для проведения предполагаемых экспериментов со стрессом в раннем возрасте на людях. Таким образом, модели на животных бесценны для понимания поведенческих и физиологических механизмов, лежащих в основе долгосрочных эффектов раннего опыта на эмоциональную реактивность и реакцию на стресс.
Грызуны особенно хорошо подходят для изучения последствий раннего жизненного опыта, поскольку их можно разводить в больших количествах и в контролируемых условиях окружающей среды. Даже весьма незначительные изменения опыта крыс в ранний постнатальный или пренатальный периоды могут вызывать долговременные последствия в поведенческих и эндокринных фенотипах (обзор см. в Holmes et al., 2005). Признавая теории привязанности, многие из этих моделей исследуют неблагоприятные факторы ранней жизни, сосредотачиваясь на выдающихся отношениях матери и ребенка.
Даже весьма незначительные изменения опыта крыс в ранний постнатальный или пренатальный периоды могут вызывать долговременные последствия в поведенческих и эндокринных фенотипах (обзор см. в Holmes et al., 2005). Признавая теории привязанности, многие из этих моделей исследуют неблагоприятные факторы ранней жизни, сосредотачиваясь на выдающихся отношениях матери и ребенка.
Стресс в раннем возрасте
Одной из наиболее широко изученных моделей стресса в раннем возрасте является разлучение с матерью (MS), при котором грызунов разлучают примерно на 3 часа в день в течение первых 2 недель жизни. Является ли точная психологическая причина последствий послеродового стресса рассеянным склерозом прямым следствием самого детеныша или косвенным, хотя манипулирование матерью до сих пор полностью не выяснено: либо имитация материнского поглаживания и кормления в период отделения, либо предоставление маток с приемным пометом в период разлучения со своими щенками могут ослабить влияние рассеянного склероза на более позднюю стрессовую гиперреактивность (например, van Oers et al.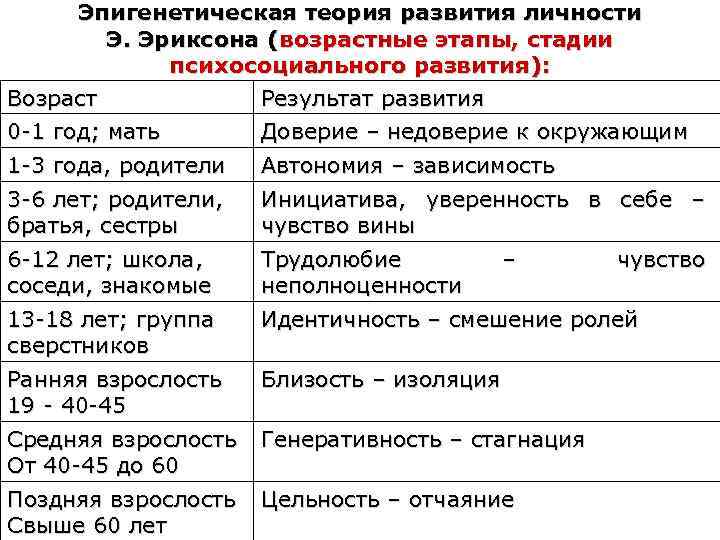 , 1999; Хуот и др., 2004). Эта процедура может привести к стойкому усилению поведения, связанного с тревогой, и пожизненной гиперактивности оси HPA в ответ на стрессоры (для обзора см. Holmes et al., 2005). Стресс в раннем возрасте также может оказывать долгосрочное воздействие на связанные с гиппокампом когнитивные функции и память (например, Eiland and McEwen, 2010), при этом появляется все больше данных, свидетельствующих о том, что эта парадигма может нарушать развитие нейронных систем, опосредующих поведение, связанное с вознаграждением, о чем свидетельствует увеличение добровольное потребление этанола и преувеличенная реакция на психостимуляторы (например, Lopez et al., 2010), поддерживая концепцию о том, что привязанность матери и ребенка является поведением, опосредованным вознаграждением (например, Moles et al., 2004).
, 1999; Хуот и др., 2004). Эта процедура может привести к стойкому усилению поведения, связанного с тревогой, и пожизненной гиперактивности оси HPA в ответ на стрессоры (для обзора см. Holmes et al., 2005). Стресс в раннем возрасте также может оказывать долгосрочное воздействие на связанные с гиппокампом когнитивные функции и память (например, Eiland and McEwen, 2010), при этом появляется все больше данных, свидетельствующих о том, что эта парадигма может нарушать развитие нейронных систем, опосредующих поведение, связанное с вознаграждением, о чем свидетельствует увеличение добровольное потребление этанола и преувеличенная реакция на психостимуляторы (например, Lopez et al., 2010), поддерживая концепцию о том, что привязанность матери и ребенка является поведением, опосредованным вознаграждением (например, Moles et al., 2004).
Выяснение нейроэндокринных изменений, лежащих в основе стойких последствий стресса в раннем возрасте у грызунов, стало важной областью исследований. Растущее число сообщений документально подтверждает постоянное увеличение нейротрансмиссии и гипоталамической экспрессии КРГ (например, Vazquez et al. , 2006) и AVP (например, Veenema et al., 2006) после стресса в раннем возрасте. Кроме того, способность ГР гиппокампа ослаблять ось HPA может быть постоянно нарушена; крысы, подвергшиеся постнатальному рассеянному склерозу, демонстрируют значительно сниженную экспрессию GR переднего мозга и нарушение синтеза синтетического глюкокортикоида дексаметазона для подавления активности оси HPA у взрослых (например, Ladd et al., 2004).
, 2006) и AVP (например, Veenema et al., 2006) после стресса в раннем возрасте. Кроме того, способность ГР гиппокампа ослаблять ось HPA может быть постоянно нарушена; крысы, подвергшиеся постнатальному рассеянному склерозу, демонстрируют значительно сниженную экспрессию GR переднего мозга и нарушение синтеза синтетического глюкокортикоида дексаметазона для подавления активности оси HPA у взрослых (например, Ladd et al., 2004).
Уход в раннем возрасте
Более короткие периоды разлуки у грызунов (например, 15 минут) или «обработка», по-видимому, вызывают качественные изменения в материнской заботе и, следовательно, оказывают противоположное влияние на поведенческие реакции и реакции, связанные со стрессом. к рассеянному склерозу, то есть снижение тревожности и ослабление реакции оси HPA на стресс при тестировании у взрослых (для обзора см. Fernández-Teruel et al., 2002). Этот результат подтверждает так называемую гипотезу «материнского посредничества» (Smotherman et al., 19). 74), при котором «эмоциональное состояние» матери запечатлевает состояние потомства.
74), при котором «эмоциональное состояние» матери запечатлевает состояние потомства.
Действительно, существует прямая связь между различиями в уровне материнской заботы и развитием индивидуальных различий в поведенческих и нейроэндокринных реакциях потомства на стресс. В частности, высокий уровень материнской заботы, по-видимому, напрямую связан со сниженной поведенческой и нейроэндокринной реакцией потомства на новизну (Liu et al., 1997). Данные, полученные на моделях грызунов, показывают, что долгосрочные эффекты манипуляций, по-видимому, зависят от изменений в дифференцировке тех нейронов, которые, как известно, ограничивают реакцию на стресс (Meaney et al., 19).96). Эти изменения включают увеличение экспрессии GR в гиппокампе, области, сильно вовлеченной в регуляцию глюкокортикоидной обратной связи, и снижение уровней гипоталамического CRH (Plotsky and Meaney, 1993).
Модели высших приматов
Приматы представляют особый интерес для изучения роли влияния окружающей среды в раннем возрасте; большая часть психопатологии вращается вокруг социальных функций, и, по сравнению с грызунами, нечеловеческие приматы демонстрируют сложное социальное поведение и структуры, напоминающие человеческие. Связь мать-младенец у приматов является наиболее фундаментальной ранней связью, и поэтому детеныши приматов демонстрируют удивительное сходство с людьми после разлуки с матерью, при этом хроническая и устойчивая разлука в младенчестве приводит к тревожному поведению, когнитивным нарушениям и долговременному развитию. срочные изменения оси HPA (например, Sanchez et al., 2010). Также возможно использовать более тонкие манипуляции в раннем жизненном опыте приматов. В одном исследовании повышенный стресс у матери из-за непредсказуемого нарушения доступности пищи во время кормления. Такие трудности привели к тому, что у младенцев развивались повышенные концентрации CRH в спинномозговой жидкости, сниженный уровень кортизола и боязливое поведение по сравнению с младенцами из контрольной группы. Кроме того, при наблюдении в юношеском возрасте концентрации CRH оставались повышенными, что указывает на то, что даже относительно кратковременные нарушения отношений мать-младенец могут вызвать длительные изменения в системах реакции на стресс у обезьян (Coplan et al.
Связь мать-младенец у приматов является наиболее фундаментальной ранней связью, и поэтому детеныши приматов демонстрируют удивительное сходство с людьми после разлуки с матерью, при этом хроническая и устойчивая разлука в младенчестве приводит к тревожному поведению, когнитивным нарушениям и долговременному развитию. срочные изменения оси HPA (например, Sanchez et al., 2010). Также возможно использовать более тонкие манипуляции в раннем жизненном опыте приматов. В одном исследовании повышенный стресс у матери из-за непредсказуемого нарушения доступности пищи во время кормления. Такие трудности привели к тому, что у младенцев развивались повышенные концентрации CRH в спинномозговой жидкости, сниженный уровень кортизола и боязливое поведение по сравнению с младенцами из контрольной группы. Кроме того, при наблюдении в юношеском возрасте концентрации CRH оставались повышенными, что указывает на то, что даже относительно кратковременные нарушения отношений мать-младенец могут вызвать длительные изменения в системах реакции на стресс у обезьян (Coplan et al. , 2001).
, 2001).
Новые ответы на старые вопросы
Вышеупомянутые исследования показывают, что различные аспекты ранней среды могут привести к резким изменениям в траекториях развития нервной системы и привести к дифференцированному риску физических и психических расстройств. Тем не менее, остается вопрос, как воздействие стресса в раннем возрасте может вызвать такие стойкие изменения в нейронных субстратах, гормональной регуляции и поведенческих реакциях у взрослых?
Клетки многоклеточного организма генетически идентичны, но структурно и функционально различны из-за дифференциальной экспрессии генов. Многие из этих различий в экспрессии генов возникают во время развития и впоследствии сохраняются в ходе митоза. Термин эпигенетика в настоящее время обычно используется для описания изучения стабильных изменений в потенциале экспрессии генов, которые возникают во время развития, дифференцировки и под влиянием окружающей среды (для обзора см. Jaenisch and Bird, 2003). В отличие от последовательностей ДНК, идентичных во всех тканях, паттерны эпигенетических меток тканеспецифичны. Следовательно, можно считать, что геном содержит два уровня информации: последовательность ДНК, унаследованную от наших родителей, которая сохраняется на протяжении всей жизни и в основном идентична во всех клетках и тканях нашего тела, и эпигенетические метки (т. е. паттерны метилирования хроматина и ДНК). которые являются клеточно- и тканеспецифичными.
Следовательно, можно считать, что геном содержит два уровня информации: последовательность ДНК, унаследованную от наших родителей, которая сохраняется на протяжении всей жизни и в основном идентична во всех клетках и тканях нашего тела, и эпигенетические метки (т. е. паттерны метилирования хроматина и ДНК). которые являются клеточно- и тканеспецифичными.
Таким образом, эпигенетическая регуляция экспрессии генов позволяет интегрировать внутренние сигналы и сигналы окружающей среды в геном, тем самым облегчая адаптацию организма к изменяющейся среде посредством изменений активности генов. Таким образом, эпигенетику можно рассматривать как придающую дополнительную пластичность жестко запрограммированному геному. В контексте ранней жизни эпигенетические изменения предлагают вероятный механизм, с помощью которого ранний опыт может быть интегрирован в геном для программирования гормональных и поведенческих реакций взрослых.
Эпигеном относится к ансамблю скоординированных эпигенетических меток, которые определяют доступность ДНК для механизмов, управляющих экспрессией генов; недоступные гены молчат, тогда как доступные гены активно транскрибируются. Хотя понимание взаимодействия между эпигенетическими модификациями все еще развивается, модификация основных гистонов, которые упаковывают ДНК в хроматин, и метилирование ДНК в боковой цепи цитозина в цитозин-гуаниновых (CpG) динуклеотидах представляют собой наиболее изученные эпигенетические метки. Фигура 2).
Хотя понимание взаимодействия между эпигенетическими модификациями все еще развивается, модификация основных гистонов, которые упаковывают ДНК в хроматин, и метилирование ДНК в боковой цепи цитозина в цитозин-гуаниновых (CpG) динуклеотидах представляют собой наиболее изученные эпигенетические метки. Фигура 2).
Рис. 2. ДНК наматывается на гистоны с образованием комплекса, называемого хроматином . N-концевые хвосты гистонов служат сайтами для эпигенетической маркировки путем ацетилирования и метилирования с помощью ферментов ремоделирования хроматина (например, HDAC, HAT, HMT и HDM). Метилирование ДНК относится к химическому переносу метильных групп на акцепторные сайты CpG с помощью класса ферментов, известных как ДНК-метилтрансферазы (DNMT). Активные метки (например, ацетилирование гистонов и гипометилирование ДНК) характеризуют «открытый» хроматин, в то время как репрессивные метки (например, метилирование гистонов и гиперметилирование ДНК) встречаются в «закрытом» хроматине.
Подписи гистонов
Хроматин относится к комплексу ДНК, обернутому вокруг гистоновых белков с образованием нуклеосом. Эти гистоновые белки сильно модифицированы на своих N-концевых концах за счет метилирования, фосфорилирования, ацетилирования и убиквитинирования как часть гистоновой сигнатуры, служащей для определения доступности ДНК; плотно упакованный «закрытый» хроматин называется гетерохроматином, тогда как доступный «открытый» хроматин называется эухроматином (Jenuwein and Allis, 2001). Известно, что ацетилирование гистонов является преобладающим сигналом для активных конфигураций хроматина, в то время как некоторые специфические реакции метилирования гистонов связаны либо с молчанием, либо с активацией генов. Ключом к этому ремоделированию хроматина являются ферменты, модифицирующие гистоны, такие как ацетилтрансферазы гистонов (HAT), которые ацетилируют хвосты гистонов, деацетилазы гистонов (HDAC), которые деацетилируют, и деметилазы гистонов, которые удаляют метилирование. Эти ферменты, модифицирующие гистоны, обычно рекрутируются посредством взаимодействия со специфическими факторами транскрипции, которые распознают и связываются с определенными цис-действующими последовательностями в генах. Таким образом, сигнальные пути, регистрирующие условия окружающей среды и управляющие активностью факторов транскрипции, могут служить проводниками для связывания переживаний с эпигенетическими модификациями генов.
Эти ферменты, модифицирующие гистоны, обычно рекрутируются посредством взаимодействия со специфическими факторами транскрипции, которые распознают и связываются с определенными цис-действующими последовательностями в генах. Таким образом, сигнальные пути, регистрирующие условия окружающей среды и управляющие активностью факторов транскрипции, могут служить проводниками для связывания переживаний с эпигенетическими модификациями генов.
Метилирование ДНК – звук тишины
Метилирование ДНК относится к химическому переносу метильной группы в положение 5 цитозиновых колец, обычно в контексте динуклеотидных последовательностей CpG, и обычно приводит к молчанию генов. Поскольку метилирование ДНК представляет собой ковалентную связь, считается, что оно более стабильно, чем другие эпигенетические метки. Такие последовательности CpG заметно недопредставлены в геномах млекопитающих, причем более 85% из них расположены в повторяющихся последовательностях, разбросанных по всему геному и сильно гиперметилированы, что, возможно, играет решающую роль в подавлении этих элементов и, таким образом, в поддержании целостности генома. Остальные ∼15% динуклеотидов CpG обычно кластеризуются в богатых GC областях, известных как «островки CpG», которые располагаются внутри или вокруг промоторов примерно 40% генов в геноме (обзор см. в Illingworth and Bird, 2009).). Составляя около 1% генома, эти островки CpG в значительной степени неметилированы в нормальных соматических клетках, в то время как области, демонстрирующие более низкую плотность CpG, чаще метилированы (Weber et al., 2007). В целом паттерны метилирования, как правило, коррелируют со структурой хроматина, т. е. активные области хроматина связаны с гипометилированной ДНК, тогда как гиперметилированная ДНК упакована в неактивный хроматин (Razin and Cedar, 1977).
Остальные ∼15% динуклеотидов CpG обычно кластеризуются в богатых GC областях, известных как «островки CpG», которые располагаются внутри или вокруг промоторов примерно 40% генов в геноме (обзор см. в Illingworth and Bird, 2009).). Составляя около 1% генома, эти островки CpG в значительной степени неметилированы в нормальных соматических клетках, в то время как области, демонстрирующие более низкую плотность CpG, чаще метилированы (Weber et al., 2007). В целом паттерны метилирования, как правило, коррелируют со структурой хроматина, т. е. активные области хроматина связаны с гипометилированной ДНК, тогда как гиперметилированная ДНК упакована в неактивный хроматин (Razin and Cedar, 1977).
В митотически активных клетках метилирование ДНК не копируется механизмом репликации ДНК, а поддерживается ферментами ДНК-метилтрансферазами (DNMT), которые используют S -аденозилметионин в качестве донора метила. Механизм метилирования ДНК сначала должен установить новые паттерны метилирования ДНК, специфичные для типа клеток, во время развития и, возможно, во взрослом состоянии в ответ на новые сигналы. Эти паттерны должны обновляться, когда клетки подвергаются делению, то есть дублируют свой геном. Из трех ДНК-метилтрансфераз, идентифицированных у млекопитающих, DNMT1 отдает предпочтение гемиметилированной ДНК in vitro , что согласуется с ее ролью в качестве поддерживающей DNMT, в то время как DNMT3a и DNMT3b могут метилировать неметилированную ДНК, поддерживающую роль .0124 de novo метилазы. Активность этих ферментов имеет решающее значение для огромного количества программ развития у млекопитающих и, следовательно, строго регулируется. Во время раннего эмбриогенеза эпигенетическое молчание генов как материнского, так и отцовского происхождения происходит преимущественно за счет активности метилирования ДНК «поддерживающей» метилтрансферазы DNMT1, в то время как дальнейшая тканеспецифическая экспрессия генов и метилирование ДНК во время более позднего постнатального развития требуют также активности «9».0124 de novo» метилтрансфераз DNMT3a и DNMT3b (обзор см.
Эти паттерны должны обновляться, когда клетки подвергаются делению, то есть дублируют свой геном. Из трех ДНК-метилтрансфераз, идентифицированных у млекопитающих, DNMT1 отдает предпочтение гемиметилированной ДНК in vitro , что согласуется с ее ролью в качестве поддерживающей DNMT, в то время как DNMT3a и DNMT3b могут метилировать неметилированную ДНК, поддерживающую роль .0124 de novo метилазы. Активность этих ферментов имеет решающее значение для огромного количества программ развития у млекопитающих и, следовательно, строго регулируется. Во время раннего эмбриогенеза эпигенетическое молчание генов как материнского, так и отцовского происхождения происходит преимущественно за счет активности метилирования ДНК «поддерживающей» метилтрансферазы DNMT1, в то время как дальнейшая тканеспецифическая экспрессия генов и метилирование ДНК во время более позднего постнатального развития требуют также активности «9».0124 de novo» метилтрансфераз DNMT3a и DNMT3b (обзор см. Turek-Plewa and Jagodziński, 2005).
Turek-Plewa and Jagodziński, 2005).
В общем, конечной точкой обоих процессов метилирования ДНК является либо долгосрочное замалчивание, либо тонкая настройка потенциала экспрессии генов. Хотя метилированные CpG-динуклеотиды могут прямо вмешиваться в связывание фактора транскрипции, большинство эффектов репрессии, по-видимому, происходит косвенно, посредством рекрутирования белков метил-CpG-связывающего домена (MBD) и связанных с ними репрессорных комплексов (для обзора см. Jørgensen and Bird, 2002). Семейство белков MBD, включающее MBD1, MBD2, MBD3, MBD4 и Kaiso в дополнение к члену-основателю MeCP2, собирается по меткам метилирования, чтобы обеспечить платформу для набора корепрессорных комплексов, включая HDAC, которые могут перезаписывать гистоновые метки, вызывая последующее уплотнение хроматина и подавление транскрипции. Эти комплексы могут дополнительно рекрутировать DNMT для стимуляции, поддержания и усиления репрессии генов, что совместимо с взаимным взаимодействием между метилированием ДНК и хроматиновыми метками в регуляции транскрипции генов.
Хотя промоторные и энхансерные области, по-видимому, привлекают наибольшее внимание в отношении метилирования ДНК и транскрипции генов, становится все более очевидным, что метилирование других генных элементов играет важную регуляторную роль. Например, повышенное метилирование ДНК в теле генов обычно связано с активной транскрипцией (Ball et al., 2009), в то время как метилирование ДНК в 3′- и внутригенных областях может играть различную роль в регуляции экспрессии генов (для обзора см. Suzuki and Bird , 2008), возможно, контролирующих активность внутригенных некодирующих РНК. Некодирующие РНК представляют собой функциональные молекулы РНК, которые не транслируются в белок и могут участвовать в различных РНК-опосредованных путях сайленсинга, при этом появляется все больше данных, указывающих на то, что регуляция этих факторов может играть ключевую роль в развитии нервной системы и нейропсихиатрических расстройствах. обзор см. в Qureshi and Mehler, 2010).
Наконец, новая эпигенетическая метка, 5-гидроксиметилцитозин, была недавно обнаружена и провозглашена «6 th base». Эта модификация динуклеотидов CpG, по-видимому, особенно распространена в головном мозге человека и мыши и увеличивается при старении в гиппокампе и мозжечке мыши (например, Song et al., 2011). Учитывая, что он может быть получен путем ферментативного окисления метилированных остатков цитозина, представляется возможным, что такие модификации могут регулировать экспрессию генов, хотя любая возможная роль в развитии или функционировании мозга еще предстоит подробно изучить.
Эта модификация динуклеотидов CpG, по-видимому, особенно распространена в головном мозге человека и мыши и увеличивается при старении в гиппокампе и мозжечке мыши (например, Song et al., 2011). Учитывая, что он может быть получен путем ферментативного окисления метилированных остатков цитозина, представляется возможным, что такие модификации могут регулировать экспрессию генов, хотя любая возможная роль в развитии или функционировании мозга еще предстоит подробно изучить.
Новая роль эпигенетики в психическом здоровье
Миллиарды нейронов в одном мозгу имеют одинаковую последовательность ДНК, но различаются по своим разнообразным функциям посредством эпигенетического программирования в пре- и постнатальном развитии и, возможно, на протяжении всей жизни. Таким образом, эпигенетические механизмы являются привратниками развития, дифференцировки и созревания мозга и, в конечном счете, связанных с ними болезненных процессов.
Генетические дефекты эпигенетического механизма
Нарушение регуляции эпигенетических путей может привести либо к молчанию, либо к неадекватной экспрессии специфических наборов генов, проявляющихся заболеваниями. Растущее понимание в этой области ведет к выявлению растущего числа эпигенетических заболеваний, включающих различные виды рака, нейродегенеративные заболевания, синдромы, характеризующиеся хромосомной нестабильностью, умственной отсталостью и нарушениями импринтинга (обзор см. Halusková, 2010).
Растущее понимание в этой области ведет к выявлению растущего числа эпигенетических заболеваний, включающих различные виды рака, нейродегенеративные заболевания, синдромы, характеризующиеся хромосомной нестабильностью, умственной отсталостью и нарушениями импринтинга (обзор см. Halusková, 2010).
В нервной системе эпигенетические метки управляют основными клеточными процессами, такими как синаптическая пластичность, и сложным поведением, таким как память и обучение. Генетические дефекты в эпигенетическом механизме, запускающие неправильную маркировку, могут приводить к серьезным дефектам развития мозга и проявляться в виде разрушительных заболеваний, таких как синдром Ретта, синдром Рубинштейна-Тейби, синдром ломкой Х-хромосомы, болезнь Альцгеймера, болезнь Хантингтона и психические расстройства, такие как как аутизм, шизофрения, зависимость и депрессия (обзор см. в Графодатской и др., 2010).
Существует большое количество генов, кодирующих эпигенетические регуляторы, мутация которых может привести к умственной отсталости. Хотя можно предположить, что различные эпигенетические факторы будут управлять экспрессией большого количества потенциально неродственных генов, нарушения в различных эпигенетических регуляторах, по-видимому, приводят к симптоматически сходным синдромам умственной отсталости (Kramer and van Bokhoven, 2009). Следовательно, возможно, что умственная отсталость коренится не в изменениях конкретного гена(ов)-мишени, а в неспособности соответствующих нейронов адекватно реагировать на сигналы окружающей среды в условиях сильно искаженного транскрипционного гомеостаза (Ramocki and Zoghbi, 2008).
Хотя можно предположить, что различные эпигенетические факторы будут управлять экспрессией большого количества потенциально неродственных генов, нарушения в различных эпигенетических регуляторах, по-видимому, приводят к симптоматически сходным синдромам умственной отсталости (Kramer and van Bokhoven, 2009). Следовательно, возможно, что умственная отсталость коренится не в изменениях конкретного гена(ов)-мишени, а в неспособности соответствующих нейронов адекватно реагировать на сигналы окружающей среды в условиях сильно искаженного транскрипционного гомеостаза (Ramocki and Zoghbi, 2008).
Одной из наиболее частых причин умственной отсталости у женщин является синдром Ретта, прогрессирующее нарушение развития нервной системы, возникающее в результате мутаций в метил-CpG-связывающем белке MeCP2, расположенном на Х-хромосоме. Интересно, что менее разрушительные генные мутации или изменения в экспрессии этого гена, по-видимому, также лежат в основе некоторых случаев аутизма (см. обзор Gonzales and LaSalle, 2010), наряду с другими членами семейства MBD в небольшом числе случаев (Cukier et al. ., 2010). Другая тяжелая, сцепленная с Х-хромосомой форма умственной отсталости (ATRX; альфа-талассемия/синдром умственной отсталости, сцепленная с Х-хромосомой) возникает в результате мутаций гена, кодирующего члена подгруппы SNF2 надсемейства белков, участвующих в ремоделировании хроматина (Picketts et al. , 1996). Дальнейшие дефекты, влияющие на белки, участвующие в модификации гистонов, ведущие к умственной отсталости, — это мутации CBP, белка с функцией HAT, лежащие в основе синдрома Рубинштейна-Тайби (Petrij et al., 1995), и изменения в RSK2, участвующие в фосфорилировании гистонов и взаимодействии с CBP. приводя к синдрому Коффина-Лоури, Х-сцепленному расстройству умственной отсталости, характеризующемуся задержкой психомоторного развития и роста (Hanauer and Young, 2002). Дефекты в белках, важных для метилирования гистонов, включают h4K4-специфическую гистондеметилазу JARIDIC, приводящую к умственной отсталости, сцепленной с Х-хромосомой (Jensen et al., 2005), домен набора ядерных рецепторов, содержащий ген белка 1 (NSD1), вызывающий синдром Сотоса и синдром Уивера.
., 2010). Другая тяжелая, сцепленная с Х-хромосомой форма умственной отсталости (ATRX; альфа-талассемия/синдром умственной отсталости, сцепленная с Х-хромосомой) возникает в результате мутаций гена, кодирующего члена подгруппы SNF2 надсемейства белков, участвующих в ремоделировании хроматина (Picketts et al. , 1996). Дальнейшие дефекты, влияющие на белки, участвующие в модификации гистонов, ведущие к умственной отсталости, — это мутации CBP, белка с функцией HAT, лежащие в основе синдрома Рубинштейна-Тайби (Petrij et al., 1995), и изменения в RSK2, участвующие в фосфорилировании гистонов и взаимодействии с CBP. приводя к синдрому Коффина-Лоури, Х-сцепленному расстройству умственной отсталости, характеризующемуся задержкой психомоторного развития и роста (Hanauer and Young, 2002). Дефекты в белках, важных для метилирования гистонов, включают h4K4-специфическую гистондеметилазу JARIDIC, приводящую к умственной отсталости, сцепленной с Х-хромосомой (Jensen et al., 2005), домен набора ядерных рецепторов, содержащий ген белка 1 (NSD1), вызывающий синдром Сотоса и синдром Уивера. Tatton-Brown and Rahman, 2007), ген гистон-лизинметилтрансферазы GLP/EHMT1, характеризующийся тяжелой умственной отсталостью (Kleefstra et al., 2006), и, наконец, MLLl, h4K4-специфичная метилтрансфераза, участвующая в синаптической пластичности гиппокампа, которая может лежать в основе корковая дисфункция в некоторых случаях шизофрении (обзор см. Akbarian and Huang, 2009).). Развитие часто тяжелой умственной отсталости при этих синдромах подтверждает важность функционального эпигенетического механизма в регуляции раннего развития мозга. В дальнейшем можно было ожидать, что нарушения в регуляции и экспрессии различных эпигенетических компонентов могут затем привести к дальнейшим психическим патологиям.
Tatton-Brown and Rahman, 2007), ген гистон-лизинметилтрансферазы GLP/EHMT1, характеризующийся тяжелой умственной отсталостью (Kleefstra et al., 2006), и, наконец, MLLl, h4K4-специфичная метилтрансфераза, участвующая в синаптической пластичности гиппокампа, которая может лежать в основе корковая дисфункция в некоторых случаях шизофрении (обзор см. Akbarian and Huang, 2009).). Развитие часто тяжелой умственной отсталости при этих синдромах подтверждает важность функционального эпигенетического механизма в регуляции раннего развития мозга. В дальнейшем можно было ожидать, что нарушения в регуляции и экспрессии различных эпигенетических компонентов могут затем привести к дальнейшим психическим патологиям.
Изменения в эпигенетической регуляции
Растет число исследований, указывающих на аберрантные эпигенетические признаки в развитии психических патологий в более позднем возрасте, хотя остаются важными вопросы, возникают ли изменения в раннем развитии или в более позднем возрасте в ответ на воздействие окружающей среды. . Например, гипометилирование ДНК на промоторе гена катехол-9Было обнаружено, что 0124 O -метилтрансфераза (COMT), фермент, регулирующий уровень дофамина, связана с шизофренией и биполярным расстройством (Abdolmaleky et al., 2006). В ряде исследований промоторной области гена RELN , кодирующего белок, участвующий в долговременной памяти, было обнаружено гиперметилирование, коррелирующее со снижением экспрессии при шизофрении (например, Grayson et al., 2005). В лобно-полярной коре дополнительное исследование обнаружило гиперметилирование ДНК в области промотора субъединицы альфа1 рецептора гамма-аминомасляной кислоты (ГАМК-А) в суицидальном и MDD мозге, которое коррелировало с измененной экспрессией мРНК DNMT (Poulter et al., 2008), в то время как в другом исследовании сообщалось об изменениях метилирования ДНК и экспрессии мРНК гена Peptidylprolyl isomerase E-like (PPIEL) у монозиготных близнецов, дискордантных по биполярному расстройству (Kuratomi et al., 2008).
. Например, гипометилирование ДНК на промоторе гена катехол-9Было обнаружено, что 0124 O -метилтрансфераза (COMT), фермент, регулирующий уровень дофамина, связана с шизофренией и биполярным расстройством (Abdolmaleky et al., 2006). В ряде исследований промоторной области гена RELN , кодирующего белок, участвующий в долговременной памяти, было обнаружено гиперметилирование, коррелирующее со снижением экспрессии при шизофрении (например, Grayson et al., 2005). В лобно-полярной коре дополнительное исследование обнаружило гиперметилирование ДНК в области промотора субъединицы альфа1 рецептора гамма-аминомасляной кислоты (ГАМК-А) в суицидальном и MDD мозге, которое коррелировало с измененной экспрессией мРНК DNMT (Poulter et al., 2008), в то время как в другом исследовании сообщалось об изменениях метилирования ДНК и экспрессии мРНК гена Peptidylprolyl isomerase E-like (PPIEL) у монозиготных близнецов, дискордантных по биполярному расстройству (Kuratomi et al., 2008).
Пары монозиготных близнецов имеют практически идентичный геном, хотя могут в различной степени различаться в пре- и постнатальной среде, что делает их очень информативными для понимания того, как эпигенетические вариации могут влиять на сложные признаки (обзор см. в Bell and Spector, 2011). Действительно, близнецы часто различаются по распространенности психических расстройств: в ряде исследований сообщается о различиях в метилировании ДНК между монозиготными близнецами, дискордантными по шизофрении (например, Petronis et al., 2003), а в более позднем отчете обнаружены более низкие уровни метилирования ДНК в височная кора близнецов с болезнью Альцгеймера (Mastroeni et al., 2009).). Дальнейший полногеномный скрининг выявил значительную вариабельность метилирования ДНК между близнецами (Kaminsky et al., 2009), что может быть связано с более ранними выводами, в которых было показано, что профили метилирования ДНК молодых пар монозиготных близнецов эпигенетически более сходны, чем более старые. монозиготные близнецы (Fraga et al., 2005). Следовательно, это предполагает, что эпигенетические изменения увеличиваются с возрастом, следуя мнению, что эпигенетические механизмы, такие как метилирование ДНК, ухудшаются с возрастом и могут даже ускорять процесс старения (Murgatroyd et al.
в Bell and Spector, 2011). Действительно, близнецы часто различаются по распространенности психических расстройств: в ряде исследований сообщается о различиях в метилировании ДНК между монозиготными близнецами, дискордантными по шизофрении (например, Petronis et al., 2003), а в более позднем отчете обнаружены более низкие уровни метилирования ДНК в височная кора близнецов с болезнью Альцгеймера (Mastroeni et al., 2009).). Дальнейший полногеномный скрининг выявил значительную вариабельность метилирования ДНК между близнецами (Kaminsky et al., 2009), что может быть связано с более ранними выводами, в которых было показано, что профили метилирования ДНК молодых пар монозиготных близнецов эпигенетически более сходны, чем более старые. монозиготные близнецы (Fraga et al., 2005). Следовательно, это предполагает, что эпигенетические изменения увеличиваются с возрастом, следуя мнению, что эпигенетические механизмы, такие как метилирование ДНК, ухудшаются с возрастом и могут даже ускорять процесс старения (Murgatroyd et al. , 2010b; Rodríguez-Rodero et al., 2010). Однако следует также учитывать влияние генетических факторов, поскольку в отчетах была обнаружена более высокая эпигенетическая изменчивость у дизиготных, чем у монозиготных близнецов (Kaminsky et al., 2009).) и внутрииндивидуальные изменения метилирования ДНК, показывающие степень семейной кластеризации (Bjornsson et al., 2008). Наконец, возможное влияние случайных стохастических факторов может еще больше осложнить такие исследования сообщениями о том, что даже у генетически идентичных лабораторных животных, живущих в одних и тех же контролируемых условиях окружающей среды, тем не менее развиваются фенотипические и эпигенетические различия (например, Vogt et al., 2008).
, 2010b; Rodríguez-Rodero et al., 2010). Однако следует также учитывать влияние генетических факторов, поскольку в отчетах была обнаружена более высокая эпигенетическая изменчивость у дизиготных, чем у монозиготных близнецов (Kaminsky et al., 2009).) и внутрииндивидуальные изменения метилирования ДНК, показывающие степень семейной кластеризации (Bjornsson et al., 2008). Наконец, возможное влияние случайных стохастических факторов может еще больше осложнить такие исследования сообщениями о том, что даже у генетически идентичных лабораторных животных, живущих в одних и тех же контролируемых условиях окружающей среды, тем не менее развиваются фенотипические и эпигенетические различия (например, Vogt et al., 2008).
Эпигенетика и старение
Связь между метилированием ДНК и старением была впервые предложена Бердышевым, который обнаружил, что глобальное метилирование геномной ДНК снижается с возрастом у нерестящейся горбуши (Бердышев и др., 19).67). Позже это было подтверждено дальнейшими доказательствами наличия постепенных глобальных потерь метилирования в различных тканях мыши, крысы и человека (например, Fuke et al. , 2004). Большая часть этого глобального гипометилирования может быть результатом того факта, что различные типы вкрапленных повторяющихся последовательностей, которые составляют основную массу геномов, по-видимому, нацелены на отдельные моменты времени в разной степени за счет возрастного гипометилирования (Jintaridth and Mutirangura, 2010). ). В общих чертах считается, что гиперметилирование, связанное с возрастом, преимущественно влияет на локусы на CpG-островках, в то время как локусы, лишенные CpG-островков, теряют метилирование с возрастом. Хотя увеличение метилирования промотора с возрастом общепризнано, например, в исследованиях тканей предстательной железы и толстой кишки человека (например, Kwabi-Addo et al., 2007), недавние данные Bjornsson et al. предполагают более сложную картину как с повышением, так и со снижением внутренних уровней глобального метилирования с течением времени (Bjornsson et al., 2008). Конечно, эпигенетическая дисрегуляция с возрастом, по-видимому, в значительной степени зависит от тканей.
, 2004). Большая часть этого глобального гипометилирования может быть результатом того факта, что различные типы вкрапленных повторяющихся последовательностей, которые составляют основную массу геномов, по-видимому, нацелены на отдельные моменты времени в разной степени за счет возрастного гипометилирования (Jintaridth and Mutirangura, 2010). ). В общих чертах считается, что гиперметилирование, связанное с возрастом, преимущественно влияет на локусы на CpG-островках, в то время как локусы, лишенные CpG-островков, теряют метилирование с возрастом. Хотя увеличение метилирования промотора с возрастом общепризнано, например, в исследованиях тканей предстательной железы и толстой кишки человека (например, Kwabi-Addo et al., 2007), недавние данные Bjornsson et al. предполагают более сложную картину как с повышением, так и со снижением внутренних уровней глобального метилирования с течением времени (Bjornsson et al., 2008). Конечно, эпигенетическая дисрегуляция с возрастом, по-видимому, в значительной степени зависит от тканей. Кроме того, по-видимому, существуют подмножества генов, на которые тканеспецифически воздействуют возрастные изменения метилирования ДНК, например, гены, участвующие в метаболизме и регуляции метаболизма в печени и висцеральной жировой ткани (Thompson et al., 2010), или сайты CpG, физически близки к генам, участвующим в связывании ДНК и регуляции транскрипции в различных областях мозга (Hernandez et al., 2011). Это более позднее исследование дает особенно сильный аргумент в пользу того, что специфические возрастные изменения метилирования ДНК могут иметь довольно широкое влияние на экспрессию генов в человеческом мозгу. Однако нам, возможно, придется пересмотреть некоторые из наших предубеждений относительно возраста и старения в связи с эпигенетическими изменениями, связанными с новым исследованием различных тканей мышей, в которых большинству изменений метилирования ДНК, обнаруженных во взрослом возрасте, предшествовали аналогичные изменения метилирования ДНК у молодых особей. и что уровни экспрессии генов вблизи прогрессивно метилированных и деметилированных CpG-сайтов уже значительно повышались или понижались, соответственно, у молодых мышей (Takasugi, 2011).
Кроме того, по-видимому, существуют подмножества генов, на которые тканеспецифически воздействуют возрастные изменения метилирования ДНК, например, гены, участвующие в метаболизме и регуляции метаболизма в печени и висцеральной жировой ткани (Thompson et al., 2010), или сайты CpG, физически близки к генам, участвующим в связывании ДНК и регуляции транскрипции в различных областях мозга (Hernandez et al., 2011). Это более позднее исследование дает особенно сильный аргумент в пользу того, что специфические возрастные изменения метилирования ДНК могут иметь довольно широкое влияние на экспрессию генов в человеческом мозгу. Однако нам, возможно, придется пересмотреть некоторые из наших предубеждений относительно возраста и старения в связи с эпигенетическими изменениями, связанными с новым исследованием различных тканей мышей, в которых большинству изменений метилирования ДНК, обнаруженных во взрослом возрасте, предшествовали аналогичные изменения метилирования ДНК у молодых особей. и что уровни экспрессии генов вблизи прогрессивно метилированных и деметилированных CpG-сайтов уже значительно повышались или понижались, соответственно, у молодых мышей (Takasugi, 2011). Это означает, что эпигеном постоянно созревает на протяжении всей жизни и что эффекты старения проявляются постепенно с течением времени.
Это означает, что эпигеном постоянно созревает на протяжении всей жизни и что эффекты старения проявляются постепенно с течением времени.
В соответствии с этой точкой зрения растущее число сообщений в литературе бросает вызов общепринятому взгляду на заблокированное состояние метилирования ДНК, демонстрируя, что метилирование ДНК остается активным процессом в постмитотических клетках (т.е. нейронах). Например, DNMT экспрессируются и регулируются во взрослом мозге (например, Brown et al., 2008), и продолжает накапливаться свидетельство того, что эпигенетические механизмы способны динамически контролировать изменения активности генов на протяжении всей жизни в результате воздействия различных факторов. факторов окружающей среды во время старения, как описано ранее.
В целом, эти данные свидетельствуют о наличии нескольких механизмов, регулирующих метилирование, которые, возможно, регулируются на разных этапах развития, созревания и старения с помощью процессов, которые реагируют на многочисленные факторы окружающей среды и генетические факторы.
Эпигеном и невзгоды раннего периода жизни
Помимо контроля конститутивной экспрессии генов, эпигенетические механизмы могут также служить для точной настройки потенциала экспрессии генов в ответ на сигналы окружающей среды. Метилирование ДНК было наиболее изучено в отношении понимания ранних жизненных переживаний и эпигенетического программирования их нейробиологических последствий. Действительно, стабильная природа метилирования ДНК делает его идеальной матрицей для поддержки устойчивых генных эффектов, контролирующих функцию мозга и поведение от раннего развития до старости. Таким образом, мы и другие исследователи предположили, что условия окружающей среды в раннем возрасте могут вызывать изменения в метилировании ДНК, облегчающие эпигенетическое программирование критических генов, участвующих в регуляции реакции на стресс, что, в свою очередь, может проявляться нейроэндокринными и поведенческими симптомами во взрослом возрасте (например, McGowan et al., 2009).; Мургатройд и др. , 2010а; Рисунок 3).
, 2010а; Рисунок 3).
Рисунок 3. Ранний жизненный опыт может устойчиво изменять уровни экспрессии ключевых генов посредством эпигенетической маркировки, которая может лежать в основе изменений поведения, нейроэндокринной системы и реакции на стресс на протяжении всей дальнейшей жизни . В совокупности этот процесс называется эпигенетическим программированием. Природа окружающей среды на протяжении всей дальнейшей жизни, помимо воздействия биологических процессов, связанных со старением и генетическим полом, может усугублять последствия программирования, установленного в раннем возрасте, что приводит к повышенной уязвимости к расстройствам настроения.
Материнская забота и эпигенетическое программирование GR
Одна хорошо охарактеризованная модель, созданная для изучения влияния окружающей среды раннего периода жизни на программирование стресса, исследует различия в качестве раннего послеродового ухода за матерью, измеряемые уровнями вылизывания и ухода. Исследования показали, что у крысят, получавших высокий уровень материнской заботы в раннем возрасте, развивалось устойчивое повышение экспрессии ГР в гиппокампе и снижалась чувствительность гиппокампа к глюкокортикоидным гормонам (Liu et al., 19).97). Кроме того, эти крысы показали пониженные уровни гипоталамического КРГ и сниженную реакцию оси HPA на стресс (Francis et al., 1999) по сравнению с животными, выращенными матерями, демонстрирующими низкий уровень материнской заботы. Анализ молекулярных механизмов, лежащих в основе длительного программирования GR, выявил важную роль эпигенетической регуляции. Исследователи показали, что повышенная экспрессия ГР в гиппокампе у животных, получающих высокий уровень материнской заботы, связана со стойким гипометилированием ДНК по специфическим динуклеотидам CpG в экзоне 1-9 гиппокампа.0236 7 промотор и повышенное ацетилирование гистонов. Эти эпигенетические модификации облегчают связывание белка A, индуцируемого фактором роста нервов, активатора транскрипции (NGF1a), с этой областью, обеспечивая вероятный механизм эпигенетического программирования функции генов материнской заботой в раннем возрасте (Weaver et al.
Исследования показали, что у крысят, получавших высокий уровень материнской заботы в раннем возрасте, развивалось устойчивое повышение экспрессии ГР в гиппокампе и снижалась чувствительность гиппокампа к глюкокортикоидным гормонам (Liu et al., 19).97). Кроме того, эти крысы показали пониженные уровни гипоталамического КРГ и сниженную реакцию оси HPA на стресс (Francis et al., 1999) по сравнению с животными, выращенными матерями, демонстрирующими низкий уровень материнской заботы. Анализ молекулярных механизмов, лежащих в основе длительного программирования GR, выявил важную роль эпигенетической регуляции. Исследователи показали, что повышенная экспрессия ГР в гиппокампе у животных, получающих высокий уровень материнской заботы, связана со стойким гипометилированием ДНК по специфическим динуклеотидам CpG в экзоне 1-9 гиппокампа.0236 7 промотор и повышенное ацетилирование гистонов. Эти эпигенетические модификации облегчают связывание белка A, индуцируемого фактором роста нервов, активатора транскрипции (NGF1a), с этой областью, обеспечивая вероятный механизм эпигенетического программирования функции генов материнской заботой в раннем возрасте (Weaver et al. , 2004). Интересно, что дальнейшее исследование с использованием другой парадигмы РС на крысах другого вида показало, что высвобождение кортикостерона и повышенная экспрессия NGF1a не вызывают изменений в уровнях метилирования ДНК на одном и том же промоторе ГР гиппокампа (Daniels et al., 2009).), снова поддерживая идею о том, что вариации в генетическом составе и различия в окружающей среде являются критическими детерминантами в организации эпигенома. В поддержку этой идеи последующие исследования обнаружили измененное метилирование промотора GR в посмертной ткани гиппокампа человека у депрессивных пациентов-самоубийц, которые страдали жестоким обращением и пренебрежением в раннем возрасте (McGowan et al., 2009). Напротив, у пациентов с суицидом, которые не подвергались невзгодам в раннем возрасте, или у пациентов, страдающих только большой депрессией, не было обнаружено эпигенетической маркировки ГР гиппокампа (Alt et al., 2010).
, 2004). Интересно, что дальнейшее исследование с использованием другой парадигмы РС на крысах другого вида показало, что высвобождение кортикостерона и повышенная экспрессия NGF1a не вызывают изменений в уровнях метилирования ДНК на одном и том же промоторе ГР гиппокампа (Daniels et al., 2009).), снова поддерживая идею о том, что вариации в генетическом составе и различия в окружающей среде являются критическими детерминантами в организации эпигенома. В поддержку этой идеи последующие исследования обнаружили измененное метилирование промотора GR в посмертной ткани гиппокампа человека у депрессивных пациентов-самоубийц, которые страдали жестоким обращением и пренебрежением в раннем возрасте (McGowan et al., 2009). Напротив, у пациентов с суицидом, которые не подвергались невзгодам в раннем возрасте, или у пациентов, страдающих только большой депрессией, не было обнаружено эпигенетической маркировки ГР гиппокампа (Alt et al., 2010).
Стресс разлуки с матерью и эпигенетическое программирование AVP
Работа в нашей лаборатории показала, что стресс РС у мышей, включающий отделение детенышей от матерей на 3 часа каждый день в течение первых 10 дней жизни, индуцирует пожизненную устойчивую экспрессию гипоталамического AVP лежит в основе повышенной секреции кортикостерона, повышенной эндокринной реакции на последующие стрессоры и измененного ингибирования оси HPA по типу обратной связи. Начиная с 10-го дня жизни, сразу после периода РС и сохраняясь не менее 1 года, повышенная экспрессия АВП была специфична для парвоцеллюлярной субпопуляции нейронов ПВЯ, в то время как экспрессия КРГ гипоталамуса и ГР гиппокампа оставалась неизменной. Важно отметить, что эта измененная экспрессия связана со сниженным уровнем метилирования ДНК в PVN в определенных динуклеотидах CpG в энхансерной области, важной для активности гена AVP (Murgatroyd et al., 2009).). Далее мы показали, что гипометилирование в этой области снижает способность MeCP2 связывать и рекрутировать репрессивные гистоновые комплексы, такие как HDAC и DNMT (Murgatroyd, неопубликовано), подтверждая предыдущие доказательства роли MeCP2 в качестве эпигенетической платформы, на которой происходит деацетилирование гистонов, метилирование h4K9. , и метилирование ДНК осуществляются для подавления транскрипции и молчания генов (например, Murgatroyd et al., 2010a).
Начиная с 10-го дня жизни, сразу после периода РС и сохраняясь не менее 1 года, повышенная экспрессия АВП была специфична для парвоцеллюлярной субпопуляции нейронов ПВЯ, в то время как экспрессия КРГ гипоталамуса и ГР гиппокампа оставалась неизменной. Важно отметить, что эта измененная экспрессия связана со сниженным уровнем метилирования ДНК в PVN в определенных динуклеотидах CpG в энхансерной области, важной для активности гена AVP (Murgatroyd et al., 2009).). Далее мы показали, что гипометилирование в этой области снижает способность MeCP2 связывать и рекрутировать репрессивные гистоновые комплексы, такие как HDAC и DNMT (Murgatroyd, неопубликовано), подтверждая предыдущие доказательства роли MeCP2 в качестве эпигенетической платформы, на которой происходит деацетилирование гистонов, метилирование h4K9. , и метилирование ДНК осуществляются для подавления транскрипции и молчания генов (например, Murgatroyd et al., 2010a).
Затем мы исследовали сигналы, контролирующие занятость MeCP2 на этом раннем этапе. Синаптическая активность, управляемая опытом, вызывает деполяризацию мембран и приток кальция в избранные нейроны, что, в свою очередь, вызывает широкий спектр клеточных ответов, связывая активность нейронов с регуляцией транскрипции (Greer and Greenberg, 2008). Кроме того, ранее было показано, что деполяризация нейронов запускает Ca 9.0190 2+ -зависимое фосфорилирование MeCP2, вызывающее диссоциацию MeCP2 от промотора BDNF и, следовательно, дерепрессию гена (e.g., Martinowich et al., 2003). Последующие исследования показали, что CaMKII (Ca 2+ /кальмодулин-зависимая протеинкиназа II) способен опосредовать это фосфорилирование крысиного MeCP2 по серину 421 (Zhou et al., 2006) и гомологичному остатку серина 438 у мышей ( Мургатройд и др., 2009). Анализ 10-дневных мышей, подвергшихся стрессу в раннем возрасте, выявил повышенную иммунореактивность CaMKII и фосфо-MeCP2, которая способствовала диссоциации MeCP2 на энхансере AVP и депрессии. Однако, несмотря на то, что мыши, подвергшиеся стрессу в раннем возрасте, протестированные во взрослом возрасте (6 недель), по-прежнему демонстрировали сниженное связывание MeCP2 на энхансере AVP, уровни фосфорилирования MeCP2 и активации CaMKII в PVN больше не отличались от таковых у контрольных животных.
Синаптическая активность, управляемая опытом, вызывает деполяризацию мембран и приток кальция в избранные нейроны, что, в свою очередь, вызывает широкий спектр клеточных ответов, связывая активность нейронов с регуляцией транскрипции (Greer and Greenberg, 2008). Кроме того, ранее было показано, что деполяризация нейронов запускает Ca 9.0190 2+ -зависимое фосфорилирование MeCP2, вызывающее диссоциацию MeCP2 от промотора BDNF и, следовательно, дерепрессию гена (e.g., Martinowich et al., 2003). Последующие исследования показали, что CaMKII (Ca 2+ /кальмодулин-зависимая протеинкиназа II) способен опосредовать это фосфорилирование крысиного MeCP2 по серину 421 (Zhou et al., 2006) и гомологичному остатку серина 438 у мышей ( Мургатройд и др., 2009). Анализ 10-дневных мышей, подвергшихся стрессу в раннем возрасте, выявил повышенную иммунореактивность CaMKII и фосфо-MeCP2, которая способствовала диссоциации MeCP2 на энхансере AVP и депрессии. Однако, несмотря на то, что мыши, подвергшиеся стрессу в раннем возрасте, протестированные во взрослом возрасте (6 недель), по-прежнему демонстрировали сниженное связывание MeCP2 на энхансере AVP, уровни фосфорилирования MeCP2 и активации CaMKII в PVN больше не отличались от таковых у контрольных животных. Вместо этого эволюционирующие различия в метилировании ДНК в этой области лежат в основе сниженной занятости MeCP2 у мышей, подвергшихся стрессу в раннем возрасте. В совокупности первоначальный стимул стресса в раннем возрасте инициирует потерю занятости MeCP2, что впоследствии приводит к жесткому кодированию опыта раннего периода жизни на уровне метилирования ДНК (рис. 4). Интересно, что у контрольных мышей также происходило деметилирование, связанное с возрастом, хотя, что очень важно, область энхансера, отмеченная стрессом в раннем возрасте, была сохранена, что подтверждает важность этой области в регуляции AVP (Murgatroyd et al., 2010b).
Вместо этого эволюционирующие различия в метилировании ДНК в этой области лежат в основе сниженной занятости MeCP2 у мышей, подвергшихся стрессу в раннем возрасте. В совокупности первоначальный стимул стресса в раннем возрасте инициирует потерю занятости MeCP2, что впоследствии приводит к жесткому кодированию опыта раннего периода жизни на уровне метилирования ДНК (рис. 4). Интересно, что у контрольных мышей также происходило деметилирование, связанное с возрастом, хотя, что очень важно, область энхансера, отмеченная стрессом в раннем возрасте, была сохранена, что подтверждает важность этой области в регуляции AVP (Murgatroyd et al., 2010b).
Рисунок 4. Зависимая от опыта активация нейронов в PVN в раннем возрасте ингибирует связывание MeCP2 с геном AVP и репрессию гена AVP у стрессированных мышей . Это дополнительно способствует гипометилированию ДНК, лежащему в основе сниженной занятости MeCP2 в энхансере AVP и сохранению эпигенетического контроля экспрессии AVP в более позднем возрасте.
Дополнительные мишени для эпигенетического программирования оси HPA
Растущее число исследований подтверждает роль эпигенетических модификаций в контроле генов, регулирующих ось HPA. Два недавних исследования демонстрируют эпигенетическое программирование гипоталамического КРГ в ответ на стресс либо в пренатальном периоде, либо во взрослом возрасте. У беременных мышей, подвергавшихся хроническим переменным стрессорам на ранних сроках гестации, было обнаружено гипометилирование промотора CRH в гипоталамусе потомства во взрослом возрасте (Mueller and Bale, 2008). Более того, хронический социальный стресс у взрослых мышей вызывал гипометилирование промотора CRH в PVN у подмножества животных, демонстрирующих последующее избегание общения (Elliott et al., 2010).
В ряде исследований описывается эпигенетическая регуляция гена POMC (проопиомеланокортин, кодирующий АКТГ), который является нижестоящей мишенью для передачи сигналов AVP и CRH. Гиперметилирование промоторной области приводит к подавлению экспрессии, которая, по-видимому, регулируется кортизолом (например, Mizoguchi et al. , 2007). Недавние исследования предполагают эпигенетическое программирование POMC с помощью пищевых сигналов, таких как переедание или анорексия (например, Ehrlich et al., 2010), в то время как другие исследования предполагают связь с тягой к алкоголю (Muschler et al., 2010). Эти предварительные результаты требуют дальнейших исследований для решения вопроса о том, распространяется ли эпигенетическое программирование оси HPA на гипофиз (POMC) в дополнение к тканям гиппокампа (GR) и гипоталамуса (AVP и CRH).
, 2007). Недавние исследования предполагают эпигенетическое программирование POMC с помощью пищевых сигналов, таких как переедание или анорексия (например, Ehrlich et al., 2010), в то время как другие исследования предполагают связь с тягой к алкоголю (Muschler et al., 2010). Эти предварительные результаты требуют дальнейших исследований для решения вопроса о том, распространяется ли эпигенетическое программирование оси HPA на гипофиз (POMC) в дополнение к тканям гиппокампа (GR) и гипоталамуса (AVP и CRH).
Эпигенетическое программирование за пределами оси HPA
Помимо оси HPA, по-видимому, существуют дополнительные пути и эпигенетические мишени стресса в раннем возрасте. Например, крысы, выращенные во враждебной постнатальной среде, демонстрировали гиперметилирование промотора, связанное со сниженной экспрессией мозгового нейтротрофического фактора (BDNF) в префронтальной коре во взрослом возрасте (Roth et al., 2009). BDNF представляет собой нейротрофин, который регулирует развитие нервной системы, нейропластичность и функции нейронов. Кроме того, он участвует в патогенезе психических и нейродегенеративных расстройств, и растет объем литературы, связывающей эпигенетическую регуляцию генов ген BDNF с пластичностью мозга и когнитивной функцией (например, Lubin et al., 2008).
Кроме того, он участвует в патогенезе психических и нейродегенеративных расстройств, и растет объем литературы, связывающей эпигенетическую регуляцию генов ген BDNF с пластичностью мозга и когнитивной функцией (например, Lubin et al., 2008).
Нейроэндокринные системы, связанные с женским сексуальным и материнским поведением, а также развитие системы ГАМК, по-видимому, также подвержены влиянию изменений в окружающей среде в раннем возрасте. У потомства самок крыс, матерей с высоким уровнем материнской заботы, развилось гипометилирование промотора рецептора эстрогена-альфа (ERα) в медиальной преоптической области, коррелирующее с повышенным связыванием транскрипционного фактора STAT5 и повышенной экспрессией ERα (Champagne et al., 2006). Это исследование показывает, что эпигенетическое программирование может иметь место в зависимости от пола, что может пролить новый свет на давний вопрос о половой предвзятости при многочисленных заболеваниях (для обзора см. Menger et al. , 2010). материнский уход показал усиление экспрессии мРНК декарбоксилазы глутаминовой кислоты 1 (GAD1) гиппокампа, снижение метилирования цитозина и повышение уровня гистон-3-лизина 9.ацетилирование (h4K9ac) промотора GAD1 (Zhang et al., 2010). Более того, экспрессия DNMT1 также была значительно ниже у потомков тех крыс, которые получали высокий уровень материнской заботы (Zhang et al., 2010). Это интересно, так как ряд исследований предполагает регуляцию компонентов эпигенетического механизма в ответ на стрессоры. Например, недавняя работа показала, что ремоделирование хроматина в различных областях мозга, включая гиппокамп, связано с эффектами стресса в различных моделях (например, Hunter et al., 2009).).
, 2010). материнский уход показал усиление экспрессии мРНК декарбоксилазы глутаминовой кислоты 1 (GAD1) гиппокампа, снижение метилирования цитозина и повышение уровня гистон-3-лизина 9.ацетилирование (h4K9ac) промотора GAD1 (Zhang et al., 2010). Более того, экспрессия DNMT1 также была значительно ниже у потомков тех крыс, которые получали высокий уровень материнской заботы (Zhang et al., 2010). Это интересно, так как ряд исследований предполагает регуляцию компонентов эпигенетического механизма в ответ на стрессоры. Например, недавняя работа показала, что ремоделирование хроматина в различных областях мозга, включая гиппокамп, связано с эффектами стресса в различных моделях (например, Hunter et al., 2009).).
Отступление от литературы об эпигенетических изменениях, вызванных ранним периодом жизни; одно недавнее исследование показало, что травматический стресс во взрослом возрасте также может вызывать эпигенетические изменения в мозге. У взрослых крыс, подвергшихся тяжелому хроническому психосоциальному стрессу, выявлено повышенное метилирование промотора BDNF в областях гиппокампа, связанное со снижением экспрессии этого гена (Roth et al. , 2011). Другим нейротрофином, который, как известно, важен для регуляции пластичности мозга и вовлечен в депрессию, является нейротрофический фактор глиальных клеток (GDNF). Изучая две генетически различные линии мышей, демонстрирующие разные поведенческие реакции на хронический стресс, исследователи недавно обнаружили, что GDNF в прилежащем ядре эпигенетически замалчивается после стресса во взрослом возрасте только у мышей, уязвимых к стрессу (Uchida et al., 2011), что еще раз подтверждает важность динамические эпигенетические изменения в ответ на сигналы окружающей среды, сохраняющиеся во взрослом возрасте.
, 2011). Другим нейротрофином, который, как известно, важен для регуляции пластичности мозга и вовлечен в депрессию, является нейротрофический фактор глиальных клеток (GDNF). Изучая две генетически различные линии мышей, демонстрирующие разные поведенческие реакции на хронический стресс, исследователи недавно обнаружили, что GDNF в прилежащем ядре эпигенетически замалчивается после стресса во взрослом возрасте только у мышей, уязвимых к стрессу (Uchida et al., 2011), что еще раз подтверждает важность динамические эпигенетические изменения в ответ на сигналы окружающей среды, сохраняющиеся во взрослом возрасте.
Клинические исследования эпигенетического программирования невзгод в раннем возрасте
Начинают появляться доказательства того, что результаты эпигенетического программирования на животных моделях могут быть экстраполированы на человеческие исследования и психопатологии, связанные с жестоким обращением или пренебрежением в детстве. Макгоуэн и др. (2008) обнаружили, что у суицидентов, имевших в анамнезе пренебрежение или жестокое обращение в раннем детстве, наблюдалось гиперметилирование промотора рибосомной РНК (рРНК). Гены рРНК кодируют рибосомальную РНК, важную для синтеза белка, что наводит на мысль, что такое снижение уровня рРНК может отражать сниженную способность к синтезу белка в гиппокампе жертв самоубийств. Хотя, как это может способствовать патологии, еще предстоит определить. Последующие исследования посмертной ткани теми же исследователями дополнительно подтвердили гиперметилирование GR промотор гена среди жертв самоубийств с историей жестокого обращения в детстве, но не среди контрольной группы или жертв самоубийств, которые не страдали от такого стресса в раннем возрасте (McGowan et al., 2009). Эти данные, по-видимому, согласуются с предыдущими исследованиями, демонстрирующими, что эпигенетический статус гомологичного промотора гена GR регулируется родительской заботой во время раннего постнатального развития крыс (Weaver et al., 2004). Хотя и косвенная, эта корреляция в исследовании человека предполагает, что эпигенетические механизмы, которые, как считается, играют роль в уязвимости грызунов к стрессовым состояниям, могут быть экстраполированы на людей.
Гены рРНК кодируют рибосомальную РНК, важную для синтеза белка, что наводит на мысль, что такое снижение уровня рРНК может отражать сниженную способность к синтезу белка в гиппокампе жертв самоубийств. Хотя, как это может способствовать патологии, еще предстоит определить. Последующие исследования посмертной ткани теми же исследователями дополнительно подтвердили гиперметилирование GR промотор гена среди жертв самоубийств с историей жестокого обращения в детстве, но не среди контрольной группы или жертв самоубийств, которые не страдали от такого стресса в раннем возрасте (McGowan et al., 2009). Эти данные, по-видимому, согласуются с предыдущими исследованиями, демонстрирующими, что эпигенетический статус гомологичного промотора гена GR регулируется родительской заботой во время раннего постнатального развития крыс (Weaver et al., 2004). Хотя и косвенная, эта корреляция в исследовании человека предполагает, что эпигенетические механизмы, которые, как считается, играют роль в уязвимости грызунов к стрессовым состояниям, могут быть экстраполированы на людей. Однако следует отметить, что необходима дальнейшая работа, чтобы установить причинно-следственную связь этой эпигенетической модификации с общим депрессивным поведением у людей. Кроме того, независимое последующее исследование не смогло идентифицировать сходное метилирование ДНК в промоторе GR или изменения при большой депрессии (Alt et al., 2010), что снова указывает на важность межиндивидуальных генетических и экологических вариаций.
Однако следует отметить, что необходима дальнейшая работа, чтобы установить причинно-следственную связь этой эпигенетической модификации с общим депрессивным поведением у людей. Кроме того, независимое последующее исследование не смогло идентифицировать сходное метилирование ДНК в промоторе GR или изменения при большой депрессии (Alt et al., 2010), что снова указывает на важность межиндивидуальных генетических и экологических вариаций.
В целом, эти исследования предполагают, что эпигенетические процессы могут опосредовать влияние ранней среды на экспрессию генов и что стабильные эпигенетические метки, такие как метилирование ДНК, могут затем сохраняться во взрослом возрасте и влиять на уязвимость к психопатологии посредством воздействия на промежуточные уровни функций, таких как активность оси ГПА.
Будущие исследования
С появлением новых высокопроизводительных технологий секвенирования исследования теперь начинают переходить от масштаба одного гена к эпигеномному анализу всех эпигенетических меток в геноме конкретной ткани. Учитывая, что эпигенетические модификации чувствительны к изменениям в окружающей среде, можно ожидать, что эти усилия позволят идентифицировать эпигеномные сигнатуры психических расстройств и молекулярных дисрегуляций, возникающих в результате стресса в раннем возрасте (Albert, 2010). В то время как такая стратегия кажется очень привлекательной в области исследований рака, направленных на клонально разросшиеся клеточные популяции, а не на гетерогенные ткани, область исследований эпигенетических ассоциаций при психических заболеваниях может быть более сложной. Эпигенетические модификации, зарегистрированные на сегодняшний день в животных моделях и посмертных тканях мозга, редко бывают «все или ничего», а постепенны и, по-видимому, происходят очень специфичным для типа клеток образом. С этой точки зрения чрезвычайная сложность и гетерогенность нервных тканей представляет собой серьезное препятствие для получения эпигенетических биомаркеров при психических заболеваниях.
Учитывая, что эпигенетические модификации чувствительны к изменениям в окружающей среде, можно ожидать, что эти усилия позволят идентифицировать эпигеномные сигнатуры психических расстройств и молекулярных дисрегуляций, возникающих в результате стресса в раннем возрасте (Albert, 2010). В то время как такая стратегия кажется очень привлекательной в области исследований рака, направленных на клонально разросшиеся клеточные популяции, а не на гетерогенные ткани, область исследований эпигенетических ассоциаций при психических заболеваниях может быть более сложной. Эпигенетические модификации, зарегистрированные на сегодняшний день в животных моделях и посмертных тканях мозга, редко бывают «все или ничего», а постепенны и, по-видимому, происходят очень специфичным для типа клеток образом. С этой точки зрения чрезвычайная сложность и гетерогенность нервных тканей представляет собой серьезное препятствие для получения эпигенетических биомаркеров при психических заболеваниях.
Эпигенетические биомаркеры
В конечном счете, идентификация «эпигенетических биомаркеров» в отдельных областях генома может предоставить важную информацию для понимания биологических процессов, лежащих в основе психических заболеваний, и, таким образом, позволить разработать и разработать новые терапевтические средства. Хотя изменения экспрессии и метилирования ДНК в головном мозге более явно связаны с изменениями в поведении, сопоставимые изменения в крови могут предоставить клинически ценный суррогат, учитывая легкий доступ к этой ткани у пациентов. Некоторые ранние исследования показали частичную корреляцию в экспрессии генов между различными областями мозга и кровью (например, Brown et al., 2001), что было подтверждено следующими данными, демонстрирующими эпигенетические различия в лимфоцитах, связанных с мозгом, при синдроме Ретта и болезни Альцгеймера. например, Wang et al., 2008). Недавно было описано, что хроническое воздействие кортикостерона на мышей стимулировало параллельное увеличение экспрессия FKBP5 между тканями мозга и кровью вместе с некоторыми, как правило, малозаметными изменениями метилирования ДНК на промоторе этого гена (Lee et al., 2010). Тем не менее, другие гены-кандидаты оси HPA, протестированные в этом исследовании, а именно NR3C1 , HSP90 , CRH и CRHR1 , не показали таких эффектов, в то время как дальнейшие исследования в этой области исследований также показали небольшую корреляцию.
Хотя изменения экспрессии и метилирования ДНК в головном мозге более явно связаны с изменениями в поведении, сопоставимые изменения в крови могут предоставить клинически ценный суррогат, учитывая легкий доступ к этой ткани у пациентов. Некоторые ранние исследования показали частичную корреляцию в экспрессии генов между различными областями мозга и кровью (например, Brown et al., 2001), что было подтверждено следующими данными, демонстрирующими эпигенетические различия в лимфоцитах, связанных с мозгом, при синдроме Ретта и болезни Альцгеймера. например, Wang et al., 2008). Недавно было описано, что хроническое воздействие кортикостерона на мышей стимулировало параллельное увеличение экспрессия FKBP5 между тканями мозга и кровью вместе с некоторыми, как правило, малозаметными изменениями метилирования ДНК на промоторе этого гена (Lee et al., 2010). Тем не менее, другие гены-кандидаты оси HPA, протестированные в этом исследовании, а именно NR3C1 , HSP90 , CRH и CRHR1 , не показали таких эффектов, в то время как дальнейшие исследования в этой области исследований также показали небольшую корреляцию. например, Юферов и др., 2011). Следовательно, перспектива диагностического эпигенетического тестирования психических заболеваний с использованием маркеров в крови представляется пока нерешенной и, безусловно, требует дальнейших исследований.
например, Юферов и др., 2011). Следовательно, перспектива диагностического эпигенетического тестирования психических заболеваний с использованием маркеров в крови представляется пока нерешенной и, безусловно, требует дальнейших исследований.
Вопрос времени
Многие из исследований, рассмотренных в этом обзоре, подчеркивают важность временного характера процессов развития мозга в связи с эффектами, которые стрессоры окружающей среды могут оказывать на эпигенетическое программирование долгосрочных изменений в развитии нервной системы и поведении. Развивающиеся области мозга обычно проходят через критические «окна» чувствительности, которые растягиваются на разные перинатальные периоды. Следовательно, само собой разумеющимся является то, что воздействие стрессоров в разные моменты времени будет давать более выраженные и длительные эффекты в тех областях мозга, которые активно развиваются в это конкретное время. Например, поздний пренатальный и ранний постнатальный периоды являются критическим периодом для развития гиппокампа, что, возможно, объясняет, почему воздействие окружающей среды в этот период тесно связано с клеточными, морфологическими и эпигенетическими изменениями в этих структурах (см. обзор McCrory et al., 2010). Напротив, воздействие окружающей среды в более позднем возрасте, как правило, оказывает фенотипическое воздействие, изменяя другие области мозга. Например, повторяющийся иммобилизационный стресс у взрослых крыс не вызывает долговременных эффектов, связанных с гиппокампом, таких как те, которые наблюдаются после аналогичного воздействия стресса в пренатальном и раннем постнатальном периодах жизни (Conrad et al., 19).99). С другой стороны, известно, что существенное развитие и дифференцировка коры продолжается и в подростковом возрасте (например, Wang and Gao, 2009), что, возможно, объясняет, почему эти области более восприимчивы к эпигенетическим изменениям в ответ на факторы окружающей среды в более позднем возрасте.
обзор McCrory et al., 2010). Напротив, воздействие окружающей среды в более позднем возрасте, как правило, оказывает фенотипическое воздействие, изменяя другие области мозга. Например, повторяющийся иммобилизационный стресс у взрослых крыс не вызывает долговременных эффектов, связанных с гиппокампом, таких как те, которые наблюдаются после аналогичного воздействия стресса в пренатальном и раннем постнатальном периодах жизни (Conrad et al., 19).99). С другой стороны, известно, что существенное развитие и дифференцировка коры продолжается и в подростковом возрасте (например, Wang and Gao, 2009), что, возможно, объясняет, почему эти области более восприимчивы к эпигенетическим изменениям в ответ на факторы окружающей среды в более позднем возрасте.
В дополнение к временному характеру развития мозга мы также должны учитывать временной и геноспецифический характер установления эпигенетических меток. Это будет иметь решающее значение для понимания того, как зависимые от опыта эпигенетические метки могут претерпевать переход от предварительного лабильного состояния к жестко запрограммированному стабильному отпечатку. Действительно, в наших исследованиях эпигенетическая маркировка ориентиров метилирования в энхансере AVP сохранялась при блокаде рецептора вазопрессина у взрослых (3 месяца) мышей, что согласуется с концепцией о том, что стресс в раннем возрасте уже запечатлел прочную клеточную память (Murgatroyd et al., 2010a). ). Однако остается вопрос, могут ли существовать критические «окна» для своевременных психотерапевтических и фармакологических вмешательств после воздействия тяжелой травмы в периоды, предшествующие установлению стабильных эпигенетических меток. С этой точки зрения терапевтические вмешательства могут повторно стимулировать или ингибировать те же самые нейроны и гены, эпигенетически запрограммированные ранее в жизни, и обратить эти изменения вспять. По-видимому, время, качество и продолжительность такой стимуляции окружающей среды могут быть весьма специфичными и контекстно-зависимыми в отношении точной природы стрессора раннего периода жизни.
Действительно, в наших исследованиях эпигенетическая маркировка ориентиров метилирования в энхансере AVP сохранялась при блокаде рецептора вазопрессина у взрослых (3 месяца) мышей, что согласуется с концепцией о том, что стресс в раннем возрасте уже запечатлел прочную клеточную память (Murgatroyd et al., 2010a). ). Однако остается вопрос, могут ли существовать критические «окна» для своевременных психотерапевтических и фармакологических вмешательств после воздействия тяжелой травмы в периоды, предшествующие установлению стабильных эпигенетических меток. С этой точки зрения терапевтические вмешательства могут повторно стимулировать или ингибировать те же самые нейроны и гены, эпигенетически запрограммированные ранее в жизни, и обратить эти изменения вспять. По-видимому, время, качество и продолжительность такой стимуляции окружающей среды могут быть весьма специфичными и контекстно-зависимыми в отношении точной природы стрессора раннего периода жизни.
Тем не менее, исследования на крысах показали, что обогащение окружающей среды в период полового созревания может смягчить некоторые эффекты ELS, связанные с тревогой (например, Imanaka et al. , 2008). Этот результат согласуется с наблюдениями из клиники. Например, у младенцев, которые ранее подвергались жестокому обращению, если их поместить в среду, в которой используются позитивные стратегии воспитания, наблюдаются значительные улучшения в поведении и регуляции кортизола (например, Fisher et al., 2007). Дальнейшее исследование приемных детей показало, что вмешательство, основанное на отношениях, в большей степени ориентированное на социальное взаимодействие с опекунами, оказалось гораздо более эффективным в снижении уровня кортизола по сравнению с вмешательством, в большей степени направленным на улучшение когнитивных навыков (Dozier et al., 2008). , возвращая нас к важности системы привязанности в раннем возрасте. Принимая во внимание эти наблюдения, дальнейшие доклинические исследования, посвященные влиянию такого обогащения окружающей среды после стресса в раннем возрасте, могли бы сосредоточиться на том, существуют ли критические временные окна для повышенной чувствительности к стрессу, принимая во внимание временные аспекты развития мозга и эпигенетические механизмы, а также адаптируемость к мелиоративным воздействиям.
, 2008). Этот результат согласуется с наблюдениями из клиники. Например, у младенцев, которые ранее подвергались жестокому обращению, если их поместить в среду, в которой используются позитивные стратегии воспитания, наблюдаются значительные улучшения в поведении и регуляции кортизола (например, Fisher et al., 2007). Дальнейшее исследование приемных детей показало, что вмешательство, основанное на отношениях, в большей степени ориентированное на социальное взаимодействие с опекунами, оказалось гораздо более эффективным в снижении уровня кортизола по сравнению с вмешательством, в большей степени направленным на улучшение когнитивных навыков (Dozier et al., 2008). , возвращая нас к важности системы привязанности в раннем возрасте. Принимая во внимание эти наблюдения, дальнейшие доклинические исследования, посвященные влиянию такого обогащения окружающей среды после стресса в раннем возрасте, могли бы сосредоточиться на том, существуют ли критические временные окна для повышенной чувствительности к стрессу, принимая во внимание временные аспекты развития мозга и эпигенетические механизмы, а также адаптируемость к мелиоративным воздействиям. Эффект обогащенной среды.
Эффект обогащенной среды.
Еще одним вариантом изменения последствий стресса в раннем возрасте может быть нацеливание на DNMT и ферменты ремоделирования хроматина. Хотя такие препараты, модифицирующие гистоны и нацеленные на метилирование ДНК, оказываются очень привлекательными для лечения рака, еще неизвестно, обладают ли они реальным потенциалом в области психических заболеваний. Тем не менее, примечательно, что часто используемый стабилизатор настроения вальпроат (VPA), как было показано, модулирует эпигеном, ингибируя HDAC, и может дополнительно способствовать деметилированию в клетках головного мозга (например, Perisic et al., 2010). Однако большая осторожность связана с тем фактом, что большинство доступных в настоящее время «эпигенетических лекарств» страдают недостаточной специфичностью как на уровне ткани, так и на уровне генома. Эта область еще может продвинуться вперед благодаря исследованиям, нацеленным на определенные ферменты, модифицирующие гистоны, такие как G9. a, которые могут быть достаточно избирательными, чтобы облегчить зависимость или психическое заболевание (Maze et al., 2010). Другой интересный подход к регулированию метилирования основан на лечении донором метила l-метионином или добавками фолиевой кислоты во время беременности. Интересно, что есть ряд недавних сообщений, связывающих низкий уровень фолиевой кислоты во время беременности с поведенческими симптомами у детей (например, Schlotz et al., 2010). Хотя сообщалось об эффектах экспрессии генов и поведении (например, Weaver et al., 2005), механизмы того, как такое лечение может быть способным нацеливать и вызывать такие эффекты в определенных областях мозга, до сих пор не совсем понятны.
a, которые могут быть достаточно избирательными, чтобы облегчить зависимость или психическое заболевание (Maze et al., 2010). Другой интересный подход к регулированию метилирования основан на лечении донором метила l-метионином или добавками фолиевой кислоты во время беременности. Интересно, что есть ряд недавних сообщений, связывающих низкий уровень фолиевой кислоты во время беременности с поведенческими симптомами у детей (например, Schlotz et al., 2010). Хотя сообщалось об эффектах экспрессии генов и поведении (например, Weaver et al., 2005), механизмы того, как такое лечение может быть способным нацеливать и вызывать такие эффекты в определенных областях мозга, до сих пор не совсем понятны.
Таким образом, в эпицентре современной психиатрии появляется понимание того, как ранние жизненные переживания могут вызывать устойчивые эпигенетические воспоминания, приводящие к повышенному риску психических расстройств. Вопрос о том, могут ли подходящие социальные или фармакологические вмешательства обратить вспять вредное эпигенетическое программирование, вызванное неблагоприятными условиями в раннем возрасте, должен получить наивысший приоритет в программах будущих исследований. Прогресс в этой области будет способствовать дальнейшему привлечению общественного интереса, общего понимания и оценки последствий жестокого обращения в детстве и безнадзорности для жертв в более позднем возрасте.
Прогресс в этой области будет способствовать дальнейшему привлечению общественного интереса, общего понимания и оценки последствий жестокого обращения в детстве и безнадзорности для жертв в более позднем возрасте.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Эта работа финансировалась Европейским Союзом (CRESCENDO – Номер контракта Европейского Союза LSHM-CT-2005-018652).
Ссылки
Абдолмалеки, Х. М., Ченг, К. Х., Фараоне, С. В., Уилкокс, М., Глатт, С. Дж., Гао, Ф., Смит, К. Л., Шафа, Р., Аеали, Б., Карневале, Дж., Пан, Х., Папагеоргис, П., Понте, Дж. Ф., Сивараман, В., Цуанг, М. Т., и Тиагалингам, С. (2006). Гипометилирование промотора MB-COMT является основным фактором риска шизофрении и биполярного расстройства. Гул. Мол. Жене . 15, 3132–3145.
Опубликован Аннотация | Полный текст в публикации
Агилера, Г., и Рабадан-Диль, К. (2000). Вазопрессинергическая регуляция гипоталамо-гипофизарно-надпочечниковой оси: значение адаптации к стрессу. Регул. Пепт. 96, 23–29.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Акбарян, С., и Хуанг, Х.С. (2009). Эпигенетическая регуляция в мозге человека фокусируется на метилировании гистонов и лизина. биол. Психиатрия 65, 198–203.
Опубликован Аннотация | Полный текст в публикации
Albert, PR (2010). Эпигенетика при психических заболеваниях: надежда или шумиха? J. Psychiatry Neurosci. 35, 366–368.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Альт, С. Р., Тернер, Дж. Д., Клок, М. Д., Мейер, О. К., Лакке, Э. А., Дерейк, Р. Х., и Мюллер, С. П. (2010). Дифференциальная экспрессия транскриптов глюкокортикоидных рецепторов при большом депрессивном расстройстве не запрограммирована эпигенетически. Психонейроэндокринология 35, 544–556.
Психонейроэндокринология 35, 544–556.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Ball, M.P., Li, J.B., Gao, Y., Lee, J.H., LePrust, E.M., Park, I.H., Xie, B., Daley, G.Q., and Church, G.M. (2009). Целевые стратегии и стратегии в масштабе генома выявляют сигнатуры метилирования тела гена в клетках человека. Нац. Биотехнолог. 27, 361–368.
Полный текст CrossRef
Белл, Дж. Т., и Спектор, Т. Д. (2011). Двойной подход к разгадке эпигенетики. Тенденции Жене. 27, 116–125.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Бердышев Г.Д., Коротаев Г.К., Боярских Г.В., Ванюшин Б.Ф. (1967). Нуклеотидный состав ДНК и РНК соматических тканей горбача и его изменения во время нереста. Биохимия 32, 988–993.
Опубликован Аннотация | Полный текст в публикации
Билезикджян Л.М., Блаунт А.Л. и Вейл В.В. (1987). Клеточные действия вазопрессина на кортикотрофы передней доли гипофиза: устойчивость к действию глюкокортикоидов. Мол. Эндокринол. 1, 451–458.
Мол. Эндокринол. 1, 451–458.
Опубликован Аннотация | Pubmed Full Text
Bjornsson, H.T., Sigurdsson, M.I., Fallin, MD, Irizarry, R.A., Aspelund, T., Cui, H., Yu, W., Rongione, M.A., Ekstrom, TJ, Harris, T.B., Launer, Л. Дж., Эйриксдоттир Г., Лепперт М. Ф., Сапиенца К., Гуднасон В. и Фейнберг А. П. (2008). Внутрииндивидуальное изменение метилирования ДНК с течением времени с семейной кластеризацией. JAMA 299, 2877–2883.
Опубликован Аннотация | Опубликован полный текст | Полнотекстовая перекрестная ссылка
Боулби, Дж. (1982). Привязанность и потеря: ретроспектива и перспектива. утра. Журнал ортопсихиатрии 52, 664–678.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Бремнер, Дж. Д., Личинио, Дж., Дарнелл, А., Кристал, Дж. Х., Оуэнс, М. Дж., Саутвик, С. М., Немерофф, С. Б., и Чарни, Д. С. (1997). Повышенные концентрации кортикотропин-рилизинг-фактора в спинномозговой жидкости при посттравматическом стрессовом расстройстве. утра. Журнал психиатрии 154, 624–629.
утра. Журнал психиатрии 154, 624–629.
Опубликован Аннотация | Опубликован полный текст
Браун, С. Э., Уивер, И. К. Г., Мини, М. Дж., и Шиф, М. (2008). Регионально-специфическое глобальное метилирование цитозина и экспрессия ДНК-метилтрансферазы в гиппокампе взрослой крысы. Неврологи. лат. 440, 49–53.
Опубликован Аннотация | Pubmed Full Text
Браун, В., Джин, П., Семан, С., Дарнелл, Дж. К., О’Доннелл, В. Т., Тененбаум, С. А., Джин, X., Фэн, Ю., Уилкинсон, К. Д., Кин, Дж. Д., Дарнелл, Р. Б., и Уоррен, С. Т. (2001). Идентификация микрочипов мРНК мозга, связанных с FMRP, и измененные профили трансляции мРНК при синдроме ломкой Х-хромосомы. Мобильный 107, 477–487.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Бунк, М., Цибере, Л., Хорват, К., Граф, К., Франк, Э., Кесслер, М.С., Мургатройд, К., Мюллер-Мыхсок, Б., Гоник, М. , Weber, P., Pütz, B., Muigg, P., Panhuysen, M., Singewald, N., Betteken, T. , Deussing, J.M., Holsboer, F., Spengler, D., and Landgraf, R. (2009). Аллель гипоморфного вазопрессина предотвращает поведение, связанное с тревогой. PLoS ONE 4, e5129. doi: 10.1371/journal.pone.0005129
, Deussing, J.M., Holsboer, F., Spengler, D., and Landgraf, R. (2009). Аллель гипоморфного вазопрессина предотвращает поведение, связанное с тревогой. PLoS ONE 4, e5129. doi: 10.1371/journal.pone.0005129
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Карпентер Л.Л., Шаттак Т.Т., Тырка А.Р., Герациоти Т.Д. и Прайс Л.Х. (2010). Влияние физического насилия в детстве на реакцию кортизола на стресс. Психофармакология (Берл.) 214, 367–375.
Опубликован Аннотация | Полный текст в публикации
Шампань Ф., Уивер И., Диорио Дж., Дымов С., Шиф М. и Мини М. Дж. (2006). Материнская забота связана с метилированием промотора рецептора эстрогена-альфа1b и экспрессией рецептора эстрогена-альфа в медиальной преоптической области женского потомства. Эндокринология 147, 2909–2915.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Conrad, C.D., LeDoux, J.E., Magariños, A.M., and McEwen, B. S. (1999). Повторяющийся ограничивающий стресс способствует выработке условного рефлекса страха независимо от атрофии дендритов CA3 гиппокампа. Поведение. Неврологи. 113, 902–913.
S. (1999). Повторяющийся ограничивающий стресс способствует выработке условного рефлекса страха независимо от атрофии дендритов CA3 гиппокампа. Поведение. Неврологи. 113, 902–913.
Опубликован Аннотация | Полный текст в публикации
Коплан, Дж. Д., Смит, Э. Л., Альтемус, М., Шарф, Б. А., Оуэнс, М. Дж., Немерофф, С. Б., Горман, Дж. М., и Розенблюм, Л. А. (2001). Переменная потребность в пище: устойчивое повышение концентрации кортикотропин-рилизинг-фактора в цистернальной спинномозговой жидкости у взрослых приматов. биол. Психиатрия 50, 200–204.
Опубликован Аннотация | Pubmed Full Text
Cukier, H.N., Rabionet, R., Konidari, I., Rayner-Evans, M.Y., Baltos, M.L., Wright, H.H., Abramson, R.K., Martin, E.R., Cuccaro, M.L., Pericak-Vance, M.A. и Гилберт, Дж. Р. (2010). Новые варианты, идентифицированные в генах метил-CpG-связывающего домена у людей с аутизмом. Нейрогенетика 11, 291–303.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Daniels, W. M., Fairbairn, L.R., van Tilburg, G., McEvoy, C.R., Zigmond, M.J., Russell, VA, and Stein, D.J. (2009). Разделение с матерью изменяет уровни фактора роста нервов и кортикостерона, но не статус метилирования ДНК экзона 1 (7) области промотора глюкокортикоидного рецептора. Метаб. Мозг Дис. 24, 615–627.
M., Fairbairn, L.R., van Tilburg, G., McEvoy, C.R., Zigmond, M.J., Russell, VA, and Stein, D.J. (2009). Разделение с матерью изменяет уровни фактора роста нервов и кортикостерона, но не статус метилирования ДНК экзона 1 (7) области промотора глюкокортикоидного рецептора. Метаб. Мозг Дис. 24, 615–627.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Де Беллис, доктор медицины, и Кучибхатла, М. (2006). Объемы мозжечка при посттравматическом стрессовом расстройстве у детей, связанном с жестоким обращением. биол. Психиатрия 60, 697–703.
Опубликован Аннотация | Опубликован полный текст
De Kloet, E.R., Vreugdenhil, E., Oitzl, M.S., and Joels, M. (1998). Баланс рецепторов кортикостероидов головного мозга в норме и при патологии. Эндокр. Ред. 19, 269–301.
Опубликован Аннотация | Pubmed Полный текст
Демпстер, Э. Л., Бурческу, И., Вигг, К., Кисс, Э., Баджи, И., Гадорос, Дж., Тамаш, З., Капорнаи, К. , Дароци, Г., Кеннеди , JL, Vetro, A., Kovacs, M., Barr, C.L., и Международный консорциум по расстройствам настроения в детском возрасте. (2009). Дальнейшие генетические данные свидетельствуют о причастности вазопрессиновой системы к расстройствам настроения, возникающим в детстве. Евро. Дж. Нейроски . 30, 1615–1619.
, Дароци, Г., Кеннеди , JL, Vetro, A., Kovacs, M., Barr, C.L., и Международный консорциум по расстройствам настроения в детском возрасте. (2009). Дальнейшие генетические данные свидетельствуют о причастности вазопрессиновой системы к расстройствам настроения, возникающим в детстве. Евро. Дж. Нейроски . 30, 1615–1619.
Опубликован Аннотация | Полный текст в публикации
Дозье, М., Пелосо, Э., Льюис, Э., Лоуренсо, Дж. П., и Левин, С. (2008). Влияние вмешательства, основанного на привязанности, на выработку кортизола у младенцев и детей ясельного возраста в приемных семьях. Дев. Психопат. 20, 845–859.
Опубликован Аннотация | Полный текст в публикации
Дадли, К.Дж., Ли, X., Кобор, М.С., Киппин, Т.Е., и Бреди, Т.В. (2011). Эпигенетические механизмы, опосредующие уязвимость и устойчивость к психическим расстройствам. Неврологи. Биоповедение . doi: 10.1016/j.neubiorev.2010.12.016. [Epub перед печатью].
CrossRef Full Text
Эрлих, С. , Вайс, Д., Бургхардт, Р., Инфанте-Дуарте, К., Брокгауз, С., Мюшлер, М. А., Блайх, С., Лемкул, У., и Фрилинг , Х. (2010). Промоутер-специфическое метилирование ДНК и экспрессия генов POMC у пациентов с острой недостаточностью веса и выздоровевших пациентов с нервной анорексией. J. Psychiatr. Рез . 44, 827–833.
, Вайс, Д., Бургхардт, Р., Инфанте-Дуарте, К., Брокгауз, С., Мюшлер, М. А., Блайх, С., Лемкул, У., и Фрилинг , Х. (2010). Промоутер-специфическое метилирование ДНК и экспрессия генов POMC у пациентов с острой недостаточностью веса и выздоровевших пациентов с нервной анорексией. J. Psychiatr. Рез . 44, 827–833.
Опубликован Аннотация | Опубликован полный текст
Эйланд, Л., и Макьюэн, Б.С. (2010). Стресс в раннем возрасте, за которым следует последующий хронический стресс во взрослом возрасте, усиливает тревогу и притупляет структурное ремоделирование гиппокампа. Гиппокамп. doi: 10.1002/hipo.20862. [Epub перед печатью].
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Эллиот Э., Эзра-Нево Г., Регев Л., Нойфельд-Коэн А. и Чен А. (2010). Устойчивость к социальному стрессу совпадает с функциональным метилированием ДНК гена Crf у взрослых мышей. Нац. Нейроски . 13, 1351–1353.
Опубликован Аннотация | Полный текст Pubmed
Фернандес-Теруэль, А. , Хименес-Льорт, Л., Эскориуэла, Р. М., Гил, Л., Агилар, Р., Штаймер, Т., и Тобенья, А. (2002). Стимуляция обработки в раннем возрасте и обогащение окружающей среды: некоторые из их эффектов опосредованы сходными нейронными механизмами? Фармакол. Биохим. Поведение 73, 233–245.
, Хименес-Льорт, Л., Эскориуэла, Р. М., Гил, Л., Агилар, Р., Штаймер, Т., и Тобенья, А. (2002). Стимуляция обработки в раннем возрасте и обогащение окружающей среды: некоторые из их эффектов опосредованы сходными нейронными механизмами? Фармакол. Биохим. Поведение 73, 233–245.
Опубликован Аннотация | Полный текст в публикации
Фишер, П.А., Стулмиллер, М., Гуннар, М.Р., и Беррастон, Б.О. (2007). Эффекты терапевтического вмешательства для приемных дошкольников на суточную активность кортизола. Психонейроэндокринология 32, 892–905.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Фрага, М. Ф., Баллестар, Э., Пас, М. Ф., Роперо, С., Сетьен, Ф., Баллестар, М. Л., Хайне-Суньер, Д., Сигудоса, Дж. К., Уриосте, М., Бенитес, Дж., Буа-Шорне М., Санчес-Агилера А., Линг К., Карлссон Э., Поулсен П., Вааг А., Стефан З., Спектор Т. Д., Ву Ю. З., Пласс, К., и Эстеллер, М. (2005). Эпигенетические различия возникают в течение жизни монозиготных близнецов. Проц. Натл. акад. науч. США 102, 10604–10609.
Проц. Натл. акад. науч. США 102, 10604–10609.
Опубликован Аннотация | Полный текст в публикации
Фрэнсис Д., Диорио Дж., Лю Д. и Мини М.Дж. (1999). Негеномная передача через поколения материнского поведения и реакции на стресс у крыс. Наука 286, 1155–1158.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Фрайс, А.Б., и Поллак, С.Д. (2004). Понимание эмоций у постинституционализированных восточноевропейских детей. Дев. Психопат. 16, 355–369.
Опубликован Аннотация | Pubmed Full Text
Фукэ К., Шимабукуро М., Петронис А., Сугимото Дж., Ода Т., Миура К., Миядзаки Т., Огура К., Окадзаки Ю., и Джинно, Ю. (2004). Возрастные изменения содержания 5-метилцитозина в периферических лейкоцитах и плацентах человека: исследование на основе ВЭЖХ. Энн. Гум. Жене. 68, 196–204.
Опубликован Аннотация | Полный текст в публикации
Глюкман, П. Д., Хэнсон, М. А., Купер, К., и Торнбург, К. Л. (2008). Влияние условий внутриутробного развития и раннего периода жизни на здоровье и болезни взрослых. Н. англ. Дж. Мед. 359, 61–73.
Л. (2008). Влияние условий внутриутробного развития и раннего периода жизни на здоровье и болезни взрослых. Н. англ. Дж. Мед. 359, 61–73.
Опубликован Аннотация | Pubmed Full Text
Goekoop, JG, de Winter, R.P., de Rijk, R., Zwinderman, KH, Frankhuijzen-Sierevogel, A., and Wiegant, VM (2006). Депрессия с вазопрессином плазмы выше нормы: подтверждение отношениями с семейной историей депрессии и смешанной тревогой и заторможенностью. Психиатрия Рез . 141, 201–211.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Гонсалес, М.Л., и ЛаСалль, Дж.М. (2010). Роль MeCP2 в развитии мозга и нарушениях развития нервной системы. Курс. Представитель психиатрии . 12, 127–134.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Графодатская Д., Чанг Б., Сатмари П. и Вексберг Р. (2010). Расстройства аутистического спектра и эпигенетика. Дж. Ам. акад. Ребенок-подросток. Психиатрия 49, 794–809.
Опубликован Аннотация | Полный текст в публикации
Грейсон, Д. Р., Цзя, X., Чен, Ю., Шарма, Р. П., Митчелл, С. П., Гвидотти, А., и Коста, Э. (2005). Гиперметилирование промотора рилина при шизофрении. Проц. Натл. акад. науч. США 102, 9341–9346.
Опубликован Аннотация | Полный текст публикации
Грир, П.Л., и Гринберг, М.Е. (2008). От синапса к ядру: кальций-зависимая транскрипция генов в контроле развития и функционирования синапсов. Нейрон 59, 846–860.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Halusková, J. (2010). Эпигенетические исследования болезней человека. Фолиа Биол. (Прага) 56, 83–96.
Опубликовано Резюме | Полный текст в публикации
Ханауэр, А., и Янг, И.Д. (2002). Синдром Коффина-Лоури: клинические и молекулярные особенности. J. Med. Жене. 39, 705–713.
Опубликован Аннотация | Pubmed Full Text
Heim, C., Mletzko, T., Purselle, D. , Mussselman, D.L., и Nemeroff, C.B. (2008). Тест дексаметазона/кортикотропин-рилизинг-фактора у мужчин с большой депрессией: роль детской травмы. биол. Психиатрия 63, 398–405.
, Mussselman, D.L., и Nemeroff, C.B. (2008). Тест дексаметазона/кортикотропин-рилизинг-фактора у мужчин с большой депрессией: роль детской травмы. биол. Психиатрия 63, 398–405.
Опубликован Аннотация | Опубликован полный текст
Хейм, К., и Немерофф, К.Б. (2002). Нейробиология стресса в раннем возрасте: клинические исследования. Семин. клин. Нейропсихиатрия 7, 147–159.
Опубликован Аннотация | Полный текст Pubmed
Эрнандес, Д. Г., Наллс, М. А., Гиббс, Дж. Р., Арепалли, С., Ван дер Брюг, М., Чонг, С., Мур, М., Лонго, Д. Л., Куксон, М. Р., Трейнор, Б. Дж. и Синглтон, А.Б. (2011). Отчетливые изменения метилирования ДНК сильно коррелируют с хронологическим возрастом в человеческом мозге. Гул. Мол. Жене. 20, 1164–1172.
Опубликован Аннотация | Полный текст в публикации
Хойзер И., Яссуридис А. и Холсбур Ф. (1994). Комбинированный тест дексаметазон/CRH: усовершенствованный лабораторный тест на психические расстройства. J. Psychiatr. Рез. 28, 341–356.
Psychiatr. Рез. 28, 341–356.
Опубликован Аннотация | Pubmed Full Text
Hochberg, Z., Feil, R., Constancia, M., Fraga, M., Junien, C., Carel, JC, Boileau, P., Le Bouc, Y., Deal, C.L., Lillycrop К., Шарфманн Р., Шеппард А., Скиннер М., Шиф М., Уотерленд Р. А., Ваксман Д. Дж., Уайтлоу Э., Онг К. и Альбертссон-Викланд К. ( 2010). Здоровье ребенка, пластичность развития и эпигенетическое программирование. Эндокр. Ред. 32, 159–224.
Опубликован Аннотация | Полный текст в публикации
Холмс А., Ле Гиске А. М., Фогель Э., Мильштейн Р. А., Леман С. и Белзунг К. (2005). Генетические, эпигенетические и экологические факторы раннего периода жизни, формирующие эмоциональность грызунов. Неврологи. Биоповедение. Версия . 29, 1335–1346.
Опубликован Аннотация | Полный текст в публикации
Холсбур, Ф. (2000). Гипотеза кортикостероидных рецепторов депрессии. Нейропсихофарма 23, 477–501. (2009). Регуляция метилирования гистона h4 гиппокампа при остром и хроническом стрессе. Проц. Натл. акад. науч. США . 106, 20912–20917.
Проц. Натл. акад. науч. США . 106, 20912–20917.
Опубликован Аннотация | Полный текст в публикации
Хуот, Р.Л., Гонсалес, М.Е., Лэдд, К.О., Тривикраман, К.В., и Плотский, П.М. (2004). Приемные пометы предотвращают сенсибилизацию гипоталамо-гипофизарно-надпочечниковой оси, опосредованную неонатальным отделением от матери. Психонейроэндокринология 29, 279–289.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Иллингворт, Р. С., и Берд, А. П. (2009). CpG-островки – «примерный путеводитель» FEBS Lett. 583, 1713–1720 гг.
Опубликован Аннотация | Полный текст в публикации
Иманака А., Моринобу С., Токи С., Ямамото С., Мацуки А., Кодзуру Т. и Ямаваки С. (2008). Тактильная стимуляция новорожденных обращает влияние неонатальной изоляции на открытое поле и тревожное поведение, а также на болевую чувствительность у взрослых самцов и самок крыс Sprague-Dawley. Поведение. Мозг Res. 186, 91–97.
Опубликован Аннотация | Полный текст в публикации
Йениш, Р. , и Берд, А. (2003). Эпигенетическая регуляция экспрессии генов: как геном интегрирует внутренние сигналы и сигналы окружающей среды? Нац. Жене. 33, 245–254.
, и Берд, А. (2003). Эпигенетическая регуляция экспрессии генов: как геном интегрирует внутренние сигналы и сигналы окружающей среды? Нац. Жене. 33, 245–254.
Опубликован Аннотация | Pubmed Full Text
Дженсен Л.Р., Аменде М., Гурок У., Мозер Б., Гиммель В., Цшах А., Янеке А.Р., Таривердян Г., Челли Дж., Фринс, Дж. П., Ван Эш, Х., Клифстра, Т., Хамель, Б., Морейн, К., Геч, Дж., Тернер, Г., Райнхардт, Р., Кальшойер, В. М., Роперс, Х. Х., и Ленцнер, С. (2005). Мутации в гене JARID1C, который участвует в регуляции транскрипции и ремоделировании хроматина, вызывают Х-сцепленную умственную отсталость. 901:24 утра. Дж. Хам. Жене . 76, 227–236.
Опубликован Аннотация | Полный текст в публикации
Jenuwein, T., and Allis, CD (2001). Трансляция гистонового кода. Наука 293, 1074–1080.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Джинтаридт, П., и Мутирангура, А. (2010). Отличительные закономерности возрастного гипометилирования в чередующихся повторяющихся последовательностях. Физиол. Геномика PMID: 20145203. 41, 194–200.
Физиол. Геномика PMID: 20145203. 41, 194–200.
Опубликован Аннотация | Опубликован полный текст | Полнотекстовая перекрестная ссылка
Йоргенсен, Х. Ф., и Берд, А. (2002). MeCP2 и другие белки, связывающие метил-CpG. Мент. Замедлить. Дев. Инвалид. Рез. Ред. 8, 87–93.
Опубликован Аннотация | Pubmed Full Text
Каминский З. А., Тан Т., Ван С. К., Птак С., О, Г. Х., Вонг А. Х., Фельдкамп Л. А., Виртанен К., Хальварсон Дж., Тиск К., Макрей А.Ф., Вишер П.М., Монтгомери Г.В., Готтесман И.И., Мартин Н.Г. и Петронис А. (2009). Профили метилирования ДНК у монозиготных и дизиготных близнецов. Нац. Жене . 41, 240–245.
Опубликован Аннотация | Pubmed Full Text
Кесслер, М.С., Мургатройд, К., Банк, М., Чибере, Л., Франк, Э., Джейкоб, В., Хорват, К., Муйгг, П., Холсбур, Ф., Сингевальд , Н., Шпенглер, Д., и Ландграф, Р. (2007). Несахарный диабет и, частично, поведение, связанное с низкой тревожностью, связаны с дефицитом вазопрессина, связанным с SNP, у мышей LAB. евро. Дж. Нейроски . 26, 2857–2864.
евро. Дж. Нейроски . 26, 2857–2864.
Опубликован Аннотация | Полный текст в публикации
Клифстра Т., Бруннер Х. Г., Амиэль Дж., Удаккер А. Р., Ниллесен В. М., Маги А., Женевьев Д., Кормье-Дэр В., ван Эш Х., Фринс, Дж. П., Хамель, Б. К., Систерманс, Э. А., де Врис, Б. Б., и ван Боховен, Х. (2006). Мутации с потерей функции гистонметилтрансферазы 1 эухроматина (EHMT1) вызывают 9Синдром субтеломерной делеции q34. утра. Дж. Хам. Жене . 2, 370–377.
Крамер, Дж. М., и ван Боховен, Х. (2009). Генетические и эпигенетические дефекты умственной отсталости. Междунар. Дж. Биохим. Клеточный Биол . 41, 96–107.
Опубликован Аннотация | Полный текст в публикации
Куратоми Г., Ивамото К., Бундо М., Кусуми И., Като Н., Ивата Н., Одзаки Н. и Като Т. (2008). Аберрантное метилирование ДНК, связанное с биполярным расстройством, выявлено у дискордантных монозиготных близнецов. Мол. Психиатрия 13, 429–441.
Опубликован Аннотация | Полный текст в публикации
Кваби-Аддо, Б. , Чанг, В., Шен, Л., Иттманн, М., Уилер, Т., Елинек, Дж., и Исса, Дж. П. (2007). Возрастные изменения метилирования ДНК в нормальных тканях предстательной железы человека. клин. Рак Res . 13, 3796–3802.
, Чанг, В., Шен, Л., Иттманн, М., Уилер, Т., Елинек, Дж., и Исса, Дж. П. (2007). Возрастные изменения метилирования ДНК в нормальных тканях предстательной железы человека. клин. Рак Res . 13, 3796–3802.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Ладд, К.О., Хуот, Р.Л., Тривикраман, К.В., Немерофф, С.Б., и Плотский, П.М. (2004). Долговременная адаптация мРНК глюкокортикоидных рецепторов и минералокортикоидных рецепторов и отрицательная обратная связь на гипоталамо-гипофизарно-надпочечниковой оси после неонатального отделения от матери. биол. Психиатрия 55, 367–375.
Опубликован Аннотация | Pubmed Full Text
Lee, R.S., Tamashiro, K.L., Yang, X., Purcell, R.H., Harvey, A., Willour, V.L., Huo, Y., Rongione, M., Wand, G.S., and Potash, J.B. ( 2010). Хроническое воздействие кортикостерона увеличивает экспрессию и снижает метилирование Fkbp5 дезоксирибонуклеиновой кислотой у мышей. Эндокринология 151, 4332–4343.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Лю, Д., Диорио, Дж., Танненбаум, Б., Калджи, К., Фрэнсис, Д., Фридман, А., Шарма, С., Пирсон, Д., Плотский, П. М., и Мини, М.Дж. (1997). Материнская забота, глюкокортикоидные рецепторы гиппокампа и реакции гипоталамо-гипофизарно-надпочечниковой системы на стресс. Наука 277, 1659–1662.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Лопес, М.Ф., Доремус-Фитцуотер, Т.Л., и Беккер, Х.К. (2010). Хроническая социальная изоляция и хронический переменный стресс на раннем этапе развития вызывают позднее повышенное потребление этанола у взрослых мышей C57BL/6J. Спирт . doi: 10.1016/j.alcohol.2010.08.017. [Epub перед печатью].
Опубликовано Резюме | Опубликован полный текст | Полный текст CrossRef
Любин, Ф.Д., Рот, Т.Л., и Суитт, Дж.Д. (2008). Эпигенетическая регуляция транскрипции гена bdnf при консолидации памяти о страхе. J. Neurosci. 28, 10576–10586.
Neurosci. 28, 10576–10586.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Мартинович, К., Хаттори, Д., Ву, Х., Фаус, С., Хе, Ф., Ху, Ю., Фан, Г. и Сун, Ю. Э. (2003). Ремоделирование хроматина, связанное с метилированием ДНК, в зависимой от активности регуляции гена BDNF. Наука 302, 890–893.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Мастроени, Д., Макки, А., Гровер, А., Роджерс, Дж., и Коулман, П.Д. (2009). Эпигенетические различия в корковых нейронах у пары монозиготных близнецов, дискордантных по болезни Альцгеймера. PLoS ONE 4, e6617. doi: 10.1371/journal.pone.0006617
Pubmed Abstract | Опубликован полный текст | CrossRef Полный текст
Мейз, И., Ковингтон, Х. Э., III, Дитц, Д. М., Лаплант, К., Рентал, В., Руссо, С. Дж., Механик, М., Музон, Э., Неве, Р. Л., Хаггарти, С. Дж. , Рен Ю., Сампат С. К., Херд Ю. Л., Грингард П., Тараховский А., Шефер А. и Нестлер Э. Дж. (2010). Существенная роль гистонметилтрансферазы G9в пластичности, вызванной кокаином. Наука 327, 213–216.
Дж. (2010). Существенная роль гистонметилтрансферазы G9в пластичности, вызванной кокаином. Наука 327, 213–216.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
МакКрори, Э., Де Брито, С.А., и Видинг, Э. (2010). Обзор исследований: нейробиология и генетика жестокого обращения и невзгод. Дж. Детская психология. Психиатрия 51, 1079–1095.
Опубликован Аннотация | Pubmed Full Text
МакГоуэн П.О., Сасаки А., Д’Алессио А.К., Дымов С., Лабонте Б., Шиф М., Турецкий Г. и Мини М.Дж. (2009 г.). Эпигенетическая регуляция глюкокортикоидного рецептора в мозге человека связана с жестоким обращением в детстве. Нац. Неврологи. 12, 342–348.
Опубликован Аннотация | Полный текст в публикации
Макгоуэн, П.О., Сасаки, А., Хуанг, Т.К.Т., Унтербергер, А., Судерман, М., Эрнст, К., Мини, М.Дж., Турецкий, Г., и Шиф, М. (2008) . Промоторное гиперметилирование промотора гена рибосомной РНК в суицидальном мозге. PLoS ONE 3, e2085. doi: 10.1371/journal.pone.0002085
doi: 10.1371/journal.pone.0002085
Опубликовано Резюме | Опубликован полный текст | Полный текст CrossRef
Мини, М. Дж., Диорио, Дж., Фрэнсис, Д., Уиддоусон, Дж., ЛаПланте, П., Калджи, К., Шарма, С., Секл, Дж. Р., и Плотски, П. М. (1996) . Ранняя экологическая регуляция экспрессии генов глюкокортикоидных рецепторов переднего мозга: последствия для адренокортикальных реакций на стресс. Дев. Неврологи. 18, 49–72.
Опубликован Аннотация | Полный текст в публикации
Менгер, Ю., Беттшайдер, М., Мургатройд, К., и Шпенглер, Д. (2010). Половые различия в эпигенетике мозга. Эпигеномика 2, 807–821.
Мейнен, Г., Унмехопа, У. А., ван Херихуиз, Дж. Дж., Хофман, М. А., Свааб, Д. Ф., и Хогендейк, У. Дж. (2006). Повышенная экспрессия мРНК аргинина и вазопрессина в гипоталамусе человека при депрессии: предварительный отчет. биол. Психиатрия 60, 892–895.
Опубликован Аннотация | Pubmed Full Text
Mizoguchi, Y., Kajiume, T. , Miyagawa, S., Okada, S., Nishi, Y., and Kobayashi, M. (2007). Стероид-зависимый карциноид тимуса, продуцируемый АКТГ: регуляция экспрессии гена POMC кортизолом посредством метилирования его промоторной области. Горм. Рез. 67, 257–262.
, Miyagawa, S., Okada, S., Nishi, Y., and Kobayashi, M. (2007). Стероид-зависимый карциноид тимуса, продуцируемый АКТГ: регуляция экспрессии гена POMC кортизолом посредством метилирования его промоторной области. Горм. Рез. 67, 257–262.
Опубликован Аннотация | Полный текст в публикации
Молес, А., Киффер, Б.Л., и Д’Амато, Ф.Р. (2004). Дефицит поведения привязанности у мышей, лишенных гена мю-опиоидного рецептора. Наука 304, 1983–1986.
Опубликован Аннотация | Полный текст в публикации
Мюллер, Б. Р., и Бэйл, Т. Л. (2008). Половое программирование эмоциональности потомства после стресса на ранних сроках беременности. J. Neurosci. 28, 9055–9065.
Опубликован Аннотация | Опубликован полный текст
Мургатройд С., Патчев А. В., Ву Ю., Микале В., Бокмюль Ю., Фишер Д., Холсбур Ф., Вотьяк С. Т., Алмейда О. Ф. и Шпенглер Д. ( 2009). Динамическое метилирование ДНК программирует стойкие неблагоприятные последствия стресса в раннем возрасте. Нац. Неврологи. 12, 1559–1566.
Нац. Неврологи. 12, 1559–1566.
Опубликован Аннотация | Pubmed Full Text
Мургатройд, К., Виггер, А., Франк, Э., Зингевальд, Н., Банк, М., Холсбур, Ф., Ландграф, Р., и Шпенглер, Д. (2004). Нарушение репрессии при полиморфизме промотора вазопрессина лежит в основе сверхэкспрессии вазопрессина в крысиной модели личностной тревожности. Дж. Нейроски . 24, 7762–7770.
Опубликован Аннотация | Pubmed Full Text
Murgatroyd, C., Wu, Y., Bockmühl, Y., and Spengler, D. (2010a). Гены учатся на стрессе: как детская травма программирует нас на депрессию? Эпигенетика 5, 194–199.
Мургатройд, К., Ву, Ю., Бокмюль, Ю., и Шпенглер, Д. (2010b). Лицо Януса метилирования ДНК при старении. Старение (Олбани, Нью-Йорк) 2, 107–110.
Мюшлер, М. А., Хиллемахер, Т., Краус, К., Корнхубер, Дж., Блайх, С., и Фрилинг, Х. (2010). Метилирование ДНК промотора гена РОМС связано с тягой к алкоголю. Дж. Нейронная передача. 117, 513–519.
Опубликован Аннотация | Полный текст в публикации
Nemeroff, C.B., Owens, M.J., Bissette, G., Andorn, A.C., and Stanley, M. (1988). Уменьшение количества мест связывания рилизинг-фактора кортикотропина в лобной коре у жертв самоубийств. Арх. Общая психиатрия 45, 577–579.
Опубликован Аннотация | Опубликован полный текст
О’Коннор, Т. Г., и Раттер, М. (2000). Поведение с расстройством привязанности после ранней тяжелой депривации: расширение и лонгитюдное наблюдение. Английская и румынская группа по изучению приемных детей. Дж. Ам. акад. Ребенок-подросток. Психиатрия 39, 703–712.
Опубликован Аннотация | Pubmed Full Text
Perisic, T., Zimmermann, N., Kirmeier, T., Asmus, M., Tuorto, F., Uhr, M., Holsboer, F., Rein, T., and Zschocke, J. (2010). Вальпроат и амитриптилин оказывают общее и разное влияние на глобальные и специфичные для промотора генов модификации хроматина в первичных астроцитах крысы. Нейропсихофармакология 35, 792–805.
Опубликован Аннотация | Опубликован полный текст
Петрий Ф., Джайлз Р. Х., Дауверс Х. Г., Сарис Дж. Дж., Хеннекам Р. К., Масуно М., Томмеруп Н., ван Оммен Г. Дж., Гудман Р. Х. и Питерс Д. Дж. (1995). Синдром Рубинштейна-Тайби, вызванный мутациями транскрипционного коактиватора CBP. Природа 376, 348–351.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Петронис, А., Готтесман, И.И., Кан, П., Кеннеди, Дж.Л., Базиле, В.С., Патерсон, А.Д., и Попендиките, В. (2003). Монозиготные близнецы демонстрируют многочисленные эпигенетические различия: ключи к дискордантности близнецов? Шизофр. Бык . 29, 169–178.
Опубликован Аннотация | Полный текст в публикации
Пикеттс, Д. Дж., Хиггс, Д. Р., Бачу, С., Блейк, Д. Дж., Куаррелл, О. В., и Гиббонс, Р. Дж. (1996). ATRX кодирует новый член семейства белков SNF2: мутации указывают на общий механизм, лежащий в основе синдрома ATR-X. Гул. Мол. Жене . 5, 1899–1907 гг.
Опубликован Аннотация | Полный текст в публикации
Плотский, П.М., и Мини, М.Дж. (1993). Ранний постнатальный опыт изменяет мРНК гипоталамического кортикотропин-рилизинг-фактора (CRF), среднее значение содержания CRF и вызванное стрессом высвобождение у взрослых крыс. Мозг Res. Мол. Мозг Res. 18, 195–200.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Поултер, М. О., Ду, Л., Уивер, И. К., Палковиц, М., Фалуди, Г., Мерали, З., Шиф, М., и Анисман, Х. (2008). Гиперметилирование промотора рецептора ГАМКА в мозге суицида: значение участия эпигенетических процессов. биол. Психиатрия 64, 645–652.
Опубликован Аннотация | Опубликован полный текст
Куреши, И. А., и Мелер, М. Ф. (2010). Генетические и эпигенетические основы половых различий в головном мозге и восприимчивости к неврологическим и психическим заболеваниям. Прогр. Мозг Res. 186, 77–95.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Raadsheer, F. C., Hoogendijk, WJ, Stam, F.C., Tilders, F.J., and Swaab, D.F. (1994). Увеличение числа нейронов, экспрессирующих кортикотропин-рилизинг-гормон, в гипоталамическом паравентрикулярном ядре у пациентов с депрессией. Нейроэндокринология 60, 436–444.
C., Hoogendijk, WJ, Stam, F.C., Tilders, F.J., and Swaab, D.F. (1994). Увеличение числа нейронов, экспрессирующих кортикотропин-рилизинг-гормон, в гипоталамическом паравентрикулярном ядре у пациентов с депрессией. Нейроэндокринология 60, 436–444.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Ramocki, MB, and Zoghbi, HY (2008). Нарушение нейронального гомеостаза приводит к распространенным нейропсихиатрическим фенотипам. Природа 455, 912–918.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Разин, А., и Сидар, Х. (1977). Распределение 5-метилцитозина в хроматине. Проц. Натл. акад. науч. США 74, 2725–2728.
Опубликован Аннотация | Полный текст в публикации
Родригес-Родеро, С., Фернандес-Морера, Х.Л., Фернандес, А.Ф., Менендес-Торре, Э., и Фрага, М.Ф. (2010). Эпигенетическая регуляция старения. Дисков. Мед. 10, 225–233.
Опубликовано Резюме | Полный текст в публикации
Рот, Т. Л., Любин, Ф.Д., Функ, А.Дж., и Суитт, Дж.Д. (2009). Длительное эпигенетическое влияние невзгод в раннем возрасте на ген BDNF. биол. Психиатрия 65, 760–769.
Л., Любин, Ф.Д., Функ, А.Дж., и Суитт, Дж.Д. (2009). Длительное эпигенетическое влияние невзгод в раннем возрасте на ген BDNF. биол. Психиатрия 65, 760–769.
Опубликован Аннотация | Полный текст в публикации
Рот, Т.Л., Золадз, П.Р., Суитт, Дж.Д., и Даймонд, Д.М. (2011). Эпигенетическая модификация ДНК Bdnf гиппокампа у взрослых крыс на животной модели посттравматического стрессового расстройства. J. Psychiatr. Рез . doi: 10.1016/j.psychires.2011.01.013. [Epub перед печатью].
CrossRef Full Text
Rupprecht, R., Lesch, K.P., Muller, U., Beck, G., Beckmann, H., and Schulte, H.M. (1989). Притупление адренокортикотропина, но нормальное высвобождение бета-эндорфина после введения человеческого кортикотропин-рилизинг-гормона при депрессии. Дж. Клин. Эндокринол. Метаб. 69, 600–603.
Опубликован Аннотация | Опубликован полный текст
Раттер, М. (1998). Отставание в развитии и дефицит после усыновления после серьезной глобальной ранней лишенности, группа изучения английского и румынского усыновленных детей (ERA). Дж. Детская психология. Психиатрия 39, 465–476.
Дж. Детская психология. Психиатрия 39, 465–476.
Опубликован Аннотация | Полный текст в публикации
Санчес, М.М., МакКормак, К., Гранд, А.П., Фулкс, Р., Графф, А., и Маэстрипьери, Д. (2010). Влияние секса и жестокого обращения с матерью в раннем возрасте на реакцию адренокортикотропного гормона и кортизола на введение кортикотропин-высвобождающего гормона в течение первых 3 лет жизни у макак-резусов, живущих в группах. Дев. Психопат. 22, 45–53.
Опубликован Аннотация | Опубликован полный текст | Полнотекстовая перекрестная ссылка
Сартр, Ж.-П. (1964). Лес Мотс. Париж: Gallimard 254–255.
Шлотц, В., Джонс, А., Филлипс, Д.И., Гейл, К.Р., Робинсон, С.М., и Годфри, К.М. (2010). Более низкий уровень фолиевой кислоты у матери на ранних сроках беременности связан с детской гиперактивностью и проблемами со сверстниками у потомства. Дж. Детская психология. Психиатрия 51, 594–602.
Опубликован Аннотация | Полный текст в публикации
Schore, AN (2000). Привязанность и регуляция правого полушария. Прикрепить. Гум. Дев. 2, 23–47.
Привязанность и регуляция правого полушария. Прикрепить. Гум. Дев. 2, 23–47.
Опубликован Аннотация | Полный текст в публикации
Секл, Дж. Р., и Мини, М. Дж. (2004). Глюкокортикоидное программирование. Энн. Академик Нью-Йорка науч. 1032, 63–84.
Опубликован Аннотация | Полный текст в публикации
Седлак, А.Дж., и Бродхерст, Д.Д. (1996). Третье национальное исследование случаев жестокого обращения с детьми и безнадзорности . Вашингтон, округ Колумбия: Министерство здравоохранения и социальных служб США, Национальный центр жестокого обращения с детьми и безнадзорности.
Smotherman, W.P., Bell, R.W., Starzec, J., Elias, J., and Zachman, T.A. (1974). Материнские реакции на волализационные реакции младенцев и обонятельные сигналы у крыс и мышей. Поведение. биол. 15, 55–66.
Сун, С. X., Зулвах, К. Э., Фу, Ю., Дай, К., Йи, К., Ли, X., Ли, Ю., Чен, Ч. Х., Чжан, В., Цзянь, X., Ван Дж., Чжан Л., Луни Т.Дж., Чжан Б. , Годли Л.А., Хикс Л.М., Лан Б.Т., Джин П. и Хе К. (2011). Селективная химическая маркировка выявляет широкогеномное распределение 5-гидроксиметилцитозина. Нац. Биотехнолог. 29, 68–72.
, Годли Л.А., Хикс Л.М., Лан Б.Т., Джин П. и Хе К. (2011). Селективная химическая маркировка выявляет широкогеномное распределение 5-гидроксиметилцитозина. Нац. Биотехнолог. 29, 68–72.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Suzuki, MM, and Bird, A. (2008). Ландшафты метилирования ДНК: провокационные выводы из эпигеномики. Нац. Преподобный Жене. 9, 465–476.
Опубликован Аннотация | Полный текст в публикации
Такасуги, М. (2011). Прогрессивные возрастные изменения метилирования ДНК начинаются в тканях мышей до наступления взрослой жизни. Мех. Старение Дев. 132, 65–71.
Опубликован Аннотация | Опубликован полный текст | Полнотекстовая перекрестная ссылка
Тарулло, А. Р., и Гуннар, М. Р. (2006). Жестокое обращение с детьми и развивающаяся ось HPA. Горм. Поведение 50, 632–639.
Опубликован Аннотация | Полный текст в публикации
Таттон-Браун, К., и Рахман, Н. (2007). Синдром Сотоса. евро. Дж. Хам. Жене. 3, 264–271.
(2007). Синдром Сотоса. евро. Дж. Хам. Жене. 3, 264–271.
Томпсон, Р. Ф., Ацмон, Г., Георге, К., Лян, Х. К., Лоуэс, К., Грелли, Дж. М., и Барзилай, Н. (2010). Тканеспецифическое нарушение регуляции метилирования ДНК при старении. Ячейка старения 9, 506–518.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Турек-Плева, Дж., и Ягодзински, П.П. (2005). Роль ДНК-метилтрансфераз млекопитающих в регуляции экспрессии генов. Клеточная мол. биол. лат. 10, 631–647.
Опубликован Аннотация | Полный текст в публикации
Тырка, А. Р., Прайс, Л. Х., Гелернтер, Дж., Шепкер, К., Андерсон, Г. М., и Карпентер, Л. Л. (2009). Взаимодействие жестокого обращения в детстве с геном рецептора кортикотропин-высвобождающего гормона: влияние на реактивность гипоталамо-гипофизарно-надпочечниковой оси. биол. Психиатрия 66, 681–685.
Опубликован Аннотация | Pubmed Full Text
Учида С., Хара К., Кобаяси А. , Оцуки К., Ямагата Х., Хобара Т., Судзуки Т., Мията Н. и Ватанабэ Ю. (2011). Эпигенетический статус Gdnf в вентральном стриатуме определяет восприимчивость и адаптацию к ежедневным стрессовым событиям. Нейрон 69, 359–372.
, Оцуки К., Ямагата Х., Хобара Т., Судзуки Т., Мията Н. и Ватанабэ Ю. (2011). Эпигенетический статус Gdnf в вентральном стриатуме определяет восприимчивость и адаптацию к ежедневным стрессовым событиям. Нейрон 69, 359–372.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
ван Эрс, Х. Дж., де Клот, Э. Р., и Левин, С. (1999). Стойкое влияние материнской депривации на регуляцию HPA может быть устранено кормлением и поглаживанием, но не дексаметазоном. J. Нейроэндокринол. 11, 581–588.
Опубликован Аннотация | Полный текст в публикации
Васкес, Д. М., Бейли, К., Дент, Г. В., Окимото, Д. К., Стеффек, А., Лопес, Дж. Ф., и Левин, С. (2006). Цепи кортикотропин-рилизинг-гормона (CRH) в головном мозге у развивающейся крысы: эффект материнской депривации. Мозг Res. 1121, 83–94.
Опубликовано Резюме | Опубликован полный текст | Полный текст CrossRef
Винема А. Х., Блюм А., Нидерле Д., Бувалда Б. и Нойманн И. Д. (2006). Влияние стресса в раннем возрасте на агрессию взрослых мужчин и гипоталамический вазопрессин и серотонин. евро. Дж. Нейроски. 24, 1711–1720.
Д. (2006). Влияние стресса в раннем возрасте на агрессию взрослых мужчин и гипоталамический вазопрессин и серотонин. евро. Дж. Нейроски. 24, 1711–1720.
Опубликован Аннотация | Полный текст в публикации
Фогт Г., Хубер М., Тиман М., ван ден Бугаарт Г., Шмитц О. Дж. и Шубарт К. Д. (2008). Производство разных фенотипов из одного и того же генотипа в одной и той же среде за счет вариаций развития. Дж. Эксп. биол. 211, 510–523.
Опубликован Аннотация | Опубликован полный текст
Ван, Х.-С., и Гао, У.-Дж. (2009). Типоспецифическое развитие рецепторов NMDA в интернейронах префронтальной коры крысы. Нейропсихофармакология 34, 2028–2040.
Опубликован Аннотация | Опубликован полный текст | Полный текст CrossRef
Wang, S.C., Oelze, B., and Schumacher, A. (2008). Возрастной эпигенетический дрейф при болезни Альцгеймера с поздним началом. ПЛОС ОДИН 3, e2698. doi: 10.1371/journal.pone.0002698
Pubmed Abstract | Опубликован полный текст | CrossRef Полный текст
Уивер, И. К., Червони, Н., Шампань, Ф. А., Д’Алессио, А. К., Шарма, С., Секл, Дж. Р., Дымов, С., Шиф, М., и Мини, М. Дж. (2004) . Эпигенетическое программирование материнским поведением. Нац. Неврологи. 7, 847–854.
К., Червони, Н., Шампань, Ф. А., Д’Алессио, А. К., Шарма, С., Секл, Дж. Р., Дымов, С., Шиф, М., и Мини, М. Дж. (2004) . Эпигенетическое программирование материнским поведением. Нац. Неврологи. 7, 847–854.
Опубликован Аннотация | Полный текст в публикации
Уивер, И. К., Шампань, Ф. А., Браун, С. Е., Дымов, С., Шарма, С., Мини, М. Дж., и Шиф, М. (2005). Изменение материнского программирования стрессовых реакций у взрослых потомков посредством добавления метила: изменение эпигенетической маркировки в более позднем возрасте. J. Neurosci. 25, 11045–11054.
Опубликован Аннотация | Опубликован полный текст | CrossRef Full Text
Вебер, М., Хеллманн, И., Стадлер, М.Б., Рамос, Л., Паабо, С., Ребхан, М., и Шубелер, Д. (2007). Распространение, потенциал молчания и эволюционное влияние метилирования промоторной ДНК в геноме человека. Нац. Жене. 39, 457–466.
Опубликован Аннотация | Pubmed Full Text
Юферов В., Нильсен Д. А. , Левран О., Рандеси М., Хамон С., Хо А., Моргелло С. и Крик М. Дж. (2011). Тканеспецифическое метилирование ДНК гена продинорфина человека в посмертных тканях мозга и РВМС. Фармакогенет. Геномика . 21, 185–196.
, Левран О., Рандеси М., Хамон С., Хо А., Моргелло С. и Крик М. Дж. (2011). Тканеспецифическое метилирование ДНК гена продинорфина человека в посмертных тканях мозга и РВМС. Фармакогенет. Геномика . 21, 185–196.
Опубликован Аннотация | Полный текст в публикации
Чжан, Т. Ю., Хеллстром, И. К., Багот, Р. К., Вен, X., Диорио, Дж., и Мини, М. Дж. (2010). Материнский уход и метилирование ДНК промотора декарбоксилазы 1 глутаминовой кислоты в гиппокампе крысы. J. Neurosci. 30, 13130–13137.
Опубликован Аннотация | Pubmed Full Text
Чжоу, З., Хун, Э. Дж., Коэн, С., Чжао, В. Н., Хо, Х. Ю., Шмидт, Л., Чен, В. Г., Линь, Ю., Савнер, Э., Гриффит, Э. К., Ху, Л., Стин, Дж. А., Вейц, С. Дж., и Гринберг, М. Э. (2006). Специфическое для мозга фосфорилирование MeCP2 регулирует зависимую от активности транскрипцию Bdnf, рост дендритов и созревание шипов. Нейрон 52, 255–269.
Опубликован Аннотация | Опубликован полный текст | CrossRef Полный текст
Эпигенетика раннего развития ребенка
- Список журналов
- Фронтовая психиатрия
-
т.
 2; 2011
2; 2011
- PMC3102328
Фронтовая психиатрия. 2011 г.; 2: 16.
Опубликовано онлайн 2011 апреля 18 апреля. Подготовленное онлайн 2011 март 12. DOI: 10.3389/fpsyt.2011.00016
1, * и 1
ПРИМЕЧАНИЕ ЗАМЕЧА
Всесторонние клинические исследования показывают, что неблагоприятные условия в раннем возрасте могут серьезно повлиять на развивающийся мозг и повысить уязвимость к расстройствам настроения в более позднем возрасте. В раннем постнатальном периоде мозг проявляет высокую пластичность, что позволяет сигналам окружающей среды изменять траектории быстро развивающихся цепей. Невзгоды в раннем возрасте способны формировать зависящее от опыта созревание путей регуляции стресса, лежащих в основе эмоциональных функций и эндокринных реакций на стресс, таких как гипоталамо-гипофизарно-надпочечниковая (ГГН) система, что приводит к длительному изменению реакции на стресс во взрослом возрасте. . На сегодняшний день в изучении взаимодействий генов и окружающей среды в человеческой популяции доминирует эпидемиология. Однако недавние исследования в области неврологии в настоящее время продвигают клинические исследования, конкретно обращаясь к механизмам, с помощью которых взаимодействия генов и окружающей среды могут предрасполагать людей к психопатологии. С этой целью разрабатываются соответствующие модели животных, в которых можно контролируемо манипулировать ранними факторами окружающей среды. Здесь мы рассмотрим недавние исследования, проведенные с общей целью понять влияние окружающей среды в раннем возрасте на формирование развития мозга, и обсудим недавно развивающуюся роль эпигенетических механизмов в преобразовании условий раннего периода жизни в долговременные изменения в экспрессии генов, лежащих в основе функций мозга. В частности, мы утверждаем, что эпигенетические механизмы могут опосредовать диалог между генами и окружающей средой в раннем возрасте и вызывать стойкое эпигенетическое программирование взрослой физиологии и дисфункции, что в конечном итоге приводит к заболеванию.
. На сегодняшний день в изучении взаимодействий генов и окружающей среды в человеческой популяции доминирует эпидемиология. Однако недавние исследования в области неврологии в настоящее время продвигают клинические исследования, конкретно обращаясь к механизмам, с помощью которых взаимодействия генов и окружающей среды могут предрасполагать людей к психопатологии. С этой целью разрабатываются соответствующие модели животных, в которых можно контролируемо манипулировать ранними факторами окружающей среды. Здесь мы рассмотрим недавние исследования, проведенные с общей целью понять влияние окружающей среды в раннем возрасте на формирование развития мозга, и обсудим недавно развивающуюся роль эпигенетических механизмов в преобразовании условий раннего периода жизни в долговременные изменения в экспрессии генов, лежащих в основе функций мозга. В частности, мы утверждаем, что эпигенетические механизмы могут опосредовать диалог между генами и окружающей средой в раннем возрасте и вызывать стойкое эпигенетическое программирование взрослой физиологии и дисфункции, что в конечном итоге приводит к заболеванию. Понимание того, как ранний жизненный опыт может привести к устойчивым эпигенетическим меткам, повышающим риск психических расстройств, как они сохраняются и как их можно обратить вспять, все больше становится предметом внимания современной психиатрии и должно проложить новые руководящие принципы для своевременных терапевтических вмешательств.
Понимание того, как ранний жизненный опыт может привести к устойчивым эпигенетическим меткам, повышающим риск психических расстройств, как они сохраняются и как их можно обратить вспять, все больше становится предметом внимания современной психиатрии и должно проложить новые руководящие принципы для своевременных терапевтических вмешательств.
Ключевые слова: эпигенетика, метилирование ДНК, хроматин, гипоталамо-гипофизарно-надпочечниковая ось, мозг, ранний возраст , 2008). Многие исследования на людях, приматах и грызунах показывают, что аспекты окружающей среды в раннем возрасте могут привести к резким изменениям в физическом и умственном развитии, ставя под угрозу сердечно-сосудистые и метаболические заболевания, изменение когнитивных функций, настроения и поведения. В частности, неблагоприятные условия в ранние периоды развития могут формировать индивидуальные различия в уязвимости к расстройствам, связанным со стрессом, на протяжении всей жизни (см. обзор Heim and Nemeroff, 2002) в зависимости от степени «совпадения» и «несоответствия» между ранним и более поздние жизненные среды.
Эти результаты поднимают интригующий вопрос о том, как эти переживания включаются на клеточном и молекулярном уровне в структуру мозга, что приводит к долгосрочным изменениям различных функций, что в конечном итоге приводит к повышенному риску психических заболеваний. Пластичность развития определяет способность организма адаптироваться к окружающей среде в раннем возрасте и осуществлять длительные изменения в наборах ключевых биологических программ, исходя из предположения, что условия окружающей среды в этот ранний период будут сохраняться на протяжении всей последующей жизни (обзор см. Hochberg et al. ., 2010). Неблагоприятный материнский опыт в раннем возрасте может сильно повлиять на зависимое от опыта созревание структур, лежащих в основе эмоциональных функций и эндокринных реакций на стресс, таких как система гипоталамо-гипофизарно-надпочечниковая (ГГН) — неотъемлемый компонент реакции организма на стресс, что приводит к усилению стрессоустойчивость во взрослом возрасте (см. обзор Seckl and Meaney, 2004). Действительно, депрессивные пациенты с историей жестокого обращения или пренебрежения в детстве часто характеризуются гиперактивностью оси HPA (для обзора см. Heim and Nemeroff, 2002).
обзор Seckl and Meaney, 2004). Действительно, депрессивные пациенты с историей жестокого обращения или пренебрежения в детстве часто характеризуются гиперактивностью оси HPA (для обзора см. Heim and Nemeroff, 2002).
Чтобы понять взаимодействие генов и окружающей среды в человеческих популяциях и выяснить пути, посредством которых опосредовано программирование в ответ на ранний жизненный опыт, исследователи в области неврологии полагаются на модели животных, в которых ранней средой можно управлять контролируемым образом. . Текущая работа предполагает, что так называемые эпигенетические механизмы регуляции генов, которые изменяют активность генов без изменения порядка их последовательности ДНК, могут объяснить, как ранний жизненный опыт может оставлять неизгладимые химические следы в мозгу и влиять как на физическое, так и на психическое здоровье позже. в жизни, даже когда первоначальный триггер уже давно ушел (см. обзор Dudley et al., 2011).
В этом обзоре мы освещаем недавние исследования на животных и людях, посвященные эпигенетической регуляции экспрессии генов в поддержании последствий раннего жизненного опыта. Таким образом, мы сосредоточимся на клинических исследованиях и исследованиях на животных, в которых изучалось, как биологические стрессовые системы, особенно ось HPA, формируются под воздействием неблагоприятных обстоятельств, а затем даем описание того, что мы знаем о функциях эпигенетических систем и их роли в развитии мозга и заболеваниях. Динамическая природа эпигенетических механизмов может иметь важное значение при рассмотрении возможности терапевтических вмешательств, поэтому мы делаем вывод о текущих доказательствах этой новой области исследований для лечения психических заболеваний.
Таким образом, мы сосредоточимся на клинических исследованиях и исследованиях на животных, в которых изучалось, как биологические стрессовые системы, особенно ось HPA, формируются под воздействием неблагоприятных обстоятельств, а затем даем описание того, что мы знаем о функциях эпигенетических систем и их роли в развитии мозга и заболеваниях. Динамическая природа эпигенетических механизмов может иметь важное значение при рассмотрении возможности терапевтических вмешательств, поэтому мы делаем вывод о текущих доказательствах этой новой области исследований для лечения психических заболеваний.
Зигмунд Фрейд постулировал, что травма рождения – нарушение физического симбиоза между плодом и матерью – становится центральной силой в нашей взрослой жизни. Этот страх и опыт покинутости — глубоко укоренившаяся тема в психологии. По мнению Боулби (1982), процессы привязанности занимают центральное место в понимании тревожности, о чем свидетельствуют его многолетние исследования детей и их привязанностей к тем, кто за ними ухаживает, когда младенцы демонстрируют дистресс в связи с надвигающимся уходом матери, как только они становятся достаточно взрослыми, чтобы чувствовать признаки того, что она уходит – около 6–9месяцев (Сартр, 1964).
Было высказано предположение, что внешняя регуляция матерью развивающихся незрелых эмоциональных систем младенца в отдельные критические периоды может представлять собой существенный фактор, влияющий на зависимый от опыта рост областей и структур мозга, важных для регуляции настроения и поведения. Следовательно, поведение привязанности можно рассматривать как биологическую систему, взаимосвязанную с системой страха и стресса, развившуюся специально для увеличения вероятности близости младенца и родителя, что, в свою очередь, обеспечивает повышенные шансы младенца на выживание. Действительно, система привязанности активизируется особенно во время стресса, и доступность объекта привязанности, такого как мать, оказывает большое влияние на снижение страха ребенка (обзор см. в Schore, 2000). Однако частые или длительные приступы отказа могут привести к тому, что стресс станет частью личности младенца, а затем и взрослого человека. К сожалению, такие ситуации слишком распространены, когда младенцы не могут сформировать привязанность либо из-за того, что их воспитывают без стимуляции и внимания со стороны постоянного опекуна, либо из-за жестокого обращения или крайнего пренебрежения; по самым скромным оценкам, каждый год в Соединенных Штатах более 1 000 000 детей подвергаются таким условиям (Sedlak and Broadhurst, 19). 96). Возможными краткосрочными последствиями этого являются гнев, отчаяние, отчужденность и временная задержка интеллектуального развития, в то время как долгосрочные последствия могут включать психосоматические расстройства и повышенный риск депрессии или тревоги.
96). Возможными краткосрочными последствиями этого являются гнев, отчаяние, отчужденность и временная задержка интеллектуального развития, в то время как долгосрочные последствия могут включать психосоматические расстройства и повышенный риск депрессии или тревоги.
Исследования детей, воспитанных в специализированных учреждениях, сыграли важную роль в понимании долгосрочных последствий социальной депривации в детстве и выявили наличие когнитивного, социального и физического дефицита (например, Rutter, 1998), что дает веские основания рассматривать эмоциональную запущенность как основной провоцирующий фактор (см. обзор Tarullo and Gunnar, 2006). Эти наблюдения согласуются с мнением о том, что ранние социальные взаимодействия играют значительную роль в развитии основных аффективных процессов, поддерживая обучение через связи между сигналами, ситуациями и эмоциональными переживаниями. В подтверждение этому, постинституционализированные дети демонстрируют значительные трудности с сопоставлением соответствующих выражений лица со сценариями счастья, грусти и страха (Fries and Pollak, 2004). Отчеты о постинституционализированных детях из Румынии показывают развитие трудностей в формировании эмоциональной привязанности к приемным опекунам, что обеспечивает дополнительное подтверждение конструкции расстройства привязанности; кроме того, у этих детей наблюдаются нерегулярные скорости метаболизма глюкозы в областях мозга, контролирующих когнитивные и эмоциональные функции, и повышенная активность оси ГГН, связанная с продолжительностью пребывания в таком типе постнатальной среды (например, O’Connor and Rutter, 2000). Эти результаты подтверждаются лонгитюдными исследованиями жестокого обращения и пренебрежения, которые указывают на повышенный риск когнитивных нарушений, социальных и эмоциональных трудностей, а также риск психических и соматических заболеваний, при этом у тех, кто позже проявляет посттравматическое стрессовое расстройство, обнаруживаются меньшие мозжечковые и церебральные объемы, коррелирующие с более ранним началом и увеличение продолжительности жестокого обращения (например, De Bellis and Kuchibhatla, 2006).
Отчеты о постинституционализированных детях из Румынии показывают развитие трудностей в формировании эмоциональной привязанности к приемным опекунам, что обеспечивает дополнительное подтверждение конструкции расстройства привязанности; кроме того, у этих детей наблюдаются нерегулярные скорости метаболизма глюкозы в областях мозга, контролирующих когнитивные и эмоциональные функции, и повышенная активность оси ГГН, связанная с продолжительностью пребывания в таком типе постнатальной среды (например, O’Connor and Rutter, 2000). Эти результаты подтверждаются лонгитюдными исследованиями жестокого обращения и пренебрежения, которые указывают на повышенный риск когнитивных нарушений, социальных и эмоциональных трудностей, а также риск психических и соматических заболеваний, при этом у тех, кто позже проявляет посттравматическое стрессовое расстройство, обнаруживаются меньшие мозжечковые и церебральные объемы, коррелирующие с более ранним началом и увеличение продолжительности жестокого обращения (например, De Bellis and Kuchibhatla, 2006). Кроме того, во взрослом возрасте опыт жестокого обращения или пренебрежения в детстве тесно связан с повышенной активностью оси HPA (например, Carpenter et al., 2010).
Кроме того, во взрослом возрасте опыт жестокого обращения или пренебрежения в детстве тесно связан с повышенной активностью оси HPA (например, Carpenter et al., 2010).
При воздействии стрессора организм активирует системы стресса, чтобы подготовиться к событиям, которые могут угрожать благополучию или выживанию. Вегетативная нервная система инициирует быструю и относительно кратковременную реакцию «сражайся или беги», в то время как гипоталамо-гипофизарно-надпочечниковая система работает медленнее, вызывая более продолжительную реакцию. Таким образом, ось HPA является ядром долгосрочной регуляции систем, контролирующих реакцию на стресс.
После воздействия стрессора нейропептиды кортикотропин-рилизинг-гормон (CRH) и аргинин-вазопрессин (AVP) высвобождаются из паравентрикулярного ядра (PVN) гипоталамуса в систему портальных сосудов. Эти нейропептиды связываются и активируют специфические рецепторы (рецепторы CRHR1 и V1b для CRH и AVP соответственно) на кортикотрофных клетках передней доли гипофиза, стимулируя высвобождение адренокортикотропного гормона (АКТГ), который затем действует на кору надпочечников, синтезируя и высвобождая глюкокортикоидные гормоны (кортизол). у приматов и кортикостерона у крыс). Глюкокортикоиды мобилизуют глюкозу из запасов энергии и повышают тонус сердечно-сосудистой системы, среди других широко распространенных эффектов. Петли обратной связи, в первую очередь опосредованные PVN и кортикотрофными клетками гипофиза, через глюкокортикоидные рецепторы (GR) сдерживают ответную реакцию оси HPA, чтобы сбросить систему к исходной активности (рисунок; для обзора см. De Kloet et al., 19).98). Короче говоря, прямая петля подготавливает организм к предвидению угрозы и оптимальному реагированию на нее, в то время как обратная связь обеспечивает эффективное возвращение к гомеостатическому равновесию, когда ему больше не угрожают.
у приматов и кортикостерона у крыс). Глюкокортикоиды мобилизуют глюкозу из запасов энергии и повышают тонус сердечно-сосудистой системы, среди других широко распространенных эффектов. Петли обратной связи, в первую очередь опосредованные PVN и кортикотрофными клетками гипофиза, через глюкокортикоидные рецепторы (GR) сдерживают ответную реакцию оси HPA, чтобы сбросить систему к исходной активности (рисунок; для обзора см. De Kloet et al., 19).98). Короче говоря, прямая петля подготавливает организм к предвидению угрозы и оптимальному реагированию на нее, в то время как обратная связь обеспечивает эффективное возвращение к гомеостатическому равновесию, когда ему больше не угрожают.
Открыть в отдельном окне
Гипоталамо-гипофизарно-надпочечниковая ось стресса . Нейропептиды кортикотропин-рилизинг-гормон (CRH) и аргинин-вазопрессин (AVP) экспрессируются в парвоцеллюарных нейронах паравентрикулярного ядра гипоталамуса. Совместное высвобождение КРГ и АВП в портальные сосуды приводит к мощной стимуляции секреции АКТГ передней доли гипофиза и, в свою очередь, кортикостерона из надпочечников. Активационному эффекту оси HPA противодействует ингибирующее действие глюкокортикоидных рецепторов, выраженных в гиппокампе, гипоталамусе и передней доле гипофиза.
Активационному эффекту оси HPA противодействует ингибирующее действие глюкокортикоидных рецепторов, выраженных в гиппокампе, гипоталамусе и передней доле гипофиза.
После периодов продолжительного стресса контроль гипоталамо-гипофизарно-надпочечниковой оси с отрицательной обратной связью может стать нерегулируемым, что может лежать в основе развития таких расстройств, как большая депрессия (обзор см. в Holsboer, 2000). Действительно, изменение активности этого контура является одним из наиболее часто наблюдаемых нейроэндокринных симптомов у пациентов, страдающих большим депрессивным расстройством (БДР), а нарушение регуляции секреции кортизола может быть обнаружено у 80% пациентов с депрессией, если субъекты относятся к разным возрастам. диапазоны (Heuser et al., 1994).
В клинических исследованиях было показано, что стресс в раннем возрасте является сильным прогностическим фактором нарушения тормозной обратной связи оси HPA (Heim et al., 2008), что было установлено тестами с дексаметазоном / CRH. Клинические данные дают веские основания предполагать, что депрессия характеризуется гипоталамическим перенапряжением систем КРГ и/или АВП. Посмертные исследования ткани головного мозга выявляют повышенный уровень КРГ (Raadsheer et al., 1994) и АВП (например, Meynen et al., 2006) в гипоталамусе людей с депрессией. Сообщалось, что повышенные концентрации КРГ в спинномозговой жидкости связаны с депрессией, посттравматическим стрессовым расстройством и обсессивно-компульсивным расстройством (например, Bremner et al., 19).97;), в то время как более высокие уровни АВП в плазме отмечаются при депрессии (например, Goekoop et al., 2006). Рецепторы к гормонам также, по-видимому, изменяются при депрессии, при этом в лобной коре обнаруживается уменьшение участков связывания КРГ (Nemeroff et al., 1988) и сниженный ответ АКТГ на КРГ (Rupprecht et al., 1989). Недавнее исследование также показало, что вариации в гене рецептора CRH1 смягчают влияние жестокого обращения в детстве на реакцию кортизола на тест дексаметазон/CRH (Tyrka et al.
Клинические данные дают веские основания предполагать, что депрессия характеризуется гипоталамическим перенапряжением систем КРГ и/или АВП. Посмертные исследования ткани головного мозга выявляют повышенный уровень КРГ (Raadsheer et al., 1994) и АВП (например, Meynen et al., 2006) в гипоталамусе людей с депрессией. Сообщалось, что повышенные концентрации КРГ в спинномозговой жидкости связаны с депрессией, посттравматическим стрессовым расстройством и обсессивно-компульсивным расстройством (например, Bremner et al., 19).97;), в то время как более высокие уровни АВП в плазме отмечаются при депрессии (например, Goekoop et al., 2006). Рецепторы к гормонам также, по-видимому, изменяются при депрессии, при этом в лобной коре обнаруживается уменьшение участков связывания КРГ (Nemeroff et al., 1988) и сниженный ответ АКТГ на КРГ (Rupprecht et al., 1989). Недавнее исследование также показало, что вариации в гене рецептора CRH1 смягчают влияние жестокого обращения в детстве на реакцию кортизола на тест дексаметазон/CRH (Tyrka et al. , 2009).), а скрининг мутаций связал полиморфизмы в генах V1b и AVP с депрессией, начинающейся в детстве (например, Dempster et al., 2009), подтверждая предыдущую доклиническую работу, в которой селективное инбридинг грызунов с высоким уровнем тревожноподобного поведения непреднамеренно обогащает для изменения в гене AVP (Murgatroyd et al., 2004; Kessler et al., 2007; Bunck et al., 2009).
, 2009).), а скрининг мутаций связал полиморфизмы в генах V1b и AVP с депрессией, начинающейся в детстве (например, Dempster et al., 2009), подтверждая предыдущую доклиническую работу, в которой селективное инбридинг грызунов с высоким уровнем тревожноподобного поведения непреднамеренно обогащает для изменения в гене AVP (Murgatroyd et al., 2004; Kessler et al., 2007; Bunck et al., 2009).
Исследования на моделях грызунов показывают, что воздействие хронического стресса может резко изменить баланс между AVP и CRH, контролирующими ось HPA. Например, повторное воздействие стрессора приводит к усилению экспрессии AVP в PVN, увеличению числа нейронов, содержащих CRH, коэкспрессирующих AVP, и повышению уровня мРНК рецептора V1b в гипофизе — данные согласуются с гипотезой о том, что при В условиях устойчивого стресса АВП становится движущей силой в регуляции оси HPA (Aguilera and Rabadan-Diehl, 2000). В качестве дополнительной поддержки исследований in vitro показали, что стимуляция высвобождения АКТГ с помощью АВП менее чувствительна к отрицательной обратной связи глюкокортикоидов по сравнению с реакцией АКТГ на КРГ (например, Bilezikjian et al. , 1987). Таким образом, эти данные свидетельствуют о снижении чувствительности ГР-опосредованной регуляции гипоталамо-гипофизарно-надпочечниковой оси при депрессии, что, по-видимому, является результатом сдвига в сторону увеличения секреции АВП.
, 1987). Таким образом, эти данные свидетельствуют о снижении чувствительности ГР-опосредованной регуляции гипоталамо-гипофизарно-надпочечниковой оси при депрессии, что, по-видимому, является результатом сдвига в сторону увеличения секреции АВП.
Учитывая, что стресс в раннем возрасте может привести к стойкому нарушению регуляции оси HPA и тесная связь между дисфункцией HPA и большой депрессией, было высказано предположение, что стресс в раннем возрасте может предрасполагать людей к психическим заболеваниям в более позднем возрасте. Очевидно, существуют этические ограничения для проведения предполагаемых экспериментов со стрессом в раннем возрасте на людях. Таким образом, модели на животных бесценны для понимания поведенческих и физиологических механизмов, лежащих в основе долгосрочных эффектов раннего опыта на эмоциональную реактивность и реакцию на стресс.
Грызуны особенно хорошо подходят для изучения последствий раннего жизненного опыта, поскольку их можно разводить в больших количествах и в контролируемых условиях окружающей среды. Даже весьма незначительные изменения опыта крыс в ранний постнатальный или пренатальный периоды могут вызывать долговременные последствия в поведенческих и эндокринных фенотипах (обзор см. в Holmes et al., 2005). Признавая теории привязанности, многие из этих моделей исследуют неблагоприятные факторы ранней жизни, сосредотачиваясь на выдающихся отношениях матери и ребенка.
Даже весьма незначительные изменения опыта крыс в ранний постнатальный или пренатальный периоды могут вызывать долговременные последствия в поведенческих и эндокринных фенотипах (обзор см. в Holmes et al., 2005). Признавая теории привязанности, многие из этих моделей исследуют неблагоприятные факторы ранней жизни, сосредотачиваясь на выдающихся отношениях матери и ребенка.
Стресс в раннем возрасте
Одной из наиболее широко изученных моделей стресса в раннем возрасте является разлучение с матерью (MS), при котором грызунов разлучают примерно на 3 часа в день в течение первых 2 недель жизни. Является ли точная психологическая причина последствий послеродового стресса рассеянным склерозом прямым следствием самого детеныша или косвенным, хотя манипулирование матерью до сих пор полностью не выяснено: либо имитация материнского поглаживания и кормления в период отделения, либо предоставление маток с приемным пометом в период разлучения со своими щенками могут ослабить влияние рассеянного склероза на более позднюю стрессовую гиперреактивность (например, van Oers et al. , 1999; Хуот и др., 2004). Эта процедура может привести к стойкому усилению поведения, связанного с тревогой, и пожизненной гиперактивности оси HPA в ответ на стрессоры (для обзора см. Holmes et al., 2005). Стресс в раннем возрасте также может оказывать долгосрочное воздействие на связанные с гиппокампом когнитивные функции и память (например, Eiland and McEwen, 2010), при этом появляется все больше данных, свидетельствующих о том, что эта парадигма может нарушать развитие нейронных систем, опосредующих поведение, связанное с вознаграждением, о чем свидетельствует увеличение добровольное потребление этанола и преувеличенная реакция на психостимуляторы (например, Lopez et al., 2010), поддерживая концепцию о том, что привязанность матери и ребенка является поведением, опосредованным вознаграждением (например, Moles et al., 2004).
, 1999; Хуот и др., 2004). Эта процедура может привести к стойкому усилению поведения, связанного с тревогой, и пожизненной гиперактивности оси HPA в ответ на стрессоры (для обзора см. Holmes et al., 2005). Стресс в раннем возрасте также может оказывать долгосрочное воздействие на связанные с гиппокампом когнитивные функции и память (например, Eiland and McEwen, 2010), при этом появляется все больше данных, свидетельствующих о том, что эта парадигма может нарушать развитие нейронных систем, опосредующих поведение, связанное с вознаграждением, о чем свидетельствует увеличение добровольное потребление этанола и преувеличенная реакция на психостимуляторы (например, Lopez et al., 2010), поддерживая концепцию о том, что привязанность матери и ребенка является поведением, опосредованным вознаграждением (например, Moles et al., 2004).
Выяснение нейроэндокринных изменений, лежащих в основе стойких последствий стресса в раннем возрасте у грызунов, стало важной областью исследований. Растущее число сообщений документально подтверждает постоянное увеличение нейротрансмиссии и гипоталамической экспрессии КРГ (например, Vazquez et al. , 2006) и AVP (например, Veenema et al., 2006) после стресса в раннем возрасте. Кроме того, способность ГР гиппокампа ослаблять ось HPA может быть постоянно нарушена; крысы, подвергшиеся постнатальному рассеянному склерозу, демонстрируют значительно сниженную экспрессию GR переднего мозга и нарушение синтеза синтетического глюкокортикоида дексаметазона для подавления активности оси HPA у взрослых (например, Ladd et al., 2004).
, 2006) и AVP (например, Veenema et al., 2006) после стресса в раннем возрасте. Кроме того, способность ГР гиппокампа ослаблять ось HPA может быть постоянно нарушена; крысы, подвергшиеся постнатальному рассеянному склерозу, демонстрируют значительно сниженную экспрессию GR переднего мозга и нарушение синтеза синтетического глюкокортикоида дексаметазона для подавления активности оси HPA у взрослых (например, Ladd et al., 2004).
Уход в раннем возрасте
Более короткие периоды разлуки у грызунов (например, 15 мин) или «уход за руками», по-видимому, вызывают качественные изменения в материнском уходе и, следовательно, оказывают противоположное влияние на поведенческие и связанные со стрессом реакции к рассеянному склерозу, то есть снижение тревожности и ослабление реакции оси HPA на стресс при тестировании у взрослых (для обзора см. Fernández-Teruel et al., 2002). Этот результат подтверждает так называемую гипотезу «материнского посредничества» (Smotherman et al., 19).74), при котором «эмоциональное состояние» матери запечатлевает состояние потомства.
Действительно, существует прямая связь между различиями в уровне материнской заботы и развитием индивидуальных различий в поведенческих и нейроэндокринных реакциях потомства на стресс. В частности, высокий уровень материнской заботы, по-видимому, напрямую связан со сниженной поведенческой и нейроэндокринной реакцией потомства на новизну (Liu et al., 1997). Данные, полученные на моделях грызунов, показывают, что долгосрочные эффекты манипуляций, по-видимому, зависят от изменений в дифференцировке тех нейронов, которые, как известно, ограничивают реакцию на стресс (Meaney et al., 19).96). Эти изменения включают увеличение экспрессии GR в гиппокампе, области, сильно вовлеченной в регуляцию глюкокортикоидной обратной связи, и снижение уровней гипоталамического CRH (Plotsky and Meaney, 1993).
Модели высших приматов
Приматы представляют особый интерес для изучения роли влияния окружающей среды в раннем возрасте; большая часть психопатологии вращается вокруг социальных функций, и, по сравнению с грызунами, нечеловеческие приматы демонстрируют сложное социальное поведение и структуры, напоминающие человеческие. Связь мать-младенец у приматов является наиболее фундаментальной ранней связью, и поэтому детеныши приматов демонстрируют удивительное сходство с людьми после разлуки с матерью, при этом хроническая и устойчивая разлука в младенчестве приводит к тревожному поведению, когнитивным нарушениям и долговременному развитию. срочные изменения оси HPA (например, Sanchez et al., 2010). Также возможно использовать более тонкие манипуляции в раннем жизненном опыте приматов. В одном исследовании повышенный стресс у матери из-за непредсказуемого нарушения доступности пищи во время кормления. Такие трудности привели к тому, что у младенцев развивались повышенные концентрации CRH в спинномозговой жидкости, сниженный уровень кортизола и боязливое поведение по сравнению с младенцами из контрольной группы. Кроме того, при наблюдении в юношеском возрасте концентрации CRH оставались повышенными, что указывает на то, что даже относительно кратковременные нарушения отношений мать-младенец могут вызвать длительные изменения в системах реакции на стресс у обезьян (Coplan et al.
Связь мать-младенец у приматов является наиболее фундаментальной ранней связью, и поэтому детеныши приматов демонстрируют удивительное сходство с людьми после разлуки с матерью, при этом хроническая и устойчивая разлука в младенчестве приводит к тревожному поведению, когнитивным нарушениям и долговременному развитию. срочные изменения оси HPA (например, Sanchez et al., 2010). Также возможно использовать более тонкие манипуляции в раннем жизненном опыте приматов. В одном исследовании повышенный стресс у матери из-за непредсказуемого нарушения доступности пищи во время кормления. Такие трудности привели к тому, что у младенцев развивались повышенные концентрации CRH в спинномозговой жидкости, сниженный уровень кортизола и боязливое поведение по сравнению с младенцами из контрольной группы. Кроме того, при наблюдении в юношеском возрасте концентрации CRH оставались повышенными, что указывает на то, что даже относительно кратковременные нарушения отношений мать-младенец могут вызвать длительные изменения в системах реакции на стресс у обезьян (Coplan et al. , 2001).
, 2001).
Вышеупомянутые исследования показывают, что различные аспекты окружающей среды в раннем возрасте могут привести к резким изменениям траекторий развития нервной системы и привести к дифференцированному риску физических и психических расстройств. Тем не менее, остается вопрос, как воздействие стресса в раннем возрасте может вызвать такие стойкие изменения в нейронных субстратах, гормональной регуляции и поведенческих реакциях у взрослых?
Клетки многоклеточного организма генетически идентичны, но структурно и функционально различны из-за дифференциальной экспрессии генов. Многие из этих различий в экспрессии генов возникают во время развития и впоследствии сохраняются в ходе митоза. Термин эпигенетика в настоящее время обычно используется для описания изучения стабильных изменений в потенциале экспрессии генов, которые возникают во время развития, дифференцировки и под влиянием окружающей среды (для обзора см. Jaenisch and Bird, 2003). В отличие от последовательностей ДНК, идентичных во всех тканях, паттерны эпигенетических меток тканеспецифичны. Следовательно, можно считать, что геном содержит два уровня информации: последовательность ДНК, унаследованную от наших родителей, которая сохраняется на протяжении всей жизни и в основном идентична во всех клетках и тканях нашего тела, и эпигенетические метки (т. е. паттерны метилирования хроматина и ДНК). которые являются клеточно- и тканеспецифичными.
Следовательно, можно считать, что геном содержит два уровня информации: последовательность ДНК, унаследованную от наших родителей, которая сохраняется на протяжении всей жизни и в основном идентична во всех клетках и тканях нашего тела, и эпигенетические метки (т. е. паттерны метилирования хроматина и ДНК). которые являются клеточно- и тканеспецифичными.
Таким образом, эпигенетическая регуляция экспрессии генов позволяет интегрировать внутренние сигналы и сигналы окружающей среды в геном, тем самым облегчая адаптацию организма к изменяющейся среде посредством изменений активности генов. Таким образом, эпигенетику можно рассматривать как придающую дополнительную пластичность жестко запрограммированному геному. В контексте ранней жизни эпигенетические изменения предлагают вероятный механизм, с помощью которого ранний опыт может быть интегрирован в геном для программирования гормональных и поведенческих реакций взрослых.
Эпигеном относится к ансамблю скоординированных эпигенетических меток, которые определяют доступность ДНК для механизмов, управляющих экспрессией генов; недоступные гены молчат, тогда как доступные гены активно транскрибируются. Хотя понимание взаимодействия между эпигенетическими модификациями все еще развивается, модификация основных гистонов, которые упаковывают ДНК в хроматин, и метилирование ДНК в боковой цепи цитозина в цитозин-гуаниновых (CpG) динуклеотидах представляют собой наиболее изученные эпигенетические метки. Фигура ).
Хотя понимание взаимодействия между эпигенетическими модификациями все еще развивается, модификация основных гистонов, которые упаковывают ДНК в хроматин, и метилирование ДНК в боковой цепи цитозина в цитозин-гуаниновых (CpG) динуклеотидах представляют собой наиболее изученные эпигенетические метки. Фигура ).
Открыть в отдельном окне
ДНК оборачивается вокруг гистонов с образованием комплекса, называемого хроматином . N-концевые хвосты гистонов служат сайтами для эпигенетической маркировки путем ацетилирования и метилирования с помощью ферментов ремоделирования хроматина (например, HDAC, HAT, HMT и HDM). Метилирование ДНК относится к химическому переносу метильных групп на акцепторные сайты CpG с помощью класса ферментов, известных как ДНК-метилтрансферазы (DNMT). Активные метки (например, ацетилирование гистонов и гипометилирование ДНК) характеризуют «открытый» хроматин, в то время как репрессивные метки (например, метилирование гистонов и гиперметилирование ДНК) встречаются в «закрытом» хроматине.
Сигнатуры гистонов
Хроматин относится к комплексу ДНК, обернутому вокруг гистоновых белков с образованием нуклеосом. Эти гистоновые белки сильно модифицированы на своих N-концевых концах за счет метилирования, фосфорилирования, ацетилирования и убиквитинирования как часть гистоновой сигнатуры, служащей для определения доступности ДНК; плотно упакованный «закрытый» хроматин называется гетерохроматином, тогда как доступный «открытый» хроматин называется эухроматином (Jenuwein and Allis, 2001). Известно, что ацетилирование гистонов является преобладающим сигналом для активных конфигураций хроматина, в то время как некоторые специфические реакции метилирования гистонов связаны либо с молчанием, либо с активацией генов. Ключом к этому ремоделированию хроматина являются ферменты, модифицирующие гистоны, такие как ацетилтрансферазы гистонов (HAT), которые ацетилируют хвосты гистонов, деацетилазы гистонов (HDAC), которые деацетилируют, и деметилазы гистонов, которые удаляют метилирование. Эти ферменты, модифицирующие гистоны, обычно рекрутируются посредством взаимодействия со специфическими факторами транскрипции, которые распознают и связываются с определенными цис-действующими последовательностями в генах. Таким образом, сигнальные пути, регистрирующие условия окружающей среды и управляющие активностью факторов транскрипции, могут служить проводниками для связывания переживаний с эпигенетическими модификациями генов.
Эти ферменты, модифицирующие гистоны, обычно рекрутируются посредством взаимодействия со специфическими факторами транскрипции, которые распознают и связываются с определенными цис-действующими последовательностями в генах. Таким образом, сигнальные пути, регистрирующие условия окружающей среды и управляющие активностью факторов транскрипции, могут служить проводниками для связывания переживаний с эпигенетическими модификациями генов.
Метилирование ДНК – звук тишины
Метилирование ДНК относится к химическому переносу метильной группы в положение 5 цитозиновых колец, обычно в контексте динуклеотидных последовательностей CpG, и обычно приводит к молчанию генов. Поскольку метилирование ДНК представляет собой ковалентную связь, считается, что оно более стабильно, чем другие эпигенетические метки. Такие последовательности CpG заметно недопредставлены в геномах млекопитающих, причем более 85% из них расположены в повторяющихся последовательностях, разбросанных по всему геному и сильно гиперметилированы, что, возможно, играет решающую роль в подавлении этих элементов и, таким образом, в поддержании целостности генома. Остальные ∼15% динуклеотидов CpG обычно кластеризуются в богатых GC областях, известных как «островки CpG», которые располагаются внутри или вокруг промоторов примерно 40% генов в геноме (обзор см. в Illingworth and Bird, 2009).). Составляя около 1% генома, эти островки CpG в значительной степени неметилированы в нормальных соматических клетках, в то время как области, демонстрирующие более низкую плотность CpG, чаще метилированы (Weber et al., 2007). В целом паттерны метилирования, как правило, коррелируют со структурой хроматина, т. е. активные области хроматина связаны с гипометилированной ДНК, тогда как гиперметилированная ДНК упакована в неактивный хроматин (Razin and Cedar, 1977).
Остальные ∼15% динуклеотидов CpG обычно кластеризуются в богатых GC областях, известных как «островки CpG», которые располагаются внутри или вокруг промоторов примерно 40% генов в геноме (обзор см. в Illingworth and Bird, 2009).). Составляя около 1% генома, эти островки CpG в значительной степени неметилированы в нормальных соматических клетках, в то время как области, демонстрирующие более низкую плотность CpG, чаще метилированы (Weber et al., 2007). В целом паттерны метилирования, как правило, коррелируют со структурой хроматина, т. е. активные области хроматина связаны с гипометилированной ДНК, тогда как гиперметилированная ДНК упакована в неактивный хроматин (Razin and Cedar, 1977).
В митотически активных клетках метилирование ДНК не копируется механизмом репликации ДНК, а поддерживается ферментами ДНК-метилтрансферазами (DNMT), которые используют S -аденозилметионин в качестве донора метила. Механизм метилирования ДНК сначала должен установить новые паттерны метилирования ДНК, специфичные для типа клеток, во время развития и, возможно, во взрослом состоянии в ответ на новые сигналы. Эти паттерны должны обновляться, когда клетки подвергаются делению, то есть дублируют свой геном. Из трех ДНК-метилтрансфераз, идентифицированных у млекопитающих, DNMT1 отдает предпочтение гемиметилированной ДНК in vitro , что согласуется с ее ролью в качестве поддерживающей DNMT, в то время как DNMT3a и DNMT3b могут метилировать неметилированную ДНК, поддерживающую роль .0008 de novo метилазы. Активность этих ферментов имеет решающее значение для огромного количества программ развития у млекопитающих и, следовательно, строго регулируется. Во время раннего эмбриогенеза эпигенетическое молчание генов как материнского, так и отцовского происхождения происходит преимущественно за счет активности метилирования ДНК «поддерживающей» метилтрансферазы DNMT1, в то время как дальнейшая тканеспецифическая экспрессия генов и метилирование ДНК во время более позднего постнатального развития требуют также активности «9».0008 de novo» метилтрансфераз DNMT3a и DNMT3b (обзор см.
Эти паттерны должны обновляться, когда клетки подвергаются делению, то есть дублируют свой геном. Из трех ДНК-метилтрансфераз, идентифицированных у млекопитающих, DNMT1 отдает предпочтение гемиметилированной ДНК in vitro , что согласуется с ее ролью в качестве поддерживающей DNMT, в то время как DNMT3a и DNMT3b могут метилировать неметилированную ДНК, поддерживающую роль .0008 de novo метилазы. Активность этих ферментов имеет решающее значение для огромного количества программ развития у млекопитающих и, следовательно, строго регулируется. Во время раннего эмбриогенеза эпигенетическое молчание генов как материнского, так и отцовского происхождения происходит преимущественно за счет активности метилирования ДНК «поддерживающей» метилтрансферазы DNMT1, в то время как дальнейшая тканеспецифическая экспрессия генов и метилирование ДНК во время более позднего постнатального развития требуют также активности «9».0008 de novo» метилтрансфераз DNMT3a и DNMT3b (обзор см. Turek-Plewa and Jagodziński, 2005).
Turek-Plewa and Jagodziński, 2005).
В общем, конечной точкой обоих процессов метилирования ДНК является либо долгосрочное замалчивание, либо тонкая настройка потенциала экспрессии генов. Хотя метилированные CpG-динуклеотиды могут прямо вмешиваться в связывание фактора транскрипции, большинство эффектов репрессии, по-видимому, происходит косвенно, посредством рекрутирования белков метил-CpG-связывающего домена (MBD) и связанных с ними репрессорных комплексов (для обзора см. Jørgensen and Bird, 2002). Семейство белков MBD, включающее MBD1, MBD2, MBD3, MBD4 и Kaiso в дополнение к члену-основателю MeCP2, собирается по меткам метилирования, чтобы обеспечить платформу для набора корепрессорных комплексов, включая HDAC, которые могут перезаписывать гистоновые метки, вызывая последующее уплотнение хроматина и подавление транскрипции. Эти комплексы могут дополнительно рекрутировать DNMT для стимуляции, поддержания и усиления репрессии генов, что совместимо с взаимным взаимодействием между метилированием ДНК и хроматиновыми метками в регуляции транскрипции генов.
Хотя промоторные и энхансерные области, по-видимому, привлекают наибольшее внимание в отношении метилирования ДНК и транскрипции генов, становится все более очевидным, что метилирование других генных элементов играет важную регуляторную роль. Например, повышенное метилирование ДНК в теле генов обычно связано с активной транскрипцией (Ball et al., 2009), в то время как метилирование ДНК в 3′- и внутригенных областях может играть различную роль в регуляции экспрессии генов (для обзора см. Suzuki and Bird , 2008), возможно, контролирующих активность внутригенных некодирующих РНК. Некодирующие РНК представляют собой функциональные молекулы РНК, которые не транслируются в белок и могут участвовать в различных РНК-опосредованных путях сайленсинга, при этом появляется все больше данных, указывающих на то, что регуляция этих факторов может играть ключевую роль в развитии нервной системы и нейропсихиатрических расстройствах. обзор см. в Qureshi and Mehler, 2010).
Наконец, новая эпигенетическая метка, 5-гидроксиметилцитозин, была недавно обнаружена и провозглашена «6 th base». Эта модификация динуклеотидов CpG, по-видимому, особенно распространена в головном мозге человека и мыши и увеличивается при старении в гиппокампе и мозжечке мыши (например, Song et al., 2011). Учитывая, что он может быть получен путем ферментативного окисления метилированных остатков цитозина, представляется возможным, что такие модификации могут регулировать экспрессию генов, хотя любая возможная роль в развитии или функционировании мозга еще предстоит подробно изучить.
Эта модификация динуклеотидов CpG, по-видимому, особенно распространена в головном мозге человека и мыши и увеличивается при старении в гиппокампе и мозжечке мыши (например, Song et al., 2011). Учитывая, что он может быть получен путем ферментативного окисления метилированных остатков цитозина, представляется возможным, что такие модификации могут регулировать экспрессию генов, хотя любая возможная роль в развитии или функционировании мозга еще предстоит подробно изучить.
Миллиарды нейронов в одном мозге имеют одинаковую последовательность ДНК, но различаются по своим разнообразным функциям посредством эпигенетического программирования во время пре- и постнатального развития и, возможно, на протяжении всей жизни. Таким образом, эпигенетические механизмы являются привратниками развития, дифференцировки и созревания мозга и, в конечном счете, связанных с ними болезненных процессов.
Генетические дефекты в эпигенетическом механизме
Нарушение регуляции эпигенетических путей может привести либо к молчанию, либо к неадекватной экспрессии определенных наборов генов, проявляющихся заболеваниями. Растущее понимание в этой области ведет к выявлению растущего числа эпигенетических заболеваний, включающих различные виды рака, нейродегенеративные заболевания, синдромы, характеризующиеся хромосомной нестабильностью, умственной отсталостью и нарушениями импринтинга (обзор см. Halusková, 2010).
Растущее понимание в этой области ведет к выявлению растущего числа эпигенетических заболеваний, включающих различные виды рака, нейродегенеративные заболевания, синдромы, характеризующиеся хромосомной нестабильностью, умственной отсталостью и нарушениями импринтинга (обзор см. Halusková, 2010).
В нервной системе эпигенетические метки управляют основными клеточными процессами, такими как синаптическая пластичность, и сложным поведением, таким как память и обучение. Генетические дефекты в эпигенетическом механизме, запускающие неправильную маркировку, могут приводить к серьезным дефектам развития мозга и проявляться в виде разрушительных заболеваний, таких как синдром Ретта, синдром Рубинштейна-Тейби, синдром ломкой Х-хромосомы, болезнь Альцгеймера, болезнь Хантингтона и психические расстройства, такие как как аутизм, шизофрения, зависимость и депрессия (обзор см. в Графодатской и др., 2010).
Существует большое количество генов, кодирующих эпигенетические регуляторы, мутация которых может привести к умственной отсталости. Хотя можно предположить, что различные эпигенетические факторы будут управлять экспрессией большого количества потенциально неродственных генов, нарушения в различных эпигенетических регуляторах, по-видимому, приводят к симптоматически сходным синдромам умственной отсталости (Kramer and van Bokhoven, 2009). Следовательно, возможно, что умственная отсталость коренится не в изменениях конкретного гена(ов)-мишени, а в неспособности соответствующих нейронов адекватно реагировать на сигналы окружающей среды в условиях сильно искаженного транскрипционного гомеостаза (Ramocki and Zoghbi, 2008).
Хотя можно предположить, что различные эпигенетические факторы будут управлять экспрессией большого количества потенциально неродственных генов, нарушения в различных эпигенетических регуляторах, по-видимому, приводят к симптоматически сходным синдромам умственной отсталости (Kramer and van Bokhoven, 2009). Следовательно, возможно, что умственная отсталость коренится не в изменениях конкретного гена(ов)-мишени, а в неспособности соответствующих нейронов адекватно реагировать на сигналы окружающей среды в условиях сильно искаженного транскрипционного гомеостаза (Ramocki and Zoghbi, 2008).
Одной из наиболее частых причин умственной отсталости у женщин является синдром Ретта, прогрессирующее нарушение развития нервной системы, возникающее в результате мутаций в метил-CpG-связывающем белке MeCP2, расположенном на Х-хромосоме. Интересно, что менее разрушительные генные мутации или изменения в экспрессии этого гена, по-видимому, также лежат в основе некоторых случаев аутизма (см. обзор Gonzales and LaSalle, 2010), наряду с другими членами семейства MBD в небольшом числе случаев (Cukier et al. ., 2010). Другая тяжелая, сцепленная с Х-хромосомой форма умственной отсталости (ATRX; альфа-талассемия/синдром умственной отсталости, сцепленная с Х-хромосомой) возникает в результате мутаций гена, кодирующего члена подгруппы SNF2 надсемейства белков, участвующих в ремоделировании хроматина (Picketts et al. , 1996). Дальнейшие дефекты, влияющие на белки, участвующие в модификации гистонов, ведущие к умственной отсталости, — это мутации CBP, белка с функцией HAT, лежащие в основе синдрома Рубинштейна-Тайби (Petrij et al., 1995), и изменения в RSK2, участвующие в фосфорилировании гистонов и взаимодействии с CBP. приводя к синдрому Коффина-Лоури, Х-сцепленному расстройству умственной отсталости, характеризующемуся задержкой психомоторного развития и роста (Hanauer and Young, 2002). Дефекты в белках, важных для метилирования гистонов, включают h4K4-специфическую гистондеметилазу JARIDIC, приводящую к умственной отсталости, сцепленной с Х-хромосомой (Jensen et al., 2005), домен набора ядерных рецепторов, содержащий ген белка 1 (NSD1), вызывающий синдром Сотоса и синдром Уивера.
., 2010). Другая тяжелая, сцепленная с Х-хромосомой форма умственной отсталости (ATRX; альфа-талассемия/синдром умственной отсталости, сцепленная с Х-хромосомой) возникает в результате мутаций гена, кодирующего члена подгруппы SNF2 надсемейства белков, участвующих в ремоделировании хроматина (Picketts et al. , 1996). Дальнейшие дефекты, влияющие на белки, участвующие в модификации гистонов, ведущие к умственной отсталости, — это мутации CBP, белка с функцией HAT, лежащие в основе синдрома Рубинштейна-Тайби (Petrij et al., 1995), и изменения в RSK2, участвующие в фосфорилировании гистонов и взаимодействии с CBP. приводя к синдрому Коффина-Лоури, Х-сцепленному расстройству умственной отсталости, характеризующемуся задержкой психомоторного развития и роста (Hanauer and Young, 2002). Дефекты в белках, важных для метилирования гистонов, включают h4K4-специфическую гистондеметилазу JARIDIC, приводящую к умственной отсталости, сцепленной с Х-хромосомой (Jensen et al., 2005), домен набора ядерных рецепторов, содержащий ген белка 1 (NSD1), вызывающий синдром Сотоса и синдром Уивера. Tatton-Brown and Rahman, 2007), ген гистон-лизинметилтрансферазы GLP/EHMT1, характеризующийся тяжелой умственной отсталостью (Kleefstra et al., 2006), и, наконец, MLLl, h4K4-специфичная метилтрансфераза, участвующая в синаптической пластичности гиппокампа, которая может лежать в основе корковая дисфункция в некоторых случаях шизофрении (обзор см. Akbarian and Huang, 2009).). Развитие часто тяжелой умственной отсталости при этих синдромах подтверждает важность функционального эпигенетического механизма в регуляции раннего развития мозга. В дальнейшем можно было ожидать, что нарушения в регуляции и экспрессии различных эпигенетических компонентов могут затем привести к дальнейшим психическим патологиям.
Tatton-Brown and Rahman, 2007), ген гистон-лизинметилтрансферазы GLP/EHMT1, характеризующийся тяжелой умственной отсталостью (Kleefstra et al., 2006), и, наконец, MLLl, h4K4-специфичная метилтрансфераза, участвующая в синаптической пластичности гиппокампа, которая может лежать в основе корковая дисфункция в некоторых случаях шизофрении (обзор см. Akbarian and Huang, 2009).). Развитие часто тяжелой умственной отсталости при этих синдромах подтверждает важность функционального эпигенетического механизма в регуляции раннего развития мозга. В дальнейшем можно было ожидать, что нарушения в регуляции и экспрессии различных эпигенетических компонентов могут затем привести к дальнейшим психическим патологиям.
Изменения в эпигенетической регуляции
Растет число исследований, указывающих на аберрантные эпигенетические признаки в развитии психических патологий в более позднем возрасте, хотя остаются важными вопросы, возникают ли изменения в раннем развитии или в более позднем возрасте в ответ на воздействие окружающей среды. . Например, гипометилирование ДНК на промоторе гена катехол-9Было обнаружено, что 0008 O -метилтрансфераза (COMT), фермент, регулирующий уровень дофамина, связана с шизофренией и биполярным расстройством (Abdolmaleky et al., 2006). В ряде исследований промоторной области гена RELN , кодирующего белок, участвующий в долговременной памяти, было обнаружено гиперметилирование, коррелирующее со снижением экспрессии при шизофрении (например, Grayson et al., 2005). В лобно-полярной коре дополнительное исследование обнаружило гиперметилирование ДНК в области промотора субъединицы альфа1 рецептора гамма-аминомасляной кислоты (ГАМК-А) в суицидальном и MDD мозге, которое коррелировало с измененной экспрессией мРНК DNMT (Poulter et al., 2008), в то время как в другом исследовании сообщалось об изменениях метилирования ДНК и экспрессии мРНК гена Peptidylprolyl isomerase E-like (PPIEL) у монозиготных близнецов, дискордантных по биполярному расстройству (Kuratomi et al., 2008).
. Например, гипометилирование ДНК на промоторе гена катехол-9Было обнаружено, что 0008 O -метилтрансфераза (COMT), фермент, регулирующий уровень дофамина, связана с шизофренией и биполярным расстройством (Abdolmaleky et al., 2006). В ряде исследований промоторной области гена RELN , кодирующего белок, участвующий в долговременной памяти, было обнаружено гиперметилирование, коррелирующее со снижением экспрессии при шизофрении (например, Grayson et al., 2005). В лобно-полярной коре дополнительное исследование обнаружило гиперметилирование ДНК в области промотора субъединицы альфа1 рецептора гамма-аминомасляной кислоты (ГАМК-А) в суицидальном и MDD мозге, которое коррелировало с измененной экспрессией мРНК DNMT (Poulter et al., 2008), в то время как в другом исследовании сообщалось об изменениях метилирования ДНК и экспрессии мРНК гена Peptidylprolyl isomerase E-like (PPIEL) у монозиготных близнецов, дискордантных по биполярному расстройству (Kuratomi et al., 2008).
Пары монозиготных близнецов имеют практически идентичный геном, хотя могут в различной степени различаться в пре- и постнатальной среде, что делает их очень информативными для понимания того, как эпигенетические вариации могут влиять на сложные признаки (обзор см. в Bell and Spector, 2011). Действительно, близнецы часто различаются по распространенности психических расстройств: в ряде исследований сообщается о различиях в метилировании ДНК между монозиготными близнецами, дискордантными по шизофрении (например, Petronis et al., 2003), а в более позднем отчете обнаружены более низкие уровни метилирования ДНК в височная кора близнецов с болезнью Альцгеймера (Mastroeni et al., 2009).). Дальнейший полногеномный скрининг выявил значительную вариабельность метилирования ДНК между близнецами (Kaminsky et al., 2009), что может быть связано с более ранними выводами, в которых было показано, что профили метилирования ДНК молодых пар монозиготных близнецов эпигенетически более сходны, чем более старые. монозиготные близнецы (Fraga et al., 2005). Следовательно, это предполагает, что эпигенетические изменения увеличиваются с возрастом, следуя мнению, что эпигенетические механизмы, такие как метилирование ДНК, ухудшаются с возрастом и могут даже ускорять процесс старения (Murgatroyd et al.
в Bell and Spector, 2011). Действительно, близнецы часто различаются по распространенности психических расстройств: в ряде исследований сообщается о различиях в метилировании ДНК между монозиготными близнецами, дискордантными по шизофрении (например, Petronis et al., 2003), а в более позднем отчете обнаружены более низкие уровни метилирования ДНК в височная кора близнецов с болезнью Альцгеймера (Mastroeni et al., 2009).). Дальнейший полногеномный скрининг выявил значительную вариабельность метилирования ДНК между близнецами (Kaminsky et al., 2009), что может быть связано с более ранними выводами, в которых было показано, что профили метилирования ДНК молодых пар монозиготных близнецов эпигенетически более сходны, чем более старые. монозиготные близнецы (Fraga et al., 2005). Следовательно, это предполагает, что эпигенетические изменения увеличиваются с возрастом, следуя мнению, что эпигенетические механизмы, такие как метилирование ДНК, ухудшаются с возрастом и могут даже ускорять процесс старения (Murgatroyd et al. , 2010b; Rodríguez-Rodero et al., 2010). Однако следует также учитывать влияние генетических факторов, поскольку в отчетах была обнаружена более высокая эпигенетическая изменчивость у дизиготных, чем у монозиготных близнецов (Kaminsky et al., 2009).) и внутрииндивидуальные изменения метилирования ДНК, показывающие степень семейной кластеризации (Bjornsson et al., 2008). Наконец, возможное влияние случайных стохастических факторов может еще больше осложнить такие исследования сообщениями о том, что даже у генетически идентичных лабораторных животных, живущих в одних и тех же контролируемых условиях окружающей среды, тем не менее развиваются фенотипические и эпигенетические различия (например, Vogt et al., 2008).
, 2010b; Rodríguez-Rodero et al., 2010). Однако следует также учитывать влияние генетических факторов, поскольку в отчетах была обнаружена более высокая эпигенетическая изменчивость у дизиготных, чем у монозиготных близнецов (Kaminsky et al., 2009).) и внутрииндивидуальные изменения метилирования ДНК, показывающие степень семейной кластеризации (Bjornsson et al., 2008). Наконец, возможное влияние случайных стохастических факторов может еще больше осложнить такие исследования сообщениями о том, что даже у генетически идентичных лабораторных животных, живущих в одних и тех же контролируемых условиях окружающей среды, тем не менее развиваются фенотипические и эпигенетические различия (например, Vogt et al., 2008).
Эпигенетика и старение
Связь между метилированием ДНК и старением впервые была предложена Бердышевым, который обнаружил, что глобальное метилирование геномной ДНК снижается с возрастом у нерестящейся горбуши (Бердышев и др., 19).67). Позже это было подтверждено дальнейшими доказательствами наличия постепенных глобальных потерь метилирования в различных тканях мыши, крысы и человека (например, Fuke et al. , 2004). Большая часть этого глобального гипометилирования может быть результатом того факта, что различные типы вкрапленных повторяющихся последовательностей, которые составляют основную массу геномов, по-видимому, нацелены на отдельные моменты времени в разной степени за счет возрастного гипометилирования (Jintaridth and Mutirangura, 2010). ). В общих чертах считается, что гиперметилирование, связанное с возрастом, преимущественно влияет на локусы на CpG-островках, в то время как локусы, лишенные CpG-островков, теряют метилирование с возрастом. Хотя увеличение метилирования промотора с возрастом общепризнано, например, в исследованиях тканей предстательной железы и толстой кишки человека (например, Kwabi-Addo et al., 2007), недавние данные Bjornsson et al. предполагают более сложную картину как с повышением, так и со снижением внутренних уровней глобального метилирования с течением времени (Bjornsson et al., 2008). Конечно, эпигенетическая дисрегуляция с возрастом, по-видимому, в значительной степени зависит от тканей.
, 2004). Большая часть этого глобального гипометилирования может быть результатом того факта, что различные типы вкрапленных повторяющихся последовательностей, которые составляют основную массу геномов, по-видимому, нацелены на отдельные моменты времени в разной степени за счет возрастного гипометилирования (Jintaridth and Mutirangura, 2010). ). В общих чертах считается, что гиперметилирование, связанное с возрастом, преимущественно влияет на локусы на CpG-островках, в то время как локусы, лишенные CpG-островков, теряют метилирование с возрастом. Хотя увеличение метилирования промотора с возрастом общепризнано, например, в исследованиях тканей предстательной железы и толстой кишки человека (например, Kwabi-Addo et al., 2007), недавние данные Bjornsson et al. предполагают более сложную картину как с повышением, так и со снижением внутренних уровней глобального метилирования с течением времени (Bjornsson et al., 2008). Конечно, эпигенетическая дисрегуляция с возрастом, по-видимому, в значительной степени зависит от тканей. Кроме того, по-видимому, существуют подмножества генов, на которые тканеспецифически воздействуют возрастные изменения метилирования ДНК, например, гены, участвующие в метаболизме и регуляции метаболизма в печени и висцеральной жировой ткани (Thompson et al., 2010), или сайты CpG, физически близки к генам, участвующим в связывании ДНК и регуляции транскрипции в различных областях мозга (Hernandez et al., 2011). Это более позднее исследование дает особенно сильный аргумент в пользу того, что специфические возрастные изменения метилирования ДНК могут иметь довольно широкое влияние на экспрессию генов в человеческом мозгу. Однако нам, возможно, придется пересмотреть некоторые из наших предубеждений относительно возраста и старения в связи с эпигенетическими изменениями, связанными с новым исследованием различных тканей мышей, в которых большинству изменений метилирования ДНК, обнаруженных во взрослом возрасте, предшествовали аналогичные изменения метилирования ДНК у молодых особей. и что уровни экспрессии генов вблизи прогрессивно метилированных и деметилированных CpG-сайтов уже значительно повышались или понижались, соответственно, у молодых мышей (Takasugi, 2011).
Кроме того, по-видимому, существуют подмножества генов, на которые тканеспецифически воздействуют возрастные изменения метилирования ДНК, например, гены, участвующие в метаболизме и регуляции метаболизма в печени и висцеральной жировой ткани (Thompson et al., 2010), или сайты CpG, физически близки к генам, участвующим в связывании ДНК и регуляции транскрипции в различных областях мозга (Hernandez et al., 2011). Это более позднее исследование дает особенно сильный аргумент в пользу того, что специфические возрастные изменения метилирования ДНК могут иметь довольно широкое влияние на экспрессию генов в человеческом мозгу. Однако нам, возможно, придется пересмотреть некоторые из наших предубеждений относительно возраста и старения в связи с эпигенетическими изменениями, связанными с новым исследованием различных тканей мышей, в которых большинству изменений метилирования ДНК, обнаруженных во взрослом возрасте, предшествовали аналогичные изменения метилирования ДНК у молодых особей. и что уровни экспрессии генов вблизи прогрессивно метилированных и деметилированных CpG-сайтов уже значительно повышались или понижались, соответственно, у молодых мышей (Takasugi, 2011). Это означает, что эпигеном постоянно созревает на протяжении всей жизни и что эффекты старения проявляются постепенно с течением времени.
Это означает, что эпигеном постоянно созревает на протяжении всей жизни и что эффекты старения проявляются постепенно с течением времени.
В соответствии с этой точкой зрения растущее число сообщений в литературе бросает вызов общепринятому взгляду на заблокированное состояние метилирования ДНК, демонстрируя, что метилирование ДНК остается активным процессом в постмитотических клетках (т.е. нейронах). Например, DNMT экспрессируются и регулируются во взрослом мозге (например, Brown et al., 2008), и продолжает накапливаться свидетельство того, что эпигенетические механизмы способны динамически контролировать изменения активности генов на протяжении всей жизни в результате воздействия различных факторов. факторов окружающей среды во время старения, как описано ранее.
В целом, эти данные свидетельствуют о наличии нескольких механизмов, регулирующих метилирование, которые, возможно, регулируются на разных этапах развития, созревания и старения с помощью процессов, которые реагируют на многочисленные факторы окружающей среды и генетические факторы.
Помимо контроля конститутивной экспрессии генов, эпигенетические механизмы могут также служить для тонкой настройки потенциала экспрессии генов в ответ на сигналы окружающей среды. Метилирование ДНК было наиболее изучено в отношении понимания ранних жизненных переживаний и эпигенетического программирования их нейробиологических последствий. Действительно, стабильная природа метилирования ДНК делает его идеальной матрицей для поддержки устойчивых генных эффектов, контролирующих функцию мозга и поведение от раннего развития до старости. Таким образом, мы и другие исследователи предположили, что условия окружающей среды в раннем возрасте могут вызывать изменения в метилировании ДНК, облегчающие эпигенетическое программирование критических генов, участвующих в регуляции реакции на стресс, что, в свою очередь, может проявляться нейроэндокринными и поведенческими симптомами во взрослом возрасте (например, McGowan et al., 2009).; Мургатройд и др., 2010а; Фигура ).
Открыть в отдельном окне
Ранний жизненный опыт может постоянно изменять уровни экспрессии ключевых генов посредством эпигенетической маркировки, которая может лежать в основе изменений поведения, нейроэндокринной системы и реакции на стресс на протяжении всей дальнейшей жизни . В совокупности этот процесс называется эпигенетическим программированием. Природа окружающей среды на протяжении всей дальнейшей жизни, помимо воздействия биологических процессов, связанных со старением и генетическим полом, может усугублять последствия программирования, установленного в раннем возрасте, что приводит к повышенной уязвимости к расстройствам настроения.
В совокупности этот процесс называется эпигенетическим программированием. Природа окружающей среды на протяжении всей дальнейшей жизни, помимо воздействия биологических процессов, связанных со старением и генетическим полом, может усугублять последствия программирования, установленного в раннем возрасте, что приводит к повышенной уязвимости к расстройствам настроения.
Материнская забота и эпигенетическое программирование GR
Одна хорошо охарактеризованная модель, созданная для изучения влияния окружающей среды раннего периода жизни на программирование стресса, исследует различия в качестве раннего послеродового ухода за матерью, измеряемые уровнями вылизывания и ухода. Исследования показали, что у крысят, получавших высокий уровень материнской заботы в раннем возрасте, развивалось устойчивое повышение экспрессии ГР в гиппокампе и снижалась чувствительность гиппокампа к глюкокортикоидным гормонам (Liu et al., 19).97). Кроме того, эти крысы показали пониженные уровни гипоталамического КРГ и сниженную реакцию оси HPA на стресс (Francis et al. , 1999) по сравнению с животными, выращенными матерями, демонстрирующими низкий уровень материнской заботы. Анализ молекулярных механизмов, лежащих в основе длительного программирования GR, выявил важную роль эпигенетической регуляции. Исследователи показали, что повышенная экспрессия ГР в гиппокампе у животных, получающих высокий уровень материнской заботы, связана со стойким гипометилированием ДНК по специфическим динуклеотидам CpG в экзоне 1-9 гиппокампа.0236 7 промотор и повышенное ацетилирование гистонов. Эти эпигенетические модификации облегчают связывание белка A, индуцируемого фактором роста нервов, активатора транскрипции (NGF1a), с этой областью, обеспечивая вероятный механизм эпигенетического программирования функции генов материнской заботой в раннем возрасте (Weaver et al., 2004). Интересно, что дальнейшее исследование с использованием другой парадигмы РС на крысах другого вида показало, что высвобождение кортикостерона и повышенная экспрессия NGF1a не вызывают изменений в уровнях метилирования ДНК на одном и том же промоторе ГР гиппокампа (Daniels et al.
, 1999) по сравнению с животными, выращенными матерями, демонстрирующими низкий уровень материнской заботы. Анализ молекулярных механизмов, лежащих в основе длительного программирования GR, выявил важную роль эпигенетической регуляции. Исследователи показали, что повышенная экспрессия ГР в гиппокампе у животных, получающих высокий уровень материнской заботы, связана со стойким гипометилированием ДНК по специфическим динуклеотидам CpG в экзоне 1-9 гиппокампа.0236 7 промотор и повышенное ацетилирование гистонов. Эти эпигенетические модификации облегчают связывание белка A, индуцируемого фактором роста нервов, активатора транскрипции (NGF1a), с этой областью, обеспечивая вероятный механизм эпигенетического программирования функции генов материнской заботой в раннем возрасте (Weaver et al., 2004). Интересно, что дальнейшее исследование с использованием другой парадигмы РС на крысах другого вида показало, что высвобождение кортикостерона и повышенная экспрессия NGF1a не вызывают изменений в уровнях метилирования ДНК на одном и том же промоторе ГР гиппокампа (Daniels et al. , 2009).), снова поддерживая идею о том, что вариации в генетическом составе и различия в окружающей среде являются критическими детерминантами в организации эпигенома. В поддержку этой идеи последующие исследования обнаружили измененное метилирование промотора GR в посмертной ткани гиппокампа человека у депрессивных пациентов-самоубийц, которые страдали жестоким обращением и пренебрежением в раннем возрасте (McGowan et al., 2009). Напротив, у пациентов с суицидом, которые не подвергались невзгодам в раннем возрасте, или у пациентов, страдающих только большой депрессией, не было обнаружено эпигенетической маркировки ГР гиппокампа (Alt et al., 2010).
, 2009).), снова поддерживая идею о том, что вариации в генетическом составе и различия в окружающей среде являются критическими детерминантами в организации эпигенома. В поддержку этой идеи последующие исследования обнаружили измененное метилирование промотора GR в посмертной ткани гиппокампа человека у депрессивных пациентов-самоубийц, которые страдали жестоким обращением и пренебрежением в раннем возрасте (McGowan et al., 2009). Напротив, у пациентов с суицидом, которые не подвергались невзгодам в раннем возрасте, или у пациентов, страдающих только большой депрессией, не было обнаружено эпигенетической маркировки ГР гиппокампа (Alt et al., 2010).
Стресс разлуки с матерью и эпигенетическое программирование AVP
Работа в нашей лаборатории показала, что стресс РС у мышей, включающий отделение детенышей от матерей на 3 часа каждый день в течение первых 10 дней жизни, индуцирует пожизненную устойчивую экспрессию гипоталамического AVP лежит в основе повышенной секреции кортикостерона, повышенной эндокринной реакции на последующие стрессоры и измененного ингибирования оси HPA по типу обратной связи. Начиная с 10-го дня жизни, сразу после периода РС и сохраняясь не менее 1 года, повышенная экспрессия АВП была специфична для парвоцеллюлярной субпопуляции нейронов ПВЯ, в то время как экспрессия КРГ гипоталамуса и ГР гиппокампа оставалась неизменной. Важно отметить, что эта измененная экспрессия связана со сниженным уровнем метилирования ДНК в PVN в определенных динуклеотидах CpG в энхансерной области, важной для активности гена AVP (Murgatroyd et al., 2009).). Далее мы показали, что гипометилирование в этой области снижает способность MeCP2 связывать и рекрутировать репрессивные гистоновые комплексы, такие как HDAC и DNMT (Murgatroyd, неопубликовано), подтверждая предыдущие доказательства роли MeCP2 в качестве эпигенетической платформы, на которой происходит деацетилирование гистонов, метилирование h4K9. , и метилирование ДНК осуществляются для подавления транскрипции и молчания генов (например, Murgatroyd et al., 2010a).
Начиная с 10-го дня жизни, сразу после периода РС и сохраняясь не менее 1 года, повышенная экспрессия АВП была специфична для парвоцеллюлярной субпопуляции нейронов ПВЯ, в то время как экспрессия КРГ гипоталамуса и ГР гиппокампа оставалась неизменной. Важно отметить, что эта измененная экспрессия связана со сниженным уровнем метилирования ДНК в PVN в определенных динуклеотидах CpG в энхансерной области, важной для активности гена AVP (Murgatroyd et al., 2009).). Далее мы показали, что гипометилирование в этой области снижает способность MeCP2 связывать и рекрутировать репрессивные гистоновые комплексы, такие как HDAC и DNMT (Murgatroyd, неопубликовано), подтверждая предыдущие доказательства роли MeCP2 в качестве эпигенетической платформы, на которой происходит деацетилирование гистонов, метилирование h4K9. , и метилирование ДНК осуществляются для подавления транскрипции и молчания генов (например, Murgatroyd et al., 2010a).
Затем мы исследовали сигналы, контролирующие занятость MeCP2 на этом раннем этапе. Синаптическая активность, управляемая опытом, вызывает деполяризацию мембран и приток кальция в избранные нейроны, что, в свою очередь, вызывает широкий спектр клеточных ответов, связывая активность нейронов с регуляцией транскрипции (Greer and Greenberg, 2008). Кроме того, ранее было показано, что деполяризация нейронов запускает Ca 9.0190 2+ -зависимое фосфорилирование MeCP2, вызывающее диссоциацию MeCP2 от промотора BDNF и, следовательно, дерепрессию гена (e.g., Martinowich et al., 2003). Последующие исследования показали, что CaMKII (Ca 2+ /кальмодулин-зависимая протеинкиназа II) способен опосредовать это фосфорилирование крысиного MeCP2 по серину 421 (Zhou et al., 2006) и гомологичному остатку серина 438 у мышей ( Мургатройд и др., 2009). Анализ 10-дневных мышей, подвергшихся стрессу в раннем возрасте, выявил повышенную иммунореактивность CaMKII и фосфо-MeCP2, которая способствовала диссоциации MeCP2 на энхансере AVP и депрессии. Однако, несмотря на то, что мыши, подвергшиеся стрессу в раннем возрасте, протестированные во взрослом возрасте (6 недель), по-прежнему демонстрировали сниженное связывание MeCP2 на энхансере AVP, уровни фосфорилирования MeCP2 и активации CaMKII в PVN больше не отличались от таковых у контрольных животных.
Синаптическая активность, управляемая опытом, вызывает деполяризацию мембран и приток кальция в избранные нейроны, что, в свою очередь, вызывает широкий спектр клеточных ответов, связывая активность нейронов с регуляцией транскрипции (Greer and Greenberg, 2008). Кроме того, ранее было показано, что деполяризация нейронов запускает Ca 9.0190 2+ -зависимое фосфорилирование MeCP2, вызывающее диссоциацию MeCP2 от промотора BDNF и, следовательно, дерепрессию гена (e.g., Martinowich et al., 2003). Последующие исследования показали, что CaMKII (Ca 2+ /кальмодулин-зависимая протеинкиназа II) способен опосредовать это фосфорилирование крысиного MeCP2 по серину 421 (Zhou et al., 2006) и гомологичному остатку серина 438 у мышей ( Мургатройд и др., 2009). Анализ 10-дневных мышей, подвергшихся стрессу в раннем возрасте, выявил повышенную иммунореактивность CaMKII и фосфо-MeCP2, которая способствовала диссоциации MeCP2 на энхансере AVP и депрессии. Однако, несмотря на то, что мыши, подвергшиеся стрессу в раннем возрасте, протестированные во взрослом возрасте (6 недель), по-прежнему демонстрировали сниженное связывание MeCP2 на энхансере AVP, уровни фосфорилирования MeCP2 и активации CaMKII в PVN больше не отличались от таковых у контрольных животных. Вместо этого эволюционирующие различия в метилировании ДНК в этой области лежат в основе сниженной занятости MeCP2 у мышей, подвергшихся стрессу в раннем возрасте. В совокупности первоначальный стимул стресса в раннем возрасте инициирует потерю занятости MeCP2, что впоследствии приводит к жесткому кодированию опыта раннего периода жизни на уровне метилирования ДНК (рис. 1). Интересно, что у контрольных мышей также происходило деметилирование, связанное с возрастом, хотя, что очень важно, область энхансера, отмеченная стрессом в раннем возрасте, была сохранена, что подтверждает важность этой области в регуляции AVP (Murgatroyd et al., 2010b).
Вместо этого эволюционирующие различия в метилировании ДНК в этой области лежат в основе сниженной занятости MeCP2 у мышей, подвергшихся стрессу в раннем возрасте. В совокупности первоначальный стимул стресса в раннем возрасте инициирует потерю занятости MeCP2, что впоследствии приводит к жесткому кодированию опыта раннего периода жизни на уровне метилирования ДНК (рис. 1). Интересно, что у контрольных мышей также происходило деметилирование, связанное с возрастом, хотя, что очень важно, область энхансера, отмеченная стрессом в раннем возрасте, была сохранена, что подтверждает важность этой области в регуляции AVP (Murgatroyd et al., 2010b).
Открыть в отдельном окне
Зависимая от опыта активация нейронов в PVN в раннем возрасте ингибирует связывание MeCP2 с геном AVP и репрессию его у стрессированных мышей . Это дополнительно способствует гипометилированию ДНК, лежащему в основе сниженной занятости MeCP2 в энхансере AVP и сохранению эпигенетического контроля экспрессии AVP в более позднем возрасте.
Дополнительные мишени для эпигенетического программирования оси HPA
Растущее число исследований подтверждает роль эпигенетических модификаций в контроле генов, регулирующих ось HPA. Два недавних исследования демонстрируют эпигенетическое программирование гипоталамического КРГ в ответ на стресс либо в пренатальном периоде, либо во взрослом возрасте. У беременных мышей, подвергавшихся хроническим переменным стрессорам на ранних сроках гестации, было обнаружено гипометилирование промотора CRH в гипоталамусе потомства во взрослом возрасте (Mueller and Bale, 2008). Более того, хронический социальный стресс у взрослых мышей вызывал гипометилирование промотора CRH в PVN у подмножества животных, демонстрирующих последующее избегание общения (Elliott et al., 2010).
Ряд исследований описывает эпигенетическую регуляцию гена POMC (про-опиомеланокортин, кодирующий АКТГ), который является нижестоящей мишенью для передачи сигналов AVP и CRH. Гиперметилирование промоторной области приводит к подавлению экспрессии, которая, по-видимому, регулируется кортизолом (например, Mizoguchi et al. , 2007). Недавние исследования предполагают эпигенетическое программирование POMC с помощью пищевых сигналов, таких как переедание или анорексия (например, Ehrlich et al., 2010), в то время как другие исследования предполагают связь с тягой к алкоголю (Muschler et al., 2010). Эти предварительные результаты требуют дальнейших исследований для решения вопроса о том, распространяется ли эпигенетическое программирование оси HPA на гипофиз (POMC) в дополнение к тканям гиппокампа (GR) и гипоталамуса (AVP и CRH).
, 2007). Недавние исследования предполагают эпигенетическое программирование POMC с помощью пищевых сигналов, таких как переедание или анорексия (например, Ehrlich et al., 2010), в то время как другие исследования предполагают связь с тягой к алкоголю (Muschler et al., 2010). Эти предварительные результаты требуют дальнейших исследований для решения вопроса о том, распространяется ли эпигенетическое программирование оси HPA на гипофиз (POMC) в дополнение к тканям гиппокампа (GR) и гипоталамуса (AVP и CRH).
Эпигенетическое программирование за пределами оси HPA
Помимо оси HPA, по-видимому, существуют дополнительные пути и эпигенетические мишени стресса в раннем возрасте. Например, крысы, выращенные во враждебной постнатальной среде, демонстрировали гиперметилирование промотора, связанное со сниженной экспрессией мозгового нейтротрофического фактора (BDNF) в префронтальной коре во взрослом возрасте (Roth et al., 2009). BDNF представляет собой нейротрофин, который регулирует развитие нервной системы, нейропластичность и функции нейронов. Кроме того, он участвует в патогенезе психических и нейродегенеративных расстройств, и растет объем литературы, связывающей эпигенетическую регуляцию генов ген BDNF с пластичностью мозга и когнитивной функцией (например, Lubin et al., 2008).
Кроме того, он участвует в патогенезе психических и нейродегенеративных расстройств, и растет объем литературы, связывающей эпигенетическую регуляцию генов ген BDNF с пластичностью мозга и когнитивной функцией (например, Lubin et al., 2008).
Нейроэндокринные системы, связанные с женским сексуальным и материнским поведением, а также развитие системы ГАМК, по-видимому, также подвержены влиянию изменений в окружающей среде в раннем возрасте. У потомства самок крыс, матерей с высоким уровнем материнской заботы, развилось гипометилирование промотора рецептора эстрогена-альфа (ERα) в медиальной преоптической области, коррелирующее с повышенным связыванием транскрипционного фактора STAT5 и повышенной экспрессией ERα (Champagne et al., 2006). Это исследование показывает, что эпигенетическое программирование может иметь место в зависимости от пола, что может пролить новый свет на давний вопрос о половой предвзятости при многочисленных заболеваниях (для обзора см. Menger et al. , 2010). материнский уход показал усиление экспрессии мРНК декарбоксилазы глутаминовой кислоты 1 (GAD1) гиппокампа, снижение метилирования цитозина и повышение уровня гистон-3-лизина 9.ацетилирование (h4K9ac) промотора GAD1 (Zhang et al., 2010). Более того, экспрессия DNMT1 также была значительно ниже у потомков тех крыс, которые получали высокий уровень материнской заботы (Zhang et al., 2010). Это интересно, так как ряд исследований предполагает регуляцию компонентов эпигенетического механизма в ответ на стрессоры. Например, недавняя работа показала, что ремоделирование хроматина в различных областях мозга, включая гиппокамп, связано с эффектами стресса в различных моделях (например, Hunter et al., 2009).).
, 2010). материнский уход показал усиление экспрессии мРНК декарбоксилазы глутаминовой кислоты 1 (GAD1) гиппокампа, снижение метилирования цитозина и повышение уровня гистон-3-лизина 9.ацетилирование (h4K9ac) промотора GAD1 (Zhang et al., 2010). Более того, экспрессия DNMT1 также была значительно ниже у потомков тех крыс, которые получали высокий уровень материнской заботы (Zhang et al., 2010). Это интересно, так как ряд исследований предполагает регуляцию компонентов эпигенетического механизма в ответ на стрессоры. Например, недавняя работа показала, что ремоделирование хроматина в различных областях мозга, включая гиппокамп, связано с эффектами стресса в различных моделях (например, Hunter et al., 2009).).
Отступление от литературы об эпигенетических изменениях, вызванных ранним периодом жизни; одно недавнее исследование показало, что травматический стресс во взрослом возрасте также может вызывать эпигенетические изменения в мозге. У взрослых крыс, подвергшихся тяжелому хроническому психосоциальному стрессу, выявлено повышенное метилирование промотора BDNF в областях гиппокампа, связанное со снижением экспрессии этого гена (Roth et al. , 2011). Другим нейротрофином, который, как известно, важен для регуляции пластичности мозга и вовлечен в депрессию, является нейротрофический фактор глиальных клеток (GDNF). Изучая две генетически различные линии мышей, демонстрирующие разные поведенческие реакции на хронический стресс, исследователи недавно обнаружили, что GDNF в прилежащем ядре эпигенетически замалчивается после стресса во взрослом возрасте только у мышей, уязвимых к стрессу (Uchida et al., 2011), что еще раз подтверждает важность динамические эпигенетические изменения в ответ на сигналы окружающей среды, сохраняющиеся во взрослом возрасте.
, 2011). Другим нейротрофином, который, как известно, важен для регуляции пластичности мозга и вовлечен в депрессию, является нейротрофический фактор глиальных клеток (GDNF). Изучая две генетически различные линии мышей, демонстрирующие разные поведенческие реакции на хронический стресс, исследователи недавно обнаружили, что GDNF в прилежащем ядре эпигенетически замалчивается после стресса во взрослом возрасте только у мышей, уязвимых к стрессу (Uchida et al., 2011), что еще раз подтверждает важность динамические эпигенетические изменения в ответ на сигналы окружающей среды, сохраняющиеся во взрослом возрасте.
Клинические исследования эпигенетического программирования невзгод в раннем возрасте
Начинают появляться доказательства того, что результаты эпигенетического программирования на животных моделях могут быть экстраполированы на человеческие исследования и психопатологии, связанные с жестоким обращением или пренебрежением в детстве. Макгоуэн и др. (2008) обнаружили, что у суицидентов, имевших в анамнезе пренебрежение или жестокое обращение в раннем детстве, наблюдалось гиперметилирование промотора рибосомной РНК (рРНК). Гены рРНК кодируют рибосомальную РНК, важную для синтеза белка, что наводит на мысль, что такое снижение уровня рРНК может отражать сниженную способность к синтезу белка в гиппокампе жертв самоубийств. Хотя, как это может способствовать патологии, еще предстоит определить. Последующие исследования посмертной ткани теми же исследователями дополнительно подтвердили гиперметилирование промотор гена GR среди жертв самоубийств с историей жестокого обращения в детстве, но не среди контрольной группы или жертв самоубийств, которые не страдали от такого стресса в раннем возрасте (McGowan et al., 2009). Эти данные, по-видимому, согласуются с предыдущими исследованиями, демонстрирующими, что эпигенетический статус гомологичного промотора гена GR регулируется родительской заботой во время раннего постнатального развития крыс (Weaver et al., 2004). Хотя и косвенная, эта корреляция в исследовании человека предполагает, что эпигенетические механизмы, которые, как считается, играют роль в уязвимости грызунов к стрессовым состояниям, могут быть экстраполированы на людей.
Гены рРНК кодируют рибосомальную РНК, важную для синтеза белка, что наводит на мысль, что такое снижение уровня рРНК может отражать сниженную способность к синтезу белка в гиппокампе жертв самоубийств. Хотя, как это может способствовать патологии, еще предстоит определить. Последующие исследования посмертной ткани теми же исследователями дополнительно подтвердили гиперметилирование промотор гена GR среди жертв самоубийств с историей жестокого обращения в детстве, но не среди контрольной группы или жертв самоубийств, которые не страдали от такого стресса в раннем возрасте (McGowan et al., 2009). Эти данные, по-видимому, согласуются с предыдущими исследованиями, демонстрирующими, что эпигенетический статус гомологичного промотора гена GR регулируется родительской заботой во время раннего постнатального развития крыс (Weaver et al., 2004). Хотя и косвенная, эта корреляция в исследовании человека предполагает, что эпигенетические механизмы, которые, как считается, играют роль в уязвимости грызунов к стрессовым состояниям, могут быть экстраполированы на людей. Однако следует отметить, что необходима дальнейшая работа, чтобы установить причинно-следственную связь этой эпигенетической модификации с общим депрессивным поведением у людей. Кроме того, независимое последующее исследование не смогло идентифицировать сходное метилирование ДНК в промоторе GR или изменения при большой депрессии (Alt et al., 2010), что снова указывает на важность межиндивидуальных генетических и экологических вариаций.
Однако следует отметить, что необходима дальнейшая работа, чтобы установить причинно-следственную связь этой эпигенетической модификации с общим депрессивным поведением у людей. Кроме того, независимое последующее исследование не смогло идентифицировать сходное метилирование ДНК в промоторе GR или изменения при большой депрессии (Alt et al., 2010), что снова указывает на важность межиндивидуальных генетических и экологических вариаций.
В целом, эти исследования предполагают, что эпигенетические процессы могут опосредовать влияние ранней среды на экспрессию генов и что стабильные эпигенетические метки, такие как метилирование ДНК, могут затем сохраняться во взрослом возрасте и влиять на уязвимость к психопатологии посредством воздействия на промежуточные уровни функций, таких как активность оси ГПА.
С появлением новых технологий высокопроизводительного секвенирования исследования теперь начинают переходить от масштаба одного гена к эпигеномному анализу всех эпигенетических меток в геноме в конкретной ткани. Учитывая, что эпигенетические модификации чувствительны к изменениям в окружающей среде, можно ожидать, что эти усилия позволят идентифицировать эпигеномные сигнатуры психических расстройств и молекулярных дисрегуляций, возникающих в результате стресса в раннем возрасте (Albert, 2010). В то время как такая стратегия кажется очень привлекательной в области исследований рака, направленных на клонально разросшиеся клеточные популяции, а не на гетерогенные ткани, область исследований эпигенетических ассоциаций при психических заболеваниях может быть более сложной. Эпигенетические модификации, зарегистрированные на сегодняшний день в животных моделях и посмертных тканях мозга, редко бывают «все или ничего», а постепенны и, по-видимому, происходят очень специфичным для типа клеток образом. С этой точки зрения чрезвычайная сложность и гетерогенность нервных тканей представляет собой серьезное препятствие для получения эпигенетических биомаркеров при психических заболеваниях.
Учитывая, что эпигенетические модификации чувствительны к изменениям в окружающей среде, можно ожидать, что эти усилия позволят идентифицировать эпигеномные сигнатуры психических расстройств и молекулярных дисрегуляций, возникающих в результате стресса в раннем возрасте (Albert, 2010). В то время как такая стратегия кажется очень привлекательной в области исследований рака, направленных на клонально разросшиеся клеточные популяции, а не на гетерогенные ткани, область исследований эпигенетических ассоциаций при психических заболеваниях может быть более сложной. Эпигенетические модификации, зарегистрированные на сегодняшний день в животных моделях и посмертных тканях мозга, редко бывают «все или ничего», а постепенны и, по-видимому, происходят очень специфичным для типа клеток образом. С этой точки зрения чрезвычайная сложность и гетерогенность нервных тканей представляет собой серьезное препятствие для получения эпигенетических биомаркеров при психических заболеваниях.
Эпигенетические биомаркеры
В конечном счете, идентификация «эпигенетических биомаркеров» в отдельных областях генома может предоставить важную информацию для понимания биологических процессов, лежащих в основе психических заболеваний, и, таким образом, позволить разработать и разработать новые терапевтические средства. Хотя изменения экспрессии и метилирования ДНК в головном мозге более явно связаны с изменениями в поведении, сопоставимые изменения в крови могут предоставить клинически ценный суррогат, учитывая легкий доступ к этой ткани у пациентов. Некоторые ранние исследования показали частичную корреляцию в экспрессии генов между различными областями мозга и кровью (например, Brown et al., 2001), что было подтверждено следующими данными, демонстрирующими эпигенетические различия в лимфоцитах, связанных с мозгом, при синдроме Ретта и болезни Альцгеймера. например, Wang et al., 2008). Недавно было описано, что хроническое воздействие кортикостерона на мышей стимулировало параллельное увеличение экспрессия FKBP5 между тканями мозга и кровью вместе с некоторыми, как правило, малозаметными изменениями метилирования ДНК на промоторе этого гена (Lee et al., 2010). Тем не менее, другие гены-кандидаты оси HPA, протестированные в этом исследовании, а именно NR3C1 , HSP90 , CRH и CRHR1 , не показали таких эффектов, в то время как дальнейшие исследования в этой области исследований также показали небольшую корреляцию.
Хотя изменения экспрессии и метилирования ДНК в головном мозге более явно связаны с изменениями в поведении, сопоставимые изменения в крови могут предоставить клинически ценный суррогат, учитывая легкий доступ к этой ткани у пациентов. Некоторые ранние исследования показали частичную корреляцию в экспрессии генов между различными областями мозга и кровью (например, Brown et al., 2001), что было подтверждено следующими данными, демонстрирующими эпигенетические различия в лимфоцитах, связанных с мозгом, при синдроме Ретта и болезни Альцгеймера. например, Wang et al., 2008). Недавно было описано, что хроническое воздействие кортикостерона на мышей стимулировало параллельное увеличение экспрессия FKBP5 между тканями мозга и кровью вместе с некоторыми, как правило, малозаметными изменениями метилирования ДНК на промоторе этого гена (Lee et al., 2010). Тем не менее, другие гены-кандидаты оси HPA, протестированные в этом исследовании, а именно NR3C1 , HSP90 , CRH и CRHR1 , не показали таких эффектов, в то время как дальнейшие исследования в этой области исследований также показали небольшую корреляцию. например, Юферов и др., 2011). Следовательно, перспектива диагностического эпигенетического тестирования психических заболеваний с использованием маркеров в крови представляется пока нерешенной и, безусловно, требует дальнейших исследований.
например, Юферов и др., 2011). Следовательно, перспектива диагностического эпигенетического тестирования психических заболеваний с использованием маркеров в крови представляется пока нерешенной и, безусловно, требует дальнейших исследований.
Вопрос времени
Многие из исследований, рассмотренных в этом обзоре, подчеркивают важность временного характера процессов развития мозга в связи с эффектами, которые стрессоры окружающей среды могут оказывать на эпигенетическое программирование долгосрочных изменений в развитии нервной системы и поведении. Развивающиеся области мозга обычно проходят через критические «окна» чувствительности, которые растягиваются на разные перинатальные периоды. Следовательно, само собой разумеющимся является то, что воздействие стрессоров в разные моменты времени будет давать более выраженные и длительные эффекты в тех областях мозга, которые активно развиваются в это конкретное время. Например, поздний пренатальный и ранний постнатальный периоды являются критическим периодом для развития гиппокампа, что, возможно, объясняет, почему воздействие окружающей среды в этот период тесно связано с клеточными, морфологическими и эпигенетическими изменениями в этих структурах (см. обзор McCrory et al., 2010). Напротив, воздействие окружающей среды в более позднем возрасте, как правило, оказывает фенотипическое воздействие, изменяя другие области мозга. Например, повторяющийся иммобилизационный стресс у взрослых крыс не вызывает долговременных эффектов, связанных с гиппокампом, таких как те, которые наблюдаются после аналогичного воздействия стресса в пренатальном и раннем постнатальном периодах жизни (Conrad et al., 19).99). С другой стороны, известно, что существенное развитие и дифференцировка коры продолжается и в подростковом возрасте (например, Wang and Gao, 2009), что, возможно, объясняет, почему эти области более восприимчивы к эпигенетическим изменениям в ответ на факторы окружающей среды в более позднем возрасте.
обзор McCrory et al., 2010). Напротив, воздействие окружающей среды в более позднем возрасте, как правило, оказывает фенотипическое воздействие, изменяя другие области мозга. Например, повторяющийся иммобилизационный стресс у взрослых крыс не вызывает долговременных эффектов, связанных с гиппокампом, таких как те, которые наблюдаются после аналогичного воздействия стресса в пренатальном и раннем постнатальном периодах жизни (Conrad et al., 19).99). С другой стороны, известно, что существенное развитие и дифференцировка коры продолжается и в подростковом возрасте (например, Wang and Gao, 2009), что, возможно, объясняет, почему эти области более восприимчивы к эпигенетическим изменениям в ответ на факторы окружающей среды в более позднем возрасте.
В дополнение к временному характеру развития мозга мы также должны учитывать временной и геноспецифический характер установления эпигенетических меток. Это будет иметь решающее значение для понимания того, как зависимые от опыта эпигенетические метки могут претерпевать переход от предварительного лабильного состояния к жестко запрограммированному стабильному отпечатку. Действительно, в наших исследованиях эпигенетическая маркировка ориентиров метилирования в энхансере AVP сохранялась при блокаде рецептора вазопрессина у взрослых (3 месяца) мышей, что согласуется с концепцией о том, что стресс в раннем возрасте уже запечатлел прочную клеточную память (Murgatroyd et al., 2010a). ). Однако остается вопрос, могут ли существовать критические «окна» для своевременных психотерапевтических и фармакологических вмешательств после воздействия тяжелой травмы в периоды, предшествующие установлению стабильных эпигенетических меток. С этой точки зрения терапевтические вмешательства могут повторно стимулировать или ингибировать те же самые нейроны и гены, эпигенетически запрограммированные ранее в жизни, и обратить эти изменения вспять. По-видимому, время, качество и продолжительность такой стимуляции окружающей среды могут быть весьма специфичными и контекстно-зависимыми в отношении точной природы стрессора раннего периода жизни.
Действительно, в наших исследованиях эпигенетическая маркировка ориентиров метилирования в энхансере AVP сохранялась при блокаде рецептора вазопрессина у взрослых (3 месяца) мышей, что согласуется с концепцией о том, что стресс в раннем возрасте уже запечатлел прочную клеточную память (Murgatroyd et al., 2010a). ). Однако остается вопрос, могут ли существовать критические «окна» для своевременных психотерапевтических и фармакологических вмешательств после воздействия тяжелой травмы в периоды, предшествующие установлению стабильных эпигенетических меток. С этой точки зрения терапевтические вмешательства могут повторно стимулировать или ингибировать те же самые нейроны и гены, эпигенетически запрограммированные ранее в жизни, и обратить эти изменения вспять. По-видимому, время, качество и продолжительность такой стимуляции окружающей среды могут быть весьма специфичными и контекстно-зависимыми в отношении точной природы стрессора раннего периода жизни.
Тем не менее, исследования на крысах показали, что обогащение окружающей среды в период полового созревания может смягчить некоторые эффекты ELS, связанные с тревогой (например, Imanaka et al. , 2008). Этот результат согласуется с наблюдениями из клиники. Например, у младенцев, которые ранее подвергались жестокому обращению, если их поместить в среду, в которой используются позитивные стратегии воспитания, наблюдаются значительные улучшения в поведении и регуляции кортизола (например, Fisher et al., 2007). Дальнейшее исследование приемных детей показало, что вмешательство, основанное на отношениях, в большей степени ориентированное на социальное взаимодействие с опекунами, оказалось гораздо более эффективным в снижении уровня кортизола по сравнению с вмешательством, в большей степени направленным на улучшение когнитивных навыков (Dozier et al., 2008). , возвращая нас к важности системы привязанности в раннем возрасте. Принимая во внимание эти наблюдения, дальнейшие доклинические исследования, посвященные влиянию такого обогащения окружающей среды после стресса в раннем возрасте, могли бы сосредоточиться на том, существуют ли критические временные окна для повышенной чувствительности к стрессу, принимая во внимание временные аспекты развития мозга и эпигенетические механизмы, а также адаптируемость к мелиоративным воздействиям.
, 2008). Этот результат согласуется с наблюдениями из клиники. Например, у младенцев, которые ранее подвергались жестокому обращению, если их поместить в среду, в которой используются позитивные стратегии воспитания, наблюдаются значительные улучшения в поведении и регуляции кортизола (например, Fisher et al., 2007). Дальнейшее исследование приемных детей показало, что вмешательство, основанное на отношениях, в большей степени ориентированное на социальное взаимодействие с опекунами, оказалось гораздо более эффективным в снижении уровня кортизола по сравнению с вмешательством, в большей степени направленным на улучшение когнитивных навыков (Dozier et al., 2008). , возвращая нас к важности системы привязанности в раннем возрасте. Принимая во внимание эти наблюдения, дальнейшие доклинические исследования, посвященные влиянию такого обогащения окружающей среды после стресса в раннем возрасте, могли бы сосредоточиться на том, существуют ли критические временные окна для повышенной чувствительности к стрессу, принимая во внимание временные аспекты развития мозга и эпигенетические механизмы, а также адаптируемость к мелиоративным воздействиям. Эффект обогащенной среды.
Эффект обогащенной среды.
Еще одним вариантом изменения последствий стресса в раннем возрасте может быть нацеливание на DNMT и ферменты ремоделирования хроматина. Хотя такие препараты, модифицирующие гистоны и нацеленные на метилирование ДНК, оказываются очень привлекательными для лечения рака, еще неизвестно, обладают ли они реальным потенциалом в области психических заболеваний. Тем не менее, примечательно, что часто используемый стабилизатор настроения вальпроат (VPA), как было показано, модулирует эпигеном, ингибируя HDAC, и может дополнительно способствовать деметилированию в клетках головного мозга (например, Perisic et al., 2010). Однако большая осторожность связана с тем фактом, что большинство доступных в настоящее время «эпигенетических лекарств» страдают недостаточной специфичностью как на уровне ткани, так и на уровне генома. Эта область еще может продвинуться вперед благодаря исследованиям, нацеленным на определенные ферменты, модифицирующие гистоны, такие как G9. a, которые могут быть достаточно избирательными, чтобы облегчить зависимость или психическое заболевание (Maze et al., 2010). Другой интересный подход к регулированию метилирования основан на лечении донором метила l-метионином или добавками фолиевой кислоты во время беременности. Интересно, что есть ряд недавних сообщений, связывающих низкий уровень фолиевой кислоты во время беременности с поведенческими симптомами у детей (например, Schlotz et al., 2010). Хотя сообщалось об эффектах экспрессии генов и поведении (например, Weaver et al., 2005), механизмы того, как такое лечение может быть способным нацеливать и вызывать такие эффекты в определенных областях мозга, до сих пор не совсем понятны.
a, которые могут быть достаточно избирательными, чтобы облегчить зависимость или психическое заболевание (Maze et al., 2010). Другой интересный подход к регулированию метилирования основан на лечении донором метила l-метионином или добавками фолиевой кислоты во время беременности. Интересно, что есть ряд недавних сообщений, связывающих низкий уровень фолиевой кислоты во время беременности с поведенческими симптомами у детей (например, Schlotz et al., 2010). Хотя сообщалось об эффектах экспрессии генов и поведении (например, Weaver et al., 2005), механизмы того, как такое лечение может быть способным нацеливать и вызывать такие эффекты в определенных областях мозга, до сих пор не совсем понятны.
Таким образом, в эпицентре современной психиатрии появляется понимание того, как ранние жизненные переживания могут вызывать устойчивые эпигенетические воспоминания, приводящие к повышенному риску психических расстройств. Вопрос о том, могут ли подходящие социальные или фармакологические вмешательства обратить вспять вредное эпигенетическое программирование, вызванное неблагоприятными условиями в раннем возрасте, должен получить наивысший приоритет в программах будущих исследований. Прогресс в этой области будет способствовать дальнейшему привлечению общественного интереса, общего понимания и оценки последствий жестокого обращения в детстве и безнадзорности для жертв в более позднем возрасте.
Прогресс в этой области будет способствовать дальнейшему привлечению общественного интереса, общего понимания и оценки последствий жестокого обращения в детстве и безнадзорности для жертв в более позднем возрасте.
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Эта работа финансировалась Европейским Союзом (CRESCENDO – Номер контракта Европейского Союза LSHM-CT-2005-018652).
- Абдолмалеки Х. М., Ченг К. Х., Фараоне С. В., Уилкокс М., Глатт С. Дж., Гао Ф., Смит К. Л., Шафа Р., Аэли Б., Карневале Дж., Пан Х., Папагеоргис П., Понте Дж. Ф., Шивараман В., Цуанг М.Т., Тиагалингам С. (2006). Гипометилирование промотора MB-COMT является основным фактором риска шизофрении и биполярного расстройства. Гум. Мол. Жене. 15, 3132–3145 [бесплатная статья PMC] [PubMed] [Google Scholar]
- Агилера Г., Рабадан-Диль К. (2000). Вазопрессинергическая регуляция гипоталамо-гипофизарно-надпочечниковой оси: значение адаптации к стрессу.
 Регул. Пепт. 96, 23–29 10.1016/S0167-0115(00)00196-8 [PubMed] [CrossRef] [Google Scholar]
Регул. Пепт. 96, 23–29 10.1016/S0167-0115(00)00196-8 [PubMed] [CrossRef] [Google Scholar] - Акбарян С., Хуанг Х. С. (2009). Эпигенетическая регуляция в мозге человека фокусируется на метилировании гистонов и лизина. биол. Psychiatry 65, 198–203 [бесплатная статья PMC] [PubMed] [Google Scholar]
- Albert PR (2010). Эпигенетика при психических заболеваниях: надежда или шумиха? J. Психиатрия Neurosci. 35, 366–368 10.1503/jpn.100148 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Альт С. Р., Тернер Дж. Д., Клок М. Д., Мейер О. К., Лакке Э. А., Дерейк Р. Х., Мюллер С. П. (2010). Дифференциальная экспрессия транскриптов глюкокортикоидных рецепторов при большом депрессивном расстройстве не запрограммирована эпигенетически. Psychoneuroendocrinology 35, 544–556 10.1016/j.psyneuen.2009.09.001 [PubMed] [CrossRef] [Google Scholar]
- Ball M.P., Li J.B., Gao Y., Lee J.H., LeProust E.M., Park I.H., Xie B., Дейли Г. К., Черч Г. М. (2009). Целевые стратегии и стратегии в масштабе генома выявляют сигнатуры метилирования тела гена в клетках человека.
 Нац. Биотехнолог. 27, 361–368 10.1038/nbt.1533 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Нац. Биотехнолог. 27, 361–368 10.1038/nbt.1533 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] - Белл Дж. Т., Спектор Т. Д. (2011). Двойной подход к разгадке эпигенетики. Тенденции Жене. 27, 116–125 10.1016/j.tig.2010.12.005 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Бердышев Г. Д., Коротаев Г. К., Боярских Г. В., Ванюшин Б. Ф. (1967). Нуклеотидный состав ДНК и РНК соматических тканей горбача и его изменения во время нереста. Биохимия, 32, 988–993 [PubMed] [Google Scholar]
- Билезикян Л. М., Блаунт А. Л., Вейл В. В. (1987). Клеточные действия вазопрессина на кортикотрофы передней доли гипофиза: устойчивость к действию глюкокортикоидов. Мол. Эндокринол. 1, 451–458 [PubMed] [Google Scholar]
- Бьорнссон Х. Т., Сигурдссон М. И., Фаллин М. Д., Иризарри Р. А., Аспелунд Т., Цуй Х., Ю В., Ронгионе М. А., Экстром Т. Дж., Харрис Т. Б., Лаунер Л. Дж., Эйриксдоттир Г., Лепперт М. Ф., Сапиенца К., Гуднасон В., Файнберг А.П. (2008). Внутрииндивидуальное изменение метилирования ДНК с течением времени с семейной кластеризацией.
 JAMA 299, 2877–2883 10.1001/jama.299.24.2877 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
JAMA 299, 2877–2883 10.1001/jama.299.24.2877 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] - Bowlby J. (1982). Привязанность и потеря: ретроспектива и перспектива. Являюсь. J. Ортопсихиатрия 52, 664–678 10.1111/j.1939-0025.1982.tb01456.x [PubMed] [CrossRef] [Google Scholar]
- Bremner J.D., Licinio J., Darnell A., Krystal J.H., Owens M.J., Southwick S.M., Nemeroff C.B., Charney D.S. (1997). Повышенные концентрации кортикотропин-рилизинг-фактора в спинномозговой жидкости при посттравматическом стрессовом расстройстве. Являюсь. J. Psychiatry 154, 624–629 [бесплатная статья PMC] [PubMed] [Google Scholar]
- Brown SE, Weaver ICG, Meaney MJ, Szyf M. (2008). Регионально-специфическое глобальное метилирование цитозина и экспрессия ДНК-метилтрансферазы в гиппокампе взрослой крысы. Неврологи. лат. 440, 49–53 [PubMed] [Google Scholar]
- Браун В., Джин П., Семан С., Дарнелл Дж. К., О’Доннелл В. Т., Тененбаум С. А., Джин С., Фэн Ю., Уилкинсон К. Д., Кин Дж.
 Д., Дарнелл Р. Б. , Уоррен С.Т. (2001). Идентификация микрочипов мРНК мозга, связанных с FMRP, и измененные профили трансляции мРНК при синдроме ломкой Х-хромосомы. Cell 107, 477–487 10.1016/S0092-8674(01)00568-2 [PubMed] [CrossRef] [Google Scholar]
Д., Дарнелл Р. Б. , Уоррен С.Т. (2001). Идентификация микрочипов мРНК мозга, связанных с FMRP, и измененные профили трансляции мРНК при синдроме ломкой Х-хромосомы. Cell 107, 477–487 10.1016/S0092-8674(01)00568-2 [PubMed] [CrossRef] [Google Scholar] - Bunck M., Czibere L., Horvath C., Graf C., Frank E., Kessler М. С., Мургатройд К., Мюллер-Михсок Б., Гоник М., Вебер П., Пютц Б., Муйгг П., Панхюйсен М., Зингевальд Н., Беткекен Т., Дойссинг Дж. М., Холсбур Ф., Шпенглер Д. , Ландграф Р. (2009 г.). Аллель гипоморфного вазопрессина предотвращает поведение, связанное с тревогой. ПЛОС ОДИН 4, e5129. 10.1371/journal.pone.0005129 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Карпентер Л.Л., Шаттак Т.Т., Тырка А.Р., Герациоти Т.Д., Прайс Л.Х. (2010). Влияние физического насилия в детстве на реакцию кортизола на стресс. Psychopharmacology (Berl.) 214, 367–375 [бесплатная статья PMC] [PubMed] [Google Scholar]
- Champagne F., Weaver I., Diorio J., Dymov S.
 , Szyf M., Meaney M.J. (2006). Материнская забота связана с метилированием промотора рецептора эстрогена-альфа1b и экспрессией рецептора эстрогена-альфа в медиальной преоптической области женского потомства. Эндокринология 147, 2909–2915 10.1210/en.2005-1119 [PubMed] [CrossRef] [Google Scholar]
, Szyf M., Meaney M.J. (2006). Материнская забота связана с метилированием промотора рецептора эстрогена-альфа1b и экспрессией рецептора эстрогена-альфа в медиальной преоптической области женского потомства. Эндокринология 147, 2909–2915 10.1210/en.2005-1119 [PubMed] [CrossRef] [Google Scholar] - Conrad C.D., LeDoux J.E., Magariños AM, McEwen B.S. (1999). Повторяющийся ограничивающий стресс способствует выработке условного рефлекса страха независимо от атрофии дендритов CA3 гиппокампа. Поведение Неврологи. 113, 902–913 [PubMed] [Google Scholar]
- Коплан Дж. Д., Смит Э. Л., Альтемус М., Шарф Б. А., Оуэнс М. Дж., Немерофф С. Б., Горман Дж. М., Розенблюм Л. А. (2001). Переменная потребность в пище: устойчивое повышение концентрации кортикотропин-рилизинг-фактора в цистернальной спинномозговой жидкости у взрослых приматов. биол. Психиатрия 50, 200–204 [PubMed] [Google Scholar]
- Цукьер Х. Н., Рабионет Р., Конидари И., Райнер-Эванс М. Ю., Балтос М. Л., Райт Х. Х., Абрамсон Р.
 К., Мартин Э. Р., Куккаро М. Л., Перикак-Ванс М. А., Гилберт Дж. Р. (2010). Новые варианты, идентифицированные в генах метил-CpG-связывающего домена у людей с аутизмом. Neurogenetics 11, 291–303 10.1007/s10048-009-0228-7 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
К., Мартин Э. Р., Куккаро М. Л., Перикак-Ванс М. А., Гилберт Дж. Р. (2010). Новые варианты, идентифицированные в генах метил-CpG-связывающего домена у людей с аутизмом. Neurogenetics 11, 291–303 10.1007/s10048-009-0228-7 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] - Daniels W.M., Fairbairn L.R., van Tilburg G., McEvoy C.R., Zigmond M.J., Russell В. А., Штейн Д. Дж. (2009 г.). Разделение с матерью изменяет уровни фактора роста нервов и кортикостерона, но не статус метилирования ДНК экзона 1 (7) области промотора глюкокортикоидного рецептора. Метаб. Мозг Дис. 24, 615–627 10.1007/s11011-009-9163-4 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- De Bellis MD, Kuchibhatla M. (2006). Объемы мозжечка при посттравматическом стрессовом расстройстве у детей, связанном с жестоким обращением. биол. Psychiatry 60, 697–703 [PubMed] [Google Scholar]
- De Kloet E. R., Vreugdenhil E., Oitzl M. S., Joëls M. (1998). Баланс рецепторов кортикостероидов головного мозга в норме и при патологии.
 Эндокр. Rev. 19, 269–301 [PubMed] [Google Scholar]
Эндокр. Rev. 19, 269–301 [PubMed] [Google Scholar] - Dempster E. L., Burcescu I., Wigg K., Kiss E., Baji I., Gadoros J., Tamás Z., Kapornai K., Daróczy G. , Кеннеди Дж. Л., Ветро А., Ковач М., Барр С. Л. и Международный консорциум по расстройствам настроения в детском возрасте. (2009). Дальнейшие генетические данные свидетельствуют о причастности вазопрессиновой системы к расстройствам настроения, возникающим в детстве. Евро. Дж. Нейроски. 30, 1615–1619 [PubMed] [Google Scholar]
- Дозье М., Пелосо Э., Льюис Э., Лоуренсо Дж. П., Левин С. (2008). Влияние вмешательства, основанного на привязанности, на выработку кортизола у младенцев и детей ясельного возраста в приемных семьях. Дев. Психопат. 20, 845–859 [бесплатная статья PMC] [PubMed] [Google Scholar]
- Дадли К.Дж., Ли С., Кобор М.С., Киппин Т.Е., Бреди Т.В. (2011). Эпигенетические механизмы, опосредующие уязвимость и устойчивость к психическим расстройствам. Неврологи. Biobehav.[Epub перед печатью]. 10.1016/j.
 neubiorev.2010.12.016 [PubMed] [CrossRef] [Google Scholar]
neubiorev.2010.12.016 [PubMed] [CrossRef] [Google Scholar] - Эрлих С., Вайс Д., Бургхардт Р., Инфанте-Дуарте К., Брокгауз С., Мюшлер М. А., Блайх С., Лемкул У., Фрилинг Х. (2010). Промоутер-специфическое метилирование ДНК и экспрессия генов POMC у пациентов с острой недостаточностью веса и выздоровевших пациентов с нервной анорексией. Дж. Психиатр. Рез. 44, 827–833 [PubMed] [Google Scholar]
- Eiland L., McEwen B.S. (2010). Стресс в раннем возрасте, за которым следует последующий хронический стресс во взрослом возрасте, усиливает тревогу и притупляет структурное ремоделирование гиппокампа. Гиппокамп. [Epub перед печатью]. 10.1002/гипо.20862. [PubMed] [CrossRef] [Академия Google]
- Эллиот Э., Эзра-Нево Г., Регев Л., Нойфельд-Коэн А., Чен А. (2010). Устойчивость к социальному стрессу совпадает с функциональным метилированием ДНК гена Crf у взрослых мышей. Нац. Неврологи. 13, 1351–1353 [PubMed] [Google Scholar]
- Фернандес-Теруэль А., Хименес-Льорт Л., Эскорихуэла Р.
 М., Гил Л., Агилар Р., Штаймер Т., Тобенья А. (2002). Стимуляция обработки в раннем возрасте и обогащение окружающей среды: некоторые из их эффектов опосредованы сходными нейронными механизмами? Фармакол. Биохим. Поведение 73, 233–245 [PubMed] [Google Scholar]
М., Гил Л., Агилар Р., Штаймер Т., Тобенья А. (2002). Стимуляция обработки в раннем возрасте и обогащение окружающей среды: некоторые из их эффектов опосредованы сходными нейронными механизмами? Фармакол. Биохим. Поведение 73, 233–245 [PubMed] [Google Scholar] - Фишер П. А., Стулмиллер М., Гуннар М. Р., Беррастон Б. О. (2007). Эффекты терапевтического вмешательства для приемных дошкольников на суточную активность кортизола. Psychoneuroendocrinology 32, 892–905 10.1016/j.psyneuen.2007.06.008 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Fraga M. F., Ballestar E., Paz M. F., Ropero S., Setien F., Баллестар М. Л., Хайне-Суньер Д., Сигудоса Дж. К., Уриосте М., Бенитес Дж., Буа-Шорнет М., Санчес-Агилера А., Линг К., Карлссон Э., Поульсен П., Вааг А., Стефан З. ., Спектор Т.Д., Ву Ю.З., Пласс С., Эстеллер М. (2005). Эпигенетические различия возникают в течение жизни монозиготных близнецов. проц. Натл. акад. науч. США 102, 10604–10609[Бесплатная статья PMC] [PubMed] [Google Scholar]
- Фрэнсис Д.
 , Диорио Дж., Лю Д., Мини М.Дж. (1999). Негеномная передача через поколения материнского поведения и реакции на стресс у крыс. Science 286, 1155–1158 10.1126/science.286.5442.1155 [PubMed] [CrossRef] [Google Scholar]
, Диорио Дж., Лю Д., Мини М.Дж. (1999). Негеномная передача через поколения материнского поведения и реакции на стресс у крыс. Science 286, 1155–1158 10.1126/science.286.5442.1155 [PubMed] [CrossRef] [Google Scholar] - Фрайс А.Б., Поллак С.Д. (2004). Понимание эмоций у постинституционализированных восточноевропейских детей. Дев. Психопат. 16, 355–369 [бесплатная статья PMC] [PubMed] [Google Scholar]
- Фукэ К., Симабукуро М., Петронис А., Сугимото Дж., Ода Т., Миура К., Миядзаки Т., Огура К., Окадзаки Ю., Джинно Ю. (2004). Возрастные изменения содержания 5-метилцитозина в периферических лейкоцитах и плацентах человека: исследование на основе ВЭЖХ. Анна. Гум. Жене. 68, 196–204 [PubMed] [Google Scholar]
- Gluckman P.D., Hanson M.A., Cooper C., Thornburg K.L. (2008). Влияние условий внутриутробного развития и раннего периода жизни на здоровье и болезни взрослых. Н. англ. Дж. Мед. 359, 61–73 [бесплатная статья PMC] [PubMed] [Google Scholar]
- Goekoop JG, de Winter R.
 P., de Rijk R., Zwinderman KH, Frankhuijzen-Sierevogel A., Wiegant VM (2006). Депрессия с вазопрессином плазмы выше нормы: подтверждение отношениями с семейной историей депрессии и смешанной тревогой и заторможенностью. Психиатрия рез. 141, 201–211 10.1016/j.psychres.2005.09.003 [PubMed] [CrossRef] [Google Scholar]
P., de Rijk R., Zwinderman KH, Frankhuijzen-Sierevogel A., Wiegant VM (2006). Депрессия с вазопрессином плазмы выше нормы: подтверждение отношениями с семейной историей депрессии и смешанной тревогой и заторможенностью. Психиатрия рез. 141, 201–211 10.1016/j.psychres.2005.09.003 [PubMed] [CrossRef] [Google Scholar] - Gonzales ML, LaSalle JM (2010). Роль MeCP2 в развитии мозга и нарушениях развития нервной системы. Курс. Психиатрия Респ. 12, 127–134 10.1007/s11920-010-0097-7 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Графодатская Д., Чанг Б., Сатмари П., Вексберг Р. (2010). Расстройства аутистического спектра и эпигенетика. Варенье. акад. Ребенок-подросток. Psychiatry 49, 794–809 [PubMed] [Google Scholar]
- Grayson D.R., Jia X., Chen Y., Sharma R.P., Mitchell C.P., Guidotti A., Costa E. (2005). Гиперметилирование промотора рилина при шизофрении. проц. Натл. акад. науч. США 102, 9341–9346 [бесплатная статья PMC] [PubMed] [Google Scholar]
- Грир П.
 Л., Гринберг М.Е. (2008). От синапса к ядру: кальций-зависимая транскрипция генов в контроле развития и функционирования синапсов. Neuron 59, 846–860 10.1016/j.neuron.2008.09.002 [PubMed] [CrossRef] [Google Scholar]
Л., Гринберг М.Е. (2008). От синапса к ядру: кальций-зависимая транскрипция генов в контроле развития и функционирования синапсов. Neuron 59, 846–860 10.1016/j.neuron.2008.09.002 [PubMed] [CrossRef] [Google Scholar] - Halusková J. (2010). Эпигенетические исследования болезней человека. Фолиа Биол. (Praha) 56, 83–96 [PubMed] [Google Scholar]
- Hanauer A., Young ID (2002). Синдром Коффина-Лоури: клинические и молекулярные особенности. Дж. Мед. Жене. 39, 705–713 [бесплатная статья PMC] [PubMed] [Google Scholar]
- Хейм К., Млецко Т., Пурсель Д., Муссельман Д. Л., Немерофф К. Б. (2008). Тест дексаметазона/кортикотропин-рилизинг-фактора у мужчин с большой депрессией: роль детской травмы. биол. Psychiatry 63, 398–405 [PubMed] [Google Scholar]
- Heim C., Nemeroff CB (2002). Нейробиология стресса в раннем возрасте: клинические исследования. Семин. клин. Neuropsychiatry 7, 147–159 [PubMed] [Google Scholar]
- Hernandez D.G., Nalls M.A., Gibbs J.R., Arepalli S.
 , van der Brug M., Chong S., Moore M., Longo D.L., Cookson M.R., Traynor B.J. , Синглтон А.Б. (2011). Отчетливые изменения метилирования ДНК сильно коррелируют с хронологическим возрастом в человеческом мозге. Гум. Мол. Жене. 20, 1164–1172 [бесплатная статья PMC] [PubMed] [Google Scholar]
, van der Brug M., Chong S., Moore M., Longo D.L., Cookson M.R., Traynor B.J. , Синглтон А.Б. (2011). Отчетливые изменения метилирования ДНК сильно коррелируют с хронологическим возрастом в человеческом мозге. Гум. Мол. Жене. 20, 1164–1172 [бесплатная статья PMC] [PubMed] [Google Scholar] - Хойзер И., Яссуридис А., Холсбур Ф. (1994). Комбинированный тест дексаметазон/CRH: усовершенствованный лабораторный тест на психические расстройства. Дж. Психиатр. Рез. 28, 341–356 [PubMed] [Google Scholar]
- Hochberg Z., Feil R., Constancia M., Fraga M., Junien C., Carel JC, Boileau P., Le Bouc Y., Deal C.L., Lillycrop К., Шарфманн Р., Шеппард А., Скиннер М., Шиф М., Уотерленд Р. А., Ваксман Д. Дж., Уайтлоу Э., Онг К., Альбертссон-Викланд К. (2010). Здоровье ребенка, пластичность развития и эпигенетическое программирование. Эндокр. Откр. 32, 159–224 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Холмс А., Ле Гиске А. М., Фогель Э., Мильштейн Р. А., Леман С., Белзунг К.
 (2005). Генетические, эпигенетические и экологические факторы раннего периода жизни, формирующие эмоциональность грызунов. Неврологи. Биоповедение. Rev. 29, 1335–1346 [PubMed] [Google Scholar]
(2005). Генетические, эпигенетические и экологические факторы раннего периода жизни, формирующие эмоциональность грызунов. Неврологи. Биоповедение. Rev. 29, 1335–1346 [PubMed] [Google Scholar] - Holsboer F. (2000). Гипотеза кортикостероидных рецепторов депрессии. Neuropsychopharma 23, 477–501 10.1016/S0893-133X(00)00159-7 [PubMed] [CrossRef] [Google Scholar]
- Hunter R.G., McCarthy K.J., Milne T.A., Pfaff D.W., McEwen B.S. (2009). Регуляция метилирования гистона h4 гиппокампа при остром и хроническом стрессе. проц. Натл. акад. науч. USA 106, 20912–20917 [бесплатная статья PMC] [PubMed] [Google Scholar]
- Хуот Р.Л., Гонсалес М.Е., Лэдд К.О., Тривикраман К.В., Плотский П.М. (2004). Приемные пометы предотвращают сенсибилизацию гипоталамо-гипофизарно-надпочечниковой оси, опосредованную неонатальным отделением от матери. Psychoneuroendocrinology 29, 279–289 10.1016/S0306-4530(03)00028-3 [PubMed] [CrossRef] [Google Scholar]
- Illingworth R.S., Bird AP (2009)).
 CpG-островки – «примерный путеводитель» FEBS Lett. 583, 1713–1720 [PubMed] [Google Scholar]
CpG-островки – «примерный путеводитель» FEBS Lett. 583, 1713–1720 [PubMed] [Google Scholar] - Иманака А., Моринобу С., Токи С., Ямамото С., Мацуки А., Кодзуру Т., Ямаваки С. (2008). Тактильная стимуляция новорожденных обращает влияние неонатальной изоляции на открытое поле и тревожное поведение, а также на болевую чувствительность у взрослых самцов и самок крыс Sprague-Dawley. Поведение Мозг Res. 186, 91–97 [PubMed] [Google Scholar]
- Jaenisch R., Bird A. (2003). Эпигенетическая регуляция экспрессии генов: как геном интегрирует внутренние сигналы и сигналы окружающей среды? Нац. Жене. 33, 245–254 [PubMed] [Google Scholar]
- Дженсен Л. Р., Аменде М., Гурок У., Мозер Б., Гиммель В., Цшах А., Янеке А. Р., Таривердян Г., Челли Дж., Фринс Дж. П., Ван Эш Х., Клифстра Т., Хамель Б. ., Морейн С., Геч Дж., Тернер Г., Райнхардт Р., Кальшойер В.М., Роперс Х.Х., Ленцнер С. (2005). Мутации в гене JARID1C, который участвует в регуляции транскрипции и ремоделировании хроматина, вызывают Х-сцепленную умственную отсталость.
 Являюсь. Дж. Хам. Жене. 76, 227–236 [бесплатная статья PMC] [PubMed] [Google Scholar]
Являюсь. Дж. Хам. Жене. 76, 227–236 [бесплатная статья PMC] [PubMed] [Google Scholar] - Jenuwein T., Allis CD (2001). Трансляция гистонового кода. Наука 293, 1074–1080 10.1126/science.1063127 [PubMed] [CrossRef] [Google Scholar]
- Jintaridth P., Mutirangura A. (2010). Отличительные закономерности возрастного гипометилирования в чередующихся повторяющихся последовательностях. Физиол. Genomics 41, 194–200 10.1152/physiolgenomics.00146.2009 [PubMed] [CrossRef] [Google Scholar]
- Jørgensen HF, Bird A. (2002). MeCP2 и другие белки, связывающие метил-CpG. Мент. Замедлить. Дев. Инвалид. Рез. Rev. 8, 87–93 [PubMed] [Google Scholar]
- Каминский З. А., Тан Т., Ван С. С., Птак С., О Г. Х., Вонг А. Х., Фельдкамп Л. А., Виртанен С., Хальварсон Дж., Тиск С. , Макрей А.Ф., Вишер П.М., Монтгомери Г.В., Готтесман И.И., Мартин Н.Г., Петронис А. (2009 г.). Профили метилирования ДНК у монозиготных и дизиготных близнецов. Нац. Жене. 41, 240–245 [PubMed] [Google Scholar]
- Кесслер М.
 С., Мургатройд К., Банк М., Чибере Л., Фрэнк Э., Джейкоб В., Хорват К., Муиг П., Холсбур Ф., Сингевальд Н., Шпенглер Д., Ландграф Р. (2007). Несахарный диабет и, частично, поведение, связанное с низкой тревожностью, связаны с дефицитом вазопрессина, связанным с SNP, у мышей LAB. Евро. Дж. Нейроски. 26, 2857–2864 [PubMed] [Google Scholar]
С., Мургатройд К., Банк М., Чибере Л., Фрэнк Э., Джейкоб В., Хорват К., Муиг П., Холсбур Ф., Сингевальд Н., Шпенглер Д., Ландграф Р. (2007). Несахарный диабет и, частично, поведение, связанное с низкой тревожностью, связаны с дефицитом вазопрессина, связанным с SNP, у мышей LAB. Евро. Дж. Нейроски. 26, 2857–2864 [PubMed] [Google Scholar] - Kleefstra T., Brunner HG, Amiel J., Oudakker A.R., Nillesen W.M., Magee A., Geneviève D., Cormier-Daire V., van Esch H., Фринс Дж. П., Хамель Б. К., Систерманс Э. А., де Врис Б. Б., ван Боховен Х. (2006). Мутации с потерей функции гистонметилтрансферазы 1 эухроматина (EHMT1) вызывают 9Синдром субтеломерной делеции q34. Являюсь. Дж. Хам. Жене. 2, 370–377 [бесплатная статья PMC] [PubMed] [Google Scholar]
- Крамер Дж. М., ван Боховен Х. (2009). Генетические и эпигенетические дефекты умственной отсталости. Междунар. Дж. Биохим. Клеточная биол. 41, 96–107 [PubMed] [Google Scholar]
- Куратоми Г., Ивамото К., Бундо М., Кусуми И., Като Н.
 , Ивата Н., Одзаки Н., Като Т. (2008). Аберрантное метилирование ДНК, связанное с биполярным расстройством, выявлено у дискордантных монозиготных близнецов. Мол. Психиатрия 13, 429–441 [PubMed] [Google Scholar]
, Ивата Н., Одзаки Н., Като Т. (2008). Аберрантное метилирование ДНК, связанное с биполярным расстройством, выявлено у дискордантных монозиготных близнецов. Мол. Психиатрия 13, 429–441 [PubMed] [Google Scholar] - Кваби-Аддо Б., Чанг В., Шен Л., Иттманн М., Уилер Т., Елинек Дж., Исса Дж. П. (2007). Возрастные изменения метилирования ДНК в нормальных тканях предстательной железы человека. клин. Рак Рез. 13, 3796–3802 10.1158/1078-0432.CCR-07-0085 [PubMed] [CrossRef] [Google Scholar]
- Лэдд К. О., Хуот Р. Л., Тривикраман К. В., Немеров К. Б., Плотский П. М. (2004). Долговременная адаптация мРНК глюкокортикоидных рецепторов и минералокортикоидных рецепторов и отрицательная обратная связь на гипоталамо-гипофизарно-надпочечниковой оси после неонатального отделения от матери. биол. Психиатрия 55, 367–375 [PubMed] [Google Scholar]
- Ли Р. С., Тамасиро К. Л., Ян С., Перселл Р. Х., Харви А., Уиллур В. Л., Хо Ю., Ронгионе М., Ванд Г. С., Поташ Дж. Б. (2010). Хроническое воздействие кортикостерона увеличивает экспрессию и снижает метилирование Fkbp5 дезоксирибонуклеиновой кислотой у мышей.
 Endocrinology 151, 4332–4343 10.1210/en.2010-0225 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Endocrinology 151, 4332–4343 10.1210/en.2010-0225 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] - Liu D., Diorio J., Tannenbaum B., Caldji C., Francis D., Фридман А., Шарма С., Пирсон Д., Плотский П. М., Мини М. Дж. (1997). Материнская забота, глюкокортикоидные рецепторы гиппокампа и реакции гипоталамо-гипофизарно-надпочечниковой системы на стресс. Science 277, 1659–1662 10.1126/science.277.5332.1659 [PubMed] [CrossRef] [Google Scholar]
- Лопес М. Ф., Доремус-Фитцуотер Т. Л., Беккер Х. С. (2010). Хроническая социальная изоляция и хронический переменный стресс на раннем этапе развития вызывают позднее повышенное потребление этанола у взрослых мышей C57BL/6J. Алкоголь. [Epub перед печатью]. 10.1016/j.alcohol.2010.08.017 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Любин Ф.Д., Рот Т.Л., Суитт Дж.Д. (2008). Эпигенетическая регуляция транскрипции гена bdnf при консолидации памяти о страхе. Дж. Нейроски. 28, 10576–10586 10.1523/JNEUROSCI.
 1786-08.2008 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
1786-08.2008 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] - Мартинович К., Хаттори Д., Ву Х., Фоус С., Хе Ф., Ху Ю., Фан Г., Сунь Ю. Э. (2003). Ремоделирование хроматина, связанное с метилированием ДНК, в зависимой от активности регуляции гена BDNF. Science 302, 890–893 10.1126/science.10 [PubMed] [CrossRef] [Google Scholar]
- Мастроени Д., Макки А., Гровер А., Роджерс Дж., Коулман П.Д. (2009). Эпигенетические различия в корковых нейронах у пары монозиготных близнецов, дискордантных по болезни Альцгеймера. ПЛОС ОДИН 4, e6617. 10.1371/journal.pone.0006617 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Maze I., Covington H. E., III, Dietz D. M., LaPlant Q., Renthal W., Russo S. J., Mechanic M. , Музон Э., Неве Р.Л., Хаггарти С.Дж., Рен Ю., Сампат С.К., Херд Ю.Л., Грингард П., Тараховский А., Шефер А., Нестлер Э.Дж. (2010). Существенная роль гистонметилтрансферазы G9в пластичности, вызванной кокаином. Science 327, 213–216 10.1126/science.
 1179438 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
1179438 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] - McCrory E., De Brito S.A., Viding E. (2010). Обзор исследований: нейробиология и генетика жестокого обращения и невзгод. Дж. Детская психология. Psychiatry 51, 1079–1095 [PubMed] [Google Scholar]
- McGowan P.O., Sasaki A., D’Alessio A.C., Dymov S., Labonte B., Szyf M., Turecki G., Meaney MJ (2009). Эпигенетическая регуляция глюкокортикоидного рецептора в мозге человека связана с жестоким обращением в детстве. Нац. Неврологи. 12, 342–348 [бесплатная статья PMC] [PubMed] [Google Scholar]
- Макгоуэн П.О., Сасаки А., Хуанг Т.К.Т., Унтербергер А., Судерман М., Эрнст К., Мини М.Дж., Турецкий Г., Шиф М. (2008). Промоторное гиперметилирование промотора гена рибосомной РНК в суицидальном мозге. ПЛОС ОДИН 3, e2085. 10.1371/journal.pone.0002085 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Meaney M.J., Diorio J., Francis D., Widdowson J., LaPlante P., Caldji C., Sharma S. , Seckl JR, Plotsky P.
 M. (1996). Ранняя экологическая регуляция экспрессии генов глюкокортикоидных рецепторов переднего мозга: последствия для адренокортикальных реакций на стресс. Дев. Неврологи. 18, 49–72 [PubMed] [Google Scholar]
M. (1996). Ранняя экологическая регуляция экспрессии генов глюкокортикоидных рецепторов переднего мозга: последствия для адренокортикальных реакций на стресс. Дев. Неврологи. 18, 49–72 [PubMed] [Google Scholar] - Menger Y., Bettscheider M., Murgatroyd C., Spengler D. (2010). Половые различия в эпигенетике мозга. Epigenomics 2, 807–821 [PubMed] [Google Scholar]
- Meynen G., Unmehopa U.A., van Heerikhuize J.J., Hofman M.A., Swaab D.F., Hoogendijk WJ (2006). Повышенная экспрессия мРНК аргинина и вазопрессина в гипоталамусе человека при депрессии: предварительный отчет. биол. Psychiatry 60, 892–895 [PubMed] [Google Scholar]
- Mizoguchi Y., Kajiume T., Miyagawa S., Okada S., Nishi Y., Kobayashi M. (2007). Стероид-зависимый карциноид тимуса, продуцируемый АКТГ: регуляция экспрессии гена POMC кортизолом посредством метилирования его промоторной области. Горм. Рез. 67, 257–262 [PubMed] [Google Scholar]
- Молес А., Киффер Б.Л., Д’Амато Ф.Р. (2004). Дефицит поведения привязанности у мышей, лишенных гена мю-опиоидного рецептора.
 Science 304, 1983–1986 [PubMed] [Google Scholar]
Science 304, 1983–1986 [PubMed] [Google Scholar] - Mueller BR, Bale TL (2008). Половое программирование эмоциональности потомства после стресса на ранних сроках беременности. Дж. Нейроски. 28, 9055–9065 [бесплатная статья PMC] [PubMed] [Google Scholar]
- Murgatroyd C., Patchev A.V., Wu Y., Micale V., Bockmühl Y., Fischer D., Holsboer F., Wotjak C.T., Almeida О. Ф., Шпенглер Д. (2009 г.). Динамическое метилирование ДНК программирует стойкие неблагоприятные последствия стресса в раннем возрасте. Нац. Неврологи. 12, 1559–1566 [PubMed] [Google Scholar]
- Мургатройд С., Виггер А., Франк Э., Сингевальд Н., Банк М., Холсбур Ф., Ландграф Р., Шпенглер Д. (2004). Нарушение репрессии при полиморфизме промотора вазопрессина лежит в основе сверхэкспрессии вазопрессина в крысиной модели личностной тревожности. Дж. Нейроски. 24, 7762–7770 [бесплатная статья PMC] [PubMed] [Google Scholar]
- Murgatroyd C., Wu Y., Bockmühl Y., Spengler D. (2010a). Гены учатся на стрессе: как детская травма программирует нас на депрессию? Эпигенетика 5, 194–199 [PubMed] [Google Scholar]
- Murgatroyd C.
 , Wu Y., Bockmühl Y., Spengler D. (2010b). Лицо Януса метилирования ДНК при старении. Старение (Олбани, Нью-Йорк) 2, 107–110 [бесплатная статья PMC] [PubMed] [Google Scholar]
, Wu Y., Bockmühl Y., Spengler D. (2010b). Лицо Януса метилирования ДНК при старении. Старение (Олбани, Нью-Йорк) 2, 107–110 [бесплатная статья PMC] [PubMed] [Google Scholar] - Мюшлер М. А., Хиллемахер Т., Краус К., Корнхубер Дж., Блейх С., Фрилинг Х. (2010) . Метилирование ДНК промотора гена РОМС связано с тягой к алкоголю. J. Нейронная передача. 117, 513–519 [PubMed] [Google Scholar]
- Nemeroff C.B., Owens M.J., Bissette G., Andorn A.C., Stanley M. (1988). Уменьшение количества мест связывания рилизинг-фактора кортикотропина в лобной коре у жертв самоубийств. Арка Gen. Psychiatry 45, 577–579 [PubMed] [Google Scholar]
- О’Коннор Т. Г., Раттер М. (2000). Поведение с расстройством привязанности после ранней тяжелой депривации: расширение и лонгитюдное наблюдение. Английская и румынская группа по изучению приемных детей. Варенье. акад. Ребенок-подросток. Psychiatry 39, 703–712 [PubMed] [Google Scholar]
- Perisic T., Zimmermann N., Kirmeier T., Asmus M., Tuorto F.
 , Uhr M., Holsboer F., Rein T., Zschocke J. (2010). Вальпроат и амитриптилин оказывают общее и разное влияние на глобальные и специфичные для промотора генов модификации хроматина в первичных астроцитах крысы. Нейропсихофармакология 35, 792–805 [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Uhr M., Holsboer F., Rein T., Zschocke J. (2010). Вальпроат и амитриптилин оказывают общее и разное влияние на глобальные и специфичные для промотора генов модификации хроматина в первичных астроцитах крысы. Нейропсихофармакология 35, 792–805 [Бесплатная статья PMC] [PubMed] [Google Scholar] - Петрий Ф., Джайлз Р. Х., Дауверсе Х. Г., Сарис Дж. Дж., Хеннекам Р. К., Масуно М., Томмеруп Н., ван Оммен Г. Дж., Гудман Р. Х., Питерс Д. Дж. (1995). Синдром Рубинштейна-Тайби, вызванный мутациями транскрипционного коактиватора CBP. Nature 376, 348–351 10.1038/376348a0 [PubMed] [CrossRef] [Google Scholar]
- Петронис А., Готтесман И. И., Кан П., Кеннеди Дж. Л., Базиль В. С., Патерсон А. Д., Попендиките В. (2003). Монозиготные близнецы демонстрируют многочисленные эпигенетические различия: ключи к дискордантности близнецов? шизофр. Бык. 29, 169–178 [PubMed] [Google Scholar]
- Пикеттс Д. Дж., Хиггс Д. Р., Бачу С., Блейк Д. Дж., Куаррелл О. У., Гиббонс Р. Дж. (1996). ATRX кодирует новый член семейства белков SNF2: мутации указывают на общий механизм, лежащий в основе синдрома ATR-X.
 Гум. Мол. Жене. 5, 1899–1907 [PubMed] [Google Scholar]
Гум. Мол. Жене. 5, 1899–1907 [PubMed] [Google Scholar] - Плотский П. М., Мини М. Дж. (1993). Ранний постнатальный опыт изменяет мРНК гипоталамического кортикотропин-рилизинг-фактора (CRF), среднее значение содержания CRF и вызванное стрессом высвобождение у взрослых крыс. Мозг Res. Мол. Мозг Res. 18, 195–200 10.1016/0169-328X(93)
-V [PubMed] [CrossRef] [Google Scholar]
- Поултер М. О., Ду Л., Уивер И. К., Палковиц М., Фалуди Г., Мерали З., Шиф М. ., Анисман Х. (2008). Гиперметилирование промотора рецептора ГАМКА в мозге суицида: значение участия эпигенетических процессов. биол. Psychiatry 64, 645–652 [PubMed] [Google Scholar]
- Куреши И. А., Мелер М. Ф. (2010). Генетические и эпигенетические основы половых различий в головном мозге и восприимчивости к неврологическим и психическим заболеваниям. прог. Мозг Res. 186, 77–95 10.1016/B978-0-444-53630-3.00006-3 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Raadsheer F.C., Hoogendijk W.J.
 , Stam F.C., Tilders F.J., Swaab D.F. (1994). Увеличение числа нейронов, экспрессирующих кортикотропин-рилизинг-гормон, в гипоталамическом паравентрикулярном ядре у пациентов с депрессией. Neuroendocrinology 60, 436–444 10.1159/000126778 [PubMed] [CrossRef] [Google Scholar]
, Stam F.C., Tilders F.J., Swaab D.F. (1994). Увеличение числа нейронов, экспрессирующих кортикотропин-рилизинг-гормон, в гипоталамическом паравентрикулярном ядре у пациентов с депрессией. Neuroendocrinology 60, 436–444 10.1159/000126778 [PubMed] [CrossRef] [Google Scholar] - Ramocki M.B., Zoghbi H.Y. (2008). Нарушение нейронального гомеостаза приводит к распространенным нейропсихиатрическим фенотипам. Природа 455, 912–918 10.1038/nature07457 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Разин А., Сидар Х. (1977). Распределение 5-метилцитозина в хроматине. проц. Натл. акад. науч. USA 74, 2725–2728 [бесплатная статья PMC] [PubMed] [Google Scholar]
- Rodríguez-Rodero S., Fernández-Morera J.L., Fernandez A.F., Menéndez-Torre E., Fraga M.F. (2010). Эпигенетическая регуляция старения. Дисков. Мед. 10, 225–233 [PubMed] [Google Scholar]
- Roth T.L., Lubin F.D., Funk A.J., Sweatt J.D. (2009). Длительное эпигенетическое влияние невзгод в раннем возрасте на ген BDNF.
 биол. Psychiatry 65, 760–769 [бесплатная статья PMC] [PubMed] [Google Scholar]
биол. Psychiatry 65, 760–769 [бесплатная статья PMC] [PubMed] [Google Scholar] - Roth TL, Zoladz PR, Sweatt JD, Diamond DM (2011). Эпигенетическая модификация ДНК Bdnf гиппокампа у взрослых крыс на животной модели посттравматического стрессового расстройства. Дж. Психиатр. Рез. [Epub перед печатью]. 10.1016/j.psychires.2011.01.013 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Rupprecht R., Lesch K.P., Muller U., Beck G., Beckmann H., Schulte H.M. (1989). Притупление адренокортикотропина, но нормальное высвобождение бета-эндорфина после введения человеческого кортикотропин-рилизинг-гормона при депрессии. Дж. Клин. Эндокринол. Метаб. 69, 600–603 [PubMed] [Google Scholar]
- Rutter M. (1998). Отставание в развитии и дефицит после усыновления после серьезной глобальной ранней лишенности, группа изучения английского и румынского усыновленных детей (ERA). Дж. Детская психология. Psychiatry 39, 465–476 [PubMed] [Google Scholar]
- Санчес М. М.
 , Маккормак К., Гранд А. П., Фулкс Р., Графф А., Маэстрипьери Д. (2010). Влияние секса и жестокого обращения с матерью в раннем возрасте на реакцию адренокортикотропного гормона и кортизола на введение кортикотропин-высвобождающего гормона в течение первых 3 лет жизни у макак-резусов, живущих в группах. Дев. Психопат. 22, 45–53 10.1017/С09545794099 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Маккормак К., Гранд А. П., Фулкс Р., Графф А., Маэстрипьери Д. (2010). Влияние секса и жестокого обращения с матерью в раннем возрасте на реакцию адренокортикотропного гормона и кортизола на введение кортикотропин-высвобождающего гормона в течение первых 3 лет жизни у макак-резусов, живущих в группах. Дев. Психопат. 22, 45–53 10.1017/С09545794099 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] - Sartre J.-P. (1964). Лес Мотс. Paris: Gallimard 254–255 [Google Scholar]
- Schlotz W., Jones A., Phillips DI, Gale C.R., Robinson S.M., Godfrey K.M. (2010). Более низкий уровень фолиевой кислоты у матери на ранних сроках беременности связан с детской гиперактивностью и проблемами со сверстниками у потомства. Дж. Детская психология. Psychiatry 51, 594–602 [бесплатная статья PMC] [PubMed] [Google Scholar]
- Schore AN (2000). Привязанность и регуляция правого полушария. Прикреплять. Гум. Дев. 2, 23–47 [PubMed] [Google Scholar]
- Секл Дж. Р., Мини М.
 Дж. (2004). Глюкокортикоидное программирование. Анна. Академик Нью-Йорка науч. 1032, 63–84 [PubMed] [Google Scholar]
Дж. (2004). Глюкокортикоидное программирование. Анна. Академик Нью-Йорка науч. 1032, 63–84 [PubMed] [Google Scholar] - Седлак А. Дж., Бродхерст Д. Д. (1996). Третье национальное исследование жестокого обращения с детьми и безнадзорности. Вашингтон, округ Колумбия: Министерство здравоохранения и социальных служб США, Национальный центр жестокого обращения с детьми и безнадзорности [Google Scholar]
- Smotherman W. P., Bell R. W., Starzec J., Elias J., Zachman T. A. (1974). Материнские реакции на волализационные реакции младенцев и обонятельные сигналы у крыс и мышей. Поведение биол. 15, 55–66 [PubMed] [Google Scholar]
- Сун С. Х., Зулвах К. Э., Фу Ю., Дай К., Йи С., Ли С., Ли Ю., Чен С. Х., Чжан В., Цзянь С., Ван Дж., Чжан Л., Луни Т. Дж., Чжан Б., Годли Л.А., Хикс Л.М., Лан Б.Т., Джин П., Хе К. (2011). Селективная химическая маркировка выявляет широкогеномное распределение 5-гидроксиметилцитозина. Нац. Биотехнолог. 29, 68–72 10.1038/nbt.1732 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Suzuki MM, Bird A.
 (2008). Ландшафты метилирования ДНК: провокационные выводы из эпигеномики. Нац. Преподобный Жене. 9, 465–476 [PubMed] [Google Scholar]
(2008). Ландшафты метилирования ДНК: провокационные выводы из эпигеномики. Нац. Преподобный Жене. 9, 465–476 [PubMed] [Google Scholar] - Такасуги М. (2011). Прогрессивные возрастные изменения метилирования ДНК начинаются в тканях мышей до наступления взрослой жизни. мех. Старение Дев. 132, 65–71 10.1016/j.mad.2010.12.003 [PubMed] [CrossRef] [Google Scholar]
- Тарулло А. Р., Гуннар М. Р. (2006). Жестокое обращение с детьми и развивающаяся ось HPA. Горм. Поведение 50, 632–639 [PubMed] [Google Scholar]
- Таттон-Браун К., Рахман Н. (2007). Синдром Сотоса. Евро. Дж. Хам. Жене. 3, 264–271 [PubMed] [Google Scholar]
- Томпсон Р. Ф., Ацмон Г., Георге К., Лян Х. К., Лоуэс К., Грелли Дж. М., Барзилай Н. (2010). Тканеспецифическое нарушение регуляции метилирования ДНК при старении. Aging Cell 9, 506–518 10.1111/j.1474-9726.2010.00577.x [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Turek-Plewa J., Jagodziński P. P. (2005). Роль ДНК-метилтрансфераз млекопитающих в регуляции экспрессии генов.
 Ячейка Мол. биол. лат. 10, 631–647 [PubMed] [Google Scholar]
Ячейка Мол. биол. лат. 10, 631–647 [PubMed] [Google Scholar] - Tyrka A.R., Price L.H., Gelernter J., Schepker C., Anderson G.M., Carpenter L.L. (2009). Взаимодействие жестокого обращения в детстве с геном рецептора кортикотропин-высвобождающего гормона: влияние на реактивность гипоталамо-гипофизарно-надпочечниковой оси. биол. Psychiatry 66, 681–685 [бесплатная статья PMC] [PubMed] [Google Scholar]
- Учида С., Хара К., Кобаяси А., Оцуки К., Ямагата Х., Хобара Т., Судзуки Т., Мията Н. ., Ватанабэ Ю. (2011). Эпигенетический статус Gdnf в вентральном стриатуме определяет восприимчивость и адаптацию к ежедневным стрессовым событиям. Neuron 69, 359–372 10.1016/j.neuron.2010.12.023 [PubMed] [CrossRef] [Google Scholar]
- van Oers HJ, de Kloet E.R., Levine S. (1999). Стойкое влияние материнской депривации на регуляцию HPA может быть устранено кормлением и поглаживанием, но не дексаметазоном. Дж. Нейроэндокринол. 11, 581–588 [PubMed] [Google Scholar]
- Васкес Д.
 М., Бейли К., Дент Г. В., Окимото Д. К., Стеффек А., Лопес Дж. Ф., Левин С. (2006). Цепи кортикотропин-рилизинг-гормона (CRH) в головном мозге у развивающейся крысы: эффект материнской депривации. Мозг Res. 1121, 83–94 10.1016/j.brainres.2006.08.104 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
М., Бейли К., Дент Г. В., Окимото Д. К., Стеффек А., Лопес Дж. Ф., Левин С. (2006). Цепи кортикотропин-рилизинг-гормона (CRH) в головном мозге у развивающейся крысы: эффект материнской депривации. Мозг Res. 1121, 83–94 10.1016/j.brainres.2006.08.104 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] - Винема А. Х., Блюме А., Нидерле Д., Бувалда Б., Нойманн И. Д. (2006). Влияние стресса в раннем возрасте на агрессию взрослых мужчин и гипоталамический вазопрессин и серотонин. Евро. Дж. Нейроски. 24, 1711–1720 [PubMed] [Google Scholar]
- Vogt G., Huber M., Thiemann M., van den Boogaart G., Schmitz O.J., Schubart C.D. (2008). Производство разных фенотипов из одного и того же генотипа в одной и той же среде за счет вариаций развития. Дж. Эксп. биол. 211, 510–523 [PubMed] [Google Scholar]
- Ван Х.-С., Гао У.-Дж. (2009). Типоспецифическое развитие рецепторов NMDA в интернейронах префронтальной коры крысы. Neuropsychopharmacology 34, 2028–2040 10.1038/npp.2009.
 20 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
20 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] - Wang S.C., Oelze B., Schumacher A. (2008). Возрастной эпигенетический дрейф при болезни Альцгеймера с поздним началом. ПЛОС ОДИН 3, e2698. 10.1371/journal.pone.0002698 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Weaver I.C., Cervoni N., Champagne F.A., D’Alessio A.C., Sharma S., Seckl J.R., Dymov S., Шиф М., Мини М.Дж. (2004). Эпигенетическое программирование материнским поведением. Нац. Неврологи. 7, 847–854 [PubMed] [Google Scholar]
- Уивер И. К., Шампанское Ф. А., Браун С. Э., Дымов С., Шарма С., Мини М. Дж., Шиф М. (2005). Изменение материнского программирования стрессовых реакций у взрослых потомков посредством добавления метила: изменение эпигенетической маркировки в более позднем возрасте. Дж. Нейроски. 25, 11045–11054 10.1523/JNEUROSCI.3652-05.2005 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Weber M., Hellmann I., Stadler M. B., Ramos L., Pääbo S.
 , Rebhan M ., Шубелер Д. (2007). Распространение, потенциал молчания и эволюционное влияние метилирования промоторной ДНК в геноме человека. Нац. Жене. 39, 457–466 [PubMed] [Google Scholar]
, Rebhan M ., Шубелер Д. (2007). Распространение, потенциал молчания и эволюционное влияние метилирования промоторной ДНК в геноме человека. Нац. Жене. 39, 457–466 [PubMed] [Google Scholar] - Юферов В., Нильсен Д. А., Левран О., Рандеси М., Хамон С., Хо А., Моргелло С., Крик М. Дж. (2011). Тканеспецифическое метилирование ДНК гена продинорфина человека в посмертных тканях мозга и РВМС. Фармакогенет. Геномика. 21, 185–196 [бесплатная статья PMC] [PubMed] [Google Scholar]
- Zhang T. Y., Hellstrom I. C., Bagot R. C., Wen X., Diorio J., Meaney M. J. (2010). Материнский уход и метилирование ДНК промотора декарбоксилазы 1 глутаминовой кислоты в гиппокампе крысы. Дж. Нейроски. 30, 13130–13137 [бесплатная статья PMC] [PubMed] [Google Scholar]
- Zhou Z., Hong E.J., Cohen S., Zhao W.N., Ho H.Y., Schmidt L., Chen W.G., Lin Y., Savner E., Griffith E.C., Hu L., Steen J.A., Weitz C.J., Greenberg M.E. ( 2006). Специфическое для мозга фосфорилирование MeCP2 регулирует зависимую от активности транскрипцию Bdnf, рост дендритов и созревание шипов.
 Neuron 52, 255–269 10.1016/j.neuron.2006.09.037 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Neuron 52, 255–269 10.1016/j.neuron.2006.09.037 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Статьи из Frontiers in Psychiatry предоставлены здесь с разрешения Frontiers Media SA
Что такое эпигенетика? | CDC
Ваши гены играют важную роль в вашем здоровье, но не меньшее значение имеют ваше поведение и окружающая среда, например, что вы едите и насколько вы физически активны. Эпигенетика — это исследование того, как ваше поведение и окружающая среда могут вызывать изменения, влияющие на работу ваших генов. В отличие от генетических изменений, эпигенетические изменения обратимы и не меняют последовательность вашей ДНК, но они могут изменить то, как ваше тело читает последовательность ДНК.
Экспрессия генов относится к тому, как часто или когда белки создаются в соответствии с инструкциями ваших генов. В то время как генетические изменения могут изменить состав белка, эпигенетические изменения влияют на экспрессию генов, включая и выключая гены. Поскольку ваше окружение и поведение, такое как диета и физические упражнения, могут привести к эпигенетическим изменениям, легко увидеть связь между вашими генами, вашим поведением и окружающей средой.
Поскольку ваше окружение и поведение, такое как диета и физические упражнения, могут привести к эпигенетическим изменениям, легко увидеть связь между вашими генами, вашим поведением и окружающей средой.
Как работает эпигенетика?
Эпигенетические изменения по-разному влияют на экспрессию генов. Типы эпигенетических изменений включают:
Метилирование ДНК
Метилирование ДНК работает путем добавления химической группы к ДНК. Как правило, эта группа добавляется в определенные места ДНК, где она блокирует белки, которые прикрепляются к ДНК, чтобы «читать» ген. Эта химическая группа может быть удалена с помощью процесса, называемого деметилированием. Как правило, метилирование «выключает» гены, а деметилирование «включает» гены.
Модификация гистонов
ДНК оборачивается вокруг белков, называемых гистонами. Когда гистоны плотно упакованы вместе, белки, которые «считывают» ген, не могут так же легко получить доступ к ДНК, поэтому ген «выключается». Когда гистоны упакованы неплотно, больше ДНК открыто или не обернуто вокруг гистона, и к ним могут получить доступ белки, которые «считывают» ген, поэтому ген «включается». Химические группы могут быть добавлены или удалены из гистонов, чтобы сделать гистоны более плотно или рыхло упакованными, включая или выключая гены.
Когда гистоны упакованы неплотно, больше ДНК открыто или не обернуто вокруг гистона, и к ним могут получить доступ белки, которые «считывают» ген, поэтому ген «включается». Химические группы могут быть добавлены или удалены из гистонов, чтобы сделать гистоны более плотно или рыхло упакованными, включая или выключая гены.
Некодирующая РНК
Ваша ДНК используется в качестве инструкции по созданию кодирующей и некодирующей РНК. Кодирующая РНК используется для производства белков. Некодирующая РНК помогает контролировать экспрессию генов, присоединяясь к кодирующей РНК вместе с определенными белками, чтобы разрушить кодирующую РНК, чтобы ее нельзя было использовать для создания белков. Некодирующие РНК могут также привлекать белки для модификации гистонов, чтобы включать или выключать гены.
Как может измениться ваша эпигенетика?
Ваша эпигенетика меняется с возрастом, как в рамках нормального развития и старения, так и в ответ на ваше поведение и окружающую среду.
- Эпигенетика и развитие
Эпигенетические изменения начинаются еще до вашего рождения. Все ваши клетки имеют одни и те же гены, но выглядят и действуют по-разному. По мере вашего роста и развития эпигенетика помогает определить, какую функцию будет выполнять клетка, например, станет ли она клеткой сердца, нервной клеткой или клеткой кожи.
Пример: нервная клетка против мышечной клетки
Ваши мышечные и нервные клетки имеют одинаковую ДНК, но работают по-разному. Нервная клетка передает информацию другим клеткам вашего тела. Мышечная клетка имеет структуру, которая помогает вашему телу двигаться. Эпигенетика позволяет мышечной клетке «включать» гены, чтобы сделать белки важными для своей работы, и «выключать» гены, важные для работы нервной клетки.
- Эпигенетика и возраст
Эпигенетика меняется на протяжении всей жизни. Ваша эпигенетика при рождении отличается от вашей эпигенетики в детстве или взрослой жизни.
Пример: исследование новорожденных, 26-летних и 103-летних
Метилирование ДНК в миллионах участков было измерено у новорожденных, 26-летних и 103-летних. Уровень метилирования ДНК снижается с возрастом. У новорожденного был самый высокий уровень метилирования ДНК, у 103-летнего человека был самый низкий уровень метилирования ДНК, а у 26-летнего человека уровень метилирования ДНК был между новорожденным и 103-летним (1).
- Эпигенетика и обратимость
Не все эпигенетические изменения постоянны. Некоторые эпигенетические изменения могут быть добавлены или удалены в ответ на изменения в поведении или окружающей среде.
Пример: Курильщики, некурящие и бывшие курильщики
Курение может привести к эпигенетическим изменениям. Например, в определенных частях гена AHRR курильщики, как правило, имеют меньшее метилирование ДНК, чем некурящие. Разница больше для заядлых курильщиков и длительных курильщиков. После отказа от курения у бывших курильщиков может начаться повышенное метилирование ДНК в этом гене. В конце концов, они могут достичь уровня, аналогичного уровню некурящих. В некоторых случаях это может произойти менее чем за год, но продолжительность времени зависит от того, как долго и сколько человек курил до того, как бросить курить (2).
После отказа от курения у бывших курильщиков может начаться повышенное метилирование ДНК в этом гене. В конце концов, они могут достичь уровня, аналогичного уровню некурящих. В некоторых случаях это может произойти менее чем за год, но продолжительность времени зависит от того, как долго и сколько человек курил до того, как бросить курить (2).
Эпигенетика и здоровье
Эпигенетические изменения могут по-разному влиять на ваше здоровье:
- Инфекции
Микробы могут изменить вашу эпигенетику, ослабив вашу иммунную систему. Это помогает микробу выжить.
Пример: Mycobacterium tuberculosis
Mycobacterium tuberculosis вызывает туберкулез. Инфекции этими микробами могут вызывать изменения гистонов в некоторых ваших иммунных клетках, что приводит к «отключению» ИЛ-12В ген. «Выключение» гена IL-12B ослабляет вашу иммунную систему и повышает выживаемость Mycobacterium tuberculosis (3).
- Рак
Определенные мутации повышают вероятность развития рака. Точно так же некоторые эпигенетические изменения увеличивают риск развития рака. Например, наличие мутации в гене BRCA1 , препятствующей его правильной работе, повышает вероятность развития рака молочной железы и других видов рака. Точно так же повышенное метилирование ДНК приводит к уменьшению 9Экспрессия гена 0008 BRCA1 повышает риск развития рака молочной железы и других видов рака (4). В то время как раковые клетки имеют повышенное метилирование ДНК в определенных генах, общий уровень метилирования ДНК в раковых клетках ниже, чем в нормальных клетках. Различные типы рака, которые выглядят одинаково, могут иметь разные модели метилирования ДНК. Эпигенетика может использоваться, чтобы помочь определить, какой тип рака у человека, или может помочь обнаружить рак, который трудно обнаружить раньше. Эпигенетика сама по себе не может диагностировать рак, и рак должен быть подтвержден дальнейшими скрининговыми тестами.
Пример: колоректальный рак
Колоректальный рак характеризуется аномальным метилированием участков ДНК рядом с определенными генами, что влияет на экспрессию этих генов. Некоторые коммерческие скрининговые тесты на колоректальный рак используют образцы стула для поиска аномальных уровней метилирования ДНК в одном или нескольких из этих участков ДНК. Важно знать, что если результат теста положительный или ненормальный, для завершения процесса скрининга необходимо провести колоноскопию (5).
- Питание во время беременности
Окружающая среда и поведение беременной женщины во время беременности, например, ест ли она здоровую пищу, могут изменить эпигенетику ребенка. Некоторые из этих изменений могут сохраняться десятилетиями и повышать вероятность развития у ребенка определенных заболеваний.
Пример: голландский голод Зимний голод (1944-1945)
Люди, чьи матери были беременны ими во время голода, были более склонны к развитию определенных заболеваний, таких как сердечные заболевания, шизофрения и диабет 2 типа (6). Примерно через 60 лет после голода исследователи изучили уровни метилирования у людей, чьи матери были беременны ими во время голода. У этих людей было повышенное метилирование одних генов и пониженное метилирование других генов по сравнению с их братьями и сестрами, которые не подвергались голоду до своего рождения (7)(8)(9). Эти различия в метилировании могут помочь объяснить, почему у этих людей была повышена вероятность развития определенных заболеваний в более позднем возрасте (6) (9) (10) (11).
Примерно через 60 лет после голода исследователи изучили уровни метилирования у людей, чьи матери были беременны ими во время голода. У этих людей было повышенное метилирование одних генов и пониженное метилирование других генов по сравнению с их братьями и сестрами, которые не подвергались голоду до своего рождения (7)(8)(9). Эти различия в метилировании могут помочь объяснить, почему у этих людей была повышена вероятность развития определенных заболеваний в более позднем возрасте (6) (9) (10) (11).
- Learn.Genetics: Учебный центр генетических наук при Университете штата Юта
содержит подробное объяснение и интерактивный учебник по эпигенетике Институт наук об окружающей среде: эпигенетика
содержит информацию об эпигенетике, эпигенетических исследованиях и видео об эпигенетике. Proc Natl Acad Sci U S A 2012; 109:10522-7
- Маккартни Д., Стивенсон А., Хиллари Р. и др., Эпигенетические признаки начала и отказа от курения. ЭБиоМедицина 2018; 37:214-220
- Чандран А.
 , Энтони С., Хосе Л. и др., Инфекция Mycobacterium Tuberculosis вызывает медикаментозное подавление экспрессии гена IL-12B в макрофагах с помощью HDAC1. Front Cell Infect Microbiol 2015; 5:90.
, Энтони С., Хосе Л. и др., Инфекция Mycobacterium Tuberculosis вызывает медикаментозное подавление экспрессии гена IL-12B в макрофагах с помощью HDAC1. Front Cell Infect Microbiol 2015; 5:90. - Tang Q, Cheng J, Cao X и др., Метилирование ДНК в крови как биомаркер рака молочной железы: систематический обзор. Клин Эпигенетика 2016; 8: 115.
- Чан С.Х., Лян Д.К. Достижения в тестах для скрининга и диагностики колоректального рака. Expert Rev Mol Diagn 2022; 22: 449-460.
- Роузбум Т., Эпидемиологические данные об истоках здоровья и болезней, связанных с развитием: последствия пренатального недоедания у людей. J Эндокринол 2019. 242:T135-T144
- Heijmans B, Tobi E, Stein A, et al., Стойкие эпигенетические различия, связанные с внутриутробным воздействием голода у людей. Proc Natl Acad Sci U S A 2008; 105: 17046-17049.
- Тоби Э., Люми Л., Таленс Р. и др., Различия в метилировании ДНК после воздействия пренатального голода являются общими и зависят от времени и пола.
 Хум Мол Жене 2009; 18:4046-53.
Хум Мол Жене 2009; 18:4046-53. - Тоби Э., Сликер Р., Луйк Р. и др., Метилирование ДНК как медиатор связи между пренатальными невзгодами и факторами риска метаболических заболеваний во взрослом возрасте. Sci Adv 2018; 4: еаао4364.
- Dayeh T, Tuomi T, Almgren P, et al., Метилирование ДНК локусов внутри ABCG1 и PHOSPHO1 в ДНК крови связано с будущим риском развития диабета 2 типа. Эпигенетика 2016; 7: 482-8.
- Pidsley R, Dempster E, Troakes C, et al., Эпигенетические и генетические вариации в контрольной области импринтинга IGF2/h29 на 11p15.5 связаны с массой мозжечка. Эпигенетика 2012; 7:155-163.
- Гены не являются неотъемлемой частью строения ребенка, это только начало истории каждого. Гены накапливают химические метки, известные под общим названием эпигеном, которые могут перестраиваться и выражаться по-разному по мере развития ребенка.
- Природа или воспитание? Оба! Дебаты теперь старая наука.

- Положительный и отрицательный опыт будут формировать эпигеном. Этот процесс начинается в утробе матери и продолжается в раннем детстве.
- Родители могут оказать положительное влияние на гены своего ребенка, создав позитивные, заботливые отношения и возможности для обучения своего ребенка, особенно в раннем возрасте.
- Эпигенетика и генетика
- Эпигенетика и психология
Эпигенетика: Развитие ребенка и гены
Развитие ребенка
Кредит: iStock.com/microgen
Ученые из Гарвардского университета считают, что они решили вопрос о том, что больше всего влияет на развитие ребенка: природа или воспитание, и говорят, что ответ «почти всегда и то, и другое».
Отчет Центра развития ребенка «Эпигенетика и развитие ребенка: как детский опыт влияет на их гены» объясняет связь между детским опытом и тем, как их гены проявляются по мере их развития.
Проще говоря, теперь мы знаем, что хотя дети наследуют гены от своих биологических родителей, эти гены являются лишь началом того, кем мы становимся по мере нашего развития.
Это связано с тем, что в раннем возрасте, когда изменения в мозге происходят наиболее быстро, гены подвержены внешнему влиянию, которое, по мнению исследователей, влияет на то, «когда, как и даже выдают ли эти гены свои инструкции».
Что такое эпигенетика?
Эпигенетика — новая область научных исследований. Хотя мы уже знали, что опыт, полученный маленькими детьми в первую тысячу дней их жизни, может сыграть положительную роль в их развитии, теперь мы знаем, что этот ранний опыт может фактически изменить способ выражения генов наших детей.
Как это работает? У всех нас есть ДНК, из которой состоят наши гены. Во время развития ДНК накапливает химические метки, которые определяют, насколько ген «экспрессирован» или нет. Совокупность этих меток известна как эпигеном, и они являются ключом к пониманию эпигенетики. Эпигеном также объясняет, почему однояйцевые близнецы часто демонстрируют разное поведение, навыки, здоровье или достижения: эпигеном у всех разный.
Во время развития ДНК накапливает химические метки, которые определяют, насколько ген «экспрессирован» или нет. Совокупность этих меток известна как эпигеном, и они являются ключом к пониманию эпигенетики. Эпигеном также объясняет, почему однояйцевые близнецы часто демонстрируют разное поведение, навыки, здоровье или достижения: эпигеном у всех разный.
Исследователи из Гарварда объясняют: «Когда события во время развития изменяют эпигенетические метки, которые управляют экспрессией генов, они могут изменить то, высвобождают ли гены информацию, которую они несут, и каким образом».
Это означает, что, хотя ваш ребенок может нести ген определенного признака, его ранний опыт (положительный или отрицательный) еще в утробе матери может определить, как эти гены включаются и выключаются — или даже проявляются вообще.
Когда события во время развития изменяют эпигенетические метки, управляющие экспрессией генов, они могут изменить то, высвобождают ли гены информацию, которую они несут, и как.
Гарвардские исследователи
Будьте в курсе последних новостей и статей за первые пять лет
Подпишитесь сейчас
Имя
Введите свое имя
Электронная почта
Введите свой адрес электронной почтыВведите действующий адрес электронной почты
Правда или вымысел? Что мы теперь знаем об эпигенетике и развитии детей.
Эта относительно новая область исследований уже развеяла ряд мифов о развитии ребенка и дала нам несколько новых фактов для размышлений.
Факт 1: Окружающая среда может изменить унаследованные гены.
Гены, которые мы унаследовали от наших биологических родителей, не оставляют неизменного следа. Хотя изменения в нашей ДНК определенно влияют на то, как экспрессируются наши гены и как функционируют белки внутри них, это только часть истории. Согласно отчету:
Согласно отчету:
«Среда, в которой человек развивается до и вскоре после рождения, дает мощный опыт, который химически модифицирует определенные гены, которые, в свою очередь, определяют, в какой степени и когда они проявляются».
Факт 2: Неблагоприятный опыт может навсегда изменить мозг.
В настоящее время исследователи подтвердили, что: «Вредный опыт, такой как недоедание, воздействие химических токсинов или наркотиков и токсический стресс до рождения или в раннем детстве, не «забывается» развивающимся ребенком.
Вместо этого этот опыт запрограммирован в архитектуре развивающегося мозга через его эпигеном, увеличивая риск «плохих результатов физического и психического здоровья… [или] нарушений в будущих способностях к обучению и поведении» 9.0003
Факт 3: Игра Моцарта не является ключом к переменам, но родители могут сделать еще кое-что.
Гарвардские ученые подтвердили в своем отчете, что нет «абсолютно никаких научных доказательств» того, что воздействие записей Моцарта вызовет эпигенетические изменения, необходимые для улучшения работы нашего мозга.
Они обнаружили, что по мере развития обучения и памяти ребенка, если мы неоднократно «активируем» участки мозга, предназначенные для обучения и памяти, мы можем производить положительные эпигенетические модификации. Этот процесс называется «подача и возврат» и основан на взаимодействии между родителем или опекуном и ребенком.
Когда наш ребенок плачет, жестикулирует или бормочет, и мы реагируем соответствующим образом, например, объятием, добрыми словами или даже зрительным контактом, мы начинаем создавать и укреплять нейронные связи, которые позитивно изменяют гены ребенка – возможно, на всю жизнь.
Факт 4. Как положительный, так и отрицательный опыт может влиять на наш эпигеном.
Хорошая новость заключается в том, что положительный опыт, такой как поддерживающие отношения, построенные между ребенком и его родителями или опекунами, или возможности для обучения, могут влиять на эпигеном. К сожалению, то же самое можно сказать и о негативных переживаниях, таких как токсины окружающей среды или стрессовые обстоятельства.
Исследователи говорят, что, хотя мы можем обратить вспять определенные негативные изменения на генетическом уровне, для мозга требуется гораздо больше, чем включение соответствующего изменения в первую очередь.
Дальнейшее осложнение? Хотя как положительные, так и отрицательные ситуации оставляют уникальную эпигенетическую «подпись», любое из этих изменений может быть постоянным или временным.
Ответ на все это для родителей ясен. Если мы сможем создать отзывчивые отношения с нашими детьми и помочь уменьшить их подверженность стрессовой среде с самого раннего возраста, мы дадим им наилучшие шансы на формирование сильного мозга с самого начала.
Краткий обзор эпигенетики
Эпигенетика | Психология сегодня
Отзыв от Psychology Today Staff
Эпигенетика — это исследование того, как окружающая среда и другие факторы могут изменить способ экспрессии генов. Хотя эпигенетические изменения не изменяют последовательность генетического кода человека, они могут играть важную роль в развитии. Ученые, работающие в области эпигенетики, изучают механизмы, влияющие на активность генов.
Содержимое
Эпигенетика и генетика
ДНК каждого человека закладывает основу для развития физических и психологических характеристик, предоставляя сложные инструкции по созданию белков и других молекул. Но способ использования этих инструкций может быть изменен различными факторами. Химические модификации, которые таким образом влияют на активность генов, в совокупности называются эпигеномом.
Но способ использования этих инструкций может быть изменен различными факторами. Химические модификации, которые таким образом влияют на активность генов, в совокупности называются эпигеномом.
Эти модификации происходят естественным образом и помогают управлять развитием — например, они позволяют клеткам мозга и других частей тела выполнять особые роли, основанные на одном и том же основном генетическом коде. Но эпигеном также подвержен влиянию токсинов и других факторов окружающей среды.
В чем разница между генетикой и эпигенетикой?
Генетика — это наука о генах — элементах генетического кода человека, состоящих из ДНК, — и чертах, на которые они влияют. Эпигенетика фокусируется на физических изменениях, влияющих на «экспрессию» генов — например, на то, активен ли конкретный ген или нет, и, следовательно, производятся ли определенные белки.
Как эпигенетические изменения влияют на экспрессию генов?
Эпигенетические изменения на самом деле не изменяют основную последовательность ДНК генов. Вместо этого они связаны с присоединением химических соединений к ДНК. (Приставка «эпи-» означает «над» или «над».) Один из основных типов эпигенетических механизмов, называемый метилированием ДНК, происходит, когда молекулы, называемые метильными группами, прикрепляются к определенным фрагментам ДНК. Это может сделать ген неактивным, препятствуя созданию белков на основе гена, путем физического блокирования ДНК и другими, менее прямыми эффектами. Метилирование также может активировать гены. Эпигенетические изменения также включают модификации гистоновых белков, вокруг которых намотаны молекулы ДНК, наряду с другими видами изменений.
Вместо этого они связаны с присоединением химических соединений к ДНК. (Приставка «эпи-» означает «над» или «над».) Один из основных типов эпигенетических механизмов, называемый метилированием ДНК, происходит, когда молекулы, называемые метильными группами, прикрепляются к определенным фрагментам ДНК. Это может сделать ген неактивным, препятствуя созданию белков на основе гена, путем физического блокирования ДНК и другими, менее прямыми эффектами. Метилирование также может активировать гены. Эпигенетические изменения также включают модификации гистоновых белков, вокруг которых намотаны молекулы ДНК, наряду с другими видами изменений.
Какие факторы внешней среды влияют на эпигенетику?
Эпигенетические изменения могут быть вызваны факторами, связанными со здоровьем, такими как диета, физические упражнения, курение или употребление наркотиков, а также ранним стрессом. Например, исследования показывают, что пренатальное воздействие голода может уменьшить метилирование гена, связанного с ростом. Различия в метилировании ДНК также были исследованы у людей, которые испытали другие формы невзгод в раннем возрасте, такие как детская травма. Такие эпигенетические различия, если они действительно вызваны тяжелым ранним опытом, потенциально могут сыграть роль в объяснении повышенной уязвимости к физическим и психическим заболеваниям.
Различия в метилировании ДНК также были исследованы у людей, которые испытали другие формы невзгод в раннем возрасте, такие как детская травма. Такие эпигенетические различия, если они действительно вызваны тяжелым ранним опытом, потенциально могут сыграть роль в объяснении повышенной уязвимости к физическим и психическим заболеваниям.
Можно ли изменить свой эпигеном?
Факторы образа жизни во взрослом возрасте, такие как физические упражнения и употребление психоактивных веществ, связаны с эпигенетическими изменениями. А эпигенетические изменения, связанные с вредным поведением, не всегда могут быть постоянными. Ученые обнаружили, например, что специфическое эпигенетическое изменение, связанное с курением, можно обратить вспять после того, как человек бросит курить. Исследования физических упражнений, психотерапии, антидепрессантов и других вмешательств показали возможность того, что они оказывают положительное влияние на самочувствие частично за счет изменения эпигенома.
Эпигенетика и психология
Все характеристики человека, в том числе психологические, в той или иной степени зависят от генетики. Поскольку эпигеном модулирует эффекты генома человека — и поскольку на него могут влиять внешние факторы — он, естественно, является основной областью исследований для тех, кто хочет понять, как формируются индивидуальные различия, психические заболевания и другие аспекты когнитивной жизни.
Поведенческие генетики и поведенческие эпигенетики — это ученые, которые исследуют, могут ли эпигенетические изменения объяснить уязвимость к определенным формам психических заболеваний. Другая возможность, которая привлекла внимание в последние годы, заключается в том, что эпигенетические изменения, возникающие в результате травматического опыта, могут передаваться от одного поколения к другому, что иногда называют межпоколенческой передачей травмы.
Как эпигенетика связана с психическими заболеваниями?
Доказательства того, что эпигенетические различия связаны с психическими заболеваниями, были обнаружены для депрессии, шизофрении, биполярного расстройства и других состояний. Например, участники исследования с депрессией показали различия — по сравнению с теми, у кого нет депрессии — в уровнях метилирования гена, ответственного за выработку белка, называемого мозговым нейротрофическим фактором, или BDNF. (BDNF играет ключевую роль в развитии нервной системы.) Остается определить, важны ли подобные эпигенетические различия для развития этих психических расстройств, но в любом случае они могут служить биомаркерами состояний.
Например, участники исследования с депрессией показали различия — по сравнению с теми, у кого нет депрессии — в уровнях метилирования гена, ответственного за выработку белка, называемого мозговым нейротрофическим фактором, или BDNF. (BDNF играет ключевую роль в развитии нервной системы.) Остается определить, важны ли подобные эпигенетические различия для развития этих психических расстройств, но в любом случае они могут служить биомаркерами состояний.
Как стресс влияет на эпигенетику?
Сильный стресс в раннем возрасте, как показывают некоторые исследования, может привести к эпигенетическим изменениям, которые способствуют длительному усилению физиологической реакции на стресс. Такой эффект может отражать механизм адаптации к угрожающей среде, основанный на раннем опыте. Но когда источник стресса, такой как жестокое обращение в раннем возрасте, не существует бесконечно, усиленная реакция на стресс может оказаться вредной в долгосрочной перспективе. (Исследования на грызунах составляют большую часть исследований ранних невзгод и эпигенетики.)
(Исследования на грызунах составляют большую часть исследований ранних невзгод и эпигенетики.)
Могут ли эпигенетические изменения, вызванные травмой, передаваться детям?
Некоторые ученые предполагают, что травма может иметь последствия для разных поколений, основываясь на эпигенетике. Предполагается, что это эпигенетическое наследие травмы проявляется через эпигенетическое воздействие материнской травмы на ребенка в утробе матери или в младенчестве, а также через наследование эпигенетических изменений родителей ребенком. Однако доказательства передачи эпигенетических изменений, связанных с травмой, от родителей к потомству все еще очень ограничены, и необходимы дальнейшие исследования, чтобы установить, происходит ли это и как это происходит.
Что такое эпигенетические часы?
Эпигенетические часы — это то, что исследователи называют измерением эпигенетических изменений, связанных со старением.



 Б. Эльконина
Б. Эльконина
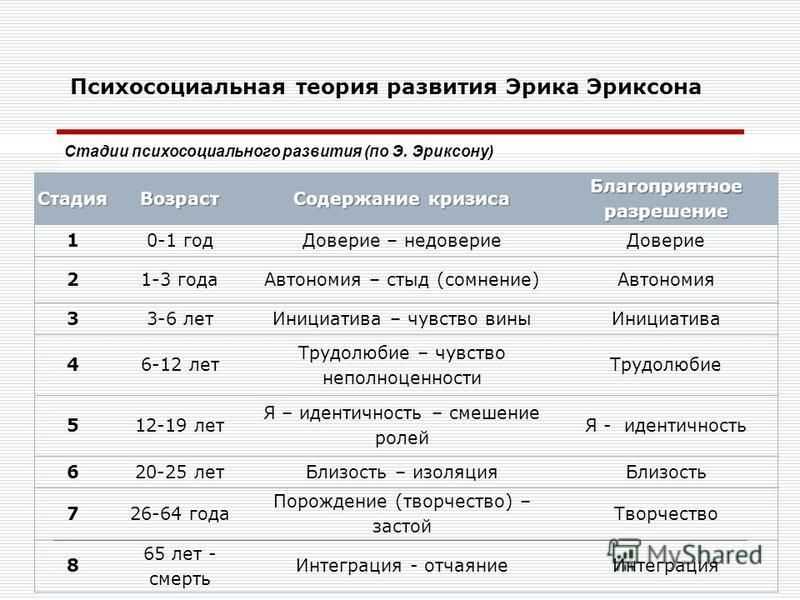 РАННЕЕ ДЕТСТВО (ОТ 1 ГОДА ДО 3 ЛЕТ)
РАННЕЕ ДЕТСТВО (ОТ 1 ГОДА ДО 3 ЛЕТ)
 2. Физиологические изменения
2. Физиологические изменения
 3. Нетрадиционные формы групповой развивающей работы
3. Нетрадиционные формы групповой развивающей работы
 В. Склярова О. Л. Янушкявичене Возрастная педагогика и психология
В. Склярова О. Л. Янушкявичене Возрастная педагогика и психология