Камптокормия: Камптокормия при болезни Паркинсона
Камптокормия при болезни Паркинсона
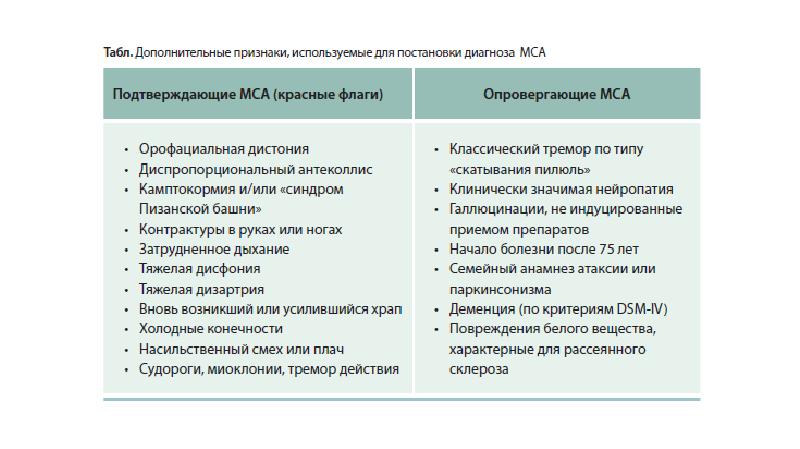
Одной из наиболее трудных проблем, с которой сталкивается врач-невролог при лечении пациентов с болезнью Паркинсона (БП), являются нарушения позы. Среди них можно выделить такие проявления, как антероколлис (синдром «свисающей головы»), наклон туловища в сторону (синдром «пизанской башни») и камптокормия (синдром «согнутой спины»), которые приводят к инвалидности пациентов и плохо поддаются противопаркинсонической терапии. Две первые формы чаще встречаются при мультисистемной атрофии, в то время как камптокормия (КК) более типична для БП [6].
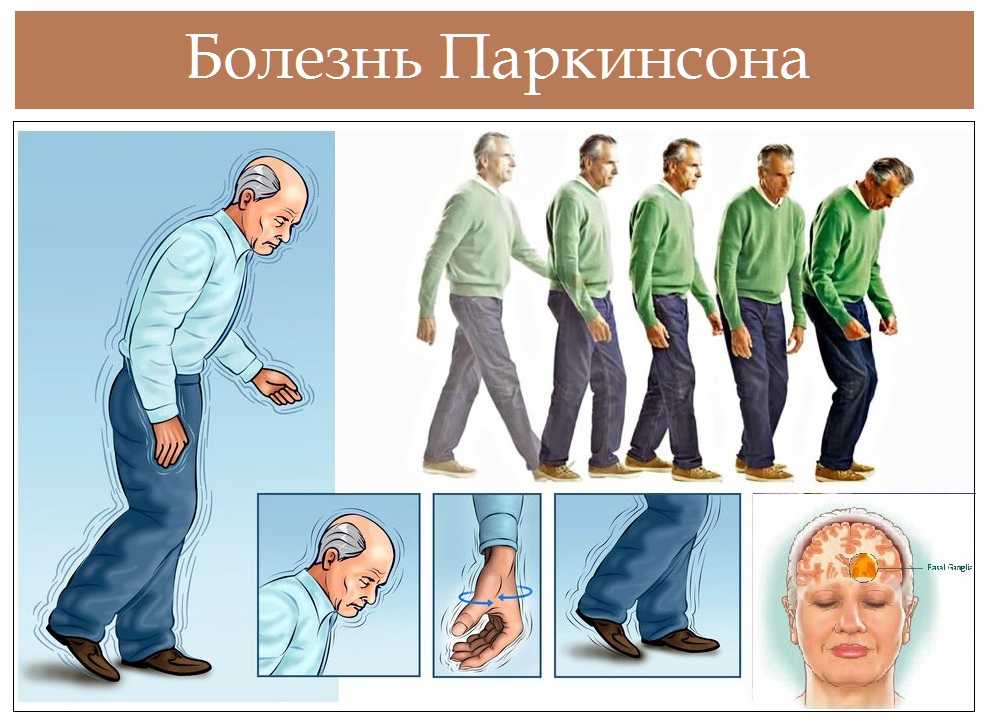
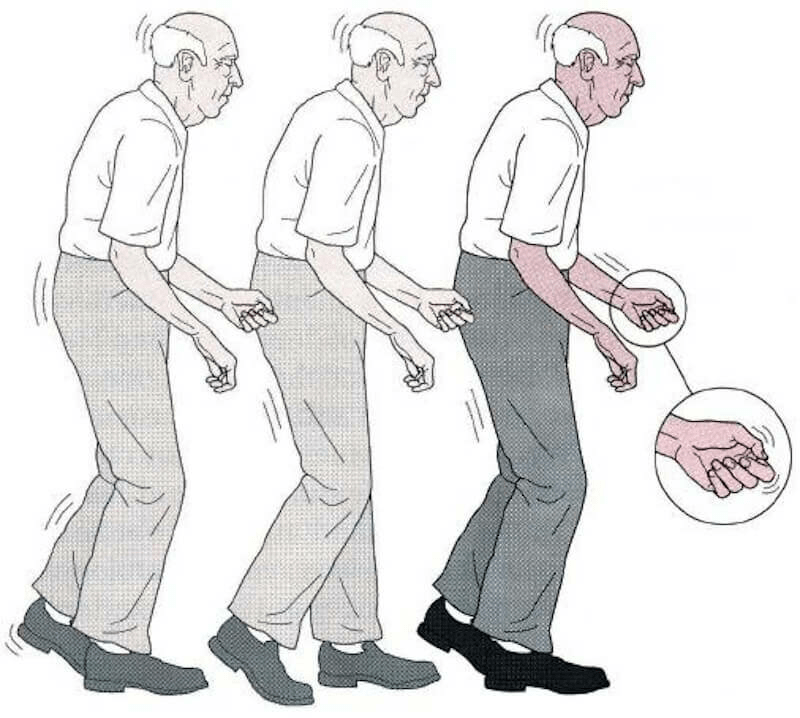
КК представляет собой непроизвольный наклон туловища вперед (сгибание в грудопоясничном отделе позвоночника), усиливающийся при длительном стоянии и ходьбе, но исчезающий или резко уменьшающийся в положении лежа [27]. Термин «камптокормия» впервые ввел в медицинскую литературу В. Brodiе в 1837 г. Это название произошло от греческих слов «согнуть» и «ствол» [13]. В 1817 г. Дж. Паркинсон в своей книге «Эссе о дрожательном параличе» отметил склонность к наклону туловища вперед как один из признаков БП [22].
В современной литературе связь КК с БП описал R. Djaldetti [13]. Первоначально КК считалась редким феноменом, но в последнее время сообщения о данном феномене стали встречаться значительно чаще [27]. Результаты современных исследований [3, 39] определяют распространенность КК среди пациентов с БП показателем от 3 до 17%.
Причины развития КК у пациентов с БП недостаточно изучены [5, 12, 15, 23, 24]. Тот факт, что проявления КК уменьшаются в горизонтальном положении, исключает дегенеративный спондилоартроз как возможную причину данного феномена [27]. Изначально КК считали крайним вариантом характерной для БП сгорбленной позы, возникающей вследствие ригидности мышц туловища [13].
Частое сочетание КК с мышечными изменениями послужило основанием к появлению гипотезы о периферическом механизме ее формирования. При этом КК, ассоциированная с БП, объясняется специфической миопатией антигравитационных мышц, выпрямляющих туловище, с субклиническим вовлечением мышц тазового и плечевого пояса [17]. Эту концепцию подтверждают клинические наблюдения (слабость паравертебральных мышц) и электрофизиологические исследования (выявление полифазных потенциалов, позитивных острых волн при ЭМГ) [26, 35].
При этом КК, ассоциированная с БП, объясняется специфической миопатией антигравитационных мышц, выпрямляющих туловище, с субклиническим вовлечением мышц тазового и плечевого пояса [17]. Эту концепцию подтверждают клинические наблюдения (слабость паравертебральных мышц) и электрофизиологические исследования (выявление полифазных потенциалов, позитивных острых волн при ЭМГ) [26, 35].
В случаях длительного течения БП с КК при морфологическом исследовании биоптата мышц обнаруживают воспалительные или другие неспецифические миопатические изменения [15, 33]. Магнитно-резонансная томография (МРТ) паравертебральных мышц также может выявлять признаки миопатии [26]. Кроме того, описаны случаи снижения тяжести КК на фоне системной терапии стероидами [43].
В ряде исследований [2, 10, 13, 36] описано возникновение или усиление КК на фоне терапии леводопой или агонистами дофаминовых рецепторов.
КК при БП обычно появляется по мере прогрессирования заболевания. По данным некоторых авторов, пациенты с КК характеризуются более старшим возрастом, большей длительностью заболевания, более выраженной степенью тяжести БП, большей продолжительностью терапии препаратами леводопы, большей суточной дозой леводопы, ранним присоединением аксиальных симптомов и более частой сопутствующей деменцией [3, 13]. Другие авторы [39], напротив, не находят корреляции между степенью сгибания туловища и возрастом, длительностью БП, стадией заболевания, а также продолжительностью лечения и дозами леводопы. В некоторых исследованиях [39] у пациентов с КК выявлены более частые случаи предшествующих хирургических вмешательств на позвоночнике (ламинэктомии по поводу грыж пояснично-крестцового отдела позвоночника и др.).
Другие авторы [39], напротив, не находят корреляции между степенью сгибания туловища и возрастом, длительностью БП, стадией заболевания, а также продолжительностью лечения и дозами леводопы. В некоторых исследованиях [39] у пациентов с КК выявлены более частые случаи предшествующих хирургических вмешательств на позвоночнике (ламинэктомии по поводу грыж пояснично-крестцового отдела позвоночника и др.).
Для клинической оценки степени выраженности КК используют гониометрическое измерение степени тораколюмбальной флексии, рассчитываемой как угол между вертикальной плоскостью и плоскостью, проходящей через край акромиона. Как правило, КК считают переднюю флексию с углом наклона более 45° [24, 39].
N. Margraf и соавт. [26] разработали шкалу, которая состоит из 5 разделов, позволяющих оценить в баллах величину угла наклона, условия возникновения, время в течение дня, когда у пациента присутствует КК, выраженность боли в спине и степень инвалидизации. В ней учитываются также длительность и течение заболевания, методы коррекции КК, наличие зависимости от приема дофаминергических средств.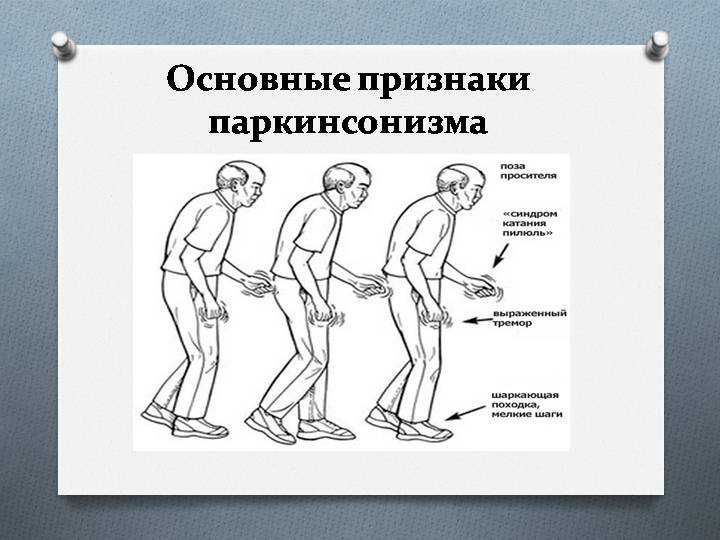
Диагноз КК ставят на основании клинических данных. МРТ головного мозга и позвоночника, электронейромиографию (ЭНМГ) и мышечную биопсию используют для исключения вторичной КК при других заболеваниях [9, 15, 26]. Для дифференциальной диагностики КК важны также определение СОЭ, С-реактивного белка, электролитов (кальций), креатинфосфокиназы (КФК), пирувата и лактата (для исключения миозитов и митохондриальной патологии) [35]. По данным ЭМГ поясничных и грудных паравертебральных мышц могут отмечаться фибрилляции, положительные острые волны и патологические разряды высокой частоты [33]. При гистологическом исследовании паравертебральных мышц при КК выявляются фиброз и наличие жировой ткани с дегенеративными волокнами [24].
Цель настоящего исследования — изучение клинических особенностей КК при БП.
Материал и методы
Исследовали 70 пациентов с БП, имевших КК. Средний возраст пациентов был 68,9±7,8 года. Стадия по Хену и Яру составила 3,4±0,7 балла; средняя продолжительность заболевания — 9,9±5,6 года.
Контрольную группу составили 20 пациентов с БП без КК. Она соответствовала основной по возрасту, полу, продолжительности заболевания и степени тяжести.
Для оценки степени тяжести БП использовалась шкала Хена и Яра в модификации Линдвалла [20]; для оценки выраженности основных симптомов БП — унифицированная шкала БП (Unifed Parkinsons Disease Rating Scale — UPDRS) [14]; для оценки постуральной неустойчивости — шкала Берга [7], шкала нарушений ходьбы и равновесия (Gait and Balance Scale) [37]; для оценки повседневной активности больных — шкала Schwab et England [31]; для оценки качества жизни больных БП — шкала PDQ-39 [29]; для оценки степени выраженности КК и степени выраженности болевого синдрома — шкала КК [26]; для оценки влияния дофаминергических препаратов на выраженность КК использовался дневник пациента [18].
Результаты и обсуждение
У пациентов с КК отмечена достоверно более низкая оценка по шкале повседневной активности Schwab and England (68,3±19,5 балла в основной группе и 72,0±15,8 балла в контрольной группе) и более низкое качество жизни (оценка по PDQ-39 — 106,0±21,3 балла в основной группе и 100,1±25,3 балла в контрольной, p<0,05). У пациентов с КК была также более выражена постуральная неустойчивость. Падения наблюдались у 29 (41,4%) пациентов. Только у 18 (25,7%) больных выявлена четкая связь появления КК с началом дофаминергической терапии. У 27 (38,6%) больных отмечалось ухудшение позы в периоде «выключения», у 8 (11,4%) пациентов — в утренние часы после ночного перерыва в приеме препаратов.
У пациентов с КК была также более выражена постуральная неустойчивость. Падения наблюдались у 29 (41,4%) пациентов. Только у 18 (25,7%) больных выявлена четкая связь появления КК с началом дофаминергической терапии. У 27 (38,6%) больных отмечалось ухудшение позы в периоде «выключения», у 8 (11,4%) пациентов — в утренние часы после ночного перерыва в приеме препаратов.
Средняя длительность КК составила 3,6±3,0 года. КК возникала преимущественно в возрасте от 61 года до 70 лет. У 55 (78,6%) больных отмечался наклон вперед, у 15 (21,4%) — сочетание наклона туловища вперед с наклоном в стороны. Тораколюмбальный угол составил в среднем 63,5±17,2°, цервико-краниальный угол — 43,2±22,5°. Болевой синдром наблюдался у 62 (88,6%) больных. У 53 (75,7%) больных отмечалась четкая связь между появлением болевого синдрома в позвоночнике и началом развития КК.
У 44 (62,9%) больных КК возникала уже в положении сидя, у 21 (30%) — сразу при приеме вертикального положения, у 2 (2,9%) — после прохождения 50 м, у 3 (4,3%) — только после значительной нагрузки в вертикальном положении. У 54 (77,1%) пациентов КК наблюдалась в течение всего дня, у 4 (5,7%) — в течение нескольких часов в дневное время, у 12 (17,1%) — только вечером. Факторами, усиливающими проявления КК, в 10% случаев были стрессовые ситуации, в 57% случаев физические нагрузки провоцировали развитие КК.
У 54 (77,1%) пациентов КК наблюдалась в течение всего дня, у 4 (5,7%) — в течение нескольких часов в дневное время, у 12 (17,1%) — только вечером. Факторами, усиливающими проявления КК, в 10% случаев были стрессовые ситуации, в 57% случаев физические нагрузки провоцировали развитие КК.
Для коррекции КК 10 (14,3%) пациентов использовали корсет; 1 (1,4%) пациенту помогало ношение заплечного рюкзака, комбинированное применение рюкзака и корсета было эффективно в 1 (1,4%) случае. Использовали при ходьбе трость 36 (37,1%) пациентов, 8 (11,4%) — были вынуждены использовать ходунки.
Были выделены 3 варианта течения КК при БП: 1. Быстропрогрессирующий тип течения — подострое начало в течение 1-4 нед и быстрое нарастание нарушения позы на протяжении нескольких месяцев (18,6%). 2. Медленно прогрессирующий тип течения — постепенное начало в течение 1-6 мес и нарастание КК на протяжении нескольких лет (65,7%). 3. Ступенчатое — медленно прогрессирующее течение с периодами ухудшения и улучшения позы (15,7%).
Таким образом, по нашим наблюдениям, большинство пациентов страдали от КК даже в положении сидя, КК наблюдалась в течение всего дня, ухудшение КК отмечалось после физической нагрузки или стресса. В большинстве случаев КК была более инвалидизирующим фактором для пациентов, чем классические двигательные симптомы БП.
Обобщая имеющийся материал, целесообразно отметить, что различные концепции патогенеза КК при БП по своему содержанию не противоречат друг другу, а скорее отражают его отдельные звенья [25]. В качестве причин развития КК при БП предполагают аксиальную дистонию или фокальную миопатию паравертебральных мышц, однако точные механизмы патогенеза изучены недостаточно. Миопатия паравертебральных мышц может формироваться вторично на фоне первичной туловищной дистонии и ригидности, отражая хроническое напряжение мышц, участвующих в компенсаторном выпрямлении туловища. Отсутствие достоверной корреляции между степенью выраженности КК и клиническими вариантами БП, эффективностью дофаминергической терапии может свидетельствовать о том, что в ее патогенезе задействованы недофаминергические механизмы [6, 16]. Косвенно о роли центральных недофаминергических путей свидетельствует уменьшение у пациентов с КК объема моста и среднего мозга по данным МРТ головного мозга [8]. Наблюдения пациентов с КК создают предпосылки рассматривать БП в качестве генетически гетерогенного заболевания.
Косвенно о роли центральных недофаминергических путей свидетельствует уменьшение у пациентов с КК объема моста и среднего мозга по данным МРТ головного мозга [8]. Наблюдения пациентов с КК создают предпосылки рассматривать БП в качестве генетически гетерогенного заболевания.
Возможности терапии КК при БП достаточно ограничены. Как правило, при ведении таких пациентов неврологам приходится сталкиваться с многочисленными трудностями, а результаты лечения часто не оправдывают ожидания [11, 39]. Лечение должно включать коррекцию противопаркинсонической терапии, отмену медикаментов, способных вызвать КК, а также хирургическую коррекцию или глубокую стимуляцию мозга [15]. В большинстве наблюдений КК при БП оказывается нечувствительной к стандартной противопаркинсонической терапии. При возникновении КК, связанной с изменениями дофаминергической терапии, целесообразна попытка коррекции медикаментозного лечения и прежде всего исключения или замены одного препарата — агониста дофаминовых рецепторов на другой. Стероиды, по данным различных авторов [26], являются эффективными лишь в редких случаях. Умеренный эффект иногда приносит клоназепам [39]. Локальные инъекции ботулинистического токсина (БТ) в подвздошную мышцу и/или прямую мышцу живота дают неоднозначные результаты [5, 40]. Чаще отмечается полное отсутствие эффекта [4, 22, 40].
Стероиды, по данным различных авторов [26], являются эффективными лишь в редких случаях. Умеренный эффект иногда приносит клоназепам [39]. Локальные инъекции ботулинистического токсина (БТ) в подвздошную мышцу и/или прямую мышцу живота дают неоднозначные результаты [5, 40]. Чаще отмечается полное отсутствие эффекта [4, 22, 40].
В отдельных случаях аномальное положение туловища улучшается при использовании заплечного рюкзака [22]. Некоторые авторы [32] предлагают использовать для облегчения КК поясничные корсеты, кожаные ортезы. В настоящее время все больше находят применение новые специальные ортезы, изготовленные по принципу торакально-тазовой передней фиксации.
Хирургическое лечение КК складывается из стабилизирующих вертебральных вмешательств, а также хронической стимуляции глубоких структур мозга [28, 33]. При операциях на позвоночнике лечение сопряжено с необходимостью длительной иммобилизации, повторными хирургическими вмешательствами, высоким риском осложнений [41, 42].
В современной литературе постепенно накапливаются данные об использовании стимуляции глубоких структур мозга, однако результаты остаются противоречивыми. Кроме того, среди исследователей пока не сложилось единого мнения относительно выбора оптимальной мишени [1, 11].
Неврология | «РМЖ» №10 от 20.05.1997
СИНДРОМ СОГНУТОГО ПОЗВОНОЧНИКА ИЗМЕНЕННОЕ КРОВОСНАБЖЕНИЕ СОСУДОВ НИЖНЕЙ КОНЕЧНОСТИ У ПАЦИЕНТОВ С ИШАЛГИЕЙ ВСЛЕДСТВИЕ ОБРАЗОВАНИЯ ГРЫЖИ МЕЖПОЗВОНОЧНЫХ ДИСКОВ
СИНДРОМ СОГНУТОГО ПОЗВОНОЧНИКА
В. Окнин
V. Oknin
Синдром согнутого позвоночника характеризуется выраженным сгибанием туловища в вертикальном положении и ограничением его разгибания. Выраженность этих симптомов уменьшается в положении лежа на спине. При компьютерной томографии выявляется снижение плотности паравертебральных мышц. Подобная поза может иметь вторичное происхождение при ряде заболеваний (см. таблицу).
таблицу).
В статье представлены результаты обследования 8 больных с синдромом согнутого позвоночника (3 женщины, 5 мужчин, все пожилые, средний возраст 60,6 года). В 2 случаях заболевание носило семейный характер. Разгибание туловища в вертикальном положении было невозможно из-за слабости параспинальных мышц. Одновременно наблюдалась умеренная экстензия в шейном отделе позвоночника. Диагноз кифоза был исключен, так как в положении лежа пассивное разгибание было нормальным. У некоторых больных сгибание туловища усугублялось при подъеме по склону, сексуальной близости. В начале заболевания отмечались преходящие боли в нижних отделах спины. Мышечный тонус, чувствительность, рефлексы не были изменены. Активность креатинфосфокиназы в сыворотке была умеренно повышена у 2 больных. При электромиографии и биопсии параспинальных мышц были найдены или неспецифические, или умеренные патологические изменения, указывающие на мышечный уровень поражения (5 больных), нейрональный уровень (1 больной). При компьютерной томографии данных мышц выявлено снижение плотности у всех больных. Контуры параспинальных мышц были нормальными, иногда сглаженными, их объем был сохранен, но сами они казались как-бы «пустыми» (лишенными субстрата). Сниженная плотность паравертебральных мышц нередко встречается при миопатиях, однако при этом никогда не наблюдается характерной согнутой позы. Суммируя данные всех больных, можно сделать заключение, что всех их объединяло 2 признака: прогрессирующая слабость паравертебральных мышц и снижение их плотности по данным компьютерной томографии.
При компьютерной томографии данных мышц выявлено снижение плотности у всех больных. Контуры параспинальных мышц были нормальными, иногда сглаженными, их объем был сохранен, но сами они казались как-бы «пустыми» (лишенными субстрата). Сниженная плотность паравертебральных мышц нередко встречается при миопатиях, однако при этом никогда не наблюдается характерной согнутой позы. Суммируя данные всех больных, можно сделать заключение, что всех их объединяло 2 признака: прогрессирующая слабость паравертебральных мышц и снижение их плотности по данным компьютерной томографии.
Вторичные формы слабости
и гипотрофии спинальных мышц
| Заболевания позвоночника: анкилозирующий спондилит Двигательные нарушения: болезнь Паркинсона спастическая кривошея торзионный спазм Нейромышечные заболевания: мyasthenia gravis конечностно-поясная миодистрофия плечелопаточно-лицевая миодистрофия боковой амиотрофический склероз (проксимальная форма) прогрессирующая спинальная атрофия дерматомиозит Метаболические заболевания: болезнь Pompe (генерализованный гликогеноз) дефицит карнитина Психические заболевания: камптокормия истерия маниакально-депрессивный психоз |
Как показали данные компьютерной томографии и магнитно-резонансной томографии, причиной согнутой позы, несомненно, является слабость параспинальных мышц. При мышечной биопсии иногда выявляется выраженный фиброз, иногда — неспецифические изменения. Являются ли эти находки результатом ранних дистрофических патологических изменений у пожилых или они вторичны по отношению к позе больного? На эти вопросы трудно ответить. Однако имеются данные, свидетельствующие в пользу поздней ограниченной аксиальной миопатии. Во-первых, вторичная параспинальная амиотрофия маловероятна, ни у кого из обследуемых не было соответствующих признаков. В некоторых случаях в начале заболевания пациенты отмечали боль в нижних отделах спины, но маловероятно, чтобы эта боль, учитывая ее частоту, являлась пусковым фактором синдрома согнутой спины. Более вероятно, что эта боль имеет механическое происхождение и обусловлена слабостью параспинальных мышц. Во-вторых, несмотря на малоубедительные данные электромиографии и мышечной биопсии, картина компьютерной томографии всегда была «миопатической», с жировой инфильтрацией мышц и сохранением их контуров. В-третьих, в случае прогрессирующего течения отмечались корреляции между мышечной слабостью, изменениями на компьютерной томографии, данными мышечной биопсии.
При мышечной биопсии иногда выявляется выраженный фиброз, иногда — неспецифические изменения. Являются ли эти находки результатом ранних дистрофических патологических изменений у пожилых или они вторичны по отношению к позе больного? На эти вопросы трудно ответить. Однако имеются данные, свидетельствующие в пользу поздней ограниченной аксиальной миопатии. Во-первых, вторичная параспинальная амиотрофия маловероятна, ни у кого из обследуемых не было соответствующих признаков. В некоторых случаях в начале заболевания пациенты отмечали боль в нижних отделах спины, но маловероятно, чтобы эта боль, учитывая ее частоту, являлась пусковым фактором синдрома согнутой спины. Более вероятно, что эта боль имеет механическое происхождение и обусловлена слабостью параспинальных мышц. Во-вторых, несмотря на малоубедительные данные электромиографии и мышечной биопсии, картина компьютерной томографии всегда была «миопатической», с жировой инфильтрацией мышц и сохранением их контуров. В-третьих, в случае прогрессирующего течения отмечались корреляции между мышечной слабостью, изменениями на компьютерной томографии, данными мышечной биопсии. И наконец, в двух случаях заболевание было наследственным.
И наконец, в двух случаях заболевание было наследственным.
Учитывая сходную клиническую картину у 8 больных, общий паттерн компьютерной томографии, авторы делают вывод, что данный синдром следует рассматривать как отдельное заболевание, проявляющееся у пожилых прогрессирующей слабостью параспинальных мышц и характерной позой.
Литература:
Serratrice G, Pouget J, Pellissier JF. Bent spine syndrome. J Neurol Neurosurg Psychiatry 1996;60:51 — 4.
ИЗМЕНЕННОЕ КРОВОСНАБЖЕНИЕ СОСУДОВ НИЖНЕЙ КОНЕЧНОСТИ У ПАЦИЕНТОВ С ИШАЛГИЕЙ ВСЛЕДСТВИЕ ОБРАЗОВАНИЯ ГРЫЖИ МЕЖПОЗВОНОЧНЫХ ДИСКОВ
J. Bender
Еще в 1969 г. было описано сочетание ишалгии и ощущения холода пораженной ноги [1]. Это ощущение объясняли вазоконстрикцией артериол кожи. Термографическое исследование давало противоречивые результаты: у некоторых пациентов, как это ни удивительно, выявляли не гипотермию, а гипертермию.
Естественно, термографические данные имеют ограниченную ценность в связи с тем, что измеряется только васкуляризация кожи, а не общая васкуляризация, основной частью которой является кровоток через мышцы.
J. Maigne и соавт. [2], сотрудники институтов Парижского университета (Франция), провели исследование с помощью внутривенного введения метилена дифосфата, меченного технецием-99.
В течение первых 90 с после инъекции этот изотоп проходит артериальную систему, а спустя 3 ч фиксируется на кости, что дает возможность провести ее сканирование. Всего с помощью этого метода было обследовано 77 пациентов, некурящих и не имеющих симптомов атеросклероза. Больные, перенесшие операцию в области поясничного отдела позвоночника или химионуклеолизис, были исключены из исследования.
Пациентов разделили на три группы. В 1-ю группу вошли 30 пациентов с ишалгией (боль доходила до колена или ниже), возникающей вследствие образования грыжи межпозвоночных дисков, что подтверждено данными компьютерной томографии (КТ) или магнитно-резонансного исследования (МРИ). У половины из них были грыжи межпозвоночных дисков L4 — L5, у остальных 15 — на уровне L5 — S1. Всех этих пациентов вначале лечили консервативно, но после изотопного исследования четверым из них была выполнена хирургическая дискэктомия. 2-ю группу составили 16 пациентов с болью в нижней части спины, односторонне иррадиирующей в верхнюю часть спины, но без грыжи межпозвоночных дисков.
У половины из них были грыжи межпозвоночных дисков L4 — L5, у остальных 15 — на уровне L5 — S1. Всех этих пациентов вначале лечили консервативно, но после изотопного исследования четверым из них была выполнена хирургическая дискэктомия. 2-ю группу составили 16 пациентов с болью в нижней части спины, односторонне иррадиирующей в верхнюю часть спины, но без грыжи межпозвоночных дисков.
3-я, контрольная, группа состояла из 31 пациента, не предъявлявших жалоб на боль в нижней части спины, ишалгию и не имевших проблем с сосудами нижних конечностей.
После внутривеннной инъекции изотопа изображение гамма-камеры фокусировали на тыльной стороне бедра со скоростью улавливания — одно изображение в секунду в течение первых 90 с. У пациентов 1-й и 2-й групп определяли разницу (в процентах) в кровотоке, измеренном в поврежденной и здоровой ноге; в 3-й группе сравнивали кровоток в правой и левой ноге. Были получены следующие результаты: в контрольной группе различия составляли в среднем 2,9%, кровоток в правой ноге был несколько больше, чем в левой. Авторы считали небольшие колебания величин — от -5,8 до +8,4% — нормальными.
Авторы считали небольшие колебания величин — от -5,8 до +8,4% — нормальными.
В 1-й группе отмечалось снижение кровотока в пораженной ноге, средняя величина снижения составила — 12,6% (от -56 до +36%), во 2-й группе среднее увеличение составляло 7%.
1-я группа значительно отличалась от 2-й и 3-й групп, в то время как последние не отличались друг от друга.
Ишалгия вследствие образования грыжи межпозвоночных дисков может сопровождаться изменением кровотока в пораженной ноге — в основном снижением, но (в меньшинстве случаев) может наблюдаться и увеличение кровотока.
Логично предположить, что это сосудистое расстройство связано с нарушением симпатической нервной системы, которая регулирует сосудистую резистентность в ногах.
Поскольку нейроны симпатической системы располагаются на участке от C8 до L2, предсталяется невозможным, чтобы такое нарушение функции было результатом прямого давления грыжи межпозвоночного диска, так как образование грыжи всегда происходило на уровне L4 — L5 или L5 — S1.
Однако авторы считают вполне возможным, что такое сдавливание ослабляет неврологические сигналы от ног вверх и таким образом влияет на симпатические центры, которые регулируют кровоток в ногах. Этот механизм может быть аналогичным описанному H. Blumberg [3] для рефлексной симпатической дистрофии.
Эту теорию хорошо подкрепляет тот факт, что рефлекс симпатической дистрофии регулярно наблюдается в случаях развивающейся ишалгии.
Литература:
1. Hakelius A, Nilsonne U, Pernow B, Zetterquist S. The cold sciatic leg. Acta Orthop Scand 1969;40:614 — 23.
2. Maigne JY, Treuil C, Chatellier G. Altered lower limb vascular perfusion in patients with sciatica secondary to disc herniation. Spine 14(21):1657 — 60.
3. BlЯmberg H, JКnig W. Clinical manifestations of reflex sympathetic dystrophy and sympathetically maintened pain. In: Wall PD, Melzack R, eds. Textbook of pain. 3rd ed. New York: Churchill Livingstone 1994;685 — 98.
Камптокормия при болезни Паркинсона: определение, эпидемиология, патогенез и методы лечения
1. Перес-Салес П. Камптокормия. Бр Дж. Психиатрия. 1990; 157: 765–7. [PubMed] [Google Scholar]
2. Wartenberg R. Camptocormia. Arch Neurol Психиатрия. 1946; 56:327. [PubMed] [Google Scholar]
3. Розен Дж. К., Фраймойер Дж. В. Обзор камптокормии и необычного случая у самки. Позвоночник. 1985; 10: 325–7. [PubMed] [Google Scholar]
4. Sandler SA. Камптокормия: функциональное состояние спины у солдат-невротиков. Arch Neurol Психиатрия. 1946;55:158–60. [PubMed] [Google Scholar]
5. Косбаб С.П. Камптокормия — редкий случай у женщин. Am J Психиатрия. 1961; 117: 839–40. [PubMed] [Google Scholar]
6. Simon RC. Случай камптокормии: конверсия в шизофренический процесс. Арх генерал психиатрия. 1964; 11: 277–81. [PubMed] [Google Scholar]
7. Лазар А., Клерман Г.Л. Камптокормия у женщин: пятилетнее исследование. Бр J Med Psychol. 1970; 43: 265–70. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
8. Djaldetti R, Mosberg-Galili R, Sroka H, et al. Камптокормия (искривление позвоночника) у больных болезнью Паркинсона – характеристика и возможный патогенез необычного явления. Мов Беспорядок. 1999;14:443–7. [PubMed] [Google Scholar]
9. Sławek J, Derejko M, Lass P. Камптокормия как форма дистонии при болезни Паркинсона. Евр Дж Нейрол. 2003; 10:107–8. [PubMed] [Google Scholar]
10. Schäbitz WR, Glatz K, Schuhan C, et al. Выраженное сгибание туловища вперед при болезни Паркинсона: очаговая миопатия параспинальных мышц, имитирующая камптокормию. Мов Беспорядок. 2003; 18: 408–14. [PubMed] [Google Scholar]
11. Holler I, Dirnberger G, Pirker W, et al. Камптокормия при идиопатической болезни Паркинсона: [(123)I]бета-ЦИТ ОФЭКТ и клинические характеристики. Евр Нейрол. 2003; 50: 118–20. [PubMed] [Академия Google]
12. Skidmore F, Mikolenko I, Weiss H, et al. Камптокормия у больного с множественной системной атрофией. Мов Беспорядок. 2005; 20:1063–4. [PubMed] [Google Scholar]
2005; 20:1063–4. [PubMed] [Google Scholar]
13. Sławek J, Derejko M, Lass P, et al. Камптокормия или Пизанский синдром при множественной системной атрофии. Клиника Нейрол Нейрохирург. 2006; 108: 699–704. [PubMed] [Google Scholar]
14. Diederich NJ, Goebel HH, Dooms G, et al. Камптокормия, ассоциированная с очаговым миозитом при мультисистемной атрофии. Мов Беспорядок. 2006; 21:390–4. [PubMed] [Академия Google]
15. Гаврилова Н., Лимузен Н., Белин Ж. и соавт. Камптокормия как симптом деменции с тельцами Леви. Клиника Нейрол Нейрохирург. 2013;115:2397–8. [PubMed] [Google Scholar]
16. Бруки С., Нитрини Р. Камптокормия при болезни Альцгеймера: связь? Мов Беспорядок. 2008; 23:156–157. [PubMed] [Google Scholar]
17. Ван Герпен Дж.А. Допа-зависимая дистоническая камптокормия. Неврология. 2006;66:1779. [PubMed] [Google Scholar]
18. Микели Ф., Пардал М.М. Допа-зависимая дистоническая камптокормия. Неврология. 2007;68:1543. [PubMed] [Академия Google]
19. Capelle HH, Schrader C, Blahak C, et al. Глубокая стимуляция мозга при камптокормии при дистонии и болезни Паркинсона. Дж Нейрол. 2011; 258:96–103. [PubMed] [Google Scholar]
Capelle HH, Schrader C, Blahak C, et al. Глубокая стимуляция мозга при камптокормии при дистонии и болезни Паркинсона. Дж Нейрол. 2011; 258:96–103. [PubMed] [Google Scholar]
20. Ван Герпен Дж.А. Камптокормия на фоне раннего бокового амиотрофического склероза. Мов Беспорядок. 2001; 16: 358–60. [PubMed] [Google Scholar]
21. Castrillo Sanz A, Rodríguez Vico J, Hernández Barral M, et al. Раннее появление камптокормии при заболевании двигательных нейронов: связь? J Clin Neuromuscul Dis. 2013;15:43–4. [PubMed] [Академия Google]
22. Kottlors M, Kress W, Meng G, et al. Фасцио-лопаточно-плечевая мышечная дистрофия с изолированной аксиальной миопатией и синдромом искривления позвоночника. Мышечный нерв. 2010;42:273–5. [PubMed] [Google Scholar]
23. Jordan B, Eger K, Koesling S, et al. Фенотип камптокормии ЛЛПД: клиническое и МРТ-исследование шести пациентов. Дж Нейрол. 2011; 258:866–73. [PubMed] [Google Scholar]
24. Papadopoulos C, Papadimas GK, Spengos K, et al.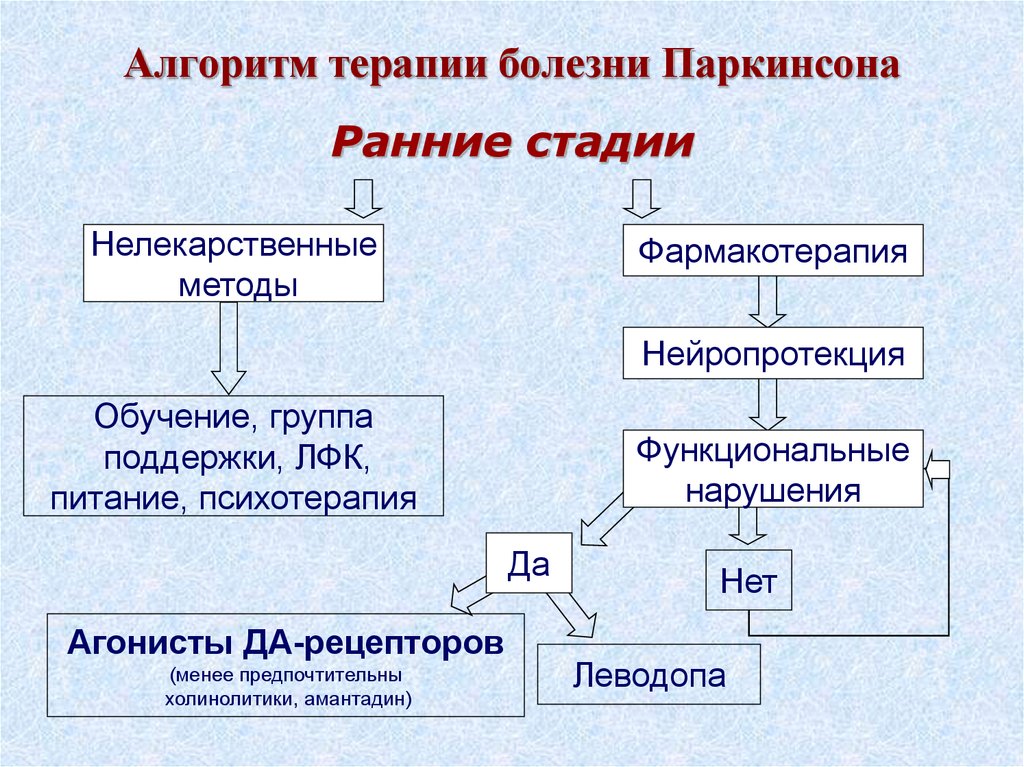 Синдром искривления позвоночника при плече-лицевой мышечной дистрофии. Мышечный нерв. 2011;43:615. [PubMed] [Академия Google]
Синдром искривления позвоночника при плече-лицевой мышечной дистрофии. Мышечный нерв. 2011;43:615. [PubMed] [Академия Google]
25. Дюпейрон А., Стобер Н., Гелис А. и соавт. Болезненная камптокормия: актуальность рукопожатия пациента. Eur Spine J. 2010; 19 (Приложение 2): S87–90. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26. Findlay AR, Lewis S, Sahenk Z, et al. Камптокормия как поздняя манифестация у манифестного носительства мышечной дистрофии Дюшенна. Мышечный нерв. 2013;47:124–7. [PubMed] [Google Scholar]
27. Kemta Lekpa F, Chevalier X, Dubourg O, et al. Изолированная камптокормия, выявляющая спорадическую немалиновую миопатию с поздним началом. Пресс Мед. 2013;42:1142–4. [PubMed] [Академия Google]
28. Renard D, Castelnovo G, Fernandez C, et al. Камптокормия как симптом миофибриллярной миопатии. Нервно-мышечное расстройство. 2012;22:987–9. [PubMed] [Google Scholar]
29. Gómez-Puerta JA, Peris P, Grau JM, et al. Камптокормия как клиническое проявление митохондриальной миопатии. Клин Ревматол. 2007; 26:1017–19. [PubMed] [Google Scholar]
Клин Ревматол. 2007; 26:1017–19. [PubMed] [Google Scholar]
30. Sakiyama Y, Okamoto Y, Higuchi I, et al. Новый фенотип митохондриального заболевания, характеризующийся семейной поздней стадией преимущественно аксиальной миопатии и энцефалопатии. Акта Нейропатол. 2011; 121:775–83. [Бесплатная статья PMC] [PubMed] [Google Scholar]
31. Zenone T, Streichenberger N, Puget M. Камптокормия как клиническое проявление полимиозита/системного склероза перекрывает миозит, связанный с анти-Ку. Ревматол Интерн. 2013;33:2411–15. [PubMed] [Google Scholar]
32. Kim JM, Song EJ, Seo JS и др. Полимиозитоподобный синдром, вызванный гипотиреозом, проявляющийся камптокормией. Ревматол Интерн. 2009; 29: 339–42. [PubMed] [Google Scholar]
33. Goodman BP, Liewluck T, Crum BA, et al. Камптокормия вследствие миозита с включениями. J Clin Neuromuscul Dis. 2012; 14:78–81. [PubMed] [Академия Google]
34. Ma H, McEvoy KM, Milone M. Спорадический миозит с включениями, проявляющийся тяжелой камптокормией. Дж. Клин Нейроски. 2013;20:1628–9. [PubMed] [Google Scholar]
Дж. Клин Нейроски. 2013;20:1628–9. [PubMed] [Google Scholar]
35. Kataoka H, Kiriyama T, Ueno S. Myasthenia gravis может вызывать камптокормию. J Neurol Нейрохирург Психиатрия. 2012; 83: 469–70. [PubMed] [Google Scholar]
36. Devic P, Choumert A, Vukusic S, et al. Миопатическая камптокормия, связанная с миастенией. Клиника Нейрол Нейрохирург. 2013; 115:1488–9. [PubMed] [Академия Google]
37. Терашима М., Катаока Х., Суги К. и др. Сосуществование хронической воспалительной демиелинизирующей полинейропатии и камптокормии. J Neurol Нейрохирург Психиатрия. 2009;80:1296–1297. [PubMed] [Google Scholar]
38. Киуру С., Ийванайнен М. Камптокормия, новый побочный эффект вальпроата натрия. Эпилепсия Рез. 1987; 1: 254–7. [PubMed] [Google Scholar]
39. Вела Л., Хименес Морон Д., Санчес С. и соавт. Камптокормия, индуцированная атипичными нейролептиками и купированная электросудорожной терапией. Мов Беспорядок. 2006;21:1977–80. [PubMed] [Google Scholar]
40. Robert F, Koenig M, Robert A, et al. Острая камптокормия, вызванная оланзапином: клинический случай. J Med Case Rep. 2010; 4:192. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Robert F, Koenig M, Robert A, et al. Острая камптокормия, вызванная оланзапином: клинический случай. J Med Case Rep. 2010; 4:192. [Бесплатная статья PMC] [PubMed] [Google Scholar]
41. Накаяма Ю., Мива Х. Камптокормия, вызванная лекарствами: урок о сосудистом паркинсонизме. Интерн Мед. 2012;51:2843–4. [PubMed] [Google Scholar]
42. Galati S, Möller JC, Städler C. Синдром Пизы, индуцированный ропиниролом, при болезни Паркинсона. Клин Нейрофармакол. 2014; 37: 58–9. [PubMed] [Google Scholar]
43. Duman I, Baklaci K, Tan AK, et al. Необычный случай камптокормии, вызванной грыжей поясничного диска. Клин Ревматол. 2008; 27: 525–7. [PubMed] [Google Scholar]
44. Ньевес А.В., Миясаки Дж.М., Ланг А.Е. Острое начало дистонической камптокормии, вызванной поражением хрусталика. Мов Беспорядок. 2001; 16: 177–80. [PubMed] [Google Scholar]
45. Jang W, Kwon HS, Kim JS, et al. Пациент с болезнью Паркинсона с камптокормией, вызванной пищеводной грыжей пищеводного отверстия диафрагмы.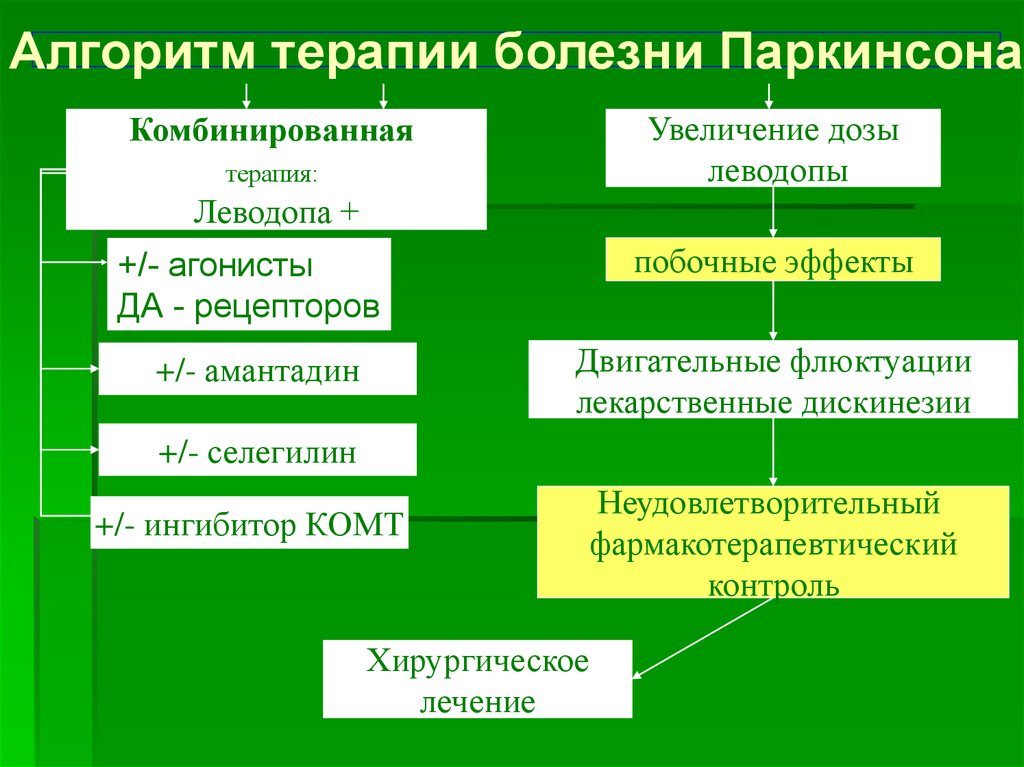 Мов Беспорядок. 2012;27:922–3. [PubMed] [Google Scholar]
Мов Беспорядок. 2012;27:922–3. [PubMed] [Google Scholar]
46. Psimaras D, Maisonobe T, Delanian S, et al. Поздняя лучевая камптокормия. Дж Нейрол. 2011; 258:1723–5. [PubMed] [Google Scholar]
47. Kelly L, Perju-Dumbrava LD, Thyagarajan D, et al. Отсроченная постлучевая камптокормия. BMJ Case Rep. 2013; 2013 doi: 10.1136/bcr-2013-200083. pii: bcr2013200083. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
48. Zwecker M, Iancu I, Zeilig G, et al. Камптокормия: случай возможной паранеопластической этиологии. Клиника реабилитации. 1998;12:157–60. [PubMed] [Google Scholar]
49. Туркмен С., Хоффманн К., Демирхан О. и соавт. Гипоплазия мозжечка с передвижением на четвероногих, вызванная мутациями в гене рецептора липопротеинов очень низкой плотности. Eur J Hum Genet. 2008;16:1070–4. [PubMed] [Google Scholar]
50. Doherty KM, van de Warrenburg BP, Peralta MC, et al. Постуральные деформации при болезни Паркинсона. Ланцет Нейрол. 2011;10:538–49.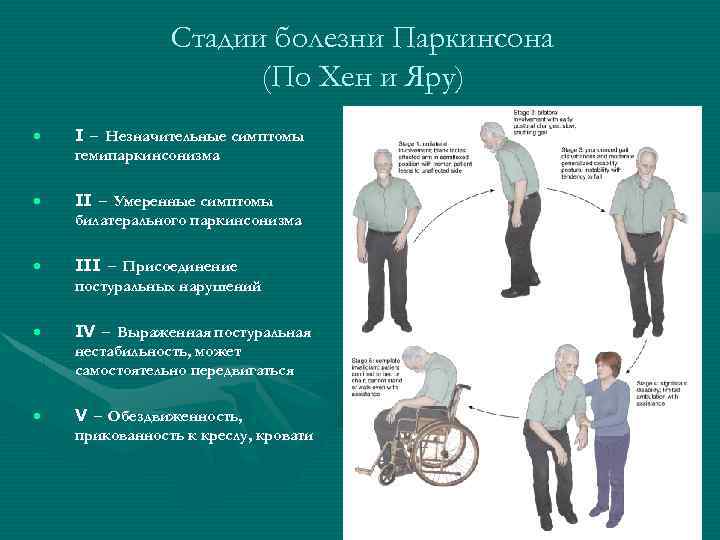 [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
51. Ашур Р., Янкович Дж. Деформации суставов и скелета при болезни Паркинсона, множественная системная атрофия и прогрессирующий надъядерный паралич. Мов Беспорядок. 2006; 21:1856–63. [PubMed] [Академия Google]
52. Tiple D, Fabbrini G, Colosimo C, et al. Камптокормия при болезни Паркинсона: эпидемиологическое и клиническое исследование. J Neurol Нейрохирург Психиатрия. 2009; 80: 145–8. [PubMed] [Google Scholar]
53. Абэ К., Учида Ю., Нотани М. Камптокормия при болезни Паркинсона. Паркинсон Дис. 2010;2010 pii: 267640. [Google Scholar]
54. Seki M, Takahashi K, Koto A, et al. Камптокормия у японских пациентов с болезнью Паркинсона: многоцентровое исследование. Мов Беспорядок. 2011;26:2567–71. [PubMed] [Академия Google]
55. Song W, Guo X, Chen K, et al. Камптокормия у китайских пациентов с болезнью Паркинсона. J Neurol Sci. 2014; 337:173–5. [PubMed] [Google Scholar]
56. Furusawa Y, Mukai Y, Kobayashi Y, et al. Роль наружной косой мышцы в верхней камптокормии у пациентов с болезнью Паркинсона. Мов Беспорядок. 2012; 27:802–3. [PubMed] [Google Scholar]
Мов Беспорядок. 2012; 27:802–3. [PubMed] [Google Scholar]
57. Laroche M, Cintas P. Синдром искривленного позвоночника (камптокормия): ретроспективное исследование 63 пациентов. Совместная кость позвоночника. 2010;77:593–6. [PubMed] [Google Scholar]
58. Ажер С.Н., Янкович Дж. Камптокормия: патогенез, классификация и ответ на терапию. Неврология. 2005; 65: 355–9. [PubMed] [Google Scholar]
59. Yoritaka A, Shimo Y, Takanashi M, et al. Моторные и немоторные симптомы у 1453 пациентов с болезнью Паркинсона: распространенность и риски. Расстройство, связанное с паркинсонизмом. 2013;19:725–31. [PubMed] [Google Scholar]
60. Lepoutre AC, Devos D, Blanchard-Dauphin A, et al. Специфическая клиническая картина камптокормии при болезни Паркинсона. J Neurol Нейрохирург Психиатрия. 2006;77:1229–34. [Бесплатная статья PMC] [PubMed] [Google Scholar]
61. Sandler SA. Камптокормия, или функциональное искривление спины. Психозом Мед. 1947; 9: 197–204. [PubMed] [Google Scholar]
62. Margraf NG, Wrede A, Rohr A, et al. Камптокормия при идиопатической болезни Паркинсона: очаговая миопатия паравертебральных мышц. Мов Беспорядок. 2010;25:542–51. [PubMed] [Google Scholar]
Margraf NG, Wrede A, Rohr A, et al. Камптокормия при идиопатической болезни Паркинсона: очаговая миопатия паравертебральных мышц. Мов Беспорядок. 2010;25:542–51. [PubMed] [Google Scholar]
63. Bloch F, Houeto JL, Tezenas du Montcel S, et al. Болезнь Паркинсона с камптокормией. J Neurol Нейрохирург Психиатрия. 2006; 77: 1223–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
64. Spuler S, Krug H, Klein C, et al. Миопатия, вызывающая камптокормию при идиопатической болезни Паркинсона: мультидисциплинарный подход. Мов Беспорядок. 2010;25:552–9. [PubMed] [Google Scholar]
65. Oh YS, Kim JS, Chung SW, et al. Камптокормия: как первый признак болезни Паркинсона. Может J Neurol Sci. 2011;38:370–2. [PubMed] [Google Scholar]
66. Marinelli P, Colosimo C, Ferrazza AM, et al. Влияние камптокормии на объемы легких при болезни Паркинсона. Респир Физиол Нейробиол. 2013; 187:164–6. [PubMed] [Академия Google]
67. Yamane K, Kimura F, Unoda K, et al. Постуральные нарушения как маркер риска тромбоза глубоких вен нижних конечностей при болезни Паркинсона. ПЛОС ОДИН. 2013;8:e66984. [PMC free article] [PubMed] [Google Scholar]
ПЛОС ОДИН. 2013;8:e66984. [PMC free article] [PubMed] [Google Scholar]
68. Jankovic J. Камптокормия, падение головы и другие синдромы искривления позвоночника: гетерогенная этиология и патогенез паркинсонических деформаций. Мов Беспорядок. 2010;25:527–528. [PubMed] [Google Scholar]
69. Ho B, Prakash R, Morgan JC, et al. Случай реагирующей на леводопу камптокормии, связанной с прогрессирующей болезнью Паркинсона. Нат Клин Практ Нейрол. 2007; 3: 526–30. [PubMed] [Академия Google]
70. Ямада К., Гото С., Мацудзаки К. и др. Облегчение камптокормии путем двусторонней стимуляции субталамических ядер у пациента с болезнью Паркинсона. Расстройство, связанное с паркинсонизмом. 2006; 12: 372–5. [PubMed] [Google Scholar]
71. Hellmann MA, Djaldetti R, Israel Z, et al. Влияние глубокой субталамической стимуляции головного мозга на камптокормию и постуральные нарушения при идиопатической болезни Паркинсона. Мов Беспорядок. 2006; 21:2008–10. [PubMed] [Google Scholar]
72. Sako W, Nishio M, Maruo T, et al. Глубокая стимуляция субталамического ядра при камптокормии, связанной с болезнью Паркинсона. Мов Беспорядок. 2009 г.;24:1076-9. [PubMed] [Google Scholar]
Sako W, Nishio M, Maruo T, et al. Глубокая стимуляция субталамического ядра при камптокормии, связанной с болезнью Паркинсона. Мов Беспорядок. 2009 г.;24:1076-9. [PubMed] [Google Scholar]
73. Umemura A, Oka Y, Ohkita K, et al. Влияние субталамической глубокой стимуляции мозга на постуральную аномалию при болезни Паркинсона. Дж Нейрохирург. 2010; 112:1283–8. [PubMed] [Google Scholar]
74. Asahi T, Taguchi Y, Hayashi N, et al. Двусторонняя субталамическая стимуляция глубокого мозга при камптокормии, связанной с болезнью Паркинсона. Стереотактная функция «Нейрохирург». 2011; 89: 173–7. [PubMed] [Google Scholar]
75. Lyons M, Boucher O, Patel N, et al. Долгосрочная польза двусторонней субталамической глубокой стимуляции мозга при камптокормии при болезни Паркинсона. Турк Нейрохирург. 2012;22:489–92. [PubMed] [Google Scholar]
76. Микели Ф., Серсозимо М.Г., Пьедимонте Ф. Камптокормия у пациента с болезнью Паркинсона: положительный эффект паллидарной глубокой стимуляции мозга. История болезни. Дж Нейрохирург. 2005; 103:1081–3. [PubMed] [Google Scholar]
История болезни. Дж Нейрохирург. 2005; 103:1081–3. [PubMed] [Google Scholar]
77. Thani NB, Bala A, Kimber TE, et al. Высокочастотная паллидарная стимуляция при камптокормии при болезни Паркинсона: клинический случай. Нейрохирургия. 2011;68:E1501–5. [PubMed] [Google Scholar]
78. Upadhyaya CD, Starr PA, Mummaneni PV. Деформация позвоночника и болезнь Паркинсона: алгоритм лечения. Нейрохирург Фокус. 2010;28:E5. [PubMed] [Академия Google]
79. Bonneville F, Bloch F, Kurys E, et al. Камптокормия и болезнь Паркинсона: МРТ. Евро Радиол. 2008;18:1710–19. [PubMed] [Google Scholar]
80. Kataoka H, Tonomura Y, Eura N, et al. Болезненные сокращения живота у пациентов с болезнью Паркинсона. Дж. Клин Нейроски. 2012;19:624–7. [PubMed] [Google Scholar]
81. Müller SV, Gläser P, Tröger M. Нарушение представления эргоцентрического пространства при цервикальной дистонии. Мов Беспорядок. 2005; 20:58–63. [PubMed] [Академия Google]
82. Reese R, Knudsen K, Falk D, et al. Моторный исход дистонической камптокормии при лечении паллидарной нейростимуляцией. Расстройство, связанное с паркинсонизмом. 2014;20:176–179. [PubMed] [Google Scholar]
Моторный исход дистонической камптокормии при лечении паллидарной нейростимуляцией. Расстройство, связанное с паркинсонизмом. 2014;20:176–179. [PubMed] [Google Scholar]
83. Эдвардс М.Дж., Талелли П., Ротвелл Дж.К. Клинические применения транскраниальной магнитной стимуляции у пациентов с двигательными нарушениями. Ланцет Нейрол. 2008; 7: 827–40. [PubMed] [Google Scholar]
84. Cohen LG, Ludlow CL, Warden M, et al. Кривые восстановления возбудимости рефлекса моргания у больных спастической дисфонией. Неврология. 1989;39:572–57. [PubMed] [Google Scholar]
85. Eekhof JL, Aramideh M, Bour LJ, et al. Кривые восстановления мигательного рефлекса при блефароспазме, спастической кривошеи и гемифациальном спазме. Мышечный нерв. 1996; 19:10–15. [PubMed] [Google Scholar]
86. Wrede A, Margraf NG, Goebel HH, et al. Миофибриллярная дезорганизация характеризует миопатию камптокормии при болезни Паркинсона. Акта Нейропатол. 2012; 123:419–32. [Бесплатная статья PMC] [PubMed] [Google Scholar]
87. Карпати Г., Карпентер С., Эйзен А.А. Экспериментальные сердцевидные поражения и немалиновые палочки: коррелятивное морфологическое и физиологическое исследование. Арх Нейрол. 1972;27:237–51. [PubMed] [Google Scholar]
Карпати Г., Карпентер С., Эйзен А.А. Экспериментальные сердцевидные поражения и немалиновые палочки: коррелятивное морфологическое и физиологическое исследование. Арх Нейрол. 1972;27:237–51. [PubMed] [Google Scholar]
88. Финстерер Дж., Стробл В. Представление, этиология, диагностика и лечение камптокормии. Евр Нейрол. 2010; 64:1–8. [PubMed] [Google Scholar]
89. Gerton BK, Theeler B, Samii A. Лечение камптокормии с помощью рюкзака. Мов Беспорядок. 2010;25:247–248. [PubMed] [Google Scholar]
90. Schroeteler FE, Fietzek UM, Ziegler K, et al. Вертикальное положение при паркинсонической камптокормии с использованием высоких ходунков с опорой на предплечья. Мов Беспорядок. 2011;26:1560–1. [PubMed] [Академия Google]
91. де Сез М.П., Крез А., де Сез М. и др. Программа ортезов и физиотерапии при камптокормии: проспективное тематическое исследование. J Rehabil Med. 2008;40:761–5. [PubMed] [Google Scholar]
92. Tomlinson CL, Patel S, Meek C, et al. Физиотерапия по сравнению с плацебо или отсутствием вмешательства при болезни Паркинсона.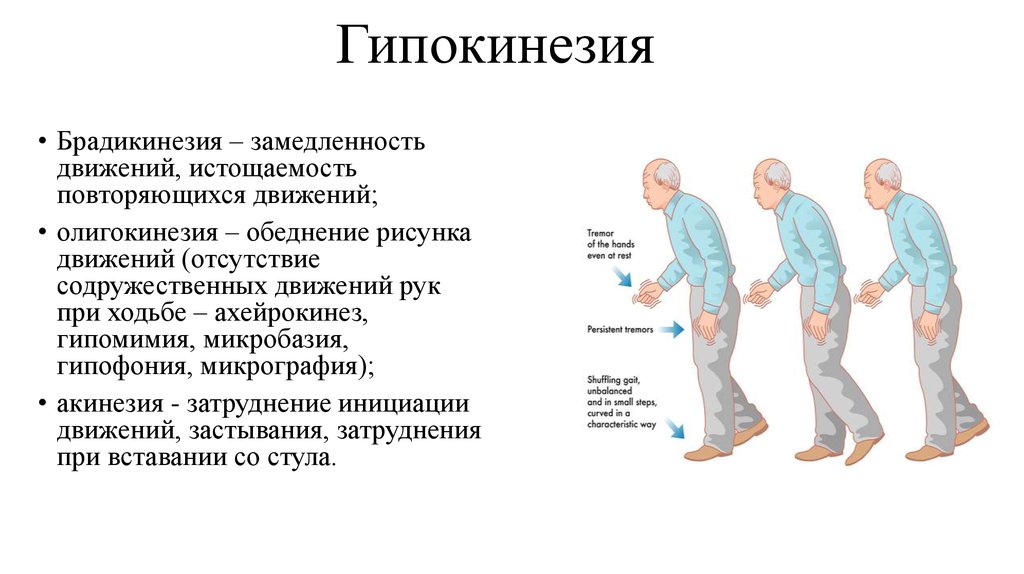 Кокрановская система базы данных, ред. 2013; 9:CD002817. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Кокрановская система базы данных, ред. 2013; 9:CD002817. [Бесплатная статья PMC] [PubMed] [Google Scholar]
93. Capecci M, Serpicelli C, Fiorentini L, et al. Постуральная реабилитация и кинезиотейпирование при осевых нарушениях осанки при болезни Паркинсона. Arch Phys Med Rehabil. 2014;95:1067–75. [PubMed] [Google Scholar]
94. Arii Y, Sawada Y, Kawamura K, et al. Непосредственный эффект спинальной магнитной стимуляции на камптокормию при болезни Паркинсона. J Neurol Нейрохирург Психиатрия. 2014;85:1221–6. [PubMed] [Google Scholar]
95. Сонг АйЮ, Ким Дж.С., Ли К.С. Допа-зависимая камптокормия у больного с множественной системной атрофией. Расстройство, связанное с паркинсонизмом. 2008; 14:161–3. [PubMed] [Google Scholar]
96. von Coelln R, Raible A, Gasser T, et al. Инъекция ботулотоксина в подвздошно-поясничную мышцу под контролем УЗИ при камптокормии. Мов Беспорядок. 2008;23:889–92. [PubMed] [Google Scholar]
97. Colosimo C, Salvatori FM. Инъекция ботулотоксина в подвздошно-поясничную мышцу при камптокормии. Мов Беспорядок. 2009; 24: 316–17. [PubMed] [Google Scholar]
Мов Беспорядок. 2009; 24: 316–17. [PubMed] [Google Scholar]
98. Fietzek UM, Schroeteler FE, Ceballos-Baumann AO. Достижение цели после лечения паркинсонической камптокормии ботулотоксином. Мов Беспорядок. 2009;24:2027–8. [PubMed] [Google Scholar]
99. Furusawa Y, Mukai Y, Kawazoe T, et al. Отдаленный эффект повторных инъекций лидокаина в наружную косую мышцу при верхней камптокормии при болезни Паркинсона. Расстройство, связанное с паркинсонизмом. 2013;19: 350–4. [PubMed] [Google Scholar]
100. Peek AC, Quinn N, Casey AT, et al. Фиксация грудопоясничного отдела позвоночника при камптокормии при болезни Паркинсона. J Neurol Нейрохирург Психиатрия. 2009;80:1275–8. [PubMed] [Google Scholar]
101. Wadia PM, Tan G, Munhoz RP, et al. Хирургическая коррекция кифоза у больных с камптокормией на фоне болезни Паркинсона: ретроспективная оценка. J Neurol Нейрохирург Психиатрия. 2011; 82: 364–8. [PubMed] [Google Scholar]
102. Schulz-Schaeffer WJ, Margraf NG, Munser S, et al. Влияние нейростимуляции на камптокормию при болезни Паркинсона зависит от длительности симптоматики. Мов Беспорядок. 2015;30:368–72. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Влияние нейростимуляции на камптокормию при болезни Паркинсона зависит от длительности симптоматики. Мов Беспорядок. 2015;30:368–72. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Презентация, этиология, диагностика и лечение камптокормии — Полный текст — Европейская неврология 2010, Vol. 64, № 1
Камптокормия (синдром искривления позвоночника, истерический кифоз) — аномалия, характеризующаяся выраженным сгибанием грудопоясничного отдела позвоночника вперед, которое обычно усиливается при ходьбе или стоянии и полностью исчезает в положении лежа. Камптокормия может быть следствием заболеваний центральной нервной системы, таких как болезнь Паркинсона, дистония, мультисистемная атрофия или болезнь Альцгеймера, вследствие заболеваний периферической нервной системы, таких как первичная миопатия, вторичная миопатия, заболевание двигательных нейронов, миастения или хроническая воспалительная демиелинизирующая полинейропатия , из-за побочных эффектов медикаментозного лечения, из-за грыжи диска, артрита или травмы позвоночника или из-за паранеоплазии. Лишь в редких случаях камптокормия может быть связана с психическим заболеванием. Диагноз ставится на основании клинических данных, визуализации головного мозга или позвоночника, игольчатой электромиографии или биопсии мышц. Варианты лечения ограничены и часто бесполезны и основаны на консервативных мерах, таких как психотерапия, физиотерапия, использование ортезов, лекарств, инъекции ботулинического токсина, отмена возбудителей, электрошоковая терапия или инвазивные меры, такие как хирургическая коррекция или глубокая стимуляция мозга. . Итог в целом справедлив. Некоторые пациенты получают пользу от терапии, в то время как другие не реагируют на лечение и постепенно становятся неподвижными.
Лишь в редких случаях камптокормия может быть связана с психическим заболеванием. Диагноз ставится на основании клинических данных, визуализации головного мозга или позвоночника, игольчатой электромиографии или биопсии мышц. Варианты лечения ограничены и часто бесполезны и основаны на консервативных мерах, таких как психотерапия, физиотерапия, использование ортезов, лекарств, инъекции ботулинического токсина, отмена возбудителей, электрошоковая терапия или инвазивные меры, такие как хирургическая коррекция или глубокая стимуляция мозга. . Итог в целом справедлив. Некоторые пациенты получают пользу от терапии, в то время как другие не реагируют на лечение и постепенно становятся неподвижными.
Введение
Камптокормия, также известная как синдром искривленного позвоночника или истерический кифоз, представляет собой серьезное инвалидизирующее, не флюктуирующее, приобретенное постуральное нарушение, обусловленное различными причинами, характеризующееся непроизвольным наклоном вперед грудопоясничного отдела позвоночника [1]. ,2]. Термин камптокормия происходит от греческих слов «камптос» (сгибаться) и «кормос» (хобот) [3]. Аномальная осанка приводит к поясничному кифозу и увеличивается или видна только тогда, когда пациент стоит или ходит [3,4]. Камптокормия чаще всего возникает из-за поражения поперечнополосатых мышц позвоночника, из-за поражения центральной нервной системы (ЦНС) или из-за некоторых редких состояний (таблица 1). Камптокормию следует отличать от синдрома Пизы (плевротонус), характеризующегося тоническим сгибанием туловища и головы в одну сторону наряду со сколиозом. Этот обзор призван обобщить и обсудить недавние результаты и перспективы на будущее, касающиеся клинических проявлений, этиологии, диагностики и лечения камптокормии.
,2]. Термин камптокормия происходит от греческих слов «камптос» (сгибаться) и «кормос» (хобот) [3]. Аномальная осанка приводит к поясничному кифозу и увеличивается или видна только тогда, когда пациент стоит или ходит [3,4]. Камптокормия чаще всего возникает из-за поражения поперечнополосатых мышц позвоночника, из-за поражения центральной нервной системы (ЦНС) или из-за некоторых редких состояний (таблица 1). Камптокормию следует отличать от синдрома Пизы (плевротонус), характеризующегося тоническим сгибанием туловища и головы в одну сторону наряду со сколиозом. Этот обзор призван обобщить и обсудить недавние результаты и перспективы на будущее, касающиеся клинических проявлений, этиологии, диагностики и лечения камптокормии.
Таблица 1
Условия, связанные с камптокормией
История
Камптокормия была впервые зарегистрирована в 17 веке испанским художником Франсиско де Сурбараном. «Функционально искривленный позвоночник» впервые описал Brodie в 1818 г. [5]. Следующее описание под термином «функционально изогнутая спина» было опубликовано тем же автором спустя 19 лет [6,7]. Термин камптокормия был впервые введен в 1914 году французскими неврологами Суке и Розановым-Салоффом, которые описали аномалию у солдат Первой мировой войны, травмированных контузией [8,9].]. Первый описанный солдат был ранен пулей, вошедшей по подмышечному краю лопатки и вышедшей около позвоночника, в результате чего туловище согнулось почти под прямым углом [9]. Для «poilu» (прозвище французского солдата Первой мировой войны) это состояние было известно как «cintrage» (боль). Мужчину «вылечили» наложением гипсовых корсетов [9]. В 1919 г. еще два случая были описаны Roussy и Lhermitte [10]. Первым был пехотинец, подброшенный в воздух разорвавшимся снарядом, который испытал сильную боль и после прихода в сознание остался сутулым вправо [10]. Его также вылечили гипсовым корсетом. Второй случай был у «егеря», который испытал респираторный дистресс, мутизм и камптокормию после того, как его похоронили во время взрыва.
[5]. Следующее описание под термином «функционально изогнутая спина» было опубликовано тем же автором спустя 19 лет [6,7]. Термин камптокормия был впервые введен в 1914 году французскими неврологами Суке и Розановым-Салоффом, которые описали аномалию у солдат Первой мировой войны, травмированных контузией [8,9].]. Первый описанный солдат был ранен пулей, вошедшей по подмышечному краю лопатки и вышедшей около позвоночника, в результате чего туловище согнулось почти под прямым углом [9]. Для «poilu» (прозвище французского солдата Первой мировой войны) это состояние было известно как «cintrage» (боль). Мужчину «вылечили» наложением гипсовых корсетов [9]. В 1919 г. еще два случая были описаны Roussy и Lhermitte [10]. Первым был пехотинец, подброшенный в воздух разорвавшимся снарядом, который испытал сильную боль и после прихода в сознание остался сутулым вправо [10]. Его также вылечили гипсовым корсетом. Второй случай был у «егеря», который испытал респираторный дистресс, мутизм и камптокормию после того, как его похоронили во время взрыва. Он выздоровел после одного сеанса электролечения [10]. Хотя эти случаи были классифицированы как истерические, одна только травматическая травма может в достаточной степени объяснить камптокормию [11]. Связь между камптокормией и болезнью Паркинсона была впервые описана Djaldetti et al. [12] в 1999. Камптокормия, обусловленная генетическим заболеванием, впервые описана у больного миотонической дистрофией 2 типа, несущего мутацию гена ZNF9 [13]. О первом пациенте с мультисистемной атрофией (МСА) и камптокормией сообщил Reichel et al. [14] в 2001 г.
Он выздоровел после одного сеанса электролечения [10]. Хотя эти случаи были классифицированы как истерические, одна только травматическая травма может в достаточной степени объяснить камптокормию [11]. Связь между камптокормией и болезнью Паркинсона была впервые описана Djaldetti et al. [12] в 1999. Камптокормия, обусловленная генетическим заболеванием, впервые описана у больного миотонической дистрофией 2 типа, несущего мутацию гена ZNF9 [13]. О первом пациенте с мультисистемной атрофией (МСА) и камптокормией сообщил Reichel et al. [14] в 2001 г.
Частота
Данных о частоте камптокормии немного. В одноцентровом эпидемиологическом исследовании 275 последовательных амбулаторных пациентов с болезнью Паркинсона распространенность камптокормии составила 6,9% [15]. Возникновение камптокормии в этом исследовании было связано с тяжестью болезни Паркинсона [15].
Клиническая картина
Камптокормия клинически характеризуется чрезмерным непроизвольным сгибанием туловища из-за прогрессирующей слабости мышц-разгибателей позвонков [16].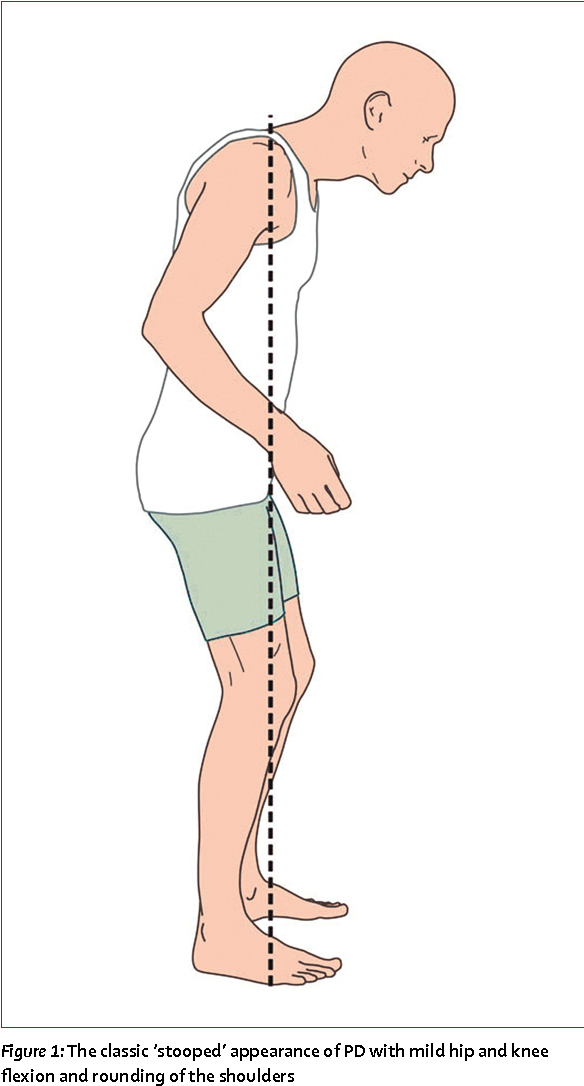 Камптокормия усиливается при стоянии и ходьбе [17] и уменьшается в положении лежа или на спине [18,19,20]. В целом ряде случаев камптокормия связана с болью в пояснице [1, 3, 7, 21, 22, 23, 24], но в других случаях она безболезненна [19]. Камптокормия может быть связана с сопутствующей слабостью большой ягодичной мышцы и бедра и коленным сгибанием [3]. Камптокормия связана с синдромом висячей головы только в единичных случаях [25,26], например, у пациентов с миотонической дистрофией 1 типа [16], МСА или постэнцефалитным синдромом Паркинсона [26]. Почти все пациенты с камптокормией имеют спондилоартроз, что делает его фактором риска развития камптокормии [27]. В исследовании 16 пациентов средний возраст начала камптокормии составил 65 лет, а средний возраст появления неврологических нарушений — 52 года [28]. Почти 69% пациентов имели болезнь Паркинсона, 25% — дистонию и один синдром Жиля де ла Туретта [28]. Семейный анамнез может быть положительным в отношении заболевания мышц в 50% случаев [23].
Камптокормия усиливается при стоянии и ходьбе [17] и уменьшается в положении лежа или на спине [18,19,20]. В целом ряде случаев камптокормия связана с болью в пояснице [1, 3, 7, 21, 22, 23, 24], но в других случаях она безболезненна [19]. Камптокормия может быть связана с сопутствующей слабостью большой ягодичной мышцы и бедра и коленным сгибанием [3]. Камптокормия связана с синдромом висячей головы только в единичных случаях [25,26], например, у пациентов с миотонической дистрофией 1 типа [16], МСА или постэнцефалитным синдромом Паркинсона [26]. Почти все пациенты с камптокормией имеют спондилоартроз, что делает его фактором риска развития камптокормии [27]. В исследовании 16 пациентов средний возраст начала камптокормии составил 65 лет, а средний возраст появления неврологических нарушений — 52 года [28]. Почти 69% пациентов имели болезнь Паркинсона, 25% — дистонию и один синдром Жиля де ла Туретта [28]. Семейный анамнез может быть положительным в отношении заболевания мышц в 50% случаев [23].
Этиология
Для объяснения этиологии и патомеханизмов, лежащих в основе камптокормии, возникли две точки зрения. Первая рассматривает камптокормию как расстройство ЦНС, приводящее к фокальной дистонии позвоночника [27]. Согласно этой гипотезе, структурой ЦНС, которая должна быть поражена, является полосатое тело и его проекции на ретикулоспинальный тракт или таламус [27]. Аргументами в пользу этой гипотезы являются положительное влияние глубокой стимуляции мозга на камптокормию в единичных случаях [27] и уменьшение объема среднего мозга и моста у пациентов с болезнью Паркинсона и камптокормией. Вторая гипотеза связывает камптокормию с поражением периферической нервной системы (ПНС), в частности с миопатией антигравитационных мышц, связанной с разгибанием туловища [27]. Эта гипотеза подтверждается миопатическими электромиографиями (ЭМГ), гиподенсивностью на МРТ мышц, миопатическими изменениями при биопсии мышц и случайным улучшением на фоне приема стероидов [27]. Камптокормия чаще всего возникает из-за органических заболеваний и лишь изредка является проявлением психического расстройства [28,29]. ].
].
Органические расстройства
Расстройства ЦНС
Расстройство ЦНС, наиболее часто сообщаемое в связи с камптокормией, — это болезнь Паркинсона [1,12]. Клинические особенности камптокормии при болезни Паркинсона включают пожилой возраст, преимущественно мужской пол, большую продолжительность заболевания и раннее вовлечение аксиальной оси [3]. Камптокормия обычно развивается после появления симптомов Паркинсона. Лишь в единичных случаях камптокормия может быть начальным проявлением болезни Паркинсона [30]. Камптокормия при болезни Паркинсона начинает развиваться в возрасте от 60 до 70 лет [3], а латентный период, с которым возникает камптокормия после начала болезни Паркинсона, составляет 5–10 лет [1,31]. Камптокормия чаще всего обнаруживается у пациентов с более тяжелой болезнью Паркинсона. Камптокормия при болезни Паркинсона связана либо с ЦНС, либо с ПНС. Аргументы в пользу ЦНС-причины заключаются в том, что камптокормия возникает вместе с расстройствами ЦНС, что тяжесть камптокормии при болезни Паркинсона связана с уменьшением объема среднего мозга и моста [32], что у половины пациентов с паркинсонизмом с камптокормией развивается синдром беспокойных ног [32], что у больных паркинсонизмом с камптокормией наблюдается повышенная мышечная активность при полисомнографии, что свидетельствует о поражении центральной регуляции движений во время сна [32], что паркинсонизм у больных камптокормией часто сочетается с дистонией [28], что могут быть дополнительные, не дисфункцию дофаминергических нейронов в базальных ганглиях или стволе головного мозга у пациентов с паркинсонизмом с камптокормией [3], а также то, что некоторые пациенты с камптокормией реагируют на глубокую стимуляцию мозга.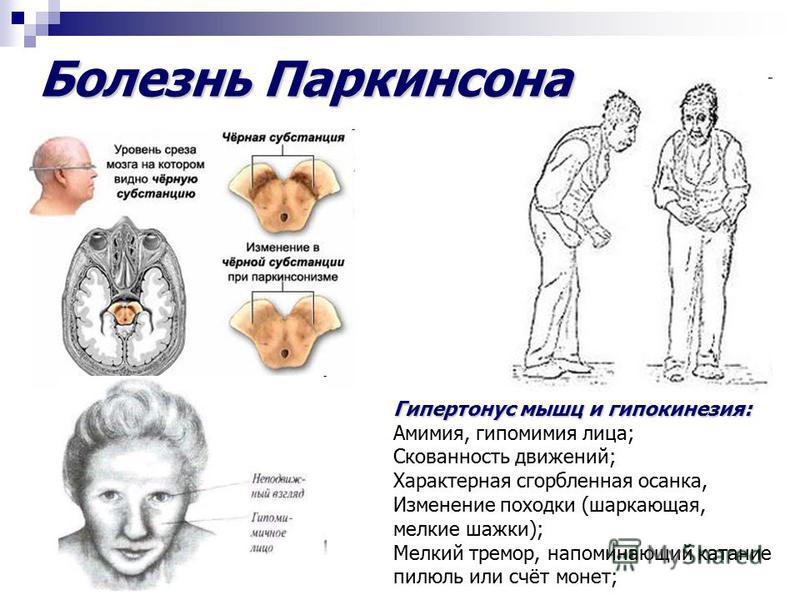 Аргументы в пользу ПНС происхождения камптокормии при болезни Паркинсона заключаются в том, что аксиальные мышцы могут проявлять миопатические признаки на ЭМГ или биопсии мышц [1] и что МРТ аксиальных мышц может показать атрофию и жировое замещение грудопоясничных мышц [33]. Нарушения ЦНС, связанные с камптокормией, в дополнение к болезни Паркинсона включают MSA [2,34,35], болезнь Альцгеймера [36], нарушения базальных ганглиев [14] и абдоминальную сегментарную дистонию [37]. Из-за частой ассоциации камптокормии с болезнью Паркинсона [3,19] или дистонии [28], некоторые авторы относят камптокормию даже к сегментарной форме дистонии [14,38].
Аргументы в пользу ПНС происхождения камптокормии при болезни Паркинсона заключаются в том, что аксиальные мышцы могут проявлять миопатические признаки на ЭМГ или биопсии мышц [1] и что МРТ аксиальных мышц может показать атрофию и жировое замещение грудопоясничных мышц [33]. Нарушения ЦНС, связанные с камптокормией, в дополнение к болезни Паркинсона включают MSA [2,34,35], болезнь Альцгеймера [36], нарушения базальных ганглиев [14] и абдоминальную сегментарную дистонию [37]. Из-за частой ассоциации камптокормии с болезнью Паркинсона [3,19] или дистонии [28], некоторые авторы относят камптокормию даже к сегментарной форме дистонии [14,38].
Нарушения ПНС
Состояния ПНС, связанные с камптокормией, включают первичные миопатии, такие как миотоническая дистрофия типа 1 [16,21] и типа 2 [39], дисферлинопатия [24], немалиновая миопатия [20], аксиальная миопатия [7,40 ,41], или митохондриальной миопатии (таблица 1) [42]. Вторичные миопатии с камптокормией включают гипотиреоидную миопатию [43], дерматомиозит, полимиозит [43,44], фокальный или сегментарный миозит [33,45,46], миозит с включениями [3] или тяжелую миастению (таблица 1) [47].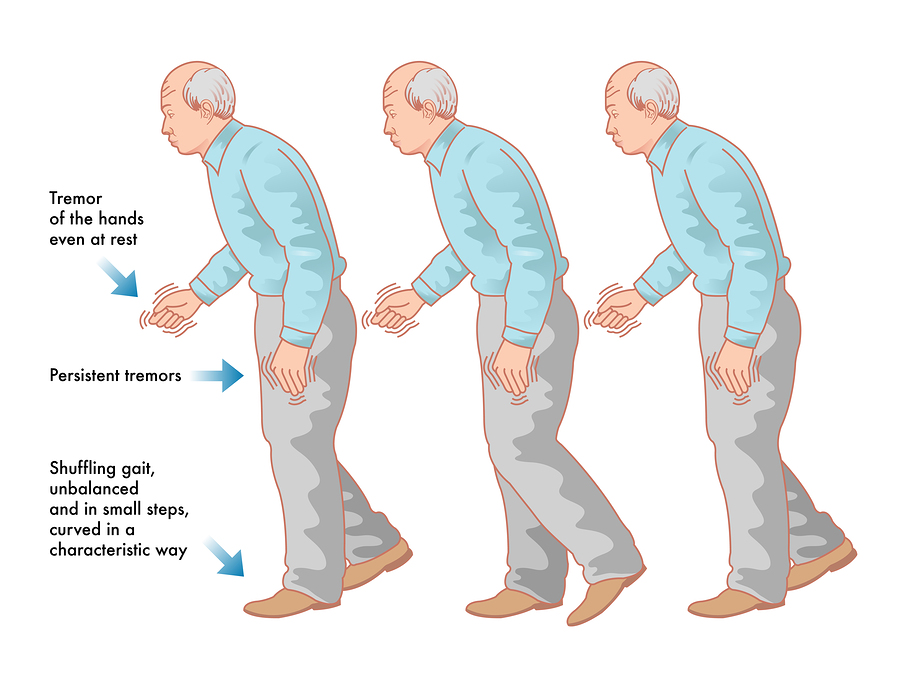 Часто наблюдаемые миопатические аномалии на ЭМГ или биопсии мышц у пациентов с паркинсонизмом с камптокормией объясняются скорее хроническими сокращениями антигравитационных мышц, участвующих в компенсаторном разгибании туловища, чем первичной миопатией [48]. Однако, почему гиперактивная мышца развивает миопатические изменения, остается спекулятивным. Из-за частой ассоциации камптокормии с миопатией некоторые авторы обычно рассматривают камптокормию как первичную опоясывающую миопатию с субклиническим поражением мышц таза и плечевого пояса [49].].
Часто наблюдаемые миопатические аномалии на ЭМГ или биопсии мышц у пациентов с паркинсонизмом с камптокормией объясняются скорее хроническими сокращениями антигравитационных мышц, участвующих в компенсаторном разгибании туловища, чем первичной миопатией [48]. Однако, почему гиперактивная мышца развивает миопатические изменения, остается спекулятивным. Из-за частой ассоциации камптокормии с миопатией некоторые авторы обычно рассматривают камптокормию как первичную опоясывающую миопатию с субклиническим поражением мышц таза и плечевого пояса [49].].
Нарушения ПНС, кроме миопатии, связанной с камптокормией, включают боковой амиотрофический склероз [50], хроническую воспалительную демиелинизирующую полинейропатию [51] или поясничную грыжу диска [52]. К настоящему времени обнаружены мутации у пациентов с камптокормией: ген RYR1 при аксиальной миопатии [53], ген DMPK при миотонической дистрофии 1 [16,21], ZFP9 при миотонической дистрофии 2 типа [39], ген дисферлина при дисферлинопатии и ген паркина. ген при болезни Паркинсона [54].
ген при болезни Паркинсона [54].
Наркотики
Редкими причинами камптокормии являются побочные эффекты терапевтических препаратов. Среди них наибольшее значение имеют нейролептические и противопаркинсонические препараты (таблица 1). Среди нейролептиков камптокормию чаще всего вызывал оланзапин [55]. L -ДОФА индуцировал или усугублял камптокормию в единичных случаях [12], но также может иметь положительный эффект в случаях, когда она вызвана болезнью Паркинсона [19, 56] или MSA (см. ниже). У одного пациента камптокормия была вызвана донепезилом [57]. У нескольких пациентов камптокормия была вызвана передозировкой вальпроевой кислоты [58]. Имеются также сведения о том, что системные кортикостероиды могут вызывать камптокормию [перс. общ.]. Если эти препараты отменяются, камптокормия может улучшиться.
Разное
У отдельных пациентов камптокормия была связана с травмой [59, 60], артритом [60] или злокачественными новообразованиями (таблица 1) [61]. В последнем случае камптокормия интерпретировалась как проявление паранеопластического синдрома.
Психические расстройства
Хотя камптокормия первоначально описывалась как конверсионное расстройство у военнослужащих [29,62,63], психогенная камптокормия встречается редко [29,64]. В частности, в раннем описании аномалии она интерпретировалась как форма истерии, возникающая у лиц с низкой самооценкой и путаницей идентичности, садомазохистским поведением по отношению к военным властям и импотенцией [11]. Камптокормия также была описана в связи с синдромом Жиля де ла Туретта [28], маниакально-депрессивным расстройством [65] или психогенным состоянием [29].].
Диагностика
Поскольку этиология камптокормии весьма неоднородна, в начале диагностической работы необходимо проводить исследования в разных направлениях. Как правило, диагноз может быть установлен на основании клинических данных, биохимических исследований крови, визуализации головного мозга, ЭМГ или биопсии мышц.
Биология
Существует ряд химических параметров крови, которые полезны при диагностике камптокормии. Среди них скорость оседания крови, С-реактивный белок, электролиты, такие как кальций и фосфор, креатинкиназа, альдолаза или витамин D. Для диагностики метаболических миопатий определение лактата и пирувата во время стандартизированных упражнений может быть дополнительной помощью. .
Среди них скорость оседания крови, С-реактивный белок, электролиты, такие как кальций и фосфор, креатинкиназа, альдолаза или витамин D. Для диагностики метаболических миопатий определение лактата и пирувата во время стандартизированных упражнений может быть дополнительной помощью. .
Визуализация
КТ головного мозга может показать атрофию, кальцификацию базальных ганглиев, лакуны базальных ганглиев, чечевицеобразные поражения или уменьшение объема среднего мозга или моста [32]. МРТ черепа может показать аномалии сигнала базальных ганглиев у небольшого числа пациентов с камптокормией и болезнью Паркинсона [22]. МРТ позвоночных мышц может показать признаки ограниченной миопатии, такие как различная степень атрофии и жирового замещения грудопоясничных параспинальных мышц [66]. Эти изменения аналогичны наблюдаемым при мышечной дистрофии [67]. Локализованные изменения от отека с усилением контраста считаются ранним признаком, тогда как атрофия или жировая дистрофия считаются поздними изменениями [1,3,68]. Некоторые авторы трактуют эти изменения скорее как вторичные, чем как причину камптокормии [52]. КТ спинных мышц может показать атрофию и гиподенсивность мышц, что интерпретируется как жировая инволюция [69].].
Некоторые авторы трактуют эти изменения скорее как вторичные, чем как причину камптокормии [52]. КТ спинных мышц может показать атрофию и гиподенсивность мышц, что интерпретируется как жировая инволюция [69].].
Игольчатая электромиография
В зависимости от основной причины ЭМГ может быть нормальной, нейрогенной или миогенной. Миогенный паттерн может быть зарегистрирован даже у пациентов с болезнью Паркинсона [1]. Игольчатая ЭМГ паравертебральных мышц также может выявить обильные фибрилляции, положительные острые волны или причудливые высокочастотные разряды [33].
Мышечная биопсия
Мышечная биопсия может быть нормальной или может показать легкие миопатические признаки, признаки воспаления, предполагающие фокальную воспалительную миопатию (очаговый миозит), или дистрофические признаки [67]. Также может быть обширный диффузный или дольчатый фиброз как единственный вариант обнаружения у пациентов с камптокормией по сравнению с контрольной группой [68]. Мышечная биопсия у пациентов с болезнью Паркинсона с камптокормией может быть разделена на три группы: некротическая миопатия, воспалительная миопатия или митохондриальная миопатия [70]. Миопатические изменения у пациентов с болезнью Паркинсона включают аномальное изменение размера волокон, увеличение внутренних ядер, увеличение соединительной ткани или беспорядок миофибрилл или жировую дистрофию [1,31]. У пациентов с прогрессирующей болезнью Паркинсона и камптокормией биопсия мышц может выявить терминальную миопатию с аутофагическими вакуолями, хроническую воспалительную миопатию, неспецифические миопатические изменения или митохондриальную миопатию [33]. В единичных случаях также могут наблюдаться отложения амилоида и рваные красные волокна [перс. общ.].
Мышечная биопсия у пациентов с болезнью Паркинсона с камптокормией может быть разделена на три группы: некротическая миопатия, воспалительная миопатия или митохондриальная миопатия [70]. Миопатические изменения у пациентов с болезнью Паркинсона включают аномальное изменение размера волокон, увеличение внутренних ядер, увеличение соединительной ткани или беспорядок миофибрилл или жировую дистрофию [1,31]. У пациентов с прогрессирующей болезнью Паркинсона и камптокормией биопсия мышц может выявить терминальную миопатию с аутофагическими вакуолями, хроническую воспалительную миопатию, неспецифические миопатические изменения или митохондриальную миопатию [33]. В единичных случаях также могут наблюдаться отложения амилоида и рваные красные волокна [перс. общ.].
Анализ походки
Кинематический, кинетический и биомеханический анализы могут выявить преувеличенный наклон таза вперед во время конечного положения при ходьбе в вертикальном положении. Однако в позе с наклоном вперед наклон таза вперед может быть значительно меньше [71]. Некоторые авторы предполагают, что поза с экстремальным наклоном вперед является компенсаторным механизмом для уменьшения чрезмерного наклона таза [71].
Некоторые авторы предполагают, что поза с экстремальным наклоном вперед является компенсаторным механизмом для уменьшения чрезмерного наклона таза [71].
Лечение
Варианты лечения камптокормии ограничены и часто бесполезны [72]. Как правило, варианты лечения можно классифицировать как консервативные или инвазивные (таблица 2). Консервативные меры включают психотерапию, физиотерапию, применение лекарств, введение ботулотоксина, отмену препаратов, вызывающих заболевание, или электрошоковую терапию. К инвазивным лечебным мероприятиям относятся хирургические методы или глубокая стимуляция головного мозга. Лечением выбора является терапия основного заболевания, а в случае отсутствия средств, модифицирующих заболевание, единственным выбором являются ортезы, физиотерапия и, в конечном итоге, анальгетики [4].
Таблица 2
Лечение камптокормии
Психотерапия
Существует ряд психотерапевтических методик, которые можно применять к пациентам с камптокормией психогенного происхождения. К ним относятся психообразование в отношении вторичной выгоды, предложения по улучшению осанки, положительное подкрепление или поведенческая терапия [56]. Убеждающее перевоспитание особенно применялось в случаях Первой мировой войны, но эта психологическая терапия была скорее аддитивной, чем убеждающей [11].
К ним относятся психообразование в отношении вторичной выгоды, предложения по улучшению осанки, положительное подкрепление или поведенческая терапия [56]. Убеждающее перевоспитание особенно применялось в случаях Первой мировой войны, но эта психологическая терапия была скорее аддитивной, чем убеждающей [11].
Физиотерапия, ортезы
Классические ортезы и физиотерапия часто малоэффективны, часто плохо переносятся [4] и от них быстро отказываются [73]. Однако применение переднеторакотазового дистракционного ортеза приводит к повышению качества жизни на 90% [4]. В единичных случаях физиотерапия и ортезы могут облегчить боль в пояснице [7].
L -ДОФА
В большинстве случаев при прогрессирующей болезни Паркинсона камптокормия L -ДОФА-устойчивый [1,74]. Однако в единичных случаях камптокормии, связанной с болезнью Паркинсона, дистонией или MSA, было показано, что введение L -ДОФА приносит пользу [62,74,75]. В зависимости от исследуемой когорты до 20% больных паркинсонизмом с камптокормией получают пользу от терапии L -ДОФА [3]. У больного МСА с преобладанием паркинсонизма камптокормия и болезнь Паркинсона заметно улучшились на фоне л -ДОФА [74]. У больного с болезнью Паркинсона коррекция дофаминергической терапии карбидопой-леводопой и энтакарпоном привела не только к улучшению течения болезни Паркинсона, но и камптокормии [76].
У больного МСА с преобладанием паркинсонизма камптокормия и болезнь Паркинсона заметно улучшились на фоне л -ДОФА [74]. У больного с болезнью Паркинсона коррекция дофаминергической терапии карбидопой-леводопой и энтакарпоном привела не только к улучшению течения болезни Паркинсона, но и камптокормии [76].
Иммуноглобулины
Опубликовано мало данных, демонстрирующих положительный эффект иммуноглобулинов (ВВИГ) при камптокормии [25]. 81-летний мужчина с подтвержденной воспалительной миопатией параспинальных мышц испытал резкое улучшение на фоне лечения ВВИГ [25]. ВВИГ эффективны только в случаях воспалительной миопатии.
Ботулотоксин
Было показано, что инъекции ботулотоксина в прямые мышцы живота эффективны в единичных случаях, когда камптокормия была вызвана фокальной дистонией [28,38]. Инъекции ботулинического токсина в подвздошно-поясничные мышцы также могут уменьшить камптокормию [34]. Однако у других пациентов с паркинсон-ассоциированной камптокормией введение ботулинического токсина в подвздошно-поясничную мышцу оказалось неэффективным [72]. Ботулинический токсин может быть эффективен не только у пациентов с фокальной дистонией, но и у пациентов с болезнью Паркинсона [77].
Ботулинический токсин может быть эффективен не только у пациентов с фокальной дистонией, но и у пациентов с болезнью Паркинсона [77].
Электросудорожная терапия
У одного пациента с камптокормией, вызванной оланзапином, отмена препарата и применение L -ДОФА вряд ли были эффективными, но успешно применялась электросудорожная терапия [61].
Разное
Пациенты с лекарственной камптокормией обычно реагируют на отмену нейролептиков или снижение суточных доз. В единичных случаях воспалительной миопатии параспинальных мышц может помочь назначение стероидов [27]. Стероиды для лечения камптокормии при болезни Паркинсона, напротив, не показали положительного эффекта [17]. Применение антихолинергических средств, амантадина, агонистов дофамина, миорелаксантов или тетрабеназина обычно малоэффективно [52].
Глубокая стимуляция мозга
В единичных случаях, когда камптокормия связана с болезнью Паркинсона или сегментарной дистонией, двусторонняя паллидная высокочастотная стимуляция глубокого мозга [62,78,79] или двусторонняя стимуляция субталамического ядра [80,81] могут иметь полезный эффект. Терапевтический эффект глубокой стимуляции мозга свидетельствует о том, что, по крайней мере, в единичных случаях камптокормия действительно является заболеванием ЦНС, обусловленным поражением полосатого тела, его ретикулоспинальной и таламической проекций [27]. У пациента с хронической инвалидизирующей болезнью Паркинсона камптокормия резко улучшилась после двусторонней субталамической глубокой стимуляции мозга [79].]. Для паллидной стимуляции электроды для глубокой стимуляции головного мозга стереотаксически имплантируют во внутренний бледный шар [82]. Длительная паллидарная стимуляция приводит к значительному функциональному улучшению при отсутствии каких-либо побочных эффектов, связанных с лечением [82].
Терапевтический эффект глубокой стимуляции мозга свидетельствует о том, что, по крайней мере, в единичных случаях камптокормия действительно является заболеванием ЦНС, обусловленным поражением полосатого тела, его ретикулоспинальной и таламической проекций [27]. У пациента с хронической инвалидизирующей болезнью Паркинсона камптокормия резко улучшилась после двусторонней субталамической глубокой стимуляции мозга [79].]. Для паллидной стимуляции электроды для глубокой стимуляции головного мозга стереотаксически имплантируют во внутренний бледный шар [82]. Длительная паллидарная стимуляция приводит к значительному функциональному улучшению при отсутствии каких-либо побочных эффектов, связанных с лечением [82].
Хирургия
В случаях, когда консервативные меры неэффективны, пациентам может помочь задняя грудопоясничная фиксация, которую может потребоваться дополнить передним межтеловым спондилодезом [83].
Заключение
Камптокормия в подавляющем большинстве случаев является органическим заболеванием, либо проявлением поражения ЦНС, либо вследствие поражения периферических нервов или скелетных мышц. Лишь в редких случаях камптокормия вызывается психическим расстройством. Лекарственные препараты, травма или ортопедические проблемы могут оказывать свое влияние. Поскольку камптокормия возникает из-за ряда различных заболеваний, начальным шагом в лечении камптокормии является выявление основной причины. Лечение, как правило, должно быть направлено на основную этиологию и патомеханизм. Общие меры, такие как физиотерапия, ортезы или ботулинический токсин, могут быть полезны в единичных случаях. Только при эффективном лечении основной причины можно ожидать существенного терапевтического эффекта. Если лечение камптокормии неэффективно, больным рано или поздно потребуются приспособления для ходьбы и, в последнюю очередь, кресло-коляска. Поскольку возможности охарактеризовать патофизиологию камптокормии при болезни Паркинсона с помощью доступных технологий ограничены, для полного понимания постуральных феноменов и разработки эффективного лечения требуется животная модель аномальной позы.
Лишь в редких случаях камптокормия вызывается психическим расстройством. Лекарственные препараты, травма или ортопедические проблемы могут оказывать свое влияние. Поскольку камптокормия возникает из-за ряда различных заболеваний, начальным шагом в лечении камптокормии является выявление основной причины. Лечение, как правило, должно быть направлено на основную этиологию и патомеханизм. Общие меры, такие как физиотерапия, ортезы или ботулинический токсин, могут быть полезны в единичных случаях. Только при эффективном лечении основной причины можно ожидать существенного терапевтического эффекта. Если лечение камптокормии неэффективно, больным рано или поздно потребуются приспособления для ходьбы и, в последнюю очередь, кресло-коляска. Поскольку возможности охарактеризовать патофизиологию камптокормии при болезни Паркинсона с помощью доступных технологий ограничены, для полного понимания постуральных феноменов и разработки эффективного лечения требуется животная модель аномальной позы.
Авторское право: Все права защищены. Никакая часть данной публикации не может быть переведена на другие языки, воспроизведена или использована в любой форме и любыми средствами, электронными или механическими, включая фотокопирование, запись, микрокопирование или любую систему хранения и поиска информации, без письменного разрешения издателя. .
Никакая часть данной публикации не может быть переведена на другие языки, воспроизведена или использована в любой форме и любыми средствами, электронными или механическими, включая фотокопирование, запись, микрокопирование или любую систему хранения и поиска информации, без письменного разрешения издателя. .
Дозировка препарата: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор препарата и дозировка, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации. Тем не менее, в связи с продолжающимися исследованиями, изменениями в правительственных постановлениях и постоянным потоком информации, касающейся лекарственной терапии и реакций на лекарства, читателю настоятельно рекомендуется проверять вкладыш в упаковке для каждого лекарства на предмет любых изменений в показаниях и дозировке, а также для дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендуемый агент является новым и/или редко используемым лекарственным средством.