Пцр на паразитов: Гельмо-скрин. Скрининговое ПЦР-исследование возбудителей гельминтозов (энтеробиоза, аскаридоза, дифиллоботриоза, описторхоза, тениоза) (Gelmo-screen. Screening PCR of pathogens of helminthiasis (enterobiosis, ascariasis, diphyllobothriosis, opisthorchiasi
Инвитро. Паразитарные инфекции, узнать цены на анализы и сдать в Москве
- ИНВИТРО
- Анализы
- Диагностика инфекционных заболеваний
- Паразитарные инфекции
- COVID-19
- Программа обследования для офисных сотрудников
- Обследование домашнего персонала
- Оценка риска развития заболеваний сердечно-сосудистой системы
- Диагностика антифосфолипидного синдрома (АФС)
- Оценка функции печени
- Диагностика состояния почек и мочеполовой системы
- Диагностика состояния желудочно-кишечного тракта
- Диагностика заболеваний соединительной ткани
- Диагностика сахарного диабета
- Диагностика анемий
- Онкология
- Диагностика и контроль терапии остеопороза
- Диагностика состояния щитовидной железы
- Госпитальные профили
- Здоров ты – здорова страна
- Гинекология, репродукция
- Здоровый ребёнок: для детей от 0 до 14 лет
- Инфекции, передаваемые половым путём (ИППП)
- Проблемы веса
- VIP-обследования
- Болезни органов дыхания
- Аллергия
- Определение запасов микроэлементов в организме
- Красота
- Витамины
- Диеты
- Лабораторные исследования перед диетой
- Спортивные профили
- Гормональные исследования для мужчин
- Оценка свертывающей системы крови
- COVID-19
- Биохимические исследования
- Глюкоза и метаболиты углеводного обмена
- Белки и аминокислоты
- Желчные пигменты и кислоты
- Липиды
- Ферменты
- Маркеры функции почек
- Неорганические вещества/электролиты:
- Витамины
- Белки, участвующие в обмене железа
- Кардиоспецифичные белки
- Маркёры воспаления
- Маркёры метаболизма костной ткани и остеопороза
- Определение лекарственных препаратов и психоактивных веществ
- Биогенные амины
- Специфические белки
- Гормональные исследования
- Лабораторная оценка гипофизарно-надпочечниковой системы
- Лабораторная оценка соматотропной функции гипофиза
- Лабораторная оценка функции щитовидной железы
- Оценка функции паращитовидных желез
- Гипофизарные гонадотропные гормоны и пролактин
- Эстрогены и прогестины
- Оценка андрогенной функции
- Нестероидные регуляторные факторы половых желёз
- Мониторинг беременности, биохимические маркёры состояния плода
- Лабораторная оценка эндокринной функции поджелудочной железы и диагностика диабета
- Биогенные амины
- Лабораторная оценка состояния ренин-ангиотензин-альдостероновой системы
- Факторы, участвующие в регуляции аппетита и жирового обмена
- Лабораторная оценка гормональной регуляции эритропоэза
- Лабораторная оценка функции эпифиза
- Анализы для ЗОЖ
- Гематологические исследования
- Клинический анализ крови
- Иммуногематологические исследования
- Коагулологические исследования (коагулограмма)
- Иммунологические исследования
- Комплексные иммунологические исследования
- Лимфоциты, субпопуляции
- Оценка фагоцитоза
- Иммуноглобулины
- Компоненты комплемента
- Регуляторы и медиаторы иммунитета
- Интерфероновый статус, оценка чувствительности к иммунотерапевтическим препаратам:
- Аллергологические исследования
- IgE — аллерген-специфические (аллерготесты), смеси, панели, общий IgE.

- IgG, аллерген-специфические
- Технология ImmunoCAP
- Технология АлкорБио
- IgE — аллерген-специфические (аллерготесты), смеси, панели, общий IgE.
-
Маркеры аутоиммунных заболеваний
- Системные заболевания соединительной ткани
- Ревматоидный артрит, поражения суставов
- Антифосфолипидный синдром
- Васкулиты и поражения почек
- Аутоиммунные поражения желудочно-кишечного тракта. Целиакия
- Аутоиммунные поражения печени
- Неврологические аутоиммунные заболевания
- Аутоиммунные эндокринопатии
- Аутоиммунные заболевания кожи
- Заболевания легких и сердца
- Иммунная тромбоцитопения
- Онкомаркёры
- Микроэлементы
- Алюминий
- Барий
- Бериллий
- Бор
- Ванадий
- Висмут
- Вольфрам
- Галлий
- Германий
- Железо
- Золото
- Йод
- Кадмий
- Калий
- Кальций
- Кобальт
- Кремний
- Лантан
- Литий
- Магний
- Марганец
- Медь
- Молибден
- Мышьяк
- Натрий
- Никель
- Олово
- Платина
- Ртуть
- Рубидий
- Свинец
- Селен
- Серебро
- Стронций
- Сурьма
- Таллий
- Фосфор
- Хром
- Цинк
- Цирконий
- Исследование структуры почечного камня
- Исследования мочи
- Клинический анализ мочи
- Биохимический анализ мочи
- Исследования кала
- Клинический анализ кала
- Биохимический анализ кала
- Исследование спермы
- Светооптическое исследование сперматозоидов
- Электронно-микроскопическое исследование спермы
- Антиспермальные антитела
- Диагностика инфекционных заболеваний
- Вирусные инфекции
- Бактериальные инфекции
- Грибковые инфекции
- Паразитарные инфекции
- Стрептококковая инфекция
- Цитологические исследования
- Гистологические исследования
- Онкогенетические исследования
- Цитогенетические исследования
- Генетические предрасположенности
- Образ жизни и генетические факторы
- Репродуктивное здоровье
- Иммуногенетика
- Резус-фактор
- Система свертывания крови
- Болезни сердца и сосудов
- Болезни желудочно-кишечного тракта
- Болезни центральной нервной системы
- Онкологические заболевания
- Нарушения обмена веществ
- Описание результатов генетических исследований врачом-генетиком
- Фармакогенетика
- Система детоксикации ксенобиотиков и канцерогенов
- Определение пола плода
- Резус-фактор плода
- Наследственные заболевания
- Наследственные болезни обмена веществ
- Обследование новорождённых для выявления наследственных болезней обмена веществ
- Дополнительные исследования (после проведения скрининга и консультации специалиста)
- Определение биологического родства: отцовства и материнства
- Определение биологического родства в семье: отцовства и материнства
- Исследование качества воды и почвы
- Исследование качества воды
- Исследование качества почвы
- Диагностика патологии печени без биопсии: ФиброМакс, ФиброТест, СтеатоСкрин
- Расчётные тесты, выполняемые по результатам СтеатоСкрина без взятия крови
- Дисбиотические состояния кишечника и влагалища (ИНБИОФЛОР, Фемофлор, микробиоценоз урогенитального тракта)
- Общая оценка естественной микрофлоры организма
- Исследование микробиоценоза урогенитального тракта (ИНБИОФЛОР)
- Фемофлор: профили исследований дисбиотических состояний урогенитального тракта у женщин
- Специфическая оценка естественной микрофлоры организма
- Бланк результатов исследования на английском языке
-
- Кровь
- Моча
- Кал
- Спермограмма
- Гастропанель
-
- Эндоскопия
- Функциональная диагностика
- УЗИ
-
- Исследования, которые мы не делаем
- Новые тесты
- Получение результатов
- Дозаказ исследований
- Услуга врача консультанта
- Профессиональная позиция
Cтоимость анализов указана без учета взятия биоматериала
Анализ крови на паразиты (гельминты)
Версия для печати
В состав данного комплекса входят следующие исследования:
Инфекции
- Возбудитель описторхоза (Opisthorchis spp), IgG
- Возбудитель эхинококкоза (Echinococcus spp), IgG
- Возбудитель токсокароза (Toxocara spp), IgG
- Возбудитель трихинеллёза (Trichinella spp), IgG
- Возбудитель аскаридоза (Ascaris lumbricoides), IgG
- Возбудитель лямблиоза (Giardia Lamblia), полуколичественное суммарное определение антител класса IgG, IgA и IgM
Биоматериал
Для данного исследования лаборатория принимает следующий биоматериал:
- Кровь (сыворотка)
Подготовка к исследованию
Взятие крови проводится не ранее чем через 3 ч после последнего приема пищи. Можно пить воду без газа.
Можно пить воду без газа.
Паразитарные заболевания — группа заболеваний, вызываемых паразитами — простейшими и гельминтами. Ежегодно число заболевающих паразитарными болезнями в России превышает 20 млн. человек и имеет тенденцию к увеличению. Наиболее распространёнными являются лямблиоз, описторхоз, эхинококкоз, токсокароз, трихинеллёз, аскаридоз.
Клиника может проявляться общими симптомами: утомляемость, снижение аппетита, раздражительность, нарушение сна, боли в животе, аллергические дерматиты, задержка психического и физического развития у детей и т.д.
Обращаем Ваше внимание на то, что интерпретация результатов исследований, установление диагноза, а также назначение лечения, в соответствии с Федеральным законом № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» от 21 ноября 2011 года, должны производиться врачом соответствующей специализации.
- Код:
-
пример
результата300069
можно сдать на дому
- Стоимость:
- org/Offer»>
При единовременном заказе нескольких услуг, услуга по сбору биоматериала оплачивается только один раз.
4 364 р.
- + 190 р. Взятие крови
- Срок выполнения:
-
Указанный срок не включает день взятия биоматериала.

1-4 к.д.
Общий анализ крови + СОЭ с лейкоцитарной формулой (с микроскопией мазка крови при наличии патологических сдвигов), венозная кровь
- результаты за 3-6 часов (CITO)
- Код:
- 110006
- Срок:
- 1 к.д.
Цена: 743 р.
Общий анализ мочи (Urine test) с микроскопией осадка
- результаты за 3-6 часов (CITO)
- Код:
- 110101
- Срок:
- 1 к.
 д.
д.
Цена: 352 р.
Билирубин общий (Bilirubin total)
- результаты за 3-6 часов (CITO)
- Код:
- 090007
- Срок:
- 1 к.д.
Цена: 286 р.
Аланин-аминотрансфераза (Alanine aminotransferase)
- результаты за 3-6 часов (CITO)
- Код:
- 090014
- Срок:
- 1 к.
 д.
д.
Цена: 275 р.
Аспартат-аминотрансфераза (Aspartate aminotransferase)
- результаты за 3-6 часов (CITO)
- Код:
- 090015
- Срок:
- 1 к.д.
Цена: 275 р.
Показать еще
О возможных противопоказаниях необходимо проконсультироваться со специалистом
Лямблии: вопросы и ответы
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Вопросы посетителей и ответы специалистов на сайте интернет-клуба ИНВИТРО.
Добрый день! У моей дочери дисбактериоз (судя по аназизам). Врач назначила пить аципол, но толку что-то мало. У меня подозрения, может у дочери есть какие-то паразиты в организме. Скажите, на какие паразиты нужно сдать, чтобы хоть это исключить. ребенка переодически высыпает, от аципола толку чуть. Спасибо
Уважаемая Ольга! Для диагностики паразитов рекомендую Вашей дочери выполнить анализ кала на лямблии (тест №483), анализ крови на глистные инвазии (тесты №№ 229, 230, 232, 235, 237) и маркёр аллергии (тест №67), биохимию крови (профили №73 и №74). Более подробную информацию о ценах на исследования и подготовке к ним можно узнать на сайте Лаборатории ИНВИТРО в разделах: «Анализы и цены» и «Профили исследований», а также по телефону 363-0-363 (единая справочная Лаборатории ИНВИТРО). Для определения дальнейшей тактики рекомендуем Вам обратиться к педиатру.
Для определения дальнейшей тактики рекомендуем Вам обратиться к педиатру.
Доброго времени суток! Возраст — 27 лет. В последние полгода беспокоят частые расстройства желудка, избыточное газообразование, урчание в животе. Хроническое заболевание — гастродуоденит. Есть подозрения на дисбактериоз кишечника и наличие паразитов (включая лямблиоз). Какие анализы порекомендуете сдать? Спасибо.
Уважаемая Светлана! Рекомендую выполнить общий анализ кала (тест №158), анализ кала на дисбактериоз с определением чувствительности к бактериофагам (тесты №№ 456, 443), анализ кала на антиген лямблии и хеликобактер — пилори (тесты №№ 483, 484), анализ крови на хеликобактер — пилори (тесты №№ 133, 177). Более подробную информацию о ценах на исследования и подготовке к ним можно узнать на сайте Лаборатории ИНВИТРО в разделах: «Анализы и цены» и «Профили исследований», а также по телефону 363-0-363 (единая справочная Лаборатории ИНВИТРО). Для определения дальнейшей тактики рекомендуем Вам обратиться к гастроэнтерологу.
Для определения дальнейшей тактики рекомендуем Вам обратиться к гастроэнтерологу.
Здравствуйте. Сдал в вашей клинике анализ крови на лямблиоз — реакция положительная. Нужно ли делать повторный анализ(сдавать кал)? Если раньше уже были лямблии, но вылечился от них. На сколько можно верить результатам анализа крови? Чем лучше лечиться от лямблий??
Уважаемый Антон! Наличие антител к лямблиям говорит о перенесённой или текущей инвазии. Для уточнения диагноза рекомендую выполнить анализ кала на определение антигена возбудителя (тест №483). Для определения дальнейшей тактики рекомендуем Вам обратиться к гастроэнтерологу.
Здравствуйте. Подскажите пожалуйста, у ребенка высыпала сыпь, вызвали скорую, нам поставили диагноз крапивница, вкололи дексометазон (после укола сыпь прошла минут через 40), сказали сдать кровь на IgE. сдали на след. день у вас в лаборатории, показатель 397(норма до 90 по ее возрасту), пересдали еще через неделю -показатель 255. Все это время мы пили фенистил. Нужно ли дополнительно сдать анализы на наличие паразитов (лямблии, глисты, аскариды…) в организме (ведь высокий уровень IgE также может говорить о наличии паразитов в организме) или нет смысла, так как уровень иммуноглобулина понижается на фоне принятия антигистаминных препаратов? Заранее спасибо.
Все это время мы пили фенистил. Нужно ли дополнительно сдать анализы на наличие паразитов (лямблии, глисты, аскариды…) в организме (ведь высокий уровень IgE также может говорить о наличии паразитов в организме) или нет смысла, так как уровень иммуноглобулина понижается на фоне принятия антигистаминных препаратов? Заранее спасибо.
Уважаемая Татьяна! Если контакт с аллергеном продолжается, то уровень иммуноглобулина Е (общего и специфического) будет оставаться высоким даже на фоне приема антигистаминных препаратов. Для выявления причины аллергической реакции рекомендую выполнить ребенку анализ крови на бытовые аллергены (профиль №98), пищевые аллергены (с учетом употребляемых продуктов), паразитарные инвазии (тесты №№ 229, 230, 232, 237), анализ кала на антиген лямблий (тест №483). Более подробную информацию о ценах на исследования и подготовке к ним можно узнать на сайте Лаборатории ИНВИТРО в разделах: «Анализы и цены» и «Профили исследований», а также по телефону 363-0-363 (единая справочная Лаборатории ИНВИТРО).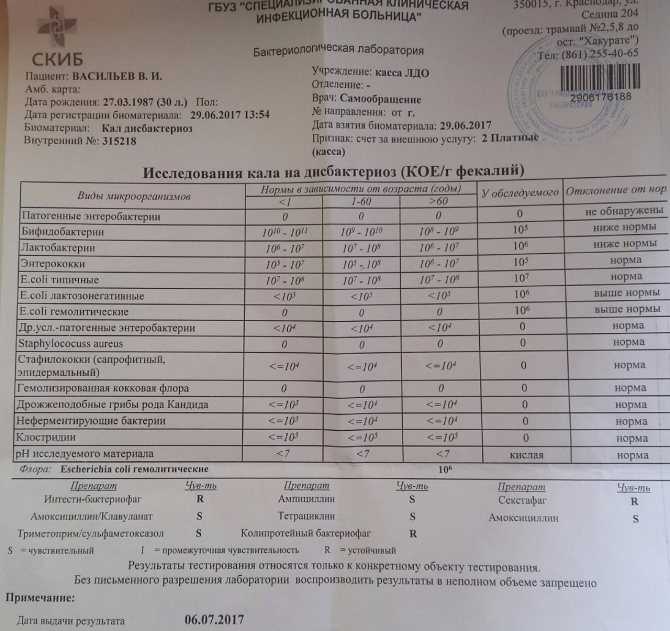 Для определения дальнейшей тактики рекомендуем Вам обратиться к аллергологу.
Для определения дальнейшей тактики рекомендуем Вам обратиться к аллергологу.
Здравствуйте! Старшей в ноябре будет 5лет, а младшей в декабре будет 4года. С прошлого года как пошли в садик начали болеть простудными заболеваниями каждый месяц. Летом сдали анализы: кровь из вены на лямблии, хламидию пневмонии,аллергию. Результаты: лямблии отрицательно у обеих, Ig M отрицательно и пок. коэф.Ig G 1,3 у обеих, Ig E 171 у младшей, 91 у старшей. Сейчас жалобы на самочуствие у старшей-кашель: 2 дня есть, потом исчезает на пару дней, начинается именно в садике. Назначили пить кетотифен обеим. Я не могу понять из ответов врача есть ли у нас хламидии и может ли кашель быть на нервной почве, потому что садик переносят обе очень плохо? Заранее спасибо, надеюсь подскажите как мне быть! Юлия.
Уважаемая Юлия! Результат анализа указывает на отсутствие активной хламидийной инфекции у девочек, а повышенный уровень общего IgE свидетельствует об аллергической их сенсибилизации к какому-либо аллергену. Для определения дальнейшей тактики рекомендую обратиться к аллергологу и педиатру.
Для определения дальнейшей тактики рекомендую обратиться к аллергологу и педиатру.
Анализ крови (сумарные антитела) показал наличие лямблий1,32++., аскариды-1.(гемотест) Кал на наличие цист лямблий -не обнаружено,аскариды-обнаружены, (30 детская поликлиника).Беспокоил ребенка(6л) жидкий стул, отсутствие аппетита . Пил вермокс,нимазол-ч/з 14 дней.Т.к обнаружить цисты лямблий довольно труднов в кале,то стоит такой вопрос- делаете ли в лаборатории анализ кала на лямблии в консервант Турдыева.А также хотим сдать в Вашей лаборатории кал на лямблии антиген-что он покажет?Не является ли этот анализ повторением анализа крови на сумарные антитела .
Анализ кала на лямблии не является аналогом анализа крови на суммарные антитела. При исследовании кала определяются антигены самого возбудителя, а не антитела к ним (тест №483). Более подробную информацию о ценах на исследования и подготовке к ним можно узнать на сайте Лаборатории ИНВИТРО в разделах: «Анализы и цены» и «Профили исследований», а также по телефону 363-0-363 (единая справочная Лаборатории ИНВИТРО). С результатами обследования обратитесь к инфекционисту.
С результатами обследования обратитесь к инфекционисту.
Добрый день! Около 3 месяцев держится субфебрильная температура 37-37,3. Была у терапевта, сдавала общий анализ крови, мочи, которые никаких отклонений не показали. Анализы на ВИЧ, гепатиты, сифилис, torch-инфекции тоже отрицательные. В последнее время часто жидкий стул, боли в животе. Пожалуйста, подскажите, какие анализы нужно сдать для оценки состояния желудка и кишечника? Пол женский, 23 года. Раньше никаких заболеваний, связанных с кишечником, не было. Спасибо!
Уважаемая Ирина! В Вашем случае рекомендую выполнить биохимический анализ крови (профили №73 и №74, тесты №№ 12, 18, 23), общий анализ кала (наш тест №158), анализ кала на дисбактериоз с определением чувствительности к бактериофагам (тесты №№ 456, 443), анализ кала на лямблии (тест №483), анализ кала на панкреатическую эластазу (тест №162ПЭ1). Более подробную информацию о ценах на исследования и подготовке к ним можно узнать на сайте Лаборатории ИНВИТРО в разделах: «Анализы и цены» и «Профили исследований», а также по телефону 363-0-363 (единая справочная Лаборатории ИНВИТРО). Для определения дальнейшей тактики рекомендуем Вам обратиться к гастроэнтерологу.
Для определения дальнейшей тактики рекомендуем Вам обратиться к гастроэнтерологу.
Здравствуйте! Моей дочери (7 лет) почти год назад был поставлен диагноз бронхиальная астма 1 степени. 2 недели лечения в аллергоцентре результата практически не дали, ребенок был выписан с хрипами, слышимыми дистанционно и кашлем. Клинические анализы по словам лечащего врача были в норме, IG E =800. В апреле было подряд 2 бронхита с обструкцией. Применяли ровамицин, эриус, бронхолитин. В мае ездили в санаторий, прошли курс физиопроцедур. Анализы и спирограмма в норме. На данный момент состояние нормальное, периодически закладывает нос (выделений нет). С момента постановки диагноза соблюдаем строгую диету, убрали ковры, заменили подушки и одеяла. До года у ребенка была аллергия на коровье молоко, давала детскую смесь на основе сои. В семье аллергическими заболеваниями никто не страдает.Вопрос: Имеет ли смысл сделать аллергопробы по крови(метод ИФА)? насколько информативен этот анализ? Возможен ли вариант, что по всем аллергенам результат буде +-? Спасибо.
Уважаемая Татьяна! Уровень иммуноглобулина Е говорит о постоянном аллергостатусе ребёнка и его контактах с аллергенами. Наиболее частой причиной возникновения повышенной сенсибилизации организма ребёнка является паразитарная инвазия, в частности аскариды, способные мигрировать в бронхиальное дерево, обуславливая бронхоспазм, а также лямблии и токсокары, вызывающие выраженные аллергические реакции. Пищевая аллергия часто ассоциирована с заболеваниями органов желудочно-кишечного тракта. Учитывая всё вышесказанное, рекомендую Вашему ребёнку выполнить анализ крови на глисты (наши тесты №№ 229, 230, 232, 234, 237), общий анализ кала (тест №158), анализ кала на дисбактериоз с определением чувствительности к бактериофагам (тесты №№ 456, 443), анализ кала на панкреатическую эластазу (тест №162ПЭ1). Для выявления аллергенов и их устранения рекомендую также провести аллергодиагностику (профиль №98 «Бытовые аллергены», профиль №101 «Растительные аллергены», профиль АЛЛ — «90 пищевых аллергенов»). Более подробную информацию о ценах на исследования и подготовке к ним можно узнать на сайте Лаборатории ИНВИТРО в разделах: «Анализы и цены» и «Профили исследований», а также по телефону 363-0-363 (единая справочная Лаборатории ИНВИТРО). Для определения дальнейшей тактики рекомендую обратиться к аллергологу, гастроэнтерологу.
Более подробную информацию о ценах на исследования и подготовке к ним можно узнать на сайте Лаборатории ИНВИТРО в разделах: «Анализы и цены» и «Профили исследований», а также по телефону 363-0-363 (единая справочная Лаборатории ИНВИТРО). Для определения дальнейшей тактики рекомендую обратиться к аллергологу, гастроэнтерологу.
ЗДРАВСТВУЙТЕ! Мой ребенок — 5 лет, уже третью неделю страдает от аллергии, пробы мы не делали ни разу. в детской поликлинике нам сказали, что нужно пока следить за кровью, ии необходимо сдать анализы ОАК и ОАМ, чтобы в крови были и эозинофилы и моноциты. В общем анализе крови они есть? и сколько стоят у Вас такие анализы?заранее спасибо!
Уважаемая Дарья! Уровень моноцитов и эозинофилов оценивается при проведении клинического анализа крови (тесты №5, №119). Наиболее частой причиной повышенной сенсибилизации организма у детей является паразитарная инвазия и заболевания органов желудочно-кишечного тракта, поэтому для исключения данной патологии рекомендую выполнить ребенку анализ крови на аскариды, токсокары, лямблии (тесты №№ 232, 234, 237), анализ крови на бытовые аллергены (профиль №98), анализ кала на антиген лямблий (тест №483), анализ кала на дисбактериоз (тесты №№ 456, 443), анализ кала на панкреатическую эластазу (тест №162ПЭ1). Более подробную информацию о ценах на исследования и подготовке к ним можно узнать на сайте Лаборатории ИНВИТРО в разделах: «Анализы и цены» и «Профили исследований», а также по телефону 363-0-363 (единая справочная Лаборатории ИНВИТРО). Для определения дальнейшей тактики рекомендую обратиться к аллергологу.
Более подробную информацию о ценах на исследования и подготовке к ним можно узнать на сайте Лаборатории ИНВИТРО в разделах: «Анализы и цены» и «Профили исследований», а также по телефону 363-0-363 (единая справочная Лаборатории ИНВИТРО). Для определения дальнейшей тактики рекомендую обратиться к аллергологу.
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Анализы на выявление паразитов
Анализы на выявление паразитов
Паразиты – организмы, которые живут за счет чужого организма, питаются его ресурсами и своей жизнедеятельностью причиняют ему вред.
По данным статистики паразитами заражены около 95% людей на Земле. Даже в развитой Европе паразиты зафиксированы у каждого третьего жителя. Для хозяев домашних животных риск заразиться паразитами возрастает до 99%. Один человек одновременно может страдать пятью и более видами паразитов.
Для хозяев домашних животных риск заразиться паразитами возрастает до 99%. Один человек одновременно может страдать пятью и более видами паразитов.
Опасность паразитов
Если количество и размер паразитов невелики, их наличие долго может оставаться незамеченным. Однако быстрое размножение или рост паразитов, их перемещение по организму в течение жизненного цикла часто является причиной развития серьезных проблем со здоровьем.
Например, аскариды, скопившиеся в кишечнике, могут вызвать запоры и непроходимость. Бычий цепень вырастает до нескольких метров в длину и серьезно повреждает пищеварительный тракт, лишает хозяина питательных веществ и витаминов. Эхинококк образует кисты во внутренних органах, в том числе в головном мозге, печени, легких. Личинки трихинеллы питаются и живут в мышцах, постепенно разрушая их.
По данным ВОЗ на паразитарные заболевания приходится около 14 млн. смертей в мире за год.
Осложнения паразитарных заболеваний
При жизнедеятельности или гибели паразита в организм хозяина выделяются вещества, обладающие токсичностью. Они могут стать причиной появления слабости, постоянной усталости, головокружения, головной боли, тошноты, понижения аппетита. Кроме того, эти вещества провоцируют сенсибилизацию организма, которая становится причиной аллергии – сыпи, дерматита, бронхита.
Они могут стать причиной появления слабости, постоянной усталости, головокружения, головной боли, тошноты, понижения аппетита. Кроме того, эти вещества провоцируют сенсибилизацию организма, которая становится причиной аллергии – сыпи, дерматита, бронхита.
Многие паразиты выбирают для обитания желудочно-кишечный тракт человека. При укреплении в кишечнике, а также питании, паразиты повреждают и уничтожают клетки слизистой оболочки и клетки крови. Обширные повреждения слизистой оболочки могут проявлять себя болью, тошнотой, нарушениями процессов пищеварения и усвоения питательных веществ.
Большое количество паразитов (например, аскарид), сплетаясь в клубок, способно вызвать закупорку кишечника и острую кишечную непроходимость.
Особенно высок риск этого осложнения у маленьких детей, ведь просвет кишечника у них уже.
Без анализа кала на паразитов, соскоба на яйца глист поставить правильный диагноз невозможно.
Паразитами они называются потому, что интересы организма хозяина их не слишком заботят. Они берут из пищи все необходимые элементы, лишая хозяина многих нужных питательных веществ – минералов и витаминов.
Поэтому одно из последствий паразитарных заболеваний – это гиповитаминозы и авитаминозы, которые могут проявляться:
• снижением иммунитета
• ухудшением состояния кожи, ногтей, волос и др.
Значительная потеря клеток крови (по причине питания ими паразита) и их недостаточное образование (из-за гиповитаминоза) приводит к анемии. Своевременное проведение анализа крови на паразитов позволит выявить причины ухудшения здоровья и начать эффективное лечение.
Такой паразит, как трихинелла, обитает в мышцах и питается ими, что вызывает сильные мышечные боли. Паразиты, которые живут или размножаются в желчных протоках (например, описторхи), могут спровоцировать их закупорку, что проявляется желтухой кожи и склер, зудом.
Паразиты являются источником регулярного хронического повреждения клеток, что провоцирует их злокачественные изменения и развитие рака.
Еще одна опасность паразитов – то, что зараженный человек становится в большинстве случаев причиной заражения других людей. В результате – все члены семьи могут заболеть при наличии паразита у одного из них.
Некоторые паразиты для улучшения выживания имеют очень сложный жизненный цикл, за который они меняют нескольких хозяев, и в каждом существуют в виде различных жизненных форм. Для эхинококка, например, человек является тупиком жизненного цикла и, попадая в его организм, паразит образует кисты и капсулы в различных органах (мозге, печени, легких).
Появление кист в головном мозге может стать причиной развития эпилепсии и других неврологических расстройств. Кроме того кисты – источник образования абсцессов во внутренних органах. Чтобы обезопасить себя и своих близких от паразитов, необходимо своевременно выявлять и лечить паразитарные болезни. Для этого необходимо проходить комплексное обследование на гельминтозы.
Какие анализы нужны для обнаружения паразитов?
Обнаружить присутствие в организме гельминтов позволяет исследование кала, крови, соскоба с перинатальных складок.
Паразиты, живущие в кишечнике, размножаются с помощью яиц или целых отсеков с большим количеством яиц, которые выделяются вместе с испражнениями. Так больной человек становится распространителем паразитов. Соскоб и кал на паразитов проводятся с целью обнаружения яиц гельминтов и простейших (таких как: лямблии, острицы, описторхи и др.).
Поскольку активная жизнедеятельность паразита проявляется выделением токсичных веществ и сенсибилизацией организма, в анализе можно увидеть характерные изменения формулы крови. Общий анализ крови помогает обнаружить повышение уровня эозинофилов, реже – анемию. Это исследование позволяет заподозрить или подтвердить наличие паразитарного заболевания без уточнения вида паразита.
Для обнаружения других видов паразитов проводится иммуноферментный анализ крови (ИФА) на эхинококкоз, трихинеллез, токсоплазмоз, токсокароз.
Определение вида паразита помогает врачу назначить нужные дополнительные обследования или сразу подобрать правильное лечение.
Анализ кала на яйца гельминтов и простейших, соскоб на паразитов и анализ крови, можно и нужно сдавать при подозрении на заражение (появлении характерных жалоб и проблем со здоровьем) тем, кто живет в зонах с повышенным риском заражения, работникам детских учреждений, пищевой промышленности, членам семьи, в которой было обнаружено паразитарное заболевание и т.д.
Своевременное обнаружение и лечение паразитозов позволяет избежать угрожающих осложнений и проблем со здоровьем.
http://dgb1rostov.ru/8-article/100-analizy-na-vyyavlenie-parazitov
Анализ крови на паразитов в Москве
Анализ крови на паразитов в Москве — цены
Вероятность заражения паразитами даже при современном уровне гигиены очень высок. Паразиты, попав в организм, в зависимости от вида могут поселиться в любом из органов и нанести непомерный вред здоровью.Главную опасность для человека представляют продукты жизнедеятельности гельминтов.
Для того чтобы обнаружить их присутствие может потребоваться целый комплекс различных процедур, к которым относится и анализ крови на паразитов.
Что показывает анализ
Данным способом выявляют следующие виды заражений:
- Лямблиоз;
- Тениоз;
- Трихинеллез;
- Лейшманиоз;
- Аскаридоз;
- Цистицерко;
- Фасциолез;
- Описторхоз;
- Эхинококкоз.
В диагностических целях для выявления типа паразитов проводится несколько видов анализов крови:
- Общий;
- Иммунологический;
- ПЦР;
- Иммуноферментный;
- Гемосканирование.
К примеру, биохимический анализ добавляется в том случае, если есть подозрение на поражение печени. Общий анализ показывает наличие воспалительного процесса в организме. В ходе иммунологического обследования в крови ищут специфические антитела. Полимеразная цепная реакция помогает обнаружить участки генов ДНК паразитов.
Полимеразная цепная реакция помогает обнаружить участки генов ДНК паразитов.
Показания к анализу
Анализ крови на паразитов назначается пациентам в следующих случаях:
- При появлении болей в области живота, которые могут возникать сами по себе или во время пальпации;
- В случае появления сильного зуда в области заднего прохода;
- При слабости мышц и суставов;
- При появлении тошноты и потере аппетита;
- При усилении аппетита и усиленном слюноотделении;
- Если у пациента имеются жалобы на частые расстройства стул;
- При изменении цвета фекалий;
- При головокружениях и бледности кожных покровов;
- В случае появлении проблем со сном;
- При появлении беспричинной раздражительности;
- При появлении обильных выделений у женщин из половых органов и нарушении цикла;
- При выявлении дерматитов, которые могут быть спровоцированы присутствием простейших и гельминтов в организме;
- В случае появления фактов недержания мочи;
- При быстрой утомляемости и апатии.
Часто исследования проводят в профилактических целях маленьким детям и людям, которые могли заразиться.
Подготовка к исследованию
Чтобы получить точный результата анализа, врачи рекомендуют соблюдать правила подготовки:
- Кровь для исследования берется утром, через восемь часов после последнего приёма пищи;/li>
- За двое суток до анализа нельзя употреблять жирную, острую и жареную пищу;
- Запрещено в течение нескольких дней употреблять алкоголь;
- Перед сдачей крови нельзя курить.
За две недели до забора материала прекращается прием лекарственных средств. В тех случаях, когда это невозможно, на направлении указывается название лекарства и принятая доза.
Результат анализа может быть искажен из — за приема антипаразитарных препаратов и антибиотиков, в таком случае врач назначит исследование повторно.
Как проводится анализ
Точность выявления паразитарного заражения при исследовании крови достаточно высока и приближается к 95 %. Гемосканирование — это одна из последних медицинских разработок. Для данного метода исследования берется всего несколько капель крови из пальца. Взятый материал помещается на предметное стекло и рассматривается под микроскопом с высокой степенью увеличения.
Гемосканирование — это одна из последних медицинских разработок. Для данного метода исследования берется всего несколько капель крови из пальца. Взятый материал помещается на предметное стекло и рассматривается под микроскопом с высокой степенью увеличения.
Кровь подвергается изучению без использования традиционных методов окрашивания, ферментов, осушения. Изображение с предметного стекла поступает на монитор, где хорошо видно присутствие гельминтов и их личинок, грибков. На все обследование затрачивается не более десяти минут.
Недостатком этого метода является то, что помимо видов, личинки которых переносятся с кровью, имеются виды с локализацией в других местах, их гемосканирование выявить не может.
ПЦР используется часто при диагностике гельминтных паразитарных поражений организма. При установлении других видов возбудителей этот метод не так эффективен. В этом случае не имеет значение жив паразит или мертв.
Нормы и расшифровка результата
При общем анализе крови под микроскопом подсчитывается число форменных элементов крови. При наличии в организме чуждых для него организмов повышается уровень лейкоцитов, и одновременно снижается число эритроцитов.
При наличии в организме чуждых для него организмов повышается уровень лейкоцитов, и одновременно снижается число эритроцитов.
Иммуноферментный анализ крови проводится с целью обнаружения иммуноглобулинов, при наличии заражения их концентрация увеличивается в несколько раз.
При иммуноферментном исследовании определяется вид паразита, и подсчитывается количество антител в единице объема. Таким способом определяется примерное время развития патологии и стадия заболевания. Основное достоинство данного типа исследования — быстрота и высокий уровень точности.
К примеру, при выявлении аскаридоза, в крови пациента обнаруживают специфические антитела, относящиеся к классу IgG или IgE к антигенам аскарид. Они вырабатываются организмом пациента в ответ на появление личинок и паразитов данного вида. Причем вначале появляются специфические антитела IgE и только по прошествии некоторого времени IgG.
Данный метод обследования используется при подозрении на наличие многих паразитарных заражений, в том числе и описторхоза. В данном случае повышается концентрации иммуноглобулинов класса G и M. Иммуноглобулины класса M появляются сразу после того, как паразит попадает в организм. Данный метод обследования становится результативным уже через две недели с момента заражения. Максимальная концентрация иммуноглобулинов происходит на третьей — четвертой неделе заражения.
В данном случае повышается концентрации иммуноглобулинов класса G и M. Иммуноглобулины класса M появляются сразу после того, как паразит попадает в организм. Данный метод обследования становится результативным уже через две недели с момента заражения. Максимальная концентрация иммуноглобулинов происходит на третьей — четвертой неделе заражения.
При диагностике трихинеллеза используется два метода исследования биологического материала. Общий анализ и серологический. В первом случае при наличии инфекции на пять процентов повышается уровень эозинофилов, которые вырабатываются в ответ на появление паразита.
ПЦР. Данный вид диагностики имеет высокий уровень точности. При обнаружении частей ДНК или РНК присутствие паразита считается доказанным. В случае получения отрицательного значения, отсутствие паразитов находится под сомнением. Так как их распространение и количество может быть недостаточным. При наличии симптомов соответствующего характера исследование крови повторяют через две недели для подтверждения отрицательного результата.
Данная статья размещена исключительно с целью ознакомления в познавательных целях и не является научным материалом или профессиональным медицинским советом. За диагностикой и лечением обратитесь к врачу.
Анализ на глисты | Сдать анализ кала на глисты в Краснодаре
Общеклинические исследования
21.02.004
Иcследование кала на простейших, яйца гельминтов
Срок: 1 дн.
Стоимость: 460
20% скидка при оплате на сайте: 368
21.02.001
Общий анализ кала (копрограмма)
Срок:
1 дн.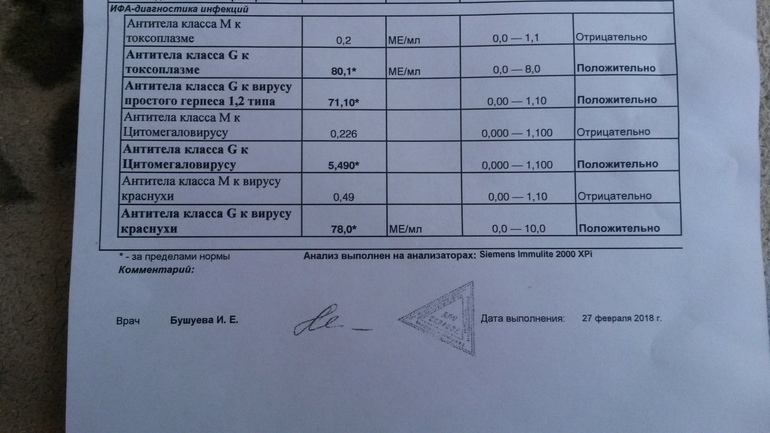
Стоимость: 665
20% скидка при оплате на сайте: 532
21.02.005
Исследование кала на скрытую кровь
Срок: 1 дн.
Стоимость: 320
20% скидка при оплате на сайте: 256
21.02.006
Содержание углеводов в кале (в т.ч. лактоза)
Срок: 2 дн.
Стоимость: 650
20% скидка при оплате на сайте: 520
21. 02.009
02.009
Скрининг колоректального рака, тест «Colonview» (гемоглобин и гемоглобин-гаптоглобиновый комплекс в кале)
Срок: 2 дн.
Стоимость: 1320
20% скидка при оплате на сайте: 1056
21.02.007
Панкреатическая эластаза 1 в кале
Срок: 8 дн.
Стоимость: 2080
20% скидка при оплате на сайте: 1664
21.02.008
Кальпротектин (в кале)
Срок:
0-10 дн.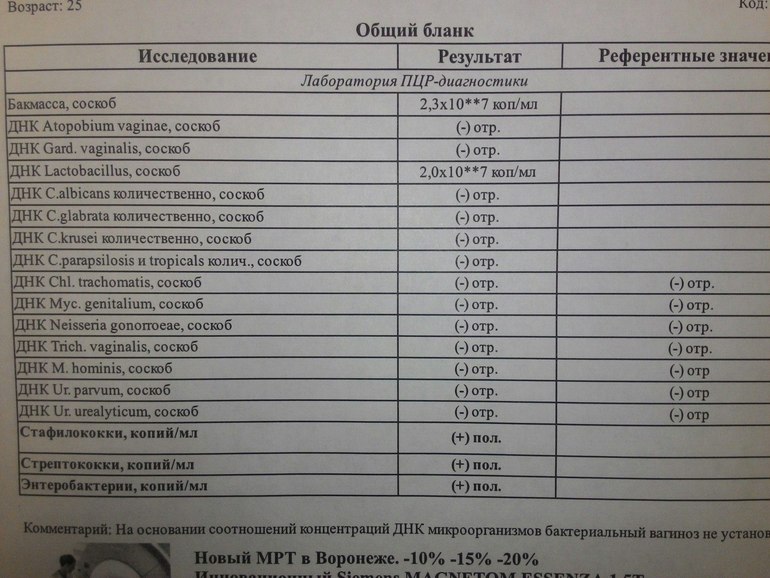
Стоимость: 2355
20% скидка при оплате на сайте: 1884
21.02.010
Исследование кала на гименолепидоз (яйца карликового цепня, Hymenolepis nana)
Срок: 3 дн.
Стоимость: 350
20% скидка при оплате на сайте: 280
Биохимия крови
04.07.001
Натрий, калий, хлор (Na/K/Cl)
Срок: 1 дн.
Стоимость: 440
20% скидка при оплате на сайте: 352
Биохимия мочи
05. 02.012
02.012
Натрий, калий, хлор мочи (Na/K/Cl)
Срок: 2 дн.
Стоимость: 230
20% скидка при оплате на сайте: 184
Микробиологические исследования
20.15.004
Ротавирус (обнаружение антигена в кале), ИХГА
Срок: 2 дн.
Стоимость: 630
20% скидка при оплате на сайте: 504
20.15.003
Исследование кала на токсины клостридий (Clostridium Difficile) A и B
Срок:
2 дн.
Стоимость: 1640
20% скидка при оплате на сайте: 1312
20.15.002
Исследование антигена хеликобактера (Helicobacter pylori) в кале
Срок: 2 дн.
Стоимость: 1055
20% скидка при оплате на сайте: 844
20.15.001
Исследование антигена лямблий (Giardia intestinalis) в кале
Срок: 2 дн.
Стоимость: 925
20% скидка при оплате на сайте: 740
Тяжелые металлы и микроэлементы
17. 02.007
02.007
Калий (моча)
Срок: 6 дн.
Стоимость: 870
20% скидка при оплате на сайте: 696
17.01.007
Калий (кровь)
Срок: 6 дн.
Стоимость: 870
20% скидка при оплате на сайте: 696
17.03.008
Калий (волосы)
Срок:
6 дн.
Стоимость: 870
20% скидка при оплате на сайте: 696
Онкомаркеры
08.00.017
Опухолевая пируваткиназа Тu M2 (в кале)
Срок: 0-16 дн.
Стоимость: 2245
20% скидка при оплате на сайте: 1796
20.16.005
Бактериологический посев (кал) на возбудителей кишечной инфекции (сальмонеллы, шигеллы) с определением чувствительности к антибиотикам
Срок: 0 дн.
Стоимость: 870
20% скидка при оплате на сайте: 696
В человеческом организме может обитать огромное количество глистов, которые чаще всего поражают кишечник. Паразиты вызывают воспаление кишечной слизистой, малокровие, анемию, аллергию. Поэтому при подозрении на их появление нужно узнать, где сдать анализы на глистов, выявить и вывести обнаруженных гельминтов.
Паразиты вызывают воспаление кишечной слизистой, малокровие, анемию, аллергию. Поэтому при подозрении на их появление нужно узнать, где сдать анализы на глистов, выявить и вывести обнаруженных гельминтов.
При каких жалобах нужно сдавать кал на глистов?
- Боли и вздутие в животе, нарушение переваривания пищи.
- Изменения в крови – анемия, увеличение концентрации эозинофилов.
- Слабость, плохое самочувствие, снижение массы тела.
- Зуд в области заднего прохода.
- Появление в кале паразитов, их личинок или члеников.
- Кашель, вызванный миграцией глистов по организму и их попаданием в легкие.
Детям нужно сдавать анализ на глистов вне зависимости от наличия симптомов. Малыши могут заразиться гельминтами во время игры в песочнице, при пользовании чужими игрушками и вещами. Иммунная система ребенка слабее, чем у взрослого, поэтому хуже справляется с паразитами.
Анализ кала на глисты необходимо сдать при прохождении медосмотра работниками, работающими с пищевыми продуктами и непосредственно контактирующими с другими людьми. Анализ на глисты берется у детей перед поступлением в школу, дошкольное учреждение, поездкой в детский лагерь или санаторий.
Как сдается анализ кала?
Для этого нужно взять небольшой объем кала и поместить его в контейнер с закрывающейся крышкой. Материал доставляется в лабораторию в тот же день. При паразитировании гельминтов в анализе будут обнаружены сами глисты, их членики, яйца или личинки. При анализе на яйца глистов берется соскоб с области вокруг заднего прохода.
В любом городе, в том числе в Краснодаре, можно сдать анализ на глисты. Для получения более точных результатов анализ сдается трехкратно. В этом случае вероятность выявления гельминтов составляет 99%.
Только жизнеспособные паразиты выявляются с помощью ПЦР после устранения малярийных инфекций грызунов с помощью медикаментозного лечения или иммунного ответа falciparum
вызывается рецидивом резистентных паразитов.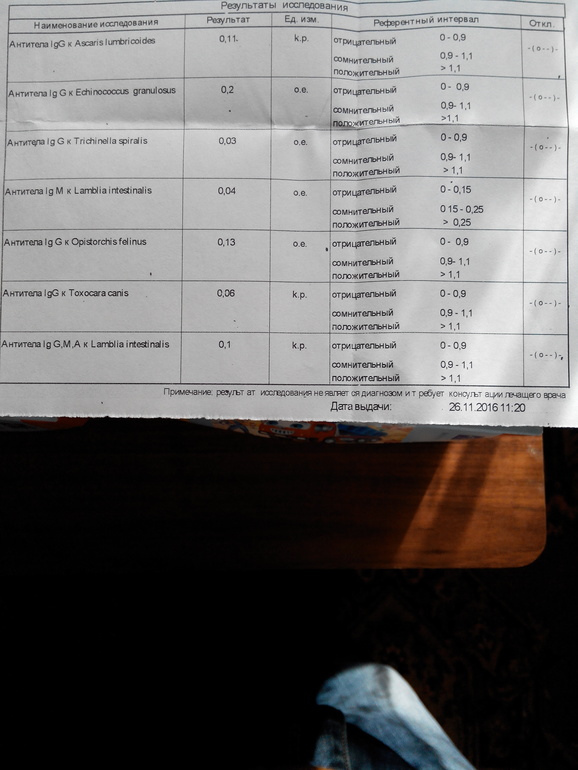 Trans R Soc Trop Med Hyg. 1994; 88: 328–331. [PubMed] [Google Scholar]
Trans R Soc Trop Med Hyg. 1994; 88: 328–331. [PubMed] [Google Scholar] 2. Babiker H A, Ranford-Cartwright L C, Currie D, Charlwood J D, Billingsley P, Teuscher T, Walliker D. Случайное спаривание в естественной популяции малярийного паразита Plasmodium falciparum . Паразитология. 1994; 109: 413–421. [PubMed] [Google Scholar]
3. Barker R H J, Banchongaksorn T, Courval J M, Suwonkerd W, Rimwungtragoon K, Wirth DF. Простой метод обнаружения Plasmodium falciparum непосредственно в образцах крови с использованием полимеразной цепной реакции. Am J Trop Med Hyg. 1992; 46: 416–426. [PubMed] [Google Scholar]
4. Bottius E, Guanzirolli A, Trape J-F, Rogier C, Konate L, Druilhe P. Малярия: еще более хроническая по своей природе, чем считалось ранее; доказательства субпатентной паразитемии, выявляемой с помощью полимеразной цепной реакции. Trans R Soc Trop Med Hyg. 1996;90:15–19. [PubMed] [Google Scholar]
5. Brown K N, Jarra W, Hills L A. Т-клетки и защитный иммунитет к Plasmodium berghei у крыс. Заразить иммун. 1976; 14: 858–871. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Заразить иммун. 1976; 14: 858–871. [Бесплатная статья PMC] [PubMed] [Google Scholar]
6. Cheng Q, Lawrence G, Reed C, Stowers A, Ranford-Cartwright L, Creasy A, Carter R, Saul A. Измерение скорости роста Plasmodium falciparum in vivo : тест на вакцину против малярии. Am J Trop Med Hyg. 1997; 57: 495–500. [PubMed] [Академия Google]
7. Contamin H, Fandeur T, Bonnefoy S, Skouri F, Ntoumi F, Mercereau-Puijalon O. ПЦР-типирование полевых изолятов Plasmodium falciparum . Дж. Клин Микробиол. 1995; 33: 944–951. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Contamin H, Fandeur T, Rogier C, Bonnefoy S, Konate L, Trape J-F, Mercereau-Puijalon O. Различные генетические характеристики изолятов Plasmodium falciparum , собранных во время последовательные клинические эпизоды малярии у сенегальских детей. Am J Trop Med Hyg. 1996;54:632–643. [PubMed] [Google Scholar]
9. Daubersies P, Sallenave-Sales S, Magne S, Trape J-F, Contamin H, Fandeur T, Rogier C, Mercereau-Puijalon O, Druilhe P. Быстрая текучесть популяций Plasmodium falciparum у бессимптомных лиц, проживающих в зоне высокой передачи. Am J Trop Med Hyg. 1996; 54:18–26. [PubMed] [Google Scholar]
Быстрая текучесть популяций Plasmodium falciparum у бессимптомных лиц, проживающих в зоне высокой передачи. Am J Trop Med Hyg. 1996; 54:18–26. [PubMed] [Google Scholar]
10. Duraisingh MT, Drakeley CJ, Muller O, Bailey R, Snounou G, Targett GAT, Greenwood BM, Warhurst DC. Доказательства селекции тирозина-86 аллеля pfmdr 1 ген Plasmodium falciparum с помощью хлорохина и амодиахина. Паразитология. 1997; 114: 205–211. [PubMed] [Google Scholar]
11. Engelbrecht F, Felger I, Genton B, Alpers M, Beck H-P. Plasmodium falciparum : заболеваемость малярией связана со специфическими генотипами поверхностного антигена мерозоитов 2. Опыт Паразитол. 1995; 81: 90–96. [PubMed] [Google Scholar]
12. Фернерт А., Снуноу Г., Ингегерд Р., Бьоркман А. Суточная динамика Plasmodium falciparum субпопуляции у бессимптомных детей в голоэндемическом районе. Am J Trop Med Hyg. 1997; 56: 538–547. [PubMed] [Google Scholar]
13. Фельгер И. , Тавул Л., Бек Х.-П. Plasmodium falciparum : экспресс-метод генотипирования поверхностного белка мерозоитов 2. Exp Parasitol. 1993; 77: 372–375. [PubMed] [Google Scholar]
, Тавул Л., Бек Х.-П. Plasmodium falciparum : экспресс-метод генотипирования поверхностного белка мерозоитов 2. Exp Parasitol. 1993; 77: 372–375. [PubMed] [Google Scholar]
14. Hulier E, Pétour P, Snounou G, Nivez M-P, Miltgen F, Mazier D, Rénia L. Метод количественной оценки развития малярийного паразита в органах млекопитающего-хозяина. Мол Биохим Паразитол. 1996;77:127–135. [PubMed] [Google Scholar]
15. Ирион А., И. Фельгер, С. Абдулла, Т. Смит, Р. Малл, М. Таннер, К. Хац и Х.-П. Бек. Отличие рецидивов от новых инфекций с помощью анализа ПЦР-ПДРФ в сравнительном испытании CGP56697 и хлорохина у танзанийских детей. Троп. Мед. Междунар. Здоровье, в печати. [PubMed]
16. Jarra W, Brown K N. Защитный иммунитет к малярии: исследования с клонированными линиями Plasmodium chabaudi и P. berghei у мышей CBA/Ca. I. Эффективность меж- и внутривидовой специфичности иммунитета, индуцированного инфекцией. Иммунол от паразитов. 1985; 7: 595–606. [PubMed] [Google Scholar]
1985; 7: 595–606. [PubMed] [Google Scholar]
17. Jaureguiberry G, Hatin I, Auriol L D, Galibert G. ПЦР-выявление Plasmodium falciparum с помощью олигонуклеотидных зондов. Молекулярные зонды. 1990; 4: 409–414. [PubMed] [Google Scholar]
18. Каин К.С., Ланар Д.Е. Определение генетической изменчивости в пределах Plasmodium falciparum с помощью ферментативно амплифицированной ДНК из дисков фильтровальной бумаги, пропитанных цельной кровью. Дж. Клин Микробиол. 1991;29:1171–1174. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Ntoumi F, Mercereau-Puijalon O, Ossari S, Luty A, Reltien J, Georges A, Millet P. Plasmodium falciparum : серповидноклеточный признак связан с более высокой распространенностью множественных инфекций у габонских детей с бессимптомными инфекциями. Опыт Паразитол. 1997; 87: 39–46. [PubMed] [Google Scholar]
20. Paul R E L, Packer M J, Walmsley M, Lagog M, Ranford-Cartwright LC, Paru R, Day K P. Модели спаривания в популяциях малярийных паразитов в Папуа-Новой Гвинее. Наука. 1995;269:1709–1711. [PubMed] [Google Scholar]
Наука. 1995;269:1709–1711. [PubMed] [Google Scholar]
21. Пинто Дж., Арез А.П., Франко С., де Росарио В.Е., Палссон К., Джейнсон Т.Г.Т., Снуноу Г. Упрощенная методология ПЦР-исследования средней кишки комаров комплекса Anopheles gambiae , в котором могут быть идентифицированы вектор и вида Plasmodium . Энн Троп Мед Паразитол. 1997; 91: 217–219. [PubMed] [Google Scholar]
22. Ranford-Cartwright LC, Balfe P, Carter R, Walliker D. Частота перекрестного оплодотворения у человеческого малярийного паразита Plasmodium falciparum . Паразитология. 1993; 107:11–18. [PubMed] [Google Scholar]
23. Roper C, Elhassan I M, Hviid L, Giha H, Richardson W, Babiker H, Satti G M H, Theander TG, Arnot D E. Обнаружение инфекций очень низкого уровня Plasmodium falciparum с использованием вложенная полимеразная цепная реакция и переоценка эпидемиологии нестабильной малярии в Судане. Am J Trop Med Hyg. 1996; 54: 325–331. [PubMed] [Google Scholar]
24. Sambrook J, Fritsch E F, Maniatis T. Молекулярное клонирование: лабораторное руководство. 2-е изд. Колд-Спринг-Харбор, Нью-Йорк: Лабораторное издательство Колд-Спринг-Харбор; 1989. [Google Scholar]
Sambrook J, Fritsch E F, Maniatis T. Молекулярное клонирование: лабораторное руководство. 2-е изд. Колд-Спринг-Харбор, Нью-Йорк: Лабораторное издательство Колд-Спринг-Харбор; 1989. [Google Scholar]
25. Сневин В.А., Эррера М., Санчес Г., Шерф А., Лэнгсли Г., Эррера С. Полиморфизм аллелей поверхностных антигенов мерозоитов MSA1 и MSA2 у дикорастущих изолятов Plasmodium falciparum из Колумбии. Мол Биохим Паразитол. 1991; 49: 265–275. [PubMed] [Google Scholar]
26. Снуноу Г. и Х.-П. Бек. Использование ПЦР-генотипирования для оценки рецидива или повторного заражения после лечения противомалярийными препаратами. Паразитол. Сегодня в прессе. [ПубМед]
27. Снуну Г., Пиньейро Л., Гонсалвес А., Фонсека Л., Диас Ф., Браун К.Н., де Росарио В.Е. Важность чувствительного обнаружения малярийных паразитов у человека и комаров-хозяев в эпидемиологических исследованиях, как показано в анализе полевых образцов из Гвинеи-Бисау. Trans R Soc Trop Med Hyg. 1993; 87: 649–653. [PubMed] [Google Scholar]
1993; 87: 649–653. [PubMed] [Google Scholar]
28. Snounou G, Viriyakosol S, Jarra W, Thaithong S, Brown K N. Идентификация четырех видов малярии человека в полевых образцах с помощью полимеразной цепной реакции и обнаружение высокой распространенности смешанной инфекции. Мол Биохим Паразитол. 1993;58:283–292. [PubMed] [Google Scholar]
29. Snounou G, Viriyakosol S, Zhu X P, Jarra W, Pinheiro L, de Rosario V E, Thaithong S, Brown K N. Высокая чувствительность обнаружения малярийных паразитов человека с помощью вложенных полимеразной цепной реакции. Мол Биохим Паразитол. 1993; 61: 315–320. [PubMed] [Google Scholar]
30. Stoute J A, Slaoui M, Heppner D G, Momin P, Kester K E, Desmons P, Wellde B T, Garçon N, Krzych U, Marchand M, Ballou W R, Cohen J D. Предварительный оценка рекомбинантной циркумспорозоитной белковой вакцины против Plasmodium falciparum малярия. N Engl J Med. 1997; 336: 86–91. [PubMed] [Google Scholar]
31. Таллиаферро В. Х. Иммунитет к малярийным инфекциям. В: Бойд М. Ф., редактор. Маляриология. Комплексный обзор всех аспектов этой группы заболеваний с глобальной точки зрения. II. Филадельфия, Пенсильвания: The WB Saunders Co.; 1949. стр. 935–965. [Google Scholar]
В: Бойд М. Ф., редактор. Маляриология. Комплексный обзор всех аспектов этой группы заболеваний с глобальной точки зрения. II. Филадельфия, Пенсильвания: The WB Saunders Co.; 1949. стр. 935–965. [Google Scholar]
32. Тирасофон В., Понгликитмонгкол М., Вилаират П., Бунсэн В., Паньим С. Новое обнаружение одного Plasmodium falciparum в зараженной крови. Biochem Biophys Res Commun. 1991; 175: 179–184. [PubMed] [Google Scholar]
33. Tirasophon W, Rajkulchai P, Ponglikitmongkol M, Wilairat P, Boonsaeng V, Panyim S. Высокочувствительный, быстрый и простой метод полимеразной цепной реакции для выявления малярии человека ( Plasmodium falciparum и Plasmodium vivax ) в образцах крови. Am J Trop Med Hyg. 1994; 51: 308–313. [PubMed] [Google Scholar]
34. Viriyakosol S, Siripoon N, Petcharapirat C, Petcharapirat P, Jarra W, Thaithong S, Brown K N, Snounou G. Генотипирование Изоляты Plasmodium falciparum с помощью полимеразной цепной реакции и потенциального использования в эпидемиологических исследованиях. Bull W H O. 1995; 73: 85–95. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Bull W H O. 1995; 73: 85–95. [Бесплатная статья PMC] [PubMed] [Google Scholar]
35. Фон Зайдлейн Л., Джаффар С., Пиндер М., Хейвуд М., Снуноу Г., Гемперли Б., Гатманн И., Ройс С., Гринвуд Б. Лечение африканских детей с неосложненным falciparum malaria новым противомалярийным препаратом, CGP 56697. J Infect Dis. 1997;176:1113–1116. [PubMed] [Google Scholar]
36. Wooden J, Gould E E, Paul AT, Sibley C H. Plasmodium falciparum : простой метод полимеразной цепной реакции для дифференциации штаммов. Опыт Паразитол. 1992; 75: 207–212. [PubMed] [Google Scholar]
CDC — DPDx — Диагностические процедуры
Микроскопическое исследование до сих пор считается «золотым стандартом» диагностики паразитарных заболеваний. Если невозможно однозначно идентифицировать паразита, образец стула можно проанализировать с помощью молекулярных методов, таких как полимеразная цепная реакция (ПЦР). ПЦР-амплифицированные фрагменты можно анализировать с использованием полиморфизма длины рестрикционных фрагментов (ПДРФ) или секвенирования ДНК, если требуется дальнейшая характеристика.
Сбор образцов
Если требуется ПЦР для образца стула, образец должен быть собран в консерванте, совместимом с молекулярной детектированием. Фиксаторы/консерванты с приемлемой эффективностью для ПЦР включают TotalFix, Unifix, модифицированный ПВА (на основе цинка или меди) и Ecofix. Образцы стула в этих консервантах можно хранить и транспортировать при комнатной температуре. В качестве альтернативы образцы стула можно собрать в чистую пробирку и хранить без консервантов; однако эти образцы должны храниться в холоде или в замороженном виде и транспортироваться либо в охлажденном виде (4°C), либо в замороженном виде (перевозится с сухим льдом). Мазки, окрашенные трихромом (на E. histolytica / E. dispar ) или кислотоустойчивые мазки (для C. parvum или C. cayetanensis ) должны сопровождать образец стула при запросе ПЦР на любой из этих простейших. Все окрашенные мазки будут прочитаны в первую очередь, и если можно будет идентифицировать паразита, ПЦР не будет проводиться. Щелкните здесь для получения дополнительной информации о доставке образцов стула в CDC.
Щелкните здесь для получения дополнительной информации о доставке образцов стула в CDC.
Фиксаторы/консерванты, которые не рекомендуются для молекулярного обнаружения, включают формалин, SAF, LV-PVA и Protofix.
В особых случаях или когда коммерческие фиксаторы не подходят, фекалии можно смешивать с 2,5% дихроматом калия (разведение 1:1) или абсолютным этанолом (разведение 1:1) и отправлять в охлажденном виде.
Экстракция ДНК
Необходимо выделить ДНК из образцов стула для ПЦР-детекции. Нажмите, чтобы просмотреть протоколы выделения ДНК, рекомендованные для молекулярной диагностики кишечных паразитов.
ПЦР-анализ
Молекулярное обнаружение Cyclospora cayetanensis, Entamoeba histolytica и E. dispar проводят в CDC с помощью как традиционной ПЦР, так и ПЦР в реальном времени. Для микроспоридий доступна обычная ПЦР. Нажмите на ссылки выше, чтобы узнать больше о конкретных тестах и просмотреть анализ результатов ПЦР для соответствующих перечисленных паразитов.
Обычная ПЦР :
Препараты ДНК, выделенные из образцов фекалий, тестируются методом ПЦР с диагностическими праймерами. Амплифицированные фрагменты ДНК электрофоретически разделяют на агарозном геле для анализа результатов.
ПЦР в реальном времени
В ПЦР в реальном времени амплификацию ДНК контролируют путем измерения флуоресцентного сигнала, генерируемого в реакционном сосуде. Сигнал флуоресценции измеряется каждый цикл и пропорционален количеству накопленного продукта ПЦР.
ПЦР в реальном времени для обнаружения паразитов в CDC использует либо ДНК-связывающий краситель SYBR Green, либо специфичные для последовательности зонды TaqMan в качестве механизмов обнаружения флуоресценции. Анализы на основе зондов обладают преимуществами высокой специфичности и возможности обнаружения нескольких мишеней в одном и том же сосуде путем комбинирования зондов, меченных красителями с разными спектрами флуоресценции. Анализы с использованием SYBR Green могут быть проще и дешевле, но следует соблюдать осторожность, поскольку обнаруживается вся двухцепочечная ДНК, включая димеры праймеров и другие артефакты ПЦР. Специфичность этих анализов можно повысить, включив анализ кривой диссоциации (плавления). Это помогает отличить правильный продукт от возможных артефактов, что позволяет избежать ложноположительных результатов. См. иллюстрации для получения подробной информации о механизмах обнаружения флуоресценции с использованием зондов SYBR Green и TaqMan.
Специфичность этих анализов можно повысить, включив анализ кривой диссоциации (плавления). Это помогает отличить правильный продукт от возможных артефактов, что позволяет избежать ложноположительных результатов. См. иллюстрации для получения подробной информации о механизмах обнаружения флуоресценции с использованием зондов SYBR Green и TaqMan.
Для получения дополнительной информации о молекулярной диагностике с использованием образцов стула позвоните в Отдел паразитарных болезней по телефону (404) 718-4120.
Принцип обнаружения SYBR Green в ПЦР в реальном времени показан на рисунке выше. 1 В смесь для ПЦР (1) добавляют флуоресцентный краситель SYBR Green. SYBR Green — это ДНК-связывающий краситель, который сильно флуоресцирует при связывании с двухцепочечной ДНК. В начале реакции присутствует очень мало двухцепочечной ДНК, поэтому флуоресцентный сигнал, определяемый термоциклером, слаб (3). По мере протекания реакции и накопления продукта ПЦР увеличивается количество двухцепочечной ДНК, а вместе с ней и сигнал флуоресценции (4-5). Сигнал обнаруживается только во время отжига и удлинения, поскольку на стадии денатурации присутствует преимущественно одноцепочечная ДНК (6).
Сигнал обнаруживается только во время отжига и удлинения, поскольку на стадии денатурации присутствует преимущественно одноцепочечная ДНК (6).
Принцип TaqMan ПЦР в реальном времени показан на схеме выше. 1 Зонд TaqMan разработан таким образом, чтобы быть комплементарным определенной последовательности, в которую входят праймеры для ПЦР. Зонд TaqMan имеет репортерный краситель на 5-м конце и гасящий краситель на 3-м конце. Пока зонд не поврежден, а репортер и гаситель находятся в непосредственной близости, сигнал флуоресценции не излучается из-за эффекта гашения (черная стрелка на 1, 2 и 3) (1). После отжига зонда TaqMan (2) и праймеров (3) праймеры удлиняются ДНК-полимеразой. Когда полимераза достигает зонда TaqMan, она использует свою экзонуклеазную активность для удаления зонда по одному нуклеотиду за раз (4). Это освобождает репортер от близости гасителя и позволяет выпускать сигнал флуоресценции от репортера (5).
Ссылки
- да Силва А.
 , Пенязек Н. Последние достижения и тенденции в методах диагностики на основе ПЦР. В: Дионисио Д., редактор. Учебник-атлас кишечных инфекций при СПИДе. Спрингер; 2003. с. 397-412.
, Пенязек Н. Последние достижения и тенденции в методах диагностики на основе ПЦР. В: Дионисио Д., редактор. Учебник-атлас кишечных инфекций при СПИДе. Спрингер; 2003. с. 397-412.
Молекулярные тесты для обнаружения паразитов и диагностики заболеваний
Тесты полимеразной цепной реакции в основном используются в качестве подтверждающего теста для выявления паразитарной инфекции у пациента с помощью ДНК, полученной из паразитарных стадий.
24 февраля 2021 г. |
Д-р Лежен имеет степень бакалавра ветеринарии и животноводства Университета Пондишери, Индия, и степень магистра ветеринарной паразитологии сельскохозяйственного университета ANGR, Индия. Он защитил докторскую диссертацию в Университете Калгари, Канада, в 2010 году. Д-р Лежен работал паразитологом дикой природы в отделении Канадского кооператива по охране дикой природы в Альберте, а затем в 2016 году перешел в Корнельский университет. В настоящее время он занимает должность директора отдела клинической паразитологии. , он курирует секцию паразитологии в Диагностическом центре здоровья животных Корнелла (AHDC). Доктор Лежен является дипломантом Американского колледжа ветеринарных микробиологов с сертификатом ветеринарной паразитологии.
, он курирует секцию паразитологии в Диагностическом центре здоровья животных Корнелла (AHDC). Доктор Лежен является дипломантом Американского колледжа ветеринарных микробиологов с сертификатом ветеринарной паразитологии.
Прочитать статьи, написанные Manigandan Lejeune
dhvstockphoto/shutterstock.com
Диагностическая паразитология является важной дисциплиной в области диагностики болезней животных и неотъемлемым компонентом скрининга здоровья животных. Эта дисциплина процветала в 20-м веке с развитием классических методов паразитологии, которые позволяли просто обнаруживать паразитов прижизненно, таких как метод центробежной флотации Корнелла-Висконсина. Варианты и модификации этих проверенных временем методов остаются основой многих лабораторий диагностической паразитологии.
В то время как морфологическая оценка жизненных стадий паразита (например, яйца, цисты, ооцисты) в образцах фекалий часто может помочь в идентификации на таксономическом уровне (например, вид, род, семейство), важном для принятия информированных клинических решений о лечении и контроле, классическая паразитология инструменты имеют ограничения для однозначной идентификации некоторых видов.
Молекулярные методы могут обеспечить столь необходимое диагностическое разрешение, необходимое для эффективного лечения паразитарных заболеваний. Многие серологические и молекулярные тесты, такие как полимеразная цепная реакция (ПЦР), в настоящее время используются для специфического обнаружения паразитов. Эти тесты более распространены в исследовательских/академических учреждениях, но также предлагаются в коммерческих диагностических лабораториях.
Основные подходы ПЦР для обнаружения паразитов
ПЦР все чаще используется для подтверждения видов паразитов, когда морфологическое обнаружение является сложной задачей ( ВСТАВКА 1 ). Существует 2 основных подхода: видоспецифические анализы и универсальные анализы.
ВСТАВКА 1 Обзор полимеразной цепной реакции
Что это такое?
Полимеразная цепная реакция (ПЦР) представляет собой процесс, используемый для селективной амплификации (воспроизведения) определенного участка двухцепочечной ДНК, для которого известна фланкирующая последовательность.
Как это работает?
Базовая ПЦР состоит из 3 стадий:
1. Денатурация двойных цепей ДНК-матрицы
2. Отжиг праймеров к каждой цепи ДНК-матрицы
3. Удлинение праймера для синтеза новой цепи ДНК
В денатурация этап, матричная ДНК нагревается до 94°C для разделения комплементарных цепей. Затем температуру понижают (обычно до 50–65°C), чтобы дать возможность праймерам рекомбинировать с или отжигают с их комплементарными мишенями на матричной ДНК. Температура отжига определяется температурой плавления (T m ) двух грунтовок. Последним этапом является удлинение , во время которого ДНК-полимераза продуцирует комплементарную копию цепи матричной ДНК, начиная с места прикрепления праймера ПЦР, с использованием дезоксинуклеотидтрифосфатов (dNTP) в реакционной смеси (буфер для ПЦР, MgCl 2 ). Температура удлинения определяется специфическими термостабильными полимеразами и обычно составляет около 72°C. Реакционную смесь нагревают до определенных температур в течение заданного времени и заданного количества циклов (от 35 до 45 циклов) с использованием термоциклера. Матрица исходной ДНК амплифицируется экспоненциально, так что одна ДНК-матрица может быть амплифицирована 35 миллиардов раз к концу 35 циклов ПЦР.
Реакционную смесь нагревают до определенных температур в течение заданного времени и заданного количества циклов (от 35 до 45 циклов) с использованием термоциклера. Матрица исходной ДНК амплифицируется экспоненциально, так что одна ДНК-матрица может быть амплифицирована 35 миллиардов раз к концу 35 циклов ПЦР.
Видоспецифические ПЦР-анализы
Видоспецифические анализы позволяют эксклюзивно обнаруживать виды паразитов даже среди близких родственников. Для этих тестов предыдущие исследования выявили область ДНК, которая уникальна для интересующего вида паразита (скажем, вида X). Затем разрабатываются специальные праймеры для точной амплификации этой области. При таком подходе только ПЦР-амплификация подтверждает идентификацию паразита как вида X, и дальнейшее секвенирование продуктов ПЦР не требуется. Это, в свою очередь, сокращает время выполнения этих анализов (обычно в тот же день).
Универсальные анализы ПЦР
Универсальные анализы обычно амплифицируют «вариабельную область» ДНК (уникальную для каждого паразита), окруженную «консервативными областями» (идентичными для всех родственных видов). Универсальные праймеры на основе консервативных участков ДНК позволяют амплифицировать вариабельные области всех родственных видов. Продукты амплифицированной ПЦР далее секвенируют и ищут в общедоступных базах данных для определения идентичности паразита. Этот подход позволяет идентифицировать интересующий паразит или другие близкородственные виды в одном цикле ПЦР.
Универсальные праймеры на основе консервативных участков ДНК позволяют амплифицировать вариабельные области всех родственных видов. Продукты амплифицированной ПЦР далее секвенируют и ищут в общедоступных базах данных для определения идентичности паразита. Этот подход позволяет идентифицировать интересующий паразит или другие близкородственные виды в одном цикле ПЦР.
Требование секвенирования для этого подхода увеличивает время выполнения универсальных анализов (от 2 до 5 дней) по сравнению с видоспецифическим тестированием. Наиболее известными участками ДНК (маркерами), используемыми в универсальных анализах, являются внутренние транскрибируемые спейсеры (ITS), цитохром-с-оксидаза (CO) и ген малой субъединицы рРНК 18S (18S).
Когда использовать ПЦР
В лабораториях диагностической паразитологии ПЦР стратегически используется в дополнение к традиционным методам, в основном для устранения диагностических ограничений последних. Надлежащее использование молекулярных методов для окончательного обнаружения паразитов зависит от необходимости различать морфологически сходные виды.
Например, цисты размером 9–13 × 7–9 мкм ( РИСУНОК 1 ), наблюдаемые при флотации фекалий с сульфатом цинка в образце кошачьих фекалий, могут быть морфологически идентифицированы как принадлежащие к роду Giardia . Дальнейшая идентификация до видов или групп от A до G невозможна, так как цисты Giardia неразличимы. Кошки могут быть инфицированы Giardia duodenalis , сборка F и/или сборка A, и последняя представляет зоонозную опасность. 1 ПЦР-тестирование на основе праймеров, разработанных для 2 консервативных областей, граничащих с вариабельной областью локуса β-гиардина (т. е. универсальный анализ), обычно проводится для дифференциации Сборки Giardia . 2
Рисунок 1. Цисты Giardia , наблюдаемые в кошачьих фекалиях, обработанных флотацией сульфатом цинка. Они не могут быть дифференцированы морфологически на виды или группы.
Напротив, яйцеклетки Dipylidium caninum (блошиный цепень; РИСУНОК 2 ) морфологически различны, и только один вид Dipylidium заражает собак. 3 Таким образом, идентификация этого яичного пакета при микроскопическом исследовании образца фекалий собаки должна подтверждать D caninum , и дальнейший молекулярный анализ/подтверждение не требуется.
3 Таким образом, идентификация этого яичного пакета при микроскопическом исследовании образца фекалий собаки должна подтверждать D caninum , и дальнейший молекулярный анализ/подтверждение не требуется.
Рисунок 2. Пакет с яйцами, извлеченный из сегмента Dipylidium caninum , выделенного в экскрементах собаки.
Когда использовать видоспецифические ПЦР-анализы
Видоспецифичные ПЦР обычно используются для подтверждения или исключения целевого вида паразита, особенно когда требуется более быстрый результат. Например, видоспецифическая ПЦР может быть показана собаке с зараженным цепнем тениидным цепнем, чтобы определить, Присутствует Echinococcus multilocularis (зоонозный вид). Яйца E multilocularis ( РИСУНОК 3 ) морфологически неотличимы от яиц других представителей семейства Taeniidae; поэтому морфологическая диагностика этих яиц позволяет идентифицировать паразита как Taeniidae, но не как род или вид. Однако заинтересованный владелец ожидает, что диагностическая лаборатория быстро идентифицирует вид. Видоспецифический ПЦР-анализ, основанный на уникальном участке нуклеотидов в гене субъединицы 1 дегидрогеназы NADH (никотинамидадениндинуклеотидный водород) ( ND1 ) из E multilocularis обладает 100% специфичностью обнаружения. 4
Однако заинтересованный владелец ожидает, что диагностическая лаборатория быстро идентифицирует вид. Видоспецифический ПЦР-анализ, основанный на уникальном участке нуклеотидов в гене субъединицы 1 дегидрогеназы NADH (никотинамидадениндинуклеотидный водород) ( ND1 ) из E multilocularis обладает 100% специфичностью обнаружения. 4
Рис. 3. Яйцо семейства Taeniidae, которое включает рода Echinococcus и рода Taenia . Яйца этих видов морфологически неразличимы.
Другие примеры использования специфической ПЦР включают выявление Dirofilaria immitis (собачий сердечный червь) в образце крови собаки и Toxoplasma gondii в кошачьих фекалиях. Видоспецифический ПЦР-анализ, нацеленный на область в CO1 гена D immitis устраняет необходимость в специальных знаниях, чтобы визуально отличить микрофилярии сердечного червя от других паразитов. 5 Точно так же ооцисты T gondii (зоонозного простейшего), выделяющиеся с кошачьими фекалиями ( РИСУНОК 4 ), напоминают ооцисты Hammondia hammondi , менее известного простейшего паразита кошек. Специфический анализ ПЦР, основанный на уникальном повторяющемся элементе из 529 пар оснований, используется для точного обнаружения T gondii 9.0281 . 6
Специфический анализ ПЦР, основанный на уникальном повторяющемся элементе из 529 пар оснований, используется для точного обнаружения T gondii 9.0281 . 6
Рисунок 4. Ооцисты, подобные Toxoplasma gondii , извлеченные из кошачьих фекалий, которые напоминают ооцисты Hammondia hammondi . Яйцо Toxocara cati (желтая стрелка) находится на заднем плане вдали от плоскости фокуса. Предоставлено Джейми Хазардом, AHDC, Корнельский университет.
Недостатком видоспецифичной ПЦР является то, что она не выявляет заражение родственными паразитами. Несмотря на это ограничение, диагностические лаборатории предпочитают видоспецифичную ПЦР для решения конкретных задач.
Когда использовать универсальные тесты ПЦР
Если целью является более полное обнаружение паразитов, а не быстрое решение, универсальные тесты могут пригодиться. Для сценария, упомянутого выше для E multilocularis , если владельцы могут быть убеждены в диагностическом преимуществе обнаружения видов Taeniidae, отличных от E multilocularis , существует универсальный анализ для тениид на основе гена CO1 . 7 Этот анализ был разработан на основе эволюционно консервативных областей CO1 , граничащие с вариабельной областью, обеспечивающей необходимое разрешение для дифференциации всех представителей родов Echinococcus (включая E granulosus и E canadensis ) и Taenia . Аналогично, универсальная ПЦР (на основе гена 18S ) используется для идентификации Babesia canis vogeli и Babesia canis canis в собачьей крови. 8 Исследование мазка крови не позволяет дифференцировать эти 2 крупных Бабезии видов, и универсальный анализ ПЦР является более решающим.
7 Этот анализ был разработан на основе эволюционно консервативных областей CO1 , граничащие с вариабельной областью, обеспечивающей необходимое разрешение для дифференциации всех представителей родов Echinococcus (включая E granulosus и E canadensis ) и Taenia . Аналогично, универсальная ПЦР (на основе гена 18S ) используется для идентификации Babesia canis vogeli и Babesia canis canis в собачьей крови. 8 Исследование мазка крови не позволяет дифференцировать эти 2 крупных Бабезии видов, и универсальный анализ ПЦР является более решающим.
Investigative Parasitology
Несмотря на отсутствие полной информации о последовательностях ДНК для многих паразитов, имеющих ветеринарное значение, универсальный подход ПЦР позволил получить столь необходимую информацию о маркерах ДНК для распространенных паразитов, которая доступна в общедоступных базах данных последовательностей. Это, в свою очередь, способствовало использованию универсальной ПЦР в качестве преобладающего инструмента для исследовательской диагностической паразитологии.
Это, в свою очередь, способствовало использованию универсальной ПЦР в качестве преобладающего инструмента для исследовательской диагностической паразитологии.
В целом паразитологи используют классические навыки, чтобы сузить идентификацию паразитов до самого низкого возможного таксономического уровня и, при необходимости, прибегают к универсальной ПЦР для идентификации конкретных видов. Например, ооцисты размером от 5 до 6 мкм ( РИСУНОК 5 ) принадлежат к роду Cryptosporidium . Однако в этом роде насчитывается более 26 действительных видов, и ооцисты большинства из них морфологически неразличимы. Ни тест на плавучесть, ни доступный Cryptosporidium иммуноферментный анализ (ELISA) помогает в идентификации видов. Собаки могут быть инфицированы C canis и/или C parvum, , оба из которых обладают зоонозным потенциалом. 9 Иногда ооцисты других видов Cryptosporidium могут проходить через кишечник собаки как ложные паразиты. Реальную озабоченность по поводу передачи Cryptosporidium владельцам/дрессировщикам собак нельзя решить, если вид не идентифицирован. В этой ситуации универсальный ПЦР-анализ на основе 9Локус гена 0280 18S может обеспечить необходимое разрешение для дифференциации каждого вида Cryptosporidium . 9
Реальную озабоченность по поводу передачи Cryptosporidium владельцам/дрессировщикам собак нельзя решить, если вид не идентифицирован. В этой ситуации универсальный ПЦР-анализ на основе 9Локус гена 0280 18S может обеспечить необходимое разрешение для дифференциации каждого вида Cryptosporidium . 9
Рис. 5. Ооцисты Cryptosporidium с характерным розовым оттенком при флотации сахаром. Ооцисты большинства валидных видов Cryptosporidium не поддаются морфологической дифференциации.
Ложный паразитизм
ПЦР эффективно используется для решения проблем диагностики паразитов, связанных с животными-компаньонами, таких как выявление ложного паразитизма у собак; то есть обнаружение паразитов в фекалиях собак, для которых собаки не являются подходящим хозяином. Собаки печально известны поеданием фекалий других животных. 10
Невыявление ложного паразитизма может привести к ненужному лечению. Например, обнаружение яиц стронгильного типа размером ~60 × 40 мкм ( РИСУНОК 6 ) в фекалиях собак обычно интерпретируется как заражение Ancylostoma caninum (собачий анкилостомоз). Если на самом деле собака съела кошачьи фекалии и передает Ancylostoma tubaeforme как ложного паразита, микроскопическая дифференциация видов невозможна. Извлечение ДНК из этих яиц и проведение универсальной ПЦР для амплификации и секвенирования маркера ITS-1 позволит установить идентичность паразита. 11 Аналогичным образом, с помощью ПЦР ITS-2 можно определить, имеют ли ложные яйца стронгильного типа жвачное или лошадиное происхождение. 12
Если на самом деле собака съела кошачьи фекалии и передает Ancylostoma tubaeforme как ложного паразита, микроскопическая дифференциация видов невозможна. Извлечение ДНК из этих яиц и проведение универсальной ПЦР для амплификации и секвенирования маркера ITS-1 позволит установить идентичность паразита. 11 Аналогичным образом, с помощью ПЦР ITS-2 можно определить, имеют ли ложные яйца стронгильного типа жвачное или лошадиное происхождение. 12
Рисунок 6. (A) Яйца Strongyle в фекалиях собак, предположительно Ancylostoma caninum .
Рисунок 6. (B) Яйца Strongyle от домашнего жвачного животного. Яйца A caninum трудно отличить от Ancylostoma tubaeforme кошек и других яиц стронгильного типа жвачных животных и лошадей, которые являются обычными ложными паразитами у собак.
Другие применения ПЦР-тестирования
ПЦР также можно использовать для выявления/подтверждения макроскопических образцов паразитов, которые выделяются с фекалиями или извлекаются из организма хозяина. Например, червя, извлеченного из передней камеры глаза собаки, обычно подозревают как Thelazia , Dirofilaria или Onchocerca . Если образец не подходит для морфологии, использование универсального анализа ПЦР на основе гена субъединицы 5 НАДН-дегидрогеназы ( ND5 ) может помочь в идентификации любого из этих видов в одном цикле ПЦР. 13-15
Например, червя, извлеченного из передней камеры глаза собаки, обычно подозревают как Thelazia , Dirofilaria или Onchocerca . Если образец не подходит для морфологии, использование универсального анализа ПЦР на основе гена субъединицы 5 НАДН-дегидрогеназы ( ND5 ) может помочь в идентификации любого из этих видов в одном цикле ПЦР. 13-15
Образцы, собранные при вскрытии, также можно исследовать с помощью ПЦР. В этих случаях патологоанатомы часто обращаются за молекулярной помощью для идентификации паразитов в гистологических срезах, как правило, для подтверждения видов простейших из таких родов, как Sarcocystis , Toxoplasma , Neospora и Hammondia , тканевые стадии которых представляют собой задача дифференцировать. Можно идентифицировать многих распространенных паразитов (включая гельминтов и членистоногих) с помощью ПЦР при условии, что данные о более широкой таксономии паразита получены с помощью гистологии.
Подготовка образца для ПЦР-тестирования
Успех ПЦР для обнаружения паразитов зависит от различных факторов, главным из которых является образец, используемый для первоначального выделения ДНК. Использование фиксаторов, таких как формалин, ухудшает диссоциацию нити ДНК, что является необходимым шагом для амплификации методом ПЦР. Таким образом, для ПЦР-тестирования крайне важно представить образцы фекалий в свежем/охлажденном виде и макроскопических паразитов в консерванте 70% этанола. Фиксированные в формалине образцы паразитов, в том числе свитки тканей, залитые парафином, требуют специального протокола выделения ДНК, который может ограничивать качество ДНК, необходимое для успешной ПЦР.
Ограничения ПЦР
В настоящее время молекулярное обнаружение паразитов не считается альтернативой классическому тестированию. Хотя в некоторых случаях он используется для диагностики препатентных инфекций у собак, в основном он используется в качестве подтверждающего теста для выявления патентованной паразитарной инфекции с помощью ДНК, полученной из стадий паразита. Препятствий на пути внедрения молекулярной паразитологической диагностики много. Разработка молекулярных анализов в качестве единственного диагностического инструмента для обнаружения паразитов потребует утомительных процессов проверки, которые находятся за пределами возможностей многих диагностических паразитологических лабораторий. Что еще более важно, риск гипердиагностики вырисовывается. Например, исследование обнаружило доказательства ПЦР T gondii ДНК в фекалиях кошки без активной кишечной инфекции; присутствовала жертва, зараженная стадией паразита «-zoite», которая служила источником ДНК. 16 Такие результаты следует интерпретировать с осторожностью.
Препятствий на пути внедрения молекулярной паразитологической диагностики много. Разработка молекулярных анализов в качестве единственного диагностического инструмента для обнаружения паразитов потребует утомительных процессов проверки, которые находятся за пределами возможностей многих диагностических паразитологических лабораторий. Что еще более важно, риск гипердиагностики вырисовывается. Например, исследование обнаружило доказательства ПЦР T gondii ДНК в фекалиях кошки без активной кишечной инфекции; присутствовала жертва, зараженная стадией паразита «-zoite», которая служила источником ДНК. 16 Такие результаты следует интерпретировать с осторожностью.
Заключение
В отличие от использования расширенной диагностики для выявления бактериальной или вирусной этиологии, многие клиницисты считают молекулярное тестирование на наличие паразитов вспомогательным и неоправданно дорогим. Любые новые передовые паразитологические тесты, даже предназначенные для экспресс-диагностики, требуют обоснования затрат и клинической значимости. Поэтому разумно использовать молекулярные достижения в дополнение к классическим методам идентификации для эффективного удовлетворения диагностических потребностей клинициста.
Поэтому разумно использовать молекулярные достижения в дополнение к классическим методам идентификации для эффективного удовлетворения диагностических потребностей клинициста.
Ссылки
Ballweber LR, Xiao L, Bowman DD, et al. Лямблиоз у собак и кошек: обновленная информация об эпидемиологии и значении для общественного здравоохранения. Тренды Паразитол 2010;26(4):180-189.
Лалле М., Поцио Э., Капелли Г. и др. Генетическая гетерогенность локуса b-giardin среди изолятов человека и животных Giardia duodenalis и идентификация потенциально зоонозных субгенотипов. Int J Parasitol 2005;35(2):207-213.
Zajac AM, Conboy GA. Исследование кала для диагностики паразитизма. В кн.: Ветеринарная клиническая паразитология. 8 -й -й изд. Чичестер, Западный Сассекс: Уайли Блэквелл; 2012:72-73.
Trachsel D, Deplazes P, Mathis A. Идентификация яиц тениид в фекалиях хищников на основе мультиплексной ПЦР с использованием мишеней в митохондриальной ДНК. Паразитология 2007;134(Pt 6):911-920.
Паразитология 2007;134(Pt 6):911-920.
О И.Ю., Ким К.Т., Сун Х.Дж. Молекулярное обнаружение Dirofilaria immitis специфический ген из образца крови инфицированной собаки с использованием полимеразной цепной реакции. Иран J Parasitol 2017;12(3):433-440.
Reischl U, Bretagne S, Kruger D, et al. Сравнение двух ДНК-мишеней для диагностики токсоплазмоза с помощью ПЦР в реальном времени с использованием гибридизационных зондов с переносом энергии флуоресцентного резонанса. BMC Infect Dis 2003;3:7.
Боулз Дж., Блэр Д., Макманус Д.П. Молекулярно-генетическая характеристика штамма оленей («северная форма») Echinococcus granulosus . Паразитология 1994;109(Pt 2):215-221.
Rucksaken R, Maneeruttanarungroj C, Maswanna T, et al. Сравнение обычной полимеразной цепной реакции и обычного мазка крови для обнаружения Babesia canis , Hepatozoon canis , Ehrlichia canis и Anaplasma platys в провинции Бурирам, Таиланд. Vet World 2019;12(5):700-705.
Vet World 2019;12(5):700-705.
Сяо Л., Эскаланте Л., Ян С. и др. Филогенетический анализ 9Паразиты 0280 Cryptosporidium на основе локуса гена малой субъединицы рРНК. Appl Environ Microbiol 1999;65(4):1578-1583.
Слосс МВт. Ложные паразиты у собаки. Университет штата Айова Ветеринар 1939;1(2): Статья 8.
Liu Y, Zheng G, Alsarakibi M, et al. Молекулярная идентификация Ancylostoma caninum , выделенного от кошек в Южном Китае, на основе полной последовательности ITS. BioMed Res Int 2013; 2013:868050.
Гассер Р.Б., Чилтон Н.Б., Хосте Х., Беверидж И. Быстрое секвенирование рДНК отдельных червей и яиц паразитических гельминтов. Nucleic Acids Res 1993;21(10):2525-2526.
Verocai GG, Hassan HK, Lakwo T и др. Молекулярная идентификация Onchocerca spp. личинок Simulium Damnosum sensu lato, собранных в Северной Уганде. Am J Trop Med Hyg 2017;97(6):1843-1845.
Лю Г.Х., Гассер Р. Б., Отранто Д. и др. Митохондриальный геном глазного червя, Thelazia callipaeda (Nematoda: Spirurida), как первый представитель семейства Thelaziidae. PLoS Negl Trop Dis 2013;7(1):e2029.
Б., Отранто Д. и др. Митохондриальный геном глазного червя, Thelazia callipaeda (Nematoda: Spirurida), как первый представитель семейства Thelaziidae. PLoS Negl Trop Dis 2013;7(1):e2029.
Ху М., Гассер Р.Б., Абс Эль-Оста Ю.Г., Чилтон Н.Б. Структура и организация митохондриального генома сердечного червя собак, Dirofilaria immitis . Паразитология 2003;127(Pt 1):37-51.
Poulle ML, Forin-Wiart MA, Josse-Dupuis E, et al. Обнаружение ДНК Toxoplasma gondii с помощью количественной ПЦР в фекалиях кошки, которая недавно проглотила инфицированную добычу, не обязательно означает выделение ооцист. Паразит 2016;23:29.
Выбор мишеней, оценка лабораторных анализов и сравнение с коммерческими наборами
На этой странице и замена ПЦР привлекательна. Почти все случаи диареи, вызванной паразитами, за девятилетний период в нашей лаборатории были вызваны 9Виды 0280 Giardia lamblia , Cryptosporidium или Entamoeba histolytica , обнаруженные при микроскопии. Мы оценили и отобрали одиночные анализы ПЦР в реальном времени (ОТ-ПЦР) для этих патогенов в 99 образцах стула от пациентов с подозрением на кишечный паразитоз, проверенных с помощью микроскопии. Стратегия включала родоспецифический ПЦР-анализ для C. parvum и C. hominis с последующей идентификацией с помощью ПЦР, позволяющей различать эти два вида. G. lamblia был обнаружен в пяти и C. parvum в одном из 68 микроскопически отрицательных образцов. Эффективность собственных анализов ОТ-ПЦР сравнивали с тремя коммерчески доступными наборами мультиплексных тестов (МТ-ПЦР) в 81 образце стула, собранном в 28 положительных при микроскопии и 27 отрицательных при микроскопии образцах от лиц с подозрением на кишечный паразитоз и в 26 пробах от лиц без подозрения на паразитарную инфекцию. Собственные анализы выявили паразитов в большем количестве образцов от пациентов с подозрением на паразитоз, чем любой из наборов. Мы пришли к выводу, что коммерческие наборы нацелены на соответствующих паразитов, но их эффективность может различаться.
Мы оценили и отобрали одиночные анализы ПЦР в реальном времени (ОТ-ПЦР) для этих патогенов в 99 образцах стула от пациентов с подозрением на кишечный паразитоз, проверенных с помощью микроскопии. Стратегия включала родоспецифический ПЦР-анализ для C. parvum и C. hominis с последующей идентификацией с помощью ПЦР, позволяющей различать эти два вида. G. lamblia был обнаружен в пяти и C. parvum в одном из 68 микроскопически отрицательных образцов. Эффективность собственных анализов ОТ-ПЦР сравнивали с тремя коммерчески доступными наборами мультиплексных тестов (МТ-ПЦР) в 81 образце стула, собранном в 28 положительных при микроскопии и 27 отрицательных при микроскопии образцах от лиц с подозрением на кишечный паразитоз и в 26 пробах от лиц без подозрения на паразитарную инфекцию. Собственные анализы выявили паразитов в большем количестве образцов от пациентов с подозрением на паразитоз, чем любой из наборов. Мы пришли к выводу, что коммерческие наборы нацелены на соответствующих паразитов, но их эффективность может различаться.
1. История вопроса
Правильная идентификация микробных агентов, вызывающих диарею у людей, имеет решающее значение для оптимального лечения. Обнаружение болезнетворных кишечных паразитов традиционно проводится путем микроскопического исследования образцов стула. За последние годы это было изменено в пользу использования ПЦР. Исследования показали, что как чувствительность, так и специфичность ПЦР лучше по сравнению с микроскопией [1–5]. Более того, микроскопия может привести к ложным выводам, когда безобидные паразиты интерпретируются как болезнетворные, а опасные для жизни паразиты могут не обнаруживаться. В частности, это было продемонстрировано для кишечной амебы [6–10]. Для оценки истинного воздействия паразитарных кишечных инфекций важно установить действительные и надежные лабораторные методы тестирования образцов стула пациентов. Использование оптимизированных лабораторных методов повысит безопасность пациентов за счет быстрой и правильной диагностики, что приведет к своевременному началу соответствующего лечения.
Целью данного исследования была оценка последствий замены микроскопии ПЦР в реальном времени (ОТ-ПЦР) для выявления кишечных паразитов, вызывающих диарею. Для этого мы сначала установили, какие паразиты были обнаружены с помощью микроскопии в нашей лаборатории в течение девяти лет, чтобы определить, какие паразиты имеют отношение к нашей популяции пациентов. Мы определили, какие ранее обнаруженные паразиты будут упущены при введении ограниченного числа видоспецифичных ПЦР-анализов и сколько случаев они представляли. Затем мы оценили эффективность собственных одиночных анализов ОТ-ПЦР для трех наиболее важных кишечных паразитарных патогенов. Наконец, производительность трех выбранных собственных анализов ОТ-ПЦР для обнаружения Giardia lamblia , Cryptosporidium parvum / Cryptosporidium hominis, и Entamoeba histolytica сравнивали с тремя коммерческими наборами для мультиплексной ПЦР в реальном времени (МТ-ПЦР).
Были определены две конкретные цели: (1) оценка эффективности видовоспецифических внутренних анализов ОТ-ПЦР для обнаружения G. lamblia , C. parvum / C. hominis, и E. histolytica в образцах стула для исследования на наличие паразитов; (2) сравнение эффективности собственных анализов RT-PCR с эффективностью трех коммерческих наборов MT-PCR для обнаружения одних и тех же паразитов.
lamblia , C. parvum / C. hominis, и E. histolytica в образцах стула для исследования на наличие паразитов; (2) сравнение эффективности собственных анализов RT-PCR с эффективностью трех коммерческих наборов MT-PCR для обнаружения одних и тех же паразитов.
2. Методы
2.1. Сбор данных из Лабораторной информационной системы (ЛИС)
Данные о пробах фекалий, исследованных на наличие паразитов с октября 2005 г. по январь 2015 г., были извлечены из электронной ЛИС. Регистрировали общее количество образцов и пациентов и результаты микроскопии.
2.2. Образцы стула
В общей сложности 125 образцов стула, из которых 99 были исследованы с помощью микроскопии на подозрение на паразитоз, были случайным образом взяты у лиц с желудочно-кишечными жалобами в период с июня 2010 г. по январь 2015 г. Девяносто девять из этих образцов были включены для объективной цели (31). микроскопия-положительные и 68 микроскопии-отрицательные) и восемьдесят один (28 микроскопия-положительные и 27 микроскопия-отрицательные) были включены для второй цели тестирования. Кроме того, для второй цели были включены 26 образцов от лиц без подозрения на паразитоз без микроскопии.
Кроме того, для второй цели были включены 26 образцов от лиц без подозрения на паразитоз без микроскопии.
Для цели 1 было проанализировано в общей сложности 99 образцов с помощью внутренней ОТ-ПЦР. Для цели 2 был проанализирован в общей сложности 81 образец с помощью собственной ОТ-ПЦР и трех коммерческих наборов для MT-ПЦР. Все образцы хранились при температуре -80°C до проведения ПЦР.
2.3. Микроскопия кишечных паразитов
Микроскопическое исследование на наличие яйцеклеток и кист обычно проводилось путем исследования окрашенных йодом влажных препаратов после концентрации формалина в этилацетате при увеличении ×400 [11]. По специальному запросу и когда видов Cryptosporidium , видов Cyclospora или видов Cystoisospora были заподозрены при рутинной микроскопии, также исследовали мазок, окрашенный модифицированным методом Циля-Нильсена [12].
2.4. Внутренняя ОТ-ПЦР
Для внутренних ПЦР ДНК экстрагировали с помощью системы NucliSENS easyMAG (bioMérieux, Франция) в соответствии с инструкциями производителя. Перед выделением ДНК ватный тампон погружали в образец кала и суспендировали в 4 мл физиологического раствора NaCl. Перед выделением ДНК к каждому образцу добавляли внутреннюю экстракцию и ПЦР-контроль, герпесвирус фоцин (лабораторный штамм PhHV) [13]. Нуклеиновые кислоты элюировали при 100 мк мкл и сразу обрабатывали для ПЦР.
Перед выделением ДНК ватный тампон погружали в образец кала и суспендировали в 4 мл физиологического раствора NaCl. Перед выделением ДНК к каждому образцу добавляли внутреннюю экстракцию и ПЦР-контроль, герпесвирус фоцин (лабораторный штамм PhHV) [13]. Нуклеиновые кислоты элюировали при 100 мк мкл и сразу обрабатывали для ПЦР.
Обнаружение трех кишечных паразитов ( G. lamblia, C. parvum / C. hominis, и E. histolytica ) было выполнено с помощью одиночной ОТ-ПЦР в 99 образцах, проанализированных как дубликаты. Один анализ был протестирован на обнаружение G. lamblia , три были протестированы на C. parvum / C. hominis , и один анализ (анализ 3) был включен для различения C. parvum и С. hominis. Наконец, был протестирован один анализ для E. histolytica с использованием праймеров и зондов (таблица 1), описанных ранее [1, 4, 13–16].
Реакционная смесь 25 мк мкл содержала 1x TaqMan® Fast Universal PCR Master Mix, 2x No AmpErase® UNG (Thermo Fisher Scientific, Уолтем, Массачусетс, США), 1000 нМ праймеров и 200 нМ зондов и 5 мк мкл ДНК-элюат.
ПЦР в реальном времени проводили с использованием термоциклера для быстрой ПЦР в реальном времени Applied Biosystems 7500 (Thermo Fisher Scientific) при следующих условиях циклирования: 95°C в течение 20 сек, затем 45 циклов: 95 °C в течение 3 сек и 60 °C в течение 30 сек.
Продукты ПЦР анализировали с использованием программного обеспечения Sequence Detection Software v.1.4 (Thermo Fisher Scientific). Порог ручного цикла был установлен на 0,1 с автоматическим базовым уровнем. Образец считался положительным, если значение Ct было ≤42 и имело экспоненциальную кривую. Отрицательные и положительные контроли экстракции и ПЦР были включены во все ПЦР-анализы.
Однокомпонентный анализ RT-PCR собственного производства на G. lamblia , C. parvum / C. hominis (анализ 1) и E. histolytica были названы набором A и сравнивались с тремя коммерческими наборами MT-PCR, использованными в задаче 2 на 79 образцах.
2.5. Наборы для диагностических тестов
Были протестированы три различных доступных на рынке набора: RIDA®GENE Parasitic Stool Panel (PG1705) от R-Biopharm AG, Дармштадт, Германия (набор B), LightMix® Modular Gastroenteritis Assays от TIB MOLBIOL, Берлин, Германия (набор C) и панель BD MAX™ Enteric Parasite Panel от BD Diagnostic, Франклин Лейкс, Нью-Джерси, США (набор D). Экстракцию ДНК для наборов B и C проводили, как описано для внутренних анализов. Для набора D экстракцию ДНК проводили в соответствии с инструкциями панели BD MAX для панели кишечных паразитов в системе BD MAX. Во всех коммерческих наборах мы использовали ДНК внутреннего контроля, которая была рекомендована и включена в наборы. Семьдесят девять образцов были протестированы в двух повторностях во всех трех наборах в соответствии с инструкциями производителя. Для набора B анализы ПЦР проводили с использованием термоциклера Applied Biosystems 7500 Fast Real-Time PCR Thermocycler со следующими условиями циклирования: 1 мин при 95°C, затем 45 циклов 95°C в течение 15 секунд и 60°C в течение 30 секунд. Для набора C анализы ПЦР проводились на приборе реального времени Roche LightCycler 480® II при следующих условиях циклирования: 10 мин при 95 °C, затем 50 циклов при 95 °C в течение 5 с, при 62 °C в течение 5 с. , и 72°C в течение 15 сек. Для набора D анализ проводили в соответствии с инструкциями панели BD MAX для определения кишечных паразитов в системе BD MAX.
Экстракцию ДНК для наборов B и C проводили, как описано для внутренних анализов. Для набора D экстракцию ДНК проводили в соответствии с инструкциями панели BD MAX для панели кишечных паразитов в системе BD MAX. Во всех коммерческих наборах мы использовали ДНК внутреннего контроля, которая была рекомендована и включена в наборы. Семьдесят девять образцов были протестированы в двух повторностях во всех трех наборах в соответствии с инструкциями производителя. Для набора B анализы ПЦР проводили с использованием термоциклера Applied Biosystems 7500 Fast Real-Time PCR Thermocycler со следующими условиями циклирования: 1 мин при 95°C, затем 45 циклов 95°C в течение 15 секунд и 60°C в течение 30 секунд. Для набора C анализы ПЦР проводились на приборе реального времени Roche LightCycler 480® II при следующих условиях циклирования: 10 мин при 95 °C, затем 50 циклов при 95 °C в течение 5 с, при 62 °C в течение 5 с. , и 72°C в течение 15 сек. Для набора D анализ проводили в соответствии с инструкциями панели BD MAX для определения кишечных паразитов в системе BD MAX. Положительный результат в наборах считался положительным, если положительным был один из двух дубликатов, использованных в задаче 2.
Положительный результат в наборах считался положительным, если положительным был один из двух дубликатов, использованных в задаче 2.
2.6. Анализ
Критерий Макнемара был использован для статистического сравнения парных данных в задаче 1.
2.7. Этика, биобанк и хранение данных
Исследование является частью программы Ph.D. проект и одобрен Датским агентством по защите данных (j.nr. 2008-58-0035). Все образцы хранились при температуре -80°C в утвержденном исследовательском биобанке, созданном для исследования. Данные хранились на утвержденном и безопасном портале, принадлежащем региону Южной Дании.
3. Результаты
3.1. LIS Data
В период с октября 2005 г. по январь 2015 г. на наличие кишечных паразитов исследовано 10593 образца от 4887 пациентов. По данным микроскопии, вызывающими диарею паразитами были видов G. lamblia (500 образцов/237 пациентов), видов Cryptosporidium (78 образцов/41 пациент) и видов E. histolytica или E. histolytica/dispar (159 образцов). /62 пациента) и видов Cyclospora (25 образцов/12 пациентов). Как было описано ранее [10], большинство паразитов были зарегистрированы как E. histolytica после микроскопии, скорее всего, оказались на самом деле E. dispar , который считается непатогенным. На основании этих данных мы решили в ходе исследования протестировать G. lamblia и C. parvum / C. hominis из-за частоты, с которой они вызывают заболевание. Для Cryptosporidium sp. тяжелое заболевание, которое он вызывает у пациентов с ослабленным иммунитетом, и важность для общественного здравоохранения как агента вспышек болезней, передающихся через пищу и воду, также способствовали принятию этого решения. Кроме того, тест на E. histolytica был включен, поскольку амебная дизентерия и амебный абсцесс печени являются тяжелыми состояниями, требующими немедленного и соответствующего лечения. Таким образом, только редкие случаи циклоспороза (примерно один в год в нашей диагностической лаборатории) будут упущены из-за выбора мишеней.
histolytica или E. histolytica/dispar (159 образцов). /62 пациента) и видов Cyclospora (25 образцов/12 пациентов). Как было описано ранее [10], большинство паразитов были зарегистрированы как E. histolytica после микроскопии, скорее всего, оказались на самом деле E. dispar , который считается непатогенным. На основании этих данных мы решили в ходе исследования протестировать G. lamblia и C. parvum / C. hominis из-за частоты, с которой они вызывают заболевание. Для Cryptosporidium sp. тяжелое заболевание, которое он вызывает у пациентов с ослабленным иммунитетом, и важность для общественного здравоохранения как агента вспышек болезней, передающихся через пищу и воду, также способствовали принятию этого решения. Кроме того, тест на E. histolytica был включен, поскольку амебная дизентерия и амебный абсцесс печени являются тяжелыми состояниями, требующими немедленного и соответствующего лечения. Таким образом, только редкие случаи циклоспороза (примерно один в год в нашей диагностической лаборатории) будут упущены из-за выбора мишеней.
3.2. Объектив 1
Внутренний анализ ОТ-ПЦР на G. lamblia дал положительный результат в 13 из 14 образцов, положительных при микроскопии, и в 5 образцах, отрицательных при микроскопии. Все три протестированных анализа ОТ-ПЦР на C. parvum / C. hominis были положительными в десяти из одиннадцати положительных при микроскопии образцов, а также в одном отрицательном при микроскопии образце. Выбранные видоспецифические внутренние анализы RT-PCR выявили ожидаемый патоген во всех образцах, положительных при микроскопии, за исключением одного образца (номер 6, таблица 2), который на основании микроскопии был зарегистрирован с G. lamblia , и одного образца ( № 23, табл. 2) с Cryptosporidium spp. Поскольку ни один из анализов RT-PCR или наборов MT-PCR не обнаружил ожидаемых паразитов в этих образцах, они могут представлять собой ложноположительные результаты микроскопии (таблица 2). 9Анализ 3 0280 Cryptosporidium идентифицировал C. hominis в четырех и C. parvum в восьми образцах. Анализ E. histolytica RT-PCR был положительным только в 1 из 8 положительных при микроскопии образцов и ни в одном из отрицательных при микроскопии образцов. Семь положительных при микроскопии образцов, отрицательных на E. histolytica с помощью ПЦР, оказались положительными при анализе на E. dispar с помощью видоспецифичной ПЦР.
hominis в четырех и C. parvum в восьми образцах. Анализ E. histolytica RT-PCR был положительным только в 1 из 8 положительных при микроскопии образцов и ни в одном из отрицательных при микроскопии образцов. Семь положительных при микроскопии образцов, отрицательных на E. histolytica с помощью ПЦР, оказались положительными при анализе на E. dispar с помощью видоспецифичной ПЦР.
Статистической разницы в количестве положительных образцов при тестировании с помощью микроскопии и ПЦР для трех выбранных паразитов не было ( = 0,22).
3.3. Объектив 2
Набор A обнаружил G. lamblia в трех образцах больше, чем набор B, на два образца больше, чем набор C, и на четыре образца больше, чем набор D. Для C. parvum / C. hominis, набор A обнаружили на один положительный образец больше, чем в наборе B, и на один положительный образец больше, чем в наборе C, но на один меньше, чем в наборе D. Только набор D был положительным на C. parvum / C. hominis в образце (номер 8), в котором другой наборы обнаружили G. lamblia (табл. 2). Все наборы обнаружены E. histolytica в том же образце.
parvum / C. hominis в образце (номер 8), в котором другой наборы обнаружили G. lamblia (табл. 2). Все наборы обнаружены E. histolytica в том же образце.
Из всех протестированных образцов противоречивые результаты были получены при повторном определении одного образца с использованием внутренних анализов (набор A), двух с использованием набора B, двух с использованием набора C и трех с использованием набора D (таблица 2).
Ни один из наборов для МТ-ПЦР не подтвердил присутствие G. lamblia в образцах под номерами 32 и 33, которые были положительными в двух из двух и в одном из двух повторов, соответственно, с помощью внутренней ОТ-ПЦР. Эти два образца были взяты у одного и того же пациента. Через три дня образец оказался положительным при тестировании в Национальной справочной лаборатории Statens Serum Institut 9.0280 . Таким образом, образцы 32 и 33 считались истинно положительными, но слабыми.
Образец номер 86 (не показан в таблице 2) тестировался только в наборах A, B и D и поэтому не включен в общее количество. В этом образце набор B был положительным как для G. lamblia , так и для E. histolytica, в одном из двух повторов. Это не было подтверждено ни одним из других тестовых наборов.
В этом образце набор B был положительным как для G. lamblia , так и для E. histolytica, в одном из двух повторов. Это не было подтверждено ни одним из других тестовых наборов.
Ингибирование фекальными компонентами не было проблемой в этом исследовании, как сообщалось ранее [17].
4. Обсуждение
В этом исследовании мы оценили ПЦР для замены микроскопии для рутинного обнаружения паразитов, вызывающих диарею. В отличие от микроскопии ПЦР выявляет только специфических паразитов. Поэтому обязательным является тщательный выбор мишеней для ПЦР-анализа. Также важно знать, какие паразиты, вызывающие диарею, присутствуют в популяции и не являются мишенями для выбранных ПЦР-тестов, а также количество пациентов, затронутых исключением тестов на конкретные редкие паразиты [18, 19].].
Основываясь на предыдущих частотах обнаружения при микроскопии и тяжести заболевания, мы решили установить ПЦР-анализы для G. lamblia , C. parvum / C. hominis, и E. histolytica. Единственным вызывающим диарею паразитом, ранее обнаруженным и не являющимся мишенью для ПЦР, был Cyclospora spp. в среднем чуть более одного случая в год.
hominis, и E. histolytica. Единственным вызывающим диарею паразитом, ранее обнаруженным и не являющимся мишенью для ПЦР, был Cyclospora spp. в среднем чуть более одного случая в год.
Три разных анализа на C. parvum / C. hominis работал одинаково, но анализ 1 дал самые низкие значения CT и использовался для цели 2. Анализ 3 различал C. hominis и C. parvum и использовался для последующей идентификации видов в положительных образцах. Быстрая идентификация видов важна для эпидемиологических исследований.
Внутренний анализ ОТ-ПЦР выявил G. lamblia и Cryptosporidium spp. в отрицательных при микроскопии образцах от пациентов с подозрением на кишечный паразитоз и, таким образом, оказались более чувствительными, чем микроскопия. Ранее сообщалось, что ПЦР более чувствительна, чем микроскопия, для обнаружения специфических паразитов. В исследовании тен Хоува, проведенном в 2007 г., ПЦР показала на 3,6 % лучшую чувствительность, чем микроскопия, для Giardia в образцах клинического стула [3], а в исследовании Старка в 2011 г. ПЦР имела на 2,9% лучшую чувствительность для Giardia и на 2% лучшую чувствительность для Cryptosporidium , чем микроскопия [5]. Мы обнаружили, что ПЦР обнаружила на 4,1% больше Giardia , чем микроскопия, но не обнаружили никакой разницы для Cryptosporidium в этом исследовании. Основным преимуществом ПЦР перед микроскопией является специфичность, полученная в результате различения E. histolytica и E. dispar [7–10]. Семь из восьми образцов, первоначально обнаруженных с помощью микроскопии E. histolytica , были отрицательными в ходе внутренней ОТ-ПЦР и впоследствии были идентифицированы как E. dispar.
ПЦР имела на 2,9% лучшую чувствительность для Giardia и на 2% лучшую чувствительность для Cryptosporidium , чем микроскопия [5]. Мы обнаружили, что ПЦР обнаружила на 4,1% больше Giardia , чем микроскопия, но не обнаружили никакой разницы для Cryptosporidium в этом исследовании. Основным преимуществом ПЦР перед микроскопией является специфичность, полученная в результате различения E. histolytica и E. dispar [7–10]. Семь из восьми образцов, первоначально обнаруженных с помощью микроскопии E. histolytica , были отрицательными в ходе внутренней ОТ-ПЦР и впоследствии были идентифицированы как E. dispar.
Сравнение четырех тестовых наборов, в том числе собственного набора A, показало разные результаты повторных тестов. Тестирование в единичных определениях может привести к ложным результатам в меньшинстве случаев. Будущее использование этих анализов может быть улучшено путем проведения тестов в двух экземплярах.
Ограничением этого исследования был, прежде всего, размер выборки, который не позволяет проводить статистический анализ различий в результатах микроскопии и ОТ-ПЦР в лабораториях. Тенденции в пользу внутренних анализов были замечены при сравнении вариации повторов и чувствительности с коммерческими наборами для тестирования.
Тенденции в пользу внутренних анализов были замечены при сравнении вариации повторов и чувствительности с коммерческими наборами для тестирования.
Судя по количеству случаев кишечных паразитозов, зарегистрированных в нашей ЛИС за последние годы, для сбора большего количества образцов потребуется время. Обнаружение паразитов в отрицательных при микроскопии образцах позволяет предположить, что замена микроскопии ПЦР увеличит количество положительных результатов и, таким образом, сократит время, необходимое для создания больших коллекций образцов.
5. Заключение
В наших условиях важно провести тест на G. lamblia , C. parvum/C. hominis, и E. histolytica. Мы ожидаем, что замена микроскопии собственными методами ОТ-ПЦР для этих паразитов приведет к более высокому уровню положительных результатов для G. lamblia и C. parvum/C. hominis , в то время как ложноположительные результаты для E. histolytica будут исключены. Добавление вторичного теста, позволяющего различать C. parvum и C. hominis будут полезны для раннего выявления вспышек.
Добавление вторичного теста, позволяющего различать C. parvum и C. hominis будут полезны для раннего выявления вспышек.
Все оцениваемые здесь коммерческие наборы для MT-PCR тестировались на соответствующие мишени. Однако при использовании комплектов наблюдались некоторые различия в производительности. Выбор метода обнаружения кишечных простейших может зависеть от условий. По сравнению с ПЦР микроскопия менее чувствительна и менее специфична, требует больше времени и больше зависит от индивидуальных навыков. Использование коммерческих наборов ПЦР может быть привлекательным в лабораториях, обрабатывающих небольшое количество образцов, в то время как собственные ПЦР-анализы могут быть установлены и поддерживаться для крупномасштабных анализов, в основном из-за более низких затрат.
Раскрытие информации
Спонсоры не играли никакой роли в разработке исследования, сборе, анализе и интерпретации данных.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Исследование является частью программы Ph.D. проект и поддерживается грантом от следующих датских организаций: Фонд развития медицинской науки им. А.П. Мёллера, «Fonden for Læge Else Poulsens Mindelegat», Beckett-Fonden, Region Syddanmarks и Region Sjællands Fælles Forskningspulje, Университет Южной Дании и Департамент Клиническая микробиология в Университетской больнице Оденсе. Авторы выражают благодарность сотрудникам лаборатории секции паразитологии в отделении клинической микробиологии университетской больницы Оденсе, Оденсе, Дания, за помощь в сборе образцов стула и отделению клинической микробиологии больницы Слагельсе, Слагельсе, Дания, за использование. их системы BD MAX, особенно Тине Васехус Мэдсен, доктору философии, за помощь в тестировании. Они также благодарят доктора Мин Чен из отделения клинической микробиологии больницы Южной Ютландии, Сённерборг, Дания, за критический пересмотр статьи.
Ссылки
-
J. J. Verweij, R.
 A. Blangé, K. Templeton et al., «Одновременное обнаружение Entamoeba histolytica , Giardia lamblia и Giardia lamblia и PCR908 parvum в образцах, состоящих из нескольких образцов в режиме реального времени PCR908 parvum. Journal of Clinical Microbiology , vol. 42, нет. 3, стр. 1220–1223, 2004.
A. Blangé, K. Templeton et al., «Одновременное обнаружение Entamoeba histolytica , Giardia lamblia и Giardia lamblia и PCR908 parvum в образцах, состоящих из нескольких образцов в режиме реального времени PCR908 parvum. Journal of Clinical Microbiology , vol. 42, нет. 3, стр. 1220–1223, 2004. Посмотреть по адресу:
Сайт издателя | Google Scholar
-
Т. Шуурман, П. Ланкамп, А. ван Белкум, М. Коойстра-Смид и А. ван Цвет, «Сравнение микроскопии, ПЦР в реальном времени и быстрого иммуноанализа для обнаружения Giardia lamblia» в образцах стула человека» Клиническая микробиология и инфекции , том. 13, нет. 12, стр. 1187–1191, 2007.
Посмотреть по адресу:
Сайт издателя | Google Scholar
-
R. ten Hove, T. Schuurman, M. Kooistra, L. Möller, L. Van Lieshout и JJ Verweij, «Обнаружение вызывающих диарею простейших у пациентов общей практики в время ПЦР», Clinical Microbiology and Infection , vol.
 13, нет. 10, стр. 1001–1007, 2007.
13, нет. 10, стр. 1001–1007, 2007. Посмотреть по адресу:
Сайт издателя | Google Scholar
-
Л. Э. С. Брюйнестейн ван Коппенрает, Дж. А. Валлинга, Г. Дж. Х. М. Руйс, М. Дж. Брюинз и Дж. Дж. Вервей, «Паразитологическая диагностика, сочетающая внутренне контролируемый анализ ПЦР в реальном времени для обнаружения четырех простейших в образцах стула с алгоритмом тестирования для микроскопия», Clinical Microbiology and Infection , vol. 15, нет. 9, стр. 869–874, 2009.
Посмотреть по адресу:
Сайт издателя | Академия Google
-
Д. Старк, С. Э. Аль-Кассаб, Дж. Л. Н. Барратт и др., «Оценка мультиплексной тандемной ПЦР в реальном времени для обнаружения Cryptosporidium spp., Dientamoeba fragilis, Entamoeba histolytica и Giardia enteralis в образцах клинического стула», Журнал клинической микробиологии , том.
 49, нет. 1, стр. 257–262, 2011.
49, нет. 1, стр. 257–262, 2011. Посмотреть по адресу:
Сайт издателя | Google Scholar
-
A. Kebede, JJ Verweij, B. Petros и AM Polderman, «Короткое сообщение: вводящая в заблуждение микроскопия при амебиазе», Тропическая медицина и международное здравоохранение , том. 9, нет. 5, стр. 651-652, 2004.
Посмотреть по адресу:
Сайт издателя | Google Scholar
-
B. S. Ayed, B. R. Abdallah, M. Mousli, K. Aolin, M. Thellier, and A. Bouratbine, «Молекулярная дифференциация Entamoeba histolytica и Entamoeba dispar от тунисских работников пищевой промышленности с амебной инфекцией, первоначально диагностированной с помощью микроскопии, Паразит , том. 15, нет. 1, стр. 65–68, 2008.
Просмотр:
Сайт издателя | Google Scholar
-
К.
 Хайрнар, С. К. Пария и Р. Паланиаппан, «Диагностика кишечного амебиаза с использованием вложенной полимеразной цепной реакции и анализа полиморфизма длины рестрикционных фрагментов», Journal of Gastroenterology , vol. 42, нет. 8, стр. 631–640, 2007.
Хайрнар, С. К. Пария и Р. Паланиаппан, «Диагностика кишечного амебиаза с использованием вложенной полимеразной цепной реакции и анализа полиморфизма длины рестрикционных фрагментов», Journal of Gastroenterology , vol. 42, нет. 8, стр. 631–640, 2007. Посмотреть по адресу:
Сайт издателя | Google Scholar
-
J. J. Verweij, F. Oostvogel, E. A. T. Brienen, A. Nang-Beifubah, J. Ziem и A. M. Polderman, «Краткое сообщение: распространенность Entamoeba histolytica и Entamoeba dispar в северной Гане», Тропическая медицина и международное здравоохранение , том. 8, нет. 12, стр. 1153–1156, 2003.
Посмотреть по адресу:
Сайт издателя | Google Scholar
-
Г. Н. Хартмейер, С. В. Хёг, М. Чен, Х. Холт, М. Н. Сков и М. Кемп, «Необходимость видовоспецифического обнаружения для диагностики амебиаза в неэндемичных условиях», Скандинавский Журнал инфекционных болезней , том.
 45, нет. 11, стр. 868–871, 2013 г.
45, нет. 11, стр. 868–871, 2013 г. Посмотреть по адресу:
Сайт издателя | Академия Google
-
А. В. Аллен и Д. С. Ридли, «Дальнейшие наблюдения за методом концентрации эфира формола для фекальных паразитов», Journal of Clinical Pathology , vol. 23, нет. 6, стр. 545-546, 1970.
Посмотреть по адресу:
Сайт издателя | Google Scholar
-
С. А. Хенриксен и Дж. Ф. Поленц, «Окрашивание криптоспоридий модифицированным методом Циля-Нильсена», Acta veterinaria Scandinavica , vol. 22, нет. 3-4, стр. 594–596, 1981.
Посмотреть по адресу:
Google Scholar
-
H. G. M. Niesters, «Количественная оценка вирусной нагрузки с использованием методов амплификации в реальном времени», Methods , vol. 25, нет.
 4, стр. 419–429, 2001.
4, стр. 419–429, 2001. Посмотреть по адресу:
Сайт издателя | Google Scholar
-
M. Fontaine and E. Guillot, «Разработка количественного ПЦР-анализа TaqMan, специфичного для Cryptosporidium parvum», FEMS Microbiology Letters , vol. 214, нет. 1, стр. 13–17, 2002.
Посмотреть по адресу:
Сайт издателя | Google Scholar
-
Р. Ян, К. Мерфи, Ю. Сонг и др., «Специфическое и количественное обнаружение и идентификация Cryptosporidium hominis и C. parvum в клинических и экологических образцах», Experimental Parasitology , vol. 135, нет. 1, стр. 142–147, 2013 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
-
С. Р. Стенсволд, М. Леббад, Дж. Дж. Вервей и др., «Идентификация и разграничение членов комплекса энтамеб с помощью пиросеквенирования», Молекулярные и клеточные зонды , vol.
 24, нет. 6, стр. 403–406, 2010.
24, нет. 6, стр. 403–406, 2010. Посмотреть по адресу:
Сайт издателя | Google Scholar
-
L. Monteiro, D. Bonnemaison, A. Vekris et al., «Комплексные полисахариды как ингибиторы ПЦР в фекалиях: модель Helicobacter pylori», Journal of Clinical Microbiology , vol. 35, нет. 4, pp. 995–998, 1997.
Посмотреть по адресу:
Google Scholar
-
Дж. Дж. Вервейдж, «Применение методов на основе ПЦР для диагностики кишечных паразитарных инфекций в клинической лаборатории», Паразитология , том. 141, нет. 14, стр. 1863–1872, 2014.
Посмотреть по адресу:
Сайт издателя | Google Scholar
-
Л. ван Лисхаут и Дж. Дж. Вервей, «Новые диагностические подходы к кишечным простейшим», Current Opinion in Infectious Diseases , vol.
 23, нет. 5, стр. 488–493, 2010.
23, нет. 5, стр. 488–493, 2010. Посмотреть по адресу:
Сайт издателя | Google Scholar
Copyright
Copyright © 2017 G. N. Hartmeyer et al. Это статья с открытым доступом, распространяемая в соответствии с лицензией Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии надлежащего цитирования оригинальной работы.
приложений ПЦР в реальном времени для диагностики лейшманиоза | Паразиты и переносчики
- Обзор
- Открытый доступ
- Опубликовано:
- Лука Галлуцци
ORCID: orcid.
 org/0000-0002-1747-526X 1 ,
org/0000-0002-1747-526X 1 , - Марчелло Чеккарелли 1 ,
- Аврора Диоталлеви 1 ,
- Микеле Менотта 1 и
- …
- Мауро Маньяни 1
Паразиты и переносчики том 11 , номер статьи: 273 (2018) Процитировать эту статью
-
15 тыс. обращений
-
60 цитирований
-
1 Альтметрический
-
Сведения о показателях
Abstract
Лейшманиоз представляет собой трансмиссивное заболевание, вызываемое многими видами Leishmania , которое может инфицировать как людей, так и других млекопитающих. Лейшманиоз представляет собой сложное заболевание с гетерогенными клиническими проявлениями, варьирующими от бессимптомных инфекций до поражений кожи (кожный лейшманиоз), слизистых оболочек (слизисто-кожный лейшманиоз) или внутренних органов (висцеральный лейшманиоз), в зависимости от вида и характеристик хозяина. Часто симптомы неубедительны, и лейшманиоз можно спутать с другими коэндемическими заболеваниями. Кроме того, коинфекции (в основном с ВИЧ у людей) могут давать атипичные клинические проявления. Правильный диагноз имеет решающее значение для применения соответствующего лечения, и использование молекулярных методов в диагностике лейшманиоза становится все более актуальным из-за их замечательной чувствительности, специфичности и возможного применения к различным клиническим образцам. Среди них подходы, основанные на ПЦР в реальном времени (кПЦР), в последние годы становятся все более популярными не только для обнаружения и количественного определения видов Leishmania , но и для идентификации видов.
Лейшманиоз представляет собой сложное заболевание с гетерогенными клиническими проявлениями, варьирующими от бессимптомных инфекций до поражений кожи (кожный лейшманиоз), слизистых оболочек (слизисто-кожный лейшманиоз) или внутренних органов (висцеральный лейшманиоз), в зависимости от вида и характеристик хозяина. Часто симптомы неубедительны, и лейшманиоз можно спутать с другими коэндемическими заболеваниями. Кроме того, коинфекции (в основном с ВИЧ у людей) могут давать атипичные клинические проявления. Правильный диагноз имеет решающее значение для применения соответствующего лечения, и использование молекулярных методов в диагностике лейшманиоза становится все более актуальным из-за их замечательной чувствительности, специфичности и возможного применения к различным клиническим образцам. Среди них подходы, основанные на ПЦР в реальном времени (кПЦР), в последние годы становятся все более популярными не только для обнаружения и количественного определения видов Leishmania , но и для идентификации видов. Однако, несмотря на то, что методы на основе количественной ПЦР доказали свою высокую эффективность в диагностике лейшманиоза, стандартизированного метода не существует. В этом обзоре обобщены методы диагностики лейшманиоза, основанные на количественной ПЦР, с акцентом на последние разработки и применения в этой области.
Однако, несмотря на то, что методы на основе количественной ПЦР доказали свою высокую эффективность в диагностике лейшманиоза, стандартизированного метода не существует. В этом обзоре обобщены методы диагностики лейшманиоза, основанные на количественной ПЦР, с акцентом на последние разработки и применения в этой области.
Справочная информация
Лейшманиоз вызывается простейшими паразитами рода Leishmania . Этот род включает три подрода: Leishmania , Viannia и Sauroleishmania . Каждый подрод представлен разными комплексами, и каждый комплекс включает несколько видов [1]. В зависимости от вида Leishmania и характеристик хозяина инфекция может протекать бессимптомно или вызывать целый ряд заболеваний, в частности кожный лейшманиоз (КЛ), висцеральный лейшманиоз (ВЛ) или кожно-слизистый лейшманиоз (МКЛ). Болезнью поражено около 12 миллионов человек; более того, 0,2–0,4 миллиона случаев в год и 0,7–1,2 миллиона случаев в год были оценены для ВЛ и КЛ соответственно [2]. Инфекции широко распространены как в Америке (Новый Свет), так и в Европе, Африке, Азии (Старый Свет), поэтому представляют собой важную глобальную проблему здравоохранения.
Инфекции широко распространены как в Америке (Новый Свет), так и в Европе, Африке, Азии (Старый Свет), поэтому представляют собой важную глобальную проблему здравоохранения.
Диагноз лейшманиоза основывается на клинических проявлениях, эпидемиологических и лабораторных данных. Что касается лабораторных методов, то отсутствует золотой стандарт для людей или животных [3], что затрудняет сбор точных эпидемиологических данных и, таким образом, ограничивает контроль над заболеванием. Более того, ложноотрицательные результаты могут отсрочить лечение, тем самым способствуя сохранению резервуаров. Недавно было разработано несколько иммунологических и молекулярных диагностических инструментов для диагностики лейшманиоза [4]. В частности, использование молекулярных методов становится все более актуальным в связи с их высокой чувствительностью, специфичностью и возможностью применения к разнообразным клиническим образцам. Среди них ПЦР в реальном времени, также называемая количественной ПЦР (кПЦР), в последнее время становится все более популярной, поскольку она быстрая, имеет широкий динамический диапазон и резко снижает перекрестное загрязнение, поскольку нет необходимости открывать реакционные пробирки для пост-тестирования. -ПЦР анализы. qPCR основывается на анализе флуоресцентного сигнала, полученного во время амплификации. Флуоресценцию можно генерировать с помощью интеркалирующих флуоресцентных красителей (например, SYBR Green) или флуоресцентных зондов (например, TaqMan®). Анализы на основе интеркалирующих красителей характеризуются высокой чувствительностью, поскольку праймеры обладают высокой специфичностью к последовательности-мишени, что позволяет избежать образования неспецифических продуктов, которые могут привести к завышенным или ложноположительным результатам. Анализ кривой плавления можно провести после ПЦР, чтобы убедиться в наличии единственного специфического ампликона. В целях генотипирования можно использовать анализ плавления с высоким разрешением (HRM) для дифференциации ампликонов на основе вариаций последовательности [5]. Использование зондов обычно дороже. Однако использование зондов позволяет мультиплексировать (частично снижая стоимость анализа) и придавать анализу дополнительную специфичность.
-ПЦР анализы. qPCR основывается на анализе флуоресцентного сигнала, полученного во время амплификации. Флуоресценцию можно генерировать с помощью интеркалирующих флуоресцентных красителей (например, SYBR Green) или флуоресцентных зондов (например, TaqMan®). Анализы на основе интеркалирующих красителей характеризуются высокой чувствительностью, поскольку праймеры обладают высокой специфичностью к последовательности-мишени, что позволяет избежать образования неспецифических продуктов, которые могут привести к завышенным или ложноположительным результатам. Анализ кривой плавления можно провести после ПЦР, чтобы убедиться в наличии единственного специфического ампликона. В целях генотипирования можно использовать анализ плавления с высоким разрешением (HRM) для дифференциации ампликонов на основе вариаций последовательности [5]. Использование зондов обычно дороже. Однако использование зондов позволяет мультиплексировать (частично снижая стоимость анализа) и придавать анализу дополнительную специфичность. Следовательно, этот подход менее подвержен ложным срабатываниям, чем метод интеркалирующего красителя.
Следовательно, этот подход менее подвержен ложным срабатываниям, чем метод интеркалирующего красителя.
Поиск в PubMed в феврале 2018 г. с подстановочным знаком « Leishmania* » в сочетании с поисковыми терминами «ПЦР в реальном времени или кПЦР» позволил найти более 540 опубликованных рукописей с 2001 г. по февраль 2018 г. Еще одна комбинация с подстановочные термины «количество*», «обнаружение*» или «диагноз*», а также ручное просеивание статей выявило около 180 рукописей, посвященных теме этого обзора. Тем не менее, многие из этих публикаций применяют аналогичные анализы.
Новаторские работы Bretagne et al. [6] и Николас и соавт. [7] описали два метода на основе количественной ПЦР для обнаружения и количественного определения паразитов Leishmania , использующих в качестве мишени ген ДНК-полимеразы и миникольцевую кинетопластную ДНК (кДНК) соответственно. С тех пор было разработано множество анализов на основе количественной ПЦР для различных молекулярных мишеней не только для обнаружения и количественного определения видов Leishmania , но также для генотипирования и идентификации видов. Что касается химии обнаружения, наиболее широко использовались зонды SYBR Green и TaqMan®, за которыми следуют другие зонды, такие как зонды FRET [8, 9].] или зонды МГБ [10]. Чувствительность и специфичность опубликованных анализов количественной ПЦР варьируются. Например, анализы кПЦР, разработанные для диагностики ВЛ у людей, показали вариацию специфичности от 29,6 до 100% и чувствительность от 91,3 до 100%, что указывает на полезность кПЦР, когда ключевое значение имеет чувствительный инструмент [4].
Что касается химии обнаружения, наиболее широко использовались зонды SYBR Green и TaqMan®, за которыми следуют другие зонды, такие как зонды FRET [8, 9].] или зонды МГБ [10]. Чувствительность и специфичность опубликованных анализов количественной ПЦР варьируются. Например, анализы кПЦР, разработанные для диагностики ВЛ у людей, показали вариацию специфичности от 29,6 до 100% и чувствительность от 91,3 до 100%, что указывает на полезность кПЦР, когда ключевое значение имеет чувствительный инструмент [4].
В этом обзоре обобщаются последние разработки и применение методов количественной ПЦР в диагностике лейшманиоза, подчеркиваются достижения и ограничения этого мощного метода.
Молекулярные мишени
Многие подходы к диагностике лейшманиоза, основанные на количественной ПЦР, были опубликованы на основе кодирующих и/или некодирующих областей в геноме Leishmania . Leishmania spp. имеют 34–36 хромосом и уникальную геномную организацию, при которой гены, кодирующие белок, организованы в полицистронные единицы и не имеют интронов; более того, экспрессия генов регулируется посттранскрипционно (т. е. на уровнях стабильности и трансляции мРНК) [11]. 9Паразиты 0280 Leishmania также обладают митохондриальным геномом, называемым кинетопластной ДНК, который организован в виде тысяч мини-колец (0,8–1,0 кб каждый) и нескольких десятков максиколец (примерно 23 кб каждый), связанных в конкатенированную сеть.
е. на уровнях стабильности и трансляции мРНК) [11]. 9Паразиты 0280 Leishmania также обладают митохондриальным геномом, называемым кинетопластной ДНК, который организован в виде тысяч мини-колец (0,8–1,0 кб каждый) и нескольких десятков максиколец (примерно 23 кб каждый), связанных в конкатенированную сеть.
Небелковые кодирующие области
Миникольца кДНК составляют примерно 95% кДНК и кодируют малые направляющие РНК (гРНК), необходимые для РНК-редактирования транскриптов, кодируемых максикольцами [12]. Поскольку миникольца присутствуют в тысячах копий на клетку, они являются идеальными мишенями для высокочувствительного обнаружения Leishmania [13, 14]. Каждая миникольцо состоит из консервативной области, содержащей начало репликации, и вариабельной области, кодирующей обычно одну гРНК [15]. Сеть миникругов состоит из различных классов миникругов. Их количество может быть вариабельным и зависеть от деформации; в недавней работе было продемонстрировано наличие более 100 классов миниколец у штамма L. tarentolae с использованием технологии NGS [16].
tarentolae с использованием технологии NGS [16].
Консервативная область миникольца содержит 3 блока консервативной последовательности (CSB-1, CSB-2 и CSB-3), которые могут быть эффективными мишенями для ПЦР-амплификации всех классов миниколец. Однако полиморфизмы были показаны в области CSB-1 L. infantum [14] и, используя праймеры, амплифицирующие субпопуляцию миниколец, также в районе CSB-2 видов Нового Света [17]. В целом, анализы, разработанные на консервативных регионах мини-кругов, идентифицируют паразитов Leishmania только на уровне рода или подрода. Фактически, анализы qPCR, предназначенные для одного вида, разработанные на миникольцах, потенциально могут амплифицировать более одного вида Leishmania , как показано несколькими авторами [14, 18,19,20,21,22].
Среди мишеней на хромосомной ДНК использовались различные участки генов рибосомной РНК (рРНК), называемые рибосомной ДНК (рДНК). Десятки или сотни копий единицы рДНК могут присутствовать на Leishmania , что обеспечивает достаточную чувствительность для анализа ДНК клинических образцов [23, 24]. Каждая повторяющаяся единица рДНК состоит из нескольких генов и спейсеров: за геном рРНК SSU (18S) следуют гены 5.8S и LSU ; две внутренние транскрибируемые спейсерные области — ITS1 и ITS2 — расположены между генами 18S и 5.8S и между генами 5.8S и LSU α соответственно [25]. 18S область рДНК из-за ее высокой консервативности обычно используется для создания праймеров и/или зондов для диагностики Leishmania spp. [26]. С другой стороны, участков ITS , которые имеют более вариабельные последовательности, могут быть использованы для типирования на видовом уровне [24, 27, 28].
Каждая повторяющаяся единица рДНК состоит из нескольких генов и спейсеров: за геном рРНК SSU (18S) следуют гены 5.8S и LSU ; две внутренние транскрибируемые спейсерные области — ITS1 и ITS2 — расположены между генами 18S и 5.8S и между генами 5.8S и LSU α соответственно [25]. 18S область рДНК из-за ее высокой консервативности обычно используется для создания праймеров и/или зондов для диагностики Leishmania spp. [26]. С другой стороны, участков ITS , которые имеют более вариабельные последовательности, могут быть использованы для типирования на видовом уровне [24, 27, 28].
В принципе, анализы количественной ПЦР, разработанные на миникольцах, консервативных областях кДНК, позволяют достичь наивысшего предела обнаружения из-за их большого количества на одного паразита. Фактически предел обнаружения 5 × 10 -4 паразитов на пробирку для ПЦР с динамическим диапазоном 10 7 было зарегистрировано для L. infantum , что позволяет обнаружить до 0,0125 паразитов/мл крови [18]. Как правило, предел чувствительности зависит от дизайна анализа (какая целевая область выбрана), используемого химического состава (интеркалирующие красители или флуоресцентные зонды), характера клинического образца и метода выделения ДНК. Например, Гомес и др. [22] сравнили чувствительность двух анализов количественной ПЦР (на основе зонда SYBR Green или TaqMan®), нацеленных на Leishmania ( Viannia ) кДНК с использованием мазков и образцов биопсии от пациентов с MCL и CL. Авторы показали, что чувствительность существенно не различалась в зависимости от типа образца, а скорее в зависимости от метода: анализ на основе зеленого SYBR достиг более высокого уровня чувствительности. Также важно подчеркнуть, что наблюдаемая более высокая чувствительность SYBR green может отражать различия в последовательностях ДНК в местах отжига праймеров, а не саму химию количественной ПЦР.
infantum , что позволяет обнаружить до 0,0125 паразитов/мл крови [18]. Как правило, предел чувствительности зависит от дизайна анализа (какая целевая область выбрана), используемого химического состава (интеркалирующие красители или флуоресцентные зонды), характера клинического образца и метода выделения ДНК. Например, Гомес и др. [22] сравнили чувствительность двух анализов количественной ПЦР (на основе зонда SYBR Green или TaqMan®), нацеленных на Leishmania ( Viannia ) кДНК с использованием мазков и образцов биопсии от пациентов с MCL и CL. Авторы показали, что чувствительность существенно не различалась в зависимости от типа образца, а скорее в зависимости от метода: анализ на основе зеленого SYBR достиг более высокого уровня чувствительности. Также важно подчеркнуть, что наблюдаемая более высокая чувствительность SYBR green может отражать различия в последовательностях ДНК в местах отжига праймеров, а не саму химию количественной ПЦР.
Последовательности, кодирующие белок
Многие гены, кодирующие белки, также использовались в качестве мишеней в анализах количественной ПЦР для идентификации/количественного определения паразитов. Среди них белок теплового шока 70 кДа ( HSP70 ) [20, 27, 29, 30], ДНК-полимераза [6, 20, 31,32,33,34], глюкозо-6-фосфатдегидрогеназа ( G6PD ). ) [13, 35], глюкозофосфатизомераза ( GPI ) [36], маннозофосфатизомераза ( MPI ), 6-фосфоглюконатдегидрогеназа ( 6PGD ) [9], трипаредоксинпероксидаза [37] и др. мишени в целом обладают высокой специфичностью, но меньшей чувствительностью по сравнению с мишенями с большим числом копий, такими как миникольца кДНК или рДНК. 9Исключением можно считать 0280 HSP70 , поскольку он является мультикопийным геном [38]. Фактически, оптимизированный анализ КПЦР показал предел обнаружения 0,1 паразита/мл культуры [30]. Ген HSP70 широко использовался для филогенетических исследований Leishmania [39], и гетерогенность его последовательности была реализована в нескольких подходах ПЦР-ПДРФ [40] и методах типирования на основе кПЦР (см. ниже). Гены G6PD , MPI , GPI и 6PGD кодируют ферменты, используемые в анализе многолокусного электрофореза ферментов (MLEE), а также использовались в подходах многолокусного типирования последовательности (MLST) [41].
Среди них белок теплового шока 70 кДа ( HSP70 ) [20, 27, 29, 30], ДНК-полимераза [6, 20, 31,32,33,34], глюкозо-6-фосфатдегидрогеназа ( G6PD ). ) [13, 35], глюкозофосфатизомераза ( GPI ) [36], маннозофосфатизомераза ( MPI ), 6-фосфоглюконатдегидрогеназа ( 6PGD ) [9], трипаредоксинпероксидаза [37] и др. мишени в целом обладают высокой специфичностью, но меньшей чувствительностью по сравнению с мишенями с большим числом копий, такими как миникольца кДНК или рДНК. 9Исключением можно считать 0280 HSP70 , поскольку он является мультикопийным геном [38]. Фактически, оптимизированный анализ КПЦР показал предел обнаружения 0,1 паразита/мл культуры [30]. Ген HSP70 широко использовался для филогенетических исследований Leishmania [39], и гетерогенность его последовательности была реализована в нескольких подходах ПЦР-ПДРФ [40] и методах типирования на основе кПЦР (см. ниже). Гены G6PD , MPI , GPI и 6PGD кодируют ферменты, используемые в анализе многолокусного электрофореза ферментов (MLEE), а также использовались в подходах многолокусного типирования последовательности (MLST) [41]. Предел обнаружения анализов кПЦР, разработанных для однокопийных генов, может быть высоким (например, 5,6 пг ДНК паразита на реакцию) [36]. В других случаях (с использованием ДНК-полимеразы или G6PD в качестве мишени) предел обнаружения составляет 0,4 паразита/реакцию [32] и 10 целевых копий/реакцию [13].
Предел обнаружения анализов кПЦР, разработанных для однокопийных генов, может быть высоким (например, 5,6 пг ДНК паразита на реакцию) [36]. В других случаях (с использованием ДНК-полимеразы или G6PD в качестве мишени) предел обнаружения составляет 0,4 паразита/реакцию [32] и 10 целевых копий/реакцию [13].
Клинические образцы
Для разработки основанного на количественной ПЦР метода диагностики лейшманиоза, кроме выбора последовательности-мишени (размер, генетическая стабильность, число копий, уровень специфичности) и характеристики эффективности анализа (специфичность, чувствительность, точность и воспроизводимость ), необходимо протестировать анализ с клиническими образцами.
Правильная выборка часто имеет решающее значение для успеха последующих испытаний [42]; фактически клинические образцы могут быть гетерогенными в зависимости от клинической картины (CL, VL, MCL). Для КЛ нуклеиновые кислоты могут быть извлечены из образца биопсии кожи на всю толщину, взятого из очага поражения, в то время как для МКЛ биоптаты должны быть взяты из участков слизистой оболочки с аномалиями [43]. Также мазки из поражений CL или MCL становятся мощным диагностическим инструментом благодаря неинвазивному и простому методу сбора [22, 44]. Для ВЛ аспираты костного мозга или лимфатических узлов, а также цельная кровь или лейкоцитарная пленка являются обычным источником образцов тканей [43]. В последнее время обнаружение кДНК L. infantum с помощью количественной ПЦР также была продемонстрирована в моче нелеченных лиц, пораженных ВЛ. Тот факт, что ДНК паразита не была обнаружена после начала терапии, указывает на то, что моча может рассматриваться как потенциальный альтернативный образец для контроля эффективности терапевтических подходов [45]. Присутствие кДНК L. infantum в моче также было показано у собак с естественным клиническим лейшманиозом, хотя и в меньших количествах по сравнению с кровью или костным мозгом [46]. При собачьем или кошачьем лейшманиозе (CanL или FeL) конъюнктивальные мазки оказались действенной альтернативой другим более инвазивным клиническим образцам, таким как аспираты крови, костного мозга или лимфатических узлов [34, 47, 48, 49].
Также мазки из поражений CL или MCL становятся мощным диагностическим инструментом благодаря неинвазивному и простому методу сбора [22, 44]. Для ВЛ аспираты костного мозга или лимфатических узлов, а также цельная кровь или лейкоцитарная пленка являются обычным источником образцов тканей [43]. В последнее время обнаружение кДНК L. infantum с помощью количественной ПЦР также была продемонстрирована в моче нелеченных лиц, пораженных ВЛ. Тот факт, что ДНК паразита не была обнаружена после начала терапии, указывает на то, что моча может рассматриваться как потенциальный альтернативный образец для контроля эффективности терапевтических подходов [45]. Присутствие кДНК L. infantum в моче также было показано у собак с естественным клиническим лейшманиозом, хотя и в меньших количествах по сравнению с кровью или костным мозгом [46]. При собачьем или кошачьем лейшманиозе (CanL или FeL) конъюнктивальные мазки оказались действенной альтернативой другим более инвазивным клиническим образцам, таким как аспираты крови, костного мозга или лимфатических узлов [34, 47, 48, 49]. ,50]. Также были успешно протестированы мазки из носа, полости рта или ушей [33, 51].
,50]. Также были успешно протестированы мазки из носа, полости рта или ушей [33, 51].
ПЦР в реальном времени была использована для изучения присутствия ДНК Leishmania в тканях диких млекопитающих как в Новом, так и в Старом Свете, чтобы найти потенциальные резервуары паразитов. Например, ДНК Leishmania была обнаружена в тканях селезенки грызунов и летучих мышей [52,53,54,55]. Кроме того, ДНК L. infantum была также извлечена из шерсти диких млекопитающих, таких как Leporidae [56], лисы, волка, крысы, куницы и ежа [57].
Все клинические образцы требуют использования внутреннего эталона (как правило, последовательности хозяина, например, β-актина или бета-2-микроглобулина), не только для мониторинга ингибирования ПЦР (т.е. ложноотрицательных результатов), но и для нормализации паразита нагрузку на количество клеток-хозяев [33, 34, 48, 58]. Хотя некоторые клинические образцы могут содержать небольшое количество ДНК паразита, использование последовательности с большим числом копий в качестве мишени (например, миникольца кДНК, рДНК) может обеспечить достаточную чувствительность.
КПЦР для обнаружения и количественного определения паразитов
Как указывалось выше, недавно были опубликованы многочисленные количественные и качественные анализы на основе ПЦР в реальном времени, предназначенные для использования в ветеринарии или медицине человека, нацеленные на различные генетические маркеры и применимые к различным типам образцов [51, 59, 60, 61]. ,62,63,64,65,66,67,68,69]. Основные характеристики анализов количественной ПЦР, нацеленных на кДНК, рДНК или другие области ДНК, обобщены в Таблице 1, Таблице 2 и Таблице 3 соответственно.
Таблица 1. Сводка характеристик анализов ПЦР в реальном времени, нацеленных на Leishmania кДНК, в хронологическом порядкеПолноразмерная таблица
анализы ПЦР в реальном времени, нацеленные на Последовательности Leishmania , отличные от кДНК или рДНК, в хронологическом порядкеПолноразмерная таблица
Некоторые тесты, разработанные для диагностики лейшманиоза, дают только качественные результаты (т. е. положительное или отрицательное обнаружение) [22, 70] . Эти качественные анализы используют преимущества технологии реального времени для сокращения времени анализа и риска заражения. Более того, многие из этих анализов часто дорабатывались для получения информации о генотипировании (см. ниже) [8, 71].
е. положительное или отрицательное обнаружение) [22, 70] . Эти качественные анализы используют преимущества технологии реального времени для сокращения времени анализа и риска заражения. Более того, многие из этих анализов часто дорабатывались для получения информации о генотипировании (см. ниже) [8, 71].
Другие анализы были разработаны для оценки паразитарной нагрузки посредством абсолютного или относительного количественного определения. Абсолютная количественная оценка основывается на использовании стандартной кривой, полученной при серийных разведениях очищенной геномной ДНК паразита или последовательности-мишени. Использование высококопийных последовательностей кДНК 18S и миниколец в качестве мишени обычно позволяет проводить амплификацию на уровне рода или подрода благодаря их консервативным последовательностям или гетерогенности классов миниколец [72]. Надежность результатов количественного определения зависит от (i) знания количества копий/клеток целевой последовательности и (ii) того факта, что это число существенно не различается между видами или между эталонными и полевыми штаммами. Что касается миникольцевой кДНК, их число копий может варьироваться от L. ( Leishmania ) или между изолятами одного вида [18, 20], что может повлиять на точность количественного определения количественной ПЦР. Однако статистически значимых различий в относительном количестве миникольцевых мишеней кДНК среди трех видов L. ( Viannia ) обнаружено не было [13]. Более того, количество копий миникольца кДНК в пределах одного штамма или у амастигот, заразивших одного пациента во время обследования, оказалось стабильным; поэтому анализ кПЦР, разработанный для этой мишени, может использоваться для сравнения уровней паразитемии во время обследования пациента и может быть особенно полезен для мониторинга рецидивов [18]. Изменения количества копий миникольца во время перехода стадии (промастиготы-амастиготы) также исследовались в 9Штамм 0280 L. chagasi (было показано, что L. chagasi идентичен штамму L. infantum из юго-западной Европы [73]). Существенных различий обнаружено не было, что позволяет сделать вывод о том, что стандартные кривые, полученные из ДНК, полученной из промастигот, могут быть использованы для количественного определения амастигот одного и того же вида/штамма [20].
Что касается миникольцевой кДНК, их число копий может варьироваться от L. ( Leishmania ) или между изолятами одного вида [18, 20], что может повлиять на точность количественного определения количественной ПЦР. Однако статистически значимых различий в относительном количестве миникольцевых мишеней кДНК среди трех видов L. ( Viannia ) обнаружено не было [13]. Более того, количество копий миникольца кДНК в пределах одного штамма или у амастигот, заразивших одного пациента во время обследования, оказалось стабильным; поэтому анализ кПЦР, разработанный для этой мишени, может использоваться для сравнения уровней паразитемии во время обследования пациента и может быть особенно полезен для мониторинга рецидивов [18]. Изменения количества копий миникольца во время перехода стадии (промастиготы-амастиготы) также исследовались в 9Штамм 0280 L. chagasi (было показано, что L. chagasi идентичен штамму L. infantum из юго-западной Европы [73]). Существенных различий обнаружено не было, что позволяет сделать вывод о том, что стандартные кривые, полученные из ДНК, полученной из промастигот, могут быть использованы для количественного определения амастигот одного и того же вида/штамма [20].
Следует также отметить, что гетерогенность последовательности миниколец могла быть потеряна при непрерывном культивировании [74]; также было показано, что in vitro селекция лекарственно-устойчивых штаммов L. amazonensis приводит к изменению доминирования класса миникольцев кДНК [75]. Однокопийные мишени не имеют этих недостатков и могут обеспечить лучшую количественную точность, но их чувствительность может быть слишком низкой для диагностических целей с использованием образцов с низкой нагрузкой паразитов и без выделения/культивирования паразитов. Например, однокопийный ген ДНК-полимеразы I использовали для нормализации числа копий миникольца кДНК с использованием метода сравнительного количественного определения (ΔΔCt) [18, 20].
При использовании клинических образцов следует учитывать наличие ДНК хозяина в качестве фона. Фактически, избыток фоновой ДНК может повлиять на надежность результатов количественной ПЦР. Таким образом, стандартные кривые должны быть проверены путем добавления соответствующих количеств ДНК хозяина в смеси для ПЦР, чтобы имитировать амплификацию в клинических образцах. В некоторых случаях присутствие фоновой ДНК может влиять на значения Ct: задержки в несколько циклов наблюдались в анализах количественной ПЦР, нацеленных на миникольцевую кДНК с использованием Leishmania 9.Образцы ДНК 0281 с добавлением ДНК человека или собаки (100 нг и 30 нг соответственно) [14, 17]. Тем не менее, диапазон линейности количественной ПЦР оставался неизменным вплоть до пределов обнаружения анализа. В других случаях фоновая ДНК хозяина, по-видимому, не влияла на значения Ct. Например, в количественной ПЦР, нацеленной на G6PD , аналогичные значения Ct были получены в присутствии по сравнению с в отсутствие ДНК человека (20 нг), и присутствие этой фоновой ДНК не влияло на чувствительность [13]. Мы также протестировали использование конъюнктивальных мазков (CS) для оценки CanL с помощью количественной ПЦР, нацеленной на кДНК. Поскольку мы использовали сырые лизаты CS в качестве источника Leishmania ДНК, их потенциальное ингибирование в количественной ПЦР было протестировано: было обнаружено, что 1 мкл сырого лизата на 25 мкл реакционной смеси для количественной ПЦР не оказывает никакого ингибирующего действия на анализы, что позволяет проводить точную количественную оценку [48].
В некоторых случаях присутствие фоновой ДНК может влиять на значения Ct: задержки в несколько циклов наблюдались в анализах количественной ПЦР, нацеленных на миникольцевую кДНК с использованием Leishmania 9.Образцы ДНК 0281 с добавлением ДНК человека или собаки (100 нг и 30 нг соответственно) [14, 17]. Тем не менее, диапазон линейности количественной ПЦР оставался неизменным вплоть до пределов обнаружения анализа. В других случаях фоновая ДНК хозяина, по-видимому, не влияла на значения Ct. Например, в количественной ПЦР, нацеленной на G6PD , аналогичные значения Ct были получены в присутствии по сравнению с в отсутствие ДНК человека (20 нг), и присутствие этой фоновой ДНК не влияло на чувствительность [13]. Мы также протестировали использование конъюнктивальных мазков (CS) для оценки CanL с помощью количественной ПЦР, нацеленной на кДНК. Поскольку мы использовали сырые лизаты CS в качестве источника Leishmania ДНК, их потенциальное ингибирование в количественной ПЦР было протестировано: было обнаружено, что 1 мкл сырого лизата на 25 мкл реакционной смеси для количественной ПЦР не оказывает никакого ингибирующего действия на анализы, что позволяет проводить точную количественную оценку [48].
Хотя использование крови в качестве клинического образца дает результаты в виде паразитов/мл, количественное определение на твердых образцах (мазки, биопсии и т. д.) требует количественного определения как паразитов, так и клеток-хозяев (с помощью другой количественной ПЦР для одной копии гена-хозяина ). Сравнение двух результатов кПЦР позволяет получить количество паразитов/количество клеток-хозяев [13, 33, 34, 48, 76, 77]. В качестве альтернативы, если выход экстракции ДНК воспроизводим среди различных образцов и количество ДНК может быть точно определено, количество паразитов также может быть нормализовано к мкг тканевой ДНК [78]. Помимо количественного определения паразита и клетки-хозяина, значение ΔCt между кривыми амплификации Leishmania -мишень и эталонный ген-хозяин (Ct Leishmania — ген-хозяин Ct) использовали в качестве дополнительного параметра для мониторинга изменений паразитарной нагрузки в течение болезни или лечения. Фактически увеличение или уменьшение значений ΔCt коррелирует с уменьшением или увеличением паразитарной нагрузки соответственно [48, 79]. Это сравнение возможно только в том случае, если эффективность количественной ПЦР Leishmania и гена-хозяина аналогична. Этот подход, основанный на расчете ΔCt двух анализов КПЦР, может обойти проблему точной количественной оценки паразитарной нагрузки (на основе стандартных эталонных штаммов) и избежать использования двух стандартных кривых, что ограничивает стоимость анализов [48].
Это сравнение возможно только в том случае, если эффективность количественной ПЦР Leishmania и гена-хозяина аналогична. Этот подход, основанный на расчете ΔCt двух анализов КПЦР, может обойти проблему точной количественной оценки паразитарной нагрузки (на основе стандартных эталонных штаммов) и избежать использования двух стандартных кривых, что ограничивает стоимость анализов [48].
В последнее время были предприняты усилия по сокращению затрат и времени, необходимых для получения результатов диагностики, а также по уменьшению количества манипуляций, что снижает риск ошибок или загрязнения. Например, анализ ПЦР в реальном времени, ранее разработанный Francino et al. [80] для обнаружения и количественного определения кинетопластной ДНК L. infantum был оптимизирован с точки зрения меньшего объема реакции и более короткого времени выполнения [81]. Более того, Рампаццо и соавт. [82] разработали готовый к использованию (желатинизированный и не требующий замораживания) дуплексный ПЦР для идентификации L. infantum у собак. В этом анализе кПЦР для обнаружения гена рРНК 18S собаки и кПЦР для обнаружения кДНК L. infantum были объединены, показывая предел обнаружения 1 паразит/реакция во всех протестированных тканях собак (аспираты селезенки, кожа и кровь).
infantum у собак. В этом анализе кПЦР для обнаружения гена рРНК 18S собаки и кПЦР для обнаружения кДНК L. infantum были объединены, показывая предел обнаружения 1 паразит/реакция во всех протестированных тканях собак (аспираты селезенки, кожа и кровь).
Анализы количественной ПЦР на лейшманиоз, которые амплифицируют видоспецифичные последовательности ДНК, не подходят для регионов с симпатрическими видами Leishmania [83]. На самом деле, даже в районах, где видов Leishmania , наличие полиморфизмов и вариаций числа копий последовательностей-мишеней (например, классы мини-колец) может мешать выполнению анализов количественной ПЦР. Чтобы исключить ложноотрицательные результаты или коинфекцию другими видами Leishmania , видоспецифическую количественную ПЦР следует сочетать с родоспецифическим анализом (анализ широкого диапазона) [24]. Таким образом, должны быть полезны подходы, основанные на первоначальной амплификации родоспецифичных последовательностей с последующим анализом видовой дифференциации/типирования.
Количественная ПЦР для мониторинга
Leishmania среди насекомых-переносчиков лейшманиоза человека [84]. Поскольку микроскопическое обнаружение паразитов в кишечнике москитов является трудоемким и требует много времени, были внедрены биомолекулярные анализы с целью изучения потенциальной роли видов москитов в распространении Leishmania паразиты. В 2008 г. Ранасингхе и соавт. [85] предложили количественную ПЦР для обнаружения ДНК L. chagasi в Lutzomyia longipalpis с использованием гена ДНК-полимеразы паразита в качестве молекулярной мишени и зонда TaqMan® с пределами обнаружения 10 пг ДНК Leishmania (∼ 120 паразитов) в 100 нг ДНК москита. Количественная оценка паразитарной нагрузки в переносчике может быть очень важной. На самом деле, хорошо известно, что паразиты Leishmania могут манипулировать поведением москитов при кормлении, поскольку высокая паразитарная нагрузка в средней кишке москитов коррелирует с постоянным характером питания, что приводит к увеличению числа Leishmania трансмиссия [86]. Предлагаемый основной механизм — это блокировка стомодеального клапана, которая заставляет москитов дольше питаться одним и тем же или разными хозяевами, часто получая лишь частичную кровяную муку. Этот факт может увеличить вероятность передачи паразитов [87]. Таким образом, учитывая важность количественного теста, Bezerra-Vasconcelos et al. исследовали другие молекулярные мишени с целью повышения чувствительности анализа [32]. В своей работе авторы проанализировали чувствительность кДНК, ДНК-полимеразы α и гена 18S рРНК в анализе количественной ПЦР на основе SYBR-Green. Амплификация кДНК показала наибольшую чувствительность, демонстрируя способность обнаруживать ДНК, эквивалентную 0,004 паразита, и самую высокую точность. Последовательно Cunha et al. [88] исследовали использование кДНК кПЦР по сравнению с обычной ПЦР кДНК для обнаружения ДНК L. infantum в Lutzomyia longipalpis , делая вывод, что кДНК кДНК можно использовать для эпидемиологических исследований, поскольку этот анализ был особенно выгоден при анализе образцов, содержащих небольшое количество паразитов.
Предлагаемый основной механизм — это блокировка стомодеального клапана, которая заставляет москитов дольше питаться одним и тем же или разными хозяевами, часто получая лишь частичную кровяную муку. Этот факт может увеличить вероятность передачи паразитов [87]. Таким образом, учитывая важность количественного теста, Bezerra-Vasconcelos et al. исследовали другие молекулярные мишени с целью повышения чувствительности анализа [32]. В своей работе авторы проанализировали чувствительность кДНК, ДНК-полимеразы α и гена 18S рРНК в анализе количественной ПЦР на основе SYBR-Green. Амплификация кДНК показала наибольшую чувствительность, демонстрируя способность обнаруживать ДНК, эквивалентную 0,004 паразита, и самую высокую точность. Последовательно Cunha et al. [88] исследовали использование кДНК кПЦР по сравнению с обычной ПЦР кДНК для обнаружения ДНК L. infantum в Lutzomyia longipalpis , делая вывод, что кДНК кДНК можно использовать для эпидемиологических исследований, поскольку этот анализ был особенно выгоден при анализе образцов, содержащих небольшое количество паразитов. В аналогичном подходе кДНК SYBR-Green qPCR использовали для изучения вспышки в юго-западном регионе Мадрида. Использование количественного подхода позволило изучить паразитарную нагрузку у голодных и накормленных кровью Phlebotomus perniciosus самки москитов, пойманные в районе очага. Полученные данные позволили авторам подтвердить, что высокая паразитарная нагрузка у самок P. perniciosus без крови в кишечнике является неопровержимым доказательством правильной акклиматизации и размножения паразитов в средней кишке москита [87]. Используя подходы, основанные на количественной ПЦР, ДНК Leishmania также была обнаружена у москитов из Албании [89], Туниса [90] и Турции [91]. Недавно появился интересный подход, основанный на последовательной количественной ПЦР, нацеленной на кДНК, за которой последовали ITS1 qPCR был предложен Karaku et al. [92] для изучения очага лейшманиоза на юго-западе Турции. Фактически, в этом регионе сосуществуют 90 280 различных видов Leishmania 90 281, поэтому для скрининга инфекции у собранных москитов использовали родоспецифичную кДНК SYBR-Green qPCR, а qPCR, нацеленную на область 90 280 ITS1 90 281, проводили с использованием видоспецифичных праймеров для обнаружения 90 280 Комплекс L.
В аналогичном подходе кДНК SYBR-Green qPCR использовали для изучения вспышки в юго-западном регионе Мадрида. Использование количественного подхода позволило изучить паразитарную нагрузку у голодных и накормленных кровью Phlebotomus perniciosus самки москитов, пойманные в районе очага. Полученные данные позволили авторам подтвердить, что высокая паразитарная нагрузка у самок P. perniciosus без крови в кишечнике является неопровержимым доказательством правильной акклиматизации и размножения паразитов в средней кишке москита [87]. Используя подходы, основанные на количественной ПЦР, ДНК Leishmania также была обнаружена у москитов из Албании [89], Туниса [90] и Турции [91]. Недавно появился интересный подход, основанный на последовательной количественной ПЦР, нацеленной на кДНК, за которой последовали ITS1 qPCR был предложен Karaku et al. [92] для изучения очага лейшманиоза на юго-западе Турции. Фактически, в этом регионе сосуществуют 90 280 различных видов Leishmania 90 281, поэтому для скрининга инфекции у собранных москитов использовали родоспецифичную кДНК SYBR-Green qPCR, а qPCR, нацеленную на область 90 280 ITS1 90 281, проводили с использованием видоспецифичных праймеров для обнаружения 90 280 Комплекс L. donovani/infantum , L. tropica и L. major . Более того, ДНК, выделенная из брюшка только что накормленных самок москитов, была амплифицирована с использованием цитохрома b в качестве мишени для идентификации позвоночного источника кровяной муки и выявления предпочтений хозяина в районе исследования [92]. Интересно, что подход кПЦР использовался также для обнаружения ДНК L. infantum в клещах ( Rhipicephalus sanguineus ), изъятых у собак, живущих в эндемичных районах Италии, с обнаружением ДНК паразита во фракции исследованных клещей [93, 94]. Последовательно, Leishmania spp. промастиготы обнаружены в кишечнике, яичниках и слюнных железах R. sanguineus , активно инвазирующий собак в Бразилии [95]. В свете этих данных потребуются дополнительные исследования для дальнейшего изучения роли клещей в инфекции Leishmania .
donovani/infantum , L. tropica и L. major . Более того, ДНК, выделенная из брюшка только что накормленных самок москитов, была амплифицирована с использованием цитохрома b в качестве мишени для идентификации позвоночного источника кровяной муки и выявления предпочтений хозяина в районе исследования [92]. Интересно, что подход кПЦР использовался также для обнаружения ДНК L. infantum в клещах ( Rhipicephalus sanguineus ), изъятых у собак, живущих в эндемичных районах Италии, с обнаружением ДНК паразита во фракции исследованных клещей [93, 94]. Последовательно, Leishmania spp. промастиготы обнаружены в кишечнике, яичниках и слюнных железах R. sanguineus , активно инвазирующий собак в Бразилии [95]. В свете этих данных потребуются дополнительные исследования для дальнейшего изучения роли клещей в инфекции Leishmania . Количественная ПЦР для
Leishmania генотипирование Для получения информации о типировании паразитов на уровне подродов, комплексов или видов могут быть разработаны как качественные, так и количественные ПЦР-анализы в реальном времени. Для этой цели были оценены различные мишени, такие как ITS область, SSU, HSP70 , G6PD , 6PGD , MPI , цистеиновая протеаза B ( cpB ), миникольцо кДНК и др. [83]. В последние годы были опубликованы различные методы типирования на основе КПЦР. Например, Вортманн и др. разработали ПЦР в реальном времени для обнаружения и дифференциации четырех комплексов Leishmania ( L. mexicana , L. donovani/infantum , L. major и видов, принадлежащих к подроду Виания ). Праймеры/зонды были сконструированы для гена глюкозофосфатизомеразы ( GPI ) с использованием изменчивости последовательности этого гена среди видов Leishmania . Предел обнаружения для всех анализов составил 5,6 пг, что эквивалентно примерно 165 копиям генома [36].
Для этой цели были оценены различные мишени, такие как ITS область, SSU, HSP70 , G6PD , 6PGD , MPI , цистеиновая протеаза B ( cpB ), миникольцо кДНК и др. [83]. В последние годы были опубликованы различные методы типирования на основе КПЦР. Например, Вортманн и др. разработали ПЦР в реальном времени для обнаружения и дифференциации четырех комплексов Leishmania ( L. mexicana , L. donovani/infantum , L. major и видов, принадлежащих к подроду Виания ). Праймеры/зонды были сконструированы для гена глюкозофосфатизомеразы ( GPI ) с использованием изменчивости последовательности этого гена среди видов Leishmania . Предел обнаружения для всех анализов составил 5,6 пг, что эквивалентно примерно 165 копиям генома [36].
Праймеры для ПЦР, которые специфически амплифицируют вид или группу видов, были разработаны на миникольцевой кДНК с использованием полиморфизма последовательностей. Однако некоторые авторы наблюдали перекрестную реакцию между видами, вероятно, из-за изменчивости классов миниколец у каждого из них [17, 19]. , 20, 23]. В другом подходе, с использованием общих праймеров для амплификации различных видов, различия в температуре плавления (Tm) ПЦР-амплифицированных областей миникольца кДНК использовались для дифференциации видов Leishmania . Николас и др. оптимизировал анализ для различения видов Старого Света L. major , L. donovani , L. tropica и L. infantum . Однако этот анализ не позволил дифференцировать L. tropica и L. infantum 9.0281 по их значениям Tm [96]. Впоследствии Де Монбрисон и соавт. [97] использовали те же праймеры в ПЦР в реальном времени с последующим анализом кривой плавления для мониторинга видов Leishmania у пациентов с КЛ из Алжира, подтвердив распространенность L. major (44,1%). Однако около 30% клинических образцов не поддавались определению. В другом исследовании Tm-анализ ампликонов, полученных из консервативной области миникольцевой кДНК, позволил дифференцировать подрод L. ( Leishmania ) от L.
, 20, 23]. В другом подходе, с использованием общих праймеров для амплификации различных видов, различия в температуре плавления (Tm) ПЦР-амплифицированных областей миникольца кДНК использовались для дифференциации видов Leishmania . Николас и др. оптимизировал анализ для различения видов Старого Света L. major , L. donovani , L. tropica и L. infantum . Однако этот анализ не позволил дифференцировать L. tropica и L. infantum 9.0281 по их значениям Tm [96]. Впоследствии Де Монбрисон и соавт. [97] использовали те же праймеры в ПЦР в реальном времени с последующим анализом кривой плавления для мониторинга видов Leishmania у пациентов с КЛ из Алжира, подтвердив распространенность L. major (44,1%). Однако около 30% клинических образцов не поддавались определению. В другом исследовании Tm-анализ ампликонов, полученных из консервативной области миникольцевой кДНК, позволил дифференцировать подрод L. ( Leishmania ) от L. ( Viannia ), но определение видов не представлялось возможным [98]. Впоследствии де Мораис и соавт. [99] идентифицировали два диапазона Tm, используя ранее разработанные праймеры, сконструированные на миникольце кДНК [59], для дифференциации двух групп видов, вызывающих КЛ в Бразилии. В группу 1 вошли L. ( V. ) braziliensis , L. ( V. ) panamensis , L. 1 ( V.0281, L. ( V. ) Guyanensis , L. ( V. ) shawi (Tm = 78–79,99 °С), а в группу 2 2 2 2 8 L. 2 вошли 901 90 V. ) naiffi , L. ( L. ) amazonensis и L. ( L. ) mexicana °C . В общей сложности 223 положительных образца крови были проанализированы с помощью количественной ПЦР с последующим анализом Tm, и результаты были сопоставлены с другими методами, такими как секвенирование SSU, кДНК-ПЦР-RFLP и MLEE. Не было обнаружено существенных различий между методами секвенирования qPCR и MLEE или SSU, в то время как для qPCR и RFLP наблюдалась очень значительная разница.
( Viannia ), но определение видов не представлялось возможным [98]. Впоследствии де Мораис и соавт. [99] идентифицировали два диапазона Tm, используя ранее разработанные праймеры, сконструированные на миникольце кДНК [59], для дифференциации двух групп видов, вызывающих КЛ в Бразилии. В группу 1 вошли L. ( V. ) braziliensis , L. ( V. ) panamensis , L. 1 ( V.0281, L. ( V. ) Guyanensis , L. ( V. ) shawi (Tm = 78–79,99 °С), а в группу 2 2 2 2 8 L. 2 вошли 901 90 V. ) naiffi , L. ( L. ) amazonensis и L. ( L. ) mexicana °C . В общей сложности 223 положительных образца крови были проанализированы с помощью количественной ПЦР с последующим анализом Tm, и результаты были сопоставлены с другими методами, такими как секвенирование SSU, кДНК-ПЦР-RFLP и MLEE. Не было обнаружено существенных различий между методами секвенирования qPCR и MLEE или SSU, в то время как для qPCR и RFLP наблюдалась очень значительная разница.
Подходы, основанные на анализе Tm, были также опробованы с использованием гена трипаредоксинпероксидазы [37]. В этом случае была разработана кПЦР на основе SYBR-green гена трипаредоксинпероксидазы, включающая анализ стадии плавления, чтобы различать L. ( L. ) major и L. ( L. ) tropica. , вызывающий кожный лейшманиоз в Иране [37].
Анализ плавления также выполняли с использованием датчиков флуоресцентного резонансного переноса энергии (FRET) [100]. Первым применил эту технологию за Типирование Leishmania , Schulz et al. разработали анализ кПЦР с зондами FRET, используя область SSU в качестве мишени [101]. Анализ показал аналитическую чувствительность 94,1 паразитов/мл крови (ДИ 95%, 70–145,3 паразитов/мл), и анализ с помощью плавящихся зондов позволил выделить три клинически значимые группы (комплекс L. donovani , комплекс L. braziliensis и другие ). Leishmania spp.). Совсем недавно Tsukayama et al. [9] использовали полиморфизмы в генах MPI и 6PGD для разработки двух ПЦР в реальном времени на основе технологии FRET и анализа кривой плавления. Эти анализы идентифицировали пять Leishmania вида Viannia Подрод, высоко распространенный в Южной Америке: L. ( В. ) Braziliensis , L. ( v. , , , , , , , , , , , , , , , , , , , , , , , , , , . ( В. ) гуянский , Л. ( В. ) Перувиана и Л. ( В .) лейнсони . Однако, чтобы повысить чувствительность анализов с клиническими образцами, обычные ПЦР для генов MPI и 6PGD были проведены до вложенных амплификаций ПЦР в реальном времени, но это ухудшило возможность количественного определения. Подход, основанный на технологии FRET и анализе кривых плавления, также использовался Nath-Chowdhury et al.
[9] использовали полиморфизмы в генах MPI и 6PGD для разработки двух ПЦР в реальном времени на основе технологии FRET и анализа кривой плавления. Эти анализы идентифицировали пять Leishmania вида Viannia Подрод, высоко распространенный в Южной Америке: L. ( В. ) Braziliensis , L. ( v. , , , , , , , , , , , , , , , , , , , , , , , , , , . ( В. ) гуянский , Л. ( В. ) Перувиана и Л. ( В .) лейнсони . Однако, чтобы повысить чувствительность анализов с клиническими образцами, обычные ПЦР для генов MPI и 6PGD были проведены до вложенных амплификаций ПЦР в реальном времени, но это ухудшило возможность количественного определения. Подход, основанный на технологии FRET и анализе кривых плавления, также использовался Nath-Chowdhury et al. [8] для дифференциации видов CL Старого Света [ L. ( L. ) major , L. ( L. ) tropica и L. ( L. ) aethiopica ], используя ген cpB в качестве мишени. Более того, Тоз и соавт. [71] разработали ПЦР-анализ в реальном времени на ITS1 для идентификации видов Старого Света L. ( L. ) tropica , L. ( L. ) major и 0 major 0. ( L. ) donovani Комплекс, использующий зонды FRET для диагностики и одновременной дифференциации турецких видов в клинических образцах. Этот тест обеспечил достаточную чувствительность для быстрого и правильного обнаружения паразитов непосредственно из клинического материала, что позволило идентифицировать L. ( L. ) tropica и L. ( L. ) infantum в Турции [71].
[8] для дифференциации видов CL Старого Света [ L. ( L. ) major , L. ( L. ) tropica и L. ( L. ) aethiopica ], используя ген cpB в качестве мишени. Более того, Тоз и соавт. [71] разработали ПЦР-анализ в реальном времени на ITS1 для идентификации видов Старого Света L. ( L. ) tropica , L. ( L. ) major и 0 major 0. ( L. ) donovani Комплекс, использующий зонды FRET для диагностики и одновременной дифференциации турецких видов в клинических образцах. Этот тест обеспечил достаточную чувствительность для быстрого и правильного обнаружения паразитов непосредственно из клинического материала, что позволило идентифицировать L. ( L. ) tropica и L. ( L. ) infantum в Турции [71].
Внедрение технологии расплава с высоким разрешением (HRM) позволило улучшить технические подходы к идентификации видов Leishmania . Анализ HRM ампликона из региона ITS1 был использован для идентификации видов Old World Leishmania [28]. При тестировании 300 образцов от людей, резервуарных хозяев и москитов этот подход выявил L. major , L. tropica , L. aethiopica и L. infantum/donovani виды. Совсем недавно Cardoso et al. [102] использовали этот анализ для оценки эпидемиологической роли рыжих лисиц как резервуаров в Португалии. Анализ HRM ампликона из гена HSP70 позволил выделить восемь видов Leishmania Нового Света, т.е. ( л. ) амазонский , L. ( L. ) Mexicana , L. ( В. ) LAINSONI , L. ( V. , L. ( V. , L. ( V. ) L. ( V. , L. V. ) GuyAnensis , L. ( V .) NAIFFI и L. ( V. ) Shawi , и три старого мира ) Shawi , и три старого мира. ) Тропика , Л.
Анализ HRM ампликона из региона ITS1 был использован для идентификации видов Old World Leishmania [28]. При тестировании 300 образцов от людей, резервуарных хозяев и москитов этот подход выявил L. major , L. tropica , L. aethiopica и L. infantum/donovani виды. Совсем недавно Cardoso et al. [102] использовали этот анализ для оценки эпидемиологической роли рыжих лисиц как резервуаров в Португалии. Анализ HRM ампликона из гена HSP70 позволил выделить восемь видов Leishmania Нового Света, т.е. ( л. ) амазонский , L. ( L. ) Mexicana , L. ( В. ) LAINSONI , L. ( V. , L. ( V. , L. ( V. ) L. ( V. , L. V. ) GuyAnensis , L. ( V .) NAIFFI и L. ( V. ) Shawi , и три старого мира ) Shawi , и три старого мира. ) Тропика , Л. ( Л. ) доновани и л. ( л. ) майор [29]. Этот метод продемонстрировал высокую чувствительность, обнаруживая менее одного паразита за реакцию даже в присутствии ДНК хозяина. В другом подходе последовательная амплификация и HRM-анализ HSP70 , а затем ITS1 позволил выделить шесть видов Leishmania Нового Света ( L. mexicana , L. infantum chagasi , L. 0amazonensis, L. 0amazonensis). Л. панамский , L. Guyanensis и L. braziliensis ) с пределом обнаружения 10 паразитов/мл [27]. Анализ HRM также был применен к кДНК кПЦР с миникольцами, что позволило различить подроды Leishmania и Viannia , а также от L. ( L. ) infantum и L. и L. ( 1 ) 8 . amazonensis [14]. Однако анализ HRM, выполненный на 62 клинических образцах от собак, инфицированных L. ( L. ) МАТАНТУМ показал, что дискриминация между L.
( Л. ) доновани и л. ( л. ) майор [29]. Этот метод продемонстрировал высокую чувствительность, обнаруживая менее одного паразита за реакцию даже в присутствии ДНК хозяина. В другом подходе последовательная амплификация и HRM-анализ HSP70 , а затем ITS1 позволил выделить шесть видов Leishmania Нового Света ( L. mexicana , L. infantum chagasi , L. 0amazonensis, L. 0amazonensis). Л. панамский , L. Guyanensis и L. braziliensis ) с пределом обнаружения 10 паразитов/мл [27]. Анализ HRM также был применен к кДНК кПЦР с миникольцами, что позволило различить подроды Leishmania и Viannia , а также от L. ( L. ) infantum и L. и L. ( 1 ) 8 . amazonensis [14]. Однако анализ HRM, выполненный на 62 клинических образцах от собак, инфицированных L. ( L. ) МАТАНТУМ показал, что дискриминация между L. ( L. ) Amazonensis и L. ( L. и L. ( L. ) L. ( L. ) L. ( L. случаев из-за перекрытия пиков плавления или поздней амплификации (Ct ˃ 30) [17]. Поэтому для различения L. ( L. ) infantum и L. ( L. ) amazonensis 9 была использована комбинация двух анализов кПЦР.0281, используя основное изобилие класса миникольцевой кДНК в L. ( L. ) amazonensis , а не ориентируясь на гипотетическую видоспецифичную последовательность [17]. Важно отметить, что в систематическом исследовании Weirather et al. [20] разработали стратегию последовательной количественной ПЦР для идентификации и быстрой дифференциации видов Leishmania и количественного определения паразитов. Сначала были использованы отобранные скрининговые праймеры для распознавания ДНК миникольца кинетопластов всех видов Leishmania . Затем для идентификации видов использовали дополнительные количественные ПЦР, индивидуализированные для географических регионов, сочетая праймеры, зонды и анализ кривых плавления.
( L. ) Amazonensis и L. ( L. и L. ( L. ) L. ( L. ) L. ( L. случаев из-за перекрытия пиков плавления или поздней амплификации (Ct ˃ 30) [17]. Поэтому для различения L. ( L. ) infantum и L. ( L. ) amazonensis 9 была использована комбинация двух анализов кПЦР.0281, используя основное изобилие класса миникольцевой кДНК в L. ( L. ) amazonensis , а не ориентируясь на гипотетическую видоспецифичную последовательность [17]. Важно отметить, что в систематическом исследовании Weirather et al. [20] разработали стратегию последовательной количественной ПЦР для идентификации и быстрой дифференциации видов Leishmania и количественного определения паразитов. Сначала были использованы отобранные скрининговые праймеры для распознавания ДНК миникольца кинетопластов всех видов Leishmania . Затем для идентификации видов использовали дополнительные количественные ПЦР, индивидуализированные для географических регионов, сочетая праймеры, зонды и анализ кривых плавления. Комбинация анализов позволила обнаружить, количественно определить и определить виды паразитов Leishmania в разных образцах от больных из Бангладеш или Бразилии, больных разными формами лейшманиоза [20].
Комбинация анализов позволила обнаружить, количественно определить и определить виды паразитов Leishmania в разных образцах от больных из Бангладеш или Бразилии, больных разными формами лейшманиоза [20].
В совокупности анализы на основе ПЦР в реальном времени продемонстрировали надежность и доступность при типировании Leishmania spp. Однако из-за изменчивости/гетерогенности паразитов невозможно установить единый метод для количественного определения паразитов и определения видов в клинических образцах, и возникла необходимость комбинирования различных анализов или их адаптации к географическим регионам.
Выводы
Применение количественной ПЦР для диагностики лейшманиоза способствовало развитию чувствительных и специфических подходов, которые являются важной частью диагностического процесса и позволяют проводить раннее и адекватное лечение [103, 104]. Приложения ПЦР в реальном времени для обнаружения/количественного определения и типирования видов Leishmania представляют собой шаг вперед по сравнению с классическими методологиями с точки зрения автоматизации и возможности высокой пропускной способности, скорости и высокой чувствительности. Тем не менее стандартизированный анализ для одновременной оценки паразитарной нагрузки и генотипа интересующих видов в конкретной географической области все еще отсутствует. На самом деле не существует единого мнения относительно процедур сбора клинических образцов, методов выделения ДНК, последовательностей-мишеней, использования мишени-хозяина в качестве эталона для нормализации или контроля качества и т. д. анализ имеет плюсы и минусы, трудно определить идеальный подход. Таким образом, можно предложить комбинацию различных анализов для максимальной чувствительности и специфичности. Поскольку первой целью клинического или эпидемиологического расследования является определение наличия или отсутствия паразитов Leishmania , высококопийная мишень, обеспечивающая низкий предел обнаружения, такая как миникольцевая кДНК, представляется лучшим выбором. Однако чувствительность qPCR, направленная на кДНК миникольца, может варьироваться в зависимости от вида, комплекса или подрода (в зависимости от состава классов миникольца).
Тем не менее стандартизированный анализ для одновременной оценки паразитарной нагрузки и генотипа интересующих видов в конкретной географической области все еще отсутствует. На самом деле не существует единого мнения относительно процедур сбора клинических образцов, методов выделения ДНК, последовательностей-мишеней, использования мишени-хозяина в качестве эталона для нормализации или контроля качества и т. д. анализ имеет плюсы и минусы, трудно определить идеальный подход. Таким образом, можно предложить комбинацию различных анализов для максимальной чувствительности и специфичности. Поскольку первой целью клинического или эпидемиологического расследования является определение наличия или отсутствия паразитов Leishmania , высококопийная мишень, обеспечивающая низкий предел обнаружения, такая как миникольцевая кДНК, представляется лучшим выбором. Однако чувствительность qPCR, направленная на кДНК миникольца, может варьироваться в зависимости от вида, комплекса или подрода (в зависимости от состава классов миникольца). Таким образом, в зависимости от видов в конкретном географическом районе, различные анализы количественной ПЦР для выявления различных таксонов с высокой чувствительностью могут проводиться параллельно или последовательно, чтобы получить указание на подрод или комплекс (посредством анализа плавления или относительного содержания целевой последовательности), а также как количественная информация. Затем на основе полученных результатов можно выбрать другие анализы количественной ПЦР для генотипирования на уровне вида. Использование SYBR green в сочетании с анализом плавления или HRM поможет снизить стоимость, но не позволит мультиплексировать. Кроме того, в случае клинических образцов с низким содержанием паразитов можно использовать вложенный подход для обогащения целевой последовательности перед применением видоспецифических анализов количественной ПЦР, что позволяет избежать поздней амплификации (Ct ˃ 30) или невозможности достижения плато в чтобы ограничить неубедительные или плохо воспроизводимые результаты анализа HRM [105].
Таким образом, в зависимости от видов в конкретном географическом районе, различные анализы количественной ПЦР для выявления различных таксонов с высокой чувствительностью могут проводиться параллельно или последовательно, чтобы получить указание на подрод или комплекс (посредством анализа плавления или относительного содержания целевой последовательности), а также как количественная информация. Затем на основе полученных результатов можно выбрать другие анализы количественной ПЦР для генотипирования на уровне вида. Использование SYBR green в сочетании с анализом плавления или HRM поможет снизить стоимость, но не позволит мультиплексировать. Кроме того, в случае клинических образцов с низким содержанием паразитов можно использовать вложенный подход для обогащения целевой последовательности перед применением видоспецифических анализов количественной ПЦР, что позволяет избежать поздней амплификации (Ct ˃ 30) или невозможности достижения плато в чтобы ограничить неубедительные или плохо воспроизводимые результаты анализа HRM [105]. Несмотря на значительный прогресс, достигнутый в последние годы, ПЦР в реальном времени все еще далека от рутинного клинического применения в эндемичных районах. Стоимость оборудования и реагентов является важным фактором, препятствующим переходу от исследований к рутинному клиническому применению в эндемичных районах. Однако миниатюризация оборудования для ПЦР в реальном времени, а также повышенная доступность реагентов для количественной ПЦР могут увеличить рутинное использование методов количественной ПЦР в странах с низким уровнем дохода.
Несмотря на значительный прогресс, достигнутый в последние годы, ПЦР в реальном времени все еще далека от рутинного клинического применения в эндемичных районах. Стоимость оборудования и реагентов является важным фактором, препятствующим переходу от исследований к рутинному клиническому применению в эндемичных районах. Однако миниатюризация оборудования для ПЦР в реальном времени, а также повышенная доступность реагентов для количественной ПЦР могут увеличить рутинное использование методов количественной ПЦР в странах с низким уровнем дохода.
Сокращения
- 6PGD:
-
6-фосфоглюконатдегидрогеназа
- КЛ:
-
Кожный лейшманиоз
- КТ:
-
Пороговый цикл
- ЛАД:
-
Резонансная передача энергии флуоресценции
- G6PD:
-
Глюкозо-6-фосфатдегидрогеназа
- GPI:
-
Глюкозофосфатизомераза
- Управление персоналом:
-
Расплав высокого разрешения
- HSP70:
-
Белок теплового шока 70
- кДНК:
-
Кинетопласт ДНК
- MCL:
-
Кожно-слизистый лейшманиоз
- ИМБ:
-
Маннозофосфатизомераза
- КПЦР:
-
Количественная ПЦР в реальном времени
- ВЛ:
-
Висцеральный лейшманиоз
Ссылки
- «>
-
Альвар Дж., Велес И.Д., Берн С., Эрреро М., Дежо П., Кано Дж. и др. Лейшманиоз во всем мире и глобальные оценки его заболеваемости. ПЛОС Один. 2012;7:e35671.
КАС пабмед ПабМед Центральный Статья Google ученый
-
Родригес-Кортес А., Охеда А., Франсино О., Лопес-Фуэртес Л., Тимон М., Альберола Дж. Инфекция Leishmania : лабораторная диагностика при отсутствии «золотого стандарта». Am J Trop Med Hyg. 2010; 82: 251–6.
-
de Paiva-Cavalcanti M, de Morais RCS, Pessoa-e-Silva R, Trajano-Silva LAM, Gonçalves-de-Albuquerque S da C, Tavares D de HC, et al. Диагностика лейшманиозов: обновленная информация об использовании иммунологических и молекулярных инструментов.
 Клетка Биоски. 2015;5:31.
Клетка Биоски. 2015;5:31. ПабМед ПабМед Центральный Статья КАС Google ученый
-
Рид Г.Х., Кент Д.О., Виттвер, Коннектикут. Анализ плавления ДНК с высоким разрешением для простой и эффективной молекулярной диагностики. Фармакогеномика. 2007; 8: 597–608.
КАС пабмед Статья Google ученый
-
Бретань С., Дюран Р., Оливи М., Гарин Дж. Ф., Сулахян А., Риволле Д. и др. ПЦР в реальном времени как новый инструмент для количественной оценки Leishmania infantum в печени инфицированных мышей. Клин Вакцина Иммунол. 2001; 8: 828–31.
КАС Статья Google ученый
-
Николя Л., Прина Э., Ланг Т., Милон Г. ПЦР в реальном времени для обнаружения и количественного определения Leishmania в тканях мыши. Дж. Клин Микробиол.
 2002; 40:1666–9.
2002; 40:1666–9. КАС пабмед ПабМед Центральный Статья Google ученый
-
Нат-Чоудхури М., Сангаралингам М., Бастьен П., Равель С., Пратлонг Ф., Мендес Дж. и др. ПЦР в реальном времени с использованием технологии FRET для дифференциации видов кожного лейшманиоза Старого Света. Векторы паразитов. 2016;9:255.
ПабМед ПабМед Центральный Статья КАС Google ученый
-
Цукаяма П., Нуньес Дж. Х., Де Лос Сантос М., Соберон В., Лукас К. М., Матлашевски Г. и др. ПЦР-анализ в реальном времени на основе FRET для выявления основных возбудителей покровного лейшманиоза Нового Света. PLoS Negl Trop Dis. 2013;7:e1956.
КАС пабмед ПабМед Центральный Статья Google ученый
-
Галлетти Э., Бонилаури П., Бардаси Л., Фонтана М.
 С., Рамини М., Ренци М. и др. Разработка зонда связывания малой бороздки на основе ПЦР в реальном времени для диагностики и количественного определения Leishmania infantum в образцах собак. рез. вет. 2011;91:243–5.
С., Рамини М., Ренци М. и др. Разработка зонда связывания малой бороздки на основе ПЦР в реальном времени для диагностики и количественного определения Leishmania infantum в образцах собак. рез. вет. 2011;91:243–5. КАС пабмед Статья Google ученый
-
Llanes A, Restrepo CM, Vecchio GD, Anguizola FJ, Lleonart R. Геном Leishmania panamensis : анализ геномики L . ( Viannia ) подрод. Научн. отп. 2015; 5:8550.
КАС пабмед ПабМед Центральный Статья Google ученый
-
Стюарт К.Д., Шнауфер А., Эрнст Н.Л., Паниграхи А.К. Комплексное управление: редактирование РНК в трипаносомах. Тенденции биохимических наук. 2005;30:97–105.
КАС пабмед Статья Google ученый
-
Хара М., Адауи В., Валенсия Б.
 М., Мартинес Д., Альба М., Кастрильон С. и др. ПЦР-анализ в реальном времени для обнаружения и количественного определения микроорганизмов Leishmania ( Viannia ) в поражениях кожи и слизистых оболочек: предварительное исследование паразитарной нагрузки и клинических параметров. Дж. Клин Микробиол. 2013;51:1826–33.
М., Мартинес Д., Альба М., Кастрильон С. и др. ПЦР-анализ в реальном времени для обнаружения и количественного определения микроорганизмов Leishmania ( Viannia ) в поражениях кожи и слизистых оболочек: предварительное исследование паразитарной нагрузки и клинических параметров. Дж. Клин Микробиол. 2013;51:1826–33. ПабМед ПабМед Центральный Статья Google ученый
-
Чеккарелли М., Галлуцци Л., Мильяццо А., Маньяни М. Обнаружение и характеристика Leishmania ( Leishmania ) и Leishmania ( Viannia ) на основе зеленой ПЦР с высоким разрешением в реальном времени и ПЦР высокого разрешения SYBR анализ ДНК миникольца кинетопластов. ПЛОС Один. 2014;9:e88845.
ПабМед ПабМед Центральный Статья КАС Google ученый
-
Штурм Н.Р., Симпсон Л. Миникольца Leishmania tarentolae различных классов последовательностей кодируют одну направляющую РНК, расположенную в вариабельной области примерно в 150 п.
 н. от консервативной области. Нуклеиновые Кислоты Res. 1991;19:6277–81.
н. от консервативной области. Нуклеиновые Кислоты Res. 1991;19:6277–81. КАС пабмед ПабМед Центральный Статья Google ученый
-
Симпсон Л., Дуглас С.М., Лейк Дж.А., Пеллегрини М., Ли Ф. Сравнение митохондриальных геномов и транскриптомов устойчивого состояния двух штаммов трипаносоматидного паразита, Leishmania tarentolae . PLoS Negl Trop Dis. 2015;9:e0003841.
ПабМед ПабМед Центральный Статья КАС Google ученый
-
Ceccarelli M, Galluzzi L, Diotallevi A, Andreoni F, Fowler H, Petersen C, et al. Использование относительной численности подкласса миникольца кДНК для дифференциации Leishmania ( L .) infantum и Leishmania ( L. ) amazonensis . Векторы паразитов. 2017;10:239.
ПабМед ПабМед Центральный Статья КАС Google ученый
«> -
Лосада-Барраган М., Кавальканти А., Уманья-Перес А., Порроцци Р., Куэрво-Эскобар С., Вальехо А.Ф. и другие. Обнаружение и количественная оценка Leishmania infantum в естественно и экспериментально инфицированных образцах животных. Вет Паразитол. 2016; 226:57–64.
ПабМед Статья Google ученый
-
Weirather JL, Jeronimo SMB, Gautam S, Sundar S, Kang M, Kurtz MA, et al. Серийный количественный анализ ПЦР для обнаружения, различения видов и количественного определения Leishmania spp. в образцах человека. Дж. Клин Микробиол. 2011;49:3892–904.

КАС пабмед ПабМед Центральный Статья Google ученый
-
Miró G, Cardoso L, Pennisi MG, Oliva G, Baneth G. Собачий лейшманиоз – новые концепции и взгляды на распространяющийся зооноз: часть вторая. Тенденции Паразитол. 2008; 24: 371–37.
ПабМед Статья Google ученый
-
Gomes CM, Cesetti MV, de Paula NA, Vernal S, Gupta G, Sampaio RNR, et al. Полевая валидация ПЦР в реальном времени на основе SYBR Green и TaqMan с использованием образцов биопсии и мазков для диагностики американского тегументарного лейшманиоза в районе, где Leishmania ( Viannia ) braziliensis является эндемичным. Дж. Клин Микробиол. 2017; 55: 526–34.
ПабМед ПабМед Центральный Статья Google ученый
-
Ван дер Ауэра Г., Дюжарден Дж.
 -К. Видотипирование кожного лейшманиоза. Clin Microbiol Rev. 2015; 28: 265–9.4.
-К. Видотипирование кожного лейшманиоза. Clin Microbiol Rev. 2015; 28: 265–9.4. КАС пабмед ПабМед Центральный Статья Google ученый
-
Шониан Г., Кулс К., Маурисио И.Л. Молекулярные подходы для лучшего понимания эпидемиологии и популяционной генетики Leishmania . Паразитология. 2011; 138:405–25.
КАС пабмед Статья Google ученый
-
Мартинес-Кальвильо С., Санкин С.М., Ян С., Фокс М., Стюарт К., Майлер П.Дж. Геномная организация и функциональная характеристика Leishmania major Локус гена рибосомной РНК Фридлина. Мол Биохим Паразитол. 2001; 116: 147–57.
КАС пабмед Статья Google ученый
-
Боссоласко С., Гайера Г., Олчини Д., Гуллетта М., Мартелло Л., Бестетти А. и др. Анализ ПЦР в реальном времени для клинического ведения пациентов, инфицированных вирусом иммунодефицита человека, с висцеральным лейшманиозом.
 Дж. Клин Микробиол. 2003;41:5080–4.
Дж. Клин Микробиол. 2003;41:5080–4. КАС пабмед ПабМед Центральный Статья Google ученый
-
Эрнандес С., Альварес С., Гонсалес С., Айяла М.С., Леон С.М., Рамирес Д.Д. Идентификация шести видов Leishmania Нового Света с помощью анализа генотипирования плавления с высоким разрешением (HRM). Векторы паразитов. 2014;7:501.
ПабМед ПабМед Центральный Статья Google ученый
-
Talmi-Frank D, Nasereddin A, Schnur LF, Schönian G, Töz SÖ, Jaffe CL, et al. Обнаружение и идентификация Old World Leishmania по анализу расплава с высоким разрешением. PLoS Negl Trop Dis. 2010;4:e581.
ПабМед ПабМед Центральный Статья КАС Google ученый
-
Zampieri RA, Laranjeira-Silva MF, Muxel SM, Stocco de Lima AC, Shaw JJ, Floeter-Winter LM.
 Анализ плавления с высоким разрешением, нацеленный на hsp70, как быстрый и эффективный метод различения видов Leishmania . PLoS Negl Trop Dis. 2016;10:e0004485.
Анализ плавления с высоким разрешением, нацеленный на hsp70, как быстрый и эффективный метод различения видов Leishmania . PLoS Negl Trop Dis. 2016;10:e0004485. -
Леон С.М., Муньос М., Эрнандес С., Айяла М.С., Флорес С., Тегеран А. и др. Аналитические характеристики четырех анализов полимеразной цепной реакции (ПЦР) и ПЦР в реальном времени (кПЦР) для обнаружения ДНК шести видов Leishmania в Колумбии. Фронт микробиол. 2017; 8:1907.
ПабМед ПабМед Центральный Статья Google ученый
-
Reis LES, Coura-Vital W, Roatt BM, LEM B, Ker HG, Fortes de Brito RC, et al. Молекулярная диагностика висцерального лейшманиоза собак: сравнительное исследование трех методов с использованием кожи и селезенки собак с естественным Инфекция Leishmania infantum . Вет Паразитол. 2013; 197: 498–503.
-
Безерра-Васконселос Д.
 Р., Мело Л.М., Альбукерке Э.С., Лучано М.С.С., Бевилакуа К.М.Л. ПЦР в реальном времени для оценки нагрузки Leishmania у москитов Lutzomyia longipalpis : скрининг генов-мишеней и оценка количественных методов. Опыт Паразитол. 2011;129:234–9.
Р., Мело Л.М., Альбукерке Э.С., Лучано М.С.С., Бевилакуа К.М.Л. ПЦР в реальном времени для оценки нагрузки Leishmania у москитов Lutzomyia longipalpis : скрининг генов-мишеней и оценка количественных методов. Опыт Паразитол. 2011;129:234–9. КАС пабмед Статья Google ученый
-
Ferreira S De A, Almeida GG, Silva S De O, Vogas GP, Fujiwara RT, De Andrade ASR и др. Мазки из носа, полости рта и ушей для диагностики висцерального лейшманиоза собак: новые практические подходы к обнаружению ДНК Leishmania infantum . PLoS Negl Trop Dis. 2013;7:e2150.
Артикул КАС Google ученый
-
де Алмейда Феррейра С., Лейте Р.С., Итуассу Л.Т., Алмейда Г.Г., Соуза Д.М., Фудзивара Р.Т. и др. Образцы мазков с кожи и конъюнктивы собак для обнаружения и количественного определения 9ДНК 0280 Leishmania infantum в эндемичном городском районе Бразилии.
 PLoS Negl Trop Dis. 2012;6:e1596.
PLoS Negl Trop Dis. 2012;6:e1596. ПабМед ПабМед Центральный Статья КАС Google ученый
-
Castilho TM, Camargo LMA, McMahon-Pratt D, Shaw JJ, Floeter-Winter LM. Анализ полимеразной цепной реакции в реальном времени для идентификации и количественного определения видов American Leishmania на основе глюкозо-6-фосфатдегидрогеназы. Am J Trop Med Hyg. 2008; 78: 122–32.
КАС пабмед Статья Google ученый
-
Wortmann G, Hochberg L, Houng H-H, Sweeney C, Zapor M, Aronson N, et al. Быстрая идентификация комплексов Leishmania с помощью ПЦР в реальном времени. Am J Trop Med Hyg. 2005; 73: 999–1004.
КАС пабмед Статья Google ученый
-
Хосрави С., Хиджази С.Х., Хашемзаде М., Эслами Г., Дарани Х.И. Молекулярная диагностика лейшманиоза Старого Света: ПЦР в реальном времени на основе гена трипаредоксинпероксидазы для обнаружения и идентификации Leishmania spp.
 Дж. Вектор Борн Дис. 2012;49:15–8.
Дж. Вектор Борн Дис. 2012;49:15–8. КАС пабмед Google ученый
-
Рамирес CA, Requena JM, Puerta CJ. Идентификация гена HSP70-II в локусе Leishmania braziliensis HSP70: геномная организация и характеристика UTR. Векторы паразитов. 2011; 4:166.
ПабМед ПабМед Центральный Статья КАС Google ученый
-
Fraga J, Montalvo AM, De Doncker S, Dujardin JC, Van der Auwera G. Филогения видов Leishmania на основе гена белка теплового шока 70. Заразить Генет Эвол. 2010;10:238–45.
КАС пабмед Статья Google ученый
-
Montalvo AM, Fraga J, El Safi S, Gramiccia M, Jaffe CL, Dujardin J-C, et al. Прямое типирование видов Leishmania в клинических образцах Старого Света: оценка 3 чувствительных методов на основе гена белка теплового шока 70.
 Диагностика Microbiol Infect Dis. 2014;80:35–9.
Диагностика Microbiol Infect Dis. 2014;80:35–9. КАС пабмед Статья Google ученый
-
Zemanová E, Jirků M, Mauricio IL, Horák A, Miles MA, Lukeš J. Комплекс Leishmania donovani : генотипы пяти метаболических ферментов (ICD, ME, MPI, G6PDH и FH), новые мишени для мультилокусное типирование последовательности. Int J Паразитол. 2007; 37: 149–60.
ПабМед Статья КАС Google ученый
-
Морейра О.К., Ядон З.Е., Куполилло Э. Применимость ПЦР в реальном времени для диагностики кожного лейшманиоза и количественного определения паразитов для клинического ведения: текущее состояние и перспективы. Acta Trop. 2017. https://doi.org/10.1016/j.actatropica.2017.09.020.
-
Аронсон Н., Хервальдт Б.Л., Либман М., Пирсон Р., Лопес-Велес Р., Вейна П. и др. Диагностика и лечение лейшманиоза: рекомендации по клинической практике Американского общества инфекционистов (IDSA) и Американского общества тропической медицины и гигиены (ASTMH).
 Am J Trop Med Hyg. 2017;96: 24–45.
Am J Trop Med Hyg. 2017;96: 24–45. ПабМед ПабМед Центральный Статья Google ученый
-
Адамс Э.Р., Гомес М.А., Шеске Л., Риос Р., Маркес Р., Коссио А. и др. Чувствительная диагностика кожного лейшманиоза путем взятия мазка из очага поражения в сочетании с количественной ПЦР. Паразитология. 2014; 141:1891–7.
КАС пабмед ПабМед Центральный Статья Google ученый
-
Pessoa-e-Silva R, Mendonça Trajano-Silva LA, Lopes da Silva MA, da Cunha Goncalves-de-Albuquerque S, de Goes TC, Silva de Morais RC, et al. Оценка мочи на Leishmania infantum Обнаружение ДНК с помощью количественной ПЦР в реальном времени. J Микробиологические методы. 2016; 131:34–41.
-
Солано-Гальего Л., Родригес-Кортес А., Тротта М., Зампиерон С., Разия Л., Фурланелло Т. и др. Обнаружение ДНК Leishmania infantum с помощью ПЦР в реальном времени на основе лада в моче собак с естественным клиническим лейшманиозом.
 Вет Паразитол. 2007; 147: 315–9.
Вет Паразитол. 2007; 147: 315–9. КАС пабмед Статья Google ученый
-
Benassi JC, Benvenga GU, Ferreira HL, Pereira VF, Keid LB, Soares R, et al. Обнаружение ДНК Leishmania infantum в конъюнктивальных мазках кошек методом количественной ПЦР в реальном времени. Опыт Паразитол. 2017;177:93–7.
КАС пабмед Статья Google ученый
-
Ceccarelli M, Galluzzi L, Sisti D, Bianchi B, Magnani M. Применение количественной ПЦР в образцах конъюнктивальных мазков для оценки собачьего лейшманиоза в пограничных случаях или рецидива заболевания и корреляции с клиническими параметрами. Векторы паразитов. 2014;7:460.
ПабМед ПабМед Центральный Статья Google ученый
-
Карвалью Феррейра А.Л., Каррегаль В.М., де Алмейда Ф.С., Лейте Р.
 С., де Андраде АСР. Обнаружение Leishmania infantum в 4 разных образцах собак с помощью ПЦР в реальном времени и гнездовой ПЦР ITS-1. Диагностика Microbiol Infect Dis. 2014;78:418–21.
С., де Андраде АСР. Обнаружение Leishmania infantum в 4 разных образцах собак с помощью ПЦР в реальном времени и гнездовой ПЦР ITS-1. Диагностика Microbiol Infect Dis. 2014;78:418–21. КАС пабмед Статья Google ученый
-
Ломбардо Г., Пенниси М.Г., Лупо Т., Мильяццо А., Капри А., Солано-Гальего Л. Обнаружение 9ДНК 0280 Leishmania infantum методом ПЦР в реальном времени в мазках из ротовой полости и конъюнктивы собак и сравнение с другими диагностическими методами. Вет Паразитол. 2012; 184:10–7.
КАС пабмед Статья Google ученый
-
Ашар М., де Оливейра Э.Т.Б., Лауренти М.Д., Маркондес М., Толезано Дж.Э., Хирамото Р.М. и др. Значение мазка из ротовой полости для молекулярной диагностики собак на разных стадиях инфекции Leishmania infantum . Вет Паразитол. 2016; 225:108–13.
ПабМед Статья Google ученый
«> -
Кассахун А., Садлова Дж., Бенда П., Косталова Т., Варбург А., Хайлу А. и др. Естественное заражение летучих мышей Leishmania в Эфиопии. Acta Trop. 2015; 150:166–70.
ПабМед Статья Google ученый
-
de Oliveira FM, Costa LHC, de Barros TL, Rauschkolb Katsuda Ito PK, Colombo FA, de Carvalho C, et al. Первое обнаружение Leishmania spp. ДНК бразильских летучих мышей отлавливают строго в городских районах. Acta Trop. 2015; 150:176–81.
-
de Rezende MB, Herrera HM, Carvalho CME, Carvalho Anjos EA, Ramos CAN, de Araújo FR и др.
 Обнаружение Leishmania spp. у летучих мышей из районов Бразилии, эндемичных по висцеральному лейшманиозу. Transbound Emerg Dis. 2017;64:e36–42.
Обнаружение Leishmania spp. у летучих мышей из районов Бразилии, эндемичных по висцеральному лейшманиозу. Transbound Emerg Dis. 2017;64:e36–42. КАС пабмед Статья Google ученый
-
Ортега М.В., Морено И., Домингес М., де ла Крус М.Л., Мартин А.Б., Родригес-Бертос А. и др. Применение специфической количественной ПЦР в реальном времени (qPCR) для идентификации ДНК Leishmania infantum в образцах селезенки, кожи и волос диких Leporidae. Вет Паразитол. 2017;243:92–9.
-
Муньос-Мадрид Р., Белинчон-Лоренцо С., Иньеста В., Фернандес-Котрина Х., Парехо Х.С., Серрано Ф.Х. и др. Первое обнаружение кинетопластной ДНК Leishmania infantum в волосах диких млекопитающих: применение метода количественной ПЦР для определения потенциальных резервуаров паразитов. Acta Trop. 2013; 128:706–9.
ПабМед Статья КАС Google ученый
«> -
де Пайва К.М., Дантас-Торрес Ф., да Кунья Гонсалвеш де Альбукерке С., Сильва де Мораис Р.С., Де Брито MEF, Отранто Д. и др. Количественные ПЦР в реальном времени для обнаружения Leishmania ( Viannia ) braziliensis у животных и человека. Молекулярные зонды. 2013;27:122–8.
-
Манна Л., Пачиелло О., Делла Морте Р., Гравино А.Е. Обнаружение паразитов Leishmania в семенниках собаки, пораженной орхитом: клинический случай. Векторы паразитов. 2012;5:216.
ПабМед ПабМед Центральный Статья Google ученый
«> -
da Silva RN, Amorim AC, Brandão RMSS, de Andrade HM, Yokoo M, Ribeiro ML, et al. ПЦР в реальном времени в клинической практике: мощный инструмент для оценки нагрузки Leishmania chagasi у собак, инфицированных естественным путем. Энн Троп Мед Паразитол. 2010; 104:137–43.
КАС пабмед Статья Google ученый
-
Белинчон-Лоренцо С., Иньеста В., Парехо Х.С., Фернандес-Котрина Х., Муньос-Мадрид Р., Сото М. и др. Обнаружение ДНК миникольца кинетопласта Leishmania infantum методом ПЦР в реальном времени в шерсти собак с лейшманиозом.
 Вет Паразитол. 2013; 192:43–50.
Вет Паразитол. 2013; 192:43–50. ПабМед Статья КАС Google ученый
-
Geisweid K, Weber K, Sauter-Louis C, Hartmann K. Оценка полимеразной цепной реакции конъюнктивального мазка для обнаружения Leishmania infantum у собак в неэндемичных районах. Вет Дж. 2013; 198:187–92.
КАС пабмед Статья Google ученый
-
Пенниси М.Г., Реале С., Ло Джудиче С., Масуччи М., Каракаппа С., Витале М. и др. ПЦР в реальном времени у собак, получавших аллопуринол от лейшманиоза. Ветрез. коммун. 2005;29:301–3.
ПабМед Статья Google ученый
-
Манна Л., Реале С., Витале Ф., Пичилло Э., Павоне Л.М., Гравино А.Е. Анализ ПЦР в реальном времени у собак, инфицированных Leishmania , получавших меглюмина антимониат и аллопуринол. Вет Дж.
 2008; 177: 279–82.
2008; 177: 279–82. КАС пабмед Статья Google ученый
-
Манна Л., Реале С., Виола Э., Витале Ф., Манзилло В.Ф., Микеле П.Л. и др. Leishmania ДНК-нагрузка и уровни экспрессии цитокинов у бессимптомных естественно инфицированных собак. Вет Паразитол. 2006; 142: 271–80.
КАС пабмед Статья Google ученый
-
Tupperwar N, Vineeth V, Rath S, Vaidya T. Разработка полимеразной цепной реакции в режиме реального времени для количественного определения видов Leishmania и мониторинга системного распространения патогена. Диагностика Microbiol Infect Dis. 2008; 61: 23–30.
КАС пабмед Статья Google ученый
-
Хоссейн Ф., Гош П., Хан М.А.А., Дути М.С., Валлур А.С., Пиконе А. и др. ПЦР в реальном времени при обнаружении и количественном определении Leishmania donovani для диагностики пациентов с висцеральным лейшманиозом и мониторинга их реакции на лечение.
 ПЛОС Один. 2017;12:e0185606.
ПЛОС Один. 2017;12:e0185606. ПабМед ПабМед Центральный Статья КАС Google ученый
-
Шан Л., Пэн В., Джин Х., Сюй Д., Чжун Н., Ван В. и др. Распространенность клыков Инфекция Leishmania infantum в провинции Сычуань, юго-запад Китая, обнаруженная с помощью ПЦР в реальном времени. Векторы паразитов. 2011; 4:173.
КАС пабмед ПабМед Центральный Статья Google ученый
-
Тоз С.О., Кулха Г., Зейрек Ф.Ю., Эртабаклар Х., Алкан М.З., Вардарлы А.Т. и др. Метод, основанный на ITS1-PCR в реальном времени, для диагностики и видовой идентификации паразита Leishmania из клинических образцов человека и собаки в Турции. PLoS Negl Trop Dis. 2013;7:e2205.
КАС пабмед ПабМед Центральный Статья Google ученый
«> -
Kuhls K, Alam MZ, Cupolillo E, Ferreira GEM, Mauricio IL, Oddone R, et al. Сравнительная микроспутниковая типизация New World Leishmania infantum демонстрирует низкую гетерогенность среди популяций и недавнее происхождение из Старого Света. PLoS Negl Trop Dis. 2011;5:e1155.
ПабМед ПабМед Центральный Статья Google ученый
-
Люкс Дж., Гилбрайд Д.Л., Вотыпка Дж., Зикова А., Бенне Р., Энглунд П.Т. Сеть кинетопластной ДНК: эволюция невероятной структуры. Эукариотическая клетка. 2002; 1: 495–502.
КАС пабмед ПабМед Центральный Статья Google ученый
«> -
Pereira L de OR, Moreira RB, de Oliveira MP, Reis S de O, de Oliveira Neto MP, Pirmez C. Is Leishmania ( Viannia ) braziliensis паразитарная нагрузка, связанная с патогенезом заболевания? Int J Infect Dis. 2017;57:132–137.
Артикул Google ученый
-
Ceccarelli M, Galluzzi L, Diotallevi A, Gasparini E, Migliazzo A, Magnani M. Актуальность молекулярной диагностики у собак, вакцинированных против лейшманиоза. Vet Med Anim Sci. 2016;4:4.
Артикул Google ученый
«> -
Наранхо С., Фондевила Д., Альтет Л., Франсино О., Риос Х., Роура Х. и др. Оценка наличия Leishmania spp. методом ПЦР в реальном времени в слезных железах собак, больных лейшманиозом. Вет Дж. 2012; 193:168–73.
ПабМед Статья Google ученый
-
Франсино О., Альтет Л., Санчес-Роберт Э., Родригес А., Солано-Гальего Л., Альберола Дж. и др. Преимущества ПЦР в реальном времени для диагностики и мониторинга собачьего лейшманиоза. Вет Паразитол.
 2006; 137: 214–21.
2006; 137: 214–21. КАС пабмед Статья Google ученый
-
Дантас-Торрес Ф., да Силва Сейлз К.Г., Гомес да Силва Л., Отранто Д., Фигередо Л.А. Leishmania -FAST15: быстрый, чувствительный и недорогой ПЦР-анализ в реальном времени для обнаружения кинетопластной ДНК Leishmania infantum и Leishmania braziliensis в образцах крови собак. Молекулярные зонды. 2017;31:65–9.
-
Rampazzo R de CP, Solcà M da S, Santos LCS, Pereira L de N, Guedes JCO, Veras PST и др. Готовый к использованию дуплексный ПЦР для обнаружения Leishmania infantum ДНК у собак, инфицированных естественным путем. Вет Паразитол. 2017; 246:100–7.
Артикул КАС Google ученый
-
Ахунди М., Даунинг Т., Вотыпка Дж., Кулс К., Лукеш Дж., Каннет А. и др. Инфекции Leishmania : молекулярные мишени и диагностика.
 Мол Аспекты Мед. 2017; 57:1–29.
Мол Аспекты Мед. 2017; 57:1–29. КАС пабмед Статья Google ученый
-
Maroli M, Felicianangeli MD, Bichaud L, Charrel RN, Gradoni L. Phlebotomine москиты и распространение лейшманиоза и других заболеваний, вызывающих озабоченность общественного здравоохранения. Мед Вет Энтомол. 2013;27:123–47.
КАС пабмед Статья Google ученый
-
Ranasinghe S, Rogers ME, Hamilton JGC, Bates PA, Maingon RDC. ПЦР-анализ в реальном времени для оценки нагрузки Leishmania chagasi в естественном переносчике москитов Lutzomyia longipalpis . Trans R Soc Trop Med Hyg. 2008; 102: 875–82.
КАС пабмед ПабМед Центральный Статья Google ученый
-
Роджерс Мэн, Бейтс Пенсильвания. Leishmania манипулирование поведением при кормлении москитов приводит к усилению передачи.
 PLoS Патог. 2007;3:e91.
PLoS Патог. 2007;3:e91. ПабМед ПабМед Центральный Статья КАС Google ученый
-
Гонсалес Э., Альварес А., Руис С., Молина Р., Хименес М. Обнаружение высокого уровня Leishmania infantum загружается в Phlebotomus perniciosus , захваченных в очаге лейшманиоза на юго-западе Мадрида (Испания) с помощью ПЦР в реальном времени. Acta Trop. 2017; 171:68–73.
ПабМед Статья КАС Google ученый
-
Cunha RC, Andreotti R, Cominetti MC, Silva EA. Обнаружение Leishmania infantum в Lutzomyia longipalpis , пойманных в Кампо-Гранде, штат Массачусетс. Rev Bras Паразитол Вет. 2014;23:269–73.
-
Айхан Н., Вело Э., де Ламбальри Х, Кота М., Кадриай П., Озбель Ю. и др. Обнаружение Leishmania infantum и нового флебовируса (балканского вируса) у москитов в Албании.
 Трансмиссивные зоонозные дис. 2016;16:802–6.
Трансмиссивные зоонозные дис. 2016;16:802–6. ПабМед Статья Google ученый
-
Benabid M, Ghrab J, Rhim A, Ben-Romdhane R, Aoun K, Bouratbine A. Временная динамика и распространенность инфекции Leishmania infantum Phlebotomus perniciosus (Diptera, Phlebotominae) в высокоэндемичных по висцеральному лейшманиозу районах Туниса. ПЛОС Один. 2017;12:e0184700.
-
Озбель Ю., Каракуш М., Арсерим С.К., Калкан Ш.О., Тёз С. Молекулярное обнаружение и идентификация Leishmania spp. в естественно инфицированных Phlebotomus tobbi и Sergentomyia dentata в очаге лейшманиоза человека и собак в западной Турции. Acta Trop. 2016; 155:89–94.
ПабМед Статья КАС Google ученый
-
Караку С.М., Пекаг Ирба С.М., Демир С., Эрен Х., Тоз С., Озбель Ю. Молекулярный скрининг Leishmania spp.
 инфекции и кровопотери у москитов из очага лейшманиоза на юго-западе Турции. Мед Вет Энтомол. 2017; 31: 224–9.
инфекции и кровопотери у москитов из очага лейшманиоза на юго-западе Турции. Мед Вет Энтомол. 2017; 31: 224–9. КАС Статья Google ученый
-
Солано-Гальего Л., Росси Л., Скроккаро А., Монтарси Ф., Калдин М., Фурланелло Т. и др. Обнаружение ДНК Leishmania infantum преимущественно в Rhipicephalus sanguineus Самцы клещей, изъятых у собак, проживающих в эндемичных по собачьему лейшманиозу районах. Векторы паразитов. 2012;5:98.
КАС пабмед ПабМед Центральный Статья Google ученый
-
Дантас-Торрес Ф., Стефания Латрофа М., Отранто Д. Количественное определение ДНК Leishmania infantum в самках, яйцах и личинках Rhipicephalus sanguineus . Векторы паразитов. 2011;4:56.
ПабМед ПабМед Центральный Статья Google ученый
«> -
Николя Л., Милон Г., Прина Э. Быстрая дифференциация видов Старого Света Leishmania с помощью полимеразной цепной реакции LightCycler и анализа кривой плавления. J Микробиологические методы. 2002; 51: 295–9.
КАС пабмед Статья Google ученый
-
Де Монбрисон Ф., Михоуби И., Пико С. ПЦР-анализ в реальном времени для идентификации видов кожных паразитов Leishmania в Константиновском регионе Алжира. Acta Trop. 2007;102:79–83.
КАС пабмед Статья Google ученый
«> -
de Morais RCS, da Costa Oliveira CN, de Albuquerque S da CG, Mendonça Trajano Silva LA, Pessoa-e-Silva R, Alves da Cruz HL, et al. ПЦР в реальном времени для идентификации видов Leishmania : оценка и сравнение с классическими методами. Опыт Паразитол. 2016; 165:43–50.
ПабМед Статья КАС Google ученый
-
Selvin PR. Ренессанс резонансной передачи энергии флуоресценции. Nat Struct Biol. 2000;7:730–4.
КАС пабмед Статья Google ученый
«> -
Cardoso L, Gilad M, Cortes H, Nachum-Biala Y, Lopes A, Vila-Viçosa M, et al. Первое сообщение об инфекции Anaplasma platys у рыжих лисиц ( Vulpes vulpes ) и молекулярном обнаружении Ehrlichia canis и Leishmania infantum у лисиц из Португалии. Векторы паразитов. 2015;8:144.
ПабМед ПабМед Центральный Статья Google ученый
-
Migliazzo A, Vitale F, Calderone S, Puleio R, Binanti D, Abramo F. Лейшманиоз кошек: случай с высокой паразитарной нагрузкой.
 Вет Дерматол. 2015;26:69–70.
Вет Дерматол. 2015;26:69–70. ПабМед Статья Google ученый
-
Opota O, Balmpouzis Z, Berutto C, Kaiser-Guignard J, Greub G, Aubert J-D, et al. Висцеральный лейшманиоз у реципиента трансплантата легкого: полезность высокочувствительной полимеразной цепной реакции в режиме реального времени для превентивной диагностики. Transpl Infect Dis. 2016;18:801–4.
КАС пабмед Статья Google ученый
-
White H, Potts G. Сканирование мутаций с помощью анализа расплава с высоким разрешением. Оценка RotorGene 6000 (Corbett Life Science), HR1 и 384-луночного сканера LightScanner (Idaho Technology). Уэссекс: Национальная справочная лаборатория по генетике; 2006.
Google ученый
-
де Пайва Кавальканти М., Фелинто де Брито М.Э., де Соуза В.В., де Миранда Гомеш Ю.
 , Абат ФСК. Разработка ПЦР в реальном времени для количественного определения Leishmania infantum ДНК в собачьей крови. Вет Дж. 2009; 182:356-8.
, Абат ФСК. Разработка ПЦР в реальном времени для количественного определения Leishmania infantum ДНК в собачьей крови. Вет Дж. 2009; 182:356-8. -
Рибейро-Ромао Р.П., Сааведра А.Ф., Да-Крус А.М., Пинту Э.Ф., Морейра О.К. Разработка ПЦР в реальном времени для оценки иммунного ответа и паразитарной нагрузки у золотистых хомяков ( Mesocricetus auratus ), инфицированных Leishmania ( Viannia ) braziliensis . Векторы паразитов. 2016;9:361.
ПабМед ПабМед Центральный Статья КАС Google ученый
-
Oliveira V da C, Boechat VC, Mendes Junior AAV, Madeira M de F, Ferreira LC, Figueiredo FB и др. Появление Leishmania infantum в центральной нервной системе естественно инфицированных собак: паразитарная нагрузка, жизнеспособность, сопутствующие инфекции и гистологические изменения. ПЛОС Один. 2017;12:e0175588.
Артикул КАС Google ученый
«> -
Prina E, Roux E, Mattei D, Milon G. Leishmania ДНК быстро разлагается после гибели паразита: анализ с помощью микроскопии и ПЦР в реальном времени. микробы заражают. 2007; 9: 1307–15.
КАС пабмед Статья Google ученый
-
van der Meide W, Guerra J, Schoone G, Farenhorst M, Coelho L, Faber W, et al. Сравнение количественной амплификации на основе последовательности нуклеиновых кислот, ПЦР с обратной транскриптазой в реальном времени и ПЦР в реальном времени для количественного определения паразитов Leishmania .
 Дж. Клин Микробиол. 2008; 46:73–78.
Дж. Клин Микробиол. 2008; 46:73–78. КАС пабмед Статья Google ученый
-
Кимблин Н., Петерс Н., Дебрабант А., Секундино Н., Эген Дж., Юрист П. и др. Количественная оценка инфекционной дозы Leishmania major передается на кожу одиночными москитами. Proc Natl Acad Sci. 2008; 105:10125–30.
КАС пабмед ПабМед Центральный Статья Google ученый
-
Миро Г., Олива Г., Крус И., Каньявате К., Мортарино М., Вишер К. и др. Многоцентровое контролируемое клиническое исследование по оценке эффективности и безопасности милтефозина и аллопуринола при лейшманиозе собак. Вет Дерматол. 2009; 20: 397–404.
ПабМед Статья Google ученый
-
Дабири С., Сафави М., Шамси Мейманди С., Юсефи К., Шамси Мейманди М., Фотоухи Ардакани Р.
 и др. Молекулярная патология и гистопатологические данные при локализованном Leishmania лимфадените. Арх Иран Мед. 2014;17:122–6.
и др. Молекулярная патология и гистопатологические данные при локализованном Leishmania лимфадените. Арх Иран Мед. 2014;17:122–6. ПабМед Google ученый
-
Müller N, Hentrich B, Frey CF, Welle M. Количественная ПЦР для диагностики кожного лейшманиоза на срезах кожи, фиксированных формалином и парафином. Молекулярные зонды. 2015;29: 507–10.
ПабМед Статья КАС Google ученый
-
Теллевик М.Г., Мюллер К.Е., Лёккен К.Р., Нерланд А.Х. Обнаружение широкого спектра видов Leishmania и определение паразитарной нагрузки инфицированной мыши с помощью ПЦР в реальном времени, направленной на ген аргининпермеазы AAP3. Acta Trop. 2014; 137:99–104.
КАС пабмед Статья Google ученый
-
Валлур А.С., Дати М.С., Рейнхарт С.
 , Таттерроу Ю., Хамано С., Бхаскар КР.Х. и др. Биомаркеры для внутриклеточных патогенов: создание инструментов в качестве вакцин и терапевтических конечных точек для висцерального лейшманиоза. Клин Микробиол Инфект. 2014; 20: O374–83.
, Таттерроу Ю., Хамано С., Бхаскар КР.Х. и др. Биомаркеры для внутриклеточных патогенов: создание инструментов в качестве вакцин и терапевтических конечных точек для висцерального лейшманиоза. Клин Микробиол Инфект. 2014; 20: O374–83. КАС пабмед Статья Google ученый
-
Коломбо Ф.А., Перейра-Чиккола В.Л., Мейра С. да С., Мотойе Г., Гава Р., Хирамото Р.М. и др. Проведение ПЦР в реальном времени для диагностики лейшманиоза с использованием L. ( L. ) infantum гипотетический белок в качестве мишени в образцах собак. Опыт Паразитол. 2015; 157:156–62.
-
Родригес ACM, Мело Л.М., Магальяйнс Р.Д., де Мораес Н.Б., де Соуза Джуниор А.Д., Бевилаква CML. Молекулярная идентификация Lutzomyia migonei (Diptera: Psychodidae) как потенциального переносчика Leishmania infantum (Kinetoplastida: Trypanosomatidae). Вет Паразитол. 2016; 220:28–32.

Бейтс Пенсильвания. Передача метациклических промастигот Leishmania флеботоминовыми москитами. Int J Паразитол. 2007; 37: 1097–106.
КАС пабмед ПабМед Центральный Статья Google ученый
Mary C, Faraut F, Lascombe L, Dumon H. Количественное определение ДНК Leishmania infantum методом ПЦР в реальном времени с высокой чувствительностью. Дж. Клин Микробиол. 2004; 42: 5249–55.
КАС пабмед ПабМед Центральный Статья Google ученый
Кассахун А., Садлова Дж., Дворжак В., Косталова Т., Рохоусова И., Фрынта Д. и другие. Обнаружение Leishmania donovani и L. tropica у эфиопских диких грызунов. Acta Trop. 2015; 145:39–44.
ПабМед Статья Google ученый
де Алмейда М.Е., Кору О., Штойрер Ф., Хервальдт Б.Л., да Силва А.Дж. Обнаружение и дифференциация Leishmania spp. в клинических образцах с помощью ПЦР в реальном времени на основе SYBR Green. Дж. Клин Микробиол. 2017; 55: 281–90.
КАС пабмед Статья Google ученый
Молина И., Фиса Р., Риера С., Фалько В., Элизальде А., Сальвадор Ф. и др. Сверхчувствительная ПЦР в реальном времени для клинического лечения висцерального лейшманиоза у ВИЧ-инфицированных пациентов. Am J Trop Med Hyg. 2013;89: 105–10.
КАС пабмед ПабМед Центральный Статья Google ученый
Kocher A, Valière S, Bañuls AL, Murienne J. Высокопроизводительное секвенирование ампликонов кДНК для анализа мини-колец Leishmania и идентификации неотропических видов. Паразитология. 2017. https://doi.org/10.1017/S0031182017002013.
Ли С.Т., Тарн С., Чанг К.П. Характеристика переключения доминирования миникольца кинетопластной ДНК во время развития и реверсии лекарственной устойчивости у Leishmania . Мол Биохим Паразитол. 1993; 58: 187–203.
КАС пабмед Статья Google ученый
Суарес М., Валенсия Б.М., Хара М., Альба М., Боггильд А.К., Дюхардин Х.-К. и др. Количественное определение кинетопластной ДНК Leishmania ( Viannia ) в язвах кожного лейшманиоза выявило межсайтовую и междисциплинарную изменчивость паразитарной нагрузки. PLoS Negl Trop Dis. 2015;9:e0003936.
ПабМед ПабМед Центральный Статья КАС Google ученый
Viol MA, Guerrero FD, de Oliveira BCM, de Aquino MCC, Loiola SH, de Melo GD, et al. Идентификация Leishmania spp. promastigotes в кишечнике, яичниках и слюнных железах Rhipicephalus sanguineus , активно инвазирующих собак. Паразитол рез. 2016; 115:3479–84.
ПабМед Статья Google ученый
Пита-Перейра Д., Линс Р., Оливейра М.П., Лима Р.Б., Перейра БАС, Морейра О.К. и др. ПЦР в реальном времени на основе SYBR Green, направленная на кинетопластную ДНК, может использоваться для различения основных этиологических агентов бразильских кожных и висцеральных лейшманиозов. Векторы паразитов. 2012;5:15.
КАС пабмед ПабМед Центральный Статья Google ученый
Schulz A, Mellenthin K, Schonian G, Fleischer B, Drosten C. Обнаружение, дифференциация и количественный анализ патогенных организмов Leishmania с помощью ПЦР в реальном времени на основе переноса энергии флуоресцентного резонанса. Дж. Клин Микробиол. 2003;41:1529–35.
КАС пабмед ПабМед Центральный Статья Google ученый
Сильва Р.С., Ричини-Перейра В.Б., Кикути М., Марсон П.М., Лангони Х. Обнаружение Leishmania ( L. ) infantum у бездомных собак молекулярными методами с чувствительными видоспецифичными праймерами. Вет К. 2017; 37: 23–30.
ПабМед Статья Google ученый
Скачать ссылки
Доступность данных и материалов
Обмен данными не применим к этой статье, так как в ходе текущего исследования наборы данных не создавались и не анализировались.
Информация об авторе
Авторы и организации
-
Департамент биомолекулярных наук, Университет Урбино Карло Бо, via Saffi 2, 61029, Урбино, PU, Италия
Лука Галлуцци, Марчелло Чеккарелли, Аврора Диот Маньяни
Авторы
- Luca Galluzzi
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Marcello Ceccarelli
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Aurora Diotallevi
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Академия
- Michele Menotta
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Mauro Magnani
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
Contributions
LG собрала информацию о литературе и написала первый черновик рукописи. MC собрал литературную информацию. MC, AD, MM, MM критически пересмотрели рукопись. Все авторы прочитали и одобрили окончательный вариант рукописи.
MC собрал литературную информацию. MC, AD, MM, MM критически пересмотрели рукопись. Все авторы прочитали и одобрили окончательный вариант рукописи.
Автор, ответственный за переписку
Переписка с Лука Галлуцци.
Декларация этики
Одобрение этики и согласие на участие
Неприменимо.
Конкурирующие интересы
Авторы заявляют об отсутствии конкурирующих интересов.
Примечание издателя
Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Права и разрешения
Открытый доступ Эта статья распространяется в соответствии с условиями международной лицензии Creative Commons Attribution 4.0 (http://creativecommons.org/licenses/by/4.0/), которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе. , при условии, что вы укажете первоначальных авторов и источник, предоставите ссылку на лицензию Creative Commons и укажите, были ли внесены изменения. Отказ от права Creative Commons на общественное достояние (http://creativecommons.org/publicdomain/zero/1.0/) применяется к данным, представленным в этой статье, если не указано иное.
Отказ от права Creative Commons на общественное достояние (http://creativecommons.org/publicdomain/zero/1.0/) применяется к данным, представленным в этой статье, если не указано иное.
Перепечатки и разрешения
Об этой статье
ПЦР-тест стула на паразиты и аналитика панели мониторинга состояния здоровья
Технологии значительно улучшились
Технология обнаружения паразитов и других патогенов значительно улучшилась с 2013 года. Этот тест ПЦР (полимеразная цепная реакция) выглядит для генетического отпечатка пальцев широкого спектра патогенов. Это гораздо более чувствительный тест, чем старомодный метод наблюдения через микроскоп.
Существует множество источников появления этих паразитов, в том числе:
- загрязненные водные пути или бассейны
- употребление в пищу сырых или немытых зараженных фруктов и овощей
- сантехника Также считается, что пониженная кислотность желудка увеличивает риск кишечного паразита.

Если вы хотите добавить тест на Helicobacter Pylori, вы можете заказать комбинированную панель здесь.
Что мы тестируем
Скрытая кровь в фекалиях
Этот тест используется для выявления кровотечения в пищеварительном тракте. Он может обнаружить крошечные следы крови в стуле и может указать на наличие заболевания на относительно ранней стадии, когда стул может казаться нормальным.
Этот анализ кала измеряет:
Сформированный стул считается нормальным. Вариации этого могут указывать на аномальные желудочно-кишечные заболевания.
Этот тест используется для выявления кровотечения в желудочно-кишечном тракте и используется в рамках Национальной программы скрининга кишечника Австралии. Этот тест может обнаружить крошечные следы крови в стуле и может указать на наличие заболевания на относительно ранней стадии, когда стул может казаться нормальным.
ПЦР-тест — Бактерии
Технология обнаружения паразитов и других патогенов значительно улучшилась с 2013 года. Этот ПЦР-тест (полимеразная цепная реакция) ищет генетические отпечатки пальцев широкого спектра патогенов. Это гораздо более чувствительный тест, чем старомодный метод наблюдения через микроскоп.
Этот ПЦР-тест (полимеразная цепная реакция) ищет генетические отпечатки пальцев широкого спектра патогенов. Это гораздо более чувствительный тест, чем старомодный метод наблюдения через микроскоп.
Этот фекальный мультиплексный ПЦР-тест выявляет следующие патогенные бактерии:
Заражение сальмонеллезом обычно возникает в результате попадания бактерий в организм через зараженную пищу, воду или руки. Яйца, молоко, мясо или птица относятся к продуктам с особенно высоким риском.
Кампилобактерная инфекция (кампилобактериоз) представляет собой бактериальную инфекцию, которая чаще всего вызывает гастроэнтерит (также известный как «гастро»), но может также вызывать заболевание, поражающее весь организм.
Шигеллезная инфекция (шигеллез) представляет собой тип гастроэнтерита, вызываемый бактериями шигеллы. Симптомы инфекции Shigella включают лихорадку, диарею (иногда с примесью крови и слизи), рвоту и спазмы желудка.
Эти инфекционные бактерии могут вызывать гастроэнтерит и симптомы за пределами кишечника. Симптомы включают диарею, тошноту, рвоту, лихорадку и боль в животе. Он может имитировать аппендицит или болезнь Крона.
Симптомы включают диарею, тошноту, рвоту, лихорадку и боль в животе. Он может имитировать аппендицит или болезнь Крона.
Aeromonas – это бактерии, которые могут вызывать острое диарейное заболевание, которое обычно проходит без лечения. Это довольно частая причина гастроэнтерита, который чаще всего возникает в теплые летние месяцы в большинстве стран.
ПЦР-тест — Паразиты
Технология обнаружения паразитов и других патогенов значительно улучшилась с 2013 года. Этот ПЦР-тест (полимеразная цепная реакция) ищет генетические отпечатки пальцев широкого спектра патогенов. Это гораздо более чувствительный тест, чем старомодный метод наблюдения через микроскоп.
Этот фекальный мультиплексный ПЦР-тест выявляет следующих паразитов:
Симптомы инфекции Giardia могут проявляться в течение 3–25 дней и могут включать диарею, тошноту, рвоту, бледный жирный стул с неприятным запахом, спазмы желудка, выделение избыточного газа, вздутие живота, потеря веса и усталость.
Cryptosporidium – микроскопический паразит, вызывающий диарейное заболевание криптоспоридиоз. И паразит, и болезнь широко известны как «крипто».
Бактерии могут находиться в кишечнике месяцами или годами и ошибочно диагностироваться как СРК. Инфекция может вызвать диарею, боли и спазмы в животе, анальный зуд, тошноту, потерю аппетита, головную боль, головокружение, депрессию, потерю веса и утомляемость.
Амебиаз представляет собой паразитарное заболевание (известное также как амебная дизентерия), вызываемое инфекцией Entamoeba histolytica или другой амебы (например, E. dispar). Болезнь может не вызывать симптомов у большинства людей.
Некоторые исследования показывают, что у людей с СРК с большей вероятностью могут быть микроорганизмы Blastocystis hominis в стуле.
Инструкции по тестированию
Ваш тестовый набор и все инструкции высылаются непосредственно вам, и нет необходимости посещать центр сбора.
Отправьте образец обратно в лабораторию, используя предоплаченный конверт и упаковку.


