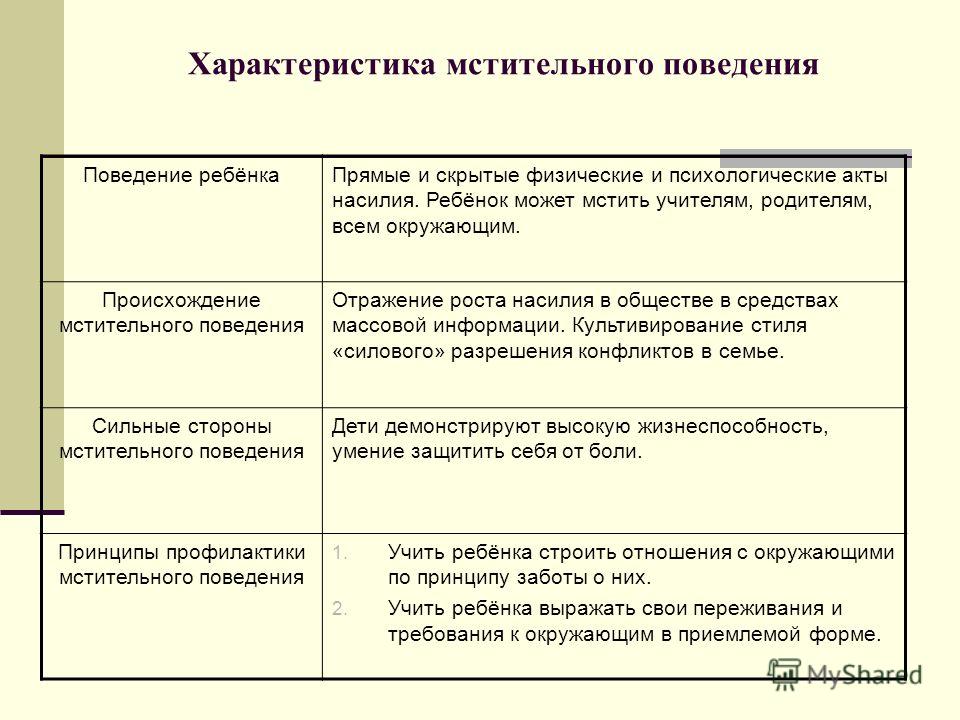
Характеристика на двоечника: характеристика на ученика 5 класса двоечника
Сева Новгородцев: «Осторожно: школьные характеристики!»
Одно из преимуществ среднего, а уж тем более пожилого возраста — это то, что на тебя больше не пишут характеристики. Живешь со своими мыслями и поступками, расплачиваешься за собственные ошибки, но главное — не лезут в душу, не учат жить.
Вообразите теперь, что вы снова в школе, и в конце года приносите домой документ, где написано: «на уроках поет, громко говорит, лезет под парту. Подвижен, неусидчив. Лжив. Прогуливает уроки».
Эти формулировки я позаимствовал из стандартной школьной характеристики, адаптированный вариант шкалы по Хоппе, где учителю нужно только поставить галочки в нужном месте.
В английских школах, особенно частных, характеристики по-прежнему сочиняют на каждого ученика индивидуально. Изящество стиля и глубокое проникновение в психологию ученика делают их порой малым литературным памятником.
Это понимаешь, когда на свет Божий вытягивают кое-что из педагогического архива.
Журналисты раскопали характеристику, написанную много лет назад его учителем биологии. «Мне известно, что Джон собирается стать ученым. Судя по его успехам, эта мысль просто смехотворна. Он не в состоянии выучить простой факт биологии, поэтому трудно представить — каким он может быть специалистом. Скорее, это будет напрасная трата сил, как для самого Джона, так и для тех, кто будет его учить».
Подозреваю, что среди журналистов немало бывших двоечников и прогульщиков, затаивших на своих учителей старую обиду. Во всяком случае, они с большим энтузиазмом расследовали школьные характеристики нынешних знаменитостей, отрывки из которых, мне кажется, с тайным злорадством публикует сегодняшняя «Дейли Мейл».
Джон Леннон, школа Куорри Банк в Ливерпуле: «Джон Леннон идет по пути к полному провалу, он абсолютно безнадежен.
Пи Джи Вудхаус, классик английской литературы, автор «Дживз и Вустер». «Обладает совершенно извращенными представлениями о юморе. Его экзаменационные работы испещрены ужасными рисунками. В тетрадях других учеников он пишет свои глупые стихи».
Эрик Морекам, выдающийся комик. «Не хотелось бы этого говорить, — пишет учитель, — но вынужден признать — из Эрика никогда ничего не выйдет».
Стивен Фрай, писатель, актер, телеведущий, интеллектуал. Ратлэнд, школа Аппингем, отчет директора: «Недостатки Стивена вопиющи, особенно в этом семестре. Английский — в самом конце класса. Боюсь, он представляет из себя весьма печальное зрелище».
Питер Устинов, актер театра и кино. Вестминстерская школа: «Питер проявляет недюжинную оригинальность, которую надо подавлять любой ценой».
Норман Уиздом, киноактер и знаменитый комик. Характеристика курсов военной подготовки: «Этот парень — шут в каждом своем сантиметре. К счастью сантиметров этих немного».
Характеристика курсов военной подготовки: «Этот парень — шут в каждом своем сантиметре. К счастью сантиметров этих немного».
Ян Флеминг, создатель книг о Джеймсе Бонде. Военная академия в Санхерсте: «Из него может получиться отличный солдат, — пишет полковник, — если он не попадется на дамских штучках».
Полковник как в воду глядел — Ян Флеминг вскоре подхватил гонорею, и его отчислили из академии за аморалку.
Из: livejournal
Фото: sobesednik.ru
№ 110. Байка «Шустрый мальчик – будущий двоечник и хулиган». 111 баек для педагогов
№ 110. Байка «Шустрый мальчик – будущий двоечник и хулиган». 111 баек для педагогов ВикиЧтение
111 баек для педагогов
Защиринская Оксана Владимировна
Содержание
№ 110. Байка «Шустрый мальчик – будущий двоечник и хулиган»
В любом классе может оказаться ученик, который отличается от сверстников поразительной активностью.-800x600.jpg) Он вертится, перекладывает свои вещи, отвлекает одноклассников. Учитель не понимает, что и когда такой ребенок успевает сделать на разных уроках.
Он вертится, перекладывает свои вещи, отвлекает одноклассников. Учитель не понимает, что и когда такой ребенок успевает сделать на разных уроках.
Существует еще одна проблема. Чрезмерная активность ученика создает в классе постоянное напряжение. Учителю не удается спрогнозировать действия шустрого мальчика, который может во время урока встать со своего места и начать ходить по классу. «Что это с моим учеником? Он не в состоянии сосредоточиться и учиться? Явно будет двоечником и хулиганом, – размышляет педагог. – А что будет дальше?»
После такой педагогической характеристики учитель перестает верить в способность своего ученика осваивать школьную программу. Клеймо «трудновоспитуемый» снижает образовательные возможности чрезмерно активного ребенка.
Мораль. Учителю не следует фиксироваться на недостатках ученика, а нужно вести поиск компенсаторных возможностей его избыточной двигательной активности и стараться использовать ее для улучшения результатов обучения.
Комментарий. Быстрота не является аналогом понятия «плохо». Для начала следует разобраться, почему ученик чрезмерно активен. Скорее всего, мы имеем дело с проявлениями синдрома гиперактивности и нарушения внимания. Сейчас такие дети есть в каждом классе.
Наши исследования показали, что школьники с гиперактивностью не испытывают интереса к происходящему в классе. Им не нравится учебный процесс. Они откровенно скучают, слушая учителя.
Создается впечатление, что ребенок живет своей жизнью и избирательно реагирует на внешние стимулы. Ему хорошо, когда есть возможность делать то, что хочется. Попробуем представить, насколько некомфортно самому ребенку с гиперактивностью. К сожалению, ему тяжело. Такой ритм жизни рано или поздно приводит к переутомлению. Сильное перевозбуждение обусловливает появление аффектов, повышенной несговорчивости, негативизма. При этом учителю трудно понять: ученику нравится или не нравится, он понял новый материал или нет.
В педагогическом процессе возникает замкнутый круг. Учителя и родители пытаются постоянно воздействовать на ребенка, а он всеми способами противодействует им. Воспитательные приемы учеником с гиперактивностью воспринимаются вообще как психологическое насилие. Мне рассказывали родители, что их ребенок отказывался ходить в школу, так как учительница постоянно при всех детях в классе унижала мальчишку. Антипедагогические приемы были весьма примитивны: грубо указать на ошибки, обозвать, демонстративно проигнорировать попытки ученика ответить на уроке. Были случаи, когда мне, как психологу, приходилось вместе с родителями переводить ученика с гиперактивностью в другую школу, где существует психологически безопасная обстановка.
При всех указанных недостатках школьникам с гиперактивностью не свойственно снижение интеллектуальных способностей. Если с ними научиться договариваться, то они демонстрируют высокие академические достижения.
Еще одна важная рекомендация: не приучайте таких детей к компьютеру и Интернету. Потом с этой зависимостью будет очень сложно бороться. Существуют более полезные занятия, среди которых можно выделить спорт, танцы, аквааэробику, песочную терапию, психологический театр, бисероплетение.
Диапазон применения байки: консультации психолога с учителями и родителями.
Данный текст является ознакомительным фрагментом.
№ 17. Байка «Добрый мальчик, но голодный»
№ 17. Байка «Добрый мальчик, но голодный» В субботу 8-й «А» класс поехал на экскурсию. По расписанию школьники возвращались только к вечеру. Каждого из них попросили продумать вопрос с питанием на время всей поездки. Родители Славы дали ему карманные деньги на обед,
№ 43.
 Байка «Помогающий мальчик»
Байка «Помогающий мальчик»
№ 43. Байка «Помогающий мальчик» Сергей оканчивал 9-й класс. Он отличался от многих сверстников редкой особенностью – желанием всем помогать. Подростка воспитывала одна мать. Она часто приговаривала: «Главное, сынок, чтобы у людей о тебе оставалась хорошая
№ 80. Байка «Гениальный двоечник»
№ 80. Байка «Гениальный двоечник» В одном из пятых классов училась необычная девочка Оля Королёва. Двигалась она плавно, медленно.– Опять о чем-то мечтает, – говорили ей вслед учителя.– Она какая-то странная, не от мира сего, – комментировали наиболее психологически
Старший ребенок и будущий малыш
Старший ребенок и будущий малыш • Скоро ваш пока еще единственный малыш станет старшим ребенком в семье. К такому важному событию, как появление крохи, должна готовиться вся семья и в том числе ваш первенец. Вам следует обязательно об этом рассказать ему. Тогда он с
Вам следует обязательно об этом рассказать ему. Тогда он с
Будущий папа!
Будущий папа! Если вы вместе с женой готовились всю беременность к этому важному событию и помогали ей справиться с различными недомоганиями, то быть с ней и малышом во время его рождения для вас естественно.Чем спокойнее она будет, чем легче ей будет перенести схватки.
Будущий отец «Можно я перережу пуповину?»
Будущий отец «Можно я перережу пуповину?» Во Франции принято, что будущий отец принимает активное участие в подготовке к родам. От него ждут безоговорочной любви к будущему ребенку с первого УЗИ, присутствия на сеансах гаптономии, позволяющей «познакомиться» с еще не
Мальчик «Это нормально, что позже начинает говорить – он же мальчик!»
Мальчик
«Это нормально, что позже начинает говорить – он же мальчик!»
Большинство французских родителей одинакового хотят и мальчика, и девочку во время первой беременности. Во время второй они, чаще всего, хотят ребенка противоположного пола. Большой успех имеют
Во время второй они, чаще всего, хотят ребенка противоположного пола. Большой успех имеют
«Мальчик воспитывает маму»
«Мальчик воспитывает маму» Я расскажу о Коле. Ему пять лет. Он посещает нашу группу с полутора лет. На все семинары у его мамы Наташи бывает возможность приходить. И с нашей группой они выезжали на отдых в Туапсе. Там жили, как в пещере, я старался там создать, насколько
Ответственность не по возрасту: «Ты же старшая!» / «Но он же будущий мужчина!»
Ответственность не по возрасту: «Ты же старшая!» / «Но он же будущий мужчина!» Старшие дети в семье, к сожалению, часто воспринимаются старше своих лет. «Сиди спокойно, ты же старшая, какой ты показываешь пример», «Учись хорошо, ты ведь старший», «Ты должна помогать мне с
Девочка и мальчик
Девочка и мальчик
Известный факт: девочки начинают говорить (повторять слова) на восьмом – девятом месяце, мальчики – на десятом – двенадцатом (Валерий Павлович Белянин). И всё же: наверняка принадлежность к племени девочек или мальчиков не самый существенный фактор из
И всё же: наверняка принадлежность к племени девочек или мальчиков не самый существенный фактор из
Взрослый мальчик
Взрослый мальчик Когда Сережа был маленьким, то очень хотел самокат. Тогда самокат был только у мальчиков из относительно состоятельных семей, а также у мальчиков в некоторых рабочих семьях, где отец был мало пьющим. Такой отец мог своими руками сделать сыну самокат из
Ты уже большой мальчик…
Ты уже большой мальчик… У детей постарше свои способы устраивать скандалы и капризничать. Обычно дети-интроверты до поры, до времени ведут себя очень тихо, и поэтому изменения поведения, связанные с гормональными перестройками, родители воспринимают как нешуточное
Мальчик-с-пальчик
Мальчик-с-пальчик Помогите ребенку устроить представление, используя в качестве актеров собственные пальцы!Что понадобится:• Смываемые фломастеры разных цветов• Небольшие кусочки ткани• СкотчОсваиваемые навыки• Когнитивные / мыслительные навыки• Ролевые игры /
Типы химических реакций: реакции одинарного и двойного замещения
Это «Типы химических реакций: реакции одинарного и двойного замещения», раздел 4. 2 из книги «Начало химии» (v. 1.0). Для получения подробной информации об этом (включая лицензирование) нажмите здесь.
2 из книги «Начало химии» (v. 1.0). Для получения подробной информации об этом (включая лицензирование) нажмите здесь.
Для получения дополнительной информации об источнике этой книги или о том, почему она доступна бесплатно, посетите домашнюю страницу проекта. Там вы можете просматривать или скачивать дополнительные книги. Чтобы загрузить ZIP-файл с этой книгой для использования в автономном режиме, просто нажмите здесь.
Помогла ли вам эта книга? Рассмотрите возможность передачи:
Помощь Creative Commons
Creative Commons поддерживает свободную культуру от музыки до образования. Их лицензии помогли сделать эту книгу доступной для вас.
Помогите государственной школе
DonorsChoose.org помогает таким людям, как вы, помогать учителям финансировать их школьные проекты, от художественных принадлежностей до книг и калькуляторов.
Цели обучения
- Распознавать химические реакции как реакции с одинарным замещением и реакции с двойным замещением.

- Используйте периодическую таблицу, ряд активности или правила растворимости, чтобы предсказать, будут ли происходить реакции одинарного или двойного замещения.
До сих пор мы представляли химические реакции как тему, но мы не обсуждали, как можно предсказать продукты химической реакции. Здесь мы начнем наше изучение некоторых типов химических реакций, которые позволяют нам предсказать, какими будут продукты реакции.
Реакция простого замещения Химическая реакция, в которой один элемент заменяет другой элемент в соединении. это химическая реакция, в которой один элемент заменяет другой элемент в соединении, образуя новый элемент и новое соединение в качестве продуктов. Например,
2HCl(водн.) + Zn(тв.) → ZnCl 2 (водн.) + H 2 (г)
является примером реакции с одной заменой. Атомы водорода в HCl замещаются атомами Zn, при этом образуется новый элемент — водород. Другой пример реакции с одной заменой:
Другой пример реакции с одной заменой:
. 2NaCl(водн.) + F 2 (г) → 2NaF(т) + Cl 2 (г)
Здесь отрицательно заряженный ион превращается из хлорида во фторид. Типичной характеристикой реакции с одним замещением является то, что один элемент является реагентом, а другой — продуктом.
Не все предлагаемые реакции одинарного замещения будут протекать между двумя заданными реагентами. Это легче всего продемонстрировать с фтором, хлором, бромом и йодом. В совокупности эти элементы называются галогенами и находятся в предпоследнем столбце периодической таблицы (см. рис. 4.1 «Галогены в периодической таблице»). Элементы в верхней части столбца заменят элементы под ними в периодической таблице, но не наоборот. Таким образом, реакция, представленная
CaI 2 (т) + Cl 2 (г) → CaCl 2 (т) + I 2 (т)
произойдет, но реакция
CaF 2 (с) + Br 2 (л) → CaBr 2 (с) + F 2 (ж)
не будет, потому что бром находится ниже фтора в периодической таблице. Это лишь один из многих способов, которыми таблица Менделеева помогает нам понять химию.
Это лишь один из многих способов, которыми таблица Менделеева помогает нам понять химию.
Рисунок 4.1 Галогены в периодической таблице
Галогены — это элементы предпоследнего столбца периодической таблицы.
Пример 2
Будет ли происходить реакция с одним замещением? Если да, укажите продукты.
- MgCl 2 + I 2 → ?
- CaBr 2 + F 2 → ?
Раствор
- Поскольку в таблице Менделеева йод находится ниже хлора, реакция с одним замещением не произойдет.
- Поскольку в таблице Менделеева фтор стоит выше брома, произойдет реакция с одним замещением, и продукты реакции будут CaF 2 и Бр 2 .
Проверь себя
Будет ли происходить реакция однократного замещения? Если да, укажите продукты.
FeI 2 + Cl 2 → ?
Ответить
Да; FeCl 2 и I 2
Тенденции химической активности легко предсказать при замене анионов в простых ионных соединениях — просто используйте их относительное положение в периодической таблице. Однако при замещении катионов тенденции не столь однозначны. Отчасти это связано с тем, что существует так много элементов, которые могут образовывать катионы; элемент в одном столбце таблицы Менделеева может заменить другой соседний элемент, а может и нет. Список, называемый серией действий. Список элементов, которые заменят элементы, расположенные ниже их, в реакциях с одиночной заменой. делает то же самое, что периодическая таблица делает для галогенов: в ней перечислены элементы, которые заменят элементы ниже их в реакциях с одним замещением. Ниже показан простой ряд действий.
Однако при замещении катионов тенденции не столь однозначны. Отчасти это связано с тем, что существует так много элементов, которые могут образовывать катионы; элемент в одном столбце таблицы Менделеева может заменить другой соседний элемент, а может и нет. Список, называемый серией действий. Список элементов, которые заменят элементы, расположенные ниже их, в реакциях с одиночной заменой. делает то же самое, что периодическая таблица делает для галогенов: в ней перечислены элементы, которые заменят элементы ниже их в реакциях с одним замещением. Ниже показан простой ряд действий.
Ряд действий по замещению катионов в реакциях одиночного замещения
- Li
- К
- Ба
- Старший
- Са
- Нет
- мг
- Ал
- Мн
- Цин
- Кр
- Фе
- Ni
- Сн
- Пб
- Н 2
- Медь
- рт.
 ст.
ст. - Аг
- Пд
- Пт
- Золото
Использование ряда активности аналогично использованию положений галогенов в периодической таблице. Элемент наверху заменит элемент под ним в соединениях, подвергающихся реакции одинарного замещения. Элементы не заменяют элементы над ними в соединениях.
Пример 3
Используйте ряд активности для прогнозирования продуктов каждого уравнения, если таковые имеются.
- FeCl 2 + Zn → ?
- HNO 3 + Au → ?
Раствор
- Поскольку цинк стоит выше железа в ряду активности, он заменит железо в соединении. Продуктами этой реакции одинарного замещения являются ZnCl 2 и Fe.
- Золото находится ниже водорода в ряду активности. Таким образом, он не заменит водород в соединении нитрат-ионом. Никакой реакции не предвидится.
Проверь себя
Используйте ряд действий, чтобы предсказать продукты этого уравнения, если таковые имеются.
AlPO 4 + Mg → ?
Ответ
Mg 3 (PO 4 ) 2 и Al
Реакция двойного замещения Химическая реакция, в которой происходит обмен частями двух ионных соединений. происходит, когда части двух ионных соединений обмениваются, образуя два новых соединения. Характерной чертой уравнения двойной замены является то, что в качестве реагентов выступают два соединения, а в качестве продуктов — два разных соединения. Пример
CuCl 2 (водн.) + 2AgNO 3 (водн.) → Cu(NO 3 ) 2 (водн.) + 2AgCl(т)
Есть два эквивалентных способа рассмотрения уравнения двойной замены: либо катионы меняются местами, либо анионы меняются местами. (Вы не можете поменять местами оба; в итоге вы получите те же самые вещества, с которых начали.) Любая точка зрения должна позволить вам предсказать правильные продукты, если вы соединяете катион с анионом, а не катион с катионом или анионом. с анионом.
с анионом.
Пример 4
Предскажите произведение этого уравнения двойной замены: BaCl 2 + Na 2 SO 4 → ?
Решение
Рассматривая реакцию либо как смену катионов, либо как смену анионов, мы ожидаем, что продуктами будут BaSO 4 и NaCl.
Проверь себя
Предскажи произведение этого уравнения двойной замены: KBr + AgNO 3 → ?
Ответ
KNO 3 и AgBr
Прогнозирование реакции двойной замены несколько сложнее, чем прогнозирование реакции одинарной замены. Однако существует один тип реакции двойного замещения, который мы можем предсказать: реакция осаждения. Реакция осаждения Химическая реакция, при которой два ионогенных соединения растворяются в воде и образуется новое ионогенное соединение, которое не растворяется. возникает, когда два ионных соединения растворяются в воде и образуют новое ионное соединение, которое не растворяется; это новое соединение выпадает из раствора в виде твердого осадка Твердое вещество, которое выпадает из раствора в результате реакции осаждения. Образование твердого осадка является движущей силой, которая заставляет реакцию протекать.
Образование твердого осадка является движущей силой, которая заставляет реакцию протекать.
Чтобы судить, будут ли происходить реакции двойного замещения, нам нужно знать, какие типы ионных соединений образуют осадки. Для этого мы используем правила растворимости. Общие утверждения, которые предсказывают, какие ионные соединения растворяются, а какие нет, которые являются общими утверждениями, которые предсказывают, какие ионные соединения растворяются (растворимы), а какие нет (нерастворимы или нерастворимы). В таблице 4.1 «Некоторые полезные правила растворимости» перечислены некоторые общие правила растворимости. Нам нужно рассмотреть каждое ионное соединение (как реагенты, так и возможные продукты) в свете правил растворимости в таблице 4.1 «Некоторые полезные правила растворимости». Если соединение растворимо, мы используем для него метку (aq), указывающую на то, что оно растворяется. Если соединение нерастворимо, мы используем для него метку (s) и предполагаем, что оно выпадет в осадок из раствора. Если все растворимо, то никакой реакции ожидать не стоит.
Если все растворимо, то никакой реакции ожидать не стоит.
Таблица 4.1 Некоторые полезные правила растворимости
| Эти соединения обычно растворяются в воде (растворимы): | Исключения: |
| Все соединения Li + , Na + , K + , Rb + , Cs + и NH 4 + | Нет |
| Все соединения NO 3 − и C 2 H 3 O 2 − | Нет |
| Соединения Cl − , Br − , I − | Ag + , Hg 2 2+ , Pb 2+ |
| Соединения SO 4 2 | рт. ст. 2 2+ , Pb 2+ , Sr 2+ , Ba 2+ ст. 2 2+ , Pb 2+ , Sr 2+ , Ba 2+ |
| Эти соединения обычно не растворяются в воде (нерастворимы): | Исключения: |
| Соединения CO 3 2− и PO 4 3− | Соединения Li + , Na + , K + , Rb + , Cs + и NH 4 + |
| Соединения ОН − | Compounds of Li + , Na + , K + , Rb + , Cs + , NH 4 + , Sr 2+ , and Ba 2+ |
Например, рассмотрим возможную реакцию двойного замещения между Na 2 SO 4 и SrCl 2 . Правила растворимости гласят, что все ионные соединения натрия растворимы, а все ионные соединения хлорида растворимы, кроме Ag + , Hg 2 2+ и Pb 2+ , которые здесь не рассматриваются. Следовательно, Na 2 SO 4 и SrCl 2 растворимы. Возможными продуктами реакции двойного замещения являются NaCl и SrSO 4 . Эти растворимые? NaCl (по тому же правилу, которое мы только что процитировали), но как насчет SrSO 9?0029 4 ? Соединения сульфат-иона обычно растворимы, но Sr 2+ является исключением: мы ожидаем, что он будет нерастворимым — осадком. Следовательно, мы ожидаем, что произойдет реакция, и сбалансированное химическое уравнение будет
Правила растворимости гласят, что все ионные соединения натрия растворимы, а все ионные соединения хлорида растворимы, кроме Ag + , Hg 2 2+ и Pb 2+ , которые здесь не рассматриваются. Следовательно, Na 2 SO 4 и SrCl 2 растворимы. Возможными продуктами реакции двойного замещения являются NaCl и SrSO 4 . Эти растворимые? NaCl (по тому же правилу, которое мы только что процитировали), но как насчет SrSO 9?0029 4 ? Соединения сульфат-иона обычно растворимы, но Sr 2+ является исключением: мы ожидаем, что он будет нерастворимым — осадком. Следовательно, мы ожидаем, что произойдет реакция, и сбалансированное химическое уравнение будет
. Na 2 SO 4 (водн.) + SrCl 2 (водн.) → 2NaCl (водн.) + SrSO 4 (тв.)
Вы ожидаете увидеть визуальное изменение, соответствующее SrSO 4 , выпадающему в осадок из раствора (рис. 4.2 «Реакции двойного замещения»).
4.2 «Реакции двойного замещения»).
Рисунок 4.2 Реакции двойной замены
Некоторые реакции двойной замены очевидны, потому что вы можете видеть твердый осадок, выходящий из раствора.
Источник: Фото предоставлено Choij, http://commons.wikimedia.org/wiki/File:Copper_solution.jpg.
Пример 5
Будет ли происходить реакция двойного замещения? Если да, укажите продукты.
- Ca(NO 3 ) 2 + KBr → ?
- NaOH + FeCl 2 → ?
Раствор
- В соответствии с правилами растворимости и Ca(NO 3 ) 2 , и KBr растворимы. Теперь рассмотрим, какими будут продукты двойной замены при замене катионов (или анионов), а именно CaBr 2 и KNO 3 . Однако правила растворимости предсказывают, что эти два вещества также будут растворимы, поэтому осадка не образуется. Таким образом, мы не прогнозируем никакой реакции в этом случае.

-
В соответствии с правилами растворимости ожидается, что и NaOH, и FeCl 2 растворимы. Если предположить, что может произойти реакция двойного замещения, нам необходимо рассмотреть возможные продукты, которыми будут NaCl и Fe(OH) 2 . NaCl растворим, но по правилам растворимости Fe(OH) 2 нет. Следовательно, должна была произойти реакция, и Fe(OH) 2 (s) выпало в осадок из раствора. Сбалансированное химическое уравнение
2NaOH(водн.) + FeCl 2 (водн.) → 2NaCl (водн.) + Fe(OH) 2 (тв.)
Проверь себя
Возникнет ли уравнение с двойной заменой? Если да, укажите продукты.
Sr(NO 3 ) 2 + KCl → ?
Ответ
Нет реакции; все возможные продукты растворимы.
Ключевые выводы
- Реакция одиночной замены заменяет один элемент на другой в соединении.

- Таблица Менделеева или ряд активности могут помочь предсказать, происходят ли реакции одинарного замещения.
- Реакция двойного замещения заменяет катионы (или анионы) двух ионных соединений.
- Реакция осаждения представляет собой реакцию двойного замещения, в которой один продукт представляет собой твердый осадок.
- Правила растворимости используются для прогнозирования возникновения некоторых реакций двойного замещения.
Упражнения
-
Какие общие характеристики помогают распознать реакции одинарного замещения?
-
Какие общие характеристики помогают распознать реакции двойного замещения?
-
Предполагая, что происходит каждая реакция с одним замещением, предскажите продукты и напишите каждое сбалансированное химическое уравнение.

- Zn + Fe(NO 3 ) 2 → ?
- F 2 + FeI 3 → ?
-
Предполагая, что происходит каждая реакция с одним замещением, предскажите продукты и напишите каждое сбалансированное химическое уравнение.
- Li + MgSO 4 → ?
- NaBr + Cl 2 → ?
-
Предполагая, что происходит каждая реакция с одним замещением, предскажите продукты и напишите каждое сбалансированное химическое уравнение.
- Sn + H 2 SO 4 → ?
- Al + NiBr 2 → ?
-
Предполагая, что происходит каждая реакция с одним замещением, предскажите продукты и напишите каждое сбалансированное химическое уравнение.
- Mg + HCl → ?
- HI + Br 2 → ?
-
Используйте периодическую таблицу или ряд активности, чтобы предсказать, будет ли происходить каждая реакция одиночного замещения, и, если да, напишите сбалансированное химическое уравнение.
- FeCl 2 + Br 2 → ?
- Fe(NO 3 ) 3 + Al → ?
-
Используйте периодическую таблицу или ряд активности, чтобы предсказать, будет ли происходить каждая реакция одиночного замещения, и, если да, напишите сбалансированное химическое уравнение.
- Zn + Fe 3 (PO 4 ) 2 → ?
- Ag + HNO 3 → ?
-
Используйте периодическую таблицу или ряд активности, чтобы предсказать, будет ли происходить каждая реакция одиночного замещения, и, если да, напишите сбалансированное химическое уравнение.

- NaI + Cl 2 → ?
- AgCl + Au → ?
-
Используйте периодическую таблицу или ряд активности, чтобы предсказать, будет ли происходить каждая реакция одиночного замещения, и, если да, напишите сбалансированное химическое уравнение.
- Pt + H 3 PO 4 → ?
- Li + H 2 O → ? (Подсказка: угостите H 2 O, как если бы он состоял из ионов H + и OH − .)
-
Предполагая, что происходят все реакции двойного замещения, предскажите продукты и напишите каждое сбалансированное химическое уравнение.
- Zn(NO 3 ) 2 + NaOH → ?
- HCl + Na 2 S → ?
Предполагая, что происходят все реакции двойного замещения, предскажите продукты и напишите каждое сбалансированное химическое уравнение.

- Ca(C 2 H 3 O 2 ) 2 + HNO 3 → ?
- Na 2 CO 3 + Sr(NO 2 ) 2 → ?
-
Предполагая, что происходят все реакции двойного замещения, предскажите продукты и напишите каждое сбалансированное химическое уравнение.
- Pb(NO 3 ) 2 + KBr → ?
- K 2 O + MgCO 3 → ?
-
Предполагая, что происходят все реакции двойного замещения, предскажите продукты и напишите каждое сбалансированное химическое уравнение.
- Sn(OH) 2 + FeBr 3 → ?
- CsNO 3 + KCl → ?
-
Используйте правила растворимости, чтобы предсказать, будет ли происходить каждая реакция двойного замещения, и, если да, напишите сбалансированное химическое уравнение.

- Pb(NO 3 ) 2 + KBr → ?
- K 2 O + Na 2 CO 3 → ?
-
Используйте правила растворимости, чтобы предсказать, будет ли происходить каждая реакция двойного замещения, и, если да, напишите сбалансированное химическое уравнение.
- Na 2 CO 3 + Sr(NO 2 ) 2 → ?
- (NH 4 ) 2 SO 4 + Ba(NO 3 ) 2 → ?
-
Используйте правила растворимости, чтобы предсказать, будет ли происходить каждая реакция двойного замещения, и, если да, напишите сбалансированное химическое уравнение.
- К 3 Заказ на покупку 4 + SrCl 2 → ?
- NaOH + MgCl 2 → ?
-
Используйте правила растворимости, чтобы предсказать, будет ли происходить каждая реакция двойного замещения, и, если да, напишите сбалансированное химическое уравнение.

- KC 2 H 3 O 2 + Li 2 CO 3 → ?
- КОН + AgNO 3 → ?
Ответы
-
Один элемент заменяет другой элемент в соединении.
-
- Zn + Fe (№ 3 ) 2 → Zn (№ 3 ) 2 + Fe
- 3F 2 + 2FeI 3 → 3I 2 + 2FeF 3
-
- Sn + H 2 SO 4 → SnSO 4 + H 2
- 2Al + 3NiBr 2 → 2AlBr 3 + 3Ni
-
- Реакции не происходит.

- Fe(NO 3 ) 3 + Al → Al(NO 3 ) 3 + Fe
- Реакции не происходит.
-
- 2NaI + Cl 2 → 2NaCl + I 2
- Реакции не происходит.
-
- Zn(NO 3 ) 2 + 2NaOH → Zn(OH) 2 + 2NaNO 3
- 2HCl + Na 2 S → 2NaCl + H 2 S
-
- Pb(NO 3 ) 2 + 2KBr → PbBr 2 + 2KNO 3
- К 2 О + MgCO 3 → K 2 CO 3 + MgO
-
- Pb(NO 3 ) 2 + 2KBr → PbBr 2 (s) + 2KNO 3
- Реакции не происходит.

-
- 2К 3 PO 4 + 3SrCl 2 → Sr 3 (PO 4 ) 2 (s) + 6KCl
- 2NaOH + MgCl 2 → 2NaCl + Mg(OH) 2 (с)
6.5: Типы химических реакций — реакции одинарного и двойного замещения
-
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 288635
Цели обучения
- Распознавать химические реакции как реакции с одинарным замещением и реакции с двойным замещением.

- Используйте периодическую таблицу, ряд активности или правила растворимости, чтобы предсказать, будут ли происходить реакции одинарного или двойного замещения.
До сих пор мы представляли химические реакции как тему, но мы не обсуждали, как можно предсказать продукты химической реакции. Здесь мы начнем наше изучение некоторых типов химических реакций, которые позволяют нам предсказать, какими будут продукты реакции.
Реакция с одинарной заменой — это химическая реакция, в которой один элемент заменяется другим элементом в соединении с образованием нового элемента и нового соединения в качестве продуктов. Представлено ниже:
\[\ce{2HCl(водн.) + Zn(т) → ZnCl2(водн.) + h3(г)}\номер \]
является примером реакции с одной заменой. Атомы водорода в \(\ce{HCl}\) замещаются атомами \(\ce{Zn}\), при этом образуется новый элемент — водород. Другой пример реакции с одной заменой:
.\[\ce{2NaCl(водн.) + F2(г) → 2NaF(т) + Cl2(г)}\номер \]
Здесь отрицательно заряженный ион превращается из хлорида во фторид. Типичной характеристикой реакции с одним замещением является то, что один элемент является реагентом, а другой — продуктом.
Типичной характеристикой реакции с одним замещением является то, что один элемент является реагентом, а другой — продуктом.
Реакция двойной замены происходит, когда части двух ионных соединений обмениваются, образуя два новых соединения. Характерной чертой уравнения двойной замены является то, что в качестве реагентов выступают два соединения, а в качестве продуктов — два разных соединения. Пример
\[\ce{CuCl2(водн.) + 2AgNO3(водн.) → Cu(NO3)2(водн.) + 2AgCl(s)}\номер \]
Есть два эквивалентных способа рассмотрения уравнения двойной замены: либо катионы меняются местами, либо анионы меняются местами. (Вы не можете поменять местами оба; в итоге вы получите те же самые вещества, с которых начали.) Любая точка зрения должна позволить вам предсказать правильные продукты, если вы соединяете катион с анионом, а не катион с катионом или анионом. анион с анионом.
Пример \(\PageIndex{3}\)
Предскажите произведение этого уравнения с двойной заменой:
\[\ce{BaCl2 + Na2SO4 → }\nonumber \]
Решение
Думая о реакции как при переключении катионов, так и при переключении анионов мы ожидаем, что продуктами будут BaSO 4 и NaCl.
Упражнение \(\PageIndex{3}\)
Предскажите произведение этого уравнения с двойной заменой:
\[\ce{KBr + AgNO3 → }\nonumber \]
- Ответить
-
КНО 3 и AgBr
Предсказать, произойдет ли реакция с двойным замещением, несколько сложнее, чем предсказать реакцию с одинарным замещением. Однако существует один тип реакции двойного замещения, который мы можем предсказать: реакция осаждения. Реакция осаждения происходит, когда два ионных соединения растворяются в воде и образуют новое ионное соединение, которое не растворяется; это новое соединение выпадает из раствора в виде твердого вещества осадок. Образование твердого осадка является движущей силой, которая заставляет протекать реакцию.
- Реакция одинарного замещения заменяет один элемент на другой в соединении.
- Реакция двойного замещения заменяет катионы (или анионы) двух ионных соединений.

- Реакция осаждения представляет собой реакцию двойного замещения, в которой один продукт представляет собой твердый осадок.
- Наверх
-
- Была ли эта статья полезной?
-
- Тип изделия
- Раздел или Страница
- Лицензия
- СС BY-NC-SA
- Версия лицензии
- 4,0
- 9Программа ООР 1057 или издатель
- Издатель, имя которого нельзя называть
- Показать страницу Оглавление
- № на стр.



