Адипсия: АДИПСИЯ | это… Что такое АДИПСИЯ?
Адипсия — симптомы заболевания и способы лечения
Содержание
- 1 Патофизиологические основы адипсии
- 2 Симптомы и причины развития болезни
- 3 Уточняющая диагностика
- 4 Медицинская помощь при адипсии
Адипсия — это заболевание, которое характеризуется отсутствием жажды даже в присутствии недостатка воды в организме или избытке солей. Это редкое состояние, как правило, возникает при гипернатриемическом обезвоживании. Причиной тому, в преобладающем большинстве случаев являются гипоталамо-гипофизарные расстройства, которые могут быть врожденными или приобретенными. Термин «адипсия» относится к области частичного дефицита воды при развивающихся патологических процессах регуляции жажды. По этой причине, более корректно было бы подобное состояние называть — гиподипсия.
Патофизиологические основы адипсии
У человека центр жажды расположен в передней части гипоталамуса. Основными физиологическими стимулами для проявления признаков потребности пополнения водой, являются гипертонус, основанный на осмотическом давлении крови и гиповолемия. Адипсия, часто является врожденной патологией, дополнительные социальные стимулы, возникшие в процессе жизни, как правило, являются первичными по отношению к сбоям регулирования воды в организме.
Адипсия, часто является врожденной патологией, дополнительные социальные стимулы, возникшие в процессе жизни, как правило, являются первичными по отношению к сбоям регулирования воды в организме.
Осморецепторы, расположенные в передней стенке третьего желудочка, являются посредниками осмотического регулирования жажды, которые регулируют секрецию вазопрессина — фактора осмотической жажды.
Гиповолемия и гипотония могут также стимулировать жажду через активацию низкого или высокого кровяного давления через рецепторы растяжения — гиповолемическая жажда. Импульсы от этих рецепторов передаются блуждающим и языкоглоточным нервами в продолговатый мозг, а оттуда — в гипоталамус. Кроме того, гипоталамус непосредственно стимулируется ангиотензином II. В общем гиповолемическая жажда происходит по причине истощения объема плазмы крови, по меньшей мере на 4-8%.
К аномалиям жажды могут привести конкретные функциональные поражения гипоталамуса, которые препятствуют активации регулирования осмотических или гиповолемических процессов. Часто эти два явления возникают сочетанно, препятствуя когнитивным процессам, необходимым для восприятия жажды.
Часто эти два явления возникают сочетанно, препятствуя когнитивным процессам, необходимым для восприятия жажды.
Любое поражение, врожденное или приобретенное, которое влияет на переднюю область гипоталамуса, может привести к отсутствию жажды. Расстройства регуляции антидиуретического гормона, вырабатываемого в гипоталамусе и ответственного за производство, хранение и выделение мочи, приводит к нарушению способности образования мочи. На данной основе часто развивается патологическое состояние, называемое несахарным диабетом, которое может характеризоваться адипсией или, наоборот — повышенной жаждой.
Симптомы и причины развития болезни
Никакие физические признаки не являются специфичными для адипсии. Наиболее явные симптомы расстройства лучше отнести к изменениям в регулировании воды вследствие гипернатриемии. Эти изменения включают в себя следующие:
- гиперпное;
- мышечная слабость;
- повышенная подвижность;
- активные вербальные признаки возбуждения;
- бессонница;
- вялость;
- кома;
- судороги — редко, за исключением случаев чрезмерно быстрой регидратации;
- потеря тургора кожи и сухие слизистые оболочки.
 Данные симптомы проявляются относительно часто, но не могут быть соизмеримы со степенью обезвоживания.
Данные симптомы проявляются относительно часто, но не могут быть соизмеримы со степенью обезвоживания.
Физические признаки, указывающие на основные нарушения часто очевидны. Примеры таких физических признаков включают в себя:
- волчья пасть;
- другие дефекты средней линии лица;
- гидроцефалия.
Объективными причинами развития адипсии часто являются:
- опухолевые поражения — герминомы, гистиоцитомы и глиомы;
- микроцефалия;
- заячья губа, волчья пасть;
- пустое турецкое седло;
- пороки развития прозрачной перегородки;
- менингоэнцефалит;
- субарахноидальное кровоизлияние;
- гидроцефалия;
- псевдотуморозное состояние;
- психогенные нарушения.
Уточняющая диагностика
Следующие лабораторные исследования показаны пациентам с подозрением на адипсию:
- Определение электролитов, азота и уровня креатинина в сыворотке крови:
- адипсия часто приводит к нарушениям электролитов в сыворотке крови;
- гипернатриемия является отличительной чертой клинически значимого дефицита воды, что может быть связано с адипсией;
- дефицит воды, связанный с адипсией также вызывает высокий уровень креатинина и увеличение соотношения креатинина и АМК.

- Результатом дефицита воды часто является заметно повышенная осмолояльность сыворотки;
- Уровни электролитов в моче и ее осмотическое давление:
- Одновременные измерения электролитов мочи и осмоляльности являются критическими в определении центральных, а не почечных причин нарушений водного гомеостаза;
- При адипсии, фракционная экскреция натрия составляет менее 1%, если дефект сосуществует с нарушениями функционала вазопрессина;
- Осмоляльности мочи очень высока, если не наблюдается дефектов, обусловленных недостаточностью вазопрессина;
- При несахарном диабете, концентрация мочи субмаксимальна, даже в условиях высокой осмоляльности сыворотки. При солевой интоксикации, концентрация в моче натрия очень высока, а его фракционная экскреция больше, чем на 1%;
- Трудности в диагностике могут возникнуть, когда адипсия и несахарный диабет сосуществуют. У этих больных первоначальные результаты испытаний могут показать наводящий несахарный диабет.

- Уровни гормонов в крови;
- При изолированной адипсии, циркулирующий уровень вазопрессина должен быть высоким, отражая соответствующую реакцию гипофиза на гиперосмолярность. У пациентов, которые имеют дефекты в регуляции жажды и секреции вазопрессина, уровень этого гормона в сыворотке очень низкий или отсутствует;
- Повышенные уровни ренина плазмы и альдостерона могут свидетельствовать о вторичной гиповолемии.
Из методов визуальной диагностики наиболее часто применяют мозговые исследования, такие как компьютерная томография и МРТ, которые весьма показаны, если основной причиной развития адипсии может быть анатомо-физиологический дефект в области головного мозга — пустое турецкое седло или опухоль. Методы также могут помочь исключить осложнения гипернатремии, такие как внутричерепное кровоизлияние.
Медицинская помощь при адипсии
Основные моменты лечения адипсии:
- Лечение основной причины заболевания может растянуться на годы, поскольку патология имеет высокую тенденцию к рецидивам.
- Большинство истинных причин адипсии неизлечимы — пациентам придется пожизненно принимать симптоматическое лечение.
- Лежащие в основе болезни повреждения гипоталамической области в 99% необратимы, что приводит к состоянию из вышеописанного пункта.
- Цель медицинской помощи — научить пациента поддерживать адекватное потребление жидкости независимо от проявлений жажды.
Варианты лечения:
- Фармакологическая терапия не предусмотрена для лечения этого заболевания в настоящее время.
- Основное направление в терапии — потребление воды регулярно и независимо от требований организма.
- Электрошоковая терапия был использована со смешанными результатами среди пациентов, у которых основной причиной является психогенный фактор.
- Когда поведенческая терапия не удается, остается только вариант длительное введение жидкостей через назогастральный зонд в особо запущенных случаях.
- Назначение десмопрессина ацетата актуально, если необходимо ограничить выход мочи. Метод особенно полезен у пациентов с сосуществующим центральным несахарным диабетом.
- При адипсии в случае несахарного диабета, восстановление функции жажды, после исключения основной причины могут быть оценены с помощью визуальной аналоговой шкалы после инфузии гипертонического раствора.
Другие терапевтические манипуляции и рекомендации:
- хирургическое удаление опухолей, гематом или кист, которые подавляют деятельность центра жажды;
- ограничения в питании не предусмотрены;
- частый и регулярный прием воды должен быть сохранен;
- ограничений на деятельность не требуется.
Адипсический несахарный диабет после транссфеноидального удаления стебельно-интравентрикулярной краниофарингиомы | Астафьева
АКТУАЛЬНОСТЬ
Краниофарингиома (КФ) — редкая эмбриональная опухоль с низкой гистологической степенью (ВОЗ), развивающаяся из остатков краниофарингеального протока в хиазмально-селлярной области. Частота встречаемости этих опухолей составляет 1,2–4,6% [1]. Общая выживаемость пациентов с КФ высока (87–95%), однако качество жизни часто ухудшается из-за последствий, обусловленных анатомической близостью к гипоталамо-гипофизарной области и зрительному перекресту [2].
Частота встречаемости этих опухолей составляет 1,2–4,6% [1]. Общая выживаемость пациентов с КФ высока (87–95%), однако качество жизни часто ухудшается из-за последствий, обусловленных анатомической близостью к гипоталамо-гипофизарной области и зрительному перекресту [2].
Несахарный диабет (НД) — это наиболее распространенное послеоперационное нарушение после хирургического лечения КФ, частота его развития составляет 60–96% [2–4].
У пациентов с КФ и НД более высокий показатель смертности, чем у пациентов без НД [5]. Вероятно, это ассоциировано с более частым поражением гипоталамических структур, а также тяжелой диснатриемией. В редких случаях развивается адипсический НД. Аномалии жажды могут привести к опасным для жизни электролитным и метаболическим последствиям, что увеличивают смертность у пациентов с КФ [2][4].
Представленный клинический случай демонстрирует адипсический НД с развитием тяжелой гипернатриемии и грубых психических нарушений после эндоскопического трансназального транссфеноидального удаления стебельно-интравентрикулярной КФ.
ОПИСАНИЕ СЛУЧАЯ
Пациентка З., 58 лет, 09.11.2021 поступила в ФГАУ «НМИЦ нейрохирургии им. акад. Н.Н. Бурденко» МЗ РФ с жалобами на ухудшение зрения.
Из анамнеза: указанные жалобы беспокоили в течение года. В 2015 г. пациентке проведена левосторонняя нефрэктомия по поводу светлоклеточного рака почки, Т1аN0M0. Также известно, что около 10 лет назад диагностирован сахарный диабет 2 типа. За 6 мес до поступления перенесла инфекцию COVID-19.
Гинекологический анамнез: 2 беременности, закончившиеся срочными родами путем кесарева сечения. Постменопауза с 53 лет.
При поступлении состояние удовлетворительное. Пациентка не предъявляла жалоб на жажду, учащенное мочеиспускание. Диурез не учитывался. Рост 167 см. Вес 95 кг. ИМТ 34,06 кг/м2. Кожные покровы чистые, физиологической окраски. Подкожно-жировая клетчатка развита избыточно, распределение преимущественно равномерное. АД 130/80 мм рт.cт., ЧСС — 78 в минуту. Неврологический статус и психическое состояние без особенностей.
При нейроофтальмологическом обследовании выявлены признаки воздействия на зрительный путь на основании головного мозга. Vis OD=1,0, Vis OS=1,0, сужение поля зрения в височной половине OD, концентрическое сужение поля зрения ОS.
В гормональном анализе крови гипопитуитарных нарушений выявлено не было (табл. 1). В биохимическом анализе крови отмечена умеренная гипернатриемия 148 ммоль/л (референсный интервал 136–145). В клиническом анализе мочи удельная плотность составила 1013 г/л. Показатели углеводного обмена компенсированы на фоне приема пероральных сахароснижающих препаратов (гликлазид 60 мг, линаглиптин 5 мг и метформин 1000 мг), гликированный гемоглобин 6,7%.
Таблица 1. Лабораторные показатели пациента
Table 1. Patient’s laboratory parameters
Показатель | Результат до операции | Результат после операции | Результат на 28 сутки после операции на фоне отмены гормональной терапии | Референсный интервал | Единицы измерения |
ТТГ | 1,4 | 0,3 | 0,2 | 0,35–4,94 | мМЕ/мл |
Т4 свободный | 11,8 | 8,5 | 9,7 | 9,0–19,0 | пмоль/л |
Т3 свободный | 3,8 | 3,1 | 2,92 | 3,5–6,5 | пмоль/л |
Кортизол | 256 | 27 | 31 | 101–536 | нмоль/л |
Пролактин | 546 | 450 | 352 | 110–562 | мкМЕ/мл |
ЛГ | — | 0. | 0,1 | 5,16–61,99 | Ед/л |
ФСГ | — | 0,2 | 0,3 | 26,72–133,41 | Ед/л |
Эстрадиол | — | 28 | 25 | 36–528 | пмоль/л |
ИФР-1 | 86 | 78 | 71,3 | 81–225 | нг/мл |
Примечание. ТТГ — тиреотропный гормон; Т4 — тироксин; Т3 — трийодтиронин; ЛГ — лютеинизирующий гормон; ФСГ — фолликулостимулирующий гормон; ИФР-1 — инсулиноподобный фактор роста 1.
При проведении МРТ головного мозга выявлена солидно-кистозная супраселлярная КФ с интравентрикулярным распространением, вовлечением стебля гипофиза (рис. 1).
1).
Рисунок 1. МРТ пациентки З. до операции. Визуализируется солидно-кистозная супраселлярная краниофарингиома с интравентрикулярным распространением, вовлечением стебля гипофиза (обозначена и указана стрелкой).
Figure 1. MRI of patient Z. before surgery. A solid cystic suprasellar craniopharyngioma with intraventricular extension involving the pituitary stalk is visualized (marked and indicated by an arrow).
10.11.2021 проведено эндоскопическое трансназальное удаление стебельно-интравентрикулярной КФ. В ходе операции обнаружен солидный и кистозный компоненты опухоли, происходящей из стебля гипофиза. После вынужденного пересечения стебля гипофиза и мобилизации опухоли она была удалена крупными фрагментами, включая практически всю капсулу. Остались небольшие фрагменты капсулы, которые были плотно спаяны с дном 3 желудочка и хиазмой зрительных нервов. После удаления основного объема опухоли визуализирован III желудочек, межталамическое сращение.
По данным послеоперационного КТ-исследования осложнений не выявлено. Гистологическое исследование подтвердило адамантиномоподобную КФ, WHO Grade I, с выраженной глиальной капсулой.
В 1-е сутки после операции отмечалось повышение уровня натрия до 155 ммоль/л (референсный интервал 136–145 ммоль/л). Пациентка предъявляла жалобы на головную боль, отмечался эпизод психомоторного возбуждения, потребовавший дополнительного назначения седатирующей терапии. Получала дексаметазон, антипсихотические и противоэпилептические препараты (кветиапин, аминомасляную кислоту, вальпроат натрия). При контроле гормонального анализа на фоне отмены дексаметазона был диагностирован пангипопитуитаризм: вторичный гипотиреоз, вторичная надпочечниковая недостаточность, вторичный гипогонадизм, дефицит соматотропного гормона (табл. 1). Была назначена терапия гидрокортизоном в дозе 30 мгв сутки и левотироксином натрия 100 мкг в сутки. В качестве сахароснижающей терапии применялся инсулин короткого действия, впоследствии была переведена на базис-болюсную инсулинотерапию, на этом фоне гликемия 7–12 ммоль/л. На 2-е сутки после операции по данным учета диуреза объем выпитой жидкости составил 1000 мл, выделенной — 2300 мл. Уровень натрия 150–155 ммоль/л, осмоляльность крови 323 мОсм/л (референсный интервал 280–295 мОсм/л). Несмотря на это, произвольной потребности в приеме жидкости пациентка не испытывала.
На 2-е сутки после операции по данным учета диуреза объем выпитой жидкости составил 1000 мл, выделенной — 2300 мл. Уровень натрия 150–155 ммоль/л, осмоляльность крови 323 мОсм/л (референсный интервал 280–295 мОсм/л). Несмотря на это, произвольной потребности в приеме жидкости пациентка не испытывала.
В связи с отсутствием у пациентки полидипсии при увеличенном объеме выделенной жидкости, стойкой гипернатриемии диагностирован адипсический НД. Назначен десмопрессин 0,1 мг 2 раза в сутки, с дополнительным приемом при повышении темпов диуреза при соблюдении питьевого режима (не менее 2000–2500 мл жидкости в сутки). На этом фоне показатели натрия стабилизировались в пределах 140–143 ммоль/л, объем выпитой жидкости соответствовал выделенному. На 5-е сутки нафоне полиурии около 4000 мл в сутки вновь отмечена гипернатриемия до 150 ммоль/л. При дополнительном приеме десмопрессина показатели нормализовались. Динамика уровня натрия в крови в периоперационном периоде отражена на рисунке 2.
Рисунок 2. Динамика уровня натрия у пациентки З.
Динамика уровня натрия у пациентки З.
Figure 2. Dynamics of sodium level in patient Z.
На 8-е сутки после операции пациентка была выписана в удовлетворительном состоянии без явного психоневрологического дефицита. Уровень натрия при выписке 144 ммоль/л. В анализах крови значимых патологических изменений не выявлено. Даны рекомендации по приему гормональной терапии (гидрокортизон, левотироксин натрия, десмопрессин), соблюдению питьевого режима с потреблением не менее 2–2,5 л жидкости в стуки. Также была скорректирована сахароснижающая терапия.
На 16-е сутки после операции (8-е сутки выписки из стационара) пациентка экстренно госпитализирована в отделение в состоянии глубокого оглушения. АД 130/80 мм рт.ст. Со слов родственников, в течение последних 4 дней больная прекратила прием гормональной терапии, не вела учет выпитой и выделенной жидкости. Развились выраженные психические нарушения, когда стала «заговариваться», была грубо дезориентирована — не понимала, где находится, что с ней происходит, не узнавала родственников.
При поступлении в биохимическом анализе крови уровень натрия 155–160 ммоль/л в течение дня, гипергликемия 12–19 ммоль/л. В отделении наблюдалось нарастание психомоторного возбуждения с галлюцинаторно-бредовой симптоматикой. Пациентка стала беспокойной, дезориентированной, отвечала невпопад, разговаривала сама с собой. Стремилась уйти, собирала вещи, разговаривала с «мнимыми» людьми, пыталась «спастись», отмахивалась от кого-то, отрывочно высказывала, что рядом в палате «животные и насекомые». Данные гормонального анализа крови на фоне отмены гидрокортизона и левотироксина приведены в таблице 1.
По данным МРТ-исследования признаков интракраниальных осложнений не выявлено, фрагменты капсулы опухоли в области III желудочка (рис. 3).
Рисунок 3. МРТ пациентки З. после операции. На фоне послеоперационных изменений визуализируются фрагменты капсулы опухоли в области III желудочка (указаны стрелкой).
Figure 3. MRI of patient Z. after surgery. Against the background of postoperative changes, fragments of the tumor capsule are visualized in the region of the third ventricle (indicated by an arrow).
Against the background of postoperative changes, fragments of the tumor capsule are visualized in the region of the third ventricle (indicated by an arrow).
Возобновлена гормональная терапия: преднизолон в дозе 30 мг, левотироксин в дозе 100 мкг, десмопрессин 0,1 мг 2–3 раза в день под контролем диуреза и уровня натрия. В связи с гипергликемией проводилась постоянная внутривенная инфузия инсулина с дальнейшей нормализацией показателей в пределах целевых значений. На фоне проводимой терапии десмопрессином постепенно достигнуто снижение уровня натрия (143–144 ммоль/л), суточный диурез 2500–3500 мл, сохранялись психические нарушения в эмоционально-личностной и мотивационной сфере, мнестические расстройства. Ввиду снижения произвольной потребности в приеме жидкости пациентка самостоятельно выпивала не более 500–600 мл в сутки, запивая пищу. Для достижения нормального водного баланса требовались уговоры медицинского персонала выпивать не менее 2500 мл жидкости в сутки.
Выписана с рекомендациями по приему преднизолона 7,5 мг, левотироксина 100 мкг и фиксированных доз десмопрессина 60 мкг (0,1 мг) 3 раза в сутки под постоянным контролем количества выпитой и выделенной жидкости со стороны пациенткии ее родственников, динамическим исследованием электролитов крови.
ОБСУЖДЕНИЕ
Адипсический НД (АНД) является редким и потенциально опасным для жизни заболеванием. Он характеризуется центральным НД вследствие дефицита вазопрессина (синоним: антидиуретический гормон, АДГ) и отсутствием нормальной реакции на жажду при гиперосмолярности. В литературе случаи НД с адипсией или гиподипсией встречаются редко. По данным работы Y. Eisenberg, А. Lawrence (2016 г.), всего в литературе описано около 100 случаев адипсически-гиподипсического НД [6–10].
Жажда и секреция АДГ являются важнейшими процессами поддержания водно-электролитного баланса. Возникновение жажды является защитным механизмом, что позволяет проводить адекватную регидратацию в ответ на полиурию, тем самым поддерживая нормальную концентрацию натрия. Основным фактором, влияющим на секрецию вазопрессина и реакцию на жажду, является изменение осмоляльности плазмы крови; нормальная осмоляльность варьирует в пределах 285–295 мОсм/кг. Повышение осмоляльности стимулирует жажду и высвобождение вазопрессина. Как известно, тела нейронов, продуцирующих АДГ, расположены в супраоптических и паравентрикулярных ядрах гипоталамуса, аксоны которых заканчиваются в задней доле гипофиза. Осморецепторы жажды также расположены в передних отделах гипоталамуса и терминальной пластинки. Возникновение послеоперационного НД связывают с интраоперационным повреждением гипофиза и его стебля, что приводит к прерыванию транспорта АДГ из гипоталамуса, нарушению его высвобождения из задней доли гипофиза, либо при повреждении аксонов АДГ-секретирующих нейронов обусловливает ретроградное (восходящее) повреждение ядер гипоталамуса, секретирующих АДГ. Причиной нарушения возникновения чувства жажды считают повреждение осморецепторной области гипоталамуса [9–11].
Как известно, тела нейронов, продуцирующих АДГ, расположены в супраоптических и паравентрикулярных ядрах гипоталамуса, аксоны которых заканчиваются в задней доле гипофиза. Осморецепторы жажды также расположены в передних отделах гипоталамуса и терминальной пластинки. Возникновение послеоперационного НД связывают с интраоперационным повреждением гипофиза и его стебля, что приводит к прерыванию транспорта АДГ из гипоталамуса, нарушению его высвобождения из задней доли гипофиза, либо при повреждении аксонов АДГ-секретирующих нейронов обусловливает ретроградное (восходящее) повреждение ядер гипоталамуса, секретирующих АДГ. Причиной нарушения возникновения чувства жажды считают повреждение осморецепторной области гипоталамуса [9–11].
Потеря чувства жажды затрудняет диагностику и увеличивает риск обезвоживания и тяжелой гипернатриемии (содержание натрия в сыворотке более 150 ммоль/л). Как было сказано выше, пациенты с АНД подвержены высокому риску тяжелой гипернатриемии. Н. Arima и соавт. сообщили об относительном риске гипернатриемии в сыворотке крови у пациентов с АНД в сравнении с пациентами с НД и сохраненной жаждой (25% против 0,4% от измеренных значений натрия) [12].
сообщили об относительном риске гипернатриемии в сыворотке крови у пациентов с АНД в сравнении с пациентами с НД и сохраненной жаждой (25% против 0,4% от измеренных значений натрия) [12].
Гипернатриемия и дегидратация могут проявляться выраженной цефалгией, гипертермией, тошнотой, рвотой, судорогами, психомоторным возбуждением, нарушением сознания. Диагноз адипсии/гиподипсии может быть установлен, когда пациент с гипернатриемией или гиперосмоляльностью отрицает жажду и/или не пьет самопроизвольно или даже проявляет отвращение к жидкости. НД у таких пациентов, как правило, постоянный, но со временем может появиться жажда, в ряде случаев заболевание разрешается в течение года после операции. Предполагается, что это связано с тем, что осморецепторы, контролирующие чувство жажды, в отличие от клеток, секретирующих АДГ, сохраняют некоторую способность к восстановлению. Чаще такое состояние встречается у пациентов с КФ, причем как до оперативного лечения, так и после него [4][13–16].
Тактика ведения пациентов с АНД аналогична алгоритму лечения пациентов с центральным НД различного генеза: нормализация диуреза и уровня натрия. Стойкая гипернатриемия диктует необходимость более длительного наблюдения в условиях стационара с целью своевременной коррекции терапии, в том числе и у бессимптомных пациентов [12].
Стойкая гипернатриемия диктует необходимость более длительного наблюдения в условиях стационара с целью своевременной коррекции терапии, в том числе и у бессимптомных пациентов [12].
Учитывая редкость встречаемости НД с адипсией, в настоящее время крупных клинических исследований по оценке эффективности различных схем лечения не проводилось. По имеющимся данным литературы, чаще применяются фиксированные дозы десмопрессина для достижения суточного диуреза от 1,5 до 2 л. Также нормализация уровня натрия кроме лекарственной терапии достигается путем достаточного потребления воды, чтобы избежать гипернатриемии при обезвоживании. Однако избыточное потребление жидкости, когда секреция АДГ не нарушена или во время лечения аналогами АДГ, может способствовать водной интоксикации и гипонатриемии. Обязателен контроль веса для оценки потерь жидкости [10][13][16–18].
ЗАКЛЮЧЕНИЕ
Представленный клинический случай демонстрирует редкую патологию диэнцефальной области — адипсический НД с развитием тяжелой гипернатриемии у пациентки со стебельно-интравентрикулярной КФ. Его развитие, вероятно, обусловлено опухолевым поражением гипоталамического «центра жажды» до проведения хирургического лечения, а интраоперационное пересечение стебля гипофиза усугубило течение НД.
Его развитие, вероятно, обусловлено опухолевым поражением гипоталамического «центра жажды» до проведения хирургического лечения, а интраоперационное пересечение стебля гипофиза усугубило течение НД.
Таким образом, всем пациентам с КФ независимо от жалоб обязательно проведение до и после оперативного вмешательства гормонального исследования, учета количества выпитой и выделенной жидкости, контроля уровня натрия, массы тела. Крайне важно исследование осмоляльности крови и мочи у пациентов с патологией диэнцефальной области. Ранняя диагностика нарушений и своевременное назначение препаратов десмопрессина в послеоперационном периоде улучшает прогноз послеоперационной реабилитации и снижает риски развития осложнений и смертности у таких пациентов.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Статья подготовлена на личные средства авторского коллектива.
Согласие пациента. Пациент добровольно подписал информированное согласие на публикацию в журнале Проблемы эндокринологии персональной медицинской информации в обезличенной форме.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов. Астафьева Л.И., Бадмаева И.Н., Сиднева Ю.Г. — существенный вклад в концепцию или дизайн исследования, в получение, анализ данных или интерпретацию результатов; Астафьева Л.И., Бадмаева И.Н., Сиднева Ю.Г., Клочкова И.С., Фомичев Д.В., Чернов И.В., Калинин П.Л. — написание статьи или внесение в рукопись существенной (важной) правки с целью повышения научной ценности статьи; Калинин П.Л. — одобрение финальной версии рукописи.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы
Согласие пациента. Пациент добровольно подписал информированное согласие на публикацию персональной медицинской информации в обезличенной форме.
1. Erfurth EM. Diagnosis, Background, and Treatment of Hypothalamic Damage in Craniopharyngioma. Neuroendocrinology. 2020;110(9-10):767-779. doi: https://doi.org/10.1159/000509616
2. Thompson CJ, Costello RW, Crowley RK. Management of hypothalamic disease in patients with craniopharyngioma. Clinical Endocrinology. 2019;90(4):506-516. doi: https://doi.org/10.1111/cen.13929
3. Honegger J, Buchfelder M, Fahlbusch R. Surgical treatment of craniopharyngiomas: endocrinological results. J Neurosurg. 1999;90(2):251-257. doi: https://doi.org/10.3171/jns.1999.90.2.0251
4. Smith D, Finucane F, Phillips J, et al. Abnormal regulation of thirst and vasopressin secretion following surgery for craniopharyngioma. Clinical Endocrinology. 2004;61(2):273-279. doi: https://doi.org/10.1111/j.1365-2265.2004.02086.x
5. Olsson DS, Andersson E, Bryngelsson I-L, et al. Excess Mortality and Morbidity in Patients with Craniopharyngioma, Especially in Patients with Childhood Onset: A Population-Based Study in Sweden. J Clin Endocrinol Metab. 2015;100(2):467-474. doi: https://doi.org/10.1210/jc.2014-3525
J Clin Endocrinol Metab. 2015;100(2):467-474. doi: https://doi.org/10.1210/jc.2014-3525
6. Hensen J, Henig A, Fahlbusch R, Meyer M, Boehnert M, Buchfelder M. Prevalence, predictors and patterns of postoperative polyuria and hyponatraemia in the immediate course after transsphenoidal surgery for pituitary adenomas. Clin Endocrinol (Oxf). 1999;50(4):431-439. doi: https://doi.org/10.1046/j.1365-2265.1999.00666.x
7. Adams JR, Blevins LS, Allen GS, et al. Disorders of water metabolism following transsphenoidal pituitary surgery: A single institution’s experience. Pituitary. 2006;9(2):93-99. doi: https://doi.org/10.1007/s11102-006-9276-2
8. Nemergut EC, Zuo Z, Jane JA, Laws ER. Predictors of diabetes insipidus after transsphenoidal surgery: a review of 881 patients. J Neurosurg. 2005;103(3):448-454. doi: https://doi.org/10.3171/jns.2005.103.3.0448
9. Schreckinger M, Walker B, Knepper J, et al. Postoperative diabetes insipidus after endoscopic transsphenoidal surgery. Pituitary. 2013;16(4):445-451. doi: https://doi.org/10.1007/s11102-012-0453-1
2013;16(4):445-451. doi: https://doi.org/10.1007/s11102-012-0453-1
10. Eisenberg Y, Frohman LA. Adipsic diabetes insipidus: A review. Endocrine Practice. 2016;22(1):76-83. doi: https://doi.org/10.4158/EP15940.RA
11. Robertson GL. Abnormalities of thirst regulation. Kidney Int. 1984;25(2):460-469. doi: https://doi.org/10.1038/ki.1984.39
12. Arima H, Wakabayashi T, Nagatani T, et al. Adipsia increases risk of death in patients with central diabetes insipidus. Endocr J. 2014;61(2):143-148. doi: https://doi.org/10.1507/endocrj.EJ13-0368
13. Crowley RK, Sherlock M, Agha A, et al. Clinical insights into adipsic diabetes insipidus: a large case series. Clin Endocrinol (Oxf). 2007;47(4):475-482. doi: https://doi.org/10.1111/j.1365-2265.2007.02754.x
14. Cuesta M, Hannon MJ, Thompson CJ. Adipsic diabetes insipidus in adult patients. Pituitary. 2017;20(3):372-380. doi: https://doi.org/10.1007/s11102-016-0784-4
15. Ball SG, Vaidja B, Baylis PH. Hypothalamic adipsic syndrome: diagnosis and management. Clin Endocrinol (Oxf). 1997;47(4):405-409. doi: https://doi.org/10.1046/j.1365-2265.1997.2591079.x
Clin Endocrinol (Oxf). 1997;47(4):405-409. doi: https://doi.org/10.1046/j.1365-2265.1997.2591079.x
16. Пигарова Е.А., Дзеранова Л.К. Диагностика и лечение центрального несахарного диабета // Ожирение и метаболизм. — 2014. — Т. 11. — №4. — С. 48–55. doi: https://doi.org/10.14341/omet2014448-55
17. Дедов И.И., Мельниченко Г.А., Пигарова Е.А. и др. Федеральные клинические рекомендации по диагностике и лечению несахарного диабета у взрослых // Ожирение и метаболизм. — 2018. — Т. 15. — №2. — С. 56-71. doi: https://doi.org/10.14341/omet9670
18. Sherlock M, Agha A, Crowley R, et al. Adipsic diabetes insipidus following pituitary surgery for a macroprolactinoma. Pituitary. 2006;9(1):59-64. doi: https://doi.org/10.1007/s11102-006-8280-x
Несахарный диабет — сложное сочетание полиурии и адипсии: клинический случай и обзор литературы
1. Eisenberg Y, Frohman LA. Адипический несахарный диабет: обзор. Эндокр Практ. (2016) 22:76–83. 10.4158/EP15940.RA [PubMed] [CrossRef] [Google Scholar]
2. Robertson GL. Нарушения регуляции жажды. почки инт. (1984) 25:460–9. 10.1038/ki.1984.39 [PubMed] [CrossRef] [Google Scholar]
Robertson GL. Нарушения регуляции жажды. почки инт. (1984) 25:460–9. 10.1038/ki.1984.39 [PubMed] [CrossRef] [Google Scholar]
3. Spetzler RF, Martin NA. Предлагаемая система классификации артериовенозных мальформаций. Дж Нейрохирург. (1986) 65:476–83. 10.3171/jns.1986.65.4.0476 [PubMed] [CrossRef] [Google Scholar]
4. Ellens NR, Figueroa BE, Clark JC. Использование вызванной барбитуратами комы во время цереброваскулярных нейрохирургических процедур: обзор литературы. Мозг Цирк. (2015) 1:140–6. 10.4103/2394-8108.172887 [CrossRef] [Google Scholar]
5. Zimmerman CA, Huey EL, Ahn JS, Beutler LR, Tan CL, Kosar S, et al. Сигнал осмолярности жидкости от кишечника к мозгу контролирует жажду насыщение. Природа. (2019) 568: 98–102. 10.1038/с41586-019-1066-x [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
6. Августин В., Гёкче С.К., Ли С., Ван Б., Дэвидсон Т.Дж., Рейманн Ф. и др.. Иерархическая нейронная архитектура, лежащая в основе жажды регулирование. Природа. (2018) 555: 204–9. 10.1038/nature25488 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Природа. (2018) 555: 204–9. 10.1038/nature25488 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
7. Bichet DG. Регуляция жажды и высвобождения вазопрессина. Annu Rev Physiol. (2019) 81: 359–73. 10.1146/annurev-physiol-020518-114556 [PubMed] [CrossRef] [Google Scholar]
8. МакКинли М.Дж., Дентон Д.А., Райан П.Дж., Яо С.Т., Стефанидис А., Олдфилд Б.Дж. От сенсорных околожелудочковых органов к коре головного мозга: нервные пути, контролирующие жажду и голод. J Нейроэндокринол. (2019) 31:e12689. 10.1111/jne.12689 [PubMed] [CrossRef] [Google Scholar]
9. McKinley MJ, Yao ST, Uschakov A, McAllen RM, Rundgren M, Martelli D. Срединное преоптическое ядро: переднее и центральное для регуляции тела жидкости, натрия, температуры, сна и сердечно-сосудистого гомеостаза. Акта Физиол. (2015) 214:8–32. 10.1111/apha.12487 [PubMed] [CrossRef] [Google Scholar]
10. Hiyama TY, Matsuda S, Fujikawa A, Matsumoto M, Watanabe E, Kajiwara H, et al. Аутоиммунитет к датчику уровня натрия в головном мозге вызывает эссенциальную гипернатриемию. Нейрон. (2010) 66:508–22. 10.1016/j.neuron.2010.04.017 [PubMed] [CrossRef] [Google Scholar]
Нейрон. (2010) 66:508–22. 10.1016/j.neuron.2010.04.017 [PubMed] [CrossRef] [Google Scholar]
11. Baylis PH, Thompson CJ. Осморегуляция секреции вазопрессина и жажды в норме и при болезни. Клин Эндокринол. (1998) 29:549–76. 10.1111/j.1365-2265.1988.tb03704.x [PubMed] [CrossRef] [Google Scholar]
12. Гизовский С, Бурк С.В. Нейронная основа гомеостатической и упреждающей жажды. Нат Рев Нефрол. (2018) 14:11–25. 10.1038/nrneph.2017.149 [PubMed] [CrossRef] [Google Scholar]
13. Smith D, McKenna K, Moore K, Tormey W, Finucane J, Phillips J и др. Барорегуляция высвобождения вазопрессина при несахарном диабете. J Clin Endocrinol Metab. (2002) 87:4564–8. 10.1210/jc.2002-020090 [PubMed] [CrossRef] [Google Scholar]
14. Jung HJ, Kwon TH. Молекулярные механизмы, регулирующие аквапорин-2 в собирательных трубочках почек. Am J Physiol Renal Physiol. (2016) 311:F1318–28. 10.1152/ajprenal.00485.2016 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
15.
16. Imai E, Kaneko S, Tsukamoto Y. Компенсаторная адаптация почек к обращению с водой у пациента с несахарным диабетом после клипирования разрыв аневризмы передней соединительной артерии. Клин Нефрол. (2017) 88:112–6. 10.5414/CN108963 [PubMed] [CrossRef] [Google Scholar]
17. McIver B, Connacher A, Whittle I, Baylis P, Thompson C. Адипсический гипоталамический несахарный диабет после клипирования аневризмы передней соединительной артерии. БМЖ. (1991) 303:1465–7. 10.1136/bmj.303.6815.1465 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
18. Ball SG, Vaidya B, Bayliss PH. Гипоталамоадипсический синдром: диагностика и лечение. Клин Эндокринол. (1997) 47:405–9. 10.1046/j.1365-2265.1997.2591079.
19. Нгуен Б.Н., Яблон С.А., Чен С.Ю. Гиподипсическая гипернатриемия и несахарный диабет после клипирования аневризмы передней соединительной артерии: диагностические и терапевтические проблемы у пациента после амнестической реабилитации. Травма головного мозга. (2001) 15:975–80. 10.1080/02699050110063459 [PubMed] [CrossRef] [Google Scholar]
20. Насси С.С., Анг В.Т., Дженкинс Дж.С. Хроническая гипернатриемия и гипотермия после субарахноидального кровоизлияния. Postgrad Med J. (1986) 62:467–741. 10.1136/pgmj.62.728.467 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
21. Спиро С.Г., Дженкинс Дж.С. Адипсия и гипотермия после субарахноидального кровоизлияния. БМЖ. (1971) 3:411–2. 10.1136/bmj.3.5771.411 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
22. Кроули Р.К., Шерлок М., Ага Д., Смит Д., Томпсон С.Дж. Клинические взгляды на адипсический несахарный диабет: большая серия случаев. Клин Эндокринол. (2007) 66:475–82. 10.1111/j.1365-2265.2007.02754.x [PubMed] [CrossRef] [Google Scholar]
(2007) 66:475–82. 10.1111/j.1365-2265.2007.02754.x [PubMed] [CrossRef] [Google Scholar]
23. Colleran K, Sanchez-Goettler L, Sloan A. Гипоталамическое ожирение, осложненное адипсическим центральным несахарным диабетом после хирургической резекции краниофарингиомы . Дж. Клин Гипертенс. (2009 г.) 11: 608–10. 10.1111/j.1751-7176.2009.00057.x [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
24. Zantut-Wittmann D, Garmes HM, Panzan AD, Lima Mde O, Baptista MT. Тяжелый рабдомиолиз из-за жировой гипернатриемии после операции на краниофарингиоме. Арк Брас Эндокринол Метабол. (2007) 51:7. 10.1590/S0004-27302007000700023 [PubMed] [CrossRef] [Google Scholar]
25. Raghunathan V, Dhaliwal MS, Gupta A, Jevalikar G. От истощения мозга до несахарного диабета с адипсией: клинический случай ребенка с краниофарингиомой. J Pediatr Endocrinol Metab. (2015) 28:323–6. 10.1515/jpem-2014-0224 [PubMed] [CrossRef] [Google Scholar]
26. Sinha A, Ball S, Jenkins A, Hale J, Cheetham T.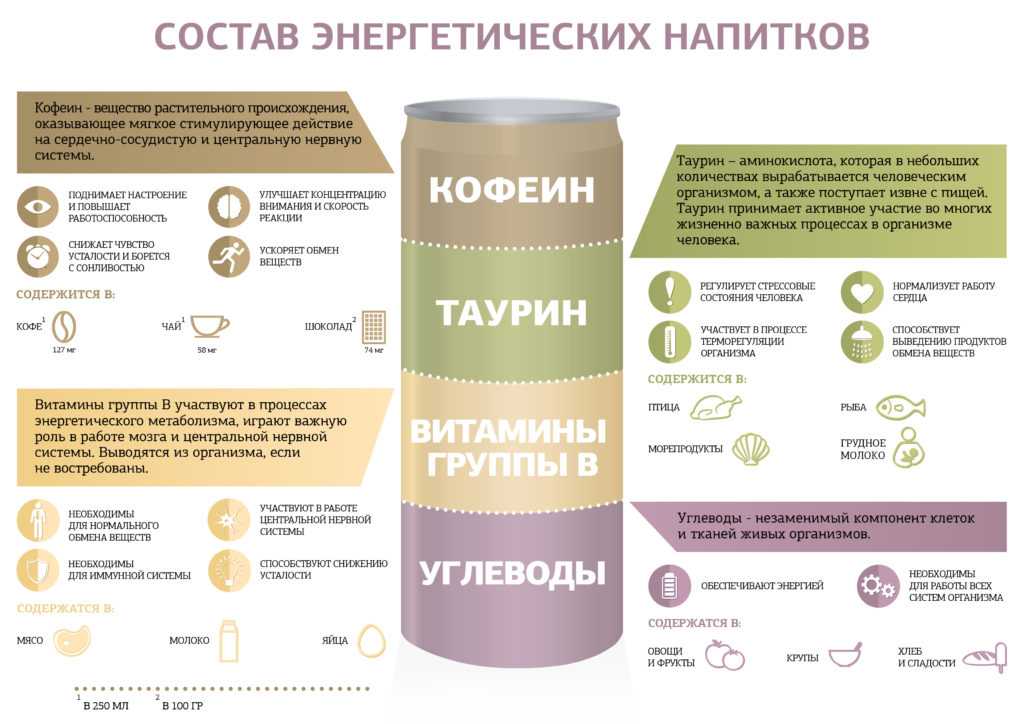 Объективная оценка восстановления жажды у пациентов с несахарным диабетом. гипофиз. (2011) 14:307–11. 10.1007/s11102-011-0294-3 [PubMed] [CrossRef] [Google Scholar]
Объективная оценка восстановления жажды у пациентов с несахарным диабетом. гипофиз. (2011) 14:307–11. 10.1007/s11102-011-0294-3 [PubMed] [CrossRef] [Google Scholar]
27. Перес М.А., Миллан Х.А., Наранхо Х.А., Флорес Ромеро А. Несахарный диабет, вторичный по отношению к резекции краниофарингиомы. BMJ Case Rep. (2019) 12:e225903. 10.1136/bcr-2018-225903 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
28. Pabich S, Flynn M, Pelley E. Ежедневный мониторинг натрия и протокол потребления жидкости: предотвращение повторных госпитализаций при несахарном диабете . Дж Эндок Соц. (2019) 3:882–6. 10.1210/js.2018-00406 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
29. Pereira MC, Vieira MM, Pereira JS, Salgado D. Адипсия у пациента с несахарным диабетом. Представитель по делу Oncol. (2015) 8:385–8. 10.1159/000440611 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
30. Zhang Y, Wang D, Feng Y, Zhang W, Zeng X. Подагра с юношеским началом и несахарный диабет: клинический случай и литературный обзор. J Int Med Res. (2018) 46:4829–36. 10.1177/0300060518800114 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
J Int Med Res. (2018) 46:4829–36. 10.1177/0300060518800114 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
31. Латча С., Любецки М., Вайнштейн А.М. Тяжелая гиперосмолярность и гипернатриемия у молодой женщины с ожирением. Клин Нефрол. (2011) 76:407–11. 10.5414/CN106617 [PubMed] [CrossRef] [Google Scholar]
32. Шерлок М., Ага А., Кроули Р., Смит Д., Томпсон С.Дж. Адипический несахарный диабет после операции на гипофизе по поводу макропролактиномы. гипофиз. (2006) 9:59–64. 10.1007/s11102-006-8280-x [PubMed] [CrossRef] [Google Scholar]
33. Hiyama TY, Utsunomiya AN, Matsumoto M, Fujikawa A, Lin CH, Hara K, et al.. Адипсическая гипернатриемия без поражения гипоталамуса сопровождается аутоантителами к субфорникальному органу. Мозговой патол. (2017) 27:323–31. 10.1111/bpa.12409[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
34. Komatsu H, Miyake H, Kakita S, Ikuta H. Гипоплазия мозолистого тела, связанная с адипсической гипернатриемией и гипоталамическим гипогонадотропином: отчет о клиническом случае и обзор литература. Педиатр Междунар. (2001) 43:683–7. 10.1046/j.1442-200X.2001.01453.x [PubMed] [CrossRef] [Google Scholar]
Педиатр Междунар. (2001) 43:683–7. 10.1046/j.1442-200X.2001.01453.x [PubMed] [CrossRef] [Google Scholar]
35. Schaff-Blass E, Robertson GL, Rosenfield RL. Хроническая гипернатриемия из-за врожденного дефекта осморегуляции жажды и вазопрессина. J Педиатр. (1983) 102:703–8. 10.1016/S0022-3476(83)80237-6 [PubMed] [CrossRef] [Google Scholar]
36. AvRuskin TW, Tang SC, Juan C. Эссенциальная гипернатриемия, секреция антидиуретического гормона и нейрогипофизина: ответ на хлорпропамид. Акта Эндокринол. (1981) 96:145–53. 10.1530/acta.0.0960145 [PubMed] [CrossRef] [Google Scholar]
37. Radetti G, Rizza F, Mengarda G, Pittschieler K. Адипсическая гипернатриемия у двух сестер. Am J Dis Чайлд. (1991) 145:321–5. 10.1001/archpedi.1991.02160030091028 [PubMed] [CrossRef] [Google Scholar]
38. Такея Т., Хамано К., Ивасаки Н., Китадзава Р., Цудзи С., Йогамото М. Случай хронической гипернатриемии с агенезией мозолистого тела. Ниппон Шуникагаккай Засси. (1996) 100:1392–5. [Google Scholar]
39. O’Reilly MW, Sexton DJ, Dennedy MC, Counihan TJ, Finucane FM, O’Brien T, et al. Рентгенологическая ремиссия и восстановление чувства жажды после терапии инфликсимабом при несахарном диабете, вторичном по отношению к нейросаркоидоз. QJM. (2015) 108:657–9. 10.1093/qjmed/hct023 [PubMed] [CrossRef] [Google Scholar]
O’Reilly MW, Sexton DJ, Dennedy MC, Counihan TJ, Finucane FM, O’Brien T, et al. Рентгенологическая ремиссия и восстановление чувства жажды после терапии инфликсимабом при несахарном диабете, вторичном по отношению к нейросаркоидоз. QJM. (2015) 108:657–9. 10.1093/qjmed/hct023 [PubMed] [CrossRef] [Google Scholar]
40. Duvernoy H, Koritké JG, Monnier G. [О васкуляризации терминальной пластинки у человека]. Zeitschrift für Zellforschung и микроскопическая анатомия. (1969) 102:49–77. 10.1007/BF00336416 [PubMed] [CrossRef] [Google Scholar]
41. Duvernoy HM, Risold PY. Околожелудочковые органы: атлас сравнительной анатомии и васкуляризации. Brain Res Rev. (2007) 56: 119–47. 10.1016/j.brainresrev.2007.06.002 [PubMed] [CrossRef] [Google Scholar]
42. Lindgren A, Vergouwen MD, van der Schaaf I, Algra A, Wermer M, Clarke MJ, et al.. Эндоваскулярная спираль в сравнении с нейрохирургическое клипирование при аневризматическом субарахноидальном кровоизлиянии. Кокрановская системная версия базы данных (2018 г. ) 8:CD003085. 10.1002/14651858.CD003085.pub3 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
) 8:CD003085. 10.1002/14651858.CD003085.pub3 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
43. Юут Дж. Х., Роберт З. Нарушения водного баланса после нейрохирургии: новый взгляд на трехфазный ответ. НДТ Плюс. (2010) 3:42–4. 10.1093/ndtplus/sfp117 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
44. Андерссон К.Е., Арнер Б. Эффекты DDAVP, синтетического аналога вазопрессина, у пациентов с краниальным несахарным диабетом. Акта Мед Сканд. (1972) 192:21–7. 10.1111/j.0954-6820.1972.tb04772.x [PubMed] [CrossRef] [Google Scholar]
45. Rembratt A, Graugaard-Jensen C, Senderovitz T, Norgaard JP, Djurhuus JC. Фармакокинетика и фармакодинамика десмопрессина при пероральном и внутривенном введении в дневное и ночное время у здоровых мужчин в возрасте 55–70 лет. Eur J Clin Pharmacol. (2004) 60:397–402. 10.1007/s00228-004-0781-9 [PubMed] [CrossRef] [Google Scholar]
46. Vande Walle J, Stockner M, Raes A, Nørgaard JP. Десмопрессин 30 лет клинического применения: обзор безопасности. Curr Drug Saf. (2007) 2:232–8. 10.2174/157488607781668891 [PubMed] [CrossRef] [Google Scholar]
Curr Drug Saf. (2007) 2:232–8. 10.2174/157488607781668891 [PubMed] [CrossRef] [Google Scholar]
47. Yutaka O, Robertson GL, Nørgaard JP, Juul KV. Лечение нейрогипофизарного несахарного диабета. J Clin Метабол эндокринолов. (2013) 98:3958–67. 10.1210/jc.2013-2326 [PubMed] [CrossRef] [Google Scholar]
48. Фьеллестад-Паулсен А., Хеглунд П., Лундин С., Полсен О. Фармакокинетика 1-деамино-8-D-аргинина вазопрессина после различных путей введения у здоровых добровольцев. Клин Эндокринол. (1993) 38:177–82. 10.1111/j.1365-2265.1993.tb00990.x [PubMed] [CrossRef] [Google Scholar]
49. Lam KS, Wat MS, Choi KL, Ip TP, Pang RW, Kumana CR. Фармакокинетика, фармакодинамика, долгосрочная эффективность и безопасность перорального 1-деамино-8-D-аргинина вазопрессина у взрослых пациентов с центральным несахарным диабетом. Бр Дж Клин Фармакол. (1996) 42:379–85. 10.1046/j.1365-2125.1996.39914.x [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
50. Steiner IM, Kaehler ST, Sauermann R, Rinosl H, Muller M, Joukhadar C. Фармакокинетика плазмы десмопрессина после сублингвального введения: предварительное исследование увеличения дозы у здоровых добровольцев мужского пола. Int J Clin Pharmacol Ther. (2006) 44:172–9. 10.5414/CPP44172 [PubMed] [CrossRef] [Google Scholar]
Фармакокинетика плазмы десмопрессина после сублингвального введения: предварительное исследование увеличения дозы у здоровых добровольцев мужского пола. Int J Clin Pharmacol Ther. (2006) 44:172–9. 10.5414/CPP44172 [PubMed] [CrossRef] [Google Scholar]
51. De Waele K, Cools M, De Guchtenaere A, Van de Walle J, Raes A, Van Aken S, et al.. Лиофилизат десмопрессина для лечения Центральный несахарный диабет: первый опыт у очень маленьких детей. Int J Endocrinol Metab. (2014) 12:e16120. 10.5812/ijem.16120 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Адипсия | патология | Британика
- Развлечения и поп-культура
- География и путешествия
- Здоровье и медицина
- Образ жизни и социальные вопросы
- Литература
- Философия и религия
- Политика, право и правительство
- Наука
- Спорт и отдых
- Технология
- Изобразительное искусство
- Всемирная история
- В этот день в истории
- Викторины
- Подкасты
- Словарь
- Биографии
- Резюме
- Популярные вопросы
- Обзор недели
- Инфографика
- Демистификация
- Списки
- #WTFact
- Товарищи
- Галереи изображений
- Прожектор
- Форум
- Один хороший факт
- Развлечения и поп-культура
- География и путешествия
- Здоровье и медицина
- Образ жизни и социальные вопросы
- Литература
- Философия и религия
- Политика, право и правительство
- Наука
- Спорт и отдых
- Технология
- Изобразительное искусство
- Всемирная история
- Britannica объясняет
В этих видеороликах Britannica объясняет различные темы и отвечает на часто задаваемые вопросы.
- Britannica Classics
Посмотрите эти ретро-видео из архивов Encyclopedia Britannica. - #WTFact Видео
В #WTFact Britannica делится некоторыми из самых странных фактов, которые мы можем найти. - На этот раз в истории
В этих видеороликах узнайте, что произошло в этом месяце (или любом другом месяце!) в истории. - Demystified Videos
В Demystified у Britannica есть все ответы на ваши животрепещущие вопросы.
- Студенческий портал
Britannica — лучший ресурс для учащихся по ключевым школьным предметам, таким как история, государственное управление, литература и т. д. - Портал COVID-19
Хотя этот глобальный кризис в области здравоохранения продолжает развиваться, может быть полезно обратиться к прошлым пандемиям, чтобы лучше понять, как реагировать сегодня. - 100 женщин
Britannica празднует столетие Девятнадцатой поправки, выделяя суфражисток и политиков, творящих историю.



 1
1