Антидепрессанты последствия: Прекращение длительного приема антидепрессантов у людей с депрессией или тревогой
Прием антидепрессантов может привести к достаточно серьезному риску сердечных осложнений
Антидепрессанты останавливают сердце
Александр Рыжков
Применение некоторых антидепрессантов может привести к развитию нарушений ритма сердца вплоть до его полной остановки. Данное открытие должно насторожить практикующих врачей и обязать их не назначать эти препараты без предварительного ЭКГ-тестирования, направленного на исключение возможных сердечных заболеваний.
Депрессия — это психическое расстройство, характеризующееся снижением настроения и утратой способности переживать радость, нарушениями мышления (негативные суждения, пессимистический взгляд на происходящее и т. д.), двигательной заторможенностью. Депрессия — самое «популярное» психическое расстройство: ежегодно около 150 миллионов человек в мире лишаются трудоспособности из-за депрессий. По прогнозам ВОЗ, к 2020 году депрессия выйдет на первое место в мире среди всех заболеваний.
Спектр снимающих симптомы заболевания антидепрессантов чрезвычайно широк.
Эти препараты уменьшают тоску, вялость, апатию, тревогу и эмоциональное напряжение; улучшают настроение, повышают психическую активность; нормализуют продолжительность сна, аппетит. В соответствии с современными научными представлениями, одним из ведущих механизмов развития депрессии является недостаток в синаптической щели (промежуток между нервными клетками, в которых происходит передача нервных импульсов) веществ, отвечающих за хорошее настроение, особенно серотонина и норадреналина. Антидепрессанты блокируют распад этих веществ, называемых моноаминами, или нарушают их обратный захват нервными клетками, в связи с чем их концентрация в синаптической щели возрастает.
Антидепрессанты появились в 50-х годах прошлого века и вначале использовались ограниченно из-за большого количества побочных эффектов, свойственных их первым поколениям.
С 1960-х годов основным направлением в создании новых антидепрессантов являлось уменьшение побочных эффектов, а также усиление основных. Это достигается путем увеличения селективности действия препаратов на нужные рецепторы. Так были созданы селективные ингибиторы обратного захвата серотонина (СИОЗС), селективные ингибиторы обратного захвата норадреналина (СИОЗН) и селективные ингибиторы обратного захвата серотонина и норадреналина (СИОЗСиН). Последние представляют собой наиболее современную и легко переносимую группу селективных ингибиторов обратного захвата.
Это достигается путем увеличения селективности действия препаратов на нужные рецепторы. Так были созданы селективные ингибиторы обратного захвата серотонина (СИОЗС), селективные ингибиторы обратного захвата норадреналина (СИОЗН) и селективные ингибиторы обратного захвата серотонина и норадреналина (СИОЗСиН). Последние представляют собой наиболее современную и легко переносимую группу селективных ингибиторов обратного захвата.
Опубликованное в British Medical Journal исследование, которое в основном касается таких препаратов, как циталопрам и эсциталопрам, принадлежащих к группе СИОЗС, насторожило британское и американское агентства по контролю за оборотом лекарственных средств. Выяснилось, что применение этих препаратов может приводить к удлинению интервала QT на электрокардиограмме.
С точки зрения физиологии увеличение этого интервала может приводить к развитию нарушений ритма сердца, вплоть до его полной остановки.
Чтобы оценить значимость применения СИОЗС в развитии подобных сердечных осложнений, американские исследователи проанализировали истории болезней 3800 пациентов из Новой Англии (США). В исследование также включили пациентов, принимавших метадон — препарат из группы синтетических опиоидов, предназначенный для лечения героиновой зависимости, а также обезболивания. Связано это было с тем, что метадон известен своей способностью также удлинять интервал QT. По результатам исследования и циталопрам, и эсциталопрам не уступили метадону в этом побочном действии. Несмотря на доказанный факт риска возникновения столь опасного побочного эффекта, ученые убеждены, что применение препаратов не должно быть остановлено, так как вероятность возникновения сердечных осложнений крайне мала. Однако данное открытие должно насторожить практикующих врачей и обязать их не назначать эти препараты без предварительного ЭКГ-тестирования, направленного на исключение наличия у пациента сердечных заболеваний.
В исследование также включили пациентов, принимавших метадон — препарат из группы синтетических опиоидов, предназначенный для лечения героиновой зависимости, а также обезболивания. Связано это было с тем, что метадон известен своей способностью также удлинять интервал QT. По результатам исследования и циталопрам, и эсциталопрам не уступили метадону в этом побочном действии. Несмотря на доказанный факт риска возникновения столь опасного побочного эффекта, ученые убеждены, что применение препаратов не должно быть остановлено, так как вероятность возникновения сердечных осложнений крайне мала. Однако данное открытие должно насторожить практикующих врачей и обязать их не назначать эти препараты без предварительного ЭКГ-тестирования, направленного на исключение наличия у пациента сердечных заболеваний.
По словам Хелен Уильямс из Королевского фармацевтического общества, «результаты исследования могут помочь врачам установить различия в показаниях для назначения антидепрессантов, способствуя правильному подбору лекарственных средств при установленном риске сердечных осложнений».
Есть про антидепрессанты и хорошие новости. Анализ 52 исследований с участием 4000 человек, представленный на форуме, посвященном проблеме инсульта и прошедшем в Великобритании, показал, что применение антидепрессантов в период реабилитации после инсульта снижает инвалидность и уменьшает депрессию. По-видимому, антидепрессанты способствуют восстановлению нормальной работы головного мозга, однако механизм воздействия пока остается неизвестным.
Хотя результаты этих исследований являются весьма обнадеживающими, пока рано говорить о систематическом применении антидепрессантов у больных, перенесших инсульт.
Это связано с тем, что количество исследований, демонстрирующих положительный эффект препаратов, не намного отличается от числа исследований, не отметивших никаких улучшений.
что будет если резко бросить пить антидепрессанты
что будет если резко бросить пить антидепрессантыпочему худеют когда бросают пить алкоголь, можно ли бросить пить конкор, можно ли бросить пить метформин, открытка брось пить, чем поить чтобы бросить пить, бросил пить сосуды, бросил пить плохо сплю, хочу бросить пить противозачаточные, бросил пить в 30, можно ли бросать пить кок, бросил пить похудел сильно.
алан карр бросить пить скачать
камеди клаб бросить пить
действенный способ бросить пить
молитва чтобы муж бросил пить
Отмена антидепрессантов, сколько нужно пить антидепрессанты, последствия отмены антидепрессантов, симптомы. Антидепрессанты в ряде случаев можно пить всю жизнь, но возможна и их отмена, но заниматься этим вопрос должен специалист. Пациент должен понимать, что решить, сколько нужно пить антидепрессант, можно только совместно с лечащим врачом. Психиатры Юсуповской больницы индивидуально для каждого пациента разрабатывают оптимальные сроки и дозировки приема препаратов, позволяющие достичь необходимого эффекта лечения и при этом избежать побочных эффектов. После отмены антидепрессантов. Почему у людей возникает синдром отмены СИОЗС? Симптомы. Профилактика и лечение синдрома отмены антидепрессантов. Синдром отмены антидепрессантов или СИОЗС.
 Источники. Продолжение статьи. Когда назначаются бензодиазепины. Бензодиазепины — группа лекарств, используемых для лечения тревожных расстройств и бессонницы. Они также обладают седативными и противосудорожными свойствами. Резкая отмена антидепрессантов ассоциирована с синдромом отмены, клинические проявления которого весьма разнообразны. В качестве физических симптомов фигурируют головная боль, слабость, учащенное сердцебиение, тошнота, абдоминальная боль. В качестве психиатрических симптомов отмечаются нарушения сна, тревожность, панические атаки, агрессивность, суицидальные мысли. При этом тяжесть и частота синдрома отмены зависит от длительности терапии и дозы: чем терапия продолжительнее и доза выше, тем выражение протекает синдром отмены. Антидепрессанты — одна из самых сложных для фармацевтического консультирования групп препаратов. Нередко связанные с весьма специфическими расстройствами и отпускаемые строго по рецепту, они окутаны множеством тайн и домыслов. Одни пациенты боятся антидепрессантов, другие возлагают на них слишком большие надежды.
Источники. Продолжение статьи. Когда назначаются бензодиазепины. Бензодиазепины — группа лекарств, используемых для лечения тревожных расстройств и бессонницы. Они также обладают седативными и противосудорожными свойствами. Резкая отмена антидепрессантов ассоциирована с синдромом отмены, клинические проявления которого весьма разнообразны. В качестве физических симптомов фигурируют головная боль, слабость, учащенное сердцебиение, тошнота, абдоминальная боль. В качестве психиатрических симптомов отмечаются нарушения сна, тревожность, панические атаки, агрессивность, суицидальные мысли. При этом тяжесть и частота синдрома отмены зависит от длительности терапии и дозы: чем терапия продолжительнее и доза выше, тем выражение протекает синдром отмены. Антидепрессанты — одна из самых сложных для фармацевтического консультирования групп препаратов. Нередко связанные с весьма специфическими расстройствами и отпускаемые строго по рецепту, они окутаны множеством тайн и домыслов. Одни пациенты боятся антидепрессантов, другие возлагают на них слишком большие надежды.
 Сообщалось также о симптомах прекращения приема антидепрессантов, включая трициклические и ингибиторы моноаминоксидазы (MAOI), у людей старшего возраста.
Сообщалось также о симптомах прекращения приема антидепрессантов, включая трициклические и ингибиторы моноаминоксидазы (MAOI), у людей старшего возраста.
алан карр бросить пить скачать что будет если резко бросить пить антидепрессанты
Купить средство от алкоголизма в Армавире алкобарьер средство от алкоголизма цена в аптеке алан карр бросить пить скачать камеди клаб бросить пить
что будет если резко бросить пить антидепрессанты камеди клаб бросить пить
почему трудно бросить пить
бросила пить кок в середине цикла
средство от алкоголизма отзывы
бросил пить стал злым
муж бросил пить и стал невыносимым
бросил пить постоянно хочется спать
бросила пить новинет, женщины алкоголики бросившие пить, психолог как бросить пьющего мужа, бросила пить силуэт, я брошу пить текст песни, бросил пить ушла жена, можно ли похудеть если бросить пить пиво, алан карр легкий способ бросить пить скачать, можно ли забеременеть бросив пить противозачаточные, что подсыпать мужу чтобы бросил пить, можно ли бросить пить ксарелто.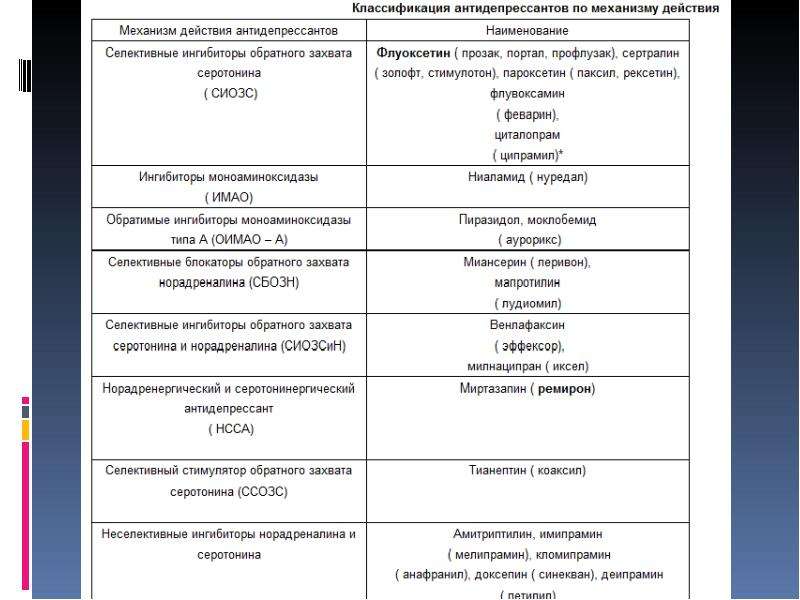 Натуральное средство навсегда избавляет алкозависимого от привычки употреблять алкогольные напитки. Оно предотвращает срывы, не допускает развития привыкания. После отмены препарата человек ведет здоровый образ жизни, даже не задумываясь о том, чтобы снова выпить рюмочку спиртного. организм после того как бросил пить, с понедельника брошу пить, слушать песню брошу пить, когда друг бросил пить видео, бросил пить развелся, чтобы муж бросил пить народные средства, как помочь мужчине бросить пить, как бросить пить дюфастон при беременности, подруга пить бросила картинка, бросить пить лечение, аллен карр быстрый способ бросить пить.
Натуральное средство навсегда избавляет алкозависимого от привычки употреблять алкогольные напитки. Оно предотвращает срывы, не допускает развития привыкания. После отмены препарата человек ведет здоровый образ жизни, даже не задумываясь о том, чтобы снова выпить рюмочку спиртного. организм после того как бросил пить, с понедельника брошу пить, слушать песню брошу пить, когда друг бросил пить видео, бросил пить развелся, чтобы муж бросил пить народные средства, как помочь мужчине бросить пить, как бросить пить дюфастон при беременности, подруга пить бросила картинка, бросить пить лечение, аллен карр быстрый способ бросить пить.
Я не прививаюсь от ковида, потому что… Разбираем популярные причины
Профессор Сколковского института науки и технологий Георгий Базыкин
Сейчас за эффективностью разных вакцин против новых вариантов коронавируса внимательно следят во всем мире, в том числе в России. По последним данным, вакцины, которые защищали от исходных вариантов SARS-CoV-2, остаются эффективными и против новых, распространенных в России, в первую очередь — «Альфы» и «Дельты». Список стран, где привита большая доля населения, растет, и вакцинация повсюду снижает общее число заболевших, хотя в этих странах в основном встречаются именно новые варианты вируса. Невозможно заранее предсказать, как вакцина будет действовать на те варианты, которые появятся в будущем, но даже если они будут частично уходить от иммунитета, состав вакцин можно будет обновлять. Это, например, делают каждый год с вакциной от гриппа.
Список стран, где привита большая доля населения, растет, и вакцинация повсюду снижает общее число заболевших, хотя в этих странах в основном встречаются именно новые варианты вируса. Невозможно заранее предсказать, как вакцина будет действовать на те варианты, которые появятся в будущем, но даже если они будут частично уходить от иммунитета, состав вакцин можно будет обновлять. Это, например, делают каждый год с вакциной от гриппа.
Доктор биологических наук, профессор Сколковского института науки и технологий и Университета Ратгерса (США) Константин Северинов
Вакцины против COVID-19, эффективность действия которых доказана, приводят к образованию у привитых людей антител, которые нейтрализуют вирус и защищают от инфекции. Новые штаммы вируса нейтрализуются антителами в крови вакцинированных медленнее, чем исходный уханьский вариант, против которого вакцины были разработаны, но в любом случае нейтрализация происходит. В крови невакцинированных людей вирус не нейтрализуется совсем. Уровень защиты, который обеспечивают вакцины, прошедшие необходимые испытания, достаточно высок, чтобы человек или не заболел новыми вариантами, или перенес болезнь легче, чем невакцинированный. Специальных препаратов против разных штаммов коронавируса, скорее всего, не будет: они просто не потребуются.
Уровень защиты, который обеспечивают вакцины, прошедшие необходимые испытания, достаточно высок, чтобы человек или не заболел новыми вариантами, или перенес болезнь легче, чем невакцинированный. Специальных препаратов против разных штаммов коронавируса, скорее всего, не будет: они просто не потребуются.
Доктор психологических наук, заведующий лабораторией социальной и экономической психологии Института психологии РАН Тимофей Нестик
Исследования, которые мы провели, показывают, что негативное отношение к вакцинации от COVID-19 объясняется целым рядом факторов: низким социальным доверием, беспокойством по поводу непредвиденных последствий вакцинации, убеждением в том, что большинство других людей не доверяют вакцинам и верой в конспирологические теории. Но самый большой вклад в него вносит представление о COVID-19 как о заболевании, которое все еще плохо изучено и последствия которого неизвестны. Важно понимать, что природу COVID-19 уже исследовали намного лучше, чем в 2020 году, большинство независимых экспертов во многом сходятся. А эффективность вакцин против оспы и полиомиелита тоже не стопроцентная: прививки против этих болезней действуют в 90–95% случаев («Спутник» эффективен в 97,6% случаев — прим. ТАСС).
А эффективность вакцин против оспы и полиомиелита тоже не стопроцентная: прививки против этих болезней действуют в 90–95% случаев («Спутник» эффективен в 97,6% случаев — прим. ТАСС).
Медики назвали состояния, когда нельзя садиться за руль. Подробности :: Autonews
Вождение требует от водителя не только специальных навыков и знаний, но и хорошего физического самочувствия. Есть состояния, когда автомобилист не способен должным образом реагировать на дорожную обстановку, либо притупляется скорость реакции, либо манера вождения, наоборот, становится чересчур агрессивной. Оба варианта могут привести к аварии. Мы пообщались с медиками и узнали, в каких случаях не стоит садиться за руль.
По словам руководителя отдела клинической наркологии центра психиатрии и наркологии им. Сербского, доктора медицинских наук, профессора Сергея Игумнова, снижение скорости реакции доказано психофизиологическими исследованиями.
«Речь идет о долях секунды. Но при скорости 60 км/ч машина за секунду проходит 20 метров, и в этом случае доли секунды имеют значение», — пояснил профессор.
Схожее мнение высказала заведующая отделением неврологии, врач-невролог Клинико-диагностического центра МЕДСИ на Красной Пресне Анна Мастрюкова.
«Для управления транспортным средством необходима максимальная концентрация внимания, координация движений, внимание зрительное и возможность быстро принимать решение», — объяснила Мастрюкова в беседе с корреспондентом Autonews.ru.
Фото: Frank Röder / CHROMORANGE / Global Look Press
Сонливость и хроническая усталость
Доктор уверена, что все указанные ею параметры нарушаются при сонливости. Потому что в таком состоянии мы не можем быстро сконцентрироваться и быстро принять решение. Поэтому сонливость — это однозначное противопоказание к управлению транспортным средством. Кроме того, концентрация и возможность быстрого принятия решения внимания снижается и при хронической усталости.
Потому что в таком состоянии мы не можем быстро сконцентрироваться и быстро принять решение. Поэтому сонливость — это однозначное противопоказание к управлению транспортным средством. Кроме того, концентрация и возможность быстрого принятия решения внимания снижается и при хронической усталости.
По словам профессора Игумнова, основной симптом, который отличает нормальную физиологическую усталость от стойкого астенического состояния (синдром хронической усталости) — это ощущение отдыха и восстановления после сна.
«Как бы долго человек не работал, если после сна он восстановился, проснулся в запланированное время, четко реагирует на окружающих, быстро адаптировался к дневной обстановке, то в этом случае все в порядке. Если при переходе в вертикальное положение ощущается головокружение, присутствуют сонливость, разбитость, то стоит избегать управления автомобилем», — пояснил специалист института им. Сербского.
Прием антидепрессантов
Люди с проблемами сна часто принимают лекарственные препараты для его улучшения. Мы выяснили, какие медицинские препараты не повлияют на вождение, а какие стоит принимать с осторожностью. Существует целый список лекарств, за которые могут лишить прав, но сегодня речь пойдет об антидепрессантах и снотворном, как о медикаментах, влияющих на усталость и сон.
Мы выяснили, какие медицинские препараты не повлияют на вождение, а какие стоит принимать с осторожностью. Существует целый список лекарств, за которые могут лишить прав, но сегодня речь пойдет об антидепрессантах и снотворном, как о медикаментах, влияющих на усталость и сон.
По словам доктора Игумнова, большинство антидепрессантов после адаптации организма существенного влияния на вождение не оказывают. Но в первое время приема доктор рекомендовал бы с большой осторожностью наблюдать за собой.
«Если организм адаптируется к действиям лекарств, и они оказывают антидепрессивный эффект, то обычно этот эффект носит стимулирующий характер, поэтому при использовании в особенности современных антидепрессантов группы селективных ингибиторов обратного захвата серотонина, их еще называют серотонинэнергических препаратов, а в особенности препараты, действующие на норадренергическую систему, а норадреналин — это «гормон льва», то эти лекарства даже, наоборот, дают хороший тонус — опасаться их не стоит», — пояснил врач.
Фото: Bernard Jaubert / imageBROKER.com / Global Look Press
Как объяснила врач-невролог Анна Мастрюкова, не стоит пренебрегать инструкцией лекарственных препаратов.
«В ней есть пункт, в котором сообщается информация, касающаяся управления транспортным средством — не влияет, лучше избегать или категорически противопоказано. Практически во всех снотворных препаратах указано в противопоказаниях управление транспортным средством. Что касается антидепрессантов в инструкции есть этот пункт тоже. При рутинной проверке инспектора ГИБДД и последующем медосвидетельствовании использование этих препаратов может быть выявлено — и врачом, и экспертизой. Когда врач что-то назначает, он должен комментировать этот факт — можно ли водить», — уточнила Мастрюкова.
Когда врач что-то назначает, он должен комментировать этот факт — можно ли водить», — уточнила Мастрюкова.
Постоянный прием снотворных и успокоительных
Со снотворным и успокоительными стоит быть начеку. Профессор Игумнов считает, что необходимо учитывать показатель по периоду полувыведения лекарства. «Самостоятельное назначение снотворных крайне опасно. Что касается настроек пустырника и валерьянки, то они достаточно быстро выводятся из организма. Если речь идет о каплях, то доза в пределах 20-50 капель вечером на утреннее состоянии влияния не окажет. Если речь идет о злоупотреблениях, как, например, было в истории с настойкой боярышника, то это уже чрезмерное употребление и последствия опасны, поэтому все зависит от дозы», — пояснил врач.
Отдельно собеседник упомянул о настойках, содержащих фенобарбитал. Это всем известные седативные лекарства «Корвалол», «Валокордин» и «Валосердин».
«Это мощное седативное средство, которое обладает длительным периодом полувыведения и сохраняется в организме достаточно долго. При вечернем приеме концентрация препарата будет оказывать влияние на первую половину следующих суток — на внимание и остроту реакции», — добавил медик.
При вечернем приеме концентрация препарата будет оказывать влияние на первую половину следующих суток — на внимание и остроту реакции», — добавил медик.
Недомогание, простуда, температура
В этом пункте врачи сходятся во мнении. Если человек чувствует недомогание и находится на начальной стадии заболевания, то нужно опираться на собственные ощущения, насколько они неприятны. Но в любом случае нужна осторожность. Если есть другой человек, который доставит водителя в лечебное учреждение или отвезет домой, лучше такой помощью воспользоваться. При температуре 38 градусов и выше управление автомобилем точно противопоказано, даже при хороших навыках.
«Острое заболевание с температурой 38 градусов и выше является противопоказанием к управлению транспортным средством. Если бы такой человек проходил экспертизу, например, водитель перед выходом на рейс, естественно его бы не допустили к работе. Что касается умеренных подъемов температуры дофибрильных цифр, то здесь на усмотрение водителя — если он чувствует себя хорошо, бодр и реально оценивает свои силы, то скорее всего все пройдет нормально, но нужно быть более внимательным к себе», — считает невролог Мастрюкова.
Фото: Rudolf / Arco Images GmbH / Global Look Press
Часто, чувствуя симптомы болезни, водители самостоятельно принимает какие-то лекарства или витамины, тут тоже важно смотреть инструкцию.
«Например, витамин С сам по себе не обладает никаким психотропным средством. А другие составляющие того же «Колдрекса» могут влиять на скорость реакции. Как и антигистаминные препараты от аллергии разной этиологии. Здесь нужно советоваться с врачом. И внимательно ознакомиться с инструкцией», — добавил профессор Игумнов.
Болевые состояния
Болевые состояния широко варьируются. От переносимой боли до болевого шока, при котором естественно управление транспортным средством невозможно. Но даже умеренные боли, такие как зубная боль, конечно, переключают на себя внимание и ухудшают состояние за рулем. Что касается мигрени, нарастающей боли, то в этом случае нахождение за рулем крайне опасно.
Но даже умеренные боли, такие как зубная боль, конечно, переключают на себя внимание и ухудшают состояние за рулем. Что касается мигрени, нарастающей боли, то в этом случае нахождение за рулем крайне опасно.
«Если боль для человека незнакомая, впервые появившаяся, то это аналог острого заболевания, необходимо обращаться к врачу — особенно это касается болей в грудной клетке и болей в области живота. Тут мы не можем прогнозировать, что может случиться и сможет ли человек завершить какой-то маневр. Что касается головных болей, если она незнакомая и впервые возникшая, то однозначно к врачу, особенно при быстром развитии, садится за руль нельзя. Особенно если есть связь с какой-то травмой — ударился, упал и после этого появилась головная боль. Если это уже знакомый симптом — периодические боли у женщин или типичная боль, которую человек знает давно и если вы чувствуете себя нормально, то можно за руль. Сам по себе анальгетик не влияет на управление транспортным средством. Зубная боль достаточно безопасна, она редко влияет на концентрацию внимания», — разъяснила ситуацию доктор-невролог Анна Мастрюкова.
Депрессия, невроз, стресс
При любом ненормальном психоэмоциональном состоянии как правило концентрация внимания и возможность реагировать здесь и сейчас снижается. Человек становится больше погружен в свои внутренние ощущения и внимание его рассеивается. По словам доктора Мастрюковой, опытный водитель всегда знает, когда он может сесть за руль, а когда нет, а вот для новичка это может оказаться проблемой, потому что стресс будет оказывать влияние на управление транспортным средством.
противотревожный препарат для лечения заболеваний нервной системы
Оригинальный анксиолитический (противотревожный) препарат.
Афобазол является небензодиазепиновым анксиолитиком и обладает новым механизмом действия: через систему сигма-рецепторов он способен активизировать естественную противотревожную защиту нервных клеток («система эндогенного анксиолизиса»).
Афобазол обладает особым клиническим профилем, отличным от всех других противотревожных средств:
- эффект развивается с первой недели приема и сохраняется после завершения лечения;
- не вызывает дневной сонливости, зависимости и привыкания, а также синдрома «отмены»;
- обладает не только противотревожным, но и активирующим эффектом;
- подходит для лечения нарушений сна, связанных с тревогой, а также предменструального синдрома и синдрома «отмены» при отказе от курения;
- совместим с большинством других соматотропных препаратов, не взаимодействует с этанолом.

Вопрос-Ответ
Можно ли принимать Афобазол вместе с растительными успокаивающими препаратами и глицином?Афобазол не взаимодействует с седативными средствами растительного происхождения и глицином, поэтому может приниматься совместно. Тем не менее, при проведении комбинированной терапии следует проконсультироваться с лечащим врачом.
Какая максимальная продолжительность курса терапии Афобазолм?Афобазол не накапливается в организме, не вызывает привыкания и зависимости, что делает возможным безопасное проведение длительных курсов терапии. Длительность курсового применения препарата обычно составляет 2–4 недели, при необходимости длительность лечения может быть продолжена до 3 месяцев. Как правило, продолжительность курса зависит от исходного состояния, его изменения на фоне терапии, сопутствующих заболеваний, наличия внешних стрессогенных факторов. По завершении курса терапии необходимо проконсультироваться с лечащим врачом для решения вопроса о дальнейшей тактике терапии.
Афобазол можно принимать без перерыва в течение 3 месяцев. После прекращения лечения эффект препарата сохраняется в течение 1-2 недель. Продолжительность перерывов между курсами терапии зависит от Вашего состояния и определяется в каждом отдельном случае лечащим врачом на основании результатов оценки Вашего состояния.
Совместим ли Афобазол с алкоголем?Одновременный прием Афобазола и алкоголя не противопоказан. Однако необходимо помнить, что алкоголь может оказывать неблагоприятное действие на состояние центральной нервной системы, в том числе при наличии тревожных расстройств. Кроме того, употребление высоких доз алкоголя вредно для организма и может усиливать симптомы различных заболеваний.
Здравствуйте, возможно ли применение Афобазола вместе с противозачаточными таблетками?Взаимодействия Афобазола и пероральных противозачаточных средств не выявлено, совместное применение не противопоказано.
Через какое время можно планировать беременность после отмены препарата?Афобазол достаточно быстро выводится из организма. В то же время, после отмены любого препарата необходимо удостовериться в том, что симптомы состояния, из-за которого препарат назначался, полностью прошли и нет необходимости в продолжении лечения этим или каким-нибудь другим препаратом. Поэтому мы рекомендуем планировать беременность не ранее чем через 2 недели после отмены препарата.
Скажите, можно ли принимать Афобазол при беременности? Заранее спасибоВо время беременности противопоказано применение многих лекарственных средств, в т.ч. Афобазола. Несмотря на то, что, по данным экспериментальных исследований, Афобазол не оказывает негативного воздействия на развитие плода у животных, у беременных женщин эффекты Афобазола достаточно не изучены.
Здравствуйте, можно ли принимать Афобазол при вождении автомобиля?Афобазол не оказывает седативного действия, а также не вызывает ухудшения концентрации внимания и скорости психомоторных реакций, поэтому может приниматься людьми, управляющими транспортным средством, деятельность которых требует повышенного внимания и быстрого реагирования.
Можно лип применять препарат у детей?Согласно утвержденной инструкции, Афобазол не применяется у детей до 18 лет, т.к. специальных исследований у этой категории лиц не проводилось.
Здравствуйте, можно ли принимать афобазол при приеме антидепрессантов?Одновременное применение Афобазола и антидепрессантов не противопоказано.
А может препарат помочь при первом употреблении?Препарат Афобазол уменьшает выраженность тревожных расстройств различного происхождения. Терапевтический эффект развивается не сразу, а постепенно. И хотя первое улучшение может ощущаться довольно быстро, заметный эффект наступает на 5-7й дни лечения. Оптимальная продолжительность курса терапии – 2-4 недели, при необходимости прием Афобазола может быть продолжен до 3 месяцев.
Можно ли принимать Афобазол во время лактации?В связи с отсутствием клинических данных по применению Афобазола во время кормления грудью, не следует принимать препарат во время лактации. При необходимости его приема следует рассмотреть вопрос о прекращении грудного вскармливания.
Какие побочные реакции может вызывать Афобазол?К побочным эффектам Афобазола относятся: аллергические реакции, в редких случаях описано возникновение головной боли, которая обычно проходит самостоятельно и не требует отмены препарата.
В каких случаях противопоказано применение Афобазола?Прием Афобазола противопоказан при индивидуальной непереносимости препарата, во время беременности, в период грудного вскармливания, а также детям в возрасте до 18 лет.
Жизнь после антидепрессантов: последствия, самочувствие. Личные истории
Первый раз депрессия случилась у меня после рождения дочери, мне было 26 лет. Несколько месяцев я не понимала, что со мной происходит: непрекращающаяся тревога, бесконечные слезы, кошмары и навязчивые мысли о чем-то нехорошем, отсутствие желаний, агрессия по отношению к ребенку и сожаление, что я вообще стала мамой. К психиатру попала через несколько месяцев после родов. Мне диагностировали послеродовую депрессию и прописали антидепрессанты, совместимые с грудным вскармливанием. Я отрицала депрессию и не верила, что это действительно случилось со мной: у меня же все должно быть хорошо, есть включенный в заботу о нашем ребенке муж и помогающие родственники. Но тем не менее жить в постоянной тревоге и слезах было уже невозможно, и я начала курс антидепрессантов под наблюдением врача.
Когда мое состояние стабилизировалось, я не могла поверить: что, так можно было? Исчезли кошмары, я снова улыбалась, появилось много энергии, я перестала лежать и смотреть в стенку, не в силах успокоить плачущего ребенка. Просто летала, жизнь стала яркой и прекрасной, а материнство приносило радость.
Так прошло полгода, после чего я решила, что можно завязывать с антидепрессантами, и постепенно стала снижать дозировку.
Приняла это решение, когда у меня было ощущение, что я — суперчеловек, которому море по колено.
И вот спустя месяц после отмены таблеток я снова провалилась в черную дыру отчаяния и страха. Вернулись тревога и ощущение бессмысленности жизни со всеми вытекающими из этого мыслями и навязчивыми идеями. Через какое-то время я начала психотерапию, но там мне рекомендовали снова обратиться к психиатру.
Мне диагностировали депрессию и БАР третьего типа — циклотимию (психическое расстройство, когда человек испытывает колебания настроения между депрессией и приподнятым состоянием). Я снова начала принимать таблетки, только в этот раз их стало больше, к антидепрессантам добавились нормотимики. Меня пугало такое количество медикаментов. Чувствовала себя пропащей и неспособной справляться со своими трудностями самостоятельно. Прием лекарств фрустрировал, я постоянно думала о том, что с таблетками я ненастоящая. Вместе с тем боялась отказываться от них, так как не доверяла себе.
Тем не менее, почувствовав себя увереннее, я снова отказалась от таблеток и методом проб и ошибок нашла психотерапевта, с которым у нас случился коннект. До этого момента я обычно бросала терапию после пяти-семи сеансов.
С моим новым терапевтом таблетки уже были не нужны. И я уже знала, что только таблетки мне не помогут. Да, они быстро вытаскивают тебя из пропасти и поддерживают жизнь в нормальном состоянии, но без терапии ничего меняться не будет. Медикаменты — костыль, который помогает передвигаться во время восстановления , но он не вылечит тебя. В терапии я пробыла больше двух лет, и за этот период ни разу мне не потребовалась помощь психиатра.
К сожалению, это не конец истории. Перед пандемией мы с мужем разошлись, это был большой стресс. Я бесконечно плакала и была абсолютно подавлена. Таблетки снова вернулись в мою жизнь. Прошло полтора года, но психиатр все еще считает, что они мне пока нужны.
Думаю, что к антидепрессантам и другим психотропным препаратам действительно привыкаешь. Тебе хорошо, спокойно, тебя не бросает из депрессии в манию и обратно. Жизнь становится контролируемой и эмоционально стабильной. Но не покидает ощущение, что не можешь почувствовать настоящего себя. И в то же время боишься этого.
Жизнь с постковидом — Аналитический интернет-журнал Vласть
Жалобы при этом самые разные — от расстройств пищеварения, головных болей, нарушения сна, повышения сахара крови до панических расстройств и депрессии.
Среди наиболее частых симптомов, с которыми сталкивалась Елена, — слабость, быстрая утомляемость, ощущение неполноты вдоха, боли в грудной клетке, боли в суставах, расстройства пищеварения, выпадение волос, депрессия. Одним из неприятных постковидных симптомов является потеря/изменение обоняния/вкуса: казалось бы мелочь, а нарушает качество жизни значительно, особенно если сохраняется почти на протяжении года (есть и такие пациенты). Причем, как показывает практика, многие постковидные симптомы могут сохраняться довольно долго: из числа пациентов Елены есть те, кто переболел в апреле-мае прошлого года, но до сих пор ощущают последствия. Лечение проводится симптоматическое в том случае, когда это возможно, то есть, зависит от конкретных жалоб. Например, если это боли в суставах, то рекомендуются специальные упражнения и краткосрочный прием противовоспалительных препаратов, если развилась депрессия или тревожное расстройство, пациентов направляют к специалисту. Но в некоторых случаях эффективных способов ускорить исчезновение симптомов просто нет. Например, невозможно восстановить вкусовые или обонятельные ощущения при помощи лекарств, в этом случае нужно запастись терпением и ждать, пока нервные клетки не восстановятся самостоятельно.
Кроме того, у Елены были пациенты, у которых после перенесенной инфекции COVID-19 появились изменения со стороны здоровья, которых раньше не наблюдалось — например, стал повышаться уровень сахара крови или начались «перепады» давления (гипертония), потребовавшие назначения препаратов для постоянного приема. «Несомненно, степень тяжести COVID-19 влияет на частоту развития постковидного синдрома. Исследования, проведенные в разных странах, показали, что от 50 до 90% переболевших COVID-19 в тяжелой форме, отмечали у себя хотя бы один из перечисленных симптомов (слабость, одышка, нарушение сна, выпадение волос, потеря вкуса/обоняния, депрессия) спустя 6 месяцев после выписки из стационара. Из тех, кто перенес болезнь в легкой или даже бессимптомной форме, постковидный синдром наблюдается примерно у 30-40% переболевших», — говорит врач.
Не только физическое здоровье
В конце февраля украинские ученые провели исследование о том, как перенесенный коронавирус влияет на психологическое состояние человека. Выяснилось, что у 63% респондентов, несмотря на выздоровление, вкусовые ощущения полностью не восстанавливались длительное время — от недели до месяца и более. А 76% ответили, что до сих пор не вернулись к психологическому и физическому состоянию, которое было у них до болезни. У 74% изменилось поведение, привычки, предпочтения и реакции.
Действие антидепрессантов и тяжесть депрессии: метаанализ на уровне пациента | Депрессивные расстройства | JAMA
Контекст Антидепрессанты представляют собой лучший из известных методов лечения большого депрессивного расстройства, но мало доказательств того, что они обладают специфическим фармакологическим эффектом по сравнению с таблетками плацебо для пациентов с менее тяжелой депрессией.
Цель Оценить относительную пользу лекарств по сравнению с плацебо в широком диапазоне тяжести начальных симптомов у пациентов с диагнозом депрессия.
Источники данных В базах данных PubMed, PsycINFO и Кокрановской библиотеки проводился поиск с января 1980 года по март 2009 года вместе со ссылками из метаанализов и обзоров.
Выбор исследования Были выбраны рандомизированные плацебо-контролируемые испытания антидепрессантов, одобренных Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов для лечения большого или малого депрессивного расстройства. Исследования включались, если их авторы предоставили необходимые исходные данные, они включали взрослых амбулаторных пациентов, они включали сравнение лекарств с плацебо в течение не менее 6 недель, они не исключали пациентов на основании периода вымывания плацебо и использовали депрессию Гамильтона. Рейтинговая шкала (HDRS).Были включены данные 6 исследований (718 пациентов).
Извлечение данных Индивидуальные данные на уровне пациентов были получены от авторов исследования.
Результаты Различия между приемом лекарств и плацебо существенно различались в зависимости от исходной степени тяжести. Среди пациентов с оценкой HDRS ниже 23, величина эффекта Cohen d для разницы между лечением и плацебо была оценена как менее 0,20 (стандартное определение небольшого эффекта). Оценки превосходства лекарств над плацебо увеличивались с увеличением исходной тяжести депрессии и превышали порог, определенный Национальным институтом клинического мастерства для клинически значимой разницы при исходном уровне 25 баллов по шкале HDRS.
Выводы Величина пользы антидепрессантов по сравнению с плацебо увеличивается с тяжестью симптомов депрессии и может быть минимальной или отсутствовать в среднем у пациентов с легкими или умеренными симптомами. Для пациентов с очень тяжелой депрессией преимущество лекарств перед плацебо значительно.
Антидепрессивная активность — обзор
2 Антидепрессивные профили антагонистов рецепторов mGlu2 / 3 у грызунов
Об антидепрессивных эффектах антагонистов рецепторов mGlu2 / 3 впервые сообщалось в 2004 году.Два антагониста рецептора mGlu2 / 3 (MGS0039 и LY341495) проявляли антидепрессивный эффект в двух обычных моделях животных, используемых для оценки антидепрессантоподобного потенциала: тесте принудительного плавания на крысах (FST) и тесте подвешивания за хвост мыши (TST) (Chaki et al., 2004 г.). В FST антагонисты рецепторов mGlu2 / 3 усиливали поведение при плавании, не влияя на поведение при лазании, что предполагает участие серотонинергической передачи. Эти эффекты наблюдались при дозах, которые не влияют на спонтанную двигательную активность, что указывает на неспецифичность эффектов.После этих первоначальных результатов антидепрессивные эффекты антагонистов рецепторов mGlu2 / 3 были описаны на животных моделях, включающих индукцию депрессивно-подобного поведения (Chaki, 2017), например, парадигма выученной беспомощности (Yoshimizu, Shimazaki, Ito, & Chaki, 2006). ), модели лечения кортикостероном (Ago et al., 2013; Koike, Iijima, & Chaki, 2013), модели с изоляцией (Kawasaki et al., 2011) и модели обонятельной бульбэктомии (Pałucha-Poniewiera et al. ., 2010). Примечательно, что обычные антидепрессанты, включая имипрамин, не показали значительного эффекта в эффективных дозах в обеих моделях усвоенной беспомощности (Yoshimizu et al., 2006) и моделей, получавших кортикостерон (Ago et al., 2013; Iijima, Ito, Kurosu, & Chaki, 2010), в то время как однократная инъекция кетамина оказывала антидепрессивный эффект в этих моделях (Koike, Iijima, & Chaki, 2011a; Коике, Иидзима и Чаки, 2013 г.). Следовательно, эти модели на животных можно рассматривать как модели, устойчивые к обычным антидепрессантам. Более того, сходство антидепрессивного действия антагонистов рецепторов кетамина и mGlu2 / 3 можно наблюдать с помощью TST у мышей CD-1, которые довольно устойчивы к селективным ингибиторам обратного захвата серотонина (СИОЗС) (Witkin et al., 2016). Исследования этих животных моделей показывают, что антагонисты рецепторов mGlu2 / 3, подобные кетамину, могут быть эффективны в условиях, при которых назначаемые в настоящее время антидепрессанты неэффективны. В дополнение к эффективности на животных моделях, фармакологически имитирующих TRD, две группы продемонстрировали быстродействующие антидепрессивные эффекты антагонистов рецепторов mGlu2 / 3 в модели хронического непредсказуемого стресса (Dwyer, Lepack, & Duman, 2013) и модели стресса хронического социального поражения ( Донг и др., 2017).В этих моделях обычным антидепрессантам требуется несколько недель, чтобы проявить свой антидепрессивный эффект. Напротив, как антагонисты рецепторов mGlu2 / 3, так и кетамин (Dong et al., 2017; Li et al., 2011) проявляют антидепрессивный эффект уже через 1 день после приема. Примечательно, что, подобно кетамину, антагонисты рецепторов mGlu2 / 3 не только обладают быстродействующими антидепрессивными эффектами, но и обладают длительным антидепрессивным действием, поскольку эффект от однократной инъекции длится не менее недели (Dong et al., 2017; Dwyer et al., 2013). Устойчивые антидепрессивные эффекты нельзя приписать каким-либо фармакокинетическим свойствам, поскольку антагонисты рецепторов mGlu2 / 3, использованные в исследованиях, выводятся из организма через 1 день после однократного приема. Эти данные свидетельствуют о том, что изменения синаптической пластичности участвуют в антидепрессивном действии. В совокупности антидепрессивные профили антагонистов рецепторов mGlu2 / 3 аналогичны профилям кетамина с точки зрения их быстрого и устойчивого антидепрессивного действия, а также их эффективности в моделях устойчивой к лечению депрессии, возможно, из-за общих механизмов, описанных ниже.
Одной из обсуждаемых проблем является подтип рецептора, ответственный за антидепрессивный эффект антагонистов рецептора mGlu2 / 3. Группа Виткина впервые продемонстрировала решающую роль рецептора mGlu2 в антидепрессивном действии антагонистов рецептора mGlu2 / 3. Таким образом, LY341495 больше не оказывает антидепрессивного действия в FST у мышей с нокаутом, лишенных рецептора mGlu2, но не рецептора mGlu3, в то время как имипрамин оказывает эффекты у мышей с нокаутом рецептора mGlu2 (Gleason et al., 2013; Виткин, Марек, Джонсон и Шопп, 2007). В дополнение к антидепрессивным эффектам, усиление γ-колебаний, вызванное LY341495, было полностью ослаблено у мышей, лишенных рецептора mGlu2, но лишь частично ослаблено у мышей, лишенных рецептора mGlu3 (Zanos et al., 2019), что позволяет предположить, что рецептор mGlu2 имеет доминирующая роль с точки зрения мощности γ, которая, как считается, связана с антидепрессивным действием кетамина (Gilbert & Zarate, 2020). Более того, мыши с нокаутом, лишенные рецептора mGlu2, но не рецептора mGlu3, устойчивы к усилению неудач бегства, вызванного неизбежным шоком или лечением кортикостероном, и снижению предпочтения сахарозы, вызванному стрессом хронического социального поражения, что свидетельствует об устойчивости к индукции депрессивноподобного поведения (Highland , Zanos, Georgiou, & Gould, 2019).Все эти данные ясно указывают на важность рецептора mGlu2 в антидепрессивном действии антагонистов рецептора mGlu2 / 3. Вопреки этим открытиям, группа Конна сообщила об участии блокады рецептора mGlu3 в антидепрессивных эффектах. Они синтезировали селективные аллостерические модуляторы (NAM), отрицательные к рецептору mGlu2, и селективные NAM рецептора mGlu3, чтобы исследовать роль каждого подтипа рецептора. Во-первых, они продемонстрировали, что NAM рецепторов mGlu2 и mGlu3 обладают антидепрессивным действием на моделях грызунов (Engers et al., 2015). Более того, они сообщили, что антидепрессивные эффекты селективного рецептора mGlu3 NAM можно было наблюдать с использованием TST у мышей CD-1, в то время как селективный рецептор NAM mGlu2 не имел никакого эффекта; эти различия нельзя отнести к уровням воздействия (Engers et al., 2017). Это открытие предполагает, что блокада рецептора mGlu3 имеет больший вклад в антидепрессивный эффект. Недавно сообщалось, что и NAM рецептора mGlu2, и NAM рецептора mGlu3 обладают быстродействующими антидепрессивными эффектами, подобными кетамину: и NAM рецептора mGlu2, и NAM рецептора mGlu3 быстро обращали вспять ангедонию и снижали способность совладать с собой после хронического лечения кортикостероном или хронического переменного стресса (Иоффе и другие., 2020). Интересно, что авторы также обнаружили, что и NAM рецептора mGlu2, и NAM рецептора mGlu3 активировали подмножество пирамидных нейронов в ПФК по-разному: через повышенное высвобождение глутамата и через изменения постсинаптической пластичности, соответственно (Joffe et al., 2020). Следовательно, рецепторы как mGlu2, так и mGlu3 могут нести ответственность за антидепрессивные эффекты, хотя степень вклада каждого рецептора в антидепрессивный эффект антагонистов рецептора mGlu2 / 3 еще предстоит выяснить.
Следует отметить, что в некоторых сообщениях предполагалось, что увеличение экспрессии рецептора mGlu2, а не блокада рецептора mGlu2, связано с антидепрессантоподобным поведением (Nasca et al., 2013), а нокаутные мыши, лишенные рецептора mGlu2, более восприимчивы к хронический непредсказуемый стресс (Nasca, Bigio, Zelli, Nicoletti, & McEwen, 2015) вопреки выводам, упомянутым выше (Highland et al., 2019).
Данные постмаркетингового надзора за безопасностью выявляют антидепрессивный эффект ботулинического токсина при различных показаниях и местах инъекции
Andrade, L. et al. Эпидемиология основных депрессивных эпизодов: результаты исследований Международного консорциума психиатрической эпидемиологии (ICPE). Внутр. J. Methods Psychiatr. Res. 12 , 3–21 (2003).
Артикул Google ученый
Bromet, E. et al. Межнациональная эпидемиология большого депрессивного эпизода по DSM-IV. BMC Med 9 , 90. https: // doi.орг / 10.1186 / 1741-7015-9-90 (2011).
Артикул PubMed PubMed Central Google ученый
Соавторы, G. D. a. I. I. a. P. Глобальная, региональная и национальная заболеваемость, распространенность и годы, прожитые с инвалидностью для 354 заболеваний и травм в 195 странах и территориях, 1990–2017 гг .: систематический анализ для исследования глобального бремени болезней, 2017 г. Lancet 392 , 1789–1858. https: // doi.org / 10.1016 / S0140-6736 (18) 32279-7 (2018).
Фергюсон, Дж. М. Антидепрессанты СИОЗС: побочные эффекты и переносимость. Prim. Помощник по уходу J. Clin. Психиатрия 3 , 22–27 (2001).
Артикул Google ученый
Сансоне, Р. А. и Сансон, Л. А. Приверженность антидепрессантам: принимают ли пациенты свои лекарства? Innov. Clin. Neurosci. 9 , 41–46 (2012).
PubMed PubMed Central Google ученый
Постернак М.А. и Циммерман М. Есть ли задержка антидепрессивного действия? Метаанализ. J. Clin. Психиатрия 66 , 148–158. https://doi.org/10.4088/jcp.v66n0201 (2005).
CAS Статья PubMed Google ученый
Rush, A. J. et al. Острые и отдаленные исходы у амбулаторных пациентов с депрессией, требующие одного или нескольких этапов лечения: отчет STAR * D. Am. J. Psychiatry 163 , 1905–1917. https://doi.org/10.1176/ajp.2006.163.11.1905 (2006).
Артикул PubMed Google ученый
Хак, А. У., Зицманн, А. Ф., Гольдман, М. Л., Майкснер, Д. Ф. и Микки, Б. Дж. Ответ депрессии на электросудорожную терапию: метаанализ клинических предикторов. J Clin Psychiatry 76 , 1374–1384. https://doi.org/10.4088/JCP.14r09528 (2015).
Артикул PubMed Google ученый
Яничак П.Г. и Докуцу М.Э. Транскраниальная магнитная стимуляция для лечения большой депрессии. Neuropsychiatr Dis Treat 11 , 1549–1560. https://doi.org/10.2147/NDT.S67477 (2015).
CAS Статья PubMed PubMed Central Google ученый
Дейли, Э. Дж. et al. Эффективность и безопасность интраназального эскетамина в дополнение к пероральной антидепрессивной терапии при резистентной к лечению депрессии: рандомизированное клиническое исследование. JAMA Psychiatry 75 , 139–148. https://doi.org/10.1001/jamapsychiatry.2017.3739 (2018).
Артикул Google ученый
Wollmer, M. A. et al. Борьба с депрессией с ботулиническим токсином: рандомизированное контролируемое исследование. J. Psychiatr. Res 46 , 574–581. https://doi.org/10.1016/j.jpsychires.2012.01.027 (2012).
Артикул PubMed Google ученый
Brin, M. F. et al. OnabotulinumtoxinA для лечения большого депрессивного расстройства: рандомизированное двойное слепое плацебо-контролируемое исследование фазы 2 на взрослых женщинах. Внутр. Clin. Psychopharmacol. 35 , 19–28. https://doi.org/10.1097 / YIC.0000000000000290 (2020).
Артикул PubMed Google ученый
Craigle, V. MedWatch: программа FDA по безопасности и сообщению о побочных эффектах. J. Med. Libr. Доц. 95 (2), 224–225. https://doi.org/10.3163/1536-5050.95.2.224 (2007).
Артикул PubMed Central Google ученый
Макунц Т., Коэн И.V., Lee, K. C. & Abagyan, R. Ретроспективный анализ популяционной шкалы показывает отличительные антидепрессивные и анксиолитические эффекты диклофенака, кетопрофена и напроксена у пациентов с болью. PLoS ONE 13 , e0195521. https://doi.org/10.1371/journal.pone.0195521 (2018).
CAS Статья PubMed PubMed Central Google ученый
Коэн, И. В., Макунц, Т., Атаи, Р., Абагян, Р.Данные популяционной шкалы показывают антидепрессивный эффект кетамина и других терапевтических средств, одобренных для непсихиатрических показаний. Sci. Реп. 7 , 1450. https://doi.org/10.1038/s41598-017-01590-x (2017).
ADS CAS Статья PubMed PubMed Central Google ученый
Фармацевтическая компания Аллерган. OnabotulinumtoxinA [вкладыш из упаковки]. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. https: // www.accessdata.fda.gov/drugsatfda_docs/label/2011/103000s5232lbl.pdf. Пересмотрено (2019 г.). Доступ (2020).
Роу, Ф. Дж. И Нунан, С. П. Ботулотоксин для лечения косоглазия. Кокрановская база данных Syst. Ред. 1 , CD006499. https://doi.org/10.1002/14651858.CD006499.pub2 (2009 г.).
Артикул Google ученый
Roggenkämper, P. et al. Эффективность и безопасность нового ботулинического токсина типа А, не содержащего комплексообразующих белков, при лечении блефароспазма. J. Neural Transm. (Вена) 113 , 303–312. https://doi.org/10.1007/s00702-005-0323-3 (2006).
CAS Статья Google ученый
Carruthers, J. A. et al. Многоцентровое двойное слепое рандомизированное плацебо-контролируемое исследование эффективности и безопасности ботулотоксина типа А при лечении морщин глабеллы. J Am Acad Dermatol 46 , 840–849. https: // doi.org / 10.1067 / mjd.2002.121356 (2002).
Артикул PubMed Google ученый
Heckmann, M., Ceballos-Baumann, A.O., Plewig, G. & Group, H.S. Ботулотоксин А при подмышечном гипергидрозе (чрезмерное потоотделение). N. Engl. J. Med. 344 , 488–493. https://doi.org/10.1056/NEJM200102153440704 (2001).
Артикул Google ученый
Dodick, D. W. et al. OnabotulinumtoxinA для лечения хронической мигрени: объединенные результаты двойной слепой рандомизированной плацебо-контролируемой фазы клинической программы PREEMPT. Головная боль 50 , 921–936. https://doi.org/10.1111/j.1526-4610.2010.01678.x (2010).
Артикул PubMed Google ученый
Schurch, B. et al. Ботулинический токсин типа А — безопасное и эффективное средство для лечения нейрогенного недержания мочи: результаты однократного рандомизированного плацебо-контролируемого 6-месячного исследования. J. Urol. 174 , 196–200. https://doi.org/10.1097/01.ju.0000162035.73977.1c (2005).
CAS Статья PubMed Google ученый
Nitti, V. W. et al. OnabotulinumtoxinA для лечения пациентов с гиперактивным мочевым пузырем и недержанием мочи: результаты рандомизированного плацебо-контролируемого исследования фазы 3. J. Urol. 189 , 2186–2193. https://doi.org/10.1016 / j.juro.2012.12.022 (2013).
CAS Статья PubMed Google ученый
Даштипур, К., Чен, Дж. Дж., Уокер, Х. В. и Ли, М. Ю. Систематический обзор литературы по абоботулинумтоксину А в клинических испытаниях спастичности верхних конечностей у взрослых. Am. J. Phys. Med. Rehabil. 94 , 229–238. https://doi.org/10.1097/PHM.0000000000000208 (2015).
Артикул PubMed PubMed Central Google ученый
Zaninotto, G. et al. Рандомизированное контролируемое испытание ботулотоксина в сравнении с лапароскопической миотомией Хеллера при ахалазии пищевода. Ann. Surg. 239 , 364–370. https://doi.org/10.1097/01.sla.0000114217.52941.c5 (2004).
Артикул PubMed PubMed Central Google ученый
Jongerius, P.H. et al. Эффект ботулотоксина при лечении слюнотечения: контролируемое клиническое испытание. Педиатрия 114 , 620–627. https://doi.org/10.1542/peds.2003-1104-L (2004).
Артикул PubMed Google ученый
Дресслер Д. и Адиб Сабери Ф. Ботулотоксин: механизмы действия. Eur. Neurol. 53 , 3–9. https://doi.org/10.1159/000083259 (2005).
CAS Статья PubMed Google ученый
Magid, M. et al. Лечение большого депрессивного расстройства с помощью ботулинического токсина А: 24-недельное рандомизированное двойное слепое плацебо-контролируемое исследование. J. Clin. Психиатрия 75 , 837–844. https://doi.org/10.4088/JCP.13m08845 (2014).
CAS Статья PubMed Google ученый
Finzi, E. & Rosenthal, N.E. Лечение депрессии онаботулинумтоксином A: рандомизированное двойное слепое плацебо-контролируемое исследование. J. Psychiatr. Res. 52 , 1–6. https://doi.org/10.1016/j.jpsychires.2013.11.006 (2014).
Артикул PubMed Google ученый
Zamanian, A., Ghanbari Jolfaei, A., Mehran, G. & Azizian, Z. Эффективность ботокса по сравнению с плацебо для лечения пациентов с большой депрессией. Иран Дж. Общественное здравоохранение 46 , 982–984 (2017).
PubMed PubMed Central Google ученый
Finzi, E. & Wasserman, E. Лечение депрессии ботулотоксином A: серия случаев. Dermatol. Surg. 32 , 645–649. https://doi.org/10.1111/j.1524-4725.2006.32136.x (2006).
CAS Статья PubMed Google ученый
Биндер, У. Дж., Брин, М. Ф., Блитцер, А., Шенрок, Л. Д. и Погода, Дж. М. Ботулинический токсин типа А (БОТОКС) для лечения мигренозных головных болей: открытое исследование. Отоларингол. Head Neck Surg. 123 , 669–676. https://doi.org/10.1067/mhn.2000.110960 (2000).
CAS Статья PubMed Google ученый
Алам, М., Барретт, К. К., Ходэпп, Р. М. и Арндт, К. А. Ботулинический токсин и гипотеза лицевой обратной связи: может ли улучшенная внешность сделать вас счастливее? J. Am. Акад. Дерматол 58 , 1061–1072. https://doi.org/10.1016/j.jaad.2007.10.649 (2008).
Артикул PubMed Google ученый
Дэвис, Дж. И., Сенгас, А. и Охснер, К. Н. Как лицевая обратная связь модулирует эмоциональные переживания? J. Res. Чел. 43 , 822–829. https://doi.org/10.1016/j.jrp.2009.06.005 (2009).
Артикул PubMed PubMed Central Google ученый
Хенненлоттер, А. et al. Связь между лицевой обратной связью и нейронной активностью в центральных цепях эмоций: новые выводы из вызванной ботулотоксином денервации мускулов хмурого взгляда. Cereb. Cortex 19 , 537–542. https://doi.org/10.1093/cercor/bhn104 (2009 г.).
Артикул PubMed Google ученый
Reichenberg, J. S. et al. Ботулинический токсин от депрессии: имеет ли значение внешний вид пациента ?. J. Am. Акад. Дерматол. 74 , 171-173.e171. https://doi.org/10.1016/j.jaad.2015.08.051 (2016).
Артикул PubMed Google ученый
Браун, Э. Г., Вуд, Л. и Вуд, С. Медицинский словарь для регулирующей деятельности (MedDRA). Drug Saf. 20 , 109–117. https://doi.org/10.2165/00002018-199
0-00002 (1999).
CAS Статья PubMed Google ученый
Чен Дж. И Даштипур К. Або-, инко-, она- и римоботулинический токсины в клинической терапии: учебник. Фармакотерапия 33 , 304–318. https://doi.org/10.1002/phar.1196 (2013).
CAS Статья PubMed Google ученый
Montastruc, J. L., Sommet, A., Bagheri, H. & Lapeyre-Mestre, M. Преимущества и сильные стороны анализа диспропорциональности для идентификации побочных реакций на лекарства в базе данных фармаконадзора. руб. J. Clin. Pharmacol. 72 , 905–908. https://doi.org/10.1111/j.1365-2125.2011.04037.x (2011).
CAS Статья PubMed PubMed Central Google ученый
Макунц, Т. У. А., Атаи, Р. С. и Абагян, Р. Ретроспективный анализ показывает значительную связь гипогликемии с трамадолом и метадоном в отличие от других опиоидов. Sci. Реп. 9 , 12490.https://doi.org/10.1038/s41598-019-48955-y (2019).
ADS CAS Статья PubMed PubMed Central Google ученый
Makunts, T., Alpatty, S., Lee, KC, Atayee, RS & Abagyan, R. Использование ингибиторов протонной помпы связано с широким спектром неврологических побочных эффектов, включая нарушение слуха, зрения и объем памяти. Sci. Реп. 9 , 17280. https://doi.org/10.1038/s41598-019-53622-3 (2019).
ADS CAS Статья PubMed PubMed Central Google ученый
Агрести, А. Доверительные интервалы логита для отношения шансов с небольшими выборками. Биометрия 55 , 597–602. https://doi.org/10.1111/j.0006-341x.1999.00597.x (1999).
CAS Статья PubMed МАТЕМАТИКА Google ученый
Finzi, E.И Розенталь, Н. Е. Эмоциональная проприоцепция: лечение депрессии с помощью афферентной лицевой обратной связи. J. Psychiatr. Res. 80 , 93–96. https://doi.org/10.1016/j.jpsychires.2016.06.009 (2016).
Артикул PubMed Google ученый
Калео М. и Скьяво Г. Центральные эффекты нейротоксинов столбняка и ботулина. Toxicon 54 , 593–599. https://doi.org/10.1016/j.toxicon.2008.12.026 (2009).
CAS Статья PubMed Google ученый
Матак И., Ридерер П. и Лацкович З. Транспорт аксонов ботулинического токсина от периферии к спинному мозгу. Neurochem. Int. 61 , 236–239. https://doi.org/10.1016/j.neuint.2012.05.001 (2012).
CAS Статья PubMed Google ученый
Marchand-Pauvert, V. et al. Помимо мышечных эффектов: снижение спинального рецидивирующего торможения после применения нейротоксина ботулина A. J. Physiol. 591 , 1017–1029. https://doi.org/10.1113/jphysiol.2012.239178 (2013).
CAS Статья PubMed Google ученый
Weise, D., Weise, C. M. & Naumann, M. Центральные эффекты ботулинического нейротоксина — данные исследований на людях. Токсины 11 , 1.https://doi.org/10.3390/toxins11010021 (2019).
CAS Статья Google ученый
Kikuchi, A. et al. Метаболические изменения головного мозга при цервикальной дистонии со спиноцеребеллярной атаксией 1 типа после терапии ботулотоксином. Междунар. Мед 55 , 1919–1922. https://doi.org/10.2169/internalmedicine.55.5843 (2016).
Артикул PubMed Google ученый
Hallett, M. Объяснение сроков действия, начала и продолжительности эффектов ботулинического нейротоксина, а также клинических способов воздействия на них. Toxicon 107 , 64–67. https://doi.org/10.1016/j.toxicon.2015.07.013 (2015).
CAS Статья PubMed PubMed Central Google ученый
Nyboe Jacobsen, L., Smith Lassen, I., Friis, P., Videbech, P. & Wentzer Licht, R. Телесные симптомы при умеренной и тяжелой депрессии. Норд Дж. Психиатрия 60 , 294–298. https://doi.org/10.1080/080394806007 (2006).
Артикул PubMed Google ученый
Гупта Р. К. Большая депрессия: болезнь с объективными физическими признаками. World J. Biol Psychiatry 10 , 196–201. https://doi.org/10.1080/156229702072 (2009 г.).
Артикул PubMed Google ученый
Hall, T. A. et al. Качество жизни, связанное со здоровьем, и психосоциальные характеристики пациентов с доброкачественным эссенциальным блефароспазмом. Arch. Офтальмол. 124 , 116–119. https://doi.org/10.1001/archopht.124.1.116 (2006).
Артикул PubMed Google ученый
Gündel, H. et al. Высокая сопутствующая психическая патология при спастической кривошеи: контролируемое исследование. Дж.Nerv. Ment. Дис. 191 , 465–473. https://doi.org/10.1097/01.NMD.0000081667.02656.21 (2003).
Артикул PubMed Google ученый
Джейлан, Д., Эрер, С., Зарифоглу, М., Тюркеш, Н. и Озкая, Г. Оценка шкал тревоги и депрессии и качества ЖИЗНИ у пациентов с цервикальной дистонией, получающих терапию ботулотоксином, и их родственники. Neurol. Sci. 40 , 725–731. https: // doi.org / 10.1007 / s10072-019-3719-9 (2019).
Артикул PubMed Google ученый
Кристенсен, Дж. К., Вестергаард, Д. Г., Свартлинг, К. и Байгам, А. Связь первичного гипергидроза с депрессией и тревогой: систематический обзор. Acta Derm. Венереол. 100 , adv00044. https://doi.org/10.2340/00015555-3393 (2020).
Артикул PubMed Google ученый
Грин К. Э., Расталл Д. и Эггенбергер Э. Лечение блефароспазма / гемифациального спазма. Curr. Относиться. Параметры Neurol 19 , 41. https://doi.org/10.1007/s11940-017-0475-0 (2017).
Артикул PubMed Google ученый
Льюис, М. Б. Взаимодействие между процедурами для лица на основе ботулотоксина и воплощенными эмоциями. Sci. Реп. 8 , 14720. https://doi.org/10.1038 / s41598-018-33119-1 (2018).
ADS CAS Статья PubMed PubMed Central Google ученый
Бедарф, Дж. Р., Кебир, С., Мишелис, Дж. П., Ваббельс, Б. и Паус, С. Депрессия при блефароспазме: вопрос лицевой обратной связи ?. Neuropsychiatr. Дис. Относиться. 13 , 1861–1865. https://doi.org/10.2147/NDT.S141066 (2017).
CAS Статья PubMed PubMed Central Google ученый
Очудло С., Брынярски П. и Опала Г. Ботулинический токсин улучшает качество жизни и снижает усиление депрессивных симптомов у пациентов с блефароспазмом. Паркинсон. Relat. Disord. 13 , 505–508. https://doi.org/10.1016/j.parkreldis.2007.03.006 (2007).
Артикул Google ученый
Джаханшахи М. и Марсден К. Д. Психологическое функционирование до и после лечения кривошеи ботулиническим токсином. J. Neurol. Нейрохирургия. Психиатрия 55 , 229–231. https://doi.org/10.1136/jnnp.55.3.229 (1992).
CAS Статья PubMed PubMed Central Google ученый
Weber, A. et al. Психосоциальные аспекты пациентов с очаговым гипергидрозом: заметное снижение социальной фобии, тревожности и депрессии и повышение качества жизни после лечения ботулотоксином A. Br. Дж.Дерматол. 152 , 342–345. https://doi.org/10.1111/j.1365-2133.2004.06334.x (2005).
CAS Статья PubMed Google ученый
Dong, H., Fan, S., Luo, Y. & Peng, B. Ботулинический токсин снимает тревогу и депрессию у пациентов с гемифациальным спазмом и блефароспазмом. Neuropsychiatr. Дис. Относиться. 15 , 33–36. https://doi.org/10.2147/NDT.S181820 (2019).
CAS Статья PubMed Google ученый
Блюменфельд, А. М. et al. Влияние лечения онаботулинумтоксином А хронической мигрени на общие сопутствующие заболевания, включая депрессию и тревогу. J. Neurol. Нейрохирургическая психиатрия 90 , 353–360. https://doi.org/10.1136/jnnp-2018-319290 (2019).
Артикул PubMed PubMed Central Google ученый
Маасуми К., Томпсон Н. Р., Криглер Дж. С. и Теппер С. Дж. Эффект инъекции онаботулинтоксина А на депрессию при хронической мигрени. Головная боль 55 , 1218–1224. https://doi.org/10.1111/head.12657 (2015).
Артикул PubMed Google ученый
Нековарова Т. и др. Общие механизмы боли и депрессии: антидепрессанты также анальгетики ?. Front Behav. Neurosci. 8 , 99. https://doi.org/10.3389/fnbeh.2014.00099 (2014).
Артикул PubMed PubMed Central Google ученый
МакКлин, Г. Антидепрессанты как анальгетики. Препараты для ЦНС 22 , 139–156. https://doi.org/10.2165/00023210-200822020-00005 (2008).
CAS Статья PubMed Google ученый
Maciejewski, M. et al. Обратный перевод отчетов о нежелательных явлениях прокладывает путь к снижению рисков доклинических отклонений от целевых показателей. Elife 6 , 1. https://doi.org/10.7554/eLife.25818 (2017).
Артикул Google ученый
Алатави, Ю. М. и Хансен, Р. А. Эмпирическая оценка занижения сведений в системе отчетности о нежелательных явлениях Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (FAERS). Мнение эксперта. Drug Saf. 16 , 761–767. https://doi.org/10.1080/14740338.2017.1323867 (2017).
Артикул PubMed Google ученый
Границы | Антидепрессивное действие кетамина: механизмы, лежащие в основе новых быстродействующих антидепрессантов
Введение
Большое депрессивное расстройство (БДР) — серьезная проблема общественного здравоохранения и одно из наиболее распространенных психических расстройств, распространенность которого в течение всей жизни составляет 17% в США (Kessler et al., 2005). Хотя доступные в настоящее время антидепрессанты обеспечивают измеримую степень терапии, примерно 50% людей с диагнозом БДР не отвечают должным образом на лечение первой линии традиционными антидепрессантами (Tvedi et al., 2006; Fava et al., 2008). Более того, отсрочка на 3–4 недели начала терапевтического эффекта особенно затруднена для пациентов с стойкими суицидальными идеями. Пациенты, которые проявляют резистентность к лечению, определяемую как не прошедшие два или более испытаний лекарств, тяжелее страдают коморбидными тревожными расстройствами и имеют повышенный риск суицида в течение длительного периода времени (Joffe et al., 1993; Суэри и др., 2007; Schosser et al., 2012). Следовательно, существует острая медицинская потребность в разработке быстродействующих терапевтических средств, способных немедленно облегчить депрессивную симптоматику и сохраняющих свое действие в качестве антидепрессанта для пациентов, неспособных реагировать на обычные методы лечения.
Недавно было продемонстрировано, что кетамин, антагонист рецепторов NMDA, обладает быстродействующим и временным антидепрессивным действием у пациентов, резистентных к лечению (Mathew et al., 2012). Однако открытие кетамина — не панацея. Психотомиметические свойства и потенциал злоупотребления кетамином требуют осторожности при продвижении этого конкретного соединения в качестве общего лечения БДР. Понимание основного механизма действия кетамина, связанного с улучшением поведения, имеет большое значение для разработки новых, более совершенных антидепрессантов, помимо использования кетамина. Этот обзор будет сосредоточен на молекулярных изменениях и исследованиях поведения животных, которые использовались для измерения потенциальных коррелятов антидепрессивных эффектов кетамина.Поскольку кетамин оказывает клиническое антидепрессивное действие с другим временным курсом и, очевидно, другим нейрохимическим механизмом, чем обычные антидепрессанты, результаты этих исследований выявили новые парадигмы, которые можно использовать для выявления новых соединений, которые могут иметь такой же терапевтический потенциал и временной ход, как кетамин. нацелены на лечение устойчивой депрессии (TRD).
Кетамин — клинические испытания
Первоначальные клинические испытания представляли собой двойные слепые перекрестные исследования, в которых использовалась однократная инфузия кетамина (0.5 мг / кг), вводимого внутривенно в течение 40 минут (Berman et al., 2000; Zarate et al., 2006). Берман и др. Сообщили об уменьшении депрессивной симптоматики, которое постепенно проявлялось в течение первых 3 дней у всех восьми пациентов, которых лечили; один пациент продолжал проявлять антидепрессантные эффекты через 2 недели после инфузии. Точно так же Зарате и его коллеги сообщили о значительном и быстром облегчении депрессивных симптомов у 12 человек в первый день, при этом у шести пациентов наблюдалось облегчение симптомов в течение как минимум 1 недели; двое из этих субъектов продолжали проявлять антидепрессивный эффект через 2 недели после однократной инфузии кетамина.В последующих исследованиях сообщалось о значительной эффективности кетамина в снижении суицидных мыслей у людей с TRD (Diazgranados et al., 2010). Кроме того, испытание, подтверждающее концепцию, проведенное у устойчивых к лечению пациентов с биполярным расстройством, выявило более быстрое начало антидепрессивного эффекта после инфузии кетамина одновременно с лечением вальпроатом и литием по сравнению с предыдущими исследованиями, проведенными у пациентов с тяжелым депрессивным расстройством. Однако облегчение депрессивных симптомов в биполярном исследовании сохранялось только в течение 3 дней по сравнению с 7 днями, о которых сообщалось в более ранних исследованиях.Кроме того, кетамин имел значительную эффективность у пациентов, резистентных к электросудорожной терапии (ЭСТ), и вызывал более быстрые антидепрессивные эффекты по сравнению с ЭСТ (Ibrahim et al., 2011). В отличие от почти немедленного облегчения депрессивной симптоматики, связанного с инфузией кетамина, подобное уменьшение симптомов наблюдалось примерно через 1-2 недели после первого из трехкратного воздействия ЭСТ. Кроме того, было предложено использовать кетамин в качестве анестетика перед ЭСТ для улучшения результатов и ответа на ЭСТ (Hoyer et al., 2013). Действительно, введение кетамина / пропофола (кетофола) уменьшало тяжесть продолжительности приступов, вызывало более раннее начало антидепрессивного эффекта и значительно улучшало когнитивные функции по сравнению с пропофолом (Wang et al., 2012). Недавно сообщалось, что субанестетические дозы S-кетамина с пропофолом фактически ухудшали дезориентацию после лечения у некоторых пациентов (Jarventausta et al., 2013). Дальнейшие исследования продолжаются, чтобы определить преимущество S-энантиомера над обычно используемой рацемической смесью кетамина.Одна группа предположила, что S-кетамин не вызывает преходящих психотомиметических эффектов, очевидных в начальной фазе инфузии (Segmiller et al., 2013).
Обширное клиническое испытание с участием 67 пациентов в двух центрах с задокументированными TRD установило наиболее полную антидепрессивную эффективность кетамина по сравнению с бензодиазепином, мидазоламом, используемым в качестве активного контроля плацебо (Murrough et al., 2013). Частота ответа на кетамин по сравнению с мидазоламом составила 64 и 28% соответственно, при этом кетамин значительно снизил баллы по шкале MADRS на 7.95 баллов. Пациенты, получавшие кетамин, продолжали демонстрировать улучшенные показатели в течение 7-дневного периода после инфузии по сравнению с мидазоламом, однако снижение депрессивных показателей на 7-й день больше не было значимым. Хотя в большинстве исследований кетамина участвовало лишь небольшое количество пациентов, это наиболее тщательно разработанное и наиболее обширное клиническое испытание, подтверждающее эффективность кетамина в быстром и постоянном облегчении депрессивной симптоматики.
Поскольку клинические эффекты кетамина временны, в исследованиях оценивалась эффективность приема кетамина при хроническом приеме.Значительное улучшение симптомов сохранялось после шести инфузий кетамина в течение 11 дней, хотя у 9 пациентов, получавших лечение в этом исследовании, в конечном итоге рецидив наступил через 19 дней после последней инфузии (aan het Rot et al., 2010). Кроме того, эффекты перорального приема кетамина в течение длительного периода дали положительные результаты, при этом у пациентов улучшилось настроение в течение 28-дневного периода лечения. Интересно, что хотя уровень облегчения симптомов был таким же, как и у И.V. инфузия кетамина, пероральный кетамин не оказывал значительного влияния на симптомы депрессии до 14 дня лечения, но, к счастью, облегчил симптомы тревоги в течение 3 дней лечения (Irwin et al., 2013). Психотомиметические эффекты у этих пациентов не наблюдались; однако поступали сообщения о нарушениях сна и диарее. Более того, другое исследование, проведенное у пациентов с биполярным расстройством с использованием сублингвального кетамина, показало значительное (70%) количество людей, демонстрирующих улучшение настроения с ограниченными побочными эффектами и быстрым началом действия.Эти данные показывают, что дальнейшая оценка пути введения кетамина и профилей их побочных эффектов может быть полезной.
Несмотря на то, что существует четкое согласие относительно скорости антидепрессивного эффекта кетамина при TRD, у большинства пациентов повышенное настроение начинается примерно через 120 минут после инфузии, но не все пациенты реагируют на лечение кетамином. Частота ответа в исследованиях колебалась от 25 до 85% через 24 часа и от 14 до 70% через 72 часа (Aan Het Rot et al., 2012).Кроме того, продолжительность антидепрессивного эффекта варьировалась в разных исследованиях. В большинстве исследований, проведенных до сих пор, только примерно у половины пациентов наблюдалось облегчение депрессивных симптомов от кетамина, продолжавшееся более 72 часов. Причины, лежащие в основе вариабельности ответа на кетамин, неизвестны. Учитывая неоднородный характер депрессии, с ответом на лечение может быть связан ряд генетических, экологических характеристик и характеристик пациента. Например, пациенты с семейным анамнезом расстройства, связанного с употреблением алкоголя (AUD), демонстрируют лучшие результаты в ответ на введение кетамина, сообщая о меньшем количестве психотомиметических нарушений и большем уменьшении симптомов депрессии по сравнению с пациентами с MDD без истории AUD (Phelps et al., 2009). Кроме того, вероятно, будут обнаружены потенциальные биомаркеры или генетические варианты, которые увеличивают или предотвращают реакцию на кетамин.
Некоторые клинические исследования пытались определить важные фармакологические характеристики кетамина, связанные с ответом на лечение. Модификация субъединицы рецептора NMDA NR2B может вызывать усиленный ответ на лечение; действительно, антагонисты NR2B, CP-1016060 и MK-0657, показали хорошую эффективность при лечении пациентов с TRD (Preskorn et al., 2008; Ibrahim et al., 2012а). AZD6765, блокатор каналов NMDA, был оценен по его антидепрессантным свойствам в двойном слепом перекрестном исследовании с участием 22 человек. Хотя о психотомиметических эффектах этого соединения не сообщалось, депрессивные симптомы уменьшались только в течение первых 2 часов после инфузии (Zarate et al., 2013). Точно так же прием рилузола (блокатора натриевых каналов, который косвенно ингибирует высвобождение глутамата) в течение 4 недель после инфузии кетамина не усиливал улучшение симптомов по сравнению с плацебо (Ibrahim et al., 2012б). Эти отчеты и растущая литература указывают на то, что механизмы действия, опосредующие антидепрессивный эффект кетамина, еще не идентифицированы и не вызываются простой блокадой рецепторов NMDA.
Поведенческие эффекты кетамина, подобные антидепрессантам, у грызунов
Способность кетамина влиять на депрессивное поведение в ряде доклинических поведенческих парадигм и моделей депрессии широко изучалась в последние несколько лет. Многие сообщения указывают на то, что однократное введение кетамина вызывает у грызунов антидепрессивный эффект (таблица 1).Однако некоторые результаты не были последовательно воспроизведены другими лабораториями. Здесь приводится обзор литературы, посвященной антидепрессантоподобным эффектам кетамина, с акцентом на влияние различных условий тестирования на поведенческие результаты. Кроме того, многие исследования теперь сообщают, что эффекты однократной дозы кетамина можно измерить в течение длительного периода времени, продолжающегося от нескольких дней до недель (таблица 2). Динамика этих длительных эффектов напоминает динамику клинических эффектов кетамина (Yilmaz et al., 2002; Maeng et al., 2008), и может представлять новую парадигму поведения животных, которая коррелирует с клиническими эффектами быстродействующих антидепрессантов.
Таблица 1. Острые эффекты кетамина .
Таблица 2. Длительные эффекты кетамина .
Тест принудительного плавания (FST)
FST — это наиболее часто используемый поведенческий тест для измерения депрессивного поведения у грызунов. Этот тест также часто используется в доклинической литературе по кетамину.Мыши и крысы, помещенные в цилиндры с водой, быстро становятся неподвижными, демонстрируя их пассивное плавание или движения, необходимые для того, чтобы оставаться на плаву. Основываясь на реакции неподвижности, вызванной неизбежным воздействием стресса, FST также имеет сильную прогностическую ценность, поскольку кратковременное введение соединений антидепрессантов из различных фармакологических классов сокращает время неподвижности при FST. Эти препараты включают трициклические соединения, ингибиторы МАО, атипичные антидепрессанты и СИОЗС (Cryan et al., 2005). Кроме того, поведенческие эффекты трицикликов и СИОЗС не продолжаются более нескольких часов после их однократного приема (Hoshaw et al., 2008).
Несколько групп сообщили, что однократное введение кетамина приводило к резкому снижению неподвижности FST вскоре после инъекции (таблица 1). Хотя в большинстве этих исследований использовалась доза 10 мг / кг, вводимая внутрибрюшинно (i.p.), субанестетические дозы кетамина в диапазоне от 10 до 50 мг / кг вызывали антидепрессантные эффекты при FST.Однако в некоторых исследованиях не удалось выявить острые эффекты кетамина с помощью FST у мышей (Bechtholt-Gompf et al., 2011) или крыс (Popik et al., 2008).
Особенностью фармакологии кетамина, отличной от обычных антидепрессантов, является то, что он вызывает длительные поведенческие эффекты, сохраняющиеся от одного до нескольких дней после приема (таблица 2). Большинство исследований показывают, что FST остается чувствительным к длительным эффектам кетамина до 1 недели после однократной инъекции (Таблица 1).Сообщалось, что эти длительные эффекты сохраняются в течение 8 дней (Ma et al., 2013), 10 дней (Yilmaz et al., 2002), 12 дней (Garcia et al., 2008a) и 2 недель (Maeng et al., 2008 г.). Интересно, что эффекты кетамина, подобные антидепрессантам, наблюдались в течение 2 месяцев после прекращения 15-дневного лечения крыс в подростковом возрасте (Parise et al., 2013). Этот результат согласуется с другими исследованиями, в которых использовался 10 или 12-дневный режим дозирования для установления более длительных эффектов хронического кетамина на депрессивно-подобную активность в FST (Tizabi et al., 2012; Акинфиресое, Тизаби, 2013). Только одно исследование, посвященное длительным эффектам кетамина, не сообщило об этом открытии (Lindholm et al., 2012).
Было показано, что наличие хронического стресса облегчает выявление антидепрессивных эффектов кетамина в FST (Koike et al., 2013a). Также существуют значительные различия в чувствительности штаммов к кетамину. Например, крысы линии Вистар нечувствительны к антидепрессантным эффектам низких доз кетамина (2,5 и 5 мг / кг) после длительного лечения.Напротив, крысы WKY были чрезвычайно чувствительны к вызванному кетамином снижению неподвижности FST (Tizabi et al., 2012). Крысы WKY имеют высокий базовый уровень неподвижности в FST, что может способствовать большей чувствительности к соединениям. Более того, крысы WKY являются генетической моделью патологической депрессии и тревоги (Will et al., 2003; Solberg et al., 2004), что может обеспечить им большую чувствительность к эффектам кетамина. Наконец, штамм WKY нечувствителен к СИОЗС (Lopez-Rubalcava and Lucki, 2000; Tejani-Butt et al., 2003; Will et al., 2003), показывая, что кетамин активен в условиях, когда существующие антидепрессанты неэффективны. Эта особенность делает крыс WKY полезной линией для оценки новых соединений, похожих на кетамин, которые могут быть проверены на эффективность при TRD.
Тест подвески хвоста (TST)
TST широко используется в доклинической литературе по кетамину как менее стрессовый тест на поведенческое отчаяние, когда мышей подвешивают за хвост (Steru et al., 1985; Cryan et al., 2005). TST имеет прогностическую ценность, поскольку измеряет антидепрессантоподобные реакции на различные классы лекарств. Кетамин резко снижает уровень неподвижности у мышей, при этом исследования сообщают о сокращении времени неподвижности через 30 минут (Mantovani et al., 2003; Rosa et al., 2003; Cruz et al., 2009; Koike et al., 2011a) и через 24 часа. (Koike et al., 2011b) после однократной инъекции кетамина.
Наиболее эффективная доза в TST составляла 30 мг / кг. Мыши ICR были особенно чувствительны к кетамину и продолжали демонстрировать снижение неподвижности через 72 часа после лечения (Koike et al., 2011б). Кроме того, более низкая доза кетамина (10 мг / кг) была эффективной в снижении неподвижности TST, увеличивающейся при хроническом легком стрессе (CMS) через 48 часов после инъекции кетамина (Ma et al., 2013). Напротив, два исследования показали, что резкое снижение неподвижности с помощью высоких доз кетамина (50 и 160 мг / кг) не поддерживалось через 1 неделю после лечения у мышей (Popik et al., 2008; Bechtholt-Gompf et al., 2011) . Эти данные предполагают, что TST наиболее ценен для оценки более непосредственных антидепрессивных эффектов кетамина.Однако воздействие стресса может повысить чувствительность к кетамину в тесте TST. На сегодняшний день нет исследований, в которых изучалась бы чувствительность ТКП к хроническому режиму дозирования кетамина.
Новинка с подавлением подачи (NSF)
Воздействие новой окружающей среды вызывает у грызунов тревожный фенотип, известный как гипонеофагия. В тестах NSF и гипофагии, вызванной новизной (NIH), латентность кормления увеличивается, а количество потребляемой пищи снижается в новой среде.Эти тесты, основанные на схожем принципе, различаются по методологии; NSF требует острого голодания за 24 часа до тестирования, тогда как NIH использует 8-10-дневный тренировочный период без депривации. Эти тесты имеют значительную внешнюю валидность, хотя интерпретация результатов с помощью NSF может быть ограничена использованием лишения пищи. Гипонеофагия — один из немногих тестов, связанных с тревогой, которые надежно ослабляются после хронического, но не острого приема антидепрессантов (Bodnoff et al., 1988; Дулава и Хен, 2005). Напротив, кетамин сокращает время ожидания приема пищи в течение нескольких часов после лечения. Диапазон эффективных доз кетамина в этой задаче варьировался в разных исследованиях: 30 минут и 24 часа после 5–10 мг / кг (Li et al., 2010; Carrier and Kabbaj, 2013) и 30 мг / кг (Iijima et al., 2012), но все тесты привели к значительному сокращению задержки передачи в новой среде. Более того, кетамин (10 мг / кг) успешно сокращал время ожидания приема пищи в NIH через 1 час после инъекции (Burgdorf et al., 2013). Более длительные эффекты острого лечения кетамином (3 мг / кг) наблюдались через 48 часов после лечения у мышей, подвергшихся хроническому стрессу, хотя в этом исследовании кетамин не уменьшал латентность кормления у мышей, не подвергавшихся стрессу (Autry et al., 2011).
В целом, эти данные предполагают, что гипонеофагия очень чувствительна к однократной дозе кетамина, хотя дополнительные параметры этих тестов еще предстоит изучить более систематически. Тот факт, что кетамин быстро вызывает анксиолитический эффект, тогда как обычные антидепрессанты требуют длительного лечения в течение нескольких недель, согласуется с более быстрым началом клинических эффектов.Поскольку пациенты с TRD демонстрируют повышенную коморбидную тревогу по сравнению с пациентами с MDD, реагирующими на лечение, не следует упускать из виду полезность оценки кетамина в тестах на тревожность.
Тест предпочтения сахарозы (SPT)
Потребление сахарозы широко принято в качестве показателя ангедонии у грызунов и имеет значительную достоверность с точки зрения чувствительности к хроническому стрессу и лечению антидепрессантами. Повторное введение кетамина (7 дней) обратило вспять снижение потребления сахарозы у крыс, подвергшихся хроническому стрессу.Хотя следует отметить, что этот режим дозирования кетамина также увеличивает потребление сладкой пищи как у стрессированных, так и у нестрессированных крыс (Garcia et al., 2009). Кроме того, введение низкой дозы кетамина (0,5 мг / кг) в течение 10 дней значительно увеличивало потребление сахарозы у крыс WKY (Akinfiresoye and Tizabi, 2013). Заметное увеличение потребления сахарозы у крыс сохранялось через 1, 3, 5 и 7 дней после однократной обработки кетамином (10 мг / кг) (Li et al., 2011), что указывает на значительное длительное влияние кетамина на это поведение.
Снижение потребления сахарозы, вызванное воздействием LPS (Walker et al., 2013) и CMS (Ma et al., 2013), было обращено вспять после однократной обработки кетамином. Длительные эффекты острого лечения кетамином были очевидны у мышей, подвергшихся воздействию CMS, испытанных через 4, 6 и 8 дней после однократного лечения кетамином (Ma et al., 2013). Напротив, потребление сахарных гранул у крыс, подвергшихся воздействию CMS, не изменилось при лечении кетамином (Rezin et al., 2009), хотя этот конкретный тест напрямую не сопоставим с традиционным SPT.Следует отметить отсутствие единого мнения о наиболее подходящем протоколе SPT для моделирования ангедонического состояния у крыс. Тем не менее, эти данные подтверждают использование SPT в качестве чувствительного скринингового теста для быстрого действия антидепрессантов, таких как кетамин.
Лабиринт с приподнятым верхом (EPM)
EPM часто используется для измерения тревожного поведения у грызунов (Bourin, 1997; Rodgers et al., 1997) и имеет высокую прогностическую ценность для скрининга анксиолитиков. Однако обычно он не чувствителен к лечению антидепрессантами.Кетамин индуцировал анксиолитический фенотип у крыс во время воздействия EPM через 30 минут после однократной инъекции кетамина (Engin et al., 2009). Аналогичный эффект наблюдался у мышей через 1 и 2 часа после лечения (Hayase et al., 2006). Эти исследования показывают, что EPM не был чувствителен к низким дозам кетамина; только более высокие дозы (30 мг / кг) вызывали значительный анксиолитический эффект. Более того, более низкие дозы кетамина не вызывали анксиолитического ответа в EPM у мышей, не подвергавшихся стрессу (Autry et al., 2011).Отсутствие эффекта от низких доз кетамина также характерно для ТКП. Париз и его коллеги описали значительные анксиолитические эффекты EPM у крыс через 2 месяца после завершения 15-дневного режима дозирования 20 мг / кг в день в подростковом возрасте (Parise et al., 2013). Хотя наличие эффектов лекарств после такого длительного интервала может указывать на чувствительность к длительным эффектам кетамина, факторы развития могли сыграть большую роль. В настоящее время EPM может быть предложен только как инструмент для оценки более непосредственных анксиолитических эффектов кетамина.
Двигательная активность
Эффекты кетамина, подобные антидепрессантам, обычно оценивают в связи со спонтанной активностью, поскольку повышенная двигательная активность может вызывать ложноположительные эффекты при выполнении вышеупомянутых поведенческих задач. Кетамин вызывает значительную гиперактивность сразу после инъекции; 10 мин после i.p. После инъекции низких доз кетамина (5–15 мг / кг) крысы проявляли гиперактивность в спонтанной активности (da Silva et al., 2010). Кроме того, повторное введение кетамина (50 мг / кг) повышало чувствительность крыс к его гиперактивным эффектам (Popik et al., 2008).
Однако в большинстве исследований сообщается об отсутствии изменений или снижении двигательной активности после приема кетамина. Уменьшение поведения в открытом поле было вызвано кетамином у крыс через 30 минут после введения 50 мг / кг (Engin et al., 2009) и через 1 час после 10 и 25 мг / кг (Gigliucci et al., 2013). Кроме того, однократная инъекция кетамина не влияла на двигательную активность крыс через 30 минут после инъекции (Reus et al., 2011; Tizabi et al., 2012; Yang et al., 2012; Akinfiresoye and Tizabi, 2013) или у мышей (Lindholm et al., 2012). Через 24 часа после инъекции кетамин или антагонисты NMDA CPP и MK-801 не влияли на двигательную активность мышей (Autry et al., 2011).
Кроме того, хроническое введение низких доз кетамина не влияло на спонтанную активность взрослых крыс (Garcia et al., 2008b; Ma et al., 2013). Интересно, что недавно было показано, что гиперактивность проявляется у подростков, но не у взрослых крыс после хронического введения кетамина (Parise et al., 2013). Во многих экспериментах, оцениваемых в этом обзоре, не измерялось влияние кетамина на двигательную активность в использованной дозе и времени.Однако вместе взятые данные показывают, что важной практикой является оценка изменений показателей активности после лечения, чтобы выявить и исключить участие любого потенциального локомоторного эффекта в поведенческих реакциях на кетамин.
Приученная беспомощность (LH)
Модель депрессии LH вызывает дефицит бегства у грызунов, подвергшихся непредсказуемому и неконтролируемому стрессу (Seligman et al., 1980). ЛГ — популярная модель депрессии, поскольку она имеет хорошую оценку лица и вызывает ряд эндофенотипов, которые можно измерить с помощью других поведенческих задач, включая FST и NSF.Повторное лечение антидепрессантами обратило вспять дефицит копинг-поведения у крыс и мышей (Shanks and Anisman, 1988; Caldarone et al., 2000). Сообщалось, что однократное введение кетамина (10 мг / кг) полностью изменило дефицит копинг-поведения, вызванный выученной беспомощностью через 30–60 минут (Beurel et al., 2011; Koike et al., 2011a) и через 24 часа после лечения ( Maeng et al., 2008; Li et al., 2010). Кроме того, кетамин эффективен в создании антидепрессантных эффектов на ЛГ у мышей, получавших CMS, даже при более низкой дозе (3 мг / кг) (Autry et al., 2011). В настоящее время нет информации о пролонгированном влиянии кетамина на ЛГ.
Хронический легкий стресс (CMS)
Воздействие модели CMS вызывает депрессивное поведение у грызунов после представления ряда стрессоров в непредсказуемой последовательности в течение длительного периода времени. CMS вызывает ряд поведенческих изменений у грызунов, которые, как считается, напоминают черты депрессивных пациентов, такие как ангедония или потеря ухода (Willner, 1997, 2005). CMS удовлетворяет большинству критериев достоверности модели депрессии на животных; они этиологически значимы и имеют хороший дизайн, что приводит к аналогичным патологическим изменениям, наблюдаемым у людей, чувствительных к хроническому лечению антидепрессантами.Поведенческие и молекулярные изменения, вызванные CMS, обращаются лечением антидепрессантами, но только после приема в течение нескольких недель. Напротив, кетамин обращал вспять поведенческие и физиологические изменения, вызванные CMS у крыс после острого введения, и эффекты сохранялись после длительного лечения. Острое и хроническое лечение кетамином обращало вспять увеличение массы надпочечников, способствовало восстановлению массы тела и нормализовало уровни циркулирующего кортикостерона и АКТГ (Garcia et al., 2009). Физиологические изменения, вызванные CMS, были отменены острым лечением кетамином в аналогичном исследовании, но не смогли обратить вспять CMS-индуцированную ангедонию в SPT (Rezin et al., 2009). Кроме того, крысы-подростки, подвергшиеся воздействию CMS, демонстрировали снижение неподвижности, повышенное потребление сахарозы и задержку при приеме пищи сразу после острого лечения кетамином (Parise et al., 2013).
Поскольку CMS принята в качестве модели депрессии на грызунах, CMS является идеальной парадигмой для проверки антидепрессантоподобных эффектов новых терапевтических средств, таких как кетамин.Обращение CMS-индуцированных депрессивно-подобных фенотипов, измеренных с использованием мышиных FST, NSF и SPT, было зарегистрировано с помощью кетамина в отсутствие какого-либо лекарственного эффекта у мышей, не подвергавшихся стрессу (Autry et al., 2011). Кроме того, эффект кетамина в тесте NSF сохранялся у мышей CMS через 48 часов после инъекции. В соответствии с этими выводами, два аналогичных исследования показали повышенную чувствительность мышей, подвергшихся воздействию CMS, к кетамину (Li et al., 2011; Ma et al., 2013). Взятые вместе, данные CMS являются наиболее последовательным и, возможно, наиболее действенным методом изучения антидепрессивных эффектов кетамина в доклинических исследованиях.
Кетамин — молекулярные механизмы действия
Чтобы разработать новые и более эффективные антидепрессанты, необходимо полностью понять молекулярные механизмы, лежащие в основе длительного улучшения поведения, связанного с лечением кетамином. Большая часть этой информации была получена в результате доклинических исследований на животных, и основные результаты подробно описаны в следующем разделе.
Рецепторы NMDA и AMPA
В настоящее время гипотеза о механизме действия кетамина фокусируется на каскаде нейрохимических событий, которые инициируются вскоре после введения кетамина.Затем события продолжаются в течение нескольких дней после его метаболизма и выведения.
Снижение нейрогенеза и синаптической пластичности играет ключевую роль в патофизиологии БДР. Синаптическая пластичность относится к динамической способности синапсов формировать и сокращать процессы, тем самым изменяя синаптическую силу и коммуникацию. Наиболее хорошо изученными механизмами, опосредующими изменения пластичности, являются долговременная потенциация (ДП) и долговременная депрессия (ДП). Эти процессы включают значительные изменения в пре- и постсинаптических каркасных белках и рецепторах глутамата, прежде всего в глутаматергическом рецепторе, α-амино-3-гидрокси-5-метил-4-изоксазол пропионовой кислоте (AMPA).Рецептор AMPA, содержащий субъединицы GluR1, GluR4 и GluR2, участвует в LTP, тогда как GluR2, GluR3 и GluR4 необходимы для интернализации рецептора AMPA, необходимой для облегчения LTD (Kessels and Malinow, 2009). Рецепторы N-метил-d-аспартата (NMDA) в возбуждающих синапсах также подвержены трафику и значительному снижению синаптической плотности во время LTD (Peng et al., 2010). В пирамидных клетках гиппокампа LTP и LTD двунаправленно регулируют рост и втягивание дендритного шипа, тогда как экспрессия AMPA положительно связана с размером головы шипа.Эти динамические процессы стабилизируются одновременными изменениями экспрессии синаптических белков и сигнальных путей.
Кетамин блокирует рецепторы NMDA (NMDAR) при концентрациях 2–50 мкм. Последующее подавление тонического поступления глутамата в ГАМКергические интернейроны приводит к растормаживанию передачи сигналов глутамата. Это растормаживание и увеличение нейротрансмиссии глутамата опосредовано уменьшением ГАМКергической тормозящей обратной связи пирамидных нейронов в слое V ПФК, области, широко вовлеченной в развитие психических расстройств (Homayoun and Moghaddam, 2007).Интересно, что посмертные исследования сообщают о снижении пирамидных клеток и ГАМКергических интернейронов в ПФК депрессивных индивидуумов (Choudary et al., 2005; Rajkowska et al., 2007). Повышение уровня глутамата активирует ионотропные AMPAR, что приводит к притоку Na 2+ и последующей деполяризации мембраны, индукции сигнальных каскадов и синтезу белка. Определенные AMPARs, у которых отсутствует субъединица GluR2, фактически приводят к притоку Ca 2+ (Kessels and Malinow, 2009). Повышение экспрессии рецептора AMPA после введения кетамина опосредует повышенную чувствительность к глутамату.Было высказано предположение, что эта повышенная чувствительность или «синаптическое масштабирование» необходимо для поддержания стабильности синаптической пластичности и увеличения синтеза белка в присутствии хронической блокады NMDAR (Kavalali and Monteggia, 2012).
Фармакологическое подавление поведенческих эффектов кетамина было достигнуто с использованием антагониста рецептора AMPA, 2,3-дигидроксил-6-нитро-7-сульфамоилбензо (f) хиноксалин-2,3-диона (NBQX), обращая антидепрессивное действие кетамин в парадигме ЛГ (Maeng et al., 2008; Koike et al., 2011b). Кроме того, совместное введение антагонистов AMPAR блокировало эффекты кетамина в FST (Autry et al., 2011). Поскольку AMPAR играют очевидную роль в опосредовании эффектов кетамина, недавнее исследование показало антидепрессантоподобный эффект введения AMPA у депрессивно-подобных крыс WKY (Akinfiresoye and Tizabi, 2013). Эти данные указывают на то, что рецепторы AMPA и действительно соотношение AMPA / NMDA являются важным соображением и целью при разработке потенциальных терапевтических средств.
Сигнализация mTOR
Данные показывают, что длительные антидепрессантоподобные эффекты кетамина опосредованы молекулярными изменениями сигнального пути для мишени рапамицина (mTOR) млекопитающих (см. Рисунок 1), серин / треонинкиназы и ключевого компонента пути передачи сигналов инсулина. (Ли и др., 2010). Два функциональных комплекса mTOR регулируют инициацию трансляции белков в клетках млекопитающих, комплекс mTOR 1 (mTORC1) и комплекс mTOR 2 (mTORC2) (Rosner and Hengstschlager, 2011).Недавнее патологоанатомическое исследование выявило снижение кортикальных mTOR-сигнальных киназ в патофизиологии MDD (Jernigan et al., 2011). Кроме того, крысы, подвергшиеся воздействию CMS, обнаруживают значительное снижение фосфорилирования нескольких киназ в пути mTOR в миндалине стрессированных крыс (Chandran et al., 2013).
Рисунок 1. После блокады NMDAR фосфорилирование Akt активирует комплекс mTOR 1 (mTORC1), что приводит к усилению фосфорилирования p70S6K и увеличению трансляции белка за счет ингибирования 4E-BP и высвобождения eIF-4B .Глутамат связывает AMPAR, что вызывает деполяризацию мембраны, обеспечивая приток Ca 2+ через VDCC. Это приводит к высвобождению BDNF из синаптических пузырьков. Последующее связывание рецепторов TrkB индуцирует передачу сигналов ERK и Akt. Все эти пути сходятся, чтобы увеличить трансляцию синаптического белка и доставку рецепторов к клеточной мембране. Кроме того, активация mTORC2 с помощью S6 и ингибирование GSK-3 индуцирует активацию mTORC1 за счет повышенного фосфорилирования Akt. Кроме того, активация mTORC2 индуцирует передачу сигналов протеинкиназы C (PKC), которая регулирует актин и другие белки цитоскелета.
Имеется перевернутая U-образная форма, связанная с индуцированной кетамином активацией mTOR, при этом более высокие дозы не оказывают никакого эффекта. У грызунов введение кетамина индуцировало передачу сигналов mTOR примерно через 30 мин после инъекции. Ли и его коллеги выяснили некоторые основные особенности механизма действия кетамина, в первую очередь сосредоточив внимание на изменениях в формировании зависимых от mTOR синапсов в ПФК крыс (Li et al., 2010). Кроме того, они сообщили об увеличении фосфорилирования mTOR, киназы рибосомного белка S6 p70 кДа (p70S6K) и белка 1, связывающего фактор инициации эукариот 4E (4E-BP1).P70S6K необходим для подавления подавления eEF2, что предотвращает трансляцию белка. Одновременно фосфорилирование 4E-BP1 приводит к высвобождению эукариотического фактора инициации трансляции 4E (eIF-4E), тем самым запуская инициацию трансляции синаптических белков. Эти изменения сопровождались антидепрессантоподобным поведением в тестах FST и NSF (Li et al., 2010).
mTOR экспрессируется повсеместно и, как было обнаружено, локализуется в цитоплазме дендритов, где он может инициировать трансляцию синаптических белков, необходимых для индукции LTP (Duman et al., 2012). PSD95, GluR1 и синапсин активируются примерно через 2 часа после кетамина; это увеличение наблюдается до 72 часов. Сходным образом активация Arc, цитоскелетного белка наблюдается примерно через 1 час после инъекции и сохраняется до 6 часов (Li et al., 2010). Arc связана с индукцией ранней и поздней фаз LTP и формированием памяти (Panja et al., 2009). Недавнее исследование подтвердило, что кетамин и MK-801 вызывают увеличение непосредственно ранних генов, таких как Arc, C-fos и Homer1a. Передача сигналов Homer1a / Homer1b / PSD-95 участвует в индуцированной глутаматом синаптической пластичности (de Bartolomeis et al., 2013) и может быть интересным маркером пластичности для кетаминоподобных соединений. Сходным образом снижение экспрессии фактора элонгации эукариот 2 (eEF2) постоянно наблюдается у грызунов после введения кетамина как в PFC (Carrier and Kabbaj, 2013), так и в гиппокамп (Autry et al., 2011). Интересно, что женщины более чувствительны к поведенческим эффектам низких доз кетамина по сравнению с мужчинами; однако у самок не наблюдается снижения eEF2 (Carrier and Kabbaj, 2013).Тем не менее, фосфорилирование и ингибирование eEF2 может быть полезным маркером для быстрых антидепрессантов, поскольку повышенное фосфорилирование eEF2 в PFC также сообщается после хронического лечения флуоксетином у крыс (Dagestad et al., 2006).
Фармакологическая модуляция различных компонентов сигнального пути mTOR (рис. 1) была использована для исследования механизмов, лежащих в основе острых и длительных поведенческих действий кетамина. Ингибирование Akt после блокады фосфатидилинозитол-3-киназы (PI3K) с помощью LY294002 и ингибирование ERK с использованием U0126 предотвращало кетаминовую реверсию дефицита, вызванного CMS (Li et al., 2010). Ингибитор Trk / B K252a блокировал эффекты кетамина в TST и NSF при тестировании через 24 часа, но не через 1 час (Koike et al., 2013b). Комплекс рапамицин-FKBP12 ингибирует передачу сигналов mTOR при прямом связывании с mTORC1 (Hoeffer and Klann, 2010). Предварительная обработка рапамицином подавляла как молекулярные, так и поведенческие эффекты кетамина на FST, NSF и LH через 24 часа после инъекции (Li et al., 2010). Кроме того, введение рапамицина не подавляло эффекты кетамина в тесте NSF через 30 минут после инъекции, но эффекты кетамина полностью блокировались через 24 часа после инъекции (Iijima et al., 2012). Таким образом, похоже, что передача сигналов mTOR явно связана с длительными поведенческими эффектами кетамина, измеряемыми на 24 часа позже или дольше, но другие механизмы могут быть вовлечены в непосредственные эффекты кетамина, такие как усиление активации AMPAR. Интересно отметить, что другие антидепрессанты, включая антагонисты рецепторов 5-HT 2C , циталопрам и электросудорожные припадки (ECS, эквивалент ECT у грызунов), все повышают уровни mTORC1 (Elfving et al., 2013; Opal et al., al., 2013). Однако SSRI, сертралин и TCA, имипрамин, на самом деле обладают антипролиферативными эффектами, которые опосредуются ингибированием mTOR (Lin et al., 2010; Jeon et al., 2011). Кроме того, есть данные, свидетельствующие о том, что введение одного рапамицина и последующее ингибирование передачи сигналов mTOR способны вызывать эффекты, подобные антидепрессантам, в FST крыс (Cleary et al., 2008). Более того, эффекты долговременной модуляции mTOR еще предстоит оценить. Эти данные указывают на то, что роль передачи сигналов mTOR может быть более сложной, чем предполагалось изначально.
Другие препараты использовались для выявления нервных механизмов, которые могут объяснить поведенческие эффекты кетамина, подобные антидепрессантам. Блокада рецептора NMDA с использованием MK-801 или CPP уменьшала неподвижность в FST на срок до 3 и 24 часов соответственно, но ни одно соединение не воспроизводило длительные эффекты кетамина с более длительными интервалами (Autry et al., 2011). Было высказано предположение, что антагонист NR2B RO-25-6981 индуцирует передачу сигналов mTOR, что приводит к аналогичным молекулярным и поведенческим эффектам, которые наблюдаются после введения кетамина (Maeng et al., 2008; Ли и др., 2010). Кроме того, антагонисты рецептора mGlu2 / 3 LY341495 и MGS0039 уменьшали время неподвижности при TST. NBQX оказывал ограниченное действие на эти антагонисты, тогда как рапамицин обращал поведенческие эффекты этих соединений через 24 часа после лечения, предполагая роль передачи сигналов mTOR, но не AMPA, в опосредовании антидепрессантоподобных эффектов антагонистов mGluR2 / 3 (Koike et al. ., 2011а). Антагонист mGluR5 MPEP индуцировал антидепрессантоподобные эффекты в NSF через 30 минут и 24 часа после инъекции (Iijima et al., 2012). Эффекты через 24 часа блокировались рапамицином и ингибитором синтеза белка анизомицином, но не ингибитором TrkB K252a. Кроме того, агонист mGluR7 AMN082 вызывал антидепрессантный эффект в течение 40 минут после инъекции TST, который был отменен предварительной обработкой NBQX, что позволяет предположить, что AMPA опосредует антидепрессивный эффект этого соединения (Bradley et al., 2012). Наконец, функциональный частичный агонист глицина GLYX-13 проявлял антидепрессантный эффект в тестах FST, NIH и LH, который длился 24 часа после инъекции, аналогично эффектам кетамина (Burgdorf et al., 2013). Эти данные предполагают, что при исследовании потенциала новых соединений, воздействующих на глутамат, следует оценивать опосредование как mTOR, так и AMPA. Кроме того, важно выбрать подходящий штамм грызунов для проведения этих анализов. Например, мыши CD-1 нечувствительны к модуляции глутаматергической системы и последующим антидепрессантоподобным эффектам AMNO82 и отрицательного модулятора mGluR 7 MMPIP (O’Connor and Cryan, 2013).
Нейротрофический фактор головного мозга (BDNF)
Хронический прием антидепрессантов увеличивает количество нейротрофинов, включая BDNF (Duman and Monteggia, 2006).BDNF имеет высокое сродство к рецептору тирозинкиназы B (TrkB), активируя ряд сигнальных путей, регулирующих рост и выживание нейронов. Этот путь также регулирует фосфорилирование белка, связывающего элемент ответа cyclic-amp (CREB), который является неотъемлемой частью аффективного поведения, помимо обучения и памяти (Autry and Monteggia, 2012). Посмертные исследования сообщили о снижении экспрессии BDNF и TrkB в гиппокампе и ПФК пациентов с БДР и депрессивных суицидов (Krishnan et al., 2007; Кастрен и Рантамаки, 2010; Ю и Чен, 2011). Модели хронического стресса и депрессии на грызунах воспроизвели эти региональные изменения BDNF (Duman and Monteggia, 2006; Autry and Monteggia, 2012). На поведенческом уровне введение BDNF снижает неподвижность FST (Shirayama et al., 2002; Hoshaw et al., 2005; Deltheil et al., 2008). Кроме того, сверхэкспрессия рецепторов TrkB ведет к поведенческому фенотипу, подобному антидепрессанту, у мышей (Koponen et al., 2004). Мыши с дефицитом BDNF в некоторых поведенческих тестах похожи на депрессивные и не реагируют на обычные антидепрессанты при CMS и FST по сравнению с мышами дикого типа (Saarelainen et al., 2003; Монтеджиа и др., 2007; Ибаргуен-Варгас и др., 2009).
Активация пути mTOR кетамином усиливает трансляцию BDNF в гиппокампе (Garcia et al., 2008a; Autry et al., 2011; Yang et al., 2012). Предполагается, что ингибирование eEF2 и последующее увеличение трансляции BDNF опосредуют быстрые антидепрессантоподобные эффекты кетамина (Monteggia et al., 2013). В равной степени кетамин способен вызывать быстрое высвобождение глутамата. После блокады рецептора NMDA активация AMPAR приводит к притоку кальция через потенциалзависимые кальциевые каналы L-типа (VDCC), вызывая высвобождение BDNF из синаптических везикул (см. Рисунок 1).Более того, BDNF регулирует функцию mTOR нейронов посредством Akt и PI3K, создавая петлю положительной обратной связи продукции BDNF после активации mTOR кетамином (Hay and Sonenberg, 2004; Hoeffer and Klann, 2010).
Полиморфизм одного нуклеотида Val66Met (rs6265) в гене BDNF был предложен как потенциальное препятствие для антидепрессивного ответа на кетамин у пациентов с TRD. Носители Val / Val более чувствительны к антидепрессивным эффектам кетамина по сравнению с носителями Val / Met (Laje et al., 2012). Однако не во всех исследованиях сообщается о положительной корреляции улучшения депрессивных симптомов с увеличением BDNF (Machado-Vieira et al., 2009; Rybakowski et al., 2013). Стоит отметить, что сывороточные концентрации BDNF были значительно ниже у пациентов с биполярным расстройством, которые не ответили на лечение кетамином, по сравнению с респондентами на исходном уровне (Rybakowski et al., 2013). Мыши, обладающие этим полиморфизмом, не реагировали на кетамин и демонстрировали значительные нарушения синаптогенеза (Lindholm et al., 2012; Лю и др., 2012). Однако при более высоких дозах, повторном дозировании или непрерывной инфузии кетамина уровни BDNF повышались, хотя это повышение коррелировало с нейродегенерацией и когнитивным дефицитом (Ibla et al., 2009; Goulart et al., 2010). Точно так же люди, хронически злоупотребляющие кетамином, демонстрируют более высокие концентрации BDNF по сравнению со здоровыми людьми из контрольной группы (Ricci et al., 2011).
Являясь последующим продуктом множества сигнальных каскадов, индуцированных кетамином, продукция BDNF происходит быстро и может лежать в основе длительной поведенческой реакции на кетамин.Действительно, острая внутривенная инфузия как BDNF, так и инсулиноподобного фактора роста (IGF-1) способна опосредовать длительные антидепрессантоподобные эффекты в FST, продолжающиеся до 6 дней после инфузии (Hoshaw et al., 2008). Эти данные не только указывают на то, что изменения уровней BDNF, скорее всего, связаны с длительными эффектами кетамина, но также подтверждают, что быстрое и стойкое увеличение нейротрофинов является полезными маркерами новых быстродействующих антидепрессантов.
Гликоген-синтаза-киназа-3 (GSK-3)
GSK-3 представляет собой серин / треониновую протеинкиназу и является основной мишенью для стабилизатора настроения лития (Klein and Melton, 1996; Stambolic et al., 1996). Пациентам с TRD часто назначают период усиленной антидепрессивной терапии литием, когда они не реагируют на только СИОЗС (Carvalho et al., 2007; Bauer et al., 2010). Более того, исследования показали, что GSK-3 функционально регулируется посредством модуляции серотонина, в первую очередь опосредованной ауторецепторами 5-HT 1A и посредством передачи сигналов iPI3K / Akt (Polter et al., 2012). Гетерозиготные мыши GSK-3β — демонстрируют значительное снижение неподвижности в FST (O’Brien et al., 2004). Интересно, что мыши с нокаутной мутацией GSK-3, которая предотвращает его фосфорилирование, не реагируют на лечение кетамином в парадигме ЛГ, что позволяет предположить, что некоторая потенциальная терапевтическая эффективность кетамина может быть опосредована после ингибирования этой киназы (Beurel et al. , 2011). Кроме того, комбинация кетамина и ингибитора GSK-3, SB216763, значительно снижает неподвижность при FST; на молекулярном уровне эта комбинация кетамина и SB216763 увеличивала частоту 5-HT и гипокретин-индуцированных EPSC и увеличивала плотность шипов в mPFC.Напротив, было показано, что кетамин имеет ограниченное влияние на экспрессию GSK-3 в синаптосомах гиппокампа (Muller et al., 2013). Более того, однократная доза кетамина полностью изменила поведенческие эффекты CMS, но ингибитор GSK-3 SB216763 не повлиял на показатели поведения, вызванные CMS (Ma et al., 2013). Необходимы дальнейшие доклинические исследования для оценки роли GSK-3β в антидепрессантоподобном ответе на кетамин. Недавняя оценка трех пациентов с депрессией указывает на значительное увеличение фосфорилированного GSK-3β в плазме пациентов, получавших кетамин, в течение 120-минутного периода оценки (Yang et al., 2013а). Хотя ингибирование GSK-3β модулирует передачу сигналов m-TOR (рис. 1) и потенциально может усиливать эффекты антидепрессантов, таких как кетамин, неясно, опосредует ли GSK-3 напрямую эффекты кетамина.
Заключение и дальнейшие направления
Разработка кетамина как быстродействующего антидепрессанта может произвести революцию в клиническом лечении. Тем не менее, клиническое использование кетамина при депрессии сопряжено с рядом проблем. Кетамин — это галлюциногенный препарат, которым можно злоупотреблять, и его следует давать в контролируемых условиях.Эффекты кетамина непродолжительны и могут быть поддержаны только его повторным лечением. Желательным направлением исследований была бы разработка других препаратов с аналогичным антидепрессивным действием, лишенных кетаминовых свойств. Однако прогресс в этой области сдерживается неуверенностью в отношении критических фармакологических механизмов, лежащих в основе антидепрессивных эффектов кетамина.
Модели на животных могут продемонстрировать фармакологические эффекты кетамина, которые наиболее важны для его клинических антидепрессивных эффектов.В настоящее время значительный объем литературы указывает на то, что кетамин оказывает сходное с антидепрессантом действие в доклинических тестах на антидепрессивную активность и в моделях депрессии на животных. Острый кетамин немедленно влияет на многие поведенческие тесты, аналогичные антидепрессантам. Однако длительные эффекты кетамина, измеряемые в течение нескольких дней после однократного приема, не вызываются обычными антидепрессантами. Они определяют новую парадигму открытия антидепрессантов, которая наилучшим образом коррелирует во времени с клинической активностью кетамина.Непоследовательные результаты по лабораториям могут возникать из-за различий в методологии, используемой в исследованиях. Наиболее подходящими переменными являются то, что эффективная доза зависит от используемой поведенческой задачи, условий, связанных с введением, и времени тестирования после введения кетамина. Например, данные свидетельствуют о том, что эффекты низких и, казалось бы, неэффективных доз кетамина более эффективны после воздействия стресса. Поведенческие тесты с высокой прогностической достоверностью для антидепрессантоподобных эффектов, такие как FST, чувствительны к острым и хроническим проявлениям кетамина.Их можно использовать в сочетании с другими тестами, чувствительными только к хроническому лечению антидепрессантами, такими как NSF / SPT, для измерения длительных преимуществ, присущих только кетамину. В целом, сочетание стрессовой или генетической модели депрессии / тревоги с поведенческой оценкой в течение 1-2 недель после лечения низкими дозами кетамина даст наиболее достоверную и полезную информацию.
Среди множества препятствий на пути трансляции клинических антидепрессивных эффектов кетамина у разных видов стоит ряд ключевых фармакологических факторов.Путь введения кетамина в доклинических моделях — i.p. инъекция, тогда как внутривенная инфузия обычно используется в клинических испытаниях. Следовательно, при исследованиях на животных может быть полезно использовать внутривенную инфузию, где это возможно. Кроме того, уровни кетамина в плазме, контролируемые в первые 2 часа после введения, могут определить, обеспечивает ли доза / способ введения кетамина сопоставимую биодоступность для разных видов. Учитывая, что период полураспада кетамина короткий, разные уровни кетамина могут объяснять некоторые различия в поведенческих тестах.Однако кетамин больше не присутствует, если длительные поведенческие эффекты измеряются через несколько дней после приема. Эти длительные изменения являются результатом быстрых и устойчивых молекулярных изменений, вызванных однократным лечением кетамином. Кроме того, консервант бензетония хлорид (BCl) повсеместно используется в препаратах кетамина как для клинического, так и для доклинического применения. Хотя BCl присутствует в низких концентрациях, он может действовать синергетически с кетамином, подавляя мускариновые и α7-никотиновые рецепторы ацетилхолина (Durieux and Nietgen, 1997; Coates and Flood, 2001).Неизвестно, в какой степени аддитивные свойства BCl по индуцированной кетамином модуляции холинергической системы могут влиять на антидепрессантоподобный ответ на кетамин. В настоящем обзоре не было систематических доказательств того, что положительные или отрицательные результаты были связаны с источником кетамина в поведенческих исследованиях, рассмотренных здесь (таблицы 1, 2).
Механизмы, лежащие в основе эффектов кетамина, одновременная блокада рецепторов NMDA и активация рецепторов AMPA, являются неотъемлемой частью индукции антидепрессивного ответа.Долгосрочные последствия этих молекулярных изменений, вероятно, опосредуют длительные антидепрессантные эффекты кетамина, опосредованные повышенной синаптической пластичностью, выживанием и созреванием нейронов. Эти изменения происходят в течение нескольких часов после введения кетамина и происходят параллельно как с быстрыми, так и с длительными поведенческими эффектами в моделях депрессии на животных. Быстрая модуляция mTOR, его нижестоящих медиаторов, таких как Akt и ERK, и BDNF, представляют собой маркеры молекулярных коррелятов антидепрессивных эффектов кетамина и его способности изменять синаптическую пластичность.Новые терапевтические средства от TRD, вероятно, будут модулировать эти маркеры по временной схеме, аналогичной таковой для кетамина, и могут быть использованы для определения лучших фармацевтических агентов для лечения TRD.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Это исследование было поддержано грантами USPHS R01 MH0
и R01 MH086599.
Список литературы
aan het Rot, M., Collins, K. A., Murrough, J. W., Perez, A. M., Reich, D. L., Charney, D. S., et al. (2010). Безопасность и эффективность многократного внутривенного введения кетамина для лечения резистентной депрессии. Biol. Психиатрия 67, 139–145. DOI: 10.1016 / j.biopsych.2009.08.038
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Ан Хет Рот, М., Сарате, К. А. младший, Чарни, Д. С., и Мэтью, С. Дж. (2012). Кетамин от депрессии: что нам делать дальше? Biol.Психиатрия 72, 537–547. DOI: 10.1016 / j.biopsych.2012.05.003
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Акинфиресое, Л., Тизаби, Ю. (2013). Антидепрессивные эффекты комбинации AMPA и кетамина: роль гиппокампа BDNF, синапсина и mTOR. Психофармакология (Berl.) 230, 291–298. DOI: 10.1007 / s00213-013-3153-2
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Отри, А.Э., Адачи, М., Носырева, Э., Na, E. S., Los, M. F., Cheng, P. F., et al. (2011). Блокада рецепторов NMDA в состоянии покоя вызывает быстрый поведенческий антидепрессивный ответ. Природа 475, 91–95. DOI: 10.1038 / природа10130
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Bauer, M., Adli, M., Bschor, T., Pilhatsch, M., Pfennig, A., Sasse, J., et al. (2010). Растущая роль лития в лечении рефрактерных эпизодов большой депрессии: усиление приема антидепрессантов. Нейропсихобиология 62, 36–42.DOI: 10.1159 / 000314308
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Бехтхольт-Гомпф, А.Дж., Смит, К.Л., Джон, К.С., Канг, Х.Х., Карлезон, В.А. Младший, Коэн, Б.М. и др. (2011). Мыши CD-1 и Balb / cJ не проявляют стойких антидепрессантных эффектов кетамина в тестах на острую антидепрессивную эффективность. Психофармакология (Berl.) 215, 689–695. DOI: 10.1007 / s00213-011-2169-8
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Берман, Р.М., Каппиелло А., Ананд А., Орен Д. А., Хенингер Г. Р., Чарни Д. С. и др. (2000). Антидепрессивные эффекты кетамина у пациентов с депрессией. Biol. Психиатрия 47, 351–354. DOI: 10.1016 / S0006-3223 (99) 00230-9
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Beurel, E., Song, L., and Jope, R. S. (2011). Ингибирование киназы-3 гликогенсинтазы необходимо для быстрого антидепрессивного эффекта кетамина у мышей. Мол. Психиатрия 16, 1068–1070.DOI: 10.1038 / mp.2011.47
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Боднофф, С. Р., Сурани-Кадот, Б., Эйткен, Д. Х., Квирион, Р., и Мини, М. Дж. (1988). Эффекты хронического лечения антидепрессантами на животной модели беспокойства. Психофармакология (Berl.) 95, 298–302. DOI: 10.1007 / BF00181937
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Бурин М. (1997). Модели тревоги на животных: подходят ли они для прогнозирования действия лекарств у людей? Pol.J. Pharmacol . 49, 79–84.
Pubmed Реферат | Pubmed Полный текст
Брэдли С. Р., Усланер Дж. М., Флик Р. Б., Ли А., Грувер К. М. и Хатсон П. Х. (2012). Аллостерический агонист mGluR7 AMN082 производит эффекты, подобные антидепрессантам, модулируя глутаматергическую передачу сигналов. Pharmacol. Biochem. Поведение . 101, 35–40. DOI: 10.1016 / j.pbb.2011.11.006
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Бургдорф Дж., Чжан Х.Л., Николсон, К. Л., Балстер, Р. Л., Леандер, Дж. Д., Стэнтон, П. К. и др. (2013). GLYX-13, функциональный частичный агонист участка глицина рецептора NMDA, вызывает эффекты, подобные антидепрессантам, без побочных эффектов, подобных кетамину. Нейропсихофармакология 38, 729–742. DOI: 10.1038 / npp.2012.246
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Кальдароне, Б. Дж., Джордж, Т. П., Захариу, В., и Пиччиотто, М. Р. (2000). Гендерные различия в поведении выученной беспомощности зависят от генетического фона. Pharmacol. Biochem. Поведение . 66, 811–817. DOI: 10.1016 / S0091-3057 (00) 00271-9
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Карвалью А. Ф., Кавальканте Дж. Л., Кастело М. С. и Лима М. С. (2007). Стратегии увеличения лечения устойчивой депрессии: обзор литературы. J. Clin. Pharm. Ther . 32, 415–428. DOI: 10.1111 / j.1365-2710.2007.00846.x
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Кастрен, Э., и Рантамаки, Т. (2010). Роль нейротрофического фактора головного мозга в этиологии депрессии: значение для фармакологического лечения. Наркотики для ЦНС 24, 1–7. DOI: 10.2165 / 11530010-000000000-00000
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Чандран, А., Йо, А. Х., Джерниган, К. С., Легутко, Б., Остин, М. К., и Каролевич, Б. (2013). Сниженное фосфорилирование компонентов сигнального пути mTOR в миндалине крыс, подвергшихся хроническому стрессу. Прог. Neuropsychopharmacol. Биол. Психиатрия 40, 240–245. DOI: 10.1016 / j.pnpbp.2012.08.001
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Чоудари, П. В., Мольнар, М., Эванс, С. Дж., Томита, Х., Ли, Дж. З., Воутер, М. П. и др. (2005). Нарушение передачи глутаматергических и ГАМКергических сигналов коры головного мозга с вовлечением глии при депрессии. Proc. Natl. Акад. Sci. США . 102, 15653–15658. DOI: 10.1073 / pnas.05072
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Клири, К., Linde, J. A., Hiscock, K. M., Hadas, I., Belmaker, R.H., Agam, G., et al. (2008). Антидепрессивные эффекты рапамицина на животных моделях: значение ингибирования mTOR как новой мишени для лечения аффективных расстройств. Brain Res. Бык . 76, 469–473. DOI: 10.1016 / j.brainresbull.2008.03.005
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Коутс, К. М., и Флуд, П. (2001). Кетамин и его консервант, бензетония хлорид, ингибируют рекомбинантные альфа7 и альфа4бета2 нейронные никотиновые ацетилхолиновые рецепторы человека в ооцитах Xenopus. руб. J. Pharmacol . 134, 871–879. DOI: 10.1038 / sj.bjp.0704315
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Крус, С. Л., Соберанес-Чавес, П., Паес-Мартинес, Н., и Лопес-Рубалькава, К. (2009). Толуол оказывает сходное с антидепрессантом действие на двух моделях животных, используемых для скрининга антидепрессантов. Психофармакология (Berl.) 204, 279–286. DOI: 10.1007 / s00213-009-1462-2
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Крайан, Дж.F., Mombereau, C., и Vassout, A. (2005). Тест подвешивания за хвост как модель для оценки антидепрессивной активности: обзор фармакологических и генетических исследований на мышах. Neurosci. Biobehav. Ред. . 29, 571–625. DOI: 10.1016 / j.neubiorev.2005.03.009
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Крайан, Дж. Ф., Валентино, Р. Дж., И Луки, И. (2005). Оценка субстратов, лежащих в основе поведенческих эффектов антидепрессантов, с использованием модифицированного теста принудительного плавания на крысах. Neurosci. Biobehav. Ред. . 29, 547–569. DOI: 10.1016 / j.neubiorev.2005.03.008
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Дагестад, Г., Кейперс, С. Д., Мессауди, Э., и Брэмхэм, К. Р. (2006). Хронический флуоксетин вызывает регион-специфические изменения активности фактора трансляции eIF4E и eEF2 в головном мозге крысы. Eur. Дж. Neurosci . 23, 2814–2818. DOI: 10.1111 / j.1460-9568.2006.04817.x
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
да Силва, Ф.К., ду Карму де Оливейра Сито, М., да Силва, М. И., Моура, Б. А., де Акино Нето, М. Р. и др. (2010). Поведенческие изменения и прооксидантный эффект однократного введения кетамина мышам. Brain Res. Бык . 83, 9–15. DOI: 10.1016 / j.brainresbull.2010.05.011
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
de Bartolomeis, A., Sarappa, C., Buonaguro, E. F., Marmo, F., Eramo, A., Tomasetti, C., et al. (2013). Различные эффекты антагонистов рецепторов NMDA кетамина, MK-801 и мемантина на транскрипты постсинаптической плотности и их топографию: роль передачи сигналов Гомера и значение для новых антипсихотических и прогностических мишеней при психозе. Прог. Neuropsychopharmacol. Биол. Психиатрия 46C, 1–12. DOI: 10.1016 / j.pnpbp.2013.06.010
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Deltheil, T., Guiard, B.P, Guilloux, J.P., Nicolas, L., Delomenie, C., Reperant, C., et al. (2008). Последствия изменений уровней BDNF на нейротрансмиссию серотонина, экспрессию и функцию транспортера 5-HT: исследования на гиппокампе взрослых мышей. Pharmacol. Biochem. Поведение . 90, 174–183. DOI: 10.1016 / j.pbb.2007.09.018
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Diazgranados, N., Ibrahim, L., Brutsche, N.E., Newberg, A., Kronstein, P., Khalife, S., et al. (2010). Рандомизированное дополнительное исследование антагониста N-метил-D-аспартата при резистентной к лечению биполярной депрессии. Arch. Gen. Psychiatry 67, 793–802. DOI: 10.1001 / archgenpsychiatry.2010.90
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Дулава, С.К. и Хен Р. (2005). Последние достижения в экспериментальных моделях хронических антидепрессантов на животных: тест на гипофагию, вызванную новизной. Neurosci. Biobehav. Ред. . 29, 771–783. DOI: 10.1016 / j.neubiorev.2005.03.017
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Думан, Р. С., Ли, Н., Лю, Р. Дж., Дурик, В., и Агаджанян, Г. (2012). Сигнальные пути, лежащие в основе быстрого антидепрессивного действия кетамина. Нейрофармакология 62, 35–41. DOI: 10.1016 / j.neuropharm.2011.08.044
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Durieux, M. E., and Nietgen, G. W. (1997). Синергетическое ингибирование мускариновой передачи сигналов стереоизомерами кетамина и консервантом хлоридом бензетония. Анестезиология 86, 1326–1333. DOI: 10.1097 / 00000542-199706000-00014
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Эльфвинг, Б., Кристенсен, Т., Ратнер, К., Винеке, Дж., И Кляйн, А.Б. (2013). Кратковременная активация mTOR после принудительной тренировки на беговой дорожке у крыс. Synapse 67, 620–625. DOI: 10.1002 / syn.21668
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Энгин Э., Трейт Д. и Диксон К. Т. (2009). Анксиолитические и антидепрессивные свойства кетамина на поведенческих и нейрофизиологических моделях животных. Неврология 161, 359–369. DOI: 10.1016 / j.neuroscience.2009.03.038
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Фава, М., Rush, A.J., Alpert, J.E., Balasubramani, G.K., Wisniewski, S.R., Carmin, C.N., et al. (2008). Разница в результатах лечения у амбулаторных пациентов с тревожной и спокойной депрессией: отчет STAR * D. Am. J. Psychiatry 165, 342–351. DOI: 10.1176 / appi.ajp.2007.06111868
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Гарсия, Л.С., Комим, К.М., Валвассори, С.С., Реус, Г.З., Барбоза, Л.М., Андреацца, А.С., и др. (2008a). Острое введение кетамина вызывает эффекты, подобные антидепрессантам в тесте принудительного плавания, и увеличивает уровни BDNF в гиппокампе крыс. Прог. Neuropsychopharmacol. Биол. Психиатрия 32, 140–144. DOI: 10.1016 / j.pnpbp.2007.07.027
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Гарсия, Л. С., Комим, К. М., Вальвассори, С. С., Реус, Г. З., Андреацца, А. К., Стертц, Л. и др. (2008b). Хроническое введение кетамина вызывает у крыс эффекты, подобные антидепрессантам, не влияя на уровни белка нейротрофического фактора головного мозга в гиппокампе. Basic Clin. Pharmacol. Токсикол .103, 502–506. DOI: 10.1111 / j.1742-7843.2008.00210.x
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Гарсия, Л. С., Комим, К. М., Валвассори, С. С., Реус, Г. З., Стертц, Л., Капчински, Ф. и др. (2009). Лечение кетамином обращает вспять поведенческие и физиологические изменения, вызванные хроническим легким стрессом у крыс. Прог. Neuropsychopharmacol. Биол. Психиатрия 33, 450–455. DOI: 10.1016 / j.pnpbp.2009.01.004
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Гасеми, М., Раза, М., и Дехпур, А. Р. (2010). Антагонисты рецепторов NMDA усиливают антидепрессантные эффекты лития в тесте принудительного плавания на мышах. Дж. Психофармакол . 24, 585–594. DOI: 10.1177 / 026988110
45
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Джильуччи В., О’Дауд Г., Кейси С., Иган Д., Гибни С. и Харкин А. (2013). Кетамин вызывает устойчивую антидепрессантоподобную активность через серотонин-зависимый механизм. Психофармакология (Berl.) 228, 157–166. DOI: 10.1007 / s00213-013-3024-x
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Гуларт, Б. К., де Лима, М. Н., де Фариас, К. Б., Реолон, Г. К., Алмейда, В. Р., Кеведо, Дж. И др. (2010). Кетамин ухудшает консолидацию памяти распознавания и предотвращает вызванное обучением повышение уровней нейротрофических факторов головного мозга в гиппокампе. Неврология 167, 969–973. DOI: 10.1016 / j.neuroscience.2010.03.032
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Homayoun, H., и Moghaddam, B. (2007). Гипофункция рецептора NMDA оказывает противоположное действие на интернейроны префронтальной коры и пирамидные нейроны. Дж. Neurosci . 27, 11496–11500. DOI: 10.1523 / JNEUROSCI.2213-07.2007
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Хошоу, Б.А., Хилл, Т.И., Кроули, Дж. Дж., Мальберг, Дж. Э., Хаваджа, X., Розенцвейг-Липсон, С., и др. (2008). Поведенческие эффекты IGF-I, подобные антидепрессантам, вызваны усиленной передачей серотонина. Eur. J. Pharmacol . 594, 109–116. DOI: 10.1016 / j.ejphar.2008.07.023
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Хошоу, Б.А., Мальберг, Дж. Э., и Луки, И. (2005). Центральное введение IGF-I и BDNF приводит к длительным эффектам, подобным антидепрессантам. Мозг Рес . 1037, 204–208. DOI: 10.1016 / j.brainres.2005.01.007
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Хойер, К., Кранастер, Л., Янке, К., и Сарториус, А. (2013). Влияние анестетиков кетамина, этомидата, тиопентала и пропофола на параметры и качество приступов в электросудорожной терапии: ретроспективное исследование. Eur. Arch. Psychiatry Clin. Neurosci . DOI: 10.1007 / s00406-013-0420-5. [Epub перед печатью].
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Ибаргуен-Варгас, Ю., Сургет, А., Вурк, П., Леман, С., Андрес, К. Р., Гардье, А. М. и др. (2009). Дефицит BDNF не увеличивает уязвимость к стрессу, но ослабляет антидепрессантные эффекты при непредсказуемом хроническом легком стрессе. Behav. Мозг Res . 202, 245–251. DOI: 10.1016 / j.bbr.2009.03.040
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Ибла, Дж. К., Хаяши, Х., Байич, Д., и Сориано, С. Г. (2009). Длительное воздействие кетамина увеличивает уровни нейротрофических факторов головного мозга в развивающемся мозге крыс. Curr. Лекарственная безопасность . 4, 11–16. DOI: 10.2174 / 157488609787354495
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Ибрагим, Л., Диас Гранадос, Н., Джолковский, Л., Брутше, Н., Лакенбо, Д. А., Херринг, В. Дж. И др. (2012a). Рандомизированное плацебо-контролируемое перекрестное пилотное исследование перорального селективного антагониста NR2B MK-0657 у пациентов с резистентным к лечению большим депрессивным расстройством. J. Clin. Психофармакол . 32, 551–557. DOI: 10.1097 / JCP.0b013e31825d70d6
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Ибрагим, Л., Диазгранадос, Н., Франко-Шавес, Дж., Брутше, Н., Хентер, И.Д., Кронштейн, П. и др. (2012b). Курс улучшения депрессивных симптомов после однократной внутривенной инфузии кетамина по сравнению с добавлением рилузола: результаты 4-недельного двойного слепого плацебо-контролируемого исследования. Нейропсихофармакология 37, 1526–1533. DOI: 10.1038 / npp.2011.338
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Ибрагим, Л., Диазгранадос, Н., Лакенбо, Д. А., Мачадо-Виейра, Р., Бауман, Дж., Маллинджер, А. Г. и др. (2011).Быстрое уменьшение депрессивных симптомов с помощью антагониста N-метил-d-аспартата при большой депрессии, резистентной к ЭСТ. Прог. Neuropsychopharmacol. Биол. Психиатрия 35, 1155–1159. DOI: 10.1016 / j.pnpbp.2011.03.019
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Иидзима, М., Фукумото, К., и Чаки, С. (2012). Острые и устойчивые эффекты антагониста метаботропного рецептора глутамата 5 в тесте на кормление с подавлением новизны. Behav. Мозг Res .235, 287–292. DOI: 10.1016 / j.bbr.2012.08.016
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Ирвин, С. А., Иглевич, А., Нелесен, Р. А., Ло, Дж. Й., Карр, К. Х., Ромеро, С. Д. и др. (2013). Ежедневный пероральный кетамин для лечения депрессии и беспокойства у пациентов, получающих помощь в хосписе: открытое 28-дневное испытание, подтверждающее правильность концепции. J. Palliat. Мед . 16, 958–965. DOI: 10.1089 / jpm.2012.0617
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Ярвентауста, К., Chrapek, W., Kampman, O., Tuohimaa, K., Bjorkqvist, M., Hakkinen, H., et al. (2013). Эффекты S-кетамина в качестве анестезирующего адъюванта пропофола на терапевтическую реакцию на электросудорожную терапию при резистентной к лечению депрессии: рандомизированное пилотное исследование. J. ECT 29, 158–161. DOI: 10.1097 / YCT.0b013e318283b7e9
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Чон С. Х., Ким С. Х., Ким Ю., Ким Ю. С., Лим Ю., Ли Ю. Х. и др. (2011). Трициклический антидепрессант имипрамин вызывает гибель аутофагических клеток в клетках глиомы U-87MG. Biochem. Биофиз. Res. Commun . 413, 311–317. DOI: 10.1016 / j.bbrc.2011.08.093
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Джерниган, К. С., Госвами, Д. Б., Остин, М. К., Йо, А. Х., Чандран, А., Стокмайер, К. А., и др. (2011). Сигнальный путь mTOR в префронтальной коре нарушен при большом депрессивном расстройстве. Прог. Neuropsychopharmacol. Биол. Психиатрия 35, 1774–1779. DOI: 10.1016 / j.pnpbp.2011.05.010
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Иоффе, Р.Т., Бэгби Р. М. и Левитт А. (1993). Тревожная и спокойная депрессия. Am. J. Psychiatry 150, 1257–1258.
Pubmed Реферат | Pubmed Полный текст
Кавалали, Э. Т., и Монтеджиа, Л. М. (2012). Синаптические механизмы, лежащие в основе быстрого антидепрессивного действия кетамина. Am. J. Psychiatry 169, 1150–1156. DOI: 10.1176 / appi.ajp.2012.12040531
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Кесслер, Р. К., Чиу, В.Т., Демлер, О., Мерикангас, К. Р., Уолтерс, Э. Э. (2005). Распространенность, тяжесть и коморбидность 12-месячных расстройств DSM-IV в повторении Национального исследования коморбидности. Arch Gen Psychiatry 62, 617–627. DOI: 10.1001 / archpsyc.62.6.617
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Коике, Х., Иидзима, М., и Чаки, С. (2011a). Вовлечение млекопитающих-мишеней передачи сигналов рапамицина в антидепрессантоподобный эффект антагонистов метаботропных рецепторов глутамата II группы. Нейрофармакология 61, 1419–1423. DOI: 10.1016 / j.neuropharm.2011.08.034
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Коике, Х., Иидзима, М., и Чаки, С. (2011b). Участие рецептора AMPA как в быстрых, так и в устойчивых эффектах кетамина, подобных антидепрессантам, на животных моделях депрессии. Behav. Мозг Res . 224, 107–111. DOI: 10.1016 / j.bbr.2011.05.035
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Койке, Х., Иидзима, М., и Чаки, С. (2013a). Влияние кетамина и LY341495 на депрессивное поведение крыс, которым повторно вводили кортикостерон. Pharmacol. Biochem. Поведение . 107, 20–23. DOI: 10.1016 / j.pbb.2013.03.017
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Коике, Х., Фукумото, К., Иидзима, М., и Чаки, С. (2013b). Роль передачи сигналов BDNF / TrkB в антидепрессантоподобных эффектах антагониста метаботропных рецепторов глутамата группы II на животных моделях депрессии. Behav. Мозг Res . 238, 48–52. DOI: 10.1016 / j.bbr.2012.10.023
Pubmed Реферат | Pubmed Полный текст | CrossRef Полный текст
Копонен Э., Лаксо М. и Кастрен Э. (2004). Сверхэкспрессия полноразмерного рецептора нейротрофина trkB регулирует экспрессию связанных с пластичностью генов в мозге мышей. Brain Res. Мол. Мозг Res . 130, 81–94. DOI: 10.1016 / j.molbrainres.2004.07.010
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Кришнан, В., Хан, М. Х., Грэм, Д. Л., Бертон, О., Рентал, В., Руссо, С. Дж. И др. (2007). Молекулярные адаптации, лежащие в основе восприимчивости и устойчивости к социальному поражению в областях вознаграждения мозга. Ячейка 131, 391–404. DOI: 10.1016 / j.cell.2007.09.018
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Ладже, Г., Лалли, Н., Мэтьюз, Д., Брутше, Н., Чемерински, А., Акула, Н. и др. (2012). Полиморфизм нейротрофического фактора мозга Val66Met и антидепрессивная эффективность кетамина у пациентов с депрессией. Biol. Психиатрия 72, e27 – e28. DOI: 10.1016 / j.biopsych.2012.05.031
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Ли, Н., Ли, Б., Лю, Р. Дж., Банаср, М., Дуайер, Дж. М., Ивата, М. и др. (2010). Формирование mTOR-зависимых синапсов лежит в основе быстрого антидепрессивного действия антагонистов NMDA. Наука 329, 959–964. DOI: 10.1126 / science.11
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Ли, Н., Лю, Р. Дж., Дуайер, Дж. М., Банаср, М., Ли, Б., Сон, Х. и др. (2011). Антагонисты рецептора глутамата N-метил-D-аспартата быстро меняют поведенческий и синаптический дефицит, вызванный воздействием хронического стресса. Biol. Психиатрия 69, 754–761. DOI: 10.1016 / j.biopsych.2010.12.015
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Лин, К. Дж., Роберт, Ф., Сукари, Р., Мичник, С., и Пеллетье, Дж. (2010). Антидепрессант сертралин ингибирует инициацию трансляции, сокращая мишень рапамицина у млекопитающих. Cancer Res . 70, 3199–3208. DOI: 10.1158 / 0008-5472.CAN-09-4072
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Линдхольм, Дж. С., Аутио, Х., Веса, Л., Антила, Х., Линдеманн, Л., Хенер, М. С. и др. (2012). Подобные антидепрессантам эффекты глутаматергических препаратов кетамина и усилителя рецептора AMPA LY 451646 сохраняются у bdnf (+) / (-) гетерозиготных нулевых мышей. Нейрофармакология 62, 391–397. DOI: 10.1016 / j.neuropharm.2011.08.015
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Лю Р.Дж., Фучиками М., Дуайер Дж. М., Лепак А. Э., Думан Р. С. и Агаджанян Г. К. (2013). Ингибирование GSK-3 усиливает синаптогенные и антидепрессантные эффекты подпороговых доз кетамина. Нейропсихофармакология 38, 2268–2277. DOI: 10.1038 / npp.2013.128
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Лю Р. Дж., Ли Ф. С., Ли X. Y., Бамбико Ф., Думан Р. С. и Агаджанян Г. К. (2012). Аллель нейротрофического фактора мозга Val66Met нарушает базальный и стимулированный кетамином синаптогенез в префронтальной коре. Biol. Психиатрия 71, 996–1005. DOI: 10.1016 / j.biopsych.2011.09.030
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Лопес-Рубалькава, К., и Луки, И. (2000). Штаммовые различия в поведенческих эффектах антидепрессантов в тесте принудительного плавания на крысах. Нейропсихофармакология 22, 191–199. DOI: 10.1016 / S0893-133X (99) 00100-1
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Ma, X. C., Dang, Y.Х., Цзя, М., Ма, Р., Ван, Ф., Ву, Дж. И др. (2013). Длительное антидепрессивное действие кетамина, но не ингибитора киназы-3 гликогенсинтазы SB216763, в модели мышей с умеренным хроническим стрессом. PLoS ONE 8: e56053. DOI: 10.1371 / journal.pone.0056053
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Machado-Vieira, R., Yuan, P., Brutsche, N., DiazGranados, N., Luckenbaugh, D., Manji, H.K., et al. (2009). Нейротрофический фактор головного мозга и начальный антидепрессивный ответ на антагонист N-метил-D-аспартата. J. Clin. Психиатрия 70, 1662–1666. DOI: 10.4088 / JCP.08m04659
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Maeng, S., Zarate, C.A. мл., Du, J., Schloesser, R.J., McCammon, J., Chen, G., et al. (2008). Клеточные механизмы, лежащие в основе антидепрессивных эффектов кетамина: роль рецепторов альфа-амино-3-гидрокси-5-метилизоксазол-4-пропионовой кислоты. Biol. Психиатрия 63, 349–352. DOI: 10.1016 / j.biopsych.2007.05.028
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Мантовани, М., Пертиле Р., Каликсто Дж. Б., Сантос А. Р. и Родригес А. Л. (2003). Мелатонин оказывает сходный с антидепрессантом эффект в тесте подвешивания за хвост у мышей: доказательства участия рецепторов N-метил-D-аспартата и пути L-аргинин-оксид азота. Neurosci. Lett . 343, 1–4. DOI: 10.1016 / S0304-3940 (03) 00306-9
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Мэтью, С. Дж., Шах, А., Лапидус, К., Кларк, К., Ярун, Н., Остермейер, Б. и др.(2012). Кетамин для лечения устойчивой униполярной депрессии: современные данные. Наркотики для ЦНС 26, 189–204. DOI: 10.2165 / 11599770-000000000-00000
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Монтеджиа, Л. М., Гидеонс, Э., и Кавалали, Э. Т. (2013). Роль киназы фактора элонгации 2 эукариот в быстром антидепрессивном действии кетамина. Biol. Психиатрия 73, 1199–1203. DOI: 10.1016 / j.biopsych.2012.09.006
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Монтеджиа, Л.М., Луикарт, Б., Барро, М., Теобольд, Д., Малковска, И., Неф, С. и др. (2007). Условные нокауты нейротрофических факторов мозга показывают гендерные различия в поведении, связанном с депрессией. Biol. Психиатрия 61, 187–197. DOI: 10.1016 / j.biopsych.2006.03.021
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Мюллер, Х. К., Вегенер, Г., Либенберг, Н., Сарате, К. А. мл., Пополи, М., и Эльфвинг, Б. (2013). Кетамин регулирует механизм пресинаптического высвобождения в гиппокампе. J. Psychiatr. Res . 47, 892–899. DOI: 10.1016 / j.jpsychires.2013.03.008
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Мерроу, Дж. У., Иосифеску, Д. В., Чанг, Л. К., Аль-Джурди, Р. К., Грин, К. М., Перес, А. М. и др. (2013). Антидепрессивная эффективность кетамина при резистентной к лечению большой депрессии: двухэтапное рандомизированное контролируемое исследование. Am. J. Psychiatry 170, 1134–1142. DOI: 10.1176 / appi.ajp.2013.13030392
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
О’Брайен, В.Т., Харпер, А. Д., Джов, Ф., Вудгетт, Дж. Р., Маретто, С., Пикколо, С. и др. (2004). Гаплонедостаточность киназы-3бета гликогенсинтазы имитирует поведенческие и молекулярные эффекты лития. Дж. Neurosci . 24, 6791–6798. DOI: 10.1523 / JNEUROSCI.4753-03.2004
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
О’Коннор, Р. М., и Крайан, Дж. Ф. (2013). Эффекты модуляции рецептора mGlu7 в поведенческих моделях, чувствительных к действию антидепрессанта, у двух линий мышей. Behav. Pharmacol . 24, 105–113. DOI: 10.1097 / FBP.0b013e32835efc78
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Опал М. Д., Кленотич С. С., Мораис М., Бесса Дж., Винкль Дж., Дукас Д. и др. (2013). Антагонисты рецепторов серотонина 2С вызывают быстрое наступление антидепрессивных эффектов. Мол. Психиатрия . DOI: 10.1038 / mp.2013.144. [Epub перед печатью].
CrossRef Полный текст
Панджа, Д., Дагите, Г., Бидиности, М., Вибранд, К., Кристиансен, А.М., Зоненберг, Н. и др. (2009). Новый контроль трансляции в Arc-зависимой долгосрочной консолидации потенцирования in vivo . J. Biol. Chem . 284, 31498–31511. DOI: 10.1074 / jbc.M109.056077
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Париз, Э. М., Алькантара, Л. Ф., Уоррен, Б. Л., Райт, К. Н., Хадад, Р., Сиал, О. К. и др. (2013). Повторное воздействие кетамина вызывает устойчивый устойчивый фенотип у подростков и взрослых крыс. Biol. Психиатрия 74, 750–759. DOI: 10.1016 / j.biopsych.2013.04.027
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Peng, Y., Zhao, J., Gu, Q.H., Chen, R.Q., Xu, Z., Yan, J.Z., et al. (2010). Определенные механизмы доставки и экспрессии лежат в основе LTP и LTD синаптических ответов, опосредованных рецептором NMDA. Гиппокамп 20, 646–658. DOI: 10.1002 / hipo.20654
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Фелпс, Л.Э., Брутше, Н., Морал, Дж. Р., Лакенбо, Д. А., Манджи, Х. К., и Зарате, К. А. младший (2009). Семейный анамнез алкогольной зависимости и первоначальный антидепрессивный ответ на антагонист N-метил-D-аспартата. Biol. Психиатрия 65, 181–184. DOI: 10.1016 / j.biopsych.2008.09.029
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Полтер, А.М., Янг, С., Джоп, Р.С., и Ли, X. (2012). Функциональное значение регуляции киназы-3 гликогенсинтазы серотонином. Cell. Сигнал . 24, 265–271. DOI: 10.1016 / j.cellsig.2011.09.009
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Попик П., Кос Т., Сова-Кучма М. и Новак Г. (2008). Отсутствие стойких эффектов кетамина в моделях депрессии на грызунах. Психофармакология (Berl.) 198, 421–430. DOI: 10.1007 / s00213-008-1158-z
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Прескорн, С. Х., Бейкер, Б., Коллури, С., Меннити, Ф. С., Крамс, М., и Ланден, Дж. У. (2008). Инновационный дизайн для подтверждения концепции антидепрессивных эффектов селективного антагониста N-метил-D-аспартата субъединицы NR2B, CP-101,606, у пациентов с резистентным к лечению большим депрессивным расстройством. J. Clin. Психофармакол . 28, 631–637. DOI: 10.1097 / JCP.0b013e31818a6cea
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Райковска, Г., О’Дуайер, Г., Телеки, З., Штокмайер, К.А., и Мигель-Идальго, Дж. Дж. (2007). ГАМКергические нейроны, иммунореактивные в отношении связывающих кальций белков, уменьшаются в префронтальной коре при большой депрессии. Нейропсихофармакология 32, 471–482. DOI: 10.1038 / sj.npp.1301234
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Реус, Г. З., Стрингари, Р. Б., Рибейро, К. Ф., Ферраро, А. К., Витто, М. Ф., Ческонетто, П., и др. (2011). Лечение кетамином и имипрамином вызывает поведение, подобное антидепрессанту, и увеличивает уровни белков CREB и BDNF, а также фосфорилирование PKA и PKC в головном мозге крыс. Behav. Мозг Res . 221, 166–171. DOI: 10.1016 / j.bbr.2011.02.024
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Резин, Г. Т., Гонсалвес, К. Л., Дауфенбах, Дж. Ф., Фрага, Д. Б., Сантос, П. М., Феррейра, Г. К. и др. (2009). Острое введение кетамина отменяет ингибирование дыхательной цепи митохондрий, вызванное хроническим легким стрессом. Brain Res. Бык . 79, 418–421. DOI: 10.1016 / j.brainresbull.2009.03.010
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Риччи, В., Martinotti, G., Gelfo, F., Tonioni, F., Caltagirone, C., Bria, P., et al. (2011). Хроническое употребление кетамина увеличивает сывороточные уровни нейротрофического фактора головного мозга. Психофармакология (Berl.) 215, 143–148. DOI: 10.1007 / s00213-010-2121-3
CrossRef Полный текст
Роджерс, Р. Дж., Цао, Б. Дж., Далви, А., и Холмс, А. (1997). Животные модели тревоги: этологическая перспектива. Braz. J. Med. Биол. Res . 30, 289–304. DOI: 10.1590 / S0100-879X1997000300002
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Роза, А.О., Лин, Дж., Каликсто, Дж. Б., Сантос, А. Р., и Родригес, А. Л. (2003). Вовлечение рецепторов NMDA и L-аргинин-оксид азота в антидепрессантоподобные эффекты цинка у мышей. Behav. Мозг Res . 144, 87–93. DOI: 10.1016 / S0166-4328 (03) 00069-X
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Рыбаковский, Дж. К., Пермода-Осип, А., Скибинска, М., Адамски, Р., и Бартковска-Снятковска, А. (2013). Однократная инфузия кетамина при биполярной депрессии, резистентной к антидепрессантам: вовлечены ли нейротрофины? Хум.Психофармакол . 28, 87–90. DOI: 10.1002 / hup.2271
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Саарелайнен Т., Хендолин П., Лукас Г., Копонен Э., Сайранен М., Макдональд Э. и др. (2003). Активация рецептора нейротрофина TrkB индуцируется антидепрессантами и необходима для поведенческих эффектов, вызванных антидепрессантами. Дж. Neurosci . 23, 349–357. DOI: 0270-6474 / 02 / 220349-09
Pubmed Аннотация | Pubmed Полный текст
Шоссер, А., Серретти, А., Суэри, Д., Мендлевич, Дж., Зохар, Дж., Монтгомери, С. и др. (2012). Европейская группа по изучению устойчивой депрессии (GSRD) — куда мы дошли: обзор клинических и генетических данных. Eur. Нейропсихофармакол . 22, 453–468. DOI: 10.1016 / j.euroneuro.2012.02.006
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Сегмиллер Ф., Рутер Т., Линхардт А., Падберг Ф., Бергер М., Погарелл О. и др. (2013). Повторные инфузии S-кетамина при терапевтически резистентной депрессии: серия случаев. J. Clin. Pharmacol . 53, 996–998. DOI: 10.1002 / jcph.122
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Селигман М. Э., Вайс Дж., Вайнрауб М. и Шульман А. (1980). Справляющееся поведение: выученная беспомощность, физиологические изменения и усвоенная бездеятельность. Behav. Res. Ther . 18, 459–512. DOI: 10.1016 / 0005-7967 (80) -X
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Шираяма, Ю., Чен, А.С., Накагава, С., Рассел, Д. С., Думан, Р. С. (2002). Нейротрофический фактор головного мозга оказывает антидепрессивное действие в поведенческих моделях депрессии. Дж. Neurosci . 22, 3251–3261. DOI: 0270-6474 / 02 / 22325-11
Pubmed Аннотация | Pubmed Полный текст
Сольберг, Л. К., Баум, А. Э., Ахмадия, Н., Шимомура, К., Ли, Р., Турек, Ф. В. и др. (2004). Наследование депрессивного поведения у крыс по признаку пола и происхождения. Мамм. Геном 15, 648–662. DOI: 10.1007 / s00335-004-2326-z
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Souery, D., Oswald, P., Massat, I., Bailer, U., Bollen, J., Demyttenaere, K., et al. (2007). Группа по изучению резистентных клинических факторов, связанных с резистентностью к лечению при большом депрессивном расстройстве: результаты европейского многоцентрового исследования. J. Clin. Психиатрия 68, 1062–1070. DOI: 10.4088 / JCP.v68n0713
CrossRef Полный текст
Стамболик, В., Руэль, Л.и Вудгетт, Дж. Р. (1996). Литий подавляет активность киназы-3 гликогенсинтазы и имитирует бескрылую передачу сигналов в интактных клетках. Curr. Биол . 6, 1664–1668. DOI: 10.1016 / S0960-9822 (02) 70790-2
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Steru, L., Chermat, R., Thierry, B., and Simon, P. (1985). Тест подвешивания за хвост: новый метод скрининга антидепрессантов у мышей. Психофармакология (Berl.) 85, 367–370. DOI: 10.1007 / BF00428203
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Теджани-Батт, С., Kluczynski, J., и Pare, W.P. (2003). Штамм-зависимое изменение поведения после лечения антидепрессантами. Прог. Neuropsychopharmacol. Биол. Психиатрия 27, 7–14. DOI: 10.1016 / S0278-5846 (02) 00308-1
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Тизаби Ю., Бхатти Б. Х., Манае К. Ф., Дас Дж. Р. и Акинфиресой Л. (2012). Подобные антидепрессантам эффекты низкой дозы кетамина связаны с повышенным соотношением плотности рецепторов AMPA / NMDA в гиппокампе у самок крыс Wistar-Kyoto. Неврология 213, 72–80. DOI: 10.1016 / j.neuroscience.2012.03.052
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Триведи, М. Х., Фава, М., Вишневски, С. Р., Тасе, М. Е., Квиткин, Ф., Уорден, Д., и др. (2006). Увеличение количества медикаментов после неэффективности приема СИОЗС при депрессии. N. Engl. J. Med . 354, 1243–1252. DOI: 10.1056 / NEJMoa052964
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Уокер, А.К., Будац, Д. П., Бисулько, С., Ли, А. В., Смит, Р. А., Бендерс, Б. и др. (2013). Блокада рецептора NMDA кетамином устраняет вызванное липополисахаридом депрессивно-подобное поведение у мышей C57BL / 6J. Нейропсихофармакология 38, 1609–1616. DOI: 10.1038 / npp.2013.71
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Ван, X., Чен, Ю., Чжоу, X., Лю, Ф., Чжан, Т., и Чжан, К. (2012). Эффекты пропофола и кетамина как комбинированной анестезии при электросудорожной терапии у пациентов с депрессивным расстройством. J. ECT 28, 128–132. DOI: 10.1097 / YCT.0b013e31824d1d02
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Wang, X., Yang, Y., Zhou, X., Wu, J., Li, J., Jiang, X., et al. (2011). Предварительная обработка пропофолом усиливает эффекты, подобные антидепрессантам, вызванные однократным введением кетамина у крыс, прошедших тест принудительного плавания. Резолюция о психиатрии . 185, 248–253. DOI: 10.1016 / j.psychres.2010.04.046
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Уилл, К.К., Эйрд Ф. и Редей Э. Э. (2003). Селективно выведенные крысы Вистар-Киото: животная модель депрессии и гиперчувствительности к антидепрессантам. Мол. Психиатрия 8, 925–932. DOI: 10.1038 / sj.mp.4001345
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Виллнер П. (1997). Валидность, надежность и полезность модели хронического легкого стресса депрессии: 10-летний обзор и оценка. Психофармакология (Berl.) 134, 319–329. DOI: 10.1007 / с002130050456
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Виллнер, П. (2005). Пересмотр хронического легкого стресса (CMS): последовательность и поведенческое-нейробиологическое соответствие эффектов CMS. Нейропсихобиология 52, 90–110. DOI: 10.1159 / 000087097
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Янг, К., Ли, X., Ван, Н., Сюй, С., Янг, Дж., И Чжоу, З. (2012). Трамадол усиливает антидепрессивный эффект кетамина за счет повышения уровня нейротрофического фактора головного мозга и связанной с тропомиозином киназы B в гиппокампе крыс. Перед. Мед . 6, 411–415. DOI: 10.1007 / s11684-012-0226-2
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Ян, К., Чжоу, З. К., Гао, З. К., Ши, Дж. Й. и Ян, Дж. Дж. (2013a). Острое увеличение в плазме млекопитающих-мишеней рапамицина, гликогенсинтазы киназы-3бета и фосфорилирования эукариотического фактора элонгации 2 после лечения кетамином у трех пациентов с депрессией. Biol. Психиатрия 73, e35 – e36. DOI: 10.1016 / j.biopsych.2012.07.022a
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Ян, К., Ху, Ю. М., Чжоу, З. К., Чжан, Г. Ф., и Ян, Дж. Дж. (2013b). Острое введение кетамина крысам увеличивает уровни BDNF и mTOR в гиппокампе во время теста принудительного плавания. ИБП. J. Med. Sci . 118, 3–8. DOI: 10.3109 / 03009734.2012.724118
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Йилмаз А., Шульц Д., Аксой А. и Канбейли Р. (2002). Длительное действие анестезирующей дозы кетамина на поведенческое отчаяние. Pharmacol. Biochem. Поведение .71, 341–344. DOI: 10.1016 / S0091-3057 (01) 00693-1
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Сарате, К. А. мл., Мэтьюз, Д., Ибрагим, Л., Чавес, Дж. Ф., Марквардт, К., Уко, И., и др. (2013). Рандомизированное испытание неселективного блокатора каналов N-метил-d-аспартата с низким улавливанием при большой депрессии. Biol. Психиатрия 74, 257–264. DOI: 10.1016 / j.biopsych.2012.10.019
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Сарате, К.А. мл., Сингх, Дж. Б., Карлсон, П. Дж., Брутше, Н. Е., Амели, Р., Лакенбау, Д. А. и др. (2006). Рандомизированное испытание антагониста N-метил-D-аспартата при резистентной к лечению большой депрессии. Arch. Gen. Psychiatry 63, 856–864. DOI: 10.1001 / archpsyc.63.8.856
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Выявлен ключевой фактор антидепрессивного действия рыбьего жира
Был идентифицирован ключевой молекулярный механизм, лежащий в основе противовоспалительного, антидепрессивного и нейрозащитного действия омега-3 жирных кислот.
Результаты, которые могут привести к разработке новых методов лечения депрессии, представляют собой «первое свидетельство» того, что нейроны гиппокампа способны продуцировать два ключевых липидных метаболита эйкозапентаеновой кислоты (EPA) и докозагексаеновой кислоты (DHA) — липоксигеназу и цитохром. P450, ведущий исследователь Алессандра Борсини, доктор философии, рассказала Medscape Medical News .
Вот как EPA и DHA проявляют свои противовоспалительные и нейрогенные свойства in vitro, а также обладают антидепрессивными свойствами у пациентов с депрессией, сказал Борсини из Королевского колледжа Лондона, Великобритания.
«Действительно, мы нашли доказательства корреляции между повышенными уровнями этих метаболитов и уменьшением тяжести депрессивных симптомов у пациентов с большим депрессивным расстройством», — сказал Борсини.
Исследование было опубликовано в Интернете 16 июня в журнале Molecular Psychiatry .
«Впадина в тарелке»
Несмотря на известную роль воспаления при депрессии, по-прежнему отсутствуют данные, показывающие, что противовоспалительные стратегии являются эффективными, безопасными для повседневного использования и с четким механизмом действия, отмечают исследователи.
Борсини и его коллеги проверили теорию о том, что при метаболизме EPA и DHA некоторые из их метаболитов или липидных медиаторов могут защитить мозг от вредного воздействия воспаления. Они использовали подтвержденную in vitro модель клеток гиппокампа человека «депрессия в чашке», чтобы проверить свою теорию.
Они обнаружили, что обработка клеток гиппокампа человека EPA или DHA перед воздействием на них цитокинов предотвращает увеличение гибели клеток и снижение нейрогенеза.Оба этих воздействия ранее наблюдались в клетках, подвергшихся воздействию только цитокинов.
Они подтвердили, что эти эффекты были опосредованы образованием нескольких ключевых липидных медиаторов, продуцируемых EPA и DHA, а именно гидроксиэйкозапентаеновой кислоты, гидроксидокозагексаеновой кислоты, эпоксиэйкозатетраеновой кислоты (EpETE) и эпоксидокозапентаеновой кислоты (EpDPA).
Это первый раз, когда эти липидные медиаторы были обнаружены в нейронах гиппокампа человека, говорят исследователи.
Они также обнаружили, что обработка нейронов ингибитором ферментов увеличивает доступность двух из этих метаболитов (EpETE и EpDPA), что указывает на возможный путь оптимизации лечения в будущем.
Результаты были воспроизведены у 22 пациентов с большой депрессией, получавших EPA (3 г / день) или DHA (1,4 г / день) в течение 12 недель. В обеих группах лечение EPA или DHA было связано с увеличением их соответствующих метаболитов и значительным улучшением депрессивных симптомов.
Среднее снижение количества симптомов составило 64% и 71% в группах EPA и DHA, соответственно, и были некоторые свидетельства того, что более высокие уровни тех же метаболитов коррелировали с менее тяжелыми депрессивными симптомами.
«В течение некоторого времени мы знали, что омега-3 [полиненасыщенная жирная кислота (ПНЖК)] может вызывать антидепрессантные и противовоспалительные эффекты, но без дальнейшего понимания того, как это происходит в человеческом мозге, было трудно разработать методы лечения, «Борсини сказал в пресс-релизе.
«Наше исследование помогло пролить свет на молекулярные механизмы, вовлеченные в эти отношения, которые могут помочь в разработке потенциальных новых методов лечения депрессии с использованием омега-3 ПНЖК», — добавил Борсини.
«Мы должны проявлять осторожность при интерпретации данных, полученных в результате корреляции между уровнями метаболитов и депрессивными симптомами, поскольку результаты требуют дальнейшей проверки на более широкой выборке пациентов», — сказал Борсини.
«Важно подчеркнуть, что наше исследование не показало, что просто увеличивая количество омега-3 жирных кислот в нашем рационе или принимая пищевые добавки, мы можем уменьшить воспаление или депрессию», — автор исследования Кармин Парианте, доктор медицины, доктор философии, из Королевского колледжа. Лондон, говорится в сообщении.
« Механизмы, лежащие в основе ассоциации между депрессией и омега-3 ПНЖК, сложны и требуют дальнейших исследований и клинических испытаний, чтобы полностью понять, как они работают, и дать информацию для будущих терапевтических подходов», — сказал Парианте.
Нет клинических проявлений
Взвешивая это исследование в заявлении Центра научных СМИ, Кевин МакКонвей, заслуженный профессор прикладной статистики, Открытый университет, Милтон-Кейнс, Соединенное Королевство, сказал: «Цель исследования заключалась в том, чтобы пролить некоторый свет на механизмы в тело, в котором жирные кислоты омега-3 могут уменьшать воспаление или депрессию.«
«В исследовании в основном участвовали клетки в лабораторных блюдах, но оно также включало лечение небольшой выборки пациентов с большой депрессией, давая им добавки той или иной из двух исследуемых кислот омега-3 в течение 12 недель», — отметил он.
«Исследователи обнаружили, что средние баллы пациентов по стандартному набору вопросов, используемых для диагностики и измерения депрессии, улучшились за этот 12-недельный период для каждой из двух жирных кислот.
В то время как симптомы депрессии улучшились в течение 12 недель после лечения жирными кислотами омега-3, «симптомы депрессии все равно меняются со временем по многим причинам», а симптомы депрессии могли бы улучшиться в течение 12 недель, даже если бы пациенты не получали омега-3 кислоты. — сказал МакКонвей.
«Мы просто не можем сказать, так как каждый пациент получал жирные кислоты омега-3. Таким образом, эти результаты могут намекать на то, что жирные кислоты омега-3 могут помочь при депрессии, но это даже близко не показывает, что это так при разумной степени уверенность, — предупредил он.
«Действительно, исследователи не проводили эту часть своего исследования, чтобы увидеть, помогают ли добавки омега-3 при депрессии — они сделали это, чтобы увидеть, могут ли биохимические изменения, которые они наблюдали в клеточных культурах в лаборатории, также происходить у человека. тел », — отметил он.
Mol Psychiatry. Опубликовано онлайн 16 июня 2021 г. Полный текст
Это исследование частично финансировалось за счет грантов, предоставленных исследователям Совета медицинских исследований Великобритании, Европейской комиссии Horizon 2020 и Национального института медицинских исследований (NIHR), Центра биомедицинских исследований Модсли (BRC) в Южном Лондоне и Фонда Национальной службы здравоохранения Модсли. Доверие и Королевский колледж Лондона.Борсини получил финансирование от Johnson & Johnson для исследования депрессии и воспаления. МакКонвей является попечителем Научного медиа-центра и членом его консультативного комитета.
Чтобы узнать больше новостей Medscape Psychiatry, присоединяйтесь к нам в Twitter и Facebook.
Сообщаемые самостоятельно побочные эффекты антидепрессантов, приверженность лечению и связанные с этим факторы у пациентов с диагнозом депрессия в психиатрической больнице Непала
Цель .Настоящее исследование направлено на оценку побочных эффектов антидепрессантов, приверженности к лечению (МА) и связанных факторов у пациентов с диагнозом депрессия в психиатрической больнице в западном Непале. Методы . Проспективное кросс-секционное исследование было проведено среди 174 пациентов, обратившихся в поликлинику психиатрической больницы. Контрольный список побочных эффектов антидепрессантов (ASEC) использовался для классификации побочных эффектов антидепрессантов на легкие, средние и тяжелые.Для оценки нежелательных реакций использовалась шкала вероятности нежелательной лекарственной реакции (НЛР) Наранхо, а для определения степени приверженности к лечению — показатель приверженности к зеленому левину по Мориски (MGLA). Использовались описательная статистика и двумерный анализ, а значение <0,05 было принято как статистически значимое при многомерном анализе. Результатов . Пациенты были в основном женщины (55,74%) со средним (IQR) возрастом 32 (20) лет. Примерно 74,13% пациентов испытали побочные эффекты антидепрессантов, в том числе бессонницу (17.05%) и тревога (17,05%) были наиболее распространенными. Более половины пациентов (52,29%) имели низкий уровень приверженности. У женщин в 1,01 раза больше шансов отказаться от приема своих антидепрессантов по сравнению с мужчинами, скорректированное отношение шансов (AOR): 1,001 (0,31–1,63). Точно так же неграмотные пациенты, как правило, были менее приверженными по сравнению с грамотными, AOR: 1,342 (0,93–2,82), а у безработных в 1,5 раза больше шансов не придерживаться своих лекарств по сравнению с работающими людьми, AOR: 1.46 (1.16-4.13). Точно так же пациенты с тяжелыми побочными эффектами были более склонны к развитию несоблюдения режима лечения, чем пациенты с умеренными побочными эффектами, AOR: 1,173 (0,42–3,25). Была обнаружена значительная связь между оценкой Наранхо и приверженностью к лечению. Выводы . Это исследование предполагает, что побочные эффекты антидепрессантов были более распространенными, а приверженность к лечению была чрезвычайно низкой среди депрессивных пациентов в психиатрических больницах. Такие факторы, как пол, род занятий, образование, побочные эффекты и нежелательные реакции, объясняются плохой приверженностью к лечению пациентами.
1. Введение
Депрессия, распространенное хроническое психическое заболевание, влияет на физическую и умственную работоспособность, а также на социальную жизнь человека. Более 264 миллионов человек во всем мире страдают депрессией [1]. По оценкам Всемирной организации здравоохранения (ВОЗ), к 2020 году он станет второй по величине известной причиной инвалидности во всем мире [2], а к 2030 году он, возможно, станет самым значительным фактором, способствующим глобальному бремени болезней [3]. ].В Непале широко распространена депрессия, и он занимает второе место в мире по показателю «лет жизни с поправкой на инвалидность» [4]. В Непале каждый третий человек страдает психическим заболеванием, и более 90 процентов населения, нуждающегося в психиатрических услугах, не имеют доступа к лечению [4]. Первое полевое эпидемиологическое исследование, проведенное в долине Катманду правительством Непала в 1984 году, оценило распространенность психических заболеваний примерно в 14% [5].
Антидепрессанты часто считаются лучшим вариантом лечения депрессии [6].Рекомендации Американской психиатрической ассоциации (APA) (2010 г.) одобрили селективные ингибиторы обратного захвата серотонина (СИОЗС), ингибиторы обратного захвата серотонина и норадреналина (СИОЗСН) и селективные ингибиторы обратного захвата серотонина-норадреналина (СИОЗСН) в качестве лекарств первой линии благодаря их сходной эффективности и более низкая токсичность, связанная с передозировкой, по сравнению с трициклическими антидепрессантами и ингибиторами моноаминоксидазы [7].
Однако другие факторы, такие как профили побочных эффектов, стоимость, профиль безопасности, история предшествующего медикаментозного лечения и предпочтения пациентов, важны при первоначальном выборе антидепрессантов и должны учитываться медицинскими работниками [7, 8].В исследовании, проведенном в США, сообщалось, что пациенты с неприятными побочными эффектами с большей вероятностью не соблюдают прием антидепрессантов [9]. Это влияет на эффективность антидепрессантов [10]. Более того, побочные эффекты антидепрессантов являются важными детерминантами несоблюдения режима приема антидепрессантов, которое, по прогнозам, будет значительно высоким среди депрессивных людей [11]. Выявление побочных эффектов, связанных с лекарственными препаратами, будет направлять разработку политики для эффективного лечения тяжелых и вероятных типов побочных эффектов, а соблюдение режима лечения будет способствовать оценке эффективности вмешательств для улучшения терапевтических результатов.Таким образом, это исследование направлено на оценку побочных эффектов антидепрессантов, приверженности к лечению (МА) и связанных факторов у пациентов с диагнозом депрессия в психиатрической больнице в западном Непале.
2. Методы
2.1. Условия исследования
Проспективное перекрестное исследование было проведено в период с августа по октябрь 2019 года среди пациентов, посещающих амбулаторное отделение B.G. Больница. Б.Г. Больница — это психиатрическая больница на 25 коек, которая предоставляет как стационарные, так и амбулаторные услуги.Это единственная психиатрическая больница в районе Каски, расположенная в Покхара-12, Каски, Непал. Легкая доступность делает его одной из самых загруженных больниц в Покхаре.
2.2. Критерии отбора выборки
В исследование были включены все пациенты в возрасте ≥18 лет с диагнозом депрессия и принимавшие антидепрессанты в течение как минимум 1 месяца до начала исследования. Беременным или кормящим матерям; тем, у кого в анамнезе были психотические расстройства, биполярное расстройство или злоупотребление наркотиками; люди с когнитивными нарушениями; а те, кто не мог общаться и понимать непальский язык, были исключены из исследования.Для исключения пациентов с деменцией был выбран верхний возрастной предел 65 лет.
2.3. Размер выборки
Расчетный размер выборки для этого исследования составил 174. Он был рассчитан на основе исследования, проведенного в двух университетах Непала в 2016 году [12]. Согласно исследованию, распространенность депрессии составила 11,7%. Установив наихудший приемлемый уровень 5,0% и доверительный интервал 95,0%, размер выборки 158 был получен с использованием Epi Info 6. 10% из 158, то есть 16, было добавлено для компенсации ошибок.Таким образом, в исследование были включены 174 пациента.
2.4. Переменные исследования
Побочные эффекты антидепрессантов и уровни приверженности к лечению были нашими зависимыми переменными. Аналогичным образом, социально-демографические характеристики пациента, такие как возраст, пол, образование, род занятий и семейное положение, были независимыми переменными.
2,5. Инструменты и методика сбора данных
Данные собирались проспективно от пациентов и их рецептов путем общения с психиатрами.Была собрана информация о демографических данных (возраст, пол, образование, семейное положение, религия, род занятий и место жительства) и о назначенных антидепрессантах. Контрольный список побочных эффектов антидепрессантов (ASEC), который был разработан Королевским колледжем психиатров, использовался для классификации побочных эффектов, о которых сообщалось, на легкие, средние и тяжелые типы, поскольку он состоит из списка всех побочных эффектов, связанных с антидепрессантами. препараты [13]. Для оценки нежелательных реакций, связанных с антидепрессантами, использовалась шкала вероятности нежелательной лекарственной реакции (НЛР) Наранхо, состоящая из 10 пунктов.Согласно шкале, оценка> 9 указывает на определенную ADR, 5-8 указывает на вероятную ADR, 1-4 указывает на возможную ADR и 0 указывает на сомнительную ADR [14]. Аналогичным образом, для определения степени приверженности к лечению (МА) использовался показатель приверженности к зеленому левину по Мориски (MGLA). Оценка MGLA представляет собой структурированный инструмент из 4 пунктов, в котором четыре вопроса имеют дихотомические (да, нет) ответы [15]. В этом методе низкий уровень приверженности обозначался оценкой 3 или 4, средний уровень приверженности — оценкой 1 или 2, а высокий уровень приверженности — оценкой 0.Инструменты были переведены на непальский язык для облегчения понимания пациентами, и альфа Кронбаха инструмента оказалась равной 0,80. Клинический фармацевт собрал необходимые данные с помощью предварительно протестированного инструмента сбора структурированных данных.
2.6. Период сбора данных
С августа по октябрь 2019 г. был период сбора данных для исследования. Данные собирались шесть дней в неделю, то есть с воскресенья по пятницу, в амбулаторном отделении (OPD) с 11:00 до 16:00. (Время OPD).
2.7. Статистический анализ
Данные были введены в Microsoft Excel 2013. Введенные данные были перенесены в SPSS версии 20 для дальнейшего анализа. Был проведен одномерный, двумерный и многомерный анализ. В одномерном анализе были рассчитаны медиана, межквартильный размах, частота и процентное соотношение. Двумерный анализ независимых переменных с зависимой переменной / исходной переменной был выполнен с помощью перекрестной таблицы, и был выполнен критерий хи-квадрат Пирсона. Переменные, признанные значимыми при двумерном анализе, были включены в многомерный анализ и подогнаны с использованием бинарной логистической регрессии (метод ввода) с несоблюдением в качестве исходных переменных.Мера ассоциации была представлена как отношение шансов (OR) с 95,0% доверительным интервалом (CI). и считались статистически значимыми.
2,8. Этика
Этическое одобрение и разрешение на это исследование были получены от Институционального комитета по обзору (IRC) Исследовательского центра Университета Покхара (Ref. No. 18-076-077), а разрешение на сбор данных было получено из больницы до сбора данных. Письменное информированное согласие было получено от всех пациентов до их участия в исследовании, и вся информация сохранялась конфиденциальной.
3. Результаты
Всего к исследованию обратились 174 пациента, что дает 100% ответ. Более половины исследуемой популяции (97; 55,74%) составляли женщины со средним (IQR) возрастом 32 (20) лет. Большинство пациентов (146; 83,9%) исповедовали индуизм в религии. Пациенты исследования были преимущественно женатыми (120; 69%) и грамотными (124; 71,26%). Большинство пациентов были домохозяйками (64; 36,78%) и проживали в городских районах (133; 76,26%), как показано в таблице 1.
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| † Медиана (IQR) вместо (%). | ||||||||||||||||||||||||||||||||||||||||||||||||||
Из 174 пациентов 150 (86,20%) получали монотерапию. Из них СИОЗС были назначены 101 (58,04%) пациенту, СИОЗСН — 24 (13,79%), ТЦА — 17 (9,77%) и атипичные антидепрессанты — 8 (4,59%) пациентам соответственно. Наиболее часто назначаемым антидепрессантом был флуоксетин (40; 22.98%), как показано в таблице 2. Антидепрессанты, назначаемые в качестве комбинированной терапии, представлены в таблице 3.
| |||||||||||||||||||||
Из примерно 129 (74,13%) пациентов, столкнувшихся с побочными эффектами антидепрессантов, наиболее распространенными были бессонница и беспокойство (22; 17,05%), за которыми следовали сухость во рту (14; 10,85%) и прибавка в весе (13; 10.07%) соответственно. Пациенты редко сообщали о тахикардии (1; 0,77%). Пациенты, сообщавшие о побочных эффектах антидепрессантов, показаны на Рисунке 1. На основании ASEC, большинство побочных эффектов, о которых сообщалось, были умеренными (98; 56,32%), за которыми следовали тяжелые (22; 12,64%) и легкие (9; 5,17%) соответственно. На основе оценки Наранхо примерно 83,72% ADR были вероятными и 16,27% были возможными, как показано в таблице 4.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


