Что такое двойная связь: Двойная связь (химия) | это… Что такое Двойная связь (химия)?
Двойная связь | это… Что такое Двойная связь?
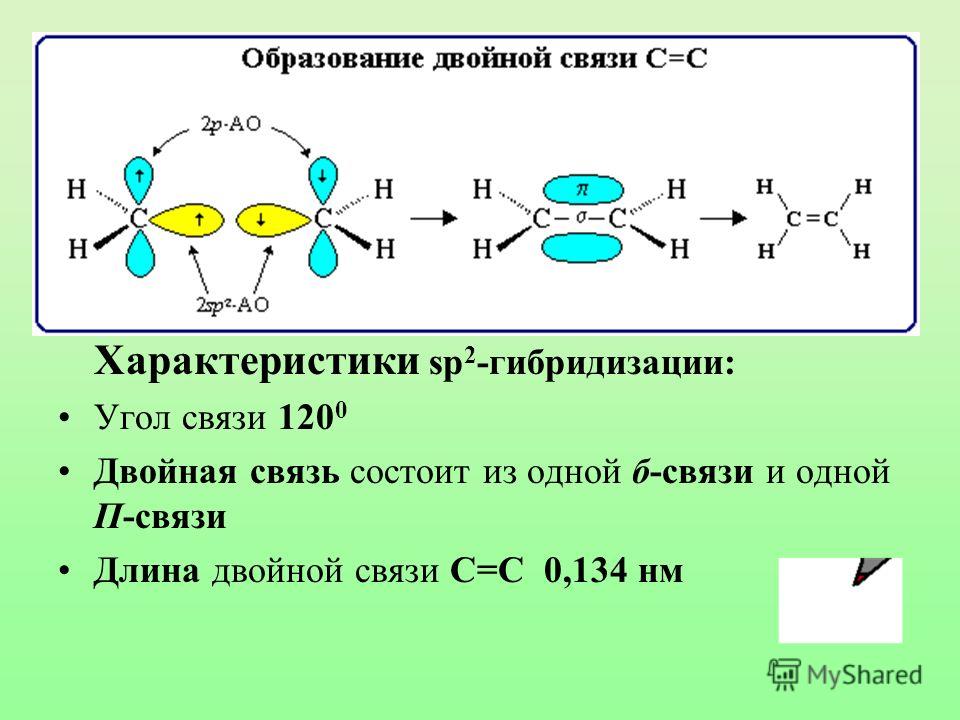
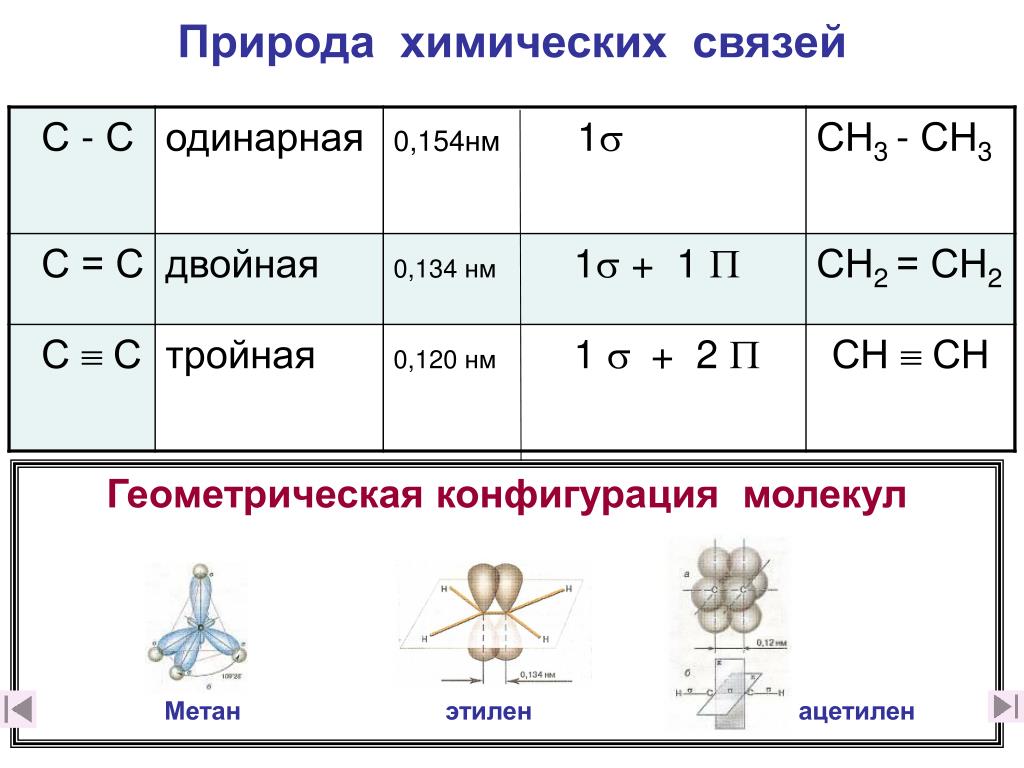
ковалентная четырёхэлектронная связь между двумя соседними атомами в молекуле. Д. с. обычно обозначается двумя валентными штрихами: >С=СC=N —, >С=О, >C=S, — N=N —, — Н=О и др. При этом подразумевается, что одна пара электронов с sp2 или sp — гибридизованными орбиталями образует σ-связь (см. рис. 1), электронная плотность которой сосредоточена вдоль межатомной оси; σ-связь подобна простой связи. Другая пара электронов с р-орбиталями образует π-связь, электронная плотность которой сосредоточена вне межатомной оси. Если в образовании Д. с. принимают участие атомы IV или V группы периодической системы, то эти атомы и атомы, связанные с ними непосредственно, расположены в одной плоскости; валентные углы равны 120°. В случае несимметричных систем возможны искажения молекулярной структуры. Д. с. короче простой связи и характеризуется высоким энергетическим барьером внутреннего вращения; поэтому положения заместителей при атомах, связанных Д.
В соединениях с двумя Д. с., разделёнными одной простой связью, имеет место сопряжение π-связей и образование единого π-электронного облака, лабильность которого проявляется вдоль всей цепи (рис. 2, слева). Следствием такого сопряжения является способность к реакциям 1,4-присоединения:
с., разделёнными одной простой связью, имеет место сопряжение π-связей и образование единого π-электронного облака, лабильность которого проявляется вдоль всей цепи (рис. 2, слева). Следствием такого сопряжения является способность к реакциям 1,4-присоединения:
Если три Д. с. сопряжены в шестичленном цикле, то секстет π-электронов становится общим для всего цикла и образуется относительно стабильная ароматическая система (см. рис. 2, справа). Присоединение к подобным соединениям как электрофильных, так и нуклеофильных реагентов энергетически затруднено. (См. также Химическая связь.)
Г. А. Сокольский.
Рис. 1. Схема двойной связи >С = С
Рис. 2. Системы сопряжённых связей (вид сверху).
Большая советская энциклопедия.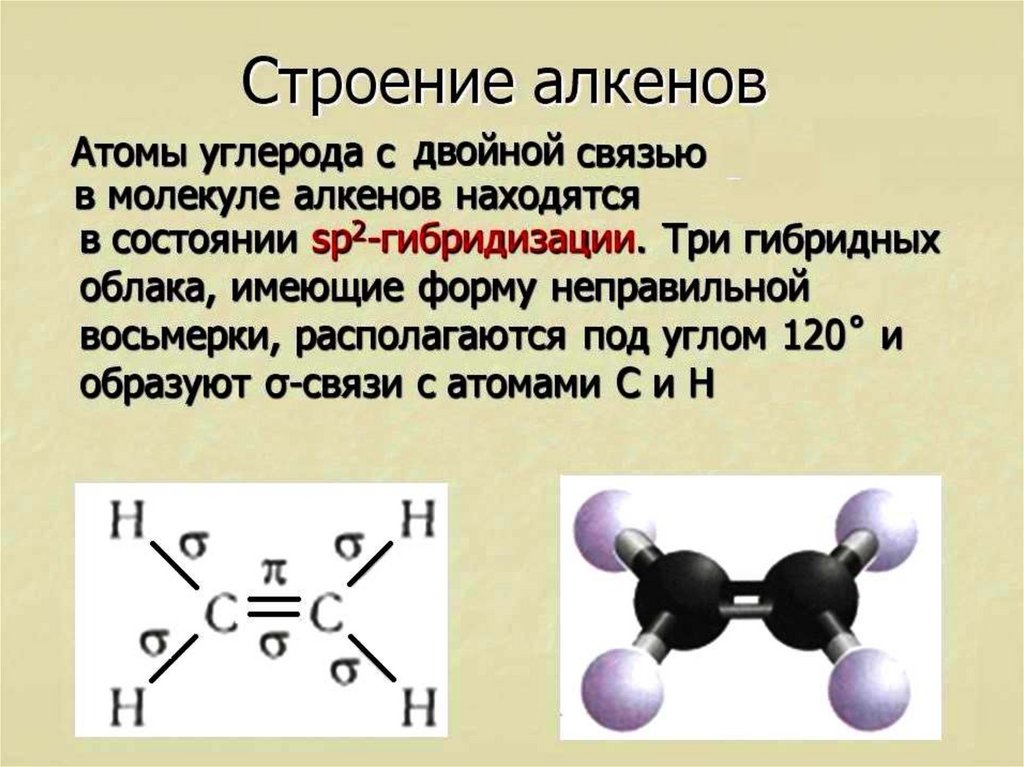 — М.: Советская энциклопедия.
1969—1978.
— М.: Советская энциклопедия.
1969—1978.
9 примеров двойной ковалентной связи: подробные пояснения —
By Адити Рой
Ковалентная двойная связь впервые была введена русским химиком Александром Бутлеровым. В этой статье кратко обсуждаются «примеры двойной ковалентной связи» различные типы двойной ковалентной связи с четкими пояснениями.
Примеры такие-
- Кислород
- Двуокись углерода
- Сернистый газ
- Диоксид азота
- Озон
- этилен
- Ацетон
- формальдегид
- Диметилсульфоксид
- Диазин
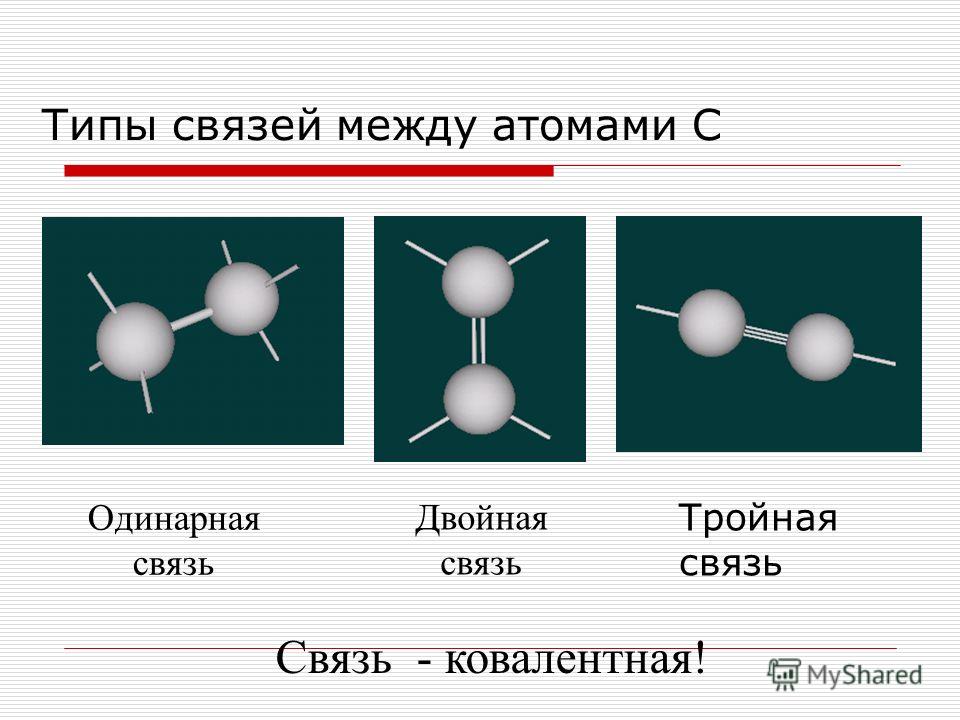
Ковалентная связь образуется из-за разделения электронов их внешней оболочки между участвующими атомами для образования связи. Совместное использование электронных пар между двумя атомами зависит от электроотрицательности соответствующего атома. Это может быть одинарная или сигма-связь, двойная или пи-связь и тройная связь.
Это может быть одинарная или сигма-связь, двойная или пи-связь и тройная связь.
Основная точка зрения статьи — двойная ковалентная связь. Двойные ковалентные связи образуются за счет перекрывания атомных орбиталей в латеральной ориентации. Двойная связь содержит одну сигма- и одну пи-связь. Двойные связи относительно короче и короче одинарной связи. Заказ облигаций двойной связи равно 2. Электронная плотность двойной связи больше и делает молекулу более реактивной по отношению к сильному акцептору электронов.
Кислороддвойной ковалентная связь образуется между двумя атомами кислорода путем обмена четырьмя электронными парами. Электроны с 2p-орбиталей участвуют в образовании двойной связи, что обозначается O=O.
Ковалентная связьИзображение Фото: Flickr.com
Углекислый газ
В двуокиси углерода две двойные связи присутствуют между углеродом и двумя кислородами и обозначаются как O=C=O.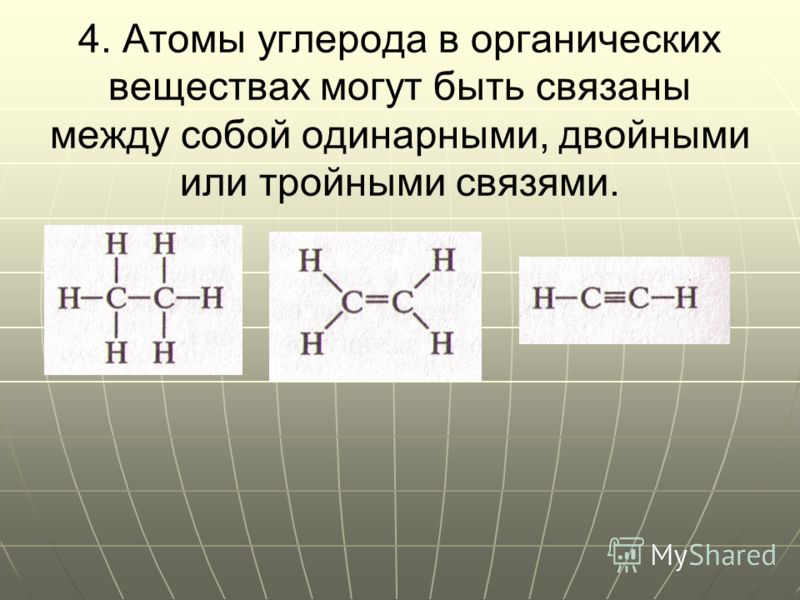 В образовании связи участвуют 2Р-орбитали как углерода, так и кислорода. Головное перекрытие между двумя орбиталями дает сигма-связь, а боковое перекрытие образует пи-связь между двумя атомами. После разделения двух электронов от каждого кислорода для образования двойной связи остальные четыре валентных электрона кислорода остаются в виде несвязанных электронных пар.
В образовании связи участвуют 2Р-орбитали как углерода, так и кислорода. Головное перекрытие между двумя орбиталями дает сигма-связь, а боковое перекрытие образует пи-связь между двумя атомами. После разделения двух электронов от каждого кислорода для образования двойной связи остальные четыре валентных электрона кислорода остаются в виде несвязанных электронных пар.
Изображение Фото: Wikimedia Commons.Диоксид серы
Связывание двуокиси серы аналогично двуокиси углерода. Строение и геометрия этих двух видов различны. Углекислый газ имеет линейную структуру, тогда как двуокись серы имеет угловую ориентацию. Как СО2, в СО2 сера имеет по одной двойной связи с каждым из атомов кислорода.
Сера делит свои четыре валентных электрона, а кислород делит два из четырех валентных электронов, образуя двойные связи. Таким образом, кислород имеет две несвязанные электронные пары, а сера имеет одну электронную пару в виде несвязанных электронных пар.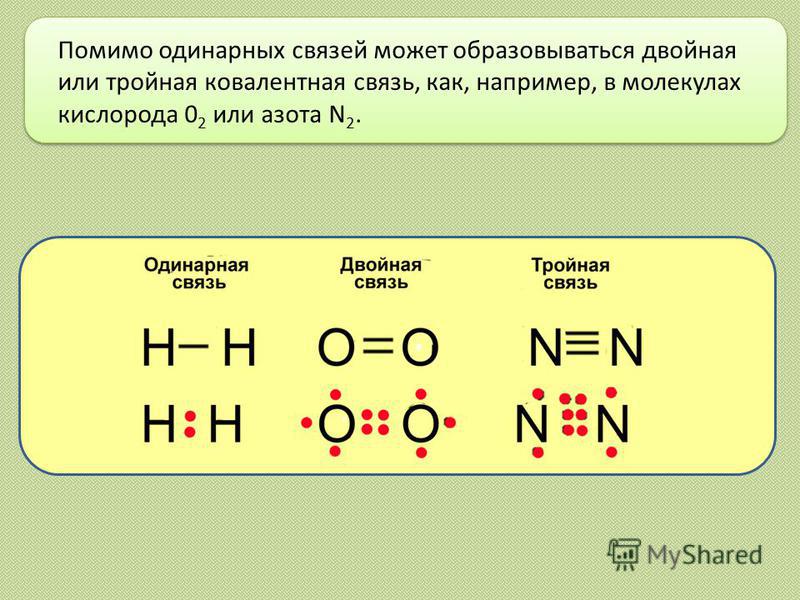
Чтобы узнать больше, пожалуйста, следуйте: 4 примера одинарных ковалентных связей: подробные сведения и факты
Диоксид азотаОн также имеет угловатую структуру (0) как диоксид серы. Написано как резонанс структура, в которой азот и кислород облигации эквивалентны. Азот связан одинарной связью с одним атомом кислорода и двойной связью с другим атомом кислорода. Но эти две связи почти одинаковы. Азот использует четыре из своих пяти электронов для образования ковалентной связи с кислородом, а остальная часть одного электрона остается несвязанной. Один из двух атомов кислорода использует два электрона, а другой не использует ни одного из своих валентных электронов для образования двойной и одинарной ковалентной связи с азотом соответственно.
Резонансная структура двойной связи диоксида азотаОзон
Это неорганическая газообразная молекула с изогнутой структурой, имеющая валентный угол 116. 8.0. Центральный кислород связан одной одинарной связью с кислородом и одной двойной связью с другим атомом кислорода. Это также выражается в виде резонансной структуры, такой как диоксид азота ( NO2). Центральный кислород использует свои четыре электрона для образования ковалентных связей, а другие атомы кислорода используют свои два электрона и не используют электроны для образования двойной связи и одинарной связи с центральным атомом кислорода соответственно.
8.0. Центральный кислород связан одной одинарной связью с кислородом и одной двойной связью с другим атомом кислорода. Это также выражается в виде резонансной структуры, такой как диоксид азота ( NO2). Центральный кислород использует свои четыре электрона для образования ковалентных связей, а другие атомы кислорода используют свои два электрона и не используют электроны для образования двойной связи и одинарной связи с центральным атомом кислорода соответственно.
Изображение Фото: Wikimedia Commons
Чтобы узнать больше, проверьте: Является ли O2 тройной связью: почему, как, характеристики и подробные факты
этиленВ этилене два атома углерода связаны двойной связью друг с другом, а четыре атома водорода связаны одинарной связью (по два в каждом углероде) с атомами углерода. Все эти шесть атомов (четыре атома водорода и два атома углерода) лежат в одной плоскости и образуют угол 117.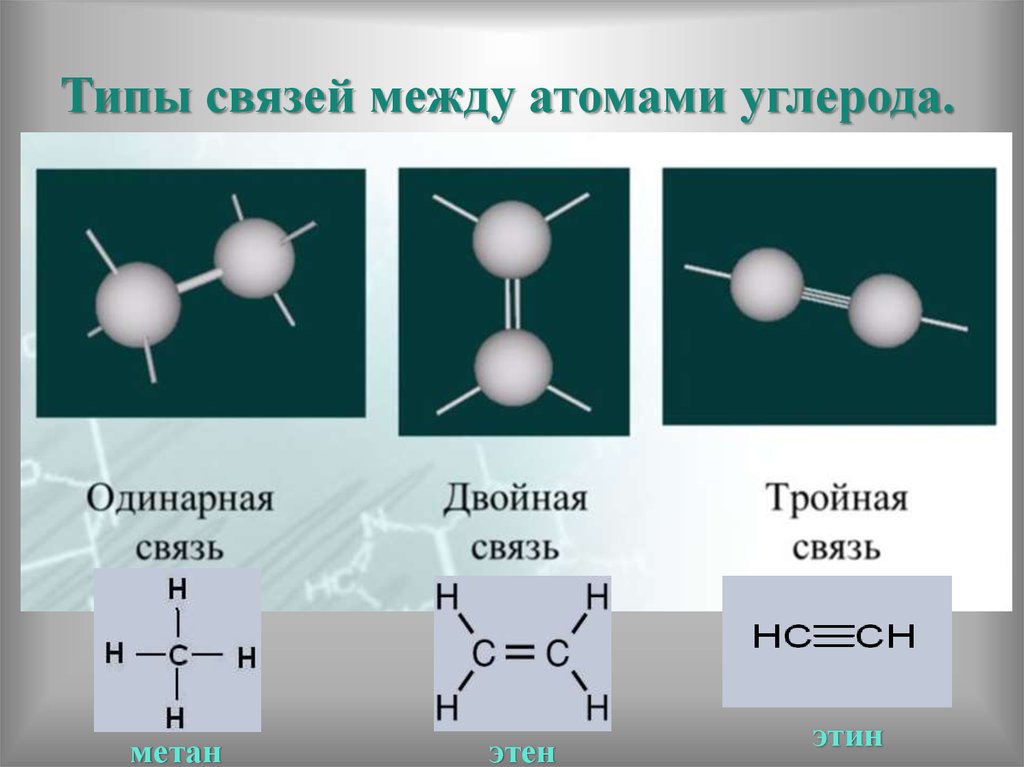 4°.0. 2рx Или 2py орбитали от каждого атома углерода перекрываются латерально друг с другом, образуя пи-связь, а сигма-связь образуется из-за перекрывания головы на 2pz орбитали.
4°.0. 2рx Или 2py орбитали от каждого атома углерода перекрываются латерально друг с другом, образуя пи-связь, а сигма-связь образуется из-за перекрывания головы на 2pz орбитали.
Ацетон представляет собой органическое жидкое соединение с высокой летучестью и горючестью. В ацетоне (CH3СОСН3), карбонильный атом углерода (не метильный углерод) связан с атомом кислорода двойной связью. Метиловый углерод ( CH3) связан с карбонильным углеродом одинарной ковалентной связью или сигма-связью. Два атома углерода метила также связаны с тремя атомами водорода (в каждом углероде) сигма-связью.
Чтобы узнать больше, проверьте: 4 примера неполярных ковалентных связей: подробные сведения и факты
формальдегидФормальдегид является простейшим альдегидом и летучим по своей природе. Подобно ацетону, карбонильный углерод связан с атомом кислорода двойной ковалентной связью, а две метильные группы замещены атомами водорода в формальдегиде.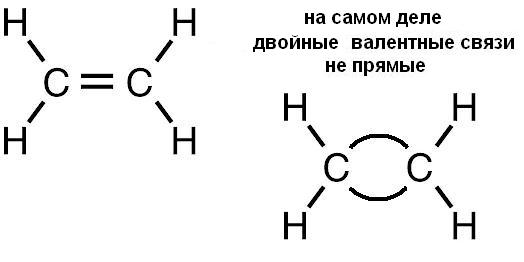 Два водорода связаны с карбонильным углеродом одной одинарной связью для каждого из атомов водорода.
Два водорода связаны с карбонильным углеродом одной одинарной связью для каждого из атомов водорода.
Диметилсульфоксид представляет собой сероорганическое соединение, широко используемое в качестве полярного апротонного растворителя. Эта бесцветная жидкость может растворять как полярный и неполярный вещество в нем. В его структуре атом серы связан с атомом кислорода двойной связью, а две метильные группы связаны с атомом серы одинарной ковалентной связью, известной как сигма-связь. Метильные атомы углерода также связаны с тремя водородными группами (в каждом углероде) одинарной связью.
Структура диметилсульфоксидаЧтобы узнать больше, пожалуйста, пройдите: 5+ примеров двойных облигаций: подробные сведения и факты
ДиазинДиазен, также известный как диимид, представляет собой соединение с молекулярной формулой (NH2)2. Он представлен двумя геометрическими изомерами (цис и транс).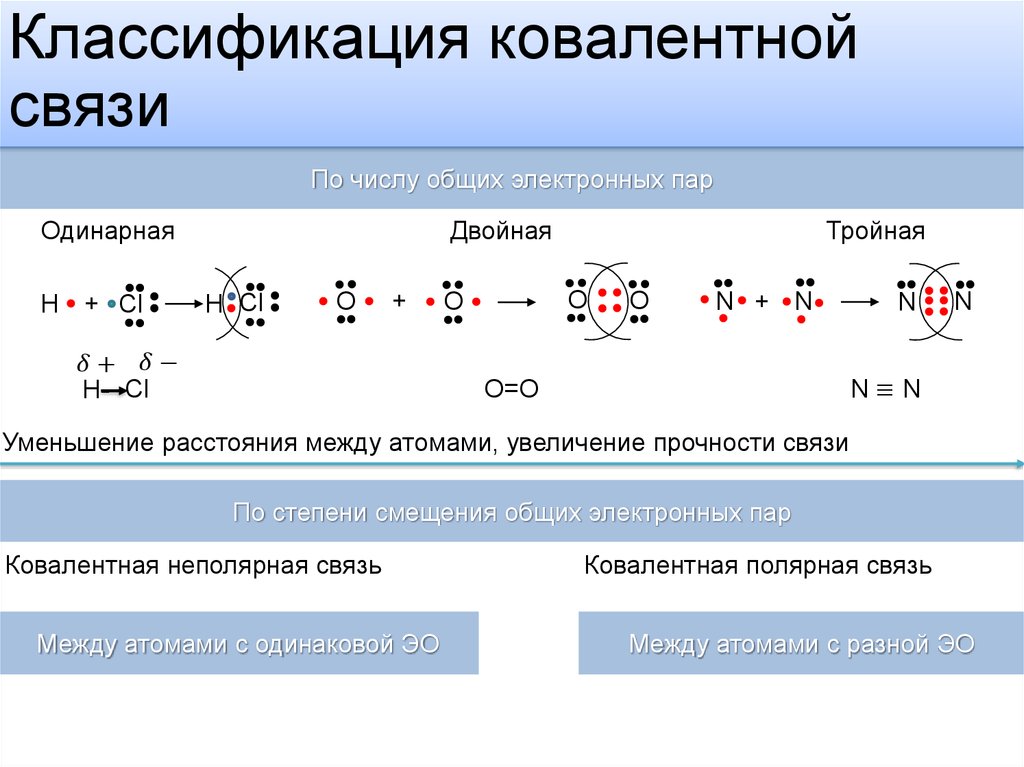 В структуре диазена два атома азота связаны друг с другом двойной ковалентной связью и связаны с двумя атомами водорода (каждый водород в каждом азоте) одинарной сигма-связью. Одна пара каждого электрона в двух атомах азота остается несвязанной.
В структуре диазена два атома азота связаны друг с другом двойной ковалентной связью и связаны с двумя атомами водорода (каждый водород в каждом азоте) одинарной сигма-связью. Одна пара каждого электрона в двух атомах азота остается несвязанной.
Ответ: Ковалентная связь образуется между двумя атомами путем совместного использования электронных пар внешней оболочки между двумя участвующими атомами. Подобно ионным связям, электроны от одного атома или молекулы не полностью передаются другому атому или молекуле.
Почему реакционная способность двойной ковалентной связи больше, чем одинарной?Ответ: Двойные ковалентные связи относительно более богаты электронами, чем одинарные ковалентные связи. Таким образом, электрофилы легче атакуют молекулярные частицы, имеющие двойную связь, чем одинарную.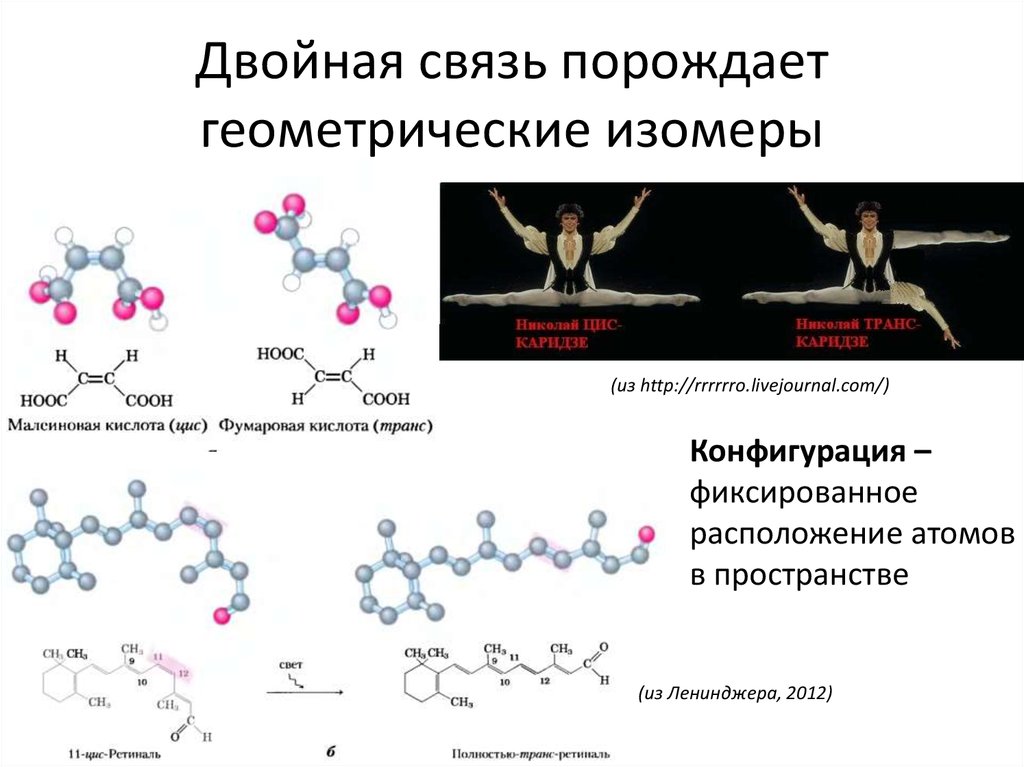
Ответ: А Ковалентная связь образуется при участии двух электронов. Итак, в образовании одной двойной связи участвует четыре электрона.
Почему двойные связи короче одинарной ковалентной связи?Ответ: Заказ облигаций двойной связи и одинарной связи равно 2 и 1 соответственно. Поскольку порядок связи зависит от прочности связи пропорционально и от длины связи (обратно пропорционально). Таким образом, двойные ковалентные связи относительно короче, чем одинарные ковалентные связи.
Двойная связь Определение и значение
- Основные определения
- Викторина
- Примеры
- Британский
- Научный
Показывает уровень сложности слова.
См. слово, которое чаще всего путают с одинарной связью
Сохранить это слово!
Показывает уровень оценки в зависимости от сложности слова.
сущ. Химия.
Химическая связь, состоящая из двух ковалентных связей между двумя атомами молекулы, представленная в химических формулах двумя линиями, двумя точками или четырьмя точками, как Ch3=Ch3; Ч3:Ч3; Ч3::Ч3.
СРАВНИТЬ ЗНАЧЕНИЯ
Нажмите, чтобы сравнить значения. Используйте функцию сравнения слов, чтобы узнать разницу между похожими и часто путаемыми словами.
ВИКТОРИНА
ВСЕ ЗА(U)R ЭТОГО БРИТАНСКОГО ПРОТИВ. АМЕРИКАНСКИЙ АНГЛИЙСКИЙ ВИКТОРИНА
Существует огромное количество различий между тем, как люди говорят по-английски в США и Великобритании. Способны ли ваши языковые навыки определить разницу? Давай выясним!
Вопрос 1 из 7
Правда или ложь? Британский английский и американский английский различаются только сленговыми словами.
Происхождение двойной связи
Впервые записано в 1885–1890 гг. двубортная, двубортная, двойная уздечка
Dictionary.com Unabridged На основе Random House Unabridged Dictionary, © Random House, Inc., 2023 г.
Как использовать двойную связь в предложении
Скелетная модель каннабигерола, показывающая линейную конфигурацию двойных связей.
Может ли Rolls-Royce конопли достичь масс?|Джошуа Эфериг|13 января 2021|Ози
Но да, я представил себе Джеймса Бонда, который просто прогуливается к ней.
Создатель «Лучника» Адам Рид раскрывает секреты 6-го сезона, от сюрреалистических сюжетных линий до жизни после ИГИЛ | Марлоу Стерн | 8 января 2015 г. | DAILY BEAST
И Олли говорит: «О, понятно, дайте мне два двойных мартини с водкой». Отсутствие связи со своими родителями было основной причиной, по которой детей отдавали.
Судья: Переселение детей — это торговля людьми|Тина Трастер|30 декабря 2014|DAILY BEAST
Без каких-либо записей и ордеров на следующее утро судья дал ему четырехзначный залог.

Что произойдет, если я наткнусь на белого полицейского?|Голди Тейлор|30 декабря 2014|DAILY BEAST
Брак — это связь и обязательство: жениться на себе смешно, потому что вы уже женаты на себе.
Почему одинокие должны сказать «Я не хочу» движению за брак с собой|Тим Тиман|30 декабря 2014 г.|DAILY BEAST
Под одной шестой они выглядят как тонкие волокна с высоким преломлением и двойным контуром. , часто завитые или секущиеся концы.
Руководство по клинической диагностике|Джеймс Кэмпбелл Тодд
В тройном, втором и четвертом, первое изменение — уклонение позади; и во второй раз лидирует тройной, есть двойной Боб.
Тинтинналогия, или Искусство звона|Ричард Дакворт и Фабиан Стедман
Все вещи двойные, одно против другого, и он не сделал ничего дефектного.
Библия, версия Дуэ-Реймса|Разное
Путь лежал под двойным рядом высоких деревьев, которые сходились наверху и образовывали зеленую арку над нашими головами.

Обучение музыке в Германии|Эми Фэй
Несчастный молодой человек настойчиво использует свое право выкрикивать «Банко» и каждый раз практически удваивается или уходит.
The Pit Town Coronet, Volume I (of 3)|Charles James Wills
Определения двойной связи в Британском словаре
двойная связь
существительное
тип химической связи, состоящей из двух ковалентных связей, соединяющих два атома в молекуле
Collins English Dictionary — Полное и полное цифровое издание 2012 г. © William Collins Sons & Co. Ltd., 1979, 1986 © HarperCollins Publishers 1998, 2000, 2003, 2005, 2006, 2007, 2009, 2012
Научные определения двойной связи
двойная связь
[dŭbʙl]
Тип ковалентной связи два атома. Каждый атом вносит в связь два электрона. Узнайте больше о ковалентной связи.
Научный словарь American Heritage®
Авторские права © 2011. Опубликовано издательством Houghton Mifflin Harcourt Publishing Company.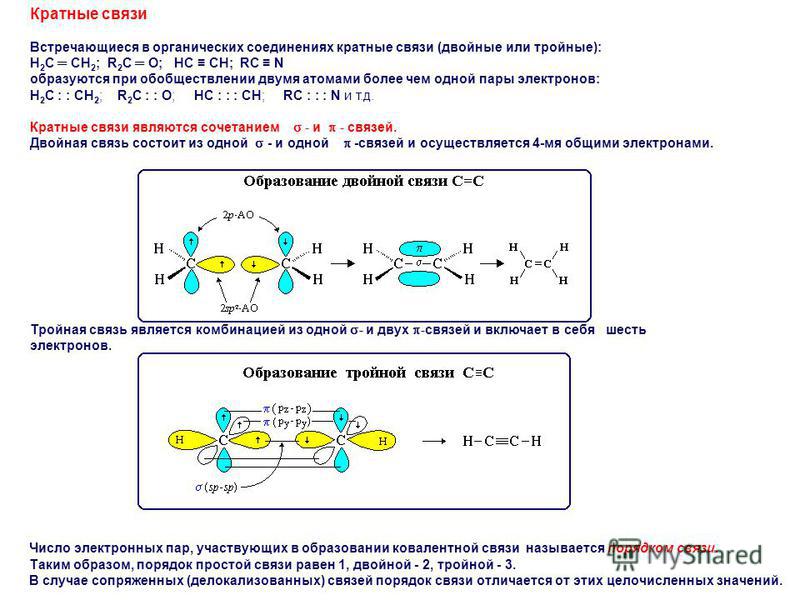 Все права защищены.
Все права защищены.
Одинарная, двойная и тройная связь
Ковалентная связь наблюдается, когда атомы делят пары с электронами. Атомы будут ковалентно связываться с другими атомами, чтобы получить большую стабильность, которая достигается за счет формирования полной оболочки электронов. Благодаря обмену большей частью (валентных) электронов атомы заполнят свою внешнюю электронную оболочку и обретут стабильность.
Правило октета объясняет, что атомы элементов главной группы кажутся связанными, так что все атомы имеют восемь электронов в своих валентных оболочках и имеют одинаковую электронную конфигурацию благородного газа.
В ковалентных связях атомы имеют тенденцию делиться своими электронами, поэтому атомы, участвующие в ковалентной связи, следуют закону Октета и достигают конфигурации благородного газа.
Объяснение образования ковалентной связи объясняется на примере:
Если есть два атома хлора, с семью валентными электронами каждый для хлора. Таким образом, каждому из этих атомов хлора требуется только еще один электрон, чтобы завершить валентность его внешней оболочки. Эти атомы связываются вместе, разделяя два электрона и образуя одну связь.
Таким образом, каждому из этих атомов хлора требуется только еще один электрон, чтобы завершить валентность его внешней оболочки. Эти атомы связываются вместе, разделяя два электрона и образуя одну связь.
Отрицательно заряженные электроны направляются в положительно заряженное ядро каждого атома, тем самым удерживая атомы вместе.
(Изображение будет загружено в ближайшее время)
В зависимости от количества пар электронов, общих между атомами, существует три типа связи. Это:
Одинарная облигация
Двойная облигация
Тройная облигация
Что такое одинарная облигация?
Одинарная связь образуется, когда одна пара электронов является общей для двух атомов.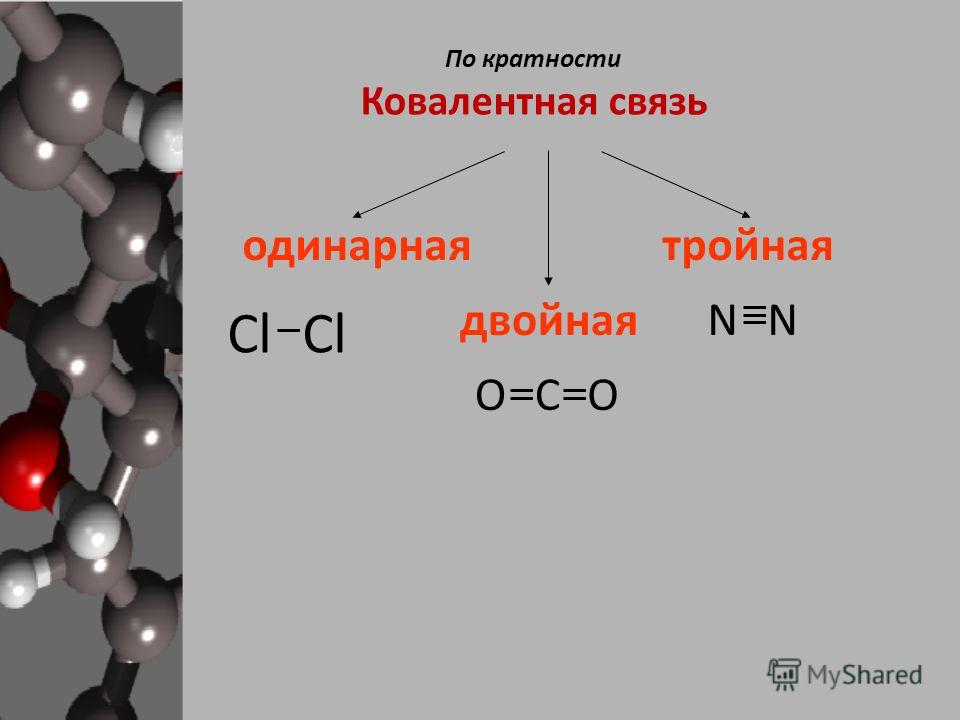
Этот тип связи является относительно слабым и имеет меньшую электронную плотность, чем двойная связь и тройная связь, но является наиболее стабильным, поскольку имеет более низкий уровень реакционной способности. Это означает, что потеря электронов атомами менее восприимчива.
Символ одинарной связи: одна линия представляет связь между двумя атомами (т. е. с участием одной электронной пары)
Пример одинарной связи: Cl2, HCl, Nh4 и т. д.
Что такое двойная связь?
Двойная связь образуется двумя атомами, имеющими две общие пары электронов.
Этот тип связи прочнее одинарной связи, но менее стабилен из-за большей реакционной способности, чем одинарная связь.
Символ двойной связи: двойные линии (=) обозначают двойную связь между двумя атомами (т.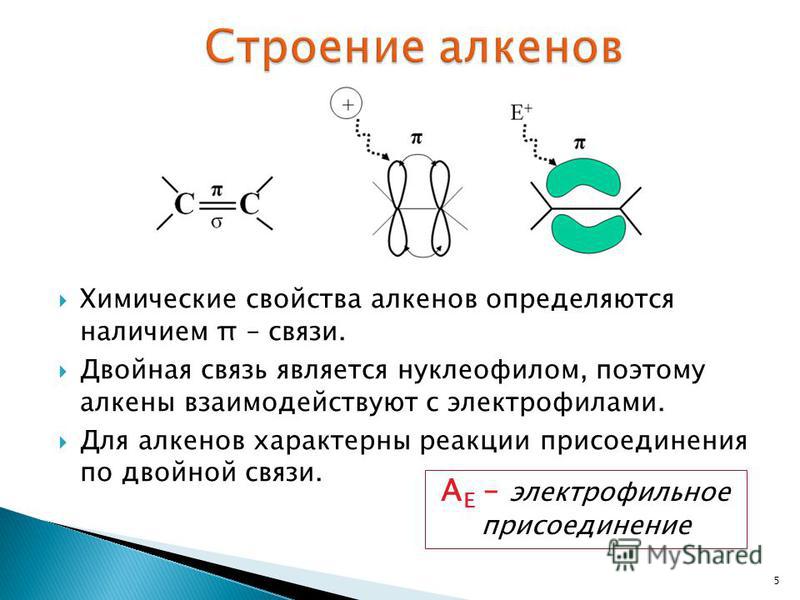 е. с участием двух электронных пар)
е. с участием двух электронных пар)
Пример двойной связи: O2, CO2 и т. д.
Что такое тройная связь?
Тройная связь образуется, когда молекула разделяет три пары электронов между двумя атомами. Это наименее стабильный из трех основных типов ковалентных связей, потому что потеря электрона очень уязвима.
Символы тройной связи: тройные линии (≡) обозначают тройную связь
Пример тройной связи: N2, C2h3 и т. д.
(Изображение будет загружено в ближайшее время)
Ключевые моменты:
Когда пары электронов делятся между атомами, это приводит к образованию ковалентных связей. Правило октета объясняет, что атомы элементов главной группы, по-видимому, связаны Так, что все атомы имеют восемь электронов в своих валентных оболочках и достигают одной и той же электронной конфигурации благородного газа.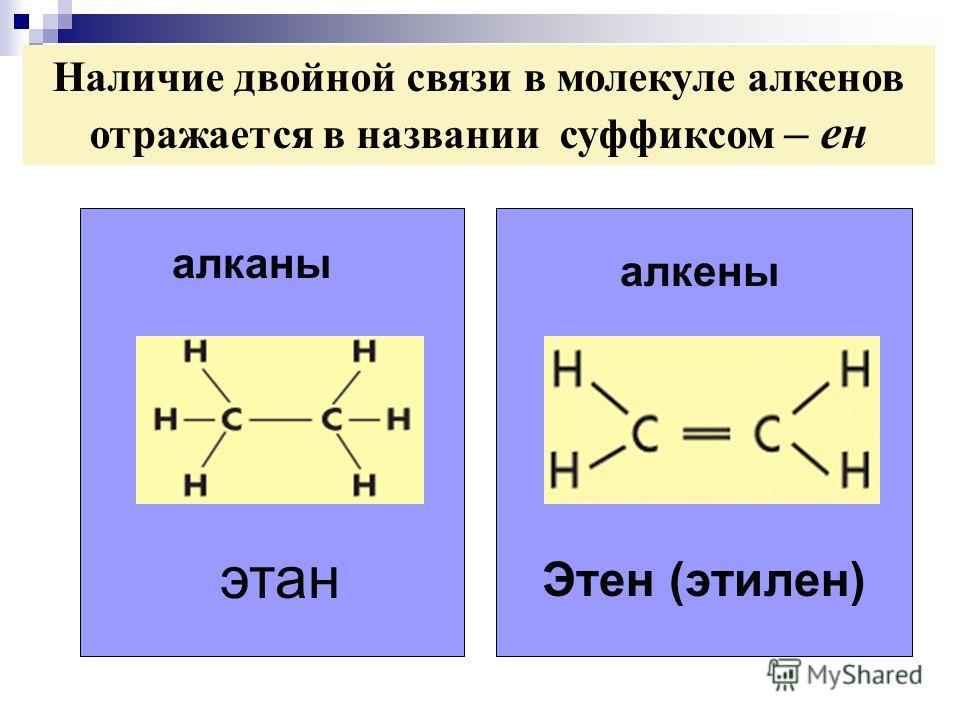 Если атомы разделяют одну пару электронов, то образуется одинарная связь, которую изображают одной линией. Если две пары электронов являются общими для атомов, то образуется двойная связь, представленная двумя параллельными линиями. Когда три пары электронов являются общими для двух атомов, образуется тройная связь.
Если атомы разделяют одну пару электронов, то образуется одинарная связь, которую изображают одной линией. Если две пары электронов являются общими для атомов, то образуется двойная связь, представленная двумя параллельными линиями. Когда три пары электронов являются общими для двух атомов, образуется тройная связь.
Разница между простой, двойной и тройной связью
Химические связи — это силы, возникающие между электронами и ядрами двух атомов, которые удерживают атомы в молекуле вместе. Химические реакции контролируются образованием или растворением химических связей. Существует множество различных типов связей, включая ковалентные, ионные и ван-дер-ваальсовые связи. Характеристики связи варьируются в зависимости от множества факторов, таких как молекулярная природа, тип твердого вещества (кристаллическое или аморфное) и т.д. Два или более электрона разделяются, образуя ковалентные связи. Количество связей, одинарных, двойных или тройных, определяется количеством общих электронов между атомами. Ковалентные связи включают в себя одинарные, двойные и тройные связи. Количество общих электронов является основным различием между одинарными двойными и тройными связями. Простая связь образуется, когда два атома имеют одну общую пару электронов, тогда как двойная связь образуется, когда два атома имеют две пары общих электронов (четыре электрона). Три пары электронов (шесть атомов) являются общими для образования тройных связей. Валентные электроны — это электроны, которые имеют общую пару электронов.
Ковалентные связи включают в себя одинарные, двойные и тройные связи. Количество общих электронов является основным различием между одинарными двойными и тройными связями. Простая связь образуется, когда два атома имеют одну общую пару электронов, тогда как двойная связь образуется, когда два атома имеют две пары общих электронов (четыре электрона). Три пары электронов (шесть атомов) являются общими для образования тройных связей. Валентные электроны — это электроны, которые имеют общую пару электронов.
Ордер на облигации с одинарными, двойными и тройными облигациями
Одинарные, двойные и тройные облигации также можно классифицировать с помощью термина, известного как ордер на облигации. Порядок связи можно определить как количество пар электронных связей, присутствующих между двумя атомами. Одинарная связь имеет порядок связи один, двойная связь имеет порядок связи два, и аналогичным образом тройная связь имеет порядок связи три, и это осуществляется в ковалентной связи между двумя атомами.