Новейшие антидепрессанты: Психиатры назвали самые эффективные антидепрессанты — Naked Science
«Авелити»: новый антидепрессант против самых тяжелых депрессий
Главное
«Авелити» (Auvelity, декстрометорфан + бупропион, 45 мг/105 мг) — новый пероральный препарат, предназначенный для лечения большого депрессивного расстройства у взрослых.
В отличие от всех существующих пероральных антидепрессантов, «Авелити», также известный под кодовым обозначением AXS-05, характеризуется быстрым и продолжительным терапевтическим действием. Улучшение депрессивных симптомов отмечается буквально через неделю, ремиссия наступает через две. «Авелити» способен успешно справиться с симптомами даже тяжелой формы депрессии у большинства пациентов.
Медицинская потребность в новых антидепрессантах, эффективных и безопасных, чрезвычайно высока ввиду продолжающегося роста распространенности депрессивных состояний во всём мире.
Так, только в одних США в 2020 году насчитывался 21 млн взрослых, в предшествовавшем году столкнувшихся как минимум с одним эпизодом большого депрессивного расстройства. Согласно оценкам, осуществленным в период марта-апреля 2021 года, 85 млн взрослых американцев испытывают выраженные депрессивные симптомы, что во много обусловлено продолжающейся пандемией коронавирусной инфекции COVID-19.
Согласно оценкам, осуществленным в период марта-апреля 2021 года, 85 млн взрослых американцев испытывают выраженные депрессивные симптомы, что во много обусловлено продолжающейся пандемией коронавирусной инфекции COVID-19.
«Авелити» разработан «Аксам терапьютикс» (Axsome Therapeutics).
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило «Авелити» в середине августа 2022 года.
«Авелити» поступит в продажу в начале четвертого квартала 2022 года.
Цена «Авелити» будет определена в ближайшие недели.
«Аксам» собирается искать коммерческого партнера для вывода препарата на рынок за пределами США.
Американский регулятор должен был определиться с одобрением «Авелити» еще в конце августа 2021 года. Однако FDA запросило у «Аксам» дополнительные данные для разрешения неполноты регистрационного досье, связанного с аналитическими методами в разделе «Химические свойства, процесс производства и контроль качества». На тот момент биржевые котировки компании потеряли почти 40%, позже отыграв падение хотя и не в полной мере.
«Аксам» намеревается расширить спектр показаний «Авелити», доказав его применимость в терапии ажитации при болезни Альцгеймера и в качестве вспомогательного средства в лечении никотиновой зависимости для желающих бросить курить.
Что такое большое депрессивное расстройство
Большое депрессивное расстройство, или клиническая депрессия, — хроническое, инвалидизирующее, с биологической подоплекой расстройство, которое характеризуется подавленным настроением, невозможностью ощущать удовлетворение, чувством вины и бесполезности, упадком сил и прочими эмоциональными и физическими симптомами. В тяжелых случаях пациент может прибегнуть к суициду. [1] [2]
Депрессия — распространенное во всём мире заболевание и одна из ведущих причин инвалидизации. Депрессии подвержены приблизительно 3,8% населения планеты, ей страдают где-то 280 млн человек. В странах с низким и средним уровнем дохода проблема депрессии особенно остра: препятствия для эффективного лечения депрессии чинят такие факторы, как нехватка ресурсов, отсутствие подготовленных медицинских работников, связанная с психическими расстройствами социальная стигма. В странах с любым уровнем дохода нередки случаи постановки неправильного диагноза людям с депрессией. [3]
В странах с любым уровнем дохода нередки случаи постановки неправильного диагноза людям с депрессией. [3]
Большое депрессивное расстройство трудно поддается лечению: почти две трети пациентов адекватно не отвечают на существующие пероральные антидепрессанты первой линии терапии. Большинство первоначальных неудач лечения также заканчиваются провалом всех последующих линий терапии. [4]
Пациентам с клинической депрессией ставится диагноз терапевтически резистентной депрессии, если они не отвечают на две и более линий терапии антидепрессантами разных фармакологических групп.
Одобренные в настоящее время пероральные антидепрессанты действуют преимущественно посредством моноаминергических механизмов. Поскольку достижение клинически значимого ответа требует длительного времени их непрерывного приема (до 6–8 недель), а сама терапия сопровождается нежелательными явлениями, это серьезно влияет на приверженность пациентов лечению: зачастую они преждевременно прекращают терапию.
Вот почему существует высокая неудовлетворенная медицинская потребность в принципиально новых фармакотерапевтических вариантах лечения клинической депрессии: такие препараты должны хорошо переноситься, действовать быстро, обеспечивать устойчивый клинический эффект. [7]
«Авелити»: комбинированный механизм действия декстрометорфана с бупропионом
Комбинированный пероральный препарат «Авелити» (Auvelity, декстрометорфан + бупропион, 45 мг/105 мг), известный под кодовым обозначением AXS-05, представляет собой антагонист рецептора N-метил-D-аспартата (NMDA) с мультимодальной активностью.
Декстрометорфан (dextromethorphan), будучи неконкурентным антагонистом NMDA-рецептора, также работает как агонист рецептора сигма-1 и ингибитор транспортных белков серотонина и норадреналина.
Антагонизм NMDA-рецептора, являющегося ионотропным глутаматным рецептором, вызывает антидепрессантный эффект, реализуемый модуляцией глутаматной нейропередачи за счет изменения тормозного тонуса интернейронов и/или прямого воздействия на постсинаптический NMDA-рецептор.
Общеизвестно, что антагонизм NMDA-рецептора при помощи кетамина (ketamine) приводит к быстрому и значительному антидепрессантному эффекту. [2] Однако применение кетамина сопровождается рядом трудностей, включая парентеральное введение, возможность злоупотребления, психотомиметические побочные эффекты, узкое терапевтическое окно. Тем не менее в марте 2019 года «Янссен» (Janssen) в составе «Джонсон энд Джонсон» (Johnson & Johnson) удалось вывести на рынок назальный спрей «Справато» (Spravato, эскетамин) для лечения терапевтически-резистентной депрессии, а затем, в августе 2020 года, добавить лечение большого депрессивного расстройства с острым суицидальным мышлением и поведением. Эскетамин (esketamine) представляет собой S(+)-энантиомер кетамина.
Сходство между декстрометорфаном и кетамином с точки зрения фармакологии рецепторов и фармакодинамических эффектов позволяет предполагать, что декстрометорфан характеризуется антидепрессантной эффективность без ограничений, присущих кетамину. Впрочем, обусловлен ли антидепрессантный эффект именно антагонизмом NMDA-рецептора, по-прежнему неясно. [3] [4]
Впрочем, обусловлен ли антидепрессантный эффект именно антагонизмом NMDA-рецептора, по-прежнему неясно. [3] [4]
Бупропион (bupropion) служит в качестве бустера (усилителя) биодоступности декстрометорфана, который слишком быстро метаболизируется в организме человека, не достигая концентрации в плазме, необходимой для достижения нужных психотерапевтических эффектов.
Поскольку бупропион ингибирует цитохром P450 2D6 (CYP2D6), а декстрометорфан является субстратом для этого фермента, происходит подавление опосредованного CYP2D6 метаболизма декстрометорфана, что отражается повышением его уровня в плазме и продлением периода полувыведения. Тем самым антидепрессантный эффект наделяется устойчивым характером. [5]
Бупропион выступает двойным ингибитором обратного захвата норадреналина и дофамина. [6]
Кроме того, декстрометорфан и бупропион являются антагонистами никотинового холинорецептора.
Комплексный антидепрессантный механизм действия «Авелити» завязан на ряде сигнальных каскадов, имеющих отношение к синаптической пластичности, и обеспечен усилением синаптических связей и улучшением коммуникационных взаимодействий между клетками головного мозга. Лекарственное соединение повышает в головном мозге уровни серотонина, норадреналина и дофамина, являющихся ключевыми нейротрансмиттерами, вовлеченными в регуляцию настроения.
Лекарственное соединение повышает в головном мозге уровни серотонина, норадреналина и дофамина, являющихся ключевыми нейротрансмиттерами, вовлеченными в регуляцию настроения.
У «Авелити» отмечены также противовоспалительные свойства. [7] [8] [9] [10] [11] Существует связь между депрессией и воспалением: у пациентов с депрессией отмечаются повышенные сывороточные уровни интерлейкина 6 (IL-6), интерлейкина 1 (IL-1), C-реактивного белка (CRP), фактора некроза опухоли (TNF) и др. воспалительных биомаркеров. [12] [13] [14] [15] [16]
«Авелити»: эффективность и безопасность лечения большого депрессивного расстройства
Главное исследование
Клиническое исследование GEMINI (NCT04019704) фазы III (рандомизированное, двойное слепое, плацебо-контролируемое, многоцентровое) привлекло взрослых пациентов (n=327) с умеренно-тяжелым (общий балл MADRS ≥ 25) большим депрессивным расстройством.
Исходные характеристики испытуемых: средний возраст 42 года, женщин 66%, средний общий балл MADRS равен 33.
«Мосмедпрепараты»
Пациентам два раза в день назначали плацебо или декстрометорфан с буприоном — на протяжении 6 недель; в первые три дня участники получали только одну дозу.
Первичная конечная точка эффективности терапии была заявлена изменением общего балла по шкале Монтгомери — Осберг для оценки депрессии (MADRS) [больше балл — тяжелее депрессивное состояние] по прошествии 6 недель.
Группа «Авелити» продемонстрировала снижение общего балла MADRS на усредненных 16,6 пункта — против 11,9 пункта в группе плацебо (p=0,002).
Получавшие декстрометорфан с буприоном показали статистически значимое (p=0,007) расхождение с контрольной группой уже на 1-й неделе лечения: общий балл MADRS снизился в среднем на 7,3 пункта — против 4,9 пункта.
Применение «Авелити» обеспечило выход к клинической ремиссии (отсутствие клинически значимых симптомов депрессии и общий балл MADRS ≤ 10) по прошествии 2, 3, 4 и 6 недель терапии у 17%, 24%, 32% и 40% пациентов — против 8%, 11%, 12% и 17% в группе плацебо (p=0,013, p=0,002, p<0,001, p<0,001).
Назначение «Авелити» привело к раннему и устойчивому клиническому ответу (снижение общего балла MADRS на ≥ 50%) по прошествии 1, 2, 3, 4 и 6 недель лечения у 15%, 28%, 42%, 49% и 54% пациентов — против 7%, 17%, 25%, 27% и 34% в группе плацебо (p=0,035, p=0,020, p=0,001, p<0,001, p<0,001).
Комбинация из декстрометорфана и буприона оказала статистически значимое влияние на улучшение баллов по шкале общего клинического впечатления об улучшении (CGI-I), по шкале общего клинического впечатления о тяжести заболевания (CGI-S), по шкале общего впечатления пациента об улучшении (PGI-I), по короткому опроснику удовлетворенности качеством жизни (Q-LES-Q-SF), по быстрому самоопроснику депрессивной симптоматики (QIDS-SR-16).
Профиль безопасности «Авелити» характеризовался приемлемой переносимостью. Среди наиболее распространенных нежелательных явлений, возникших во время лечения: головокружение (у 16% пациентов в группе «Авелити» — против 6% в группе плацебо), тошнота (13% против 9%), головная боль (8% против 4%), диарея (7% против 3%), сонливость (7% против 3%), сухость полости рта (6% против 2%).
Инструкция по медицинскому применению лекарственного препарата «Авелити» снабжена «чернорамочным» предупреждением о повышенном риске суицидальных мыслей и поведения у детей, подростков и молодых взрослых (18–24 лет), принимающих антидепрессанты. Такую популяцию пациентов следует тщательно контролировать на предмет ухудшения клинической картины и проявления суицидальных наклонностей. «Авелити» не одобрен для применения пациентами педиатрического возраста.
Длительное исследование #1
Клиническое исследование COMET (NCT04039022) фазы III (нерандомизированное, открытое, многоцентровое) пригласило взрослых пациентов (n=611) с умеренно-тяжелым (общий балл MADRS ≥ 25) большим депрессивным расстройством.
Исходные характеристики испытуемых: средний возраст 42 года, женщин 62%, средний общий балл MADRS равен 33.
На протяжении 12 месяцев пациентам назначали дважды в день декстрометорфан с буприоном.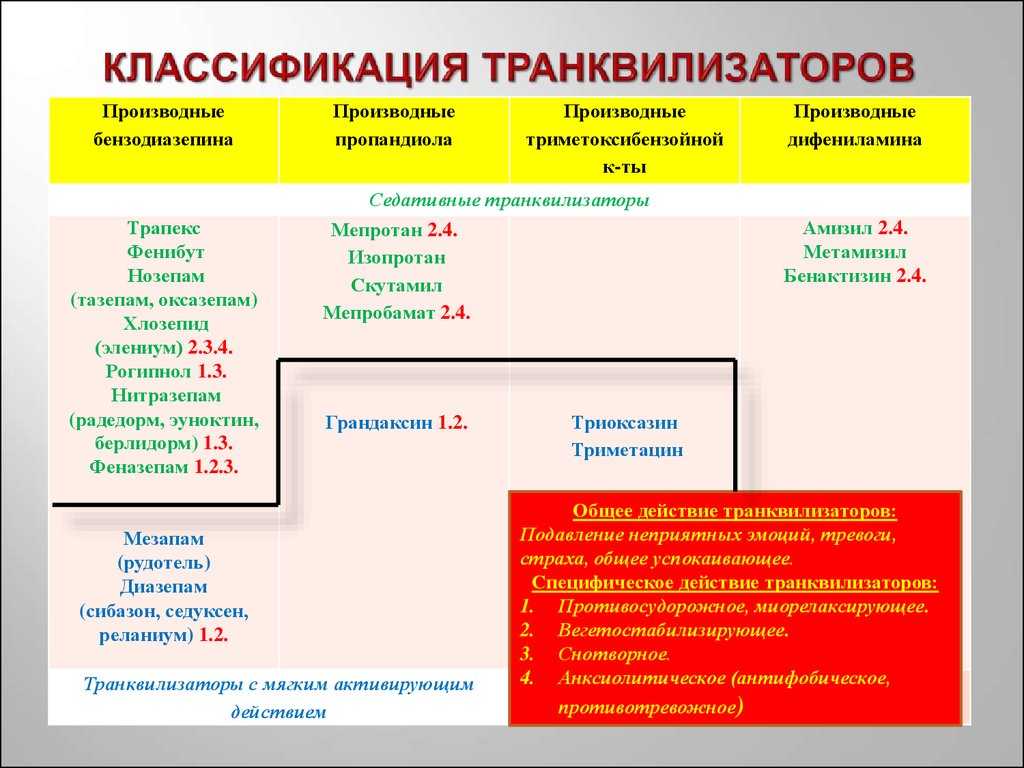
Длительное лечение большого депрессивного расстройства препаратом «Авелити» позволило добиться следующих показателей эффективности терапии.
Среднее снижение общего балла MADRS составило 9,1, 14,0 и 21,1 пункта по прошествии 1, 2 и 6 недель. По истечении 6 и 12 месяцев этот бал снизился на 23,9 и 23,0 пункта.
В статусе клинического ответа на лечение депрессии оказались 19%, 40% и 73% пациентов после 1, 2 и 6 недель терапии. Клинический ответ был справедлив для 85% и 83% испытуемых после 6 и 12 месяцев лечения.
Клиническая ремиссия депрессии зафиксирована для 8%, 22% и 53% пациентов после 1, 2 и 6 недель лечения. К этому статусу вышли 69% и 69% участников по прошествии 6 и 12 месяцев терапии.
Явные улучшения депрессивных симптомов, оцениваемые по шкале CGI-I, отмечены у 27%, 50% и 83% пациентов после 1, 2 и 6 недель лечения. Это же зарегистрировано для 87% и 93% пациентов после 6 и 12 месяцев терапии.
Клинический ответ на лечение депрессии по шкале нетрудоспособности Шихана (SDS; общий балл ≤ 12), оценивающей функциональные возможности на работе/в учебе, в социальной жизни, семейной жизни/домашних обязанностях, засвидетельствован для 42,9%, 55,1% и 70,7% пациентов после 1, 2 и 6 недель лечения. Указанное оказалось справедливым для 81% и 76% испытуемых после 6 и 12 месяцев терапии.
Профиль безопасности «Авелити» характеризовался приемлемой переносимостью. Среди наиболее распространенных нежелательных явлений, возникших во время лечения: головокружение (у 13% пациентов), тошнота (12%), головная боль (9%), сухость полости рта (7%), снижение аппетита (6%). Все побочные реакции носили легко-умеренную степень выраженности.
Длительное исследование #2
Клиническое исследование EVOLVE (нерандомизированное, открытое, многоцентровое) включило взрослых пациентов (n=186) с умеренно-тяжелым (общий балл MADRS ≥ 25) большим депрессивным расстройством, которые ранее лечились хотя бы одним антидепрессантом в ходе текущего эпизода депрессии и лечение которых себя не оправдало.
Исходные характеристики испытуемых: средний общий балл MADRS равнялся 32.
Пациентам назначали дважды в день декстрометорфан с буприоном — сроком до 15 месяцев.
Назначение «Авелити» привело к быстрому улучшению депрессивных симптомов. Так, среднее снижение общего балла MADRS составило 9,1±7,6 (p<0,001), 13,3±8.6 (p<0,001) и 20,4±7,8 (p<0,001) по прошествии 1, 2 и 6 недель соответственно. При этом клинический ответ был зарегистрирован для 17,7%, 39,0% и 74,2% пациентов. К ремиссии большого депрессивного расстройства вышли 5,7%, 16,2% и 46,0% испытуемых.
Антидепрессантный эффект «Авелити» характеризовался долгосрочностью и устойчивостью на протяжении всех 12 месяцев терапии. Так, статус ремиссии оказался справедливым для 65% и 68% пациентов после 6 и 12 месяцев лечения.
Функциональная ремиссия большого депрессивного расстройства, согласно шкале SDS (общий балл ≤ 6) была достигнута 18%, 31% и 40% пациентов после 1, 2 и 6 недель лечения. По прошествии 6 и 12 месяцев терапии к статусу функциональной ремиссии вышли 54% и 59% испытуемых.
По прошествии 6 и 12 месяцев терапии к статусу функциональной ремиссии вышли 54% и 59% испытуемых.
Применение «Авелити» обеспечило снятие тревожности, согласно шкале Гамильтона для оценки выраженности тревоги (HAM-A), у 36%, 51% и 58% пациентов, которые достигли ремиссии по этому клиническому показателю (общий балл ≤ 7) по прошествии 1, 2 и 6 недель лечения. Ремиссия по истечении 6 и 12 месяцев терапии была зафиксирована для 75% и 78% испытуемых.
Длительное назначение «Авелити» характеризовалось приемлемой переносимостью. Среди наиболее распространенных нежелательных явлений: тошнота (у 8,9% пациентов), головная боль (7,5%), сухость полости рта (6,2%), бессонница (5,5%), головокружение (5,5%).
Дополнительное исследование
Клиническое исследование ASCEND (NCT03595579) фазы II (рандомизированное, двойное слепое, с группой активного контроля, многоцентровое) охватило взрослых пациентов (n=80) с умеренно-тяжелым (общий балл MADRS ≥ 25) большим депрессивным расстройством.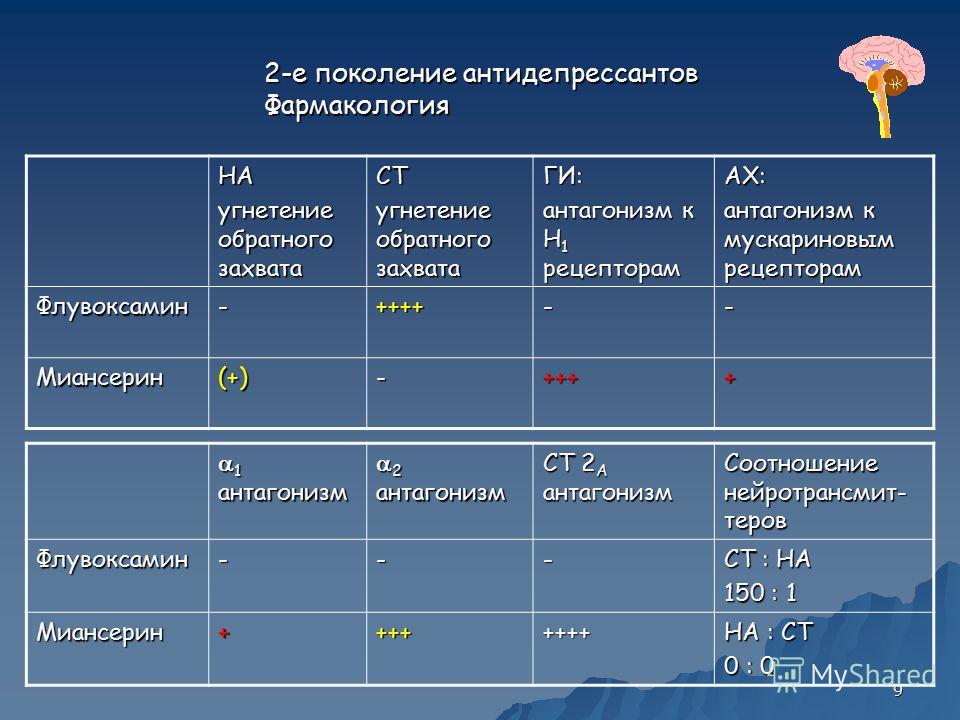
Исходные характеристики испытуемых: средний возраст 37,5 лет, женщин 64%, средний общий балл MADRS равен 32.
«Мосмедпрепараты»
Участникам назначали либо декстрометорфан с бупропионом, либо только бупропион — дважды в день на протяжении 6 недель.
Применение «Авелити» обеспечило статистически значимое снижение общего балла MADRS: за весь курс лечения его снижение составило в среднем 13,7 пункта — против 8,8 пункта в группе бупропиона (p<0,001).
На 1-й, 2-й и 6-й неделе пациенты, получавшие декстрометорфан с бупропионом, продемонстрировали снижение общего балла MADRS на 7,4, 12,5 и 17,3 пункта — против 4,5, 7,8 и 12,1 пункта в контрольной группе (p=0,169, p=0,024, p=0,013).
Клиническая ремиссия зафиксирована на 6-й неделе у 47% испытуемых в группе декстрометорфана с бупропионом — против 16% в контрольной (p=0,004).
Назначение «Авелити» привело к улучшению других показателей эффективности лечения депрессии, включая баллы по подшкале MADRS-6 (основные симптомы депрессии), по шкале CGI-I, по шкале CGI-S.
Профиль безопасности «Авелити» характеризовался приемлемостью. Не отмечено каких-либо побочных эффектов, связанных с психотомиметическими нарушениями, увеличением массы тела, усилением сексуальной дисфункции.
«Авелити»: рыночные перспективы
Большое депрессивное расстройство свело в могилу множество экспериментальных лекарственных препаратов. Это заболевание весьма нелегко поддается терапии, и потому удивительно, как декстрометрофану с бупропионом удалось влёгкую пройти три клинических испытания, важных для регуляторного одобрения. Более того, терапевтическая эффективность «Авелити» оказалась непротиворечивой во всех трех исследований, чего в случае почти любых ментальных расстройств добиться практически нереально. Общеизвестна проблема проверки лекарств при психоневрологических нарушениях, когда в одном клиническом испытании экспериментальный препарат срабатывает с должной эффективностью, тогда как в другом, пусть даже полностью аналогичном по дизайну, проваливается.
Так, «Авелити», проверенный в опорном клиническом испытании GEMINI (NCT04019704) фазы III, длительном COMET (NCT04039022) фазы III и дополнительном ASCEND (NCT03595579) фазы II, продемонстрировал снижение общего балла MADRS на 16,6, 21,1 и 17,3 пункта по прошествии 6 недель лечения, или, в процентном исчислении от исходного, на 50%, 64%, 54%. К клинической ремиссии депрессии вышли соответственно 40%, 53% и 47% пациентов. И всё это без особых отрицательных явлений.
Длительное применение декстрометрофана с бупропионом улучшило пропорцию пациентов, добравшихся до статуса клинической ремиссии, до 69% за полгода лечения. И опять же без негативных побочных реакций.
«Аксам» хотела бы подкрепить уверенность в терапевтической состоятельности «Авелити», доказав, что он также успешно справляется с терапевтически резистентной депрессией (когда не помогают две и более линий терапии разными стандартными антидепрессантами), но получилось не особо гладко. Клиническое испытание STRIDE-1 (NCT02741791) фазы III, сравнивающее препарат с бупропионом, не смогло продемонстрировать статистически значимый перевес экспериментального лекарства. Проблема была заключена не в самом «Авелити», а недочетах дизайна исследования, приведших к недостаточной статистической мощности. Последующее MERIT (NCT04608396) фазы II подтвердило, что «Авелити» по силам отсрочивать время наступления и предотвращать рецидив депрессивных симптомов. Когорта COMET-TRD в COMET (NCT04039022) также показала должную эффективность терапии. Тем не менее сейчас «Аксам» не рассматривает декстрометрофан с бупропионом в качестве препарата против депрессии, устойчивой к лечению.
Проблема была заключена не в самом «Авелити», а недочетах дизайна исследования, приведших к недостаточной статистической мощности. Последующее MERIT (NCT04608396) фазы II подтвердило, что «Авелити» по силам отсрочивать время наступления и предотвращать рецидив депрессивных симптомов. Когорта COMET-TRD в COMET (NCT04039022) также показала должную эффективность терапии. Тем не менее сейчас «Аксам» не рассматривает декстрометрофан с бупропионом в качестве препарата против депрессии, устойчивой к лечению.
«Аксам» убедилась, что «Авелити» пригоден для лечения других клинических значимых групп пациентов: при большом депрессивном расстройстве, не ответившем на одну линию терапии стандартными антидепрессантами, и при большом депрессивном расстройстве с суицидальными наклонностями. Соответствующие когорты COMET-AU и COMET-SI в COMET (NCT04039022) это подтвердили: после 6 недель лечения ремиссия зарегистрирована у 40% и 50% пациентов; суицидальные наклонности исчезли у 60% больных уже на первой неделе терапии.
Параллельно «Аксам» продолжает проверять «Авелити» в терапии ажитации при болезни Альцгеймера и лечении никотиновой зависимости. Так, в клиническом исследовании ADVANCE (NCT03226522) фазы II/III исходный общий балл по опроснику Коэн-Мансфилд для оценки возбудимости (CMAI) снизился почти наполовину, а в клиническом испытании NCT03471767 фазы II декстрометорфан с бупропионом обеспечил большее уменьшение числа выкуриваемых сигарет и большее снижение интенсивности курения в сравнении с назначением только бупропиона, одобренного средства для желающих бросить курить.
Согласно оценкам отраслевых обозревателей, «Авелити» перешагнет порог в полмиллиарда долларов ежегодных продаж только к 2026 году. Столь сдержанные прогнозы обусловлены, очевидно, с задержками регуляторного вердикта. Очевидно, как только препарат будет одобрен, финансовые ожидания резко улучшатся. Что говорить, если до регуляторных проблем прогноз продаж «Авелити» был исключительно оптимистичным: в 2026 году реализация препарата должна была выйти на уровень 1,3 млрд долларов в год.
С позиций защиты интеллектуальной собственности у «Авелити» всё хорошо: фирменная комбинация декстрометорфана с буприоном надежно запатентована до 2037–2040 гг.
Важная информация
Mosmedpreparaty.ru — специализированная научно-исследовательская и справочно-информационная аналитическая служба группы компаний «Мосмедпрепараты», таргетированная на ключевые события глобальной отрасли фармации, биотехнологий, медицины и здравоохранения.
- Ничто на Mosmedpreparaty.ru не является рекламой или продвижением лекарственных препаратов, методов лечения, медицинских услуг.
- Сведения и публикации Mosmedpreparaty.ru носят исключительно научно-просветительский и ознакомительный характер.
- Медицинская информация, транслируемая Mosmedpreparaty.ru, предназначена только для специалистов в области здравоохранения и сфере обращения лекарственных средств.
- Медицинская информация, содержащаяся на Mosmedpreparaty.
 ru, не предназначена для использования в качестве замены консультации со специалистом в области здравоохранения.
ru, не предназначена для использования в качестве замены консультации со специалистом в области здравоохранения. - Ничто на Mosmedpreparaty.ru не должно истолковываться как предоставление медицинского совета или рекомендации и не может служить основанием для принятия каких-либо решений или осуществления каких-либо действий без участия специалиста в области здравоохранения.
Присутствие на веб-ресурсе Mosmedpreparaty.ru и ознакомление с его содержимым означает, что вы прочитали «Пользовательское соглашение» и приняли его условия.
Новейшие основанные на мелатонине методы терапии: потенциальные преимущества в терапии большой депрессии (реферат) — Дневник психиатра №1 2013
Введение
Большая депрессия является главной причиной преждевременной смертности и инвалидизации. Несмотря на спорность терапевтических преимуществ антидепрессантов при легких депрессиях, в целом клиническая польза препаратов и психотерапии для пациентов с депрессией не вызывает сомнений. Положительные эффекты лечения включают снижение частоты самоубийств, повышение работоспособности, редукцию вторичного злоупотребления алкоголем и другими психоактивными веществами, снижение риска сердечно-сосудистой патологии и, благодаря более регулярному и широкому использованию адекватных медицинских служб, дестигматизацию депрессии и тревоги. Длительная терапия антидепрессантами часто является ключевым компонентом лечения пациентов с тяжелой депрессией, что стимулирует разработку препаратов с улучшенными профилями безопасности. Хотя новейшие антидепрессанты имеют клинически значимые различия в эффективности и переносимости, в разработке большинства препаратов основным направлением было воздействие на одни и те же моноаминовые мишени (например, серотонин, норадреналин или дофамин). В последнее время значительно пополнились наши знания о биологии циркадианной системы, клиническом значении нарушений суточных ритмов, неблагоприятном влиянии многих антидепрессантов на циркадианные циклы и архитектуру сна, а также механизмах, за счет которых литий оказывает глубокое влияние на циркадианную биологию.
Положительные эффекты лечения включают снижение частоты самоубийств, повышение работоспособности, редукцию вторичного злоупотребления алкоголем и другими психоактивными веществами, снижение риска сердечно-сосудистой патологии и, благодаря более регулярному и широкому использованию адекватных медицинских служб, дестигматизацию депрессии и тревоги. Длительная терапия антидепрессантами часто является ключевым компонентом лечения пациентов с тяжелой депрессией, что стимулирует разработку препаратов с улучшенными профилями безопасности. Хотя новейшие антидепрессанты имеют клинически значимые различия в эффективности и переносимости, в разработке большинства препаратов основным направлением было воздействие на одни и те же моноаминовые мишени (например, серотонин, норадреналин или дофамин). В последнее время значительно пополнились наши знания о биологии циркадианной системы, клиническом значении нарушений суточных ритмов, неблагоприятном влиянии многих антидепрессантов на циркадианные циклы и архитектуру сна, а также механизмах, за счет которых литий оказывает глубокое влияние на циркадианную биологию. В свете разработки аналога мелатонина с подтвержденным антидепрессивным эффектом – Вальдоксана, эти достижения привели к смещению приоритетов на потенциальную клиническую пользу манипуляций циркадианной системой.
В свете разработки аналога мелатонина с подтвержденным антидепрессивным эффектом – Вальдоксана, эти достижения привели к смещению приоритетов на потенциальную клиническую пользу манипуляций циркадианной системой.
Циркадианная система и цикл «сон–бодрствование»
Циркадианная система является центральным звеном в поддержании суточного цикла «сон– бодрствование» и общего благополучия. Эта система координирует ключевые физиологические функции, включая цикл «сон– бодрствование», терморегуляцию, эндокринную, иммунную, сердечно-сосудистую и метаболическую системы (см. рисунок). Хотя циркадианные ритмы нарушаются при многих нейропсихических расстройствах (например, психотические расстройства, постинфекционные заболевания, состояния хронической слабости и хроническая боль), их нарушения приобретают фундаментальный характер при большой депрессии, атипичной депрессии и сезонном аффективном расстройстве. Значительные флуктуации также тесно связаны с разными фазами биполярного аффективного расстройства.
Циркадианные нарушения при депрессии
Установлены тесные связи между циркадианными нарушениями и некоторыми наиболее типичными симптомами клинической депрессии, включая задержку начала сна, беспокойный сон, ранние утренние пробуждения, слабость в дневное время, уплощение или реверс утренних пиков субъективного настроения, энергии и бдительности. Профили циркадианных нарушений варьируют в широких пределах: у некоторых пациентов наблюдается смещение фазы на более раннее время (проявляется ранним засыпанием, ранним пробуждением и смещением на более раннее время ритмов секреции мелатонина, кортизола и норадреналина), тогда как у других выявляется задержка фазы (позднее засыпание, отставленное утреннее пробуждение). Также отмечается снижение амплитуды суточных колебаний других ключевых параметров, включая температуру тела и плазменные концентрации кортизола. В условиях внутренней десинхронизации несколько циркадианных ритмов (например, температура тела, плазменные концентрации мелатонина и кортизола, «сон–бодрствование») утрачивают соответствие по фазе как друг с другом, так и с окружающей средой. На наш взгляд, такое нарушение внутренних связей между ключевыми физиологическими циклами сна, настроения, когнитивных функций и др. приводит к формированию полифазных профилей сна, чрезмерной сонливости или слабости в состоянии бодрствования, депрессивному настроению и нарушениям нейрокогнитивных функций. У большинства пациентов с депрессией отмечаются увеличение латентности сна и высокая частота пробуждений в течение ночи. Соответственно, развиваются выраженная гиперсомния, слабость в дневное время или дремота. Кроме того, у пациентов с депрессией выявляются полисомнографические изменения архитектуры сна, включая сокращение времени медленноволнового сна, редукцию периодов парадоксального (REM) сна, сокращение латентности первого эпизода REM-сна и увеличение количества I и II стадий сна. Если не-REM-сон (стадия I, стадия II и медленноволновой сон) регулируется преимущественно гомеостатической системой, то REM-сон регулируется циркадианной системой. Целью терапии антидепрессантами является не только восстановление нормального профиля цикла «сон–бодрствование», но также ресинхронизация циркадианно зависимой биологии и ее связей с внешней средой.
На наш взгляд, такое нарушение внутренних связей между ключевыми физиологическими циклами сна, настроения, когнитивных функций и др. приводит к формированию полифазных профилей сна, чрезмерной сонливости или слабости в состоянии бодрствования, депрессивному настроению и нарушениям нейрокогнитивных функций. У большинства пациентов с депрессией отмечаются увеличение латентности сна и высокая частота пробуждений в течение ночи. Соответственно, развиваются выраженная гиперсомния, слабость в дневное время или дремота. Кроме того, у пациентов с депрессией выявляются полисомнографические изменения архитектуры сна, включая сокращение времени медленноволнового сна, редукцию периодов парадоксального (REM) сна, сокращение латентности первого эпизода REM-сна и увеличение количества I и II стадий сна. Если не-REM-сон (стадия I, стадия II и медленноволновой сон) регулируется преимущественно гомеостатической системой, то REM-сон регулируется циркадианной системой. Целью терапии антидепрессантами является не только восстановление нормального профиля цикла «сон–бодрствование», но также ресинхронизация циркадианно зависимой биологии и ее связей с внешней средой.
Нарушение циркадианной функции как причина нейропсихических расстройств
Накапливается все больше доказательств того, что нарушения циркадианной функции могут быть главным фактором риска нейропсихических расстройств. В этом контексте нарушения циркадианных ритмов (независимо от клинического диагноза) реализуются в фенотипе, который характеризуется депрессивным настроением, слабостью в дневное время, снижением концентрации, скелетно-мышечными болями и аномальными суточными колебаниями в субъективных оценках уровня энергии. Первичные циркадианные расстройства и первичные аффективные расстройства имеют общие генетические факторы риска и одинаковые детерминанты окружающей среды. Значимые внешние факторы включают длительное нарушение режима сна, злоупотребление алкоголем и другими психоактивными веществами, путешествия с пересечением меридианов или сменную работу, другие общемедицинские заболевания (например, острую инфекцию). Поведенческие или фармакологические методы терапии, направленные на нормализацию циркадианной функции, способствуют не только значительному улучшению настроения, но и существенному улучшению когнитивных функций и редукции слабости в дневное время.
Циркадианные недостатки современных средств терапии большой депрессии
На протяжении более 50 лет мишенью терапии большой депрессии были моноаминергические системы. Многие трициклические антидепрессанты прошлого поколения оказывают благоприятное влияние на засыпание и длительность сна (преимущественно через гистаминергические механизмы), но при этом подавляют REM-сон. Более того, способность подавлять REM-сон раньше рассматривалась как облигатное свойство антидепрессантов. Наиболее широко используемые в современной практике селективные ингибиторы обратного захвата серотонина часто нарушают медленноволновой сон и циклы REM-сна (как минимум при кратковременной терапии) и не всегда восстанавливают нормальную циркадианную функцию. Эти побочные эффекты новых антидепрессантов часто приводят к необходимости сопутствующей терапии седативными средствами. Для современной терапии тяжелой депрессии типично присоединение антипсихотиков II поколения с выраженными седативными или нормотимическими свойствами (например, оланзапин или кветиапин). Снотворные средства, которые просто сокращают время засыпания или число ночных пробуждений, не лечат депрессию. Сходным образом чистые седативные препараты лишь в ограниченной степени способны корректировать хронобиологические нарушения, а их длительное применение сопряжено с риском развития толерантности и зависимости. Нормализация хронобиологии все чаще рассматривается как маркер эффективности терапии антидепрессантами. Неудача в попытках нормализации ритмов сопряжена с повышением риска резидуальных симптомов или ранних рецидивов.
Снотворные средства, которые просто сокращают время засыпания или число ночных пробуждений, не лечат депрессию. Сходным образом чистые седативные препараты лишь в ограниченной степени способны корректировать хронобиологические нарушения, а их длительное применение сопряжено с риском развития толерантности и зависимости. Нормализация хронобиологии все чаще рассматривается как маркер эффективности терапии антидепрессантами. Неудача в попытках нормализации ритмов сопряжена с повышением риска резидуальных симптомов или ранних рецидивов.
Циркадианная направленность терапии антидепрессантами
Циркадианная направленность терапии депрессии предусматривает не только восстановление нормальных суточных колебаний в пределах цикла «сон–бодрствование», но также восстановление и ресинхронизацию других ключевых нейрогормональных (например, колебания плазменных концентраций мелатонина и кортизола), физиологических (например, температура тела) и нейрокогнитивных (например, бдительность) функций. Предпосылкой такого подхода служит перенастройка циркадианной системы под влиянием стимулов внешней среды. Разработано несколько стратегий достижения этой цели, включая адекватный распорядок воздействия ярким белым или голубым светом, терапию мелатонином и перестройку распорядка сна и бодрствования. В одном из исследований установлен положительный эффект комбинации психофармакотерапии и циркадианных методов терапии (например, депривация сна, воздействие ярким светом и смещение фазы сна на более раннее время) в редукции депрессивных симптомов у пациентов с биполярным расстройством. У пациентов, которым в результате рандомизации была назначена дополнительная циркадианная терапия (n=32), отмечался достоверно более выраженный антидепрессивный эффект через 48 ч после начала лечения (размер эффекта 0,56; p=0,03), который стойко сохранялся до 7-й недели терапии (0,51; p=0,02), в сравнении с пациентами, которые получали только фармакотерапию (n=17). Некоторые антидепрессанты улучшают некоторые показатели сна, включая эффективность сна и увеличение количества REM-сна, другие (например, трициклические антидепрессанты и селективные ингибиторы обратного захвата серотонина) оказывают негативное влияние на архитектуру сна, сокращают длительность REM-сна и увеличивают латентность REM-сна.
Предпосылкой такого подхода служит перенастройка циркадианной системы под влиянием стимулов внешней среды. Разработано несколько стратегий достижения этой цели, включая адекватный распорядок воздействия ярким белым или голубым светом, терапию мелатонином и перестройку распорядка сна и бодрствования. В одном из исследований установлен положительный эффект комбинации психофармакотерапии и циркадианных методов терапии (например, депривация сна, воздействие ярким светом и смещение фазы сна на более раннее время) в редукции депрессивных симптомов у пациентов с биполярным расстройством. У пациентов, которым в результате рандомизации была назначена дополнительная циркадианная терапия (n=32), отмечался достоверно более выраженный антидепрессивный эффект через 48 ч после начала лечения (размер эффекта 0,56; p=0,03), который стойко сохранялся до 7-й недели терапии (0,51; p=0,02), в сравнении с пациентами, которые получали только фармакотерапию (n=17). Некоторые антидепрессанты улучшают некоторые показатели сна, включая эффективность сна и увеличение количества REM-сна, другие (например, трициклические антидепрессанты и селективные ингибиторы обратного захвата серотонина) оказывают негативное влияние на архитектуру сна, сокращают длительность REM-сна и увеличивают латентность REM-сна. Поскольку REM-сон регулируется циркадианной системой, увеличение его латентности скорее свидетельствует об изменениях в циркадианной системе, нежели в гомеостатической системе сна. Нарушения других параметров, связанных с циркадианной системой, включая мелатонин, температуру тела и кортизол, также типичны для пациентов с депрессией, поэтому терапия антидепрессантами должна быть нацелена и на эти аспекты депрессивного расстройства. Подобных эффектов следует ожидать от препаратов, связывающихся с мелатонинергическими рецепторами.
Поскольку REM-сон регулируется циркадианной системой, увеличение его латентности скорее свидетельствует об изменениях в циркадианной системе, нежели в гомеостатической системе сна. Нарушения других параметров, связанных с циркадианной системой, включая мелатонин, температуру тела и кортизол, также типичны для пациентов с депрессией, поэтому терапия антидепрессантами должна быть нацелена и на эти аспекты депрессивного расстройства. Подобных эффектов следует ожидать от препаратов, связывающихся с мелатонинергическими рецепторами.
Вальдоксан
Вальдоксан является уникальным препаратом, поскольку действует как селективный агонист MT1- и MT2-рецепторов и антагонист 5HT2C-рецепторов. Вальдоксан быстро всасывается: время до максимальной концентрации в крови составляет 45–90 мин после однократной пероральной дозы 25–50 мг. После приема внутрь Вальдоксан подвергается интенсивному первичному печеночному метаболизму, который соучаствует в значительной вариабельности межиндивидуальной биодоступности. В циркулирующей крови Вальдоксан в большей части связывается протеинами плазмы (более 90%) и почти полностью метаболизируется (до 80% дозы выводится с мочой в форме метаболитов). Средний период полужизни составляет 140 мин. Вальдоксан повышает концентрации дофамина и норадреналина в префронтальной коре вследствие антагонизма к 5HT2С-рецепторам. Наряду с ожидаемыми на основании механизма действия хронобиотическими эффектами Вальдоксан также является клинически значимым антидепрессантом и обладает анксиолитическими свойствами. Предполагается, что эти психотропные эффекты обусловлены синергизмом между мелатонинергическими (MT1-, MT2-рецепторы) и моноаминергическими (5HT2C-рецепторы) эффектами. Антидепрессивный эффект Вальдоксана также может быть связан с другими нециркадианными механизмами, такими как стимуляция выработки нейротрофического фактора головного мозга. Назначение Вальдоксана молодым мужчинам перед сном приводит к смещению на более раннее время циркадианной фазы ритмов температуры тела и мелатонина, а также более раннему снижению частоты сердечных сокращений.
В циркулирующей крови Вальдоксан в большей части связывается протеинами плазмы (более 90%) и почти полностью метаболизируется (до 80% дозы выводится с мочой в форме метаболитов). Средний период полужизни составляет 140 мин. Вальдоксан повышает концентрации дофамина и норадреналина в префронтальной коре вследствие антагонизма к 5HT2С-рецепторам. Наряду с ожидаемыми на основании механизма действия хронобиотическими эффектами Вальдоксан также является клинически значимым антидепрессантом и обладает анксиолитическими свойствами. Предполагается, что эти психотропные эффекты обусловлены синергизмом между мелатонинергическими (MT1-, MT2-рецепторы) и моноаминергическими (5HT2C-рецепторы) эффектами. Антидепрессивный эффект Вальдоксана также может быть связан с другими нециркадианными механизмами, такими как стимуляция выработки нейротрофического фактора головного мозга. Назначение Вальдоксана молодым мужчинам перед сном приводит к смещению на более раннее время циркадианной фазы ритмов температуры тела и мелатонина, а также более раннему снижению частоты сердечных сокращений. Также отмечается смещение на раннее время окончания периода сна и REM-сна в отсутствие других изменений в показателях сна. Выраженные эффекты смещения фазы также зафиксированы в другом исследовании с участием здоровых пожилых мужчин – смещение на более раннее время ритмов температуры тела и кортизола под действием Вальдоксана, вновь без влияния на параметры сна. Подобные антидепрессивным эффекты Вальдоксана подтверждены в исследованиях на животных. У человека выполнена экстенсивная программа рандомизированных контролируемых исследований. Стандартные терапевтические дозы Вальдоксана в этих исследованиях составили 25–50 мг. В качестве препаратов сравнения использовались известные антидепрессанты, включая флуоксетин, пароксетин, сертралин и венлафаксин. В исследованиях с активными препаратами сравнения Вальдоксан (25–50 мг) был сопоставим по эффективности с венлафаксином (75–150 мг; форма замедленного высвобождения – 150 мг) и превосходил по эффективности флуоксетин (20–10 мг) и сертралин (50–100 мг).
Также отмечается смещение на раннее время окончания периода сна и REM-сна в отсутствие других изменений в показателях сна. Выраженные эффекты смещения фазы также зафиксированы в другом исследовании с участием здоровых пожилых мужчин – смещение на более раннее время ритмов температуры тела и кортизола под действием Вальдоксана, вновь без влияния на параметры сна. Подобные антидепрессивным эффекты Вальдоксана подтверждены в исследованиях на животных. У человека выполнена экстенсивная программа рандомизированных контролируемых исследований. Стандартные терапевтические дозы Вальдоксана в этих исследованиях составили 25–50 мг. В качестве препаратов сравнения использовались известные антидепрессанты, включая флуоксетин, пароксетин, сертралин и венлафаксин. В исследованиях с активными препаратами сравнения Вальдоксан (25–50 мг) был сопоставим по эффективности с венлафаксином (75–150 мг; форма замедленного высвобождения – 150 мг) и превосходил по эффективности флуоксетин (20–10 мг) и сертралин (50–100 мг). Достоверно более выраженное улучшение показателей сна, включая повышение качества сна (среднее различие 5,63; 95% ДИ 0,85–10,41; p=0,021), редукцию ночных пробуждений (среднее различие 4,86; 95% ДИ 0,23–9,49; p=0,040) и инсомнии (среднее различие 0,37; 95% ДИ 0,01–0,72; p=0,044) отмечалось при терапии Вальдоксаном в сравнении с венлафаксином. В длительном исследовании профилактики рецидивов депрессии частота рецидивов на 24-й неделе при терапии Вальдоксаном составила 20,6% в сравнении с 41,4% для плацебо (разница в 20,8%; 95% ДИ 11-0-30-0), а через 10 мес исследования – 23,9% для Вальдоксана против 50,0% для плацебо (разница в частоте рецидивов 26,4%; 95% ДИ 12-7-39-0). Наконец, в отличие от пароксетина Вальдоксан не вызывает симптомы отмены. Поскольку Вальдоксан не повышает уровни серотонина, он не вызывает побочных эффектов, типичных для других новых антидепрессантов (прежде всего гастроинтестинальные расстройства, головные боли, половые дисфункции, психомоторная ажитация, прибавка в массе тела), а также серьезных нежелательных явлений (таких, как серотониновый синдром или серотониновые симптомы отмены).
Достоверно более выраженное улучшение показателей сна, включая повышение качества сна (среднее различие 5,63; 95% ДИ 0,85–10,41; p=0,021), редукцию ночных пробуждений (среднее различие 4,86; 95% ДИ 0,23–9,49; p=0,040) и инсомнии (среднее различие 0,37; 95% ДИ 0,01–0,72; p=0,044) отмечалось при терапии Вальдоксаном в сравнении с венлафаксином. В длительном исследовании профилактики рецидивов депрессии частота рецидивов на 24-й неделе при терапии Вальдоксаном составила 20,6% в сравнении с 41,4% для плацебо (разница в 20,8%; 95% ДИ 11-0-30-0), а через 10 мес исследования – 23,9% для Вальдоксана против 50,0% для плацебо (разница в частоте рецидивов 26,4%; 95% ДИ 12-7-39-0). Наконец, в отличие от пароксетина Вальдоксан не вызывает симптомы отмены. Поскольку Вальдоксан не повышает уровни серотонина, он не вызывает побочных эффектов, типичных для других новых антидепрессантов (прежде всего гастроинтестинальные расстройства, головные боли, половые дисфункции, психомоторная ажитация, прибавка в массе тела), а также серьезных нежелательных явлений (таких, как серотониновый синдром или серотониновые симптомы отмены). Тошнота, головокружение и головная боль были наиболее частыми нежелательными явлениями у пациентов, получавших терапию Вальдоксаном, однако частота этих побочных эффектов была такой же, как у пациентов, получавших плацебо. Профиль побочных эффектов Вальдоксана не отличается от профиля плацебо по показателям многих типичных для антидепрессантов нежелательных явлений, включая прибавку в массе тела, половые дисфункции и эффекты отмены.
Тошнота, головокружение и головная боль были наиболее частыми нежелательными явлениями у пациентов, получавших терапию Вальдоксаном, однако частота этих побочных эффектов была такой же, как у пациентов, получавших плацебо. Профиль побочных эффектов Вальдоксана не отличается от профиля плацебо по показателям многих типичных для антидепрессантов нежелательных явлений, включая прибавку в массе тела, половые дисфункции и эффекты отмены.
Заключение
Аналоги мелатонина обладают новым и эффективным механизмом, обеспечивающим смещение фазы у человека. Хотя эти препараты исследовались преимущественно при расстройствах сна, они имеют потенциал для применения в качестве главных или дополнительных средств терапии широкого круга нейропсихических расстройств, сопровождающихся стойкими циркадианными нарушениями. Важно, что только Вальдоксан (который также связывается с 5HT2C-рецепторами) оказывает клинически значимый антидепрессивный эффект. Благодаря благоприятному профилю побочных эффектов и безопасности и способности восстанавливать нормальную циркадианную функцию между депрессивными эпизодами, этот препарат может занять уникальное место в терапии некоторых пациентов с тяжелой депрессией и другими развернутыми аффективными расстройствами.
ФАРМАТЕКА » Современные антидепрессанты: проблемы рационального выбора
Рассматриваются особенности антидепрессантов, относящихся к группам ингибиторов МАО, триклицических антидепрессантов, селективных ингибиторов обратного захвата серотонина, ингибиторов обратного захвата норадреналина, антидепрессантов “двойного” действия, стимуляторов обратного захвата серотонина со смешанным механизмом действия, а также препаратов зверобоя. Подчеркивается, что существующие в настоящее время антидепрессанты у большинства больных обладают сходной эффективностью и различаются преимущественно профилем побочных эффектов. Выбор препарата конкретному больному определяется потенциальной безопасностью и переносимостью, предполагаемой приверженностью лечению и эффективностью терапии в анамнезе (при наличии такого опыта).
В настоящее время на мировом фармацевтическом рынке находится около 50 антидепрессантов различных фармакологических групп, позволяющих осуществлять рациональный выбор препарата конкретному больному.
Классификация антидепрессантов
Существует несколько классификаций антидепрессантов:
- по поколениям;
- химической структуре;
- механизму;
- направленности психотропного действия.
Общепринятой классификации по поколениям нет: разные авторы выделяют от двух до пяти поколений антидепрессантов. Чаще используют термины “старые антидепрессанты”, к которым относят ингибиторы моноаминооксидазы (МАО) необратимого действия и трициклические антидепрессанты (ТЦА), и “новые антидепрессанты” – ингибиторы МАО обратимого действия, селективные ингибиторы обратного захвата серотонина (СИОЗС), ингибиторы обратного захвата норадреналина (ИОЗН), препараты “двойного” действия (например, ингибиторы обратного захвата серотонина и норадреналина – ИОЗСН) и др. Наиболее широкое распространение получила классификация, основанная на механизме действия (табл. 1). Последствия блокады основных рецепторов представлены в табл. 2.
Кроме того, практическое значение имеет подразделение антидепрессантов на препараты с седативным (тримипрамин, доксепин, амитриптилин, пипофезин, миансерин, миртазапин, тразодон, флувоксамин), стимулирующим (имипрамин, дезипрамин, нортриптилин, флуоксетин, моклобемид) или сбалансированным (кломипрамин, мапротилин, сертралин, пиразидол) действием.
Ингибиторы моноаминооксидазы
Неселективные ингибиторы МАО (типов А и В) необратимого действия были первыми антидепрессантами, введенными в медицинскую практику. В настоящее время их применяют редко из–за частого развития побочных эффектов, необходимости соблюдения “бестираминовой” диеты, сложности дозирования и высокого риска летальных исходов при передозировке. По антидепрессантной активности ингибиторы МАО в целом аналогичны ТЦА, однако могут превосходить последние по эффективности при депрессии с выраженным симптомом усталости и у больных с высокой психологической чувствительностью к отверженности или неудаче межличностных отношений [3]. Они могут быть также полезны пациентам, не ответившим на лечение ТЦА [4].
Новые представители этой группы препаратов – селективные ингибиторы МАО–А (пиразидол, моклобемид) отличаются от предшественников значительно меньшей токсичностью и лучшей переносимостью. В ряде клинических исследований показаны их эффективность и безопасность при применении в общесоматической практике.
Мета–анализы клинических исследований моклобемида показали, что по эффективности при тяжелой депрессии, “двойной” депрессии (большое депрессивное расстройство [БДР], накладывающееся на дистимию) и депрессии, сопровождающейся симптомами тревоги и ажитации, он не уступает ТЦА [5, 6]. Особенно хороший ответ на лечение моклобемидом наблюдался у пациентов с БДР, имеющим меланхолический компонент.
Селегилин, обладающий в низких дозах (до 10 мг/сут) селективностью в отношении МАО типа В, преимущественно применяют для лечения болезни Паркинсона. В более высоких дозах, необходимых для лечения депрессии, селективность препарата в отношении МАО–В утрачивается и его свойства приближаются к свойствам “старых” ингибиторов МАО. При пероральном применении препарата в этих дозах необходимо исключение из питания продуктов, содержащих тирамин. Однако этот недостаток можно преодолеть, по крайней мере частично, при использовании трансдермальной лекарственной формы селегилина, одобренной FDA в конце февраля 2006 г. Основанием для ее разрешения стали результаты двух двойных слепых рандомизированных исследований с участием более 440 пациентов, в которых было показано, что пластырь, предназначенный для однократного применения в сутки и содержащий селегилин в дозе 6 мг, обладает выраженным антидепрессивным действием и не вызывает угнетения МАО в пищеварительной системе [7, 8]. При применении пластырей, содержащих более высокие дозы препарата (9 и 12 мг/сут), рекомендуется соблюдение тех же предосторожностей, что и при использовании пероральных неселективных ингибиторов МАО, включая “бестираминовую” диету.
Основанием для ее разрешения стали результаты двух двойных слепых рандомизированных исследований с участием более 440 пациентов, в которых было показано, что пластырь, предназначенный для однократного применения в сутки и содержащий селегилин в дозе 6 мг, обладает выраженным антидепрессивным действием и не вызывает угнетения МАО в пищеварительной системе [7, 8]. При применении пластырей, содержащих более высокие дозы препарата (9 и 12 мг/сут), рекомендуется соблюдение тех же предосторожностей, что и при использовании пероральных неселективных ингибиторов МАО, включая “бестираминовую” диету.
Трициклические антидепрессанты
В группу ТЦА входит ряд препаратов, различающихся по химической структуре (вторичные и третичные амины), механизмам и направленности психотропного действия. ТЦА оказывают сильный антидепрессивный эффект и по эффективности при тяжелой депрессии превосходят некоторые более новые группы препаратов, в частности СИОЗС. Однако ТЦА значительно уступают антидепрессантам последующих поколений по безопасности и переносимости. Относительно неблагоприятный профиль побочных эффектов ТЦА обусловлен главным образом их антихолинергическими, антиадренергическими и антигистаминными свойствами. Антихолинергические и седативные свойства выражены у вторичных аминов (нортриптилин, дезипрамин) меньше, чем у третичных, поэтому они обычно лучше переносятся больными.
Относительно неблагоприятный профиль побочных эффектов ТЦА обусловлен главным образом их антихолинергическими, антиадренергическими и антигистаминными свойствами. Антихолинергические и седативные свойства выражены у вторичных аминов (нортриптилин, дезипрамин) меньше, чем у третичных, поэтому они обычно лучше переносятся больными.
ТЦА могут вызывать разнообразные нежелательные эффекты со стороны сердечно–сосудистой системы: тахикардию, нарушения проводимости, ортостатическую гипотензию. Уже в терапевтических дозах они могут приводить к удлинению интервалов PQ, QRS и QT, особенно у пациентов с исходными нарушениями проводимости [9]. Удлинение интервала QT способствует развитию желудочковой аритмии по типу пируэта (torsades de pointes). Ее риск значительно возрастает при одновременном применении ТЦА с другими препаратами, удлиняющими QT. ТЦА могут вызывать атриовентрикулярную блокаду I и II степеней, асистолию и внезапную кардиальную смерть, риск которой повышается при применении доз, эквивалентных более 100 мг амитриптилина [10].
У больных ИБС применение ТЦА ассоциируется с повышением риска заболеваемости, включая инфаркт миокарда, и смертности [11, 12]. Поэтому препараты этой группы не рекомендуют назначать пациентам с выраженной кардиоваскулярной патологией [11–13]. Применения ТЦА также рекомендуется избегать у больных со склонностью к ортостатической гипотонии и у пациентов, получающих антигипертензивную терапию. Опасность для кардиологических больных могут представлять и последствия лекарственных взаимодействий ТЦА, например с клонидином, антиаритмическими препаратами, варфарином и ацетилсалициловой кислотой. В период лечения ТЦА рекомендуется мониторировать концентрации препаратов в крови, артериальное давление и ЭКГ [14].
Выраженная холинолитическая активность обусловливает неблагоприятное влияние ТЦА на когнитивные функции (ухудшение памяти, снижение концентрации внимания, затруднение интеллектуальной деятельности), что особенно опасно для лиц пожилого возраста и больных с исходными когнитивными нарушениями. ТЦА противопоказаны пациентам с глаукомой, гипертрофией предстательной железы, непроходимостью кишечника, судорожными припадками и делирием в анамнезе.
ТЦА противопоказаны пациентам с глаукомой, гипертрофией предстательной железы, непроходимостью кишечника, судорожными припадками и делирием в анамнезе.
К недостаткам ТЦА относятся также узкий терапевтический индекс, высокий риск летальности при передозировке и необходимость титрации дозы. Угрожающие жизни кардиотоксические эффекты, в т. ч. с летальным исходом, могут возникать уже при десятикратном превышении терапевтической дозы ТЦА. Этим обусловлена нежелательность применения препаратов этой группы у больных с суицидальными мыслями.
Плохая переносимость ТЦА зачастую вынуждает снижать их дозы или отменять лечение. На практике только 20–25 % пациентов получают адекватные дозы ТЦА, что в свою очередь способствует снижению эффективности терапии [15].
С учетом плохой переносимости ТЦА и наличия на рынке более безопасных альтернатив их применение в настоящее время рекомендуют резервировать для тяжелых, рефрактерных и резистентных случаев депрессии.
Селективные ингибиторы обратного захвата серотонина
СИОЗС обладают широким спектром фармакологической активности, оказывая выраженные антидепрессивный, анксиолитический, антипанический и анальгетический эффекты.
СИОЗС несколько менее эффективны, чем ТЦА, при тяжелой депрессии и депрессии с меланхолическим компонентом, но равно эффективны с ними при легких и среднетяжелых депрессиях. У больных с выраженными физическими симптомами или болью СИОЗС могут уступать ТЦА и селективным ИОЗН [16]. Однако они более эффективны, чем селективные ИОЗН, у лиц молодого возраста (18–24 года) [17], а флуоксетин является единственным антидепрессантом с доказанной эффективностью у детей и подростков [18].
СИОЗС рекомендуют отдавать предпочтение перед ТЦА у лиц с биполярной депрессией, т. к. ТЦА могут индуцировать у этой категории больных манию или гипоманию. Благоприятное соотношение эффективность/безопасность, подтвержденное в многочисленных адекватных клинических исследованиях, позволяет рассматривать СИОЗС в качестве препаратов первого ряда в общесоматической практике, в т. ч. у кардиологических больных [14, 19], лиц пожилого возраста [20], беременных и кормящих грудью женщин [21, 22].
На сегодняшний день они являются наиболее широкоприменяемыми антидепрессантами в первичном звене оказания медицинской помощи во всем мире [23].
Более низкий риск кардиотоксичности СИОЗС по сравнению с ТЦА обусловлен практически полным отсутствием антихилинергического, антиадренергического и антигистаминного действий. Более того, результаты клинических исследований позволяют предположить наличие кардиопротективного эффекта у пароксетина, флуоксетина и сертралина, которое связывают с истощением под их влиянием запасов серотонина в тромбоцитах и блокадой внутриклеточной мобилизации кальция. В самом большом (n = 369) исследовании СИОЗС в кардиологии – The Sertraline Antidepressant Heart Randomized Trial (SADHART) – прослеживалась тенденция к снижению смертности больных острым инфарктом миокарда или нестабильной стенокардией с БДР, получавших сертралин [24]. Частота неблагоприятных кардиоваскулярных явлений составила в группе сертралина 14,5 против 22,4 % в группе плацебо.
К достоинствам СИОЗС относятся отсутствие у них выраженной поведенческой токсичности, возможность проведения лечения фиксированными дозами или минимальная потребность в титрации, а также высокая безопасность при передозировке.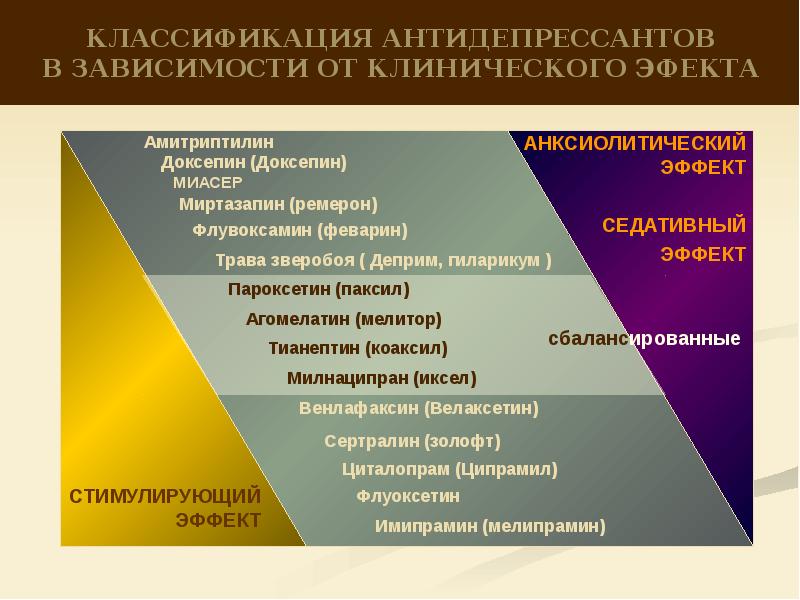 Превышение суточной дозы СИОЗС до 30 раз ассоциируется с минимальным количеством неблагоприятных симптомов или их полным отсутствием, более высокая передозировка обычно приводит к сонливости, тремору, тошноте и рвоте. При превышении суточной дозы более чем в 75 раз возможно развитие таких осложнений, как судороги, изменения на ЭКГ и нарушение сознания. Описан случай превышения дозы сертралина в 270 раз без серьезных последствий. Летальные исходы при применении СИОЗС почти во всех случаях обусловлены их взаимодействиями с алкоголем или другими лекарственными средствами [25, 26].
Превышение суточной дозы СИОЗС до 30 раз ассоциируется с минимальным количеством неблагоприятных симптомов или их полным отсутствием, более высокая передозировка обычно приводит к сонливости, тремору, тошноте и рвоте. При превышении суточной дозы более чем в 75 раз возможно развитие таких осложнений, как судороги, изменения на ЭКГ и нарушение сознания. Описан случай превышения дозы сертралина в 270 раз без серьезных последствий. Летальные исходы при применении СИОЗС почти во всех случаях обусловлены их взаимодействиями с алкоголем или другими лекарственными средствами [25, 26].
Несмотря на более высокую цену СИОЗС по сравнению с ТЦА, стоимость лечения препаратами этих групп аналогична. Это обусловлено тем, что применение СИОЗС сопряжено с меньшим количеством побочных эффектов, требующих медикаментозной коррекции, и меньшей частотой переключения на антидепрессанты других групп [27].
Препараты группы СИОЗС в целом обладают сходной эффективностью при депрессии. В мета–анализе клинических исследований было выявлено лишь небольшое, но достоверное превосходство сертралина над флуоксетином [28]. Для СИОЗС характерен и сходный спектр безопасности, хотя частота отдельных побочных эффектов при применении разных препаратов может различаться [29]. Так, флуоксетин чаще вызывает нервозность, беспокойство, дерматологические реакции, снижение аппетита и массы тела, сертралин – диарею, а пароксетин – сухость во рту [30]. Для пароксетина характерен также более тяжелый синдром отмены, чем для других СИОЗС [31].
Для СИОЗС характерен и сходный спектр безопасности, хотя частота отдельных побочных эффектов при применении разных препаратов может различаться [29]. Так, флуоксетин чаще вызывает нервозность, беспокойство, дерматологические реакции, снижение аппетита и массы тела, сертралин – диарею, а пароксетин – сухость во рту [30]. Для пароксетина характерен также более тяжелый синдром отмены, чем для других СИОЗС [31].
Различия в частоте и выраженности побочных эффектов СИОЗС обусловлены как фармакодинамическими, так и фармакокинетическими особенностями этих препаратов. Наряду с основным механизмом действия, связанным с угнетением обратного захвата серотонина, практически все препараты имеют дополнительные механизмы: пароксетин обладает антихолинергическими свойствами и угнетает кальцийзависимую синтетазу NO (NOS), флуоксетин является агонистом 5–HT2–рецепторов, сертралин ингибирует обратный захват дофамина. Большинство СИОЗС имеют достаточно длительный период полувыведения (около суток), позволяющий применять их 1 раз в день, что благоприятно влияет на аккуратность соблюдения пациентом назначенного режима лечения. Исключение составляет флувоксамин, который необходимо принимать 2 раза в сутки. Самый длительный период полувыведения характерен для флуоксетина (T½ препарата – 2–3 суток, активного метаболита – 5–21 сутки). Длительный период полувыведения флуоксетина обусловливает меньший риск развития синдрома отмены в случае резкого прекращения лечения и полезен недисциплинированным пациентам, плохо соблюдающим назначенный режим терапии [32]. Кроме того, после отмены флуоксетина требуется более продолжительный (5 недель) период “отмывания” перед назначением других лекарственных средств, влияющих на серотонинергические процессы, например ингибиторов МАО или суматриптана, а побочные эффекты флуоксетина могут персистировать в течение более длительного времени, чем таковые других СИОЗС [33].
Исключение составляет флувоксамин, который необходимо принимать 2 раза в сутки. Самый длительный период полувыведения характерен для флуоксетина (T½ препарата – 2–3 суток, активного метаболита – 5–21 сутки). Длительный период полувыведения флуоксетина обусловливает меньший риск развития синдрома отмены в случае резкого прекращения лечения и полезен недисциплинированным пациентам, плохо соблюдающим назначенный режим терапии [32]. Кроме того, после отмены флуоксетина требуется более продолжительный (5 недель) период “отмывания” перед назначением других лекарственных средств, влияющих на серотонинергические процессы, например ингибиторов МАО или суматриптана, а побочные эффекты флуоксетина могут персистировать в течение более длительного времени, чем таковые других СИОЗС [33].
Флуоксетин является мощным ингибитором CYP2 D62 и 2C9/10, а также взаимодействует с другими изоферментами цитохрома Р450 – 2C19 и 3A¾, что обусловливает высокий риск неблагоприятных последствий лекарственных взаимодействий, включая серотониновый синдром [33]. Минимальный риск лекарственных взаимодействий характерен для сертралина, циталопрама и эсциталопрама, оказывающих слабое действие на изоферменты цитохрома Р450.
Минимальный риск лекарственных взаимодействий характерен для сертралина, циталопрама и эсциталопрама, оказывающих слабое действие на изоферменты цитохрома Р450.
Ко многим побочным эффектам СИОЗС в течение нескольких недель развивается толерантность. Например, в начале лечения достаточно частым побочным эффектом, связанным с повышением серотонинергической активности в желудочно–кишечном тракте является тошнота, однако она, как правило, проходит в течение первой недели лечения [29].
Благодаря благоприятному соотношению польза/риск, доказанному в многочисленных клинических исследованиях, мета–анализах и при многолетнем широком практическом применении, СИОЗС рассматриваются в качестве препаратов выбора у большинства больных с нетяжелой депрессией, особенно в общесоматической практике.
Игибиторы обратного захвата норадреналина
К антидепрессантам, преимущественно угнетающим обратный захват норадреналина, относятся препараты из группы ТЦА, – нортриптилин, мапротилин и дезипрамин, а также селективный ИОЗН – ребоксетин.
При БДР ребоксетин в целом сходен по эффективности с ТЦА и СИОЗС [34]. В клинических исследованиях он превосходил имипрамин у больных депрессией с меланхолическим компонентом и флуоксетин – при тяжелых БДР [35]. Ребоксетин демонстрировал также существенные преимущества перед флуоксетином в отношении улучшения социального функционирования больных. Результаты небольших исследований позволяют предположить, что клинический эффект ребоксетина развивается быстрее (начало – в среднем через 10 дней), чем у антидепрессантов других групп. Возможно, он лучше СИОЗС устраняет симптомы тревоги у больных БДР [36].
Ребоксетин значительно превосходит ТЦА по переносимости. Он обладает слабым антихолинергическим действием, поэтому значительно реже ТЦА вызывает сухость во рту и запоры. В клинических исследованиях побочные эффекты ребоксетина носили преимущественно легкий или умеренный характер. Он не приводил к нарушению жизненно важных функций и лабораторных показателей. В исследованиях короткой продолжительности частота отмены препарата не отличалась от таковой плацебо. Ребоксетин не вызывает выраженной тошноты, диареи, гипотензии и седативного эффекта. Нарушения сексуальной функции наблюдаются у небольшой части пациентов, преимущественно при применении дозы выше 8 мг/сут. Ребоксетин не обладает кардиотоксичностью, не нарушает когнитивных функций и не ассоциируется с повышенным риском судорог или ортостатической гипотензии. В сравнительном исследовании с флуоксетином он превосходил последний по желудочно–кишечной и центральной (ажитация/нервозность/тревога) переносимости [37].
Ребоксетин не вызывает выраженной тошноты, диареи, гипотензии и седативного эффекта. Нарушения сексуальной функции наблюдаются у небольшой части пациентов, преимущественно при применении дозы выше 8 мг/сут. Ребоксетин не обладает кардиотоксичностью, не нарушает когнитивных функций и не ассоциируется с повышенным риском судорог или ортостатической гипотензии. В сравнительном исследовании с флуоксетином он превосходил последний по желудочно–кишечной и центральной (ажитация/нервозность/тревога) переносимости [37].
Достоинствами ребокситина являются низкий потенциал лекарственных взаимодействий и отсутствие синдрома отмены.
При депрессивных расстройствах ребоксетин рассматривается в качестве эффективной и безопасной альтернативы СИОЗС и ТЦА. Кроме того, он может быть новой опцией для лечения булимии [38].
Антидепрессанты “двойного” действия
К препаратам, примерно в равной степени угнетающим обратный захват серотонина и норадреналина, относятся некоторые ТЦА, в частности имипрамин и амитриптилин. Новыми ИОЗСН являются венлафаксин, дулоксетин и милнаципран. Они блокируют переносчики моноаминов более избирательно, чем ТЦА, в связи с чем не влияют на сердечную проводимость [34]. Между собой эти препараты различаются селективностью действия: милнаципран в равной степени блокирует обратный захват серотонина и норадреналина, а дулоксетин (в 10 раз) и венлафаксин (в 30 раз) сильнее блокируют захват серотонина, чем норадреналина [39].
Новыми ИОЗСН являются венлафаксин, дулоксетин и милнаципран. Они блокируют переносчики моноаминов более избирательно, чем ТЦА, в связи с чем не влияют на сердечную проводимость [34]. Между собой эти препараты различаются селективностью действия: милнаципран в равной степени блокирует обратный захват серотонина и норадреналина, а дулоксетин (в 10 раз) и венлафаксин (в 30 раз) сильнее блокируют захват серотонина, чем норадреналина [39].
В клинических исследованиях венлафаксин превосходил ТЦА и флуоксетин по эффективности лечения острого эпизода тяжелой депрессии, способности предупреждать рецидивы заболевания [40–42]. Он также превосходил СИОЗС у пациентов с тяжелыми БДР и резистентной депрессией. Дулоксетин проявлял сходную эффективность с пароксетином [43], милнаципран – с СИОЗС и имипрамином [44–46]. Помимо депрессии новые ИОЗСН также эффективны при тревожных расстройствах.
Результаты клинических исследований позволяют предположить, что терапевтический эффект ИОЗСН развивается быстрее, чем СИОЗС [47].
По переносимости новые ИОЗСН превосходят ТЦА, что связано прежде всего с отсутствием у них влияния на вегетативную нервную систему. Венлафаксин, по–видимому, переносится хуже, чем дулоксетин и милнаципран [48]. Он вызывает седативный эффект, тошноту, нарушение сексуальной функции, дозозависимое (> 200 мг/сут) повышение АД и синдром отмены. В открытом сравнительном исследовании с четырьмя СИОЗС переносимость венлафаксина при длительном применении в максимально переносимых дозах не отличалась от таковой препаратов сравнения [49]. Однако риск летальных исходов при передозировке венлафаксина выше, чем при применении других серотонинергических препаратов, поэтому его надо с осторожностью назначать больным с суицидальными намерениями [50]. При применении венлафаксина следует соблюдать также бдительность в отношении серотонинового синдрома. Для предупреждения синдрома отмены дозы венлафаксина надо снижать постепенно.
Профиль побочных эффектов дулоксетина сходен с таковым СИОЗС [51]. В клинических исследованиях он вызывал побочные эффекты легкой и средней тяжести, которые носили преимущественно транзиторный характер [52]. Основной причиной отмены дулоксетина была тошнота. Он вызывал также небольшое повышение АД и частоты сердечных сокращений, которое, по мнению некоторых авторов, не имеет клинического значения [52]. Тем не менее гипертоникам его следует назначать с осторожностью [51]. Применение дулоксетина не рекомендовано больным с клиренсом креатинина < 30 мл/мин и/или нарушением функции печени [51].
В клинических исследованиях он вызывал побочные эффекты легкой и средней тяжести, которые носили преимущественно транзиторный характер [52]. Основной причиной отмены дулоксетина была тошнота. Он вызывал также небольшое повышение АД и частоты сердечных сокращений, которое, по мнению некоторых авторов, не имеет клинического значения [52]. Тем не менее гипертоникам его следует назначать с осторожностью [51]. Применение дулоксетина не рекомендовано больным с клиренсом креатинина < 30 мл/мин и/или нарушением функции печени [51].
Милнаципран отличается благоприятными фармакокинетическими свойствами. Он быстро всасывается в желудочно–кишечном тракте, имеет высокую биодоступность и низкую степень связывания с белками плазмы. Препарат быстро выводится из организма, подвергаясь глюкуронированию в печени и на 90 % выделяясь в неизмененном виде с мочой. Благоприятная фармакокинетика способствует повышению безопасности препарата. Фармакокинетическими преимуществами милнаципрана перед большинством других антидепрессантов являются небольшие межиндивидуальные колебания концентраций в крови, слабое влияние на систему цитохрома Р450 и низкий потенциал лекарственных взаимодействий [53]. Возможно, по переносимости милнаципран несколько превосходит СИОЗС [54]. В частности, он реже СИОЗС вызывает желудочно–кишечные побочные эффекты и тревогу, но чаще – головную боль, сухость во рту и дизурию [55]. Дизурия наблюдается примерно у 7 % мужчин, получающих милнаципран [56]. Отсутствие кардиотоксичности при передозировке обусловливает значительно более высокую безопасность милнаципрана по сравнению с ТЦА [57].
Возможно, по переносимости милнаципран несколько превосходит СИОЗС [54]. В частности, он реже СИОЗС вызывает желудочно–кишечные побочные эффекты и тревогу, но чаще – головную боль, сухость во рту и дизурию [55]. Дизурия наблюдается примерно у 7 % мужчин, получающих милнаципран [56]. Отсутствие кардиотоксичности при передозировке обусловливает значительно более высокую безопасность милнаципрана по сравнению с ТЦА [57].
Антидепрессанты “двойного” действия, угнетающие обратный захват серотонина и норадреналина, могут быть рекомендованы больным с выраженной соматизированной тревогой и патологическим аффектом. Преимуществом новых ИОЗСН перед СИОЗС является более высокая эффективность в облегчении хронической боли, как ассоциированной с депрессией, так и не зависимой от нее [58]. Показана эффективность венлафаксина и дулоксетина при боли, обусловленной диабетической нейропатией, и боли при первичной или вторичной депрессии [59–61]. Дулоксетин официально одобрен FDA для лечения боли, ассоциированной с диабетической периферической нейропатией у взрослых [62]. Дулоксетин и милнаципран представляются перспективными препаратами для лечения фибромиалгии. В клинических исследованиях они устраняли не только боль, но и другие симптомы фибромиалгии у 60 % пациентов [63].
Дулоксетин и милнаципран представляются перспективными препаратами для лечения фибромиалгии. В клинических исследованиях они устраняли не только боль, но и другие симптомы фибромиалгии у 60 % пациентов [63].
К препаратам с двойным механизмом действия относят и бупропион, угнетающий обратный захват норадреналина и дофамина [1]. По эффективности он близок ТЦА [34] и СИОЗС [64]. Отсутствие у бупропиона влияния на серотонинергические процессы обусловливает отличия в профиле его побочных эффектов от СИОЗС. Он реже вызывает тошноту, диарею, сонливость и ухудшение сексуальной функции. Напротив, препарат может стимулировать сексуальную активность. Это позволяет применять бупропион для усиления эффектов СИОЗС или профилактики их побочных эффектов. Бупропион может быть эффективной альтернативой СИОЗС, в т. ч. у больных, не ответивших на лечение этими препаратами [65, 66]. Он нашел широкое применение для облегчения отвыкания от табакокурения.
В дозах, не превышающих 450 мг/сут, бупропион способствует инверсии фазы у больных с биполярной депрессией в меньшей степени, чем другие антидепрессанты [67].
К числу серьезных побочных эффектов бупропиона при применении в высоких дозах (однократная доза более 200 мг или суточная более 450 мг) и/или у пациентов с припадками в анамнезе относятся судороги. Риск их развития уменьшается при делении суточной дозы на несколько приемов [30], однако такой режим применения может привести к снижению приверженности пациентов лечению.
Стимуляторы обратного захвата серотонина
В группу стимуляторов обратного захвата серотонина входит один препарат – тианептин. По химической структуре он является трициклическим соединением дибензотиазепинового типа. Механизм действия тианептина остается не до конца ясным. Показано, что он стимулирует обратный захват серотонина при однократном и длительном введении, но не влияет на постсинаптические серотониновые рецепторы. В последнее время широко обсуждается влияние тианептина на нейропластические процессы в головном мозге, в частности в гиппокампе. У животных с экспериментальной моделью депрессии на фоне хронического стресса он приводил к нормализации различных параметров пластичности гиппокампа, а также повышал устойчивость к стрессу [68, 69].
В краткосрочных исследованиях (продолжительностью от 4 недель до 3 месяцев) тианептин проявлял сходную эффективность с ТЦА и СИОЗС. Он не уступал амитриптилину, импрамину и флуоксетину по устранению тревоги у больных БДР, биполярными расстройствами и дистимией, превосходя в этом отношении мапротилин [70]. Следует отметить, что амитриптилин и мапротилин применялись в этих исследованиях в субмаксимальных дозах.
Длительная терапия тианептином позволяла эффективно предупреждать рецидивы депрессии. Препарат эффективен у больных эндогенной депрессией и у лиц с синдромом отмены алкоголя [71].
Тианептин не влияет на альфа1–адренергические Н1–гистаминовые рецепторы, в значительной мере определяющие седативные свойства антидепрессантов, а также на М–холинорецепторы. Он оказывает сбалансированное действие на ЦНС, обладая при этом анксиолитическими свойствами [72]. Препарат не оказывает существенного влияния на сердечно–сосудистую систему. В клинических исследованиях при его применении наблюдалось небольшое уменьшение частоты сердечных сокращений, не сопровождавшееся изменениями проводимости [73], и в редких случаях – ортостатическая гипотензия [70]. Производитель указывает, что при применении препарата возможны тахикардия, экстрасистолия, стенокардия и загрудинная боль, однако в большом фармакоэпидемиологическом исследовании КОМПАС, проведенном в России в 2002 г., тианептин зарекомендовал себя безопасным средством лечения депрессивных состояний у больных с сопутствующими соматическими заболеваниями, включая сердечно–сосудистые [74].
Производитель указывает, что при применении препарата возможны тахикардия, экстрасистолия, стенокардия и загрудинная боль, однако в большом фармакоэпидемиологическом исследовании КОМПАС, проведенном в России в 2002 г., тианептин зарекомендовал себя безопасным средством лечения депрессивных состояний у больных с сопутствующими соматическими заболеваниями, включая сердечно–сосудистые [74].
Тианептин не оказывает негативного влияния на когнитивные функции. Напротив, есть сведения, что он может способствовать улучшению памяти, концентрации внимания и улучшению ориентации. Он не изменяет психомоторную активность и в отличие от большинства других антидепрессантов мало влияет на сексуальную функцию [75].
Тианептин хорошо переносится больными при кратковременном и длительном применении. В клинических исследованиях он реже амитриптилина вызывал такие побочные эффекты, как сухость во рту (20 против 38 %), запор (15 против 19 %), головокружение/синкопе (13 против 23 %), сонливость (10 против 17 %), и ортостатическую гипотензию (3 против 8 %), но чаще – бессонницу и кошмарные сновидения (20 против 7 %) [70]. Препарат редко вызывает гепатотоксические реакции. Прием тианептина может сопровождаться небольшим увеличением массы тела [76].
Препарат редко вызывает гепатотоксические реакции. Прием тианептина может сопровождаться небольшим увеличением массы тела [76].
Тианептин имеет достаточно благоприятный фармакокинетический профиль (высокая биодоступность, отсутствие метаболизма при первом проходе через печень, ограниченное распределение и быстрое выведение), обеспечивающий ему существенные преимущества перед типичными ТЦА. Однако его быстрое выведение из организма повышает значение строгого соблюдения назначенного режима лечения и ограничивает применение тианептина у недисциплинированных больных [71]. После прекращения лечения тианептином синдром отмены развивается очень редко [77].
Тианептин рекомендуют для лечения невротических, соматоформных расстройств, депрессии у лиц пожилого возраста или тревожных и депрессивных расстройств в период абстиненции у больных хроническим алкоголизмом [70, 71, 78].
Антидепрессанты со смешанным механизмом действия
Митразапин блокирует центральные пресинаптические альфа2–адренергические ауто– и гетерорецепторы и усиливает адрено– и серотонинергическую передачу в ЦНС. Стимулируя передачу импульсов через серотониновые 5–HT1–рецепторы, он угнетает 5–HT2– и 5–HT3–рецепторы [79]. Препарат слабо влияет на альфа1–адренорецепторы и холинорецепторы, умеренно блокирует гистаминовые h2–рецепторы. Он угнетает также альфа–адренорецепторы и М–холинорецепторы на периферии, что приводит к развитию ортостатической гипотензии и антихолинергических побочных эффектов.
Стимулируя передачу импульсов через серотониновые 5–HT1–рецепторы, он угнетает 5–HT2– и 5–HT3–рецепторы [79]. Препарат слабо влияет на альфа1–адренорецепторы и холинорецепторы, умеренно блокирует гистаминовые h2–рецепторы. Он угнетает также альфа–адренорецепторы и М–холинорецепторы на периферии, что приводит к развитию ортостатической гипотензии и антихолинергических побочных эффектов.
Эффективность миртазапина у больных БДР была установлена в плацебо–контролируемых и сравнительных исследованиях с амитриптилином, кломипрамином, доксепином, флуоксетином, пароксетином, циталопрамом и венлафаксином. Показана его эффективность при депрессиях, резистентных к СИОЗС и ТЦА, и у больных с непереносимостью препаратов этих групп [80, 81]. Миртазапин эффективен при депрессии с сопутствующими симптомами тревоги и нарушениями сна. Он показан также пациентам с пониженной массой тела [82].
Клинический эффект препарата развивается достаточно быстро – через 1–2 недели, что может объясняться его двойным механизмом действия [83].
Наиболее частыми побочными эффектами миртазапина являются дозозависимая сонливость (54 %), сухость во рту (25 %), головокружение (7 %), повышение аппетита (17 %) и массы тела (12 %) [84]. Выраженность некоторых побочных эффектов, например сонливости и прибавки веса, имеет тенденцию к уменьшению при длительном применении препарата и повышении дозы. Миртазапин обладает низкой кардиотоксичностью и редко вызывает ортостатическую гипотензию [85]. В отличие от СИОЗС он крайне редко вызывает сексуальную дисфункцию. В период лечения миртазапином может наблюдаться умеренное повышение уровня холестерина, триглицеридов и аланиноаминотрансферазы. Самым серьезным побочным эффектом препарата является агранулоцитоз, который встречается с частотой 1 : 1000 и носит обратимый характер [84]. Митразапин подвергается интенсивному метаболизму в печени с участием CYP 1A2, 2D6 и 3A4, однако обладает низким риском лекарственных взаимодействий.
Место миртазапина в клинической практике окончательно не установлено, хотя в большинстве случаев его рассматривают как препарат второго ряда. В качестве препарата первого ряда он может применяться у пациентов с тяжелой тревогой или бессонницей [84].
В качестве препарата первого ряда он может применяться у пациентов с тяжелой тревогой или бессонницей [84].
Миансерин является тетрациклическим антидепрессантом, оказывающим антагонистический эффект по отношению к постсинаптическим
5–НТ2–рецепторам, а также угнетающим альфа1– и альфа2–адренорецепторы.
Препарат обладает антидепрессивными и седативными свойствами и рекомендован для лечения депрессивных расстройств, в т. ч. сопровождающихся тревогой. Он может применяться совместно с СИОЗС для усиления их эффекта [86].
По эффективности миансерин сопоставим с ТЦА, но оказывает значительно более слабое антихолинергическое действие, не обладает кардиотоксичностью и относительно безопасен при передозировке [87, 88]. Его применение ассоциируется с повышением риска лейкопении и агранулоцитоза [89].
В целом миансерин хорошо переносится больными с сердечно–сосудистыми заболеваниями, в т. ч. перенесшими инфаркт миокарда, и пожилыми пациентами [87]. В клинических исследованиях частота отмены миансерина у соматических больных с депрессией была достоверно ниже, чем при применении плацебо [90]. Тем не менее при использовании препарата у пожилых следует помнить о возможном неблагоприятном влиянии на когнитивные функции – ухудшении внимания и способности концентрироваться [91].
Тем не менее при использовании препарата у пожилых следует помнить о возможном неблагоприятном влиянии на когнитивные функции – ухудшении внимания и способности концентрироваться [91].
Нефазодон помимо антагонизма с 5–HT2–рецепторами умеренно угнетает также обратный захват серотонина, норадреналина и дофамина. По эффективности он близок СИОЗС, но реже вызывает сексуальную дисфункцию и расстройства сна [92, 93]. Нефазодон обладает анксиолитическими свойствами и оказывает благоприятное влияние на структуру сна. Наиболее частый побочный эффект препарата – седация. Он может вызывать также головную боль, сухость во рту, тошноту, головокружение, ортостатическую гипотензию и повышение массы тела.
Нефазодон особенно показан женщинам с послеродовой депрессией, пациентам с тяжелой депрессией и с резистентными к лечению БДР с тревогой [1]. Однако его применение ограничивают редкие случаи тяжелой гепатотоксичности, ставшие причиной добровольного отзыва производителем с мирового фармацевтического рынка оригинального препарата нефазодон.
Близкий по химической структуре нефазодону тразодон угнетает 5–HT2–рецепторы и альфа1–адренорецепторы. Он имеет ограниченное самостоятельное применение в качестве антидепрессанта. Чаще его назначают в сочетании с СИОЗС при депрессиях, в структуре которых существенное место занимают тревога и нарушение сна. В низких дозах (50–100 мг) препарат используют для лечения бессонницы. Однако соотношение риск/польза при применении тразодона в качестве снотворного средства у лиц, не страдающих депрессией, особенно пожилого возраста, не определено [94]. Его выраженные седативные свойства способствуют сонливости, снижению активности пациентов и затруднению выполнения ими повседневных обязанностей и профессиональной деятельности. Помимо седации тразодон вызывает головокружение и психомоторные нарушения, часто являющиеся причиной его отмены. У пожилых пациентов он может снижать способность к концентрации внимания [91]. В редких случаях тразодон вызывает приапизм. Недавно описан случай приапизма, потребовавший урологического вмешательства после однократного приема тразодона в дозе 100 мг [95]. При применении в более высоких дозах (300–600 мг), необходимых для лечения депрессии, переносимость препарата еще в большей степени ухудшается. В этих дозах он часто вызывает чрезмерную седацию или гипотензию. При постмаркетинговом фармаконадзоре получены сообщения о развитии сердечных аритмий при лечении тразодоном, чаще возникающих на фоне его передозировки [96]. Этот эффект связывают с ингибирующим действием тразодона на быстрые калиевые каналы.
При применении в более высоких дозах (300–600 мг), необходимых для лечения депрессии, переносимость препарата еще в большей степени ухудшается. В этих дозах он часто вызывает чрезмерную седацию или гипотензию. При постмаркетинговом фармаконадзоре получены сообщения о развитии сердечных аритмий при лечении тразодоном, чаще возникающих на фоне его передозировки [96]. Этот эффект связывают с ингибирующим действием тразодона на быстрые калиевые каналы.
Другие антидепрессанты
Во многих европейских странах к антидепрессантам первого ряда при легкой и умеренной депрессии относят препараты, действующим веществом которых является Hypericum perforatum (зверобой) [97]. Данные ряда клинических исследований позволяют предположить, что у больных легкой и умеренной депрессией Hypericum perforatum превосходит по эффективности плацебо и, возможно, не уступает стандартным антидепрессантам, значительно превосходя последние по переносимости [98]. Показано, что механизм действия Hypericum perforatum связан с нарушением обратного захвата серотонина, а не блокадой МАО, как предполагали раньше. Желудочно–кишечные побочные эффекты зверобоя, как правило, можно предупреждать путем деления суточной дозы (900 мг) на три приема. Осторожность следует соблюдать в отношении многочисленных лекарственных взаимодействий Hypericum perforatum. В случае отсутствия эффекта в течение 3–6 месяцев рекомендуется перевод больного на стандартный антидепрессант.
Желудочно–кишечные побочные эффекты зверобоя, как правило, можно предупреждать путем деления суточной дозы (900 мг) на три приема. Осторожность следует соблюдать в отношении многочисленных лекарственных взаимодействий Hypericum perforatum. В случае отсутствия эффекта в течение 3–6 месяцев рекомендуется перевод больного на стандартный антидепрессант.
Заключение
В целом эксперты приходят к мнению, что существующие в настоящее время антидепрессанты у большинства больных обладают сходной эффективностью и различаются преимущественно профилем побочных эффектов [30]. Выбор препарата конкретному больному определяется потенциальной безопасностью и переносимостью, предполагаемой приверженностью лечению и эффективностью терапии в анамнезе (при наличии такого опыта). Для проявления клинического эффекта антидепрессантов обычно требуется 2–6 недель. Неудачи лечения чаще бывают обусловлены не резистентностью к терапии, а несоблюдением режима лечения, неадекватной дозой антидепрессанта или неадекватной продолжительностью лечения [97].
Новейшие антидепрессанты: брексанолон, эскетамин, агомелатин
Антидепрессанты — это лекарства, которые могут облегчить симптомы депрессии, такие как усталость и эмоциональное оцепенение.
Существует несколько различных видов антидепрессантов, но наиболее часто назначаются селективные ингибиторы обратного захвата серотонина (СИОЗС).
Флуоксетин (Прозак) появился на рынке в 1988 году как первый СИОЗС, и в течение следующих 30 лет многие эксперты считали СИОЗС «современным» антидепрессантом.
В 2019 году Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) одобрило два новых антидепрессанта, брексанолон и эскетамин. Также возобновился интерес к агомелатину, антидепрессанту, который в настоящее время недоступен в Соединенных Штатах.
Читайте дальше, чтобы узнать больше об этих новых антидепрессантах, в том числе об их сравнении с СИОЗС, их побочных эффектах и о том, как их попробовать.
В 2019 году FDA одобрило брексанолон (Zulresso) в качестве первого препарата, специально разработанного для лечения послеродовой депрессии (ППД) средней и тяжелой степени.
Эксперты считают, что некоторые СИОЗС безопасны для приема во время беременности или кормления грудью, но эти препараты могут не приводить к значительному улучшению состояния в течение нескольких недель. Когда у вас есть PPD, симптомы не только влияют на ваше самочувствие — они также могут иметь долгосрочные последствия для вашей связи с ребенком.
Брексанолон, однако, начинает действовать немедленно. Согласно двум рандомизированным клиническим испытаниям, опубликованным в 2018 году, это лекарство может значительно уменьшить симптомы ПРЛ — преимущества, которые сохранялись, когда исследователи наблюдали за участниками через 30 дней после лечения.
Узнайте больше о лечении послеродовой депрессии.
Как это работает
Брексанолон повышает уровень нейротрансмиттера гамма-аминомасляной кислоты (ГАМК) в мозге.
В двух словах, ГАМК ослабляет химическую активность ваших нейронов, почти как диммер для определенных клеток.
Ученые точно не знают, как брексанолон лечит симптомы ППД, но одна из теорий предполагает, что при ППД уровень ГАМК не восстанавливается достаточно быстро после беременности, чтобы справиться со стрессом. По сути, гормоны кортизола беспрепятственно растут, способствуя симптомам депрессии. Таким образом, брексанолон может предложить «перезагрузку», восстановив уровень ГАМК.
По сути, гормоны кортизола беспрепятственно растут, способствуя симптомам депрессии. Таким образом, брексанолон может предложить «перезагрузку», восстановив уровень ГАМК.
Вы получаете это лекарство однократно внутривенно в течение 2 с половиной дней. Вы останетесь в своем медицинском центре в течение всего 60-часового лечения для наблюдения.
Безопасность и побочные эффекты
Как и другие препараты, влияющие на уровень ГАМК, брексанолон может вызывать седативный эффект. Примерно 1 из 4 человек испытывает побочные эффекты, связанные с седацией, в первые 24 часа лечения.
Вы можете чувствовать:
- сильную сонливость даже днем
- рассеянность и рассеянность
- головокружение или обморок
Ваша медицинская бригада будет осматривать вас каждые 2 часа на наличие крайних симптомов, таких как обморок. Если у вас возникнут серьезные побочные эффекты, инфузию прекратят. Симптомы, связанные с седацией, должны прекратиться в течение 15 минут после прекращения внутривенного вливания.
Как получить рецепт
Вы можете получить это лечение только в утвержденных медицинских центрах, и вам потребуется направление врача, чтобы присоединиться к программе лечения.
Лечение может стоить до 34 000 долларов, хотя медицинская страховка может помочь компенсировать часть расходов. Такие компании, как Aetna и Cigna, требуют предварительной авторизации, поэтому вам нужно убедиться, что ваша страховая компания покрывает лечение, прежде чем вы зарегистрируетесь в своей клинике.
Имейте также в виду, что большинство страховых компаний покрывают только один курс лечения, так как исследования еще не исследовали потенциальные преимущества дополнительных раундов лечения.
Компания, производящая брексанолон, также предлагает несколько программ финансовой помощи, которые стоит рассмотреть, если цена делает их недоступными.
Эскетамин (Spravato) является химическим родственником анестетика кетамина. FDA одобрило эскетамин в 2019 году для лечения резистентной к лечению депрессии или депрессии, которая сохраняется после того, как вы попробуете как минимум два разных лечения антидепрессантами.
Во время клинических испытаний врачи давали участникам назальный спрей с эскетамином или спрей с плацебо. Все участники также принимали пероральные антидепрессанты, которые они раньше не пробовали. По сравнению с людьми, которые принимали пероральный антидепрессант и использовали спрей плацебо, те, кто использовал спрей эскетамина, сообщали о большем облегчении симптомов и более длительных бессимптомных периодах.
Как это работает
Эскетамин запускает цепную реакцию химических веществ, которая в конечном итоге повышает уровень нейротрофического фактора головного мозга (BDNF). BDNF помогает вашим нейронам создавать новые связи, что, в свою очередь, позволяет вам формировать воспоминания, узнавать новую информацию и развивать различные привычки.
Депрессия обычно связана с низким уровнем BDNF, и ваш мозг может испытывать трудности с адаптацией к изменениям. Эскетамин помогает восстановить уровень BDNF, а также общую пластичность мозга.
Как и в случае с брексанолоном, вы должны принимать эскетамин в присутствии медицинского работника. Ваш врач или клиницист назначит вам дозу от 56 до 84 миллиграммов (мг), которую вы впрыснете в ноздри. Затем вы расслабляетесь в кресле в течение 2 часов. В течение этого времени ваша команда по уходу будет контролировать ваше артериальное давление и частоту сердечных сокращений.
Ваш врач или клиницист назначит вам дозу от 56 до 84 миллиграммов (мг), которую вы впрыснете в ноздри. Затем вы расслабляетесь в кресле в течение 2 часов. В течение этого времени ваша команда по уходу будет контролировать ваше артериальное давление и частоту сердечных сокращений.
Это лекарство действует быстро, и многие люди сразу же замечают облегчение. Лечение требует нескольких сеансов, как правило, два раза в неделю в течение первых 28 дней, а затем с интервалом во времени. Эффекты обычно длятся до следующей дозы.
Безопасность и побочные эффекты
В ходе клинических испытаний участники, как правило, сообщали о побочных эффектах от легкой до умеренной степени тяжести. Вы можете чувствовать сонливость, головокружение или немного «не в себе» во время сеанса лечения. Эти побочные эффекты часто исчезают в течение 90 минут после приема дозы.
В редких случаях люди сообщали о более серьезных побочных эффектах, таких как:
- рвота
- тревога и спутанность сознания
- ухудшение депрессии или мысли о самоубийстве
Эскетамин также может привести к значительному повышению артериального давления во время сеанса лечения, поэтому вам потребуется наблюдение в течение 2 часов. Если у вас гипертония или другое сосудистое заболевание, обязательно сообщите об этом своему врачу перед началом лечения.
Если у вас гипертония или другое сосудистое заболевание, обязательно сообщите об этом своему врачу перед началом лечения.
Как получить рецепт
Вы можете получить это лечение только в утвержденном медицинском центре, поэтому вам нужно будет спросить своего врача или психиатра, хотите ли вы попробовать эскетамин.
Вместо этого курс лечения зависит от тяжести ваших симптомов и от того, сколько вы можете заплатить. По состоянию на 2021 год стандартная доза эскетамина в 56 мг стоит 59 долларов.0, а большая доза 84 мг стоит 885 долларов.
Начальный месяц терапии часто является самым дорогим, так как руководства по лечению рекомендуют лечение два раза в неделю в течение первого месяца. Этот первый месяц может стоить от 4800 до 6800 долларов.
На сегодняшний день нет официальных руководств, устанавливающих идеальную продолжительность лечения.
По данным компании, производящей Spravato, некоторые страховые программы покрывают большую часть стоимости эскетамина. Вам нужно будет вносить доплату всего в размере 10 долларов США за сеанс, пока вы не достигнете предела пособий в размере 7 150 долларов США в год.
Вам нужно будет вносить доплату всего в размере 10 долларов США за сеанс, пока вы не достигнете предела пособий в размере 7 150 долларов США в год.
Агомелатин (Вальдоксан), пероральный антидепрессант, доступен в некоторых других странах с 2009 года, хотя вы не можете получить это лекарство в Соединенных Штатах.
Вы принимаете агомелатин в виде таблеток по 25 мг один раз в день перед сном. Если ваши симптомы депрессии не реагируют, врач может увеличить дозу до 50 мг в день.
Агомелатин может быть особенно полезен при депрессии, которая:
- связана с нарушением циркадного ритма (цикла сон-бодрствование)
- включает ангедонию или трудности с получением удовольствия
- возникает при заболеваниях, таких как болезнь Паркинсона или диабет II типа
- возникает при сезонных изменениях
- возникает как часть биполярного расстройства
Принцип действия
Агомелатин имеет два основных воздействие на ваш мозг. Он повышает активность нервных рецепторов мелатонина, что помогает вам спать. Он также снижает активность специфических рецепторов серотонина и помогает увеличить дофамин и норадреналин в лобной коре.
Он повышает активность нервных рецепторов мелатонина, что помогает вам спать. Он также снижает активность специфических рецепторов серотонина и помогает увеличить дофамин и норадреналин в лобной коре.
Повышение уровня мелатонина может улучшить проблемы со сном. В небольшом исследовании 2018 года, в котором приняли участие 24 молодых человека, исследователи обнаружили, что чем больше агомелатин изменял циркадные ритмы участников, тем больше уменьшались их симптомы депрессии.
Эксперты пока точно не знают, как в картину вписывается снижение уровня серотонина.
Тем не менее, более ранние исследования на животных, проведенные в 2014 году, показывают, что одновременное повышение уровня мелатонина и снижение связывания серотонина с рецепторами может помочь защитить вновь созданные нейроны, защищая их от повреждений, вызванных хроническим стрессом. 9

В конце концов, если у вас не возникнет серьезных побочных эффектов, вы, вероятно, будете более склонны продолжать принимать лекарство.
Как агомелатин сравниваетсяВ обзоре 2018 года, включающем 522 испытания с общим числом участников 116 477, сравнивали 21 антидепрессант.
Когда авторы обзора рассматривали показатели отсева именно из-за побочных реакций, они обнаружили, что все включенные антидепрессанты имели более высокий уровень отсева, чем плацебо, за исключением агомелатина.
Между прочим, исследователи также включили агомелатин в число семи наиболее эффективных антидепрессантов среди изученных.
При приеме многих антидепрессантов у вас могут возникнуть гриппоподобные симптомы, если вы внезапно прекратите принимать лекарство. Это явление, называемое синдромом отмены, не возникает при применении агомелатина. Вы можете легко прекратить даже длительное использование агомелатина.
Итак, вы можете задаться вопросом: если это лекарство работает так хорошо, что мешает его одобрению в Соединенных Штатах?
Агомелатин может вызвать один очень серьезный побочный эффект: гепатотоксичность. Лекарство повышает уровень аминокислот в печени, называемых трансаминазами, вызывая повреждение печени у 4,6% людей, которые его принимают. Людям, принимающим это лекарство, необходимо проверить функцию печени на 3, 6, 12 и 24 неделе лечения.
Лекарство повышает уровень аминокислот в печени, называемых трансаминазами, вызывая повреждение печени у 4,6% людей, которые его принимают. Людям, принимающим это лекарство, необходимо проверить функцию печени на 3, 6, 12 и 24 неделе лечения.
Другие антидепрессанты могут оказывать аналогичное влияние на печень, но с гораздо меньшей частотой:
Как получить рецепт
В настоящее время вы не можете получить рецепт на агомелатин в Соединенных Штатах или Канаде, поскольку регулирующие органы считают, что существует риск повреждения печени. высокая, чтобы позволить препарат на рынке.
Вполне возможно, что агомелатин станет более доступным в будущем, если исследователи найдут способ минимизировать риск гепатотоксичности.
Врачи в Европе и Австралии могут прописывать это лекарство.
Брексанолон и эскетамин оказывают наибольшую пользу при послеродовой депрессии и депрессии, резистентной к терапии, соответственно. Эти лекарства также имеют высокую цену, что может затруднить доступ к ним.
Эти лекарства также имеют высокую цену, что может затруднить доступ к ним.
Агомелатин может эффективно лечить широкий спектр подтипов депрессии. Но он также несет в себе риск токсичности для печени и не был одобрен для использования в Соединенных Штатах.
Подводя итог, можно сказать, что эти лекарства, скорее всего, не заменят СИОЗС в качестве первой линии лечения других типов депрессии в ближайшее время. Тем не менее, их существование открывает возможности для будущих достижений в лечении депрессии.
Эмили Суэйм — внештатный писатель и редактор, специализирующийся на психологии. Она имеет степень бакалавра английского языка в колледже Кеньон и степень магистра искусств в области письма Калифорнийского колледжа искусств. В 2021 году она получила сертификат Совета редакторов в области наук о жизни (BELS). Вы можете найти больше ее работ на GoodTherapy, Verywell, Investopedia, Vox и Insider. Найдите ее в Twitter и LinkedIn.
Что это такое и многое другое I Psych Central
Новые антидепрессанты предлагают свежий подход к лечению депрессии и предлагают варианты, когда другие лекарства могут не работать.
Ингибиторы обратного захвата серотонина (СИОЗС) изменили подход к лечению депрессии с их появлением в 1980-х годах. Они предложили улучшение по сравнению с более старыми антидепрессантами, такими как трициклические, потому что у них было меньше побочных эффектов.
Но с тех пор в области антидепрессантов было сделано много новых разработок.
Лечение депрессии обычно включает комбинацию терапии и лекарств. Однако исследования показывают, что около трети людей с депрессией не реагируют на современные лекарства.
Новые антидепрессанты могут помочь восполнить этот пробел. В новейших антидепрессантах используются новые механизмы, чтобы возобновить действие старых антидепрессантов.
На рынке появились три новых антидепрессанта для лечения депрессии:
- брексанолон
- эскетамин
- агомелатин
В отличие от СИОЗС и других антидепрессантов, эти новые лекарства могут начать облегчать симптомы уже через несколько часов или дней, а не через несколько недель.
Брексанолон
Брексанолон, одобренный в 2019 году Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA), используется для лечения послеродовой депрессии у взрослых, которые не беременны.
Как действует брексанолон?
Прогестерон и аллопрегнанолон — это гормоны, уровень которых достигает своего пика в организме в третьем триместре беременности. Аллопрегнанолон является метаболитом (побочным продуктом) прогестерона. После рождения ребенка уровни прогестерона и аллопрегнанолона резко и значительно падают.
Ученые считают, что внезапное падение уровня гормонов может способствовать послеродовой депрессии.
Точный механизм действия брексанолона до конца не изучен. Но поскольку это раствор аллопрегнанолона, считается, что он помогает активировать рецепторы гамма-аминомасляной кислоты (ГАМК) и повышает уровень ГАМК в мозгу. Люди с депрессией, как правило, имеют более низкие уровни ГАМК и более низкую активность рецепторов ГАМК.
Как вы принимаете брексанолон?
Брексанолон вводят внутривенно (в/в) в течение 60 часов (2,5 дня). В настоящее время брексанолон можно вводить только в условиях стационара.
Скорее всего, вы начнете с низкой дозы, которая будет постепенно увеличиваться до тех пор, пока уровень аллопрегнанолона не достигнет уровня, который обычно наблюдается в третьем триместре беременности.
В течение последних 8 часов инфузии доза постепенно снижается.
Каковы побочные эффекты брексанолона?
Наиболее часто сообщаемые побочные эффекты брексанолона включают:
- сухость во рту
- покраснение
- потеря сознания (обморок)
- сонливость
На что следует обратить внимание при приеме брексанолона?
Вы можете потерять сознание во время инфузии брексанолона. Медицинский работник будет внимательно следить за вами на предмет чрезмерной сонливости и потери сознания.
Как и другие антидепрессанты, брексанолон может увеличить вероятность суицидальных мыслей или поведения у людей в возрасте 24 лет и младше. Рекомендуется следить за своими симптомами во время приема этого лекарства.
Рекомендуется следить за своими симптомами во время приема этого лекарства.
Эскетамин
Эскетамин — это новый антидепрессант, одобренный FDA в 2019 году для лечения депрессии, которая не улучшается с помощью других лекарств.
Он принадлежит к классу препаратов, называемых блокаторами рецепторов N-метил-D-аспартата (NMDA). Его получают из кетамина — препарата, используемого для анестезии. Этот новый антидепрессант работает иначе, чем другие обычно назначаемые антидепрессанты.
Как действует эскетамин?
В ходе клинических исследований ученые обнаружили, что кетамин снимает депрессию так, как не помогают традиционные антидепрессанты. По сравнению с другими широко используемыми антидепрессантами, у людей, принимавших кетамин, наблюдалось улучшение симптомов депрессии в течение нескольких часов, а не нескольких недель.
Не совсем понятно, как работает эскетамин, но он может действовать аналогично кетамину. Оба препарата являются блокаторами рецепторов NMDA.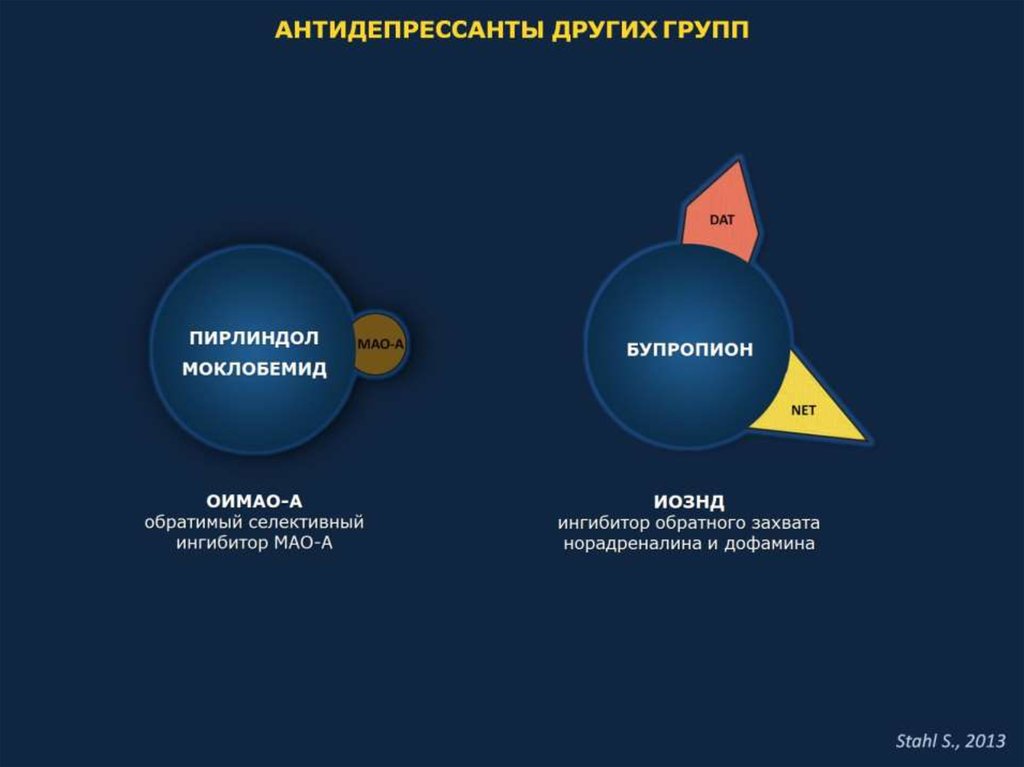 Блокируя рецепторы NMDA, эскетамин запускает выработку глутамата.
Блокируя рецепторы NMDA, эскетамин запускает выработку глутамата.
Глутамат — это химическое вещество в вашем мозгу, которое помогает формировать новые связи между клетками мозга. Ученые считают, что создание новых связей между клетками мозга может помочь людям с депрессией развить новые позитивные мысли и поведение.
Как вы принимаете эскетамин?
Эскетамин выпускается в виде назального спрея. Специалист в области психического здоровья покажет вам, как его использовать и сколько лекарств нужно принимать. Скорее всего, вы будете использовать эскетамин один или два раза в неделю вместе с другим пероральным антидепрессантом.
После приема эскетамина медицинская бригада будет наблюдать за вами в течение примерно 2 часов. Они дадут вам знать, когда вам будет безопасно покинуть учреждение.
Каковы побочные эффекты эскетамина?
Побочные эффекты, наиболее часто наблюдаемые при приеме эскетамина, включают:
- Тревога
- Гловокружение
- ДЛЯ СУБЕЛА
- Ощущение от себя от себя
- .
 принимая эскетамин?
принимая эскетамин? Эскетамин может вызвать у вас сонливость или оторванность от себя, своих мыслей или пространства и времени (диссоциация). Также есть вероятность, что вы можете стать зависимыми от эскетамина. По этой причине эскетамин назначают только в медицинских учреждениях.
После приема эскетамина медицинский работник будет наблюдать за вами в течение не менее 2 часов на предмет повышения артериального давления и признаков чрезмерной сонливости или диссоциации. Рекомендуется избегать вождения или работы с механизмами после приема эскетамина в течение 24 часов.
Как и другие антидепрессанты, эскетамин может увеличить риск суицидальных мыслей и действий у молодых людей.
Агомелатин
Агомелатин — это антидепрессант, который действует двумя уникальными способами. Он блокирует серотониновые рецепторы, так что в вашем мозгу появляется больше серотонина. Он также стимулирует рецепторы мелатонина, чтобы помочь вам уснуть.
Агомелатин одобрен для лечения депрессии в Европе и Австралии.
 Однако FDA еще не одобрило лекарство для использования в Соединенных Штатах из-за отрицательных результатов, полученных на поздних стадиях испытаний. Возможность повреждения печени также вызывает беспокойство.
Однако FDA еще не одобрило лекарство для использования в Соединенных Штатах из-за отрицательных результатов, полученных на поздних стадиях испытаний. Возможность повреждения печени также вызывает беспокойство. Новые антидепрессанты открывают новые возможности в лечении депрессии, которые ранее не изучались. Тем не менее, старые антидепрессанты по-прежнему являются препаратами первого выбора в качестве антидепрессантов. Вот пять самых распространенных антидепрессантов.
Селективные ингибиторы обратного захвата серотонина (СИОЗС)
СИОЗС остаются наиболее назначаемыми антидепрессантами. Флуоксетин (прозак) был первым СИОЗС, одобренным FDA для лечения депрессии.
Другие обычно назначаемые SSRIS включает в себя:
- Циталопрам (Celexa)
- Эсциталопрам (LEXAPRO)
- Paroxetin прописали антидепрессанты. Левомилнаципран (Фетзима) был одобрен FDA в 2013 году для лечения депрессии.
Другие обычно используемые SNRIS включает в себя:
- десвенлафаксин (Pristiq)
- Дулоксетин (Cymbalta)
- VenLafaxine (Effexor)
Noraderergic и специфические серотхергические антителины (Nass)
Noraderergic и специфические серотхергические антителины (Nass)
Noraderergic и специфические серотористы (Nass)
.
 и норадреналин, но они также блокируют рецепторы гормона стресса адреналина.
и норадреналин, но они также блокируют рецепторы гормона стресса адреналина. Их часто назначают при депрессии и тревоге, а также при расстройствах личности. Наиболее часто используемым NaSSA является миртазапин (Ремерон).
Трициклические антидепрессанты (ТЦА)
Поскольку ТЦА могут иметь некоторые неприятные побочные эффекты, их реже назначают при депрессии. Тем не менее, ТЦА по-прежнему используются при других состояниях, таких как проблемы со сном и некоторые виды хронической боли. Обычно используемые TCA включают:
- Amitriptyline (Elavil)
- Doxepin (Sinequan)
- Имипрамин (Tofranil)
- Nortriptyline (Pamelor)
Atypacless Fallespressents
. Каждый из них работает немного иначе, чем другие антидепрессанты и даже другие атипичные антидепрессанты.Примеры атипичных антидепрессантов включают в себя:
- Bupropion (Wellbutrin)
- Olanzapine/Fluoxetine (Symbax)
- Trazodone (Desyrel, Oleptro)
- Vortioxetine (Trintellix)
- Vortioxetine (Trintellix)
- Vortioxetine (Trintellix)
- (Trintellix)
- (Trintellix)
- (Trintellix)
- (Trintellix)
- .
 или думаете о том, чтобы отказаться от вашего текущего лечения, поиск подходящего вам лекарства может занять некоторое время.
или думаете о том, чтобы отказаться от вашего текущего лечения, поиск подходящего вам лекарства может занять некоторое время. Принятие мер для получения дополнительной информации о новых антидепрессантах может помочь вам найти подходящее лекарство. Подумайте о том, чтобы обратиться к специалисту в области психического здоровья. Они могут помочь вам при выборе антидепрессанта, соответствующего вашим уникальным симптомам.
Помните, что вам не нужно переживать депрессию в одиночку. Помощь доступна. Вы можете посетить нашу страницу «Как найти поддержку в области психического здоровья» для получения списка ресурсов и горячих линий в области психического здоровья.
Что это такое и многое другое I Psych Central
Новые антидепрессанты предлагают свежий подход к лечению депрессии и предлагают варианты, когда другие лекарства могут не работать.
Ингибиторы обратного захвата серотонина (СИОЗС) изменили подход к лечению депрессии с их появлением в 1980-е годы.
 Они предложили улучшение по сравнению с более старыми антидепрессантами, такими как трициклические, потому что у них было меньше побочных эффектов.
Они предложили улучшение по сравнению с более старыми антидепрессантами, такими как трициклические, потому что у них было меньше побочных эффектов. Но с тех пор в области антидепрессантов было сделано много новых разработок.
Лечение депрессии обычно включает комбинацию терапии и лекарств. Однако исследования показывают, что около трети людей с депрессией не реагируют на современные лекарства.
Новые антидепрессанты могут помочь восполнить этот пробел. В новейших антидепрессантах используются новые механизмы, чтобы возобновить действие старых антидепрессантов.
На рынке появились три новых антидепрессанта для лечения депрессии:
- брексанолон
- эскетамин
- агомелатин
В отличие от СИОЗС и других антидепрессантов, эти новые препараты могут начать облегчать симптомы уже через несколько часов или дней. .
Брексанолон
Брексанолон, одобренный в 2019 году Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA), используется для лечения послеродовой депрессии у взрослых, которые не беременны.

Как действует брексанолон?
Прогестерон и аллопрегнанолон — это гормоны, уровень которых достигает своего пика в организме в третьем триместре беременности. Аллопрегнанолон является метаболитом (побочным продуктом) прогестерона. После рождения ребенка уровни прогестерона и аллопрегнанолона резко и значительно падают.
Ученые считают, что резкое падение уровня гормонов может способствовать послеродовой депрессии.
Точный механизм действия брексанолона до конца не изучен. Но поскольку это раствор аллопрегнанолона, считается, что он помогает активировать рецепторы гамма-аминомасляной кислоты (ГАМК) и повышает уровень ГАМК в мозгу. Люди с депрессией, как правило, имеют более низкие уровни ГАМК и более низкую активность рецепторов ГАМК.
Как вы принимаете брексанолон?
Брексанолон вводят внутривенно (в/в) в течение 60 часов (2,5 дня). В настоящее время брексанолон можно вводить только в условиях стационара.
Скорее всего, вы начнете с низкой дозы, которая будет постепенно увеличиваться до тех пор, пока уровень аллопрегнанолона не достигнет уровня, который обычно наблюдается в третьем триместре беременности.

В течение последних 8 часов инфузии доза постепенно снижается.
Каковы побочные эффекты брексанолона?
Наиболее часто сообщаемые побочные эффекты брексанолона включают:
- сухость во рту
- покраснение
- потеря сознания (обморок)
- сонливость
На что следует обратить внимание при приеме брексанолона?
Вы можете потерять сознание во время инфузии брексанолона. Медицинский работник будет внимательно следить за вами на предмет чрезмерной сонливости и потери сознания.
Как и другие антидепрессанты, брексанолон может увеличить вероятность суицидальных мыслей или поведения у людей в возрасте 24 лет и младше. Рекомендуется следить за своими симптомами во время приема этого лекарства.
Эскетамин
Эскетамин — это новый антидепрессант, одобренный FDA в 2019 году для лечения депрессии, при которой не помогают другие лекарства.
Он принадлежит к классу препаратов, называемых блокаторами рецепторов N-метил-D-аспартата (NMDA).
 Его получают из кетамина — препарата, используемого для анестезии. Этот новый антидепрессант работает иначе, чем другие обычно назначаемые антидепрессанты.
Его получают из кетамина — препарата, используемого для анестезии. Этот новый антидепрессант работает иначе, чем другие обычно назначаемые антидепрессанты. Как действует эскетамин?
В ходе клинических исследований ученые обнаружили, что кетамин снимает депрессию так, как не помогают традиционные антидепрессанты. По сравнению с другими широко используемыми антидепрессантами, у людей, принимавших кетамин, наблюдалось улучшение симптомов депрессии в течение нескольких часов, а не нескольких недель.
Не совсем понятно, как работает эскетамин, но он может действовать аналогично кетамину. Оба препарата являются блокаторами рецепторов NMDA. Блокируя рецепторы NMDA, эскетамин запускает выработку глутамата.
Глутамат — это химическое вещество в вашем мозгу, которое помогает формировать новые связи между клетками мозга. Ученые считают, что создание новых связей между клетками мозга может помочь людям с депрессией развить новые позитивные мысли и поведение.
Как вы принимаете эскетамин?
Эскетамин выпускается в виде назального спрея.
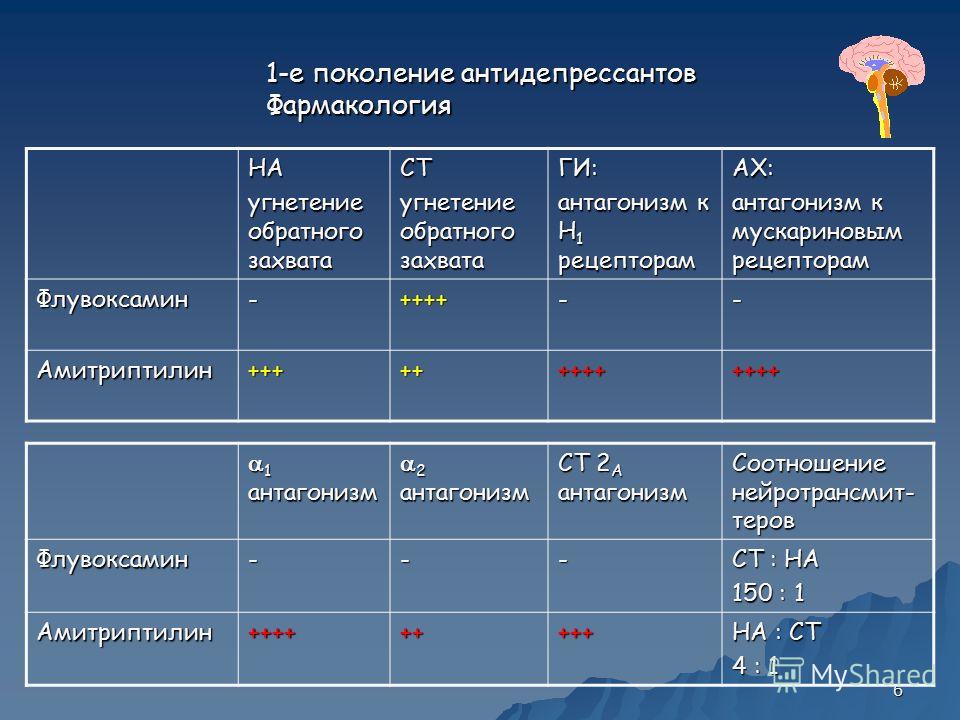 Специалист в области психического здоровья покажет вам, как его использовать и сколько лекарств нужно принимать. Скорее всего, вы будете использовать эскетамин один или два раза в неделю вместе с другим пероральным антидепрессантом.
Специалист в области психического здоровья покажет вам, как его использовать и сколько лекарств нужно принимать. Скорее всего, вы будете использовать эскетамин один или два раза в неделю вместе с другим пероральным антидепрессантом. После приема эскетамина медицинская бригада будет наблюдать за вами в течение примерно 2 часов. Они дадут вам знать, когда вам будет безопасно покинуть учреждение.
Каковы побочные эффекты эскетамина?
Побочные эффекты, наиболее часто наблюдаемые при приеме эскетамина, включают:
- тревогу
- головокружение
- сонливость
- чувство отстраненности от себя
- чувство опьянения
- повышение кровяного давления0037 онемение части тела
- вялость
- рвота
На что следует обратить внимание при приеме эскетамина?
Эскетамин может вызвать у вас сонливость или оторванность от себя, своих мыслей или пространства и времени (диссоциация). Также есть вероятность, что вы можете стать зависимыми от эскетамина.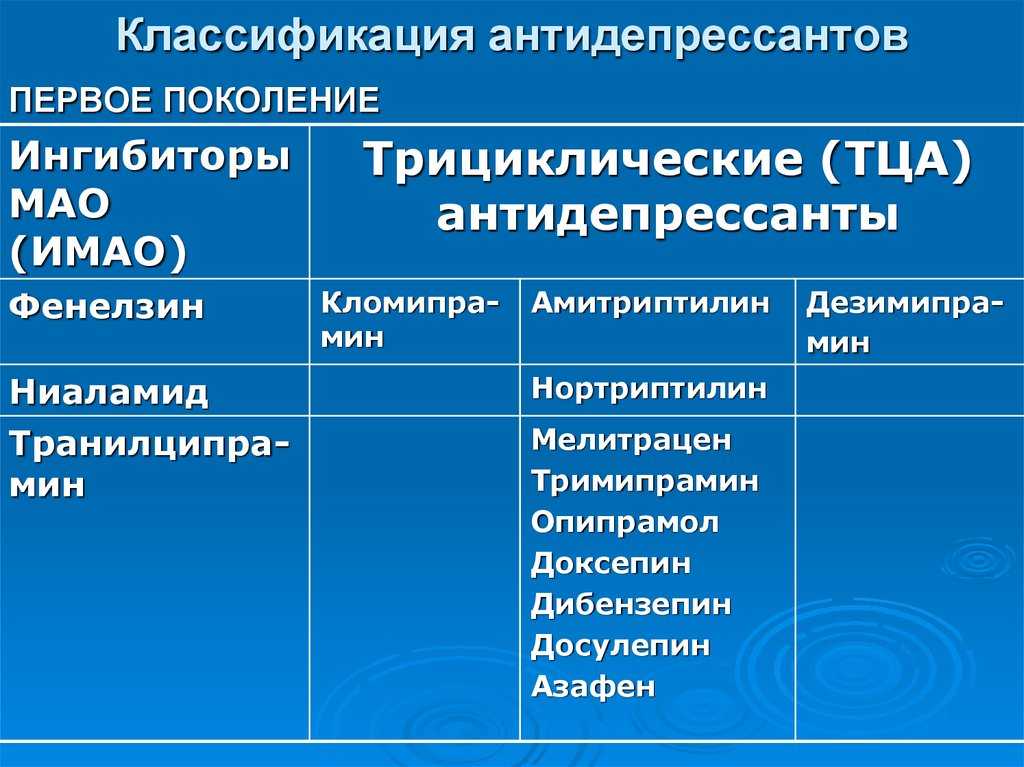 По этой причине эскетамин назначают только в медицинских учреждениях.
По этой причине эскетамин назначают только в медицинских учреждениях.
После приема эскетамина медицинский работник будет наблюдать за вами в течение не менее 2 часов на предмет повышения артериального давления и признаков чрезмерной сонливости или диссоциации. Рекомендуется избегать вождения или работы с механизмами после приема эскетамина в течение 24 часов.
Как и другие антидепрессанты, эскетамин может увеличить риск суицидальных мыслей и действий у молодых людей.
Агомелатин
Агомелатин — это антидепрессант, который действует двумя уникальными способами. Он блокирует серотониновые рецепторы, так что в вашем мозгу появляется больше серотонина. Он также стимулирует рецепторы мелатонина, чтобы помочь вам уснуть.
Агомелатин одобрен для лечения депрессии в Европе и Австралии. Однако FDA еще не одобрило лекарство для использования в Соединенных Штатах из-за отрицательных результатов, полученных на поздних стадиях испытаний. Возможность повреждения печени также вызывает беспокойство.
Новые антидепрессанты открывают новые возможности в лечении депрессии, которые ранее не изучались. Тем не менее, старые антидепрессанты по-прежнему являются препаратами первого выбора в качестве антидепрессантов. Вот пять самых распространенных антидепрессантов.
Селективные ингибиторы обратного захвата серотонина (СИОЗС)
СИОЗС остаются наиболее назначаемыми антидепрессантами. Флуоксетин (прозак) был первым СИОЗС, одобренным FDA для лечения депрессии.
Другие часто назначаемые СИОЗС включают:
- Циталопрам (Celexa)
- ЭССИТАЛОПАМ (LEXAPRO)
- Пароксетин (Paxil)
- Сертралин (Zoloft)
Serotonin-NorepinePhriene. Левомилнаципран (Фетзима) был одобрен FDA в 2013 году для лечения депрессии.
Другие часто используемые СИОЗСН включают:
- десвенлафаксин (Пристик)
- дулоксетин (Симбалта)
- венлафаксин (Эффексор)
Норадренергические и специфические серотонинергические антидепрессанты (NaSSA)
Подобно СИОЗС и СИОЗСН, эти препараты влияют на серотонин и норадреналин, но они также блокируют рецепторы гормона стресса адреналина.
Их часто назначают при депрессии и тревоге, а также при расстройствах личности. Наиболее часто используемым NaSSA является миртазапин (Ремерон).
Трициклические антидепрессанты (ТЦА)
Поскольку ТЦА могут иметь некоторые неприятные побочные эффекты, их реже назначают при депрессии. Тем не менее, ТЦА по-прежнему используются при других состояниях, таких как проблемы со сном и некоторые виды хронической боли. Обычно используемые TCA включают:
- амитриптилин (элавил)
- доксепин (синеван)
- имипрамин (тофранил)
- нортриптилин (памелор)
атипичные антидепрессанты, которые не попадают в другие категории антидепрессантов
A 900. Каждый из них работает немного иначе, чем другие антидепрессанты и даже другие атипичные антидепрессанты.
Примеры атипичных антидепрессантов включают:
- бупропион (Веллбутрин)
- оланзапин/флуоксетин (Симбакс)
- тразодон (десирел, олептро)
- вортиоксетин (тринтелликс)
Независимо от того, ищете ли вы новое лекарство от депрессии или думаете отказаться от текущего лечения, поиск подходящего препарата может занять некоторое время.


