Принцип действия антидепрессантов: что это такое, когда назначают, побочные эффекты
70-летняя история трициклических антидепрессантов
Исторический экскурс, посвященный трициклическим антидепрессантам (ТЦА), продолжает серию аналитических исследований событий из истории психофармакотерапии. Ранее нами была проведена систематизация данных из истории селективных ингибиторов обратного захвата серотонина (СИОЗС), мультимодальных серотонинергических антидепрессантов, ингибиторов обратного захвата серотонина и норадреналина (ИОЗСН) и атипичных нейролептиков. При работе над настоящим исследованием мы в большей степени, чем ранее, столкнулись с проблемой противоречивости мнений, высказываемых при описании исторических событий, особенно в современной литературе. Многие из таких разногласий по возможности были устранены при помощи изучения литературных первоисточников. Мы будем признательны читателю за помощь в определении правильности представленных фактов. Настоящий исторический экскурс важен не только с общепознавательной точки зрения, но и с позиции лучшего понимания современного состояния вопроса терапии психических расстройств, а также в связи с тем опытом, который может быть извлечен из почти 70-летней истории ТЦА.
Появление первых ТЦА имипрамина и амитриптилина и начало их применения при лечении депрессии (конец 40-х — начало 70-х годов XX века)
Экспериментальное соединение G-22355, которое в дальнейшем получило название имипрамин и положило начало группе ТЦА, было синтезировано химиками швейцарской фармацевтической компании «Geigy» F. Häflinger и W. Schindler [1] на стыке 40-х и 50-х годов в процессе поиска новых лекарственных средств среди трициклических соединений — производных иминодибензила. Первые исследования показали, что при применении некоторых из них развиваются седативный, антигистаминный, анальгетический и спазмолитический эффекты. Однако интерес руководства «Geigy» к этой группе соединений вскоре угас. Оценка их клинических эффектов возобновилась только в 1956 г. после появления новости о том, что применение трициклического соединения хлорпромазина улучшает состояние больных шизофренией.
Из-за большого сходства строения молекул имипрамина и хлорпромазина (идентичны по структуре боковой цепи и различаются по строению трициклического ядра) имипрамин был выбран для испытания при лечении больных шизофренией. Первоначально его клинические эффекты были исследованы врачом R. Kuhn в швейцарской психиатрической клинике, расположенной в коммуне Мюнстерлинген. Терапия оказалась неэффективной у больных шизофренией. Однако был отмечен положительный эффект при лечении пациентов с депрессивной симптоматикой [3]. Как позже вспоминал R. Kuhn, он сознательно избегал использования в исследовании рейтинговых шкал, а полагался только на клинический опыт врачей и медицинских сестер [4]. Этот пример ярко иллюстрирует тот факт, что в прошлом верные выводы об эффектах лекарственных средств делались обычными врачами на основании обсервационных наблюдений без применения не существовавших тогда методов доказательной медицины.
История изучения клинических эффектов имипрамина в 50-е годы R. Kuhn и другими исследователями хорошо описана, в том числе в самое последнее время [4—7]. Дублировать эти данные в рамках настоящей статьи нецелесообразно. Одно из исследований проводил швейцарский психиатр J. Angst. Из яркого интервью, данного им в 2012 г. [8], очевидно, с каким энтузиазмом в 50-е годы психиатры вели исследовательскую работу.
В конце 1957 г. имипрамин стал доступен для использования в Швейцарии под торговым названием «Тофранил» [5, 9], а в следующем году — в других странах Европы. В США его начали применять в 1958 г. [10]. Использование имипрамина в СССР было начато примерно одновременно с его распространением за рубежом. Сначала использовали препарат, производимый «Geigy». Вскоре под руководством М.Д. Машковского сотрудники Всесоюзного научно-исследовательского химико-фармацевтического института им. С. Орджоникидзе (ВНИХФИ) сами синтезировали молекулу имипрамина [11]. После этого его стали применять в нашей стране в виде отечественного препарата имизин [12].
Имипрамин стал родоначальником группы ТЦА и первым ТЦА со стимулирующим действием. Внимание к имипрамину не ослабевает до сих пор. Его и сейчас применяют в клинической практике. Нередко имипрамин используют в качестве средства сравнения при исследовании клинических эффектов новых антидепрессантов. В последние десятилетия не раз публиковались обзоры об истории открытия и применения имипрамина и биографические очерки о пионерах в исследовании его эффектов. Всего лишь несколько лет назад первая статья R. Kuhn, посвященная результатам исследования клинических эффектов имипрамина, была переведена на английский язык [4].
Вторым ТЦА, появившимся в распоряжении психиатров, стал амитриптилин. В 1960 г. в надежде на получение нового антидепрессанта специалисты швейцарской фармацевтической компании «Hoffmann-La Roche» при помощи модификации молекулы имипрамина синтезировали экспериментальное соединение Ro 4−1575 [13]. В это же время молекула такой же химической структуры была создана в лаборатории датской фармацевтической компании «Lundbeck». В США амитриптилин был синтезирован на несколько лет раньше, чем в Европе. В 1958 г. в процессе поиска новых нейролептиков специалисты американской фармацевтической компании «Merck» видоизменили молекулу одного из соединений с тиоксантеновым ядром и синтезировали вещество MK-230 [14]. В дальнейшем все эти соединения получили международное непатентованное название (МНН) амитриптилин.
В США амитриптилин был синтезирован на несколько лет раньше, чем в Европе. В 1958 г. в процессе поиска новых нейролептиков специалисты американской фармацевтической компании «Merck» видоизменили молекулу одного из соединений с тиоксантеновым ядром и синтезировали вещество MK-230 [14]. В дальнейшем все эти соединения получили международное непатентованное название (МНН) амитриптилин.
В США амитриптилин первым применил F. Ayd в больнице Франклин-Сквер в Балтиморе и установил его антидепрессивную активность. Первые сообщения о клинических эффектах амитриптилина появились в научной периодической печати в самом начале 60-х годов. В 1961 г. амитриптилин стал выпускаться для широкого применения «Hoffmann-La Roche» под названием «Лароксил» и «Lundbeck» под названием «Саротен». В США он был одобрен для применения при лечении депрессии в 1961 г. под торговым названием «Элавил». Все эти препараты производили в виде химического соединения амитриптилина гидрохлорида.
Советские психиатры начали использовать амитриптилин гораздо позже, чем их зарубежные коллеги.
Одними из первых психиатров, описавших собственный опыт применения амитриптилина в СССР, были сотрудники Научно-исследовательского психоневрологического института (НИПНИ) им. В.М. Бехтерева И.Н. Михаленко и Ю.Л. Нуллер. В 1964 г. в статье «Дифференцированная терапия эндогенной депрессии» они представили результаты лечения ингибиторами моноаминоксидазы (ИМАО), мелипрамином и амитриптилином [16]. Парадоксально, но в 1966 г. в другой работе Ю.Л. Нуллер писал: «О хороших результатах при терапии тревожных депрессий амитриптилином имеется значительная» (зарубежная) «литература, на выводы которой мы вынуждены ссылаться, не имея собственного опыта применения этого антидепрессанта» [17].
Во второй половине 60-х годов в нашей стране был синтезирован амитриптилина малеинат (соединение амитриптилина с малеиновой кислотой). Он отличался от амитриптилина гидрохлорида большей относительной молекулярной массой, поэтому применялся в более высоких дозах. Одно из первых сообщений о его клинических эффектах было опубликовано И.Н. Михаленко и Ю.Л. Нуллером в 1967 г. [18]. Его фармакологические свойства описала латвийский фармаколог С.К. Германе [19]. В начале 70-х годов амитриптилина малеинат был разрешен для широкого использования в СССР в виде препарата дамилен.
Создание амитриптилина привнесло значительное новшество в лечение больных депрессией. Быстро было установлено, что из-за выраженного седативного эффекта его применение гораздо эффективнее при лечении больных тревожной депрессией, чем терапия другими антидепрессантами, которые имелись в распоряжении психиатров в то время: имипрамином и ИМАО. Амитриптилин стал родоначальником группы седативных антидепрессантов. До сих пор он рассматривается в качестве золотого стандарта при исследовании клинических эффектов новых антидепрессантов.
Амитриптилин стал родоначальником группы седативных антидепрессантов. До сих пор он рассматривается в качестве золотого стандарта при исследовании клинических эффектов новых антидепрессантов.
Значительное расширение группы ТЦА и начало применения кломипрамина при лечении неврозов (60-е — 70-е годы XX века)
Вслед за открытием способности имипрамина и амитриптилина ослаблять проявления депрессии в клиническую практику были введены новые ТЦА. В 60-е годы было зарегистрировано более 10 (дезипрамин, тримипрамин, мелитрацен, опипрамол, нортриптилин, протриптилин, доксепин, дибензепин, иприндол, кломипрамин, диметакрин, бутриптилин, ноксиптилин) и в 70-е годы — более 5 (амоксапин, мапротилин, лофепрамин, метапрамин, кинупрамин, аминептин) их представителей. Многие из них, несмотря на появление антидепрессантов новых поколений, до сих пор широко используются для лечения больных депрессией и другими психическими и даже соматическими заболеваниями.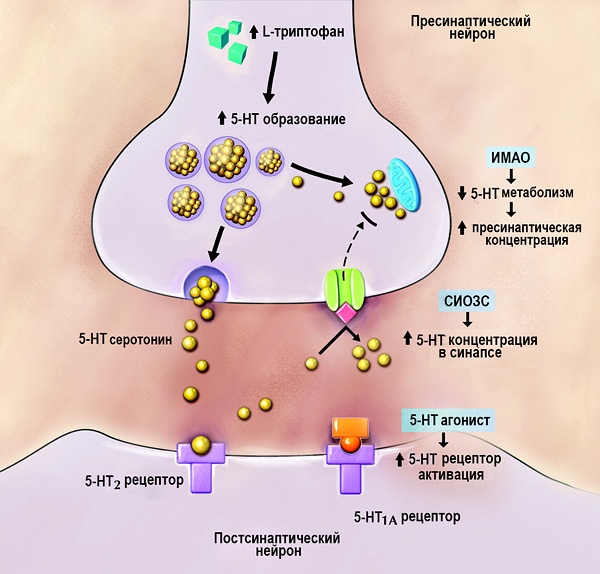
В истории ТЦА, введенных в практику в 60-е — 70-е годы, отдельного описания заслуживает история кломипрамина. В 1964 г. специалисты «Geigy» синтезировали экспериментальное средство G-34586. Первоначально оно получило известность под названием «Хлоримипрамин». В 1967 г. ему было присвоено МНН «Кломипрамин». В этом же году кломипрамин был официально одобрен для лечения больных депрессией в Европе. В США он был недоступен для применения еще два десятилетия. Его использование разрешили только в 1989 г. после проведения 3-й фазы собственных клинических испытаний при лечении больных обсессивно-компульсивным расстройством (ОКР). Кломипрамин стал первым антидепрессантом, официально одобренным для терапии больных ОКР в этой стране. До этого момента североамериканские психиатры пытались лечить таких пациентов имипрамином [20] и амитриптилином [21] (без официального разрешения на это органов-регуляторов фармацевтического рынка). Применение кломипрамина для лечения больных депрессией в США до сих пор не одобрено.
В 1967 г. французский психиатр J. Guyotat и его коллеги первыми обнаружили, что кломипрамин эффективно ослабляет обсессивно-фобическую симптоматику. В этом же году похожие результаты были опубликованы испанскими специалистами С. Fernandez и J. Lopez-Ibor [22]. В дальнейшем руководство «Geigy» стало инициатором проведения новых более масштабных исследований. Их число прогрессивно увеличивалось в 70-е годы и быстро сравнялось с числом исследований, посвященных оценке эффективности терапии больных депрессией. Результаты большинства новых исследований свидетельствовали об эффективности лечения больных, состояние которых определялось обсессивно-фобической симптоматикой. В результате показания к применению кломипрамина были официально расширены. Еще один немаловажный итог изучения эффективности терапии кломипрамином больных с обсессивно-фобической симптоматикой заключался в совершенствовании методики проведения исследований у этой группы пациентов. До этого момента она находилась в зачаточном состоянии. На момент изучения антиобсессивного действия кломипрамина психиатры располагали всего лишь одним рейтинговым инструментом для оценки выраженности обсессивно-фобических расстройств — Leyton Obsessional Inventory [23]. Открытие способности кломипрамина ослаблять обсессивно-фобическую симптоматику стало толчком для разработки новых оценочных шкал и опросников. Наконец, данные об эффективности кломипрамина при лечении больных обсессивно-фобическими расстройствами и открытие его мощной способности ингибировать обратный захват серотонина привели к формулированию в 1977 г. американским специалистом J. Yarvura-Tobias и соавт. серотонинергической теории патогенеза ОКР [24, 25].
На момент изучения антиобсессивного действия кломипрамина психиатры располагали всего лишь одним рейтинговым инструментом для оценки выраженности обсессивно-фобических расстройств — Leyton Obsessional Inventory [23]. Открытие способности кломипрамина ослаблять обсессивно-фобическую симптоматику стало толчком для разработки новых оценочных шкал и опросников. Наконец, данные об эффективности кломипрамина при лечении больных обсессивно-фобическими расстройствами и открытие его мощной способности ингибировать обратный захват серотонина привели к формулированию в 1977 г. американским специалистом J. Yarvura-Tobias и соавт. серотонинергической теории патогенеза ОКР [24, 25].
В нашей стране кломипрамин начали использовать гораздо позже, чем это произошло в Западной Европе, и чуть позже, чем в США. В 1988 г. авторы руководства по психиатрии, изданного под редакцией Г.В. Морозова, писали, что «кломипрамин в СССР распространения не получил» [26]. Однако уже в 90-е годы он стал доступен для применения в странах СНГ и был включен в справочники по фармакологии. Одним из первых отечественных психиатров, которые представили наиболее полную информацию о его клинических эффектах, был А.А. Недува [27]. Он рассматривал кломипрамин как наиболее мощный антидепрессант со стимулирующим и легким анксиолитическим эффектами. Кломипрамин до сих пор широко применяется в России для лечения больных с депрессией и неврозами.
Одним из первых отечественных психиатров, которые представили наиболее полную информацию о его клинических эффектах, был А.А. Недува [27]. Он рассматривал кломипрамин как наиболее мощный антидепрессант со стимулирующим и легким анксиолитическим эффектами. Кломипрамин до сих пор широко применяется в России для лечения больных с депрессией и неврозами.
Наряду с кломипрамином из ТЦА, созданных в западных странах в 60-е — 70-е годы, отечественные психиатры применяли тримипрамин и дезипрамин. В 80-е годы тримипрамин был доступен для использования в СССР. Однако затем, по воспоминаниям А.А. Недувы, «был незаслуженно оттеснен из нашей практики» [27]. Он вновь появился в России в 90-е годы. В это же время отечественные психиатры стали использовать дезипрамин, хотя некоторые из них уже имели опыт его применения. В первой половине 60-х годов И.П. Лапин [17] использовал дезипрамин в качестве антидепрессанта сравнения при изучении эффектов средств — производных иминодибензила, созданных сотрудниками кафедры технологии красителей Технологического института им. Ленсовета. Образцы дезипрамина, использованные в исследовании, были получены им от одного из североамериканских коллег. В 90-е годы немецкая фармацевтическая компания «Arzneimittelwerk Dresden GmbH» (AWD), производившая генерики кломипрамина, тримипрамина и дезипрамина, активно проводила их маркетинг в России. В 1995 г. состоялся симпозиум, посвященный «линейке ее продуктов». В том же году в журнале «Социальная и клиническая психиатрия» А.А. Недува представил обзорную статью, посвященную трем антидепрессантам, производимым AWD [27]. Кроме опыта применения тримипрамина и дезипрамина у отечественных психиатров была возможность изучить клинические эффекты опипрамола, мелитрацена, дибензепина и доксепина. Последним в этом списке находился мапротилин, который перестал импортироваться в Россию компанией-производителем совсем недавно, в 2010 г.
Создание и совершенствование классификаций ТЦА (60-е годы XX века — настоящее время)
Вопрос о необходимости классификации ТЦА стал актуален в начале 60-х годов, когда в распоряжении психиатров появилось несколько их представителей. Первая классификация отличалась простотой. В ее основу были положены особенности химического строения, и термин «ТЦА» в ней еще не использовался. В 1962 г. Э.Я. Штернберг [28]и Ю.А. Александровский и соавт. [29] выделили 3 группы ТЦА: «производные иминодибензила» (имипрамин), «производные амитриптилина» (собственно амитриптилин) и «некоторые производные фенотиазина» (левомепромазин). Эта классификация некоторое время использовалась психиатрами и даже вошла в учебники по психиатрии начала 70-х годов [30]. К середине 60-х годов химическая классификация значительно усложнилась. В 1966 г. И.П. Лапин выделил уже 5 групп [17]. Громоздкость этой систематики и невозможность ее соотнесения с особенностями клинических эффектов того или иного ТЦА предопределили тот факт, что она не стала популярной. Ее вытеснили другие классификации.
В 60-е годы на основании особенностей химического строения ТЦА стали подразделять на третичные и вторичные амины. После завершения периода создания ТЦА группа третичных аминов оказалась более многочисленной, чем группа вторичных аминов. Первоначально такое разделение основывалось исключительно на химическом принципе. Однако в дальнейшем появились данные о различии их нейрохимических и клинических эффектов. На стыке 70-х и 80-х годов стало очевидным, что третичные амины (имипрамин, амитриптилин) в большей степени блокируют обратный захват серотонина и обладают большей выраженностью седативного действия и холинолитических побочных эффектов, а вторичные амины (дезипрамин, нортриптилин) в большей степени ингибируют обратный захват норадреналина, обладают большей выраженностью стимулирующего действия и меньшей выраженностью холинолитической активности [31]. Также оказалось, что третичные амины обладают большей силой антидепрессивной активности, чем вторичные амины. Практическое значение этих данных заключалось в рекомендации начала терапии со вторичных аминов [32]. В случае их неэффективности рекомендовалось использовать третичные амины [33].
В первой половине 60-х годов P. Kielholz [34, 35] предложил расположить антидепрессанты в последовательном ряду на основании соотношения в спектре действия каждого из них стимулирующего или седативного эффектов. Такая систематика приобрела большую популярность, в том числе в нашей стране. Она получила название «схема Кильхольца». Многие годы схема Кильхольца была основополагающей при описании различий клинического действия разных ТЦА. Со временем она была модифицирована (вероятно, для простоты ее восприятия, а не из практических соображений) в классификацию, в которой было выделено две группы — стимулирующие и седативные антидепрессанты. Затем она была расширена за счет выделения 3-й группы — антидепрессанты сбалансированного действия. После того, как в 80—90-е годы в клиническую практику были введены представители новых поколений антидепрессантов (особенно СИОЗС, ИОЗСН), которые было трудно четко отнести в одну из перечисленных групп, правомерность использования схемы Кильхольца не раз критиковалась. Однако в отношении систематики ТЦА ее применение представляется оправданным до сих пор.
Еще одна классификация заключалась в разделении ТЦА на группы «типичных» и «атипичных» представителей. В ее основу прежде всего был положен нейрохимический подход. Термин «атипичный» ТЦА стал употребляться тогда, когда выяснилось, что нейрохимическая активность некоторых ТЦА отличается от нейрохимического эффекта большинства представителей этой группы — «типичных» ТЦА — одновременного ингибирования обратного захвата серотонина и норадреналина. В практике это проявлялось тем, что спектр клинических эффектов каждого из «атипичных» ТЦА отличался от стандартного спектра клинической активности типичных ТЦА. Возможность разделения ТЦА на «типичные» и «атипичные» появилась только после внедрения методов, давших возможность тонко изучить нейрохимический механизм их действия. На стыке 70-х и 80-х годов термины «типичные» и «атипичные» ТЦА уже широко использовались за рубежом [36]. В нашей стране в 8-м издании пособия «Лекарственные средства», составленного в 1977 г. М.Д. Машковским, упоминание о типичных и атипичных ТЦА еще отсутствовало. Однако в 9-м издании, выпущенном в 1984 г., автор уже использовал эту терминологию. В последние десятилетия при классификации антидепрессантов типичные ТЦА обычно обозначаются термином «ТЦА — неселективные ингибиторы обратного захвата моноаминов». Атипичные ТЦА относятся в разные нейрохимические группы на основании действия, преобладающего в спектре их нейрохимической активности, например к норадреналинергическим, серотонинергическим или дофаминергическим антидепрессантам.
Появление оригинальных советских ТЦА хлорацизина, флуацизина, пипофезина и их дальнейшая судьба (конец 50-х годов XX века — настоящее время)
Первое оригинальное отечественное трициклическое соединение, обладающее антидепрессивной активностью, — хлорацизин — было синтезировано в конце 50-х годов в Институте фармакологии и химиотерапии С.В. Журавлевым и А.Н. Гриценко [17]. Структура ядра его молекулы полностью соответствовала структуре ядра молекулы хлорпромазина, но они различались по строению боковой цепочки. Первоначально фармакологические эффекты хлорацизина были исследованы Ю.И. Вихляевым и Н.В. Кавериной. Оказалось, что хлорацизин не обладает нейролептической активностью, но его применение увеличивает объемную скорость коронарного кровотока и предупреждает развитие экспериментальных аритмий. В 1961 г. хлорацизин стал использоваться в СССР при лечении больных с ишемической болезнью сердца. В 1962 г. название «Хлорацизин» было официально принято ВОЗ в качестве МНН.
В начале 60-х годов началось активное изучение психотропных эффектов хлорацизина. В 1961 г. Е.Л. Щелкунов рекомендовал провести психофармакологическое испытание хлорацизина в качестве антидепрессанта [17]. Оно проводилось им и другими сотрудниками лаборатории психофармакологии НИПНИ им. В.М. Бехтерева. Было обнаружено, что хлорацизин, так же как имипрамин, обладает центральным «адренопозитивным» и холинолитическим действием. На основании этих данных было предложено провести клинические испытания хлорацизина в качестве антидепрессанта.
Изучение клинических эффектов хлорацизина проводилось в клинике НИПНИ им. В.М. Бехтерева. Результаты были представлены в середине 60-х годов сотрудниками отдела гериатрической психиатрии и отдела экспериментальной терапии психозов А.А. Бажиным и Ю.Л. Нуллером [17, 37]. Авторы пришли к заключению, что лечение наиболее эффективно при «нетяжелых эндогенных депрессиях» и «депрессивных состояниях сосудистого генеза». Было установлено, что при терапии развиваются умеренные атропиноподобные эффекты.
Отечественные фармакологи и интернисты относили хлорацизин в группу «спазмолитических и гипотензивных средств» [38], но указывали на наличие в спектре его клинической активности антидепрессивного эффекта. Отечественные психофармакологи и психиатры причисляли хлорацизин к антидепрессантам — производным фенотиазина [17]. В середине 60-х годов руководитель лаборатории психофармакологии НИПНИ им. В.М. Бехтерева И.П. Лапин в модифицированной им схеме Кильхольца разместил хлорацизин между ИМАО и дезипрамином, т. е. отнес его к стимулирующим антидепрессантам [17, 39].
Несмотря на выявление у хлорацизина антидепрессивной активности, он не получил широкой популярности при лечении депрессии. В 1980 г. в одном из руководств по психофармакологии [40] указывалось, что хлорацизин применяется в психиатрии при терапии депрессий, развивающихся в рамках маниакально-депрессивного психоза, инволюционной меланхолии и сосудистых психозов. Однако уже в 1986 г. в 3-м издании Большой медицинской энциклопедии Н.В. Каверина описывала его исключительно как сердечно-сосудистое средство [41]. В качестве показаний к его применению в психиатрии приводилась лишь «стенокардия у больных депрессией».
В 60-е годы в Институте фармакологии и химиотерапии был синтезирован оригинальный отечественный ТЦА фторацизин. Ядро его молекулы было идентично ядру молекулы хлорпромазина, за исключением того, что в одном из положений трехчленного цикла атом хлора был заменен на трифторметильную группу. В 1971 г. ВОЗ присвоила фторацизину МНН Флуацизин. В 1965 г. Ю.И. Вихляев и другие сотрудники Института фармакологии и химиотерапии подали заявку на изобретение, предмет которого был определен как «применение фторацизина в качестве антидепрессивного средства». В 1969 г. флуацизин был разрешен для широкого использования в СССР в виде пероральной и парентеральной форм [42]. В 1972 г. в 7-м издании пособия для врачей «Лекарственные средства» М.Д. Машковский уже подробно описал флуацизин (наравне с еще тремя ТЦА — имипрамином, амитриптилином и пипофезином) [43].
Флуацизин характеризовали как антидепрессант с умеренным тимолептическим действием (слабее, чем у других ТЦА) и выраженными седативным/противотревожным и холинолитическим эффектом. Эти особенности определили возможность его применения при тревожных (но не при заторможенных) депрессиях [38, 44]. Отмечалось, что в отличие от других ТЦА терапия флуацизином не приводит к обострению продуктивной симптоматики у больных шизофренией и способствует ослаблению депрессивного аффекта при нейролептической депрессии [43, 44]. Сильная выраженность холинолитического действия позволила применять флуацизин в качестве корректора лекарственной экстрапирамидной симптоматики. После распада СССР флуацизин еще некоторое время применялся в России, Украине и некоторых других странах СНГ.
В 60-е годы во ВНИХФИ под руководством М.Д. Машковского в лаборатории, возглавляемой М.Н. Щукиной, проводился поиск новых антидепрессантов. Были синтезированы трициклические соединения — производные диазафеноксазина [40]. Одно из них — оригинальный отечественный антидепрессант пипофезин — было получено в 1969 г. [45]. В 1978 г. ВОЗ утвердила это название в качестве МНН. Многие современные авторы указывают, что пипофезин был первым оригинальным отечественным антидепрессантом, однако, как свидетельствует анализ исторических фактов, это не так.
М.Д. Машковский и его коллеги показали, что пипофезин обладает психофармакологическими свойствами, характерными для других антидепрессантов. Было установлено, что в отличие от других ТЦА пипофезин не вызывает холинолитического эффекта [40]. Сообщалось, что его токсичность в 2 раза ниже, чем токсичность имипрамина.
Изучение клинического эффекта пипофезина свидетельствовало о том, что сила его антидепрессивной активности сравнительно невысока. В 1975 г. Г.Я. Авруцкий [46] писал, что по силе антидепрессивного эффекта пипофезин уступает имипрамину и амитриптилину. Его рекомендовали применять при депрессиях легкой и средней степени тяжести. Примечательным наблюдением было то, что применение пипофезина у больных шизофренией не вызывало развития ее обострений, что расширило возможность безопасного лечения шизофренических депрессий.
Пипофезин был одобрен для применения МЗ СССР в 1970 г. в виде препарата азафен и несколько десятилетий применялся в клинической практике. Как позже вспоминал главный врач московской психиатрической больницы № 8 (Клиники неврозов) Н.Н. Шинаев, «в 70-е —80-е годы XX века подавляющему числу пациентов, имевших показания к терапии антидепрессантами, назначался именно пипофезин» [47, 48]. После распада СССР пипофезин выпускался фармацевтическим предприятием Мосхимфармпрепараты. Однако в 1997 г. его производство было прекращено. По воспоминаниям Н.Н. Шинаева «…на протяжении ряда лет на симпозиумах и конференциях, посвященных терапии пограничных психических расстройств, многие докладчики ностальгически вспоминали препарат добрыми словами и сожалели о его отсутствии».
В 2005 г. отечественная фармацевтическая компания «Макиз-Фарма» возобновила производство пипофезина. В этот период производитель начал его активный маркетинг. В результате в России были проведены новые открытые исследования его клинического эффекта. Их результаты подтвердили данные, полученные в XX веке. В периодической научной печати было публиковано большое число новых статей. В 2007 г. Н.Н. Иванец и другие сотрудники Национального научного центра наркологии опубликовали результаты слепого плацебо-контролируемого исследования эффективности пипофезина при лечении аффективных расстройств у больных алкоголизмом [49] — нечастый для России пример проведения исследования в соответствии с принципами доказательной медицины. В 2007 г. в России впервые была зарегистрирована лекарственная форма пипофезина пролонгированного действия. В 2008 г. Н.А. Тювина и другие сотрудники кафедры психиатрии и медицинской психологии Московской медицинской академии им. И.М. Сеченова одними из первых опубликовали результаты открытого исследования клинического эффекта этой формы пипофезина [50].
ТЦА, созданные в СССР, широко не применялись за границами нашей страны. Причина этого, скорее, заключалась в неспособности фармацевтического рынка экономически и политически «закрытого» государства составить конкуренцию развитой фармацевтической индустрии западных стран, а не в конкурентоспособности самих лекарственных средств. Это подтверждается тем фактом, что после распада СССР в Западной Европе стал применяться антидепрессант из группы ИМАО, созданный советскими специалистами — пирлиндол.
Создание ТЦА в восточноевропейских странах социалистического лагеря и дальнейшая судьба их представителей: досулепин и другие ТЦА (1957 г. — 60-е годы XX века)
В стороне от процесса создания ТЦА не остались государственные фармацевтические организации восточноевропейских стран социалистического лагеря. Лидером среди них (за исключением СССР) была Чехословакия. Известно несколько ТЦА, синтезированных в этой стране.
Наибольшую популярность получил досулепин. Он был синтезирован в 1962 г. сотрудниками расположенных в Праге кафедры фармакологии Медицинского института гигиены и Научно-исследовательского института фармации и биохимии M. Rajsner и М. Protiva [51]. В этом же году в научной периодической печати было опубликовано одно из первых сообщений о его эффекте [52]. Молекула досулепина была идентична молекуле амитриптилина за исключением того, что в одном из положений трехчленного цикла атом углерода был заменен на атом серы. В 1965 г. этому антидепрессанту было присвоено МНН «Досулепин». Также он был известен под названием «Дотиепин». Первые клинические исследования показали наличие в спектре его психотропной активности «анксиолитического эффекта» [53]. Вскоре досулепин получил широкое признание. В 1970 г. сотрудник «Geigy» W. Theobald перечислял досулепин в перечне других ТЦА, в том числе созданных компанией, в которой он работал [54].
Первоначально досулепин выпускался чехословацким фармацевтическим предприятием SPOFA в виде препарата протиаден, а позже стал производиться чешской фармацевтической компанией «Lechiva». Фармацевтические компании других стран, например «Boots» и «Knoll», выпускали его генерические препараты. Досулепин стал широко использоваться для лечения больных депрессией и тревожными расстройствами во многих странах и применяется до сих пор. В США для использования он разрешен не был.
Советские психиатры применяли досулепин в своей практике. В 1974 г. Г.Я. Авруцкий и соавт. [55] в одном из изданий руководства по психофармакотерапии подробно описали клинический эффект досулепина, отнеся его к седативным антидепрессантам. Авторы отмечали, что его тимоаналептическое действие выражено слабее, чем у амитриптилина, но сильнее, чем у фторацизина и тримипрамина. Однако в руководствах тех же авторов, изданных в 1981 и 1988 г., описание досулепина отсутствовало. Видимо, в это время в СССР он уже не применялся. Тем не менее в 1987 г. А.Б. Смулевич все еще описывал [56] досулепин как антидепрессант «узкого спектра действия», эффективный при неглубоких депрессиях. В конце 90-х годов досулепин, видимо, использовался в Украине и был включен в украинские справочники по психофармакологии с показаниями: «депрессия, ночное недержание мочи, подготовка к операции больных с повышенным уровнем тревожности» [57].
Кроме досулепина, чехословацкие фармакологи создали еще ряд ТЦА. Однако информация о них в литературе довольно скудна. В 1957 г. (т.е. за 5 лет до создания досулепина) М. Protiva и другие сотрудники кафедры фармакологии Медицинского института гигиены и Научно-исследовательского института фармации и биохимии синтезировали пропазепин. В 1961 г. были представлены данные [58] о сходстве фармакологической активности пропазепина и имипрамина. В течение следующих 10 лет чехословацкие ученые регулярно публиковали новую информацию о фармакологическом и клиническом эффекте пропазепина. Интересно, что в середине 60-х годов, т. е. за несколько лет до формулирования серотонинергической теории патогенеза депрессии, чехословацкий исследователь K. Ryšánek прицельно изучал влияние пропазепина на серотонинергическую систему [59]. В 1965 г. пропазепину было присвоено МНН «Празепин». В 1966 г. И.П. Лапин упоминал пропазепин в предложенной им классификации антидепрессантов [17], объединив его с имипрамином, дезипрамином и тримипрамином в группу ТЦА — производных иминодибензила. Последнее сообщение о пропазепине, которое удалось найти в научной периодической печати, датируется 1970 г. [60]. После изучения литературы так и осталось непонятным, применялся ли пропазепин в широкой клинической практике или его использование ограничилось клиническими испытаниями. Также в 60-е годы в Чехословакии было опубликовано несколько исследований, посвященных эффекту прогептатриена. В 1981 г. Ю.Л. Нуллер называл этот антидепрессант при описании группы ТЦА [61]. Вероятно, широко он никогда не использовался.
Изучение влияния ТЦА на моноаминергическую систему и появление представления о рациональности создания антидепрессантов «двойного» механизма действия (1959 г. — 70-е годы XX века)
Первым исследователем, установившим влияние ТЦА на моноаминергическую систему, был сотрудник «Geigy» E. Sigg. В 1959 г. он показал, что имипрамин подобно кокаину усиливает действие норадреналина [62]. Хотя это открытие было сделано в тестах на периферических тканях лабораторных животных, оно легло в основу представления о том, что действие ТЦА связано с «сенситизацией центральных адренергических механизмов». Психиатры того периода не раз упоминали о «гипотезе», или «схеме Сигга». В дальнейшем феномен, описанный E. Sigg, использовался в качестве теста при оценке фармакологических свойств потенциальных антидепрессантов. В 1961 г. американский биохимик J. Axelrod и его коллеги из Национального института психического здоровья США в опытах на лабораторных животных показали, что имипрамин тормозит «усвоение» норадреналина нервными окончаниями различных тканей [63]. Исследования J. Axelrod внесли огромный вклад в развитие представления о норадреналинергическом действии антидепрессантов. В 1970 г. ему была присуждена Нобелевская премия в области физиологии и медицины за исследование процесса «кругооборота» адреналина и норадреналина в синапсе.
Теория влияния на норадреналинергическую систему головного мозга на многие годы стала основной при объяснении механизма реализации антидепрессивного действия ТЦА. В 1966 г. Р.Я. Вовин писал: «возникает соблазн предположить, что общий знаменатель антидепрессивной активности состоит из активации центральных адренергических механизмов» [17]. В этот период значение серотонина в механизме действия ТЦА оценено не было. В середине 60-х годов И.П. Лапин высказывал мнение: «…не удается устранить депрессивное настроение усилением процессов, связанных с серотонином» [17]. Значение влияния ТЦА на серотонинергическую систему будет признано несколькими годами позже по исторической иронии благодаря работам того же И.П. Лапина. В 1969 г. он и его ученик Г.Ф. Оксенкруг в журнале «Lancet» опубликовали статью «Intensification of the central serotoninergic processes as a possible determinant of the thymoleptic effect». Открытие И.П. Лапина стало большим прогрессом для развития советской психофармакологии и психиатрии. До этого периода в течение многих лет отечественные специалисты в своих исследованиях вольно или невольно руководствовались преимущественно рефлекторной теорией И.П. Павлова, в тот период признанной основополагающей на государственном уровне при объяснении механизма развития различных
Антидепрессанты
Из всех психиатрических расстройств депрессия считается самой недооцененной. 10–20 % всех людей минимум раз в жизни сталкивается с этим заболеванием. Среди пожилых распространенность депрессии увеличивается и достигает 15–25 %. Основной проблемой депрессии является недостаточное развитие ее диагностики и нехватка психиатров. Поэтому в данном посте мы посчитали ненужным сразу грузить вас классификацией антидепрессантов, а сперва обратить ваше внимание на патогенез данного заболевания. Именно знание теории помогает понять, почему такие группы фармацевтических препаратов, как седативные и анксиолитические средства, в монотерапии являются недостаточно эффективными.
Долгое время в лечении депрессии активно применялась электрошоковая терапия, целью которой являлось усиление метаболизма нейромедиаторов в головном мозге. Удивительно, но у 75 % пациентов действительно наблюдалось улучшение симптоматики. Так, например, известный пианист Владимир Горовиц годами страдал от депрессии, и именно электрошоковая терапия помогла ему вернуться на сцену.
От 15 до 30 % всех депрессивных расстройств имеют склонность к хроническому течению и многократным рецидивам. Именно поэтому большинство схем терапии рассчитаны на долгий период времени. Поскольку часть депрессивных расстройств связана с другими заболеваниями, необходимо уделить особое внимание возможности комбинировать различные группы фармацевтических препаратов.
Причин депрессии может быть несколько. Для этого состояния характерен ряд физиологических изменений: в тканях организма снижается концентрация норадреналина, уменьшается количество серотониновых рецепторов и снижается их аффинитет к лигандам (5-HT2A, 5-HT1B, 5-HT1A в коре головного мозга), повышается активность кортикотропина и глюкокортикоидов, наблюдается атрофия фронтальной и префронтальной коры гиппокампа, там же наблюдается снижение количества связей между нейронами, во фронтальной коре уменьшается количество кровеносных сосудов, снижается концентрация мелатонина, что приводит к расстройствам сна. Стоит отметить, что депрессивные расстройства часто наследуются (40–50 % униполярных и 60–70 % биполярных расстройств). Однако генетическая пенетрантность, как и в случае остальных психических заболеваний, снижена. Поэтому у 90 % пациентов не наблюдается аналогичных случаев заболевания в кругу семьи. Расстройства усиливаются в зависимости от продолжительности заболевания.
В 1965 году американский врач Шильдкраут предположил, что в основе депрессии могут лежать процессы, приводящие к снижению концентрации серотонина и норадреналина в синаптической щели. У человека в заднем ядре шва и в голубом пятне (locus coeruleus) каждого полушария мозга насчитывается до 165000 норадренергических и 55000 серотонинергических нейронов. Именно поэтому даже небольшое снижение количества этих нейронов уже способно вызвать характерные симптомы. Также при депрессии повышается выработка пресинаптически расположенных альфа-2-адренергических рецепторов. При воздействии норадреналина на ауторецепторы и серотонина на гетерорецепторы (нейромедиаторы высвобождаются из того же нейрона) весь процесс замедляется по принципу отрицательной обратной связи, что только усиливает нехватку этих нейромедиаторов в синаптической щели. Недостаток адреналина в свою очередь приводит к апатии и чувству усталости.
Серотонину же приписывают участие в образовании контактов между нейронами. Многие показатели, связанные с метаболизмом серотонина, такие как, например, снижение концентрации серотонина и его рецепторов, мутации в генах, кодирующих транспортные системы серотонина, сниженная выработка серотонин-связывающих белков, таких как p11, коррелируют с выраженностью депрессивного расстройства. Предполагают, что снижение концентрации дофамина также влияет на развитие депрессии, но не является ее первопричиной.
Также для депрессивных расстройств характерно снижение нейрогенеза в основном из-за стресс-индуцированного гиперкортизолизма и нарушения функции нейротрофического фактора BDNF (brain derived neurotrophic factor). В результате экспериментов было доказано, что увеличение синтеза BDNF помогало побороть симптомы депрессии, вызванные недостаточностью этого фактора. Ученые смогли доказать, что репрессор транскрипции GATA1 способен снижать количество синапсов в префронтальной коре животных и таким образом провоцировать развитие у них депрессивной симптоматики. Как вы можете увидеть в инфографике, на развитие данного заболевания влияет нарушение работы гипоталамо-гипофизарной оси, а также повышение нейрональной холинергической трансмиссии. Многие фармакологические препараты в свою очередь способны вызывать депрессивные расстройства (глюкокортикоиды, очень высокие или низкие концентрации гестагенов, нейролептики, антиконвульсанты, а также антигипертензивные средства, фторхинолоны и интерфероны). Характерную симптоматику вызывает также отказ от опиоидов и бензодиазепинов после их длительного приема.
Разобрав эти механизмы, мы, наконец, можем перейти к главному и ответить на вопрос — какими же свойствами должны обладать препараты данной группы?
Все антидепрессанты, кроме лития и агомелатина, приводят к повышению концентрации норадреналина и/или серотонина в синаптической щели. Это можно сделать несколькими способами: блокировать транспортные системы, переносящие эти медиаторы обратно в нейрон, снизив активность альфа-2-адренергических рецепторов (как было указано выше), уменьшить активность фермента, отвечающего за распад серотонина и норадреналина (MAO A, MAO A/B), а также воздействовать на рецептор серотонина 5-HT2C.
Норадреналин поступает в пресинаптическое окончание при помощи специального высокоселективного транспортера NET и частично через клетки микроглии с использованием не настолько избирательных транспортных систем. Небольшое количество норадреналина способно диффундировать в межклеточное пространство, а оттуда напрямую в кровь. При депрессии концентрация норадреналина снижается. Антидепрессивные препараты способны вытеснить норадреналин из связи с рецептором, что увеличивает его концентрацию в синаптической щели и взаимодействие с рецепторами. Со стороны адренергической системы во время терапии антидепрессантами также наблюдается ряд изменений: повышается выработка постсинтаптических альфа-1 и бета-рецепторов и происходит снижение количества пресинаптических альфа-2 рецепторов. Однако эти изменения характерны для терапии не всеми видами антидепрессантов.
Серотонин поступает обратно в нейроны при помощи белка SERT, который, как вы уже можете догадаться, тоже можно блокировать для увеличения количества серотонина в синаптической щели. Действие антидепрессантов на эту систему неодинаково, поскольку все рецепторы очень различны по своей структуре и расположению. Однако можно сказать, что под действием антидепрессантов в целом уменьшается выработка постсинаптических 5-HT2A рецепторов, что коррелирует с анксиолитическим действием этих препаратов, снижается выработка пресинаптических 5-HT1A рецепторов (обладают ингибиторным потенциалом по принципу отрицательной обратной связи), а также блокируются 5-HT2С рецепторы, что приводит к эффекту анксиолиза и повышенному высвобождению норадреналина и допамина в префротальной коре.
Прямые антагонисты пресинаптических альфа-2-адренергических рецепторов миансерин и миртазапин блокируют процессы аутоингибирования высвобождения норадреналина, что также приводит к увеличению норадреналина в синаптической щели. Количество пресинаптических альфа-2-рецепторов снижается, а постсинаптические альфа-2-рецепторы начинают связывать адреналин сильнее.
Антидепрессанты, кроме буспирона, не влияют напрямую на метаболизм дофамина, поэтому они и не обладают антипсихотическим потенциалом (разве что тримипрамин способен блокировать D2-рецептор допамина). Но, тем не менее, дофаминовая трансмиссия под действием антидепрессантов увеличивается. Это связано с тем, что транспортный белок норадреналина NET также способен связываться с дофамином. Агонист D2-рецепторов прамипексол допущен к использованию при депрессивных расстройствах в рамках болезни Паркинсона.
Стоит отметить, что многие механизмы действия антидепрессантов остаются неизученными. Например, невозможно по химической структуре того или иного антидепрессанта предсказать его силу его действия. Терапевтический эффект препарата едва ли коррелирует с силой блокады белков-транспортеров серотонина и норадреналина. Также не удалось отметить взаимосвязь количества рецепторов моноаминов и выраженностью клинических эффектов антидепрессантов.
Как стало понятным, фармакологические препараты группы антидепрессантов имеют схожие механизмы действия — соответственно, и их побочные эффекты будут похожи. Вместо того, чтобы заучивать побочные действия каждого конкретного антидепрессанта, мы попытаемся запомнить их более систематично.
Побочные эффекты в основном особенно выражены у двух групп антидепрессантов — у антагонистов альфа-2-адренергических рецепторов и у трициклических антидепрессантов. Эти две группы препаратов воздействуют не только на те рецепторы, что были описаны в предыдущем посте, но и на мускариновые, альфа-1-адренергические и гистаминовые рецепторы. Именно из-за их влияния на эти системы многие пациенты отказываются от приема лекарственных препаратов данных групп, предпочитая им селективные ингибиторы обратного захвата серотонина и/или норадреналина.
Трициклические антидепрессанты (например, амитриптилин) и антагонисты альфа-2-адренергических рецепторов обладают достаточно большим аффинитетом к мускариновым рецепторам ацетилхолина. Блокируя их, эти вещества вызывают побочные эффекты, сходные таковым атропина: сухость во рту (риск развития кариеса при употреблении жевательной резинки с содержанием сахара), мидриаз и нарушение аккомодации глаз (и, как следствие — повышенная опасность падений), увеличение внутриглазного давления, запор, нарушение мочеиспускания, спутанность сознания вплоть до антихолинергического делирия с оптическими галлюцинациями, тахикардия (усилена за счет блокады альфа-1-адренергических рецепторов). У пожилых людей прием препаратов, вызывающих ксеростомию, особенно проблематичен. Им приходится постоянно пить воду, все чаще заменяя ее напитками с высоким содержанием сахара, что влияет на метаболизм углеводов, приводит к развитию кариеса и увеличению веса. Сухость во рту является побочным эффектом более 500 лекарственных веществ, среди которых в основном антихолинергические (трициклические антидепрессанты, нейролептики, антагонисты гистаминовых рецепторов первого типа), а также антигипертензивные препараты (бета-блокаторы и ингибиторы кальциевых каналов). Соблюдая правила гигиены полости рта и рекомендации стоматолога, можно успешно избежать данного побочного эффекта.
Как вы можете догадаться, препараты данных групп лучше не комбинировать с другими веществами, вызывающими атропиноподобные эффекты (нейролептики, антипаркинсонические средства, блокаторы гистаминовых рецепторов первого типа).
Блокада адренергических альфа-1-рецепторов три- и тетрациклическими антидепрессантами приводит к расширению сосудов, что повышает риск развития гипотонии. Поэтому данные группы лекарственных препаратов не рекомендуется пить на ночь. При сердечной недостаточности и выраженной гипертонии особенно остро может проявляться вызванная антидепрессантами ортостатическая гипотония (в данном случае рекомендована терапия симпатомиметиками этилэфрином и мидодрином). Также существует риск развития рефлекторной тахикардии и нарушений ритма, которые способны усиливаться из-за одновременной блокады ацетилхолиновых рецепторов и вызванного этим снижения парасимпатической активности.
Трициклические антидепрессанты и антагонисты адренергических альфа-2-рецепторов способны почти так же сильно блокировать гистаминовые рецепторы первого типа, что и селективные блокаторы этой группы. Это связано со сродством связывающихся с этими рецепторами доменов: многие вещества, являющиеся антагонистами гистаминовых рецепторов первого типа, также являются антагонистами мускаринового ацетилхолинового рецептора (это сродство выражено сильнее, чем к рецептору гистамина второго типа).
Главными последствиями блокады гистаминового рецептора первого типа являются седация и сонливость. Седативное действие иногда считается не побочным, а даже скорее желательным, ведь пациенты часто страдают от беспокойства и бессонницы, особенно в начале терапии. Отрицательными эффектами, конечно же, будут являться нарушения концентрации и внимания, что весьма важно, если пациенту необходимо управлять транспортным средством.
Из средств массовой информации даже обывателю известен другой побочный эффект антидепрессантов — увеличение аппетита и склонность к набору веса. Дело в том, что гистаминовые рецепторы первого типа находятся в том числе и в гипоталамусе и отвечают за аппетит. Сигналы от этих рецепторов контролируют чувство насыщения в такой же степени, что и лептин. При их блокаде, соответственно, этот сигнал ослабевает, что приводит к тому, что пациент набирает в весе. При блокаде рецепторов 5-НТ2А этот эффект выражен особенно сильно. Иногда пациенты набирают в весе от 10 до 20 килограмм, что, конечно же, влияет на самооценку и, таким образом, на эффективность самой терапии.
Как уже было оговорено, целью приема антидепрессантов является усиление влияния норадреналина, адреналина и серотонина, что не обходится без своих побочных эффектов. Пациенты склонны к повышенному потоотделению, при этом оно усиливается при приеме эстрогенов и серотонинергического опиоида трамадола. Норадреналин увеличивает тонус сфинктера мочевого пузыря, что приводит к затруднениям мочеиспускания. Серотонин вызывает тошноту и диарею. Из-за неадекватно сильного выделения антидиуретического гормона при приеме некоторых антидепрессантов возможно развитие гипонатриемии (синдром Пархона).
Употребление антидепрессантов (в больших концентрациях) может привести к увеличению давления. Также при их приеме возможно развитие анемии и агранулоцитоза. Некоторые препараты, например, венлафаксин и миртазапин, приводят к выпадению волос. Наблюдается взаимосвязь между приемом антидепрессантов и развитием синдрома беспокойных ног.
В последующих постах мы разберемся в отдельных группах антидепрессантах, не сильно акцентируя внимание на побочных эффектах, ведь возникновение каждого из них можно понять из таблицы, зная, на какие рецепторы воздействует препарат.
Препараты данной группы являются неселективными ингибиторами обратного захвата моноаминов. За этим сложным названием скрывается сам механизм действия этих антидепрессантов.
Эта группа антидепрессантов является единственной, получившей свое названия из-за строения молекулы. В 1957 году была расшифрована форма трициклического нейролептического средства хлорпромазина. Это сродство структур нейролептиков типа фенотиазина и тиоксантена объясняет сродство эффектов антидепрессантов и нейролептиков, как, например, тримипрамина, обладающего также антипсихотическим действием.
Напомним, что препараты этой группы ингибируют обратный захват норадреналина и серотонина нейронами (причем захват первого преобладает), ингибируют 5-HT2A/C-рецептор серотонина (анксиолитическое действие кломипрамина), а также блокируют гистаминовый рецептор первого типа (седативный эффект). В небольших количествах они ингибируют в том числе и обратный захват дофамина.
Трициклические антидепрессанты обладают липофильными свойствами, что позволяет им легко проходить через ГЭБ. В их метаболизме особую роль отводят так называемому эффекту первого прохождения через печень (first pass effect), что обуславливает их низкую биодоступность. ТЦА метаболизируются в печени, поэтому при их передозировке форсированный диурез не приносит результата. Под влиянием CYP2D6 третичные амины (амитриптилин, имипрамин) превращаются во вторичные (дезипрамин, нортриптилин).
В зависимости от типа исходного соединения все ТЦА делят на три группы:
- Имипраминовый тип: имипрамин и кломипрамин.
- Амитриптилиновый тип: амитриптилин, амитриптилина оксид, доксепин, опипрамол, тримипрамин.
- Дезипраминовый тип: дезипрамин, нортриптилин.
Эффект ТЦА становится заметен не сразу. В первую неделю в основном преобладает седативный компонент, во вторую — тимеретический, на третьей неделе наблюдается их тимолептический эффект. Такая заторможенность эффектов действия ТЦА дает возможность предположить, что изучены еще не все механизмы действия этих препаратов, ведь концентрация нейромедиаторов в синаптической щели увеличивается уже в первый день приема.
Амитриптилин применяют при тяжелых формах депрессии. В низких дозировках (25–50 мг) амитриптилин используют также как коанальгетическое средство при нейропатической боли. Как и многие другие препараты данной группы, амитриптилин обладает широким спектром побочных действий, которые, однако, со временем ослабевают. Трициклические антидепрессанты ингибируют в том числе и адренергические α1-рецепторы, мускариновые рецепторы ацетилхолина и гистаминовые рецепторы первого типа. К антихолинергическим эффектам относят сухость во рту, нарушения диуреза, запоры, нарушения аккомодации, расстройства зрения, повышение внутриглазного давления, тахикардию и делирий (особенно у пожилых пациентов. ТЦА при деменции противопоказаны). Возможно развитие судорог центрального генеза. ТЦА обладают кардиотоксическим и негативным инотропным действием, что приводит к гипотонии, увеличению комплекса QRS и развитию нарушений сердечного ритма. Из-за блокады адренергических α1-рецепторов наблюдается развитие ортостатической гипотонии. Из-за блокады гистаминовых рецепторов первого типа у пациентов наблюдается головокружение, усталость, увеличение веса и аппетита. Именно поэтому прием ТЦА рекомендован перед сном. Также ТЦА провоцируют развитие синдрома Пархона. Симптомы передозировки ТЦА сходны с таковыми при серотониновом синдроме: повышение температуры, экстрасистолия, тахикардия, спутанность сознания, мидриаз, галлюцинации, нарушения зрения. Купировать такое состояние советуют физостигмином, а также активированным углем, антиконвульсивными препаратами, бикарбонатом натрия и вливанием изотонических растворов.
Нортриптилин является метаболитом амитриптилина и подходит скорее для комбинационной терапии, в первую очередь из-за своего более ослабленного антихолинергического действия и побочных эффектов, что касаются сердечной деятельности. Однако для препаратов дезипраминового типа, к которым относится нортриптилин, характерно и особо выраженное тимеретическое действие. Препараты же имипраминового типа этим не отличаются.
Имипрамин является высокопотентным ингибитором транспортера норадреналина. Из-за того, что он лишь немного ингибирует антигистаминовые рецепторы первого типа, седативный эффект имипрамина значительно снижен. Его антихолинергические побочные эффекты выражены намного слабее. Тримипрамин ингибирует также D2-рецептор и является единственным препаратом данной группы, обладающим антипсихотическим эффектом.
Кломипрамин, напротив, отличается тем, что достаточно сильно ингибирует SERT. Связанное с этим его анксиолитическое действие применяют в лечении обсессивно-компульсивных расстройств.
Доксепин связывается с H1-рецепторами, ингибируя их, что находит применение в терапии нейродермита (off label use), ослабляя чувство зуда, а седативный компонент помогает заснуть. Препарат назначают при алкогольном абстинентном синдроме и отмене опиоидов.
Тримипрамин, как уже было отмечено ранее, единственный из этой группы обладает антипсихотическим действием, поскольку является антагонистом дофаминовых D2-рецепторов.
Опипрамол имеет структуру трициклического антидепрессанта, но не способен ингибировать ни NET, ни SERT. Его основная функция — блокада гистаминовых рецепторов первого типа, что обуславливает сильный анксиолитический эффект и способствует лучшему засыпанию, не вызывая зависимости подобно бензодиазепинам.
Побочные эффекты были подробно оговорены в предыдущем посте. Стоит отметить, что блокада натриевых каналов (амитриптилин) способствует развитию нарушений сердечного ритма с увеличением интервала QT (но обеспечивает анальгетическое действие). Блокада мускариновых рецепторов ацетилхолина чревата развитием тахикардии и симпатомиметических эффектов: повышения АД и тремора.
Повышение тонуса норадреналина способствует развитию возбужденных состояний ЦНС вплоть до судорожного приступа. Метаболизм трициклических антидепрессантов в печени влечет за собой увеличение концентрации трансаминаз печени в крови. Логично предположить, что препараты этой группы не назначают больным эпилепсией, кардиальной аритмией при заболеваниях печени, гиперплазией простаты и глаукомой.
ТЦА применяют в основном при эндогенных депрессиях, но на данный момент из-за побочных действий препараты данной группы являются скорее резервными. Резкая отмена ТЦА провоцирует развитие бессонницы и симптомов, сходных с таковыми при гриппе, а также существует положительная корреляция резкой отмены ТЦА с количеством суицидов.
Тетрациклические антидепрессанты являются ингибиторами адренергических α2-рецепторов. Они являются слабыми ингибиторами NET и SERT, а их способность блокировать гистаминовые рецепторы первого типа обуславливает их седативное действие в начале терапии. Поэтому эти препараты получили применение при ажитированной депрессии. Миансерин и мапротилин являются производными миртазапина. S-(+)-энантиомеры способны блокировать адренергические α2-рецепторы и 5-HT2-рецепторы. R-(-)-энантиомеры ингибируют и 5-HT3-рецепторы. Миртазапин не блокирует захват моноаминов. Благодаря своему седативному действию при отсутствии антихолинергических побочных действий и лишь незначительному эметическому эффекту миртазапин применяют в гериатрии в основном как снотворное средство, не влияющее на REM-сон. Миансерин способен вызывать агранулоцитоз и апластические анемии, поэтому при его применении рекомендуется регулярно делать анализ крови. Миртазапин провоцирует чаще всего синдром беспокойных ног и увеличение веса до 10 кг на протяжении всего лишь нескольких недель. Как и трициклические антидепрессанты, тетрациклические противопоказаны при эпилепсии, почечной недостаточности и глаукоме.
В зависимости от того, какой именно нейромедиатор подвергается обратному захвату, препараты данной группы лекарственных средств разделяются на несколько типов: СИОЗС, СИОЗСиН и СИОЗН.
Побочных эффектов данных групп препаратов значительно меньше, чем у трициклических антидепрессантов. Ингибиторы селективного захвата не оказывают влияния на деятельность ССС, а также не обладают антихолинергическим и проконвульсивным действием. К тяжелым побочным эффектам относится серотониновый синдром. Его симптомами являются боли в животе, лихорадка, тахикардия с повышением АД, гиперрефлексия и миоклонус. Возможен летальный исход. Причиной развития серотонинового синдрома может быть передозировка лекарственными средствами, усиливающими серотонинергические эффекты, в особенности комбинацией селективных ингибиторов обратного захвата серотонина с трамадолом, триптанами, моклобемидом, ингибиторами МАО и препаратами лития.
Венлафаксин и дулоксетин блокируют обратный захват как серотонина, так и норадреналина, и оба являются субстратами CYP2D6.
Венлафаксину (дозировка 75–300 мг в день, период полувыведения — 5 часов, активный метаболит — дезметилвенфлаксин) свойственна низкая биодоступность (менее 20 %) при приеме внутрь. В низких дозировках он способен ингибировать обратный захват серотонина, в высоких — норадреналина, что, однако, никак не влияет на его антидепрессивный потенциал. Венлафаксин способен также частично ингибировать обратный захват дофамина.
Дулоксетин (дозировка 30–90 мг в день) блокирует в равной степени обратный захват обоих нейромедиаторов. Как уже можно догадаться, воздействуя только лишь на обратный захват нейромедиаторов, селективные ингибиторы данной группы не оказывают атропинергического и седирующего воздействия, в отличие от трициклических антидепрессантов. Иногда больные начинают жаловаться на трудности при мочеиспускании, потливость и нарушение потенции, но это редко приводит к отказам от приема препаратов. Эти препараты противопоказаны при заболеваниях печени, сильной гипертонии, эпилепсии и глаукоме.
Селективные ингибиторы норадреналина (ребоксетин, дозировка 8–12 мг в день, период полувыведения — 13 часов, активный метаболит — дезетилребоксетин) обеспечивают повышение концентрации норадреналина в синаптической щели. Из-за многочисленных побочных эффектов, связанных с влиянием норадреналина, СИОЗН применяются только при сильных депрессивных эпизодах. Метаболизм ребоксетина происходит при помощи CYP3A4, что ограничивает его применение в комбинации с препаратами, оказывающими влияние на работу этого цитохрома.
При селективной блокаде только лишь обратного захвата серотонина антидепрессивный эффект данной группы выражен лучше. К препаратам данной группы относят циталопрам (дозировка 10–60 мг в день, период полувыведения — 33 часа, активный метаболит — дезметилциталопрам), его более специфический к SERT S-энантиомер эсциталопрам (дозировка 5–20 мг в день), сертралин (дозировка 50–200 мг в день, период полувыведения 24 часа, активный метаболит — дезметилсертралин), пароксетин (дозировка 20–60 мг в день, период полувыведения 8–30 часов), флуоксетин (дозировка 10–60 мг в день, период полувыведения — 48–96 часов, активный метаболит — норфлуоксетин) и флувоксамин (дозировка 50–300 мг в день). Последние два препарата способны также воздействовать на опиоидные рецепторы, оказывая анальгетический эффект. В остальном антидепрессивное действие вышеуказанных препаратов примерно одинаковое. Также их концентрация несущественно меняется при почечной недостаточности. Согласно данным многих метаанализов, эсциталопрам и сертралин оказывают лучший антидепрессивный эффект, а циталопрам отличается меньшим количеством побочных действий при хорошей эффективности. Эсциталопрам, в зависимости от дозировки, способен удлинять QT интервал, что, к сожалению, не дает препарату достичь лучшего эффекта из-за необходимости снижения дозировки. Отличия в применении отдельных представителей этой группы представлены в таблице, прикрепленной к посту. Флуоксетин и пароксетин являются сильными, а циталопрам и эсциталопрам слабыми ингибиторами CYP2D6. Блокировка этой системы увеличивает концентрацию трициклических антидепрессантов и нейролептиков в крови, а действие тамоксифена (антагонист эстрогена, применяется в терапии рака молочной железы), наоборот, снижается, так как тамоксифен, являясь пролекарством, подвергается активации именно в данной системе в печени.
Блокировка SERT сама по себе вызывает ряд побочных действий, таких как, например, сонливость и акатизию (внутреннее беспокойство за счет 5HT2-рецепторов серотонина), особенно в начале терапии. Серотонин участвует также в процессах агрегации тромбоцитов. В мембране тромбоцитов построен точно такой же транспортер серотонина SERT, что и в нейронах, поэтому из-за нехватки серотонина снижается его вазоконстрикторное действие на 5НТ2А рецепторы серотонина. Поэтому применять препараты данной группы следует осторожно, в случае если пациент болен хроническими воспалительными заболеваниями кишечника или принимает препараты салициловой кислоты (антиагреганты) или антагонисты витамина К (непрямые антикоагулянты). Из-за повышенной стимуляции рецепторов серотонина 5HT2A в самом заднем поле (аrea postrema) и 5HT3-рецепторов в ЖКТ эти препараты провоцируют рвоту, которую удается купировать блокаторами 5HT3-рецептора серотонина (ондансетрон). Именно из-за чувства тошноты препараты данной группы в начале терапии приводят к снижению веса пациента. Из-за повышенной секреции антидиуретического гормона происходит задержка жидкости в организме, что приводит к снижению концентрации натрия в крови в первые 4–6 недель после начала приема препаратов у 10–20 % больных. Нарушения потенции также наблюдаются при приеме этой группы антидепрессантов. Сертралин обратимо снижает качество сперматозоидов и вызывает нарушения эякуляции. Причиной тому является непрямой антагонизм дофаминовых рецепторов, провоцирующий гиперпролактинемию.
Дапоксетин допущен к использованию при преждевременном семяизвержении. В данном случае препарат получил допуск из-за своего побочного действия. Однако в некоторых случаях антидепрессанты данной группы провоцируют обратное семяизвержение (ретроградная эякуляция семенной жидкости происходит в проксимальном направлении в мочевой пузырь, что может привести к воспалительным процессам). Активация рецепторов серотонина также влияет на дофаминовую систему: больные чувствуют себя более усталыми (активация 5НТ2С-рецепторов снижает выброс дофамина). Избыток серотонина провоцирует тремор, головные боли и остеопороз, а также псевдохолинергическую сухость во рту и особо сильную потливость кожи головы. Интересным является следующий факт: одно время наблюдалось, что повышение решимости и жажды действия препаратами данной группы увеличило количество суицидов. Предполагали, что повышение готовности к действию привело к тому, что больные депрессией чаще стали принимать решение покончить с собой. Но позднее одно большое британское исследование опровергло это утверждение, доказав, что самостоятельный отказ от препаратов увеличивает количество совершаемых суицидов.
Отдельно стоит отметить препарат бупропион (дозировка 150–300 мг в день, период полувыведения 20–37 часов, активные метаболиты — гидроксибупроприон, треогидробупроприон, эритрогидробупроприон), который является в основном ингибитором обратного захвата норадреналина и дофамина, но также воздействует и на другие трансмиттерные системы. Стоит отметить, что его прием не приводит к увеличению веса и лишь незначительно сказывается на половых функциях. Данный препарат также допущен к применению в терапии никотиновой зависимости.
- Herdegen T. et al. Kurzlehrbuch Pharmakologie und Toxikologie. – Georg Thieme Verlag, 2013.
- Diener H. C. Klinische Pharmakologie. – Georg Thieme Verlag, 2011.
Шесть друзей серотонина (СИОЗС) — PsyAndNeuro.ru
Согласно номенклатуре психотропных препаратов, основанной на нейронауках, к селективным ингибиторам обратного захвата серотонина (СИОЗС) относятся 6 антидепрессантов: флуоксетин, пароксетин, сертралин, флувоксамин, циталопрам и эсциталопрам. Основной механизм антидепрессивного действия данной группы заключается в блокировании обратного захвата серотонина из синаптической щели, в результате чего увеличивается концентрация данного медиатора в ЦНС. При этом антидепрессанты группы СИОЗС практически не блокируют обратный захват норадреналина и дофамина.
СИОЗС являются наиболее популярными антидепрессантами. Несмотря на это, имеется множество особенностей данных препаратов, которые, порой, остаются в неведении врача. На основе базы по нейропсихофармакологии, мы подготовили TOP-10 самых интересных характеристик СИОЗС, которые будет полезно использовать в клинической практике:
1. Флуоксетин в комбинации с оланзапином рассматривается как довольно эффективный вариант лечения терапевтически резистентных депрессий. Кроме того, флуоксетин считается лучшим антидепрессантом для лечения атипичной депрессии и может off-label назначаться при селективном мутизме, лёгкой ажитации при деменции и даже болезни Рейно.
2. Хотя пароксетин противопоказан при беременности, большинство авторитетных рецензентов считают пароксетин одним из самых предпочтительных антидепрессантов во время грудного вскармливания.
3. Сертралин off-label может назначаться при зуде, что можно учитывать при выборе терапии депрессивных и ипохондрических расстройств с подобными жалобами.
4. Эсциталопрам, в сравнении с другими СИОЗС, имеет самое слабое воздействие на сексуальную сферу, что необходимо учитывать при наличие подобных жалоб у пациентов, выявленных ранее при применение других антидепрессантов или в силу физиологических способностей.
5. В отличии от большинства СИОЗС, способных вызывать вначале терапии диарею, пароксетини из-за своей выраженной м-холинолитической активности может вызвать запоры.
6. Сертралин считается антидепрессантом с самой доказанной кардиологической безопасностью, что необходимо учитывать при назначении терапии лицам пожилого возраста.
7. В высоких дозах сертралин способен блокировать также обратный захват дофамина, в то время как другие антидепрессанты СИОЗС в высоких дозах начинают блокировать обратный захват норадреналина. Из-за этих свойств сертралин в меньшей степени способен вызывать СИОЗС-ассоциированную апатию и ангедонию и повышать пролактин.
8. Пароксетин является препаратом выбора при лечени постинсультных депрессий из-за хорошей клинической эффективности и переносимости среди пациентов, ранее перенёсших инсульт.
9. Такие специфические побочные эффекты СИОЗС, как апатия/снижение эмоциональной реактивности и снижение либидо/задержка эякуляции, могут быть использованы в первом случае при повышенной эмоциональной лабильности и импульсивности, во втором – при преждевременной эякуляции у депрессивных пациентов.
10 Наверное, самыми известными фактами для практикующих врачей являются более выраженное седативное действие флувоксамина и пароксетина, а также более активизирующее действие флуоксетина, что можно использовать при разных подтипах депрессии. При этом флувоксамин зарегистрирован FDA только для лечения ОКР и социальной тревожности, и официально не может использоваться в США как антидепрессант.
Автор: Касьянов Е.Д.
Источник: База по нейропсихофармакологии
Триттико (тразодон) – уникальный серотонинергический антидепрессант с рядом дополнительных свойств // Trittico (trazodone) – an unique serotonergic antidepressant with some interesting properties
ПСИХИАТРИЯ И ПСИХОФАРМАКОТЕРАПИЯ Том 20, №3–4, 2018 / PSYCHIATRY AND PSYCHOPHARMACOTHERAPY Vol. 20, No. 3–4, 2018
У НАШИХ ДРУЗЕЙ / FROM OUR FRIENDS
52
передачи, в то время как нарушение норадренергической
нейропередачи играет меньшую роль, химиками-фарма-
кологами в 1960–70-х годах были синтезированы первые
селективные ингибиторы обратного захвата серотонина
(СИОЗС) – зимелидин, бромфенирамин и др. Эти препа-
раты были практически лишены взаимодействий с М-хо-
линергическими, h2-гистаминовыми и a1-адренергически-
ми рецепторами и поэтому имели низкий по сравнению с
ТЦА уровень соответствующих ПЭ (S.Stahl, 2013).
Уже в начале клинического применения этих первых
СИОЗС выявилось, что и СИОЗС, как класс АД, не лишены
своих специфических ПЭ. Так, в частности, оказалось, что
СИОЗС, будучи, в отличие от ТЦА, практически лишены се-
дативного эффекта, часто вызывают бессонницу, кошмар-
ные сновидения, психомоторное возбуждение или обост-
рение тревожности и беспокойства, особенно в начале те-
рапии. Другими частыми проблемами, ассоциирующимися
с применением СИОЗС, оказались сексуальные нарушения
(снижение либидо и яркости оргазма вплоть до полной
аноргазмии у обоих полов, нарушения эрекции или эякуля-
ции у мужчин), а также нарушения со стороны желудочно-
кишечного тракта (ЖКТ): снижение аппетита, тошнота, рво-
та, понос. Общие для всех СИОЗС ПЭ (сексуальные, диссом-
нические, тревожные и со стороны ЖКТ) в разной степени
свойственны и всем современным, клинически применяе-
мым по сей день, СИОЗС – от исторически первых флуоксе-
тина и флувоксамина до появившегося самым последним
в группе СИОЗС эсциталопрама (S.Stahl, 2013).
Исследования показали, что причиной развития указан-
ных ПЭ при применении СИОЗС является неизбиратель-
ная стимуляция различных подтипов серотониновых ре-
цепторов, прежде всего 5-HT2A, 5-HT2C, 5-HT3, в меньшей
мере – 5-HT6и 5-HT7при повышении под влиянием
СИОЗС содержания серотонина в синапсах. Одновремен-
но оказалось, что для реализации антидепрессивного эф-
фекта самых разных классов АД (не только ТЦА, но
и ИМАО, и СИОЗС) наиболее важна и в целом необходима
стимуляция только 5-HT1A-подтипа серотониновых рецеп-
торов. В то же время исследованиями было показано, что
упомянутые «нежелательные» подтипы серотониновых
рецепторов (5-HT2A/C, 5-HT3, 5-HT6, 5-HT7) целесообразнее
не стимулировать, а, наоборот, блокировать. Более того,
было показано, что блокада, например, 5-HT2A/C или
5-HT3-серотониновых рецепторов ассоциируется не толь-
ко с уменьшением сексуальных ПЭ, тошноты, анорексии,
тревоги и диссомнических нарушений, но и с самостоя-
тельным антидепрессивным эффектом либо с усилением
антидепрессивного эффекта от обратного захвата моно-
аминов (S.Stahl, 2013).
От II поколения антидепрессантов (селективных
ингибиторов обратного захвата моноаминов)
к III поколению (препаратам рецепторного действия,
и в частности Триттико)
Все это в совокупности привело к зарождению еще в
1960-х годах идеи синтезировать такой АД, который бы
одновременно и ингибировал обратный захват серотони-
на, подобно ТЦА или первым СИОЗС (зимелидину, бром-
фенирамину), и обладал свойствами сильного блокатора
5-HT2A/C и ряда других нежелательных подтипов серотони-
новых рецепторов, подобно некоторым ТЦА, но при этом
не обладал нежелательными М-холиноблокирующими ПЭ.
Ученые, выдвинувшие такую идею, полагали, что препарат
с такими рецепторными свойствами будет не только луч-
ше переноситься и давать в среднем меньше ПЭ по сравне-
нию с доступными тогда СИОЗС (зимелидином, бромфе-
нирамином) и тем более по сравнению с ТЦА, но и будет
более эффективным, чем СИОЗС. Как показало время, эти
априорные ожидания во многом сбылись при последую-
щем клиническом изучении и сравнении с другими АД
препарата Триттико (тразодон), синтезированного спе-
циалистами научно-исследовательской лаборатории
«Анджелини Ресерч Лаборатори» в Италии в конце 1960-х
годов именно в рамках реализации упомянутой идеи
(S.Stahl, 2013).
В англоязычных классификациях типов АД Триттико
(тразодон) называют антагонистом серотониновых ре-
цепторов 2-го типа и одновременно ингибитором об-
ратного захвата серотонина (Serotonin-2 receptor Anta-
gonist/Reuptake Inhibitor, SARI) [И.В.Забозлаева, Е.В.Мали-
нина, 2011; S.Stahl, 2013]. В русскоязычных классифика-
циях типов АД тразодон обычно называют «специфиче-
ским серотонинергическим АД» или «атипичным АД»
(И.В.Забозлаева, Е.В.Малинина, 2011; Ю.В.Быков и соавт,
2013). Сложный комплексный и атипичный механизм
действия Триттико обусловливает как его уникальность
среди всех других АД, так и нередкую эффективность
Триттико в случаях, резистентных к различным другим
АД (Э.Фрешска, 2013).
Тразодон под торговыми названиями Trittico и Триттико
применялся и применяется в Европе и СССР (а ныне в
постсоветских странах) для лечения депрессивных, тре-
вожных и диссомнических расстройств с начала 1970-х
годов (J.Feighner, W.Boyer, 1988). В США же Управление по
контролю за качеством пищевых продуктов и лекарств
(Food and Drug Administration, FDA) выдало тразодону раз-
решение на применение под торговым названием Desyrel®
только в 1981 г. Несмотря на поздний вход на американ-
ский рынок, уже в начале 1980-х годов тразодон в США
стал самым продаваемым и самым часто назначаемым из
всех клинически использовавшихся на тот момент АД,
опережая даже только что появившийся в то время, очень
популярный и широко разрекламированный «1-й совре-
менный СИОЗС» – флуоксетин. Причиной столь широкой
популярности и коммерческого успеха тразодона в США
стали его хорошая переносимость, малое количество ПЭ,
в частности, отсутствие М-холинолитического действия,
выраженное снотворное и противотревожное действие,
отсутствие у него, в противоположность флуоксетину и
другим СИОЗС, склонности давать сексуальные ПЭ (на-
против, тразодон нередко улучшает сексуальную функ-
цию, нарушенную при депрессиях или вследствие приме-
нения других АД), отсутствие у него склонности вызывать
или усугублять бессонницу, анорексию, тревожность в на-
чале лечения (Э.Фрешска, 2013).
Интересно отметить, что идея сочетания в одном препа-
рате способности ингибировать обратный захват моно-
аминов (прежде всего серотонина) и избирательно стиму-
лировать «нужный» подтип серотониновых рецепторов
(5-HT1A) и/или блокировать «ненужные» подтипы (прежде
всего 5-HT2A/C, 5-HT3, но также и 5-HT6, 5-HT7), впервые реа-
лизованная в синтезе тразодона, оказалась очень плодо-
творной и на сегодняшний день реализована в таких со-
временных мультимодальных АД (АД IV поколения), как
вилазодон (Viibryd), вортиоксетин (Бринтелликс). Таким
образом, тразодон можно считать препаратом, во многом
опередившим свое время. Несмотря на то что тразодон по-
явился на рынке раньше современных СИОЗС (но позже
кратковременного появления на рынке зимелидина и
бромфенирамина), его правомерно считать АД III, а не
II поколения, лишенным ряда ПЭ, свойственных всем
СИОЗС как классу, тогда как СИОЗС правомерно считать
АД II поколения (S.Stahl, 2013).
На сегодняшний день тразодон доступен во многих
странах мира в различных формах выпуска. В США и не-
которых других странах он известен под торговым на-
званием Desyrel®, в Европе – Trittico, в Канаде – Trazorel®,
в Великобритании и Ирландии – Molipaxin®. В мире он
Некоторые антидепрессанты показали снижение риска инсульта
Прием антидепрессантов из группы ингибиторов обратного захвата серотонина уменьшает риск развития ишемического инсульта. Об этом свидетельствуют результаты большого популяционного исследования, опубликованного 7 августа в журнале «Neurology».
Риск ишемического инсульта при приеме селективных ингибиторов обратного захвата серотонина (СИОЗС) был на 12% ниже, чем при приеме антидепрессантов из других групп. Как сообщается, риск развития инфаркта миокарда (ИМ) у включенных пациентов не изменялся.
В общей популяции депрессия часто сопутствует сердечно-сосудистым заболеваниям (ССЗ), а значит, антидепрессанты обычно назначают пациентам с повышенным риском инфаркта или инсульта. В связи с этим профиль сердечно-сосудистой безопасности этих лекарств привлекает большое внимание исследователей.
Настоящее исследование включало 868 755 взрослых пациентов (64% из них составляли женщины), которым недавно были назначены СИОЗС (дулоксетин, флуоксетин, пароксетин или сертралин), и 69 633 пациентов, которые принимали антидепрессанты с другим типом действия (миансерин, миртазапин, нефазодон, ребоксетин, агомелатин или вилоксазин) в период с 1 января 1995 года по 30 июня 2014 года. Средний период наблюдения составил 5,7 лет; за это время у 15 860 пациентов был диагностирован ишемический инсульт или транзиторная ишемическая атака (31,1 на 10 000 человек в год).
Любой прием СИОЗС ассоциировался со снижением частоты инсульта и ТИА (относительный риск [ОР], 0,88; 95% ДИ, 0,80-0,97) по сравнению со другими антидепрессантами. Однако более заметный эффект наблюдался при приеме терапии более 60 дней (ОР 0,84; 95% ДИ 0,72-0,97).
За время наблюдения ИМ развился у 8626 пациентов (16,7 на 10 000 человек в год, 95% ДИ, 16,3-17,0). В отличие от риска инсульта, риск ИМ не различался между группами (ОР; 1,00, 95% ДИ, 0,87–1,15).
В статистической модели учитывались поправки на ожирение, курение, злоупотребление алкоголем, наличие сопутствующей артериальной гипертензии, мерцательной аритмии, застойной сердечной недостаточности и на другие факторы.
Полученный эффект СИОЗС объясняется нарушением функции тромбоцитов, так как ранее было замечено повышение риска тяжелых желудочно-кишечных кровотечений и внутричерепных кровоизлияний.
Авторы работы признают, что риск инсульта при приеме СИОЗС снижается ненамного, однако даже такое эффективное антиагрегантное средство, как ацетилсалициловая кислота, снижает его не более чем на 30%. Также они оговариваются, что полученные данные не должны изменить принцип подбора препаратов – они, как и ранее, должны назначаться в соответствии с этиологией и клинической картиной депрессии, возможной эффективностью и побочными эффектами – однако новая информация будет полезна врачам и пациентам при лечении.
Источники:
https://www.medscape.com/
https://n.neurology.org/
Текст подготовил: к.м.н. Круглый Л.Б.
Аспекты токсического действия антидепрессантов
Антидепрессанты по частоте назначения и использования в медицинской практике среди всех психотропных лекарств в мире занимают второе место после транквилизаторов, что обусловлено большой распространенностью депрессий и субдепрессий у населения во всех развитых странах.
Несмотря на сравнительно обширный арсенал антидепрессантов, они, к сожалению, не отвечают современным требованиям в аспекте их эффективности и особенно безопасности в условиях клинического применения. Именно эти принципы фармакотерапии обеспечивают главный критерий использования лекарств — «польза — вред», что особенно важно с точки зрения государственных гарантий получения населением безопасных (прежде всего в токсикологическом отношении), эффективных и доступных лекарственных средств.
Знания и оценка профиля безопасности любого препарата, в том числе и корректоров психической сферы человека, являются неотъемлемой частью как доклинических исследований, так и постмаркетингового мониторинга осложнений.
При этом оценка врачом риска возникновения токсических проявлений при применении психотропных лекарств предусматривает наличие систематизированных знаний токсикодинамики и кинетики препаратов. К сожалению, знаниям лекарственной токсикологии со стороны практикующих врачей не всегда уделяется должное внимание.
В связи с этим целью настоящей статьи является краткое изложение современных представлений о токсикодинамике, в том числе о механизмах токсического действия и токсикокинетики антидепрессантов различного химического строения.
Известно, что отравления антидепрессантами протекают крайне тяжело и в ряде случаев могут привести к смертельным исходам. Наибольшей токсичностью обладают трициклические антидепрессанты (ТЦА) и классические ингибиторы моноаминоксидазы (МАО).
Трициклические антидепрессанты
Трициклические антидепрессанты имеют очень малую широту терапевтического действия, т.е. терапевтические дозы очень близки к токсическим. Они вызывают отравления при однократном приеме более 1 г (летальность при приеме более 1 г превышает 20 %). Из-за различной токсичности антидепрессантов их введение в дозах от 10 до 20 мг/кг представляет риск возникновения отравления от легкой до тяжелой степени.
Поэтому в центрах токсикологии, реанимации и интенсивной терапии, неотложной помощи следует подвергать мониторингу пациентов (особенно детей), получивших дозу, превышающую таковую высшую терапевтическую, которую следует рассматривать как токсическую дозу. Для всех ТЦА, за исключением дезипрамина, нортриптилина и тримипрамина, эта доза составляет > 5 мг/кг; для дезипрамина, нортриптилина, тримипрамина — > 2,5 мг/кг.
В основе токсикодинамики ТЦА лежат нейротоксичность и кардиотоксичность — поражения периферической и центральной нервной системы (ЦНС) и сердца. В связи с этим клинические проявления передозировки ТЦА можно систематизировать в соответствии с их влиянием на вегетативную нервную систему (антихолинергическое, адреноблокирующее действие), сердечно-сосудистую систему и ЦНС.
Нарушения функции ЦНС развиваются в результате блокады центральных холинорецепторов и проявляются психомоторным возбуждением, атропиноподобными галлюцинациями, делирием, психовегетативными и вестибулярными расстройствами («рушатся» стены, «переворачивается» кровать), метаморфопсиями (нарушением схемы тела), миоклонией, резким снижением температуры тела. Затем нарастают процессы оглушения с последующим развитием сопора и комы с угнетением дыхания.
Нарушение функции сердечно-сосудистой системы под действием ТЦА проявляется нарушением проводимости и развитием аритмий (синусовой тахикардии, переходящей в трепетание и мерцание предсердий, желудочковой тахикардии или фибрилляции). Гипертензия, возникающая в первые 8 часов отравления, сменяется гипотензией (через 9—12 часов после развития отравления) по типу ортостатической гипотонии, которая также является одной из основных причин смерти.
При отравлении антидепрессантами на электрокардиограмме отмечаются синусовая тахикардия, увеличение интервала РR, QT и комплекса QRS, а также блоки проведения различного уровня и различной степени. Основные проявления токсического действия на миокард выражены на протяжении первых 12 часов, но могут развиваться в течение первых 6 суток после отравления.
Для передозировки ТЦА характерным является развитие адренергического синдрома, что приводит к повышению артериального давления (АД). Альфа-адреноблокирующее действие более выражено у препаратов с четвертичным атомом азота (амитриптилин, доксепин, тримипрамин) по сравнению с соединениями, содержащими вторичный атом азота (дезипрамин, нортриптилин).
Мембранодепрессивные (хининоподобные) свойства ТЦА усугубляют имеющееся угнетение автоматизма, возбудимости и сократимости миокарда, что способствует развитию сердечных блокад и аритмий. Сочетание хининоподобного и адреноблокирующего эффектов усугубляет также ортостатическую гипотонию.
Опасным при передозировке ТЦА является сочетание антихолинергического и судорожного синдромов. Такое сочетание приводит к нарушению терморегуляции и является основой для развития гипертермии, приводящей к повреждению мозга, рабдомиолизу, почечной недостаточности и смерти. Смерть при передозировании ТЦА может наступать в течение 24 ч после приема препарата.
Механизм токсического действия ТЦА обусловлен их антихолинергическими и антигистаминными свойствами, чрезмерной блокадой обратного захвата нейротрансмиттеров (серотонина, норадреналина и дофамина), прямой альфа-адренергической блокадой и блокадой мембранных каналов натрия с последующей деполяризацией мембраны, что оказывает хинидиноподобное действие на миокард.
Токсикокинетика ТЦА характеризуется быстрой абсорбцией препарата из желудочно-кишечного тракта (ЖКТ). Максимум концентрации в сыворотке регистрируется через 2—8 ч после приема терапевтических доз, но при передозировании, вследствие антихолинергического действия, возможно замедление опорожнения желудка и скорости всасывания.
Тем не менее признаки интоксикации ТЦА возникают, как правило, быстро, и в большинстве случаев летальность наступает в течение считанных часов. Всосавшийся препарат подвергается печеночному метаболизму первого прохождения, но при приеме высоких доз возможно насыщение.
Это обстоятельство, а также энтеропеченочная рециркуляция увеличивают биодоступность, которая для амитриптилина составляет 30—60 %, дезипрамина — 33—51 %, доксепина — 13—45 %, имипрамина — 22—77 %, нортриптилина — 46—70 %. ТЦА обладают высокой способностью связываться с белками плазмы (амитриптилин — 95 %, дезипрамин — 92 %, имипрамин — 85 %, нортриптилин — 93 %), имеют большой объем распределения (от 10 до 20 л/кг).
Для некоторых тканей концентрация в 10—100 раз превышает таковую в крови. Это обусловливает увеличение периода полувыведения, который в основном превышает 24 ч, а для амитриптилина составляет 31—46 ч.
Антидепрессанты преимущественно накапливаются в ткани мозга, печени и миокарда. Продукты метаболизма ТЦА в печени обладают фармакологической активностью, подвергаются конъюгации и выделяются почками. Действие активных метаболитов обусловливает токсичность ТЦА через 12—24 ч после его передозирования.
Ацидификация мочи усиливает выведение амитриптилина в 1000 раз, однако это количество препарата составляет всего 5 % от принятой дозы. Дезипрамин, доксепин, имипрамин и нортриптилин выводятся почками в неизмененном виде.
К факторам риска возникновения отравлений ТЦА относятся: пожилой возраст, патология сердечной деятельности, генетический полиморфизм цитохрома P450-2D6, который обусловливает медленное гидроксилирование (дезипрамин). Однако для оценки риска возникновения аритмий или сердечного приступа в случае передозирования ТЦА исследование концентрации препарата в крови не используется.
Назначение препаратов, нарушающих проводимость и обладающих мембраностабилизирующим действием (хинидин, новокаинамид, аймалин, верапамил, сердечные гликозиды, бета-адреноблокаторы), противопоказано при отравлении антидепрессантами (усиление кардиотоксических эффектов).
Комбинация ТЦА и ингибиторов МАО может инициировать лихорадку, сокращение мышц, гипотензию, метаболический ацидоз и сердечно-сосудистую недостаточность.
При сочетании антидепрессантов с нейролептиками, транквилизаторами происходит усиление седативного эффекта препаратов и их депримирующего влияния на ЦНС. Одновременное применение ТЦА с нейролептиками, противо-паркинсоническими препаратами (центральных холиноблокаторов) потенцирует центральные и периферические холиноблокирующие эффекты, что создает возможность развития делирия. Усиление угнетающего действия на ЦНС и седативного эффекта ТЦА наблюдается также при их комбинации с бета-адреноблокаторами.
Оральные контрацептивы, эстрогенные препараты, противовоспалительные средства (салицилаты, амидопирин, фенилбутазон), изониазид, вальпроат натрия угнетают биотрансформацию антидепрессантов, повышают концентрацию в крови и усиливают их основное действие и побочные эффекты. Селективные ингибиторы обратного захвата серотонина способны замедлять метаболизм трициклических антидепрессантов. Описаны случаи возникновения острого психоза при сочетании амитриптилина с фуразолидоном.
Ингибиторы моноаминоксидазы
В настоящее время неселективные ингибиторы МАО используют редко, что связано с их высокой токсичностью. Более новые средства этого класса, избирательные ингибиторы МАО-А, применяются шире, так как вызывают значительно меньше побочных эффектов, лучше переносятся и не требуют соблюдения специальной диеты. Они совместимы со многими лекарствами, с которыми несовместимы неизбирательные ингибиторы МАО.
Отравления ингибиторами MAO подразделяются на следующие типы:
Фактическое отравление в результате передозировки (встречается редко). Симптомы преднамеренной передозировки могут проявляться через 32 ч после приема препарата, но в основном наблюдаются в течение 24 ч.
Взаимодействие препарата с продуктами питания, тираминовая реакция (или реакция на сыр). Она развивается довольно быстро и проявляется в течение 15—90 мин после приема. Большинство симптомов исчезают через 6 ч. Летальные исходы могут наступать в результате осложнений на фоне гипертонического криза и острой сердечно-сосудистой недостаточности.
Взаимодействие с препаратами, вызывающими высвобождение катехоламинов, может быть опасным для жизни у лиц, которые также принимают ингибиторы МАО.
Симптомы и проявления интоксикации для всех трех указанных типов одинаковы и обусловлены избытком катехоламиновых нейромедиаторов. Острое отравление ингибиторами МАО протекает по типу острого адренергического криза.
Клиническую картину интоксикации ингибиторами МАО условно можно разделить на 4 фазы.
- Фаза 1 (асимптоматический период) длится 12—24 ч.
- Для симпатомиметической 2-й фазы характерными являются головная боль, возбуждение, расширение зрачков, тахикардия, сонливость, гиперрефлексия, приливы и тошнота. Симптомы могут усугубляться вплоть до комы, мышечной ригидности, гиперпирексии, гипотензии, приступа эпилепсии и угнетения сердечной деятельности.
- В 3-й фазе наблюдается острая сердечно-сосудистая недостаточность и коллапс, нарушения со стороны ЦНС.
- В последней, 4-й фазе имеют место вторичные осложнения, включающие почечную недостаточность, отек легких и асистолию.
Со стороны органов и систем регистрируются следующие токсические реакции:
- центральная и периферическая нервная система: головная боль, головокружение, напряжение мускулатуры шеи, боли в затылке, бессонница, светобоязнь, отсутствует восприятие красного и зеленого цветов, тошнота, рвота, запоры, нарушения мочеиспускания, парестезии, мышечная слабость, затрудненность движений, тревожное возбуждение, неистовая двигательная активность со стонами и гримасничаньем, невнятная речь, гиперрефлексия, периферическая нейропатия, галлюцинации, злокачественная гипертермия, тризм, тонико-клонические судороги (вначале кратковременные, по 1—2 мин, затем переходят в приступообразные с последующим развитием комы), опистотонус;
- сердечно-сосудистая система: тахикардия, желудочковые тахиаритмии, экстрасистолии, гипертонический криз, осложняющийся геморрагическим инсультом или инфарктом миокарда; сердечная недостаточность;
- дыхательная система: острый отек легких;
- печень: у лиц с медленным ацетилированием ингибиторов МАО в печени возможно развитие острой печеночной недостаточности;
- метаболические нарушения: развитие метаболического ацидоза.
Наиболее тяжелые отравления развиваются при одновременном применении ТЦА и ингибиторов МАО. Для таких отравлений характерны резкое возбуждение, гипертермические реакции, обильное потоотделение, делирий, судороги, ригидность мышц, кома. Предвестником летального исхода при данном виде отравления является резкое снижение АД, которое приводит к смерти через 6 часов. Смерть наступает на фоне сердечной и дыхательной недостаточности.
Механизм токсического действия ингибиторов МАО связан с ингибированием моноаминоксидазы, ответственной за разрушение моноаминовых нейромедиаторов (норадреналина, адреналина, допамина и серотонина), что приводит к их накоплению.
Ингибиторы МАО не влияют на образование МАО, и фермент регенерирует в течение многих недель. В высоких дозах ингибиторы МАО ингибируют и другие ферменты, что может вызывать ряд токсических эффектов.
Острый адренергический криз обусловлен ингибированием моноаминооксидаз, расщепляющих моноамины и тирамин, превращающийся при условии блокады МАО в норадреналин и поступающий в организм с тирамин-содержащими продуктами питания. В результате развивается гиперстимуляция адренорецепторов большим количеством долгоживущих моноаминов и, как результат, гипертензивный синдром.
Поскольку МАО локализована во многих органах, то отравление препаратами этой группы часто сопровождается развитием ишемических повреждений, таких как некрозы печени, инфаркты миокарда и плаценты. В результате накопления дофамина наблюдаются бред, галлюцинации и другие психические нарушения. Развитие маниакальных состояний является следствием блокады обратного захвата серотонина и возбуждения центральных серотониновых рецепторов.
Токсикокинетика ингибиторов МАО характеризуется тем, что они быстро и полностью всасываются из ЖКТ, пик концентрации в плазме крови достигается через 2—3 ч после приема. Им свойственны большой объем распределения (1—5 л/кг) и высокая степень связывания с белками.
Препараты метаболизируются в печени путем окисления и ацетилирования. Неактивные метаболиты выводятся из организма почками. Период полувыведения препаратов колеблется в пределах от 15 мин до 3,5 ч.
К факторам, повышающим токсичность ингибиторов МАО, относится одновременное их назначение с антидепрессантами других групп, антигипертензивными, противоаритмическими препаратами, так как это может привести к летальному исходу в результате развития серотонинового синдрома.
Серотониновый синдром, как правило, возникает при одновременном назначении ингибиторов МАО с другими серотонинергическими средствами, а также развивается после передозировки или использования в терапевтических дозах препаратов, повышающих активность серотонина в мозге. Чаще всего серотониновый синдром вызывает одновременное применение ингибиторов МАО с селективными ингибиторами обратного захвата серотонина, кломипрамином и триптофаном.
Большинство лекарственных средств из группы неселективных ингибиторов МАО не сочетаются с некоторыми препаратами из-за инактивирования ряда ферментов печени, а также пищевыми продуктами, что требует соблюдения специальной диеты для предупреждения развития тираминового (сырного) синдрома, характеризующегося стойкой артериальной гипертензией.
Развитие «сырного» синдрома связано с нарушением дезаминирования аминокислоты тирамина, основного пищевого амина, содержащегося в некоторых пищевых продуктах (сыр, кофе, бобовые, копчености, шоколад, красные вина и др.). Тирамин не проходит через гематоэнцефалический барьер, что обусловливает периферические эффекты «сырной» реакции, характеризующейся повышением АД и токсическими эффектами тирамина на паренхиматозные органы (печень, почки).
Ингибиторы МАО способны инактивировать пиридоксин-зависимые ферментные системы (пиридоксин фосфокиназу, ДОФА-декарбоксилазу, глутаматдекарбоксилазу) и тем самым провоцировать развитие судорожного синдрома.
Повышенная опасность интоксикации возникает при патологии сердечно-сосудистой системы, ЦНС (эпилепсия, острые геморрагические инсульты, атеросклероз, депрессия, алкоголизм), печени, почек, сахарном диабете. Интоксикация редко наблюдается при применении новых ингибиторов МАО и ингибиторов обратного захвата серотонина, если эти средства применяются раздельно.
Сочетание ингибиторов МАО с наркотическими анальгетиками, анестетиками, барбитуратами может вызывать гипотонию, токсические явления, коматозные состояния, угнетение дыхания, гипертермию, судороги.
При сочетанном применении карбамазепина и ингибиторов МАО возможно появление токсических эффектов. Усиление нежелательных эффектов ингибиторов МАО может спровоцировать также применение их совместно с гормональными препаратами щитовидной железы и анорексигенными средствами (фепранон и дезопимон).
Таким образом, средства фармакотерапии депрессивных и субдепрессивных состояний из групп ТЦА и ингибиторов МАО представляют потенциальную и реальную опасность возникновения и развития острых отравлений. Токсикодинамика этих групп антидепрессантов характеризуется многовекторностью эффектов, что требует проведения соответствующих мер, направленных на предупреждение их реализации.
Дроговоз С.М., Лукьянчук В.Д., Шейман Б.С.
2014 г.
Оценка эффективности антидепрессивной терапии больных с аффективной патологией на основании фармакогенетического исследования
Актуальность
Аффективными патологиями называют заболевания, в основе которых лежат нарушения в эмоциональной сфере. Самые распространённые из них – это биполярное аффективное расстройство (БАР), шизоэффективное расстройство и, конечно, депрессия. Последняя в одних случаях может рассматриваться как самостоятельное заболевание, в других же – как симптом.
Продолжительная депрессия, протекающая в умеренной или тяжёлой форме, оборачивается серьёзным нарушением здоровья, что не только ведёт к нарушению нормального функционирования человека на работе, в школе и в семье, но в отдельных случаях и к суициду.
Основным способом лечения депрессий являются антидепрессанты. Очень важно, чтобы схема лечения подошла именно тому больному, который обратился за помощью. Но не всегда получается сразу подобрать эффективную терапию.
Для эффективной схемы лечения с учётом всех нюансов на помощь приходит фармакогенетическое тестирование, которое позволяет посмотреть мутации различных генов и подобрать индивидуальную терапию. Это снижает лишнее потребление лекарственных средств и позволяет наиболее эффективно лечить больного.
Цель исследования
Определение эффективности антидепрессивной терапии больных с аффективной патологией.
Задачи исследования
- Изучить литературу по поставленной проблеме.
- Выделить две группы больных с контролируемыми симптомами и неэффективно купированными симптомами (для оценки эффективности используется шкала HADS), выборка пациентов формируется врачами филиала ПКБ № 4 ПНД № 8 медико-реабилитационного отделения).
- Провести фармакогенетическое тестирование.
- Обработать и проанализировать полученные данные.
Содержание работы
Работа состоит из теоретической и практической частей. В теоретической части нами были рассмотрены аффективные патологии, механизмы действия антидепрессантов, фармакогенетика и генетическая обусловленность метаболизма. В исследовании использовались информационные источники: научные труды А.Г. Гофмана, Р. Марри, Д. Греннер, Д. Сычёва, беседы с врачами-психиатрами ПКБ № 4.
Основной задачей практической части было подтверждение или опровержение выдвинутой гипотезы о том, что наличие мутированного гена CYP2C19 влияет на эффективность использования антидепрессантов. Практическая часть состояла
из нескольких этапов.
- Формирование выборки пациентов.
- Проведение психометричесого исследования (шкала HADS).
- Взятие образцов.
- Лабораторное исследование с использованием метода ПЦР.
- Анализ и клиническая оценка.
Оснащение и оборудование, использованное при создании работы
Амплификатор, пробирки для микроанализов, крафт-пакеты, ватные палочки, реагенты для выделения ДНК из буккального соскоба, реагенты для выявления полиформизма G681A в гене CYP2C19.
Выводы
В процессе исследования нами была изучена литература определённой проблематики и сформулировано описание аффективных расстройств и используемых для их лечения антидепрессантов.
В рамках практической части на основании показателей шкалы HADS были выделены две группы пациентов с контролируемыми симптомами и неэффективно купированными симптомами.
В результате проведённого фармакогенетического исследования было выявлено, что одиннадцать пациентов обладали генотипом GG, два пациента − генотипом AA и один пациент − GA.
Анализ результатов генетического теста подтвердил, что пациенты с генотипом AA и генотипом GA дают положительный ответ при применении антидепрессантов не из групп СИОЗС и МАО, что подтверждается и клинической диагностикой врачей-психиатров, и психометрической шкалой (HADS). Остальные пациенты использовали антидепрессанты различных групп и давали положительный психотерапевтический эффект.
Проанализировав полученные данные, мы можем говорить, что у пациентов под номерами 5 и 8 с выявленным генотипом АА антидепрессанты из фармогруппы СИОЗС и МАО не рекомендовано включать в схему лечения из-за их неэффективности. Так, например, пациент № 5 находился на терапии СИОЗС (Золофт) 200мг/сут. Положительной динамики не наблюдалось, купирования симптомов не происходило. Пациенту был сменён антидепрессант: назначен анамфранил (трициклический антидепрессант), и через 10 дней врач отметил положительную динамику.
Перспективы использования результатов работы
Возможность использования фармакогенетического тестирования для подбора индивидуальной терапии при аффективных патологиях.
Сотрудничество с вузом/учреждением при создании работы
ФГБОУ ВО РНИМУ им. Н.И. ПИРОГОВА МИНЗДРАВА РОССИИ
Награды/достижения
Призёр в конференциях «Старт в медицину», «Наука для жизни», победитель в конференции «Ломоносовские чтения».
Особое мнение
«Мне было интересно работать в лаборатории, общаться с врачами-психиатрами, изучать литературу по поставленной проблеме.
Обучение в академических классах позволяет не только изучать необходимые предметы, но и слушать лекции преподавателей. Особенный интерес, безусловно, вызывает работа в лабораториях и личное участие в интересных, актуальных проектах»
Типы, побочные эффекты, использование и эффективность
Мы включаем продукты, которые, по нашему мнению, будут полезны нашим читателям. Если вы совершаете покупку по ссылкам на этой странице, мы можем получить небольшую комиссию. Вот наш процесс.
Антидепрессанты — это лекарства, которые могут помочь облегчить симптомы депрессии, социального тревожного расстройства, тревожных расстройств, сезонного аффективного расстройства и дистимии или легкой хронической депрессии, а также других состояний.
Они направлены на исправление химического дисбаланса нейромедиаторов в головном мозге, которые, как считается, ответственны за изменения настроения и поведения.
Антидепрессанты были впервые разработаны в 1950-х годах. Их использование стало более распространенным за последние 20 лет.
По данным Центров по контролю и профилактике заболеваний (CDC), процент людей в возрасте 12 лет и старше, употребляющих антидепрессанты, в США вырос с 7,7 процента в 1999–2002 годах до 12,7 процента в 2011–2014 годах. Примерно вдвое больше женщин употребляют антидепрессанты, чем мужчины.
Антидепрессанты можно разделить на пять основных типов:
СИОЗС и СИОЗС
Это наиболее часто назначаемый тип антидепрессантов.
Ингибиторы обратного захвата серотонина и норадреналина (ИОЗСН) используются для лечения большой депрессии, расстройств настроения и, возможно, но реже, синдрома дефицита внимания с гиперактивностью (СДВГ), обсессивно-компульсивного расстройства (ОКР), тревожных расстройств, симптомов менопаузы, фибромиалгии и хроническая невропатическая боль.
ИОЗСН повышают уровень серотонина и норадреналина, двух нейромедиаторов в головном мозге, которые играют ключевую роль в стабилизации настроения.
Примеры включают дулоксетин (Cymbalta), венлафаксин (Effexor) и десвенлафаксин (Pristiq).
Селективные ингибиторы обратного захвата серотонина (СИОЗС) являются наиболее часто назначаемыми антидепрессантами. Они эффективны при лечении депрессии и имеют меньше побочных эффектов, чем другие антидепрессанты.
СИОЗС блокируют обратный захват или абсорбцию серотонина в головном мозге. Это облегчает получение и отправку сообщений клеткам мозга, что приводит к лучшему и более стабильному настроению.
Их называют «селективными», потому что они в основном влияют на серотонин, а не на другие нейротрансмиттеры.
SSRI и SNRIs могут иметь следующие побочные эффекты:
Примеры включают циталопрам (Celexa), эсциталопрам (Lexapro), флуоксетин (Prozac, Sarafem), флувоксамин (Luvox), пароксетин (Paxil) и сертралин (Zoloft).
Поступали сообщения о том, что люди, употребляющие СИОЗС и СИОЗСН, особенно в возрасте до 18 лет, могут испытывать мысли о самоубийстве, особенно когда они впервые начинают употреблять наркотики.
В соответствии с требованиями Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) все антидепрессанты имеют предупреждение в виде черного ящика.
Трициклические антидепрессанты (ТЦА)
Трициклические антидепрессанты (ТЦА) названы так потому, что в химической структуре этих препаратов есть три кольца. Они используются для лечения депрессии, фибромиалгии, некоторых типов беспокойства и могут помочь контролировать хроническую боль.
Трициклические препараты могут иметь следующие побочные эффекты:
- судороги
- бессонница
- тревога
- аритмия или нерегулярное сердцебиение
- гипертония
- сыпь
- тошнота и рвота
- абдоминальные спазмы
- потеря веса
- задержка мочи
- повышенное давление на глаз
- сексуальная дисфункция
Примеры включают амитриптилин (элавил), амоксапин-кломипрамин (анафранил), дезипрамин (норпрамин), доксепин (синекванаме), имипрамин (тофранил) (нортриптилин), нортриптилин , протриптилин (вивактил) и тримипрамин (сурмонтил).
Ингибиторы моноаминоксидазы (ИМАО)
Этот тип антидепрессантов обычно прописывался до введения СИОЗС и СИОЗСН.
Подавляет действие моноаминоксидазы, фермента мозга. Моноаминоксидаза помогает расщеплять нейротрансмиттеры, такие как серотонин.
Если расщепляется меньше серотонина, циркулирует больше серотонина. Теоретически это приводит к более стабильному настроению и меньшему беспокойству.
Врачи теперь используют ИМАО, если СИОЗС не помогли.MAOI обычно сохраняют для случаев, когда другие антидепрессанты не работают, потому что MAOI взаимодействуют с несколькими другими лекарствами и некоторыми продуктами питания.
Побочные эффекты включают:
- помутнение зрения
- сыпь
- судороги
- отек
- потеря веса или увеличение веса
- сексуальная дисфункция
- диарея, тошнота и запор
- беспокойство
- бессонница и сонливость
- головокружение
- аритмия или нерегулярный сердечный ритм
- обморок или обморок при вставании
- гипертония или высокое кровяное давление
Примеры ИМАО включают фенелзин (нардил), транилципромин (парнат), изокарбоксазид (марплан) и селегилин (EMSAM, Элдеприл).
Норадреналин и специфические серотонинергические антидепрессанты (NASSA)
Они используются для лечения тревожных расстройств, некоторых расстройств личности и депрессии.
Возможные побочные эффекты включают:
- запор
- сухость во рту
- увеличение веса
- сонливость и седативный эффект
- помутнение зрения
- головокружение
Более серьезные побочные реакции включают судороги, снижение лейкоцитов, обмороки и аллергию. реакции.
Примеры включают миансерин (Толвон) и миртазапин (Ремерон, Аванза, Зиспин).
Как действуют антидепрессанты?
Это видео на YouTube Пола Богдана объясняет, как работают антидепрессанты.
Любые побочные эффекты, вероятно, появятся в течение первых 2 недель, а затем постепенно исчезнут.
Общие эффекты — тошнота и беспокойство, но это будет зависеть от типа используемого препарата, как упоминалось выше.
Если побочные эффекты очень неприятны или они включают мысли о самоубийстве, следует немедленно сообщить об этом врачу.
Кроме того, исследования связали следующие побочные эффекты с использованием антидепрессантов, особенно среди детей и подростков.
Чрезмерное повышение настроения и активация поведения
Это может включать манию или гипоманию. Следует отметить, что антидепрессанты не вызывают биполярного расстройства, но они могут демаскировать состояние, которое еще не проявилось.
Суицидальные мысли
Было несколько сообщений о повышенном риске возникновения суицидных мыслей при первом применении антидепрессантов.
Это может быть связано с лекарствами или другими факторами, такими как время, необходимое лекарству, чтобы подействовать, или, возможно, недиагностированное биполярное расстройство, которое может потребовать другого подхода к лечению.
FDA требует, чтобы антидепрессанты несли в черных ящиках предупреждение об этом возможном эффекте.
Абстинентный синдром
В отличие от некоторых лекарств, нет необходимости постоянно повышать дозу, чтобы получить тот же эффект от антидепрессантов. В этом смысле они не вызывают привыкания.
Когда вы перестанете принимать антидепрессант, у вас не будет таких же симптомов отмены, как, например, при отказе от курения.
Однако почти каждый третий человек, принимавший СИОЗС и СИОЗСН, сообщает о некоторых симптомах отмены после прекращения лечения.
Симптомы длились от 2 недель до 2 месяцев и включали:
- беспокойство
- головокружение
- кошмары или яркие сны
- ощущения в теле, похожие на электрошок
- гриппоподобные симптомы
- боль в животе
в в большинстве случаев симптомы были легкими.Тяжелые случаи встречаются редко и более вероятны после прекращения приема Сероксата и Эффексора.
Врачи должны снижать дозу постепенно, чтобы свести к минимуму риск возникновения неприятных симптомов отмены.
Эти лекарства используются не только для лечения депрессии, но и для других состояний.
Основное или разрешенное использование антидепрессантов — лечение:
Иногда лекарство используется не по назначению. Это означает, что использование не одобрено FDA, но врач может решить, что его следует использовать, поскольку это может быть эффективным лечением.
Использование антидепрессантов не по назначению:
Исследования показывают, что 29 процентов антидепрессантов используются не по назначению.
Человеку может потребоваться несколько недель, чтобы заметить действие антидепрессанта. Многие люди перестают их использовать, потому что считают, что лекарства не действуют.
Причины, по которым люди могут не видеть улучшения, включают:
- лекарство, не подходящее для человека
- отсутствие контроля со стороны поставщика здравоохранения
- необходимость дополнительных методов лечения, таких как когнитивно-поведенческая терапия (КПТ)
- забыли принять лекарство в нужное время
Поддержание контакта с врачом и посещение последующих посещений помогает повысить шансы того, что лекарство подействует.Возможно, потребуется изменить дозировку или подойдет другое лекарство.
Важно принимать антидепрессант в соответствии с инструкциями, иначе он не подействует.
Большинство людей не почувствуют никаких преимуществ в течение первой или второй недели. Полный эффект проявится только через 1-2 месяца. Настойчивость жизненно важна.
Как долго длится лечение?
По данным Королевского колледжа психиатрии Соединенного Королевства, от 5 до 6 человек из каждых 10 будут испытывать значительное улучшение через 3 месяца.
Люди, принимающие лекарства, должны продолжать лечение в течение как минимум 6 месяцев после того, как почувствовали себя лучше. Те, кто прекратил прием до 8 месяцев, могут увидеть возвращение симптомов.
Те, у кого был один или несколько рецидивов, должны продолжать лечение не менее 24 месяцев.
Тем, кто регулярно испытывает рецидивы депрессии, возможно, потребуется принимать это лекарство в течение нескольких лет.
Однако обзор литературы, опубликованный в 2011 году, показал, что длительный прием антидепрессантов может ухудшить симптомы у некоторых людей, так как это может привести к биохимическим изменениям в организме.
Поделиться на PinterestВрач поможет взвесить все «за» и «против» приема антидепрессантов во время беременностиСообщается, что в Соединенных Штатах 8 процентов женщин принимают антидепрессанты во время беременности.
Использование СИОЗС во время беременности связано с более высоким риском выкидыша, преждевременных родов, низкой массы тела при рождении и врожденных пороков развития.
Возможные проблемы во время родов включают чрезмерное кровотечение у матери.
После рождения у новорожденного могут возникать проблемы с легкими, известные как стойкая легочная гипертензия.
Исследование 69 448 беременностей показало, что использование ИОЗСН или ТЦА во время беременности может увеличить риск индуцированной беременностью гипертензии или высокого кровяного давления, известного как преэклампсия. Однако остается неясным, связано ли это с наркотиками или депрессией.
Результаты, опубликованные в JAMA в 2006 году, показали, что почти каждый третий младенец, матери которого принимали антидепрессанты во время беременности, страдает неонатальным абстинентным синдромом. Симптомы отмены включали нарушение сна, тремор и пронзительный плач.В некоторых случаях симптомы были серьезными.
Лабораторное исследование показало, что грызуны, которые подвергались воздействию циталопрама — антидепрессанта СИОЗС — непосредственно до и после рождения, демонстрировали значительные аномалии мозга и поведение.
Однако для некоторых женщин риск продолжения приема лекарства меньше, чем риск прекращения, например, если ее депрессия может вызвать действие, которое может нанести вред ей или ее будущему ребенку.
Врач и пациент должны полностью обсудить преимущества и потенциальный вред прекращения приема антидепрессантов в это время.
Если возможно, следует рассмотреть другие методы лечения, такие как когнитивная КПТ, медитация или йога.
Грудное вскармливание
Небольшие количества некоторых антидепрессантов попадают в грудное молоко, например сертралин и нортриптилин.
В течение нескольких недель после рождения младенцы могут расщеплять активные ингредиенты лекарства в печени и почках так же эффективно, как и взрослые.
Решение использовать антидепрессанты в настоящее время будет связано с несколькими факторами:
- Здоров ли ребенок?
- Родились ли они недоношенными?
- Состояние матери ухудшится?
Сколько активных ингредиентов попадет в грудное молоко, в зависимости от типа лекарства
Одно исследование, опубликованное в журнале The Journal of Clinical Endocrinology and Metabolism , показало, что у женщин, принимающих антидепрессанты во время беременности, это может потребоваться больше времени для кормления грудью.
Исследователи объясняют, что грудные железы регулируются серотонином, поэтому их способность производить молоко в нужное время связана с производством и регулированием этого гормона.
КПТ и другие виды консультирования и терапии также могут помочь при депрессии.
Зверобой
Зверобой, приготовленный из травы зверобоя, помогает некоторым людям при депрессии. Он доступен без рецепта в качестве дополнения.
Однако его следует принимать только после разговора с врачом, поскольку есть некоторые возможные риски.
- В сочетании с некоторыми антидепрессантами зверобой может вызвать потенциально опасное для жизни повышение уровня серотонина.
- Может ухудшить симптомы биполярного расстройства и шизофрении. Человеку, у которого есть или может быть депрессия, связанная с биполярным расстройством, не следует употреблять зверобой.
- Это может снизить эффективность некоторых лекарств, отпускаемых по рецепту, включая противозачаточные таблетки, некоторые сердечные лекарства, варфарин и некоторые методы лечения ВИЧ и рака.
Важно сообщить своему врачу или фармацевту, если вы планируете принимать зверобой.Зверобой.
Некоторые данные подтверждают использование зверобоя для лечения депрессии, но некоторые исследования показали, что он не более эффективен, чем плацебо.
Световой короб
Людям, страдающим сезонным аффективным расстройством (САР), или «зимней хандрой», может помочь световая терапия. Для этого нужно первым делом по утрам сидеть перед световым коробом в течение 20-60 минут. Лайтбоксы можно приобрести в Интернете.
Добавки витамина D могут помочь в лечении SAD, а могут и не помочь.Доказательства неубедительны.
Диета и упражнения
Некоторые исследования показали, что здоровая, хорошо сбалансированная диета, много физических упражнений и поддержание связи с семьей и друзьями могут снизить риск депрессии и рецидивов.
Депрессия — серьезное заболевание, которое может нуждаться в лечении. Любой, кто испытывает симптомы депрессии, должен обратиться к врачу.
Типы, побочные эффекты, использование и эффективность
Мы включаем продукты, которые, по нашему мнению, будут полезны нашим читателям.Если вы совершаете покупку по ссылкам на этой странице, мы можем получить небольшую комиссию. Вот наш процесс.
Антидепрессанты — это лекарства, которые могут помочь облегчить симптомы депрессии, социального тревожного расстройства, тревожных расстройств, сезонного аффективного расстройства и дистимии или легкой хронической депрессии, а также других состояний.
Они направлены на исправление химического дисбаланса нейромедиаторов в головном мозге, которые, как считается, ответственны за изменения настроения и поведения.
Антидепрессанты были впервые разработаны в 1950-х годах.Их использование стало более распространенным за последние 20 лет.
По данным Центров по контролю и профилактике заболеваний (CDC), процент людей в возрасте 12 лет и старше, употребляющих антидепрессанты, в США вырос с 7,7 процента в 1999–2002 годах до 12,7 процента в 2011–2014 годах. Примерно вдвое больше женщин употребляют антидепрессанты, чем мужчины.
Антидепрессанты можно разделить на пять основных типов:
СИОЗС и СИОЗС
Это наиболее часто назначаемый тип антидепрессантов.
Ингибиторы обратного захвата серотонина и норадреналина (ИОЗСН) используются для лечения большой депрессии, расстройств настроения и, возможно, но реже, синдрома дефицита внимания с гиперактивностью (СДВГ), обсессивно-компульсивного расстройства (ОКР), тревожных расстройств, симптомов менопаузы, фибромиалгии и хроническая невропатическая боль.
ИОЗСН повышают уровень серотонина и норадреналина, двух нейромедиаторов в головном мозге, которые играют ключевую роль в стабилизации настроения.
Примеры включают дулоксетин (Cymbalta), венлафаксин (Effexor) и десвенлафаксин (Pristiq).
Селективные ингибиторы обратного захвата серотонина (СИОЗС) являются наиболее часто назначаемыми антидепрессантами. Они эффективны при лечении депрессии и имеют меньше побочных эффектов, чем другие антидепрессанты.
СИОЗС блокируют обратный захват или абсорбцию серотонина в головном мозге. Это облегчает получение и отправку сообщений клеткам мозга, что приводит к лучшему и более стабильному настроению.
Их называют «селективными», потому что они в основном влияют на серотонин, а не на другие нейротрансмиттеры.
SSRI и SNRIs могут иметь следующие побочные эффекты:
Примеры включают циталопрам (Celexa), эсциталопрам (Lexapro), флуоксетин (Prozac, Sarafem), флувоксамин (Luvox), пароксетин (Paxil) и сертралин (Zoloft).
Поступали сообщения о том, что люди, употребляющие СИОЗС и СИОЗСН, особенно в возрасте до 18 лет, могут испытывать мысли о самоубийстве, особенно когда они впервые начинают употреблять наркотики.
В соответствии с требованиями Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) все антидепрессанты имеют предупреждение в виде черного ящика.
Трициклические антидепрессанты (ТЦА)
Трициклические антидепрессанты (ТЦА) названы так потому, что в химической структуре этих препаратов есть три кольца. Они используются для лечения депрессии, фибромиалгии, некоторых типов беспокойства и могут помочь контролировать хроническую боль.
Трициклические препараты могут иметь следующие побочные эффекты:
- судороги
- бессонница
- тревога
- аритмия или нерегулярное сердцебиение
- гипертония
- сыпь
- тошнота и рвота
- абдоминальные спазмы
- потеря веса
- задержка мочи
- повышенное давление на глаз
- сексуальная дисфункция
Примеры включают амитриптилин (элавил), амоксапин-кломипрамин (анафранил), дезипрамин (норпрамин), доксепин (синекванаме), имипрамин (тофранил) (нортриптилин), нортриптилин , протриптилин (вивактил) и тримипрамин (сурмонтил).
Ингибиторы моноаминоксидазы (ИМАО)
Этот тип антидепрессантов обычно прописывался до введения СИОЗС и СИОЗСН.
Подавляет действие моноаминоксидазы, фермента мозга. Моноаминоксидаза помогает расщеплять нейротрансмиттеры, такие как серотонин.
Если расщепляется меньше серотонина, циркулирует больше серотонина. Теоретически это приводит к более стабильному настроению и меньшему беспокойству.
Врачи теперь используют ИМАО, если СИОЗС не помогли.MAOI обычно сохраняют для случаев, когда другие антидепрессанты не работают, потому что MAOI взаимодействуют с несколькими другими лекарствами и некоторыми продуктами питания.
Побочные эффекты включают:
- помутнение зрения
- сыпь
- судороги
- отек
- потеря веса или увеличение веса
- сексуальная дисфункция
- диарея, тошнота и запор
- беспокойство
- бессонница и сонливость
- головокружение
- аритмия или нерегулярный сердечный ритм
- обморок или обморок при вставании
- гипертония или высокое кровяное давление
Примеры ИМАО включают фенелзин (нардил), транилципромин (парнат), изокарбоксазид (марплан) и селегилин (EMSAM, Элдеприл).
Норадреналин и специфические серотонинергические антидепрессанты (NASSA)
Они используются для лечения тревожных расстройств, некоторых расстройств личности и депрессии.
Возможные побочные эффекты включают:
- запор
- сухость во рту
- увеличение веса
- сонливость и седативный эффект
- помутнение зрения
- головокружение
Более серьезные побочные реакции включают судороги, снижение лейкоцитов, обмороки и аллергию. реакции.
Примеры включают миансерин (Толвон) и миртазапин (Ремерон, Аванза, Зиспин).
Как действуют антидепрессанты?
Это видео на YouTube Пола Богдана объясняет, как работают антидепрессанты.
Любые побочные эффекты, вероятно, появятся в течение первых 2 недель, а затем постепенно исчезнут.
Общие эффекты — тошнота и беспокойство, но это будет зависеть от типа используемого препарата, как упоминалось выше.
Если побочные эффекты очень неприятны или они включают мысли о самоубийстве, следует немедленно сообщить об этом врачу.
Кроме того, исследования связали следующие побочные эффекты с использованием антидепрессантов, особенно среди детей и подростков.
Чрезмерное повышение настроения и активация поведения
Это может включать манию или гипоманию. Следует отметить, что антидепрессанты не вызывают биполярного расстройства, но они могут демаскировать состояние, которое еще не проявилось.
Суицидальные мысли
Было несколько сообщений о повышенном риске возникновения суицидных мыслей при первом применении антидепрессантов.
Это может быть связано с лекарствами или другими факторами, такими как время, необходимое лекарству, чтобы подействовать, или, возможно, недиагностированное биполярное расстройство, которое может потребовать другого подхода к лечению.
FDA требует, чтобы антидепрессанты несли в черных ящиках предупреждение об этом возможном эффекте.
Абстинентный синдром
В отличие от некоторых лекарств, нет необходимости постоянно повышать дозу, чтобы получить тот же эффект от антидепрессантов. В этом смысле они не вызывают привыкания.
Когда вы перестанете принимать антидепрессант, у вас не будет таких же симптомов отмены, как, например, при отказе от курения.
Однако почти каждый третий человек, принимавший СИОЗС и СИОЗСН, сообщает о некоторых симптомах отмены после прекращения лечения.
Симптомы длились от 2 недель до 2 месяцев и включали:
- беспокойство
- головокружение
- кошмары или яркие сны
- ощущения в теле, похожие на электрошок
- гриппоподобные симптомы
- боль в животе
в в большинстве случаев симптомы были легкими.Тяжелые случаи встречаются редко и более вероятны после прекращения приема Сероксата и Эффексора.
Врачи должны снижать дозу постепенно, чтобы свести к минимуму риск возникновения неприятных симптомов отмены.
Эти лекарства используются не только для лечения депрессии, но и для других состояний.
Основное или разрешенное использование антидепрессантов — лечение:
Иногда лекарство используется не по назначению. Это означает, что использование не одобрено FDA, но врач может решить, что его следует использовать, поскольку это может быть эффективным лечением.
Использование антидепрессантов не по назначению:
Исследования показывают, что 29 процентов антидепрессантов используются не по назначению.
Человеку может потребоваться несколько недель, чтобы заметить действие антидепрессанта. Многие люди перестают их использовать, потому что считают, что лекарства не действуют.
Причины, по которым люди могут не видеть улучшения, включают:
- лекарство, не подходящее для человека
- отсутствие контроля со стороны поставщика здравоохранения
- необходимость дополнительных методов лечения, таких как когнитивно-поведенческая терапия (КПТ)
- забыли принять лекарство в нужное время
Поддержание контакта с врачом и посещение последующих посещений помогает повысить шансы того, что лекарство подействует.Возможно, потребуется изменить дозировку или подойдет другое лекарство.
Важно принимать антидепрессант в соответствии с инструкциями, иначе он не подействует.
Большинство людей не почувствуют никаких преимуществ в течение первой или второй недели. Полный эффект проявится только через 1-2 месяца. Настойчивость жизненно важна.
Как долго длится лечение?
По данным Королевского колледжа психиатрии Соединенного Королевства, от 5 до 6 человек из каждых 10 будут испытывать значительное улучшение через 3 месяца.
Люди, принимающие лекарства, должны продолжать лечение в течение как минимум 6 месяцев после того, как почувствовали себя лучше. Те, кто прекратил прием до 8 месяцев, могут увидеть возвращение симптомов.
Те, у кого был один или несколько рецидивов, должны продолжать лечение не менее 24 месяцев.
Тем, кто регулярно испытывает рецидивы депрессии, возможно, потребуется принимать это лекарство в течение нескольких лет.
Однако обзор литературы, опубликованный в 2011 году, показал, что длительный прием антидепрессантов может ухудшить симптомы у некоторых людей, так как это может привести к биохимическим изменениям в организме.
Поделиться на PinterestВрач поможет взвесить все «за» и «против» приема антидепрессантов во время беременностиСообщается, что в Соединенных Штатах 8 процентов женщин принимают антидепрессанты во время беременности.
Использование СИОЗС во время беременности связано с более высоким риском выкидыша, преждевременных родов, низкой массы тела при рождении и врожденных пороков развития.
Возможные проблемы во время родов включают чрезмерное кровотечение у матери.
После рождения у новорожденного могут возникать проблемы с легкими, известные как стойкая легочная гипертензия.
Исследование 69 448 беременностей показало, что использование ИОЗСН или ТЦА во время беременности может увеличить риск индуцированной беременностью гипертензии или высокого кровяного давления, известного как преэклампсия. Однако остается неясным, связано ли это с наркотиками или депрессией.
Результаты, опубликованные в JAMA в 2006 году, показали, что почти каждый третий младенец, матери которого принимали антидепрессанты во время беременности, страдает неонатальным абстинентным синдромом. Симптомы отмены включали нарушение сна, тремор и пронзительный плач.В некоторых случаях симптомы были серьезными.
Лабораторное исследование показало, что грызуны, которые подвергались воздействию циталопрама — антидепрессанта СИОЗС — непосредственно до и после рождения, демонстрировали значительные аномалии мозга и поведение.
Однако для некоторых женщин риск продолжения приема лекарства меньше, чем риск прекращения, например, если ее депрессия может вызвать действие, которое может нанести вред ей или ее будущему ребенку.
Врач и пациент должны полностью обсудить преимущества и потенциальный вред прекращения приема антидепрессантов в это время.
Если возможно, следует рассмотреть другие методы лечения, такие как когнитивная КПТ, медитация или йога.
Грудное вскармливание
Небольшие количества некоторых антидепрессантов попадают в грудное молоко, например сертралин и нортриптилин.
В течение нескольких недель после рождения младенцы могут расщеплять активные ингредиенты лекарства в печени и почках так же эффективно, как и взрослые.
Решение использовать антидепрессанты в настоящее время будет связано с несколькими факторами:
- Здоров ли ребенок?
- Родились ли они недоношенными?
- Состояние матери ухудшится?
Сколько активных ингредиентов попадет в грудное молоко, в зависимости от типа лекарства
Одно исследование, опубликованное в журнале The Journal of Clinical Endocrinology and Metabolism , показало, что у женщин, принимающих антидепрессанты во время беременности, это может потребоваться больше времени для кормления грудью.
Исследователи объясняют, что грудные железы регулируются серотонином, поэтому их способность производить молоко в нужное время связана с производством и регулированием этого гормона.
КПТ и другие виды консультирования и терапии также могут помочь при депрессии.
Зверобой
Зверобой, приготовленный из травы зверобоя, помогает некоторым людям при депрессии. Он доступен без рецепта в качестве дополнения.
Однако его следует принимать только после разговора с врачом, поскольку есть некоторые возможные риски.
- В сочетании с некоторыми антидепрессантами зверобой может вызвать потенциально опасное для жизни повышение уровня серотонина.
- Может ухудшить симптомы биполярного расстройства и шизофрении. Человеку, у которого есть или может быть депрессия, связанная с биполярным расстройством, не следует употреблять зверобой.
- Это может снизить эффективность некоторых лекарств, отпускаемых по рецепту, включая противозачаточные таблетки, некоторые сердечные лекарства, варфарин и некоторые методы лечения ВИЧ и рака.
Важно сообщить своему врачу или фармацевту, если вы планируете принимать зверобой.Зверобой.
Некоторые данные подтверждают использование зверобоя для лечения депрессии, но некоторые исследования показали, что он не более эффективен, чем плацебо.
Световой короб
Людям, страдающим сезонным аффективным расстройством (САР), или «зимней хандрой», может помочь световая терапия. Для этого нужно первым делом по утрам сидеть перед световым коробом в течение 20-60 минут. Лайтбоксы можно приобрести в Интернете.
Добавки витамина D могут помочь в лечении SAD, а могут и не помочь.Доказательства неубедительны.
Диета и упражнения
Некоторые исследования показали, что здоровая, хорошо сбалансированная диета, много физических упражнений и поддержание связи с семьей и друзьями могут снизить риск депрессии и рецидивов.
Депрессия — серьезное заболевание, которое может нуждаться в лечении. Любой, кто испытывает симптомы депрессии, должен обратиться к врачу.
Как наконец работают антидепрессанты?
На протяжении многих лет мне очень нравилось быть пораженным научной литературой, и не так уж много раз я был удивлен больше, чем сегодня утром.Я много лет делал в этом блоге ссылки на то, что мы даже не знаем, как работают антидепрессанты, но если эта новая статья верна, то, возможно, теперь мы знаем. Я удивлен.
Это от многонациональной группы, возглавляемой из Университета Хельсинки, и они сделали несколько очень интересных открытий о белке рецептора-2 тирозинкиназы (TrkB). Уже давно известно, что он играет важную роль в пластичности нейронов — TrkB — это рецептор с высоким сродством к нейротрофическому фактору головного мозга (BDNF), который, как следует из названия, является одним из нейротрофических сигнальных белков, которые могут регулировать рост и ветвление. аксонов и синаптической плотности.Они интенсивно изучались с 1980-х годов как возможные участники (или методы лечения) при ряде состояний ЦНС — я хорошо помню, как участвовал в (обреченной) программе, которая исследовала родственный белок, фактор роста нервов (NGF), для болезни Альцгеймера. Большинство из них работают путем связывания с рецепторными тирозинкиназами — например, NGF связывается с так называемым TrkA.
Поскольку мозг такой, какой он есть, было трудно добиться прогресса в терапевтическом использовании этих систем, хотя они явно чрезвычайно важны.В последние годы выдвигается гипотеза депрессии, основанная на BDNF. В этой идее есть много вещей, которые имеют смысл, не в последнюю очередь то, что кажется, что уровни BDNF коррелируют с особенностями самой депрессии как на животных моделях, так и на людях, и было показано, что несколько известных антидепрессантов усиливают передачу сигналов BDNF через какой-то неизвестный механизм. Считалось, что это косвенный эффект этих препаратов, потому что (в конце концов) уже известно, что они имеют высокоаффинные мишени в системе передачи сигналов моноаминов, т.е.грамм. ингибиторы обратного захвата серотонина, такие как флуоксетин (прозак). Тот же аргумент приводится в отношении соединений NMDA, дофаминовых лигандов и других, и это ни в коем случае не глупая идея. Если мы в чем-то уверены относительно этих рецепторов мозга, так это в том, что они перекрестно взаимодействуют друг с другом шестью способами, начиная с воскресенья. Таким образом, BDNF вполне может быть важным фактором, но есть повод спорить обо всем этом, поскольку есть почти любой важный вопрос о функционировании мозга.
Итак, одна из вещей, которые раскрывает эта статья, заключается в том, что функция белка TrkB заключается в том, чтобы служить датчиком уровня холестерина.Я знаю, что мы все десятилетиями сталкивались с историями общественного здравоохранения о том, что холестерин = смерть, и когда он покрывает внутреннюю часть ваших артерий, это довольно точно. Но он также необходим для жизни как незаменимый компонент каждой клеточной мембраны. Во всяком случае, это еще более важно в мозге, где было показано, что он является еще одним регулятором пластичности нейронов и важным компонентом миелиновых оболочек и белого вещества мозга. В остальной части тела холестерин обрабатывается сложной липопротеидной системой, включающей печень, тонкий кишечник и другие органы, ставшие известными с годами.Но все это останавливается на гематоэнцефалическом барьере, а мозг имеет свою собственную сложную систему для импорта и распределения холестерина в нейронах.
В этой статье идентифицирован мотив распознавания холестерина в последовательности TrkB (который не присутствует в родственных рецепторах). Добавление холестерина в системы BDNF / TrkB оказало значительное влияние на передачу сигналов и, по-видимому, также способствовало перемещению белка TrkB из внутриклеточных компартментов на поверхность клетки (что также, естественно, должно было изменить ландшафт передачи сигналов).
Теперь о гипотезе BDNF. Я использовал фразу «неизвестный механизм» выше, и это именно то, что, возможно, прояснила эта работа. Авторы показывают, что когда белок TrkB образует димер в клеточной мембране, сайт связывания для малых молекул формируется на границе раздела. Полный список известных антидепрессантов (флуоксетин, имипрамин, венлафаксин, моклобемид, кетамин, эскетамин и R, R-гидроксиноркетамин) связываются с этим сайтом примерно на 1 микромолярном уровне (и могут замещать друг друга в анализах связывания (в то время как набор контролируют соединения ЦНС, такие как хлорпромазин, дифенгидрамин и даже S, S-гидроксиноркетамин не действуют.Те, кто проводил исследования в этой области, не забудут, что перечисленные выше антидепрессанты действуют через совершенно другие механизмы.
Но все эти соединения имеют сходные эффекты на взаимодействие связывания TrkB-BDNF — например, они способствуют переносу через мембрану самого белка TrkB. Очень интересная связь связана с известным эффектом антидепрессантов на количество рецепторов AMPA в клеточной мембране, который связывают с антидепрессивным действием кетамина и его производных.Этот эффект подавляется известными ингибиторами TrkB, поэтому он, по-видимому, ниже связывания класса кетамина с TrkB. Также кажется, что форма и размер этого сайта связывания малых молекул изменяются холестерин-чувствительными функциями трансмембранного домена TrkB, и предсказывается, что связывание будет наиболее благоприятным в наиболее богатых холестерином частях клетки. мембрана. Возможно, это не совпадение, так это синаптическая область в нейроне.
Авторы проделывают хорошую работу по проверке гипотез, создавая различные точечные мутации белка TrkB, и они показывают, что они могут нарушить функцию чувствительности к холестерину, предполагаемое связывание малых молекул и эффекты BDNF, воздействуя на ключевые остатки согласно прогнозу.Эти эффекты видны в анализах связывания и в микроскопии клеточной мембраны со сверхвысоким разрешением, а также в анализах самой нейрональной пластичности. Наконец, в ключевом эксперименте было показано, что такие мутантные формы TrkB на самом деле отменяют эффекты антидепрессантов у мышей, которые экспрессируют измененные рецепторные белки. Результаты очень похожи на те, которые вы видите у животных с дефицитом BDNF. В эту рукопись вложено много работы.
Холестериновая часть истории тоже всплывает в этих экспериментах.Авторы заметили, что поведенческие эффекты также теряются при остром лечении правистатином (изменяя гомеостаз холестерина и, предположительно, оказывая влияние на сайт связывания малых молекул TrkB, поскольку он ощущает снижение общего холестерина мембран). Насколько я могу судить, не было обнаружено никакой связи между употреблением статинов и депрессией (и это не похоже на то, что люди не смотрели!), Но это интересно рассмотреть. Возможно, если есть эффект, он временный, так как мозг затем возвращает уровень холестерина в более приемлемый диапазон? Неизвестный.
В целом, это отличная и заставляющая задуматься статья, имеющая множество подтверждений. Если эти результаты выдержат дальнейшее экспериментирование — и поверьте мне, экспериментов будет много, — то это большой шаг вперед в нашем понимании депрессии. Что было бы очень и очень хорошей новостью. Я начал свою работу в фармацевтической промышленности, занимаясь лекарственной химией ЦНС, и был напуган тем, как мало мы действительно понимаем такие болезни. Потребовались десятилетия работы, но, возможно, был включен ключевой выключатель света.Будем надеяться.
Антидепрессанты
Антидепрессанты в основном используются при лечении большой депрессии и тревоги. Они работают, постепенно изменяя баланс определенных химических веществ в мозгу, называемых нейротрансмиттерами. Большинство антидепрессантов увеличивают количество присутствующих нейротрансмиттеров. Мозг естественным образом удаляет нейротрансмиттеры посредством процесса, называемого обратным захватом, и некоторые из самых популярных антидепрессантов блокируют обратный захват, тем самым повышая концентрацию определенных нейротрансмиттеров.
Обычно людям, которым прописывают антидепрессанты для лечения психического состояния, также рекомендуется использовать лекарства в сочетании с другими вариантами лечения, такими как психотерапия. Сами по себе лекарства не могут вылечить первопричины проблем с психическим здоровьем, а вместо этого используются для контроля симптомов.
Роль нейротрансмиттеров
Несколько видов нейромедиаторов участвуют в регуляции поведения и настроения. Серотонин, дофамин и норэпинефрин являются одними из наиболее важных из этих химических веществ.
- Серотонин (5-HT): серотонин вырабатывается в желудочно-кишечном тракте и центральной нервной системе. Считается, что он улучшает настроение и бдительность. В целом, он отвечает за множество функций, включая подвижность желудочно-кишечного тракта, а также сердечно-сосудистую систему и несколько функций органов.
- Дофамин (DA): Дофамин отвечает за счастье, бдительность, а также положение и ориентацию тела.
- Норадреналин (NE): этот нейромедиатор, также известный как норадреналин, вызывает настороженность.
Нервная система человека естественным образом удаляет нейротрансмиттеры посредством процесса, называемого обратным захватом. В процессе обратного захвата нейротрансмиттеры удаляются из синаптических щелей нескольких нейронов с целью рециркуляции и удаления. Из-за этого процесса и химического состава каждого человека конкретная концентрация нейромедиатора может снижаться до уровней, вызывающих нарушение настроения.
История антидепрессантов
До 1950-х годов для лечения депрессии иногда использовались вызывающие привыкание опиоиды, амфетамин и метамфетамины.Затем, в начале 1950-х годов, исследователи обнаружили корреляцию между депрессией и лекарствами, повышающими и понижающими уровень моноаминов, и была разработана гипотеза биогенного амина. Эта гипотеза предполагает, что недостаток моноаминов, особенно норадреналина и серотонина, вызывает депрессию, и что увеличение этих моноаминов в мозге может облегчить депрессию.
Ипрониазид, лекарство от туберкулеза, было одним из первых средств от депрессии. Когда врачи начали прописывать это лекарство в 1951 году, они обнаружили, что люди, которым они давали его, получали новую энергию и улучшали настроение, а также избавлялись от симптомов туберкулеза.Первый клинический антидепрессант был открыт примерно в то же время учеными, которые пытались лечить шизофрению, и нашли лекарство, которое воздействовало на нейротрансмиттеры в головном мозге, заставляя людей, принимавших его, испытывать эйфорию. Это не помогло в лечении шизофрении, но люди, страдающие депрессией, которые пробовали препарат, сообщили о положительном эффекте. Этот препарат, тофранил, помог облегчить симптомы депрессии, но побочные эффекты заставили ученых искать более безопасные варианты. Прозак, Золофт и Паксил последовали за Тофранилом и добились значительного успеха на рынке.
Сегодня антидепрессанты назначают часто: примерно каждый десятый американец принимает антидепрессанты. Причина депрессии и то, как действуют антидепрессанты, до сих пор до конца не изучены, что вызвало споры об антидепрессантах и их использовании. Например, новые исследования показывают, что лекарства могут иметь меньшее влияние на людей с не такой тяжелой депрессией, но данные действительно показывают, что для многих из тех, кто страдает тяжелой депрессией, антидепрессанты могут иметь положительный эффект.
Типы и названия лекарств
Есть несколько различных классов антидепрессантов. В их числе:
- Селективные ингибиторы обратного захвата серотонина (СИОЗС): СИОЗС являются одними из самых безопасных и эффективных антидепрессантов, доступных сегодня. Эти лекарства включают:
- Ингибиторы обратного захвата серотонина и норэпинефрина (ИОЗСН): ИОЗСН действуют несколько иначе, чем СИОЗС, но также обычно считаются эффективными для многих людей.SNRIs включают:
- Трициклические антидепрессанты (ТЦА): ТЦА — это старые классы антидепрессантов, которые обычно больше не назначаются, за исключением случаев, когда кому-то не удается улучшить состояние с помощью новых лекарств. К препаратам этого класса относятся:
- Ингибиторы моноаминоксидазы (ИМАО) : ИМАО также обычно не назначают, поскольку они являются более старым типом антидепрессантов, которые могут нести более высокий риск побочных эффектов. Лекарства MAOI включают:
- Эмсам (селегилин)
- Марплан (изокарбоксазид)
- нардил (фенелзин)
- Парнат (транилципромин)
- Aminoketones включает только один препарат:
- Тетрациклины включают препараты:
- Людиомил (мапротилин)
- Ремерон (миртазапин)
- Триазолопиридины включают такие препараты, как:
Как работают антидепрессанты
Каждая классификация антидепрессантов работает немного иначе, чем следующая, и может давать разные результаты лечения.
- SSRIs : SSRIs блокируют процесс обратного захвата серотонина или 5-HT. Повышенная концентрация серотонина улучшает настроение и бдительность, что приводит к повышенному интересу и активности. СИОЗС имеют наименьшее количество побочных эффектов и нежелательных реакций на лекарства. СИОЗС также используются при генерализованной тревоге, посттравматическом стрессе, сезонном аффективном расстройстве (САР), предменструальном дисфорическом расстройстве и нервной булимии (только флуоксетин). Обычно результаты приходят через 2–12 недель в зависимости от состояния и тяжести симптомов.СИОЗС доступны в таблетках для приема внутрь.
- SNRIs : Подобно SSRI, SNRIs блокируют обратный захват NE и 5-HT. Эти агенты производят двойное действие, увеличивая концентрацию обоих нейромедиаторов. СИОЗС более эффективны и обычно назначаются людям, которые не восстанавливаются с помощью СИОЗС. Нейропатическую боль, связанную с диабетической невропатией и депрессией, такую как боль в спине и мышцах, также можно лечить с помощью SNRIs и TCA. Эти препараты доступны в форме таблеток для перорального применения.
- TCAs : Трициклические антидепрессанты имеют эффекты, аналогичные SNRIs, но они сильно действуют на холинергические, мускариновые, гистаминовые и адренергические рецепторы.Таким образом, они вызывают больше побочных эффектов. ТЦА доступны в форме таблеток и капсул для перорального применения.
- ИМАО : ИМАО подавляют активность фермента, называемого моноаминоксидазой (МАО). Этот фермент расщепляет дофамин, что снижает его концентрацию в организме. Подавление МАО увеличивает количество дофамина, который вызывает ощущение счастья и бдительности. MOAI доступны в форме таблеток и трансдермальных пластырей.
- Аминокетоны : Аминокетоны — слабые ингибиторы обратного захвата норадреналина и дофамина.Однако последние исследования показывают, что они лучше подавляют процесс поглощения дофамина, чем норадреналин. Бупропион — единственный агент в этой категории. Он используется, чтобы помочь человеку бросить курить, облегчая абстинентный синдром от курения и связанной с ним депрессии.
- Триазолопиридины : Триазолопиридины обладают слабым ингибирующим свойством обратного захвата серотонина или 5-HT. При длительном применении эти агенты блокируют пресинаптические рецепторы 5-HT 2A .Это увеличивает концентрацию серотонина в организме. Однако препараты этой категории могут вызывать серьезные побочные эффекты, включая ортостатическую гипотензию, седативный эффект, замедление когнитивных функций и головокружение.
Побочные эффекты
Побочные эффекты нормальны при приеме антидепрессантов. Общие побочные эффекты включают головную боль, тошноту, бессонницу, возбуждение и проблемы с сексуальной активностью. Обычно эти побочные эффекты не являются серьезными. Кроме того, большинство побочных эффектов возникают в первые несколько недель лечения и со временем уменьшаются.Врачи могут скорректировать дозировку лекарств или переключиться на другие лекарства, если побочные эффекты мешают нормальному функционированию.
В частности, известно, чтоТЦА вызывают сильные холинергические побочные эффекты, такие как сухость во рту, тошнота, задержка мочи, аритмии и головокружение. В более высоких дозах ТЦА могут вызывать опасную для жизни аритмию, а ортостатическая гипотензия также может быть серьезным побочным эффектом у пожилых людей. Потеря либидо, аноргазмия у женщин, эректильная дисфункция у мужчин и увеличение веса обычно являются побочными эффектами.О сексуальных проблемах, вызванных ТЦА, обычно меньше сообщают, чем при приеме СИОЗС. Хотя СИОЗС с большей вероятностью вызывают сексуальные проблемы, СИОЗС и СИОЗС в целом имеют меньше побочных эффектов, чем ТЦА, и поэтому их чаще назначают.
ИМАО и триазолопиридины имеют обычную, но потенциально опасную возможность вызывать постуральную гипотензию. Постуральная гипотензия — это медицинский термин, обозначающий головокружение или головокружение, которое иногда возникает, когда вы слишком быстро встаете или слишком резко растягиваетесь.Некоторые ИМАО могут вызывать седативный эффект, и их следует принимать с осторожностью, если вы придерживаетесь диеты, богатой тирамином, например, в частности, с высокими концентрациями красного мяса, шоколада, некоторых продуктов из свинины и большинства сыров. Аминокетоны могут вызывать судороги, тошноту, рвоту и желудочные расстройства.
Предупреждение FDA об увеличении риска самоубийства
В 2007 году Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США объявило о просьбе к производителям антидепрессантов обновить этикетки своих продуктов с предупреждениями о повышенных рисках суицидального мышления и поведения для молодых людей в возрасте от 18 до 24 лет при начале лечения, обычно в течение первых двух недель месяцев приема лекарства.На этикетках было разрешено указывать, что никакие научные данные не указывают на повышенный риск самоубийства для взрослых старше 24 лет и что риск самоубийства фактически снижается для взрослых старше 65 лет, начинающих лечение.
Немедленно сообщите своему врачу или психиатру, если у вас возникнут мысли о самоубийстве, когда вы начинаете прием антидепрессантов, чтобы можно было скорректировать дозировку или лечение. Точно так же медицинские работники должны помнить об этом повышенном риске и контролировать тех, кто находится под их опекой, если прописывают антидепрессант лицам младше 24 лет.
Симптомы отмены
В большинстве случаев антидепрессанты следует постепенно исключать из протокола лечения. Внезапное прекращение приема антидепрессантов может привести к абстинентному синдрому и рецидиву депрессии и беспокойства. Другие эффекты могут включать тошноту, рвоту, внезапные и яркие сны, головную боль, боль и возвращение депрессии.
Резкая отмена ТЦА часто связана с симптомами, указывающими на холинергическую природу, например головокружением, тошнотой, диареей, бессонницей и беспокойством, особенно если суточная доза превышает 300 мг.Следовательно, соответствующую дозу следует снижать в течение нескольких дней.
Когда прекратить использование
Поскольку антидепрессанты отпускаются только по рецепту, вы должны поговорить со своим врачом, прежде чем их прекратить. Если симптомы и возникновение хотя бы одного эпизода депрессии существуют, ваш врач обычно не прекращает действие рецепта в течение шести месяцев. Всегда помните, что ваше состояние депрессии или беспокойства и симптомы отмены могут появиться после прекращения приема этих лекарств.
Большинству антидепрессантов для достижения полной эффективности требуется несколько недель. Согласно исследованиям, когнитивная терапия в сочетании с лекарствами оказалась более эффективной, чем только лекарства. По данным Национального института психического здоровья, большинству людей, страдающих депрессией, необходимо продолжать принимать антидепрессанты от шести до двенадцати месяцев или дольше, чтобы увидеть все преимущества лекарства. У некоторых людей может быть только один эпизод депрессии или беспокойства, в то время как для других депрессия представляет собой хроническое состояние на всю жизнь.Хотя иногда метод проб и ошибок необходим, чтобы подобрать человеку правильный антидепрессант, в целом эффективность этих лекарств высока. Приблизительно от 80% до 87% людей с депрессией хорошо реагируют на первое назначение антидепрессанта.
Артикул:
- MedlinePlus. (нет данных). Антидепрессанты. Национальная медицинская библиотека — Национальные институты здравоохранения . Получено с http://www.nlm.nih.gov/medlineplus/antidepressants.HTML
- Клиника Мэйо. (нет данных). Депрессия (большая депрессия). Получено с http://www.mayoclinic.com/health/antidepressants/MH00071 .
- Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. (нет данных). Понимание приема антидепрессантов. Получено с http://www.fda.gov/ForConsumers/ConsumerUpdates/ucm095980.htm .
- Американская психиатрическая ассоциация. (2000). Диагностическое и статистическое руководство по психическим расстройствам , 4-е изд., Редакция текста. Вашингтон: Американская психиатрическая ассоциация.
- Kessler, R.C. и Уолтерс, Э.Е. (1998). Эпидемиология большой депрессии и малой депрессии DSM-III-R среди подростков и молодых людей в Национальном обследовании коморбидности. Подавить тревогу , 7, 3–14.
- Дельгадо П.Л., Морено Ф.А., Поттер Р. и др. (1997). Норэпинефрин и серотонин в действии антидепрессантов: данные исследований истощения нейротрансмиттеров. В Briley, M., Montgomery, S.A., eds. Антидепрессивная терапия на заре третьего тысячелетия .Лондон: Марин Дуниц, 141–163.
- Emslie, G.J., Heiligenstein, J.H., Wagner, K.D., et al. (2002). Флуоксетин для острого лечения депрессии у детей и подростков: рандомизированное исследование, контролируемое плацебо. J Am Acad Child Adolesc Psych , 10, 1205–1215.
Содержание страницы проверено Джеймсом Пендлтоном, Северная Дакота
Как работают антидепрессанты | Статьи
Что такое депрессия?
Депрессия — это клиническое состояние, в целом характеризующееся всепроникающей грустью и отсутствием удовольствия от повседневной жизни.Она отличается от обычной печали своей продолжительностью (не менее 10-14 дней непрерывного или почти постоянного присутствия этих эмоциональных трудностей) и своим негативным влиянием на повседневное функционирование в таких областях, как производительность труда и личные отношения. В большинстве случаев депрессия также связана с чувством беспокойства и нарушением сна, аппетита и либидо. В худшем случае депрессия сопровождается очень тревожными мыслями, например, что жизнь не стоит того, чтобы жить, и даже актами членовредительства, ведущими к попытке или успешному самоубийству.В западном мире депрессия считается одной из основных причин инвалидности, причем каждый пятый человек испытывает депрессию в течение своей жизни.
Антидепрессанты: лекарства от депрессии
Лекарства, которые работают специально для лечения вышеупомянутых депрессивных симптомов, существуют с конца 1960-х годов. За прошедшие годы было разработано множество классов (трициклические препараты, селективные ингибиторы обратного захвата серотонина, двойные ингибиторы обратного захвата норадреналина и серотонина и другие).Эти разные классы обладают сходной эффективностью (то есть все они одинаково эффективны в облегчении депрессивных симптомов), но последовательные поколения лекарств привели к лучшей переносимости и меньшей токсичности. Прежде чем мы рассмотрим, как работают антидепрессанты, важно указать несколько фактов, относящихся к их клиническому применению:
Антидепрессанты эффективны : сотни тщательно проведенных исследований с использованием сравнения «пустышек» и 40-летний клинический опыт ясно показали, что антидепрессанты действительно работают: эти лекарства улучшают симптомы депрессии.Это улучшение особенно заметно у людей с более тяжелыми формами депрессии, и по этой причине антидепрессанты не следует (и даже не назначают) людям с легкой и преходящей депрессией, где разговорная терапия столь же эффективна.
Антидепрессанты спасают жизни: , несмотря на неоднозначную огласку, антидепрессанты обладают сильным антисуицидным действием, а социальные исследования показали, что снижение использования антидепрессантов сопровождается увеличением количества самоубийств.Одним из потенциальных источников путаницы в этом отношении является то, что некоторые антидепрессанты (не все) могут усиливать возбуждение и беспокойство в первые несколько дней приема, и это может привести к кратковременному субъективному ухудшению депрессивных симптомов. Однако это не было связано с повышенным риском самоубийства.
Антидепрессанты не вызывают привыкания: вещества, такие как алкоголь или героин, считаются «вызывающими привыкание», когда их положительное воздействие таково, что люди не могут перестать их принимать, и когда люди пытаются прекратить их принимать, и когда люди испытывают физический и психический стресс.Антидепрессанты не вызывают немедленного удовольствия при приеме; они действительно вызывают некоторые неприятные физические и психические ощущения при внезапной остановке, но они обычно кратковременны, и их можно избежать, уменьшив дозу.
Доступные антидепрессанты все еще недостаточно хороши: Несмотря на многие положительные особенности, описанные выше, важно подчеркнуть, что не всем пациентам помогают антидепрессанты. Действительно, примерно у половины всех пациентов с депрессией не наблюдается улучшения после первого курса антидепрессантов, и до одной трети может не улучшиться ни с одним из доступных антидепрессантов.Таким образом, крайне важно продолжить изучение того, «как работает антидепрессант», чтобы создать новые и более эффективные лекарства. Остальная часть этой статьи представит наше текущее понимание того, как работают антидепрессанты.
Антидепрессанты действуют на функцию мозга
Мозг является центром эмоциональных переживаний и регуляции, и поэтому неудивительно, что именно здесь действуют антидепрессанты. Преобладающая модель состоит в том, что во время депрессии активность некоторых эндогенных веществ, которые опосредуют функцию мозга (называемых «нейротрансмиттерами» или химическими посредниками), снижается, и что антидепрессанты работают, восстанавливая эту эндогенную активность.В свою очередь, восстановление активности нейротрансмиттера имеет множество последующих последствий, которые улучшают способность мозга справляться со стрессом и реагировать на сложные эмоциональные обстоятельства. Особый интерес представляет концепция о том, что эти изменения функции мозга вызываются не только антидепрессантами, но и разговорной терапией, что указывает на общие конечные терапевтические пути как для лекарственного, так и для немедикаментозного вмешательства.
Антидепрессанты помогают уменьшить «негативные предубеждения» в интерпретации и запоминании эмоциональных событий: Одним из психологических механизмов, ведущих к депрессии (или усугубляемой депрессией), является тенденция интерпретировать и запоминать происходящие с нами события как более негативные, чем они есть на самом деле. .Повседневная жизнь полна неоднозначных ситуаций и переживаний — если, например, вы видите друга на улице, а он игнорирует вас, это потому, что вы ему не нравитесь, или им нужна новая пара очков? Люди, страдающие депрессией, часто интерпретируют и запоминают такую ситуацию более негативно. Исследования показывают, что антидепрессанты помогают восстановить баланс между интерпретацией и запоминанием этих ситуаций, а также позволяют учитывать положительную информацию. Интересно, что этот сдвиг в мышлении сопровождается «биологическими изменениями» в мозге, которые можно увидеть с помощью методов визуализации (таких как магнитно-резонансная томография), которые говорят нам, какие области мозга активируются в ответ на эмоциональный стимул.Действительно, недавно мы показали, что изменения в частях мозга, которые имеют дело с эмоциональной информацией, таких как область, называемая миндалевидным телом (набор ядер «миндалевидной» формы в височной доле), происходят до того, как реципиент осознает какое-либо изменение. Затем считается, что эти изменения постепенно уменьшают переживание депрессии, поскольку пациент может видеть более позитивную перспективу реальности (см. Рисунок 1).
Рисунок 1: Антидепрессанты уменьшают реакцию миндалины на негативные сигналы, такие как испуганное выражение лица.–Godlewska et al (2012) Антидепрессанты укрепляют нашу способность справляться со стрессом: Часто депрессия вызывается стрессовым жизненным событием. Хотя полная биологическая дорожная карта, согласно которой стресс вызывает депрессию, еще неизвестна, одним из важных элементов является система гормональной реакции на стресс, при этом уровень основного гормона стресса — кортизола — постоянно повышается у пациентов с депрессией. В свою очередь, повышенный уровень кортизола, по-видимому, способствует развитию депрессивных симптомов.Например, высокий уровень кортизола (или экспериментальный стресс у животных) снижает количество и функцию нейрональных клеток головного мозга. Антидепрессанты, в свою очередь, ослабляют систему гормональной реакции на стресс, тем самым позволяя уровням кортизола вернуться к норме, в конечном итоге спасая клетки мозга от воздействия стресса. При этом антидепрессанты не только помогают разрешить текущую депрессию, но и предотвращают возникновение депрессии в будущем в ответ на стресс.
Следует отметить, что антидепрессанты оказывают этот эффект, стимулируя рождение новых клеток («нейрогенез») в областях мозга, которые регулируют реакцию на стресс, таких как «гиппокамп».Нейрогенез снижается при стрессе и депрессии и усиливается антидепрессантами. Действительно, нам удалось построить человеческий мозг «в тарелке» и с помощью микроскопа посмотреть, что происходит с нейрогенезом человека во время стресса и лечения антидепрессантами (см. Рис. 2).
Панель A: Клетки мозга окрашены двумя разными маркерами: зеленые новые клетки мозга, которые делятся, и красные новые полностью сформированные нейроны. .Совершенно очевидно, что по сравнению с нормальными («контрольными») условиями стресс (в данном случае инкубация с гормоном стресса кортизолом) резко снижает количество новых клеток мозга.
Панель B: Подсчитывая клетки под микроскопом, мы можем количественно определить, сколько клеток присутствует в чашке. Нормальная («контрольная») ситуация (синий цвет) определяется как «ноль». Стресс (красный) уменьшает количество новых клеток мозга примерно на 25%, а антидепрессанты (желтый) увеличивают количество новых клеток мозга примерно на 25%.Наконец, при введении в стрессовой ситуации (розовый) антидепрессанты защищают новые клетки мозга от воздействия стресса и возвращают систему к нормальному состоянию.
Выводы
Антидепрессанты — эффективные лекарства, но необходимо больше узнать о том, как действуют антидепрессанты и почему они действуют у одних пациентов, а у других — нет. Поэтому психофармакологические исследования антидепрессантов имеют решающее значение для улучшения жизни многих людей.
Предлагаемые показания:
- Anacker C, Pariante CM (2012) Может ли нейрогенез взрослых сдерживать стрессовые реакции и депрессивное поведение? Молекулярная психиатрия .17 января: 9-10.
- Anacker C, Zunszain PA, Cattaneo A, Carvalho LA, Garabedian MJ, Thuret, Price J, Pariante CM (2011). Антидепрессанты усиливают нейрогенез в гиппокампе человека, активируя рецептор глюкокортикоидов. Molecular Psychiatry 6, 738-50.
- Zunszain PA, Anacker C, Cattaneo A, Carvalho LA, Pariante CM . (2011) Глюкокортикоиды, цитокины и аномалии мозга при депрессии. Prog Neuropsychopharmacol Biol Psychiatry 35: 722-729.
- Годлевска Б.Р., Норбери Р., Селварадж С., Коуэн П.Дж., Хармер С.Дж. (2012) Кратковременное лечение СИОЗС нормализует гиперактивность миндалины у пациентов с депрессией. Psychol Med. 25 апреля 2012 г .: 1-9
- Harmer CJ, Goodwin GM, Cowen PJ. (2009) Почему антидепрессанты так долго действуют? Когнитивная нейропсихологическая модель действия антидепрессантов. Br J Психиатрия . 195 (2): 102-8
Антидепрессанты работают, но не так, как думали ученые
Большинство клинических испытаний антидепрессантов было проведено несколько десятилетий назад на людях с тяжелой депрессией, набранных в специализированных психиатрических службах.Тем не менее, большинство людей, принимающих эти препараты, страдают депрессией от легкой до умеренной. Мы хотели узнать, работает ли для этой группы обычный антидепрессант сертралин. Мы обнаружили, что это действительно работает, но не так, как мы ожидали.
За последние два десятилетия в богатых странах значительно выросло количество рецептов на антидепрессанты (за последние десять лет этот показатель увеличился вдвое), и это вызвало опасения, что их назначают слишком часто. Подавляющее большинство антидепрессантов назначают врачи общей практики пациентам с легкими или умеренными симптомами тревоги или депрессии, даже если у этих пациентов недостаточно симптомов для клинического диагноза депрессии или тревоги.
Читать далее: Неужели быстрые антидепрессанты так сладки, как звучат?
В нашем новом исследовании, опубликованном в The Lancet Psychiatry, изучалась эффективность сертралина у пациентов первичного звена с симптомами депрессии, от легкой до тяжелой. Мы не устанавливали никаких критериев серьезности, потому что нам нужна была выборка, аналогичная тем, которые получают сейчас антидепрессанты.
Сертралин — это селективный ингибитор обратного захвата серотонина (СИОЗС) — препараты, которые повышают уровень химического вещества, называемого серотонином, в головном мозге — и одно из наиболее часто назначаемых лекарств от депрессии и тревоги.
В нашем исследовании приняли участие более 650 человек в возрасте от 18 до 74 лет из 179 приемных семей в Англии. Все они сообщали своему врачу о симптомах депрессии, таких как плохое настроение, потеря удовольствия, трудности с концентрацией внимания и проблемы со сном, и обращались за лечением. Мы случайным образом разделили пациентов на две группы: они либо получали сертралин в течение 12 недель, либо получали плацебо, идентичное таблетке сертралина.
Ни исследователи, ни пациенты не знали, к какой группе были отнесены люди.Этот тип «двойного слепого исследования» помогает снизить систематическую ошибку. После начала исследования мы собирали данные от участников через регулярные промежутки времени: через две, шесть и 12 недель после того, как они начали исследование.
Затрудненный сон — депрессивный симптом. amenic181 / ShutterstockСнижение беспокойства
Результаты нас удивили. Наша теория заключалась в том, что депрессивные симптомы улучшатся на сертралине к шести неделям, но мы не нашли доказательств того, что это так. Любое влияние на депрессивные симптомы происходило позже, было меньше и менее убедительно.Напротив, сертралин приводил к раннему уменьшению симптомов тревоги за несколько недель до какого-либо улучшения депрессивных симптомов.
Большинство людей с депрессивными симптомами также имеют симптомы тревоги, и для кого-то было бы необычно иметь симптомы депрессии, но не симптомы тревоги. Уменьшая симптомы тревоги, антидепрессант заставлял людей с депрессией чувствовать себя лучше. Те, кто принимал антидепрессант, в два раза чаще говорили, что чувствуют себя лучше, чем те, кто принимал плацебо.Даже если депрессивные симптомы требуют больше времени для ответа, раннее воздействие на тревожность приводит к улучшению качества жизни человека.
Читать далее: Кетамин: болеутоляющее, наркотик для вечеринок и, возможно, антидепрессант следующего поколения
Давно ведутся дискуссии о том, помогают ли антидепрессанты людям с легкими симптомами. В наше исследование были включены люди с широким диапазоном степени тяжести, и мы не обнаружили доказательств того, что эффект антидепрессанта был меньше у пациентов с легкими или умеренными симптомами.Сертралин, кажется, приносит пользу более широкой группе людей, чем считалось ранее. Одно только наше исследование не может исключить возможность того, что сертралин может быть менее эффективным у людей с легкими симптомами, но мы не нашли доказательств этого.
Наши результаты подтверждают длительное назначение сертралина и других подобных антидепрессантов людям с депрессивными симптомами. Как и в случае с любым лекарством, преимущества должны быть сопоставлены с любыми побочными эффектами и возможностью появления симптомов отмены при прекращении приема препарата.
Это исследование проводилось в Великобритании, где существует сильная система первичной медико-санитарной помощи. Но есть сходство между поведением врачей и пациентов во всех богатых странах, независимо от системы здравоохранения. Например, во всех богатых странах увеличилось количество рецептов на антидепрессанты. Мы думаем, что наши выводы применимы и к другим странам.
Антидепрессанты — одно из наиболее часто назначаемых лекарств в мире, но мы все еще развиваем понимание того, как они действуют.В целом это исследование обнадеживает. В среднем люди, получающие антидепрессанты в учреждениях первичной медико-санитарной помощи Великобритании, получают пользу, даже если польза от них больше в отношении симптомов тревоги, чем симптомов депрессии.
Как на самом деле работают антидепрессанты? | Neuroscience
Антидепрессанты; лекарство от депрессии или генерализованной тревоги. Когда вы думаете об этом, это невероятно: у вас может быть изнурительное расстройство настроения, вы примете несколько таблеток и почувствуете себя лучше. Невероятно, что медицинская наука продвинулась настолько далеко, что теперь мы полностью понимаем, как человеческий мозг производит настроение и другие эмоции, поэтому мы можем манипулировать ими с помощью дизайнерских наркотиков.
Верно, это невероятно. Потому что это не так. Тот факт, что антидепрессанты сейчас так распространены, — это в некотором смысле неоднозначное благо. С одной стороны, все, что помогает снизить стигму и позволяет пострадавшим понять, что они не одиноки, может быть только полезным. Депрессия невероятно распространена, поэтому осознание этого может буквально спасти множество жизней.
С другой стороны, знакомство не означает автоматического понимания. В наши дни почти у каждого есть смартфон, но сколько людей, если их подтолкнуть, смогут создать сенсорный экран? Держу пари, не много.То же самое и с депрессией и антидепрессантами. Несмотря на все репортажи и мнения о них, подробности их работы остаются неясными и неуловимыми.
На самом деле, в случае с антидепрессантами, это скорее вопрос , почему они работают, а не как. Большинство антидепрессантов, от самых ранних трициклических ингибиторов и ингибиторов монаминоксидазы до широко распространенных современных селективных ингибиторов обратного захвата серотонина (СИОЗС), работают за счет увеличения уровней определенных нейротрансмиттеров в мозге, обычно предотвращая их расщепление и реабсорбцию в нейронах. , что означает, что они дольше задерживаются в синапсах, вызывая большую активность, таким образом «компенсируя» снижение общих уровней.Антидепрессанты заставляют оставшиеся нейротрансмиттеры работать в два раза активнее, поэтому общая активность, так сказать, более «нормальная».
Но знание того, что это действуют антидепрессанты, на самом деле не объясняет, как они в конечном итоге облегчают депрессию. В каком-то смысле нейротрансмиттеры для мозга — это то же самое, что алфавит для языка; основные элементы гораздо более богатых и сложных конструкций. Таким образом, повышение уровня нейротрансмиттеров по всему мозгу на самом деле не говорит нам ничего конкретного. Это как восстановить классическую картину и сказать, что ей «нужно больше зеленого»; это может быть правдой, но где ? Сколько? Какой оттенок? Это слишком неконкретно, чтобы рассказать нам что-нибудь полезное.
Депрессия настолько плохо изучена, что большинство людей иллюстрируют ее, когда кто-то держит голову руками, как это покажет просмотр любого архива изображений. Это не утяжеляет ваш мозг или что-то в этом роде. Фотография: Nastia11 / Getty Images / iStockphotoНа самом деле антидепрессанты были открыты в основном случайно; Швейцарские ученые, ищущие методы лечения шизофрении в 1950-х годах, обнаружили, что определенное экспериментальное вещество вызывает у их испытуемых эйфорию. И вот, родились антидепрессанты.Здесь нет ничего необычного, за открытиями многих лекарств стоит удача и интуиция. Но это привело к моноаминовой теории депрессии, которая утверждает, что, поскольку большинство антидепрессантов повышают уровень нейротрансмиттеров моноаминового класса, депрессия вызывается истощением моноаминов в мозге.
Кроме того, гипотеза моноаминов все чаще рассматривается как недостаточная. Конечно, это часть происходящего, но не вся история. Во-первых, антидепрессанты практически мгновенно повышают активность нейротрансмиттеров, но для достижения терапевтического эффекта обычно требуются недели.Почему? Это похоже на то, как если бы вы залили пустой бак вашей машины бензином, и он снова начал работать только через месяц; это означает, что отсутствие топлива могло быть проблемой a , но это явно не проблема , а проблема только .
Есть и другие возможные объяснения. Было показано, что нейропластичность, способность образовывать новые связи между нейронами, нарушена у пациентов с депрессией. Теоретически это мешает мозгу «правильно» реагировать на отталкивающие раздражители и стресс. Происходит что-то плохое, и нарушение пластичности означает, что мозг более «фиксирован», как есть, как слишком долго оставленный торт, не позволяющий двигаться дальше, адаптироваться или избежать негативного мышления и, следовательно, депрессии.Антидепрессанты также постепенно увеличивают нейропластичность, поэтому может быть именно поэтому они работают так, как они работают, спустя долгое время после повышения уровня трансмиттера. Это не похоже на заливку топлива в машину, это больше похоже на удобрение растений; требуется время, чтобы полезные элементы были поглощены системой.
Есть и другие возможности. Воспаление, вызывающее чрезмерную нагрузку на мозг, — это одно, гиперактивная передняя поясная кора — другое. По сути, это сложно, и мы пока ничего не можем подтвердить.
По сути, депрессия — это не перелом ноги или простуда. Мы не можем посмотреть на это, сказать «вот в чем дело, прямо здесь» и приступить к исправлению. Психиатрические проблемы никогда не бывают такими простыми (и это без множества совпадений с большим количеством физических недугов). Отчасти проблема в том, что «депрессия» — это скорее универсальный термин для чего-то, что проявляется по-разному. Это расстройство настроения, но его влияние может существенно различаться. Некоторые заканчивают непоколебимым черным отчаянием, другие не испытывают настроения, о котором можно было бы говорить, просто чувствуя себя плоским, пустым и лишенным эмоций.Некоторые (в основном мужчины) постоянно злятся и беспокоятся.
Это одна из причин, почему так трудно установить первопричину. Человеческий мозг — самая сложная вещь, и даже незначительный недостаток или сбой в работе может проявляться различными, неожиданными способами. И нет никаких оснований предполагать, что все случаи депрессии имеют одну и ту же причину. Поэтому неудивительно, что антидепрессанты не работают или даже ухудшают положение многих пациентов. Есть и другие подходы, но они могут не сработать и для вас.Если причины и последствия депрессии значительно различаются от человека к человеку, эффективность лечения будет меняться.
Большинство терапевтических вмешательств также не связаны с кожаными кушетками. Может, это голливудская штука? Фотография: Getty Images / StockbyteАнтидепрессанты также имеют множество потенциальных побочных эффектов, которые сами по себе различаются от человека к человеку. И хотя терапевтические эффекты (которые, по мнению многих, сами по себе завышены или основаны на сомнительных доказательствах), проявляются через несколько недель, то же самое нельзя сказать о неприятных побочных эффектах, как недавно обнаружила Дебора Орр.
Учитывая все это, вы можете задаться вопросом, как вообще антидепрессанты оказались настолько распространенными? Что ж, это может сводиться к тому, что, несмотря на все недостатки и проблемы, которые у них могут быть, они лучше, чем ничего, особенно когда альтернативой является невылеченная депрессия. Некоторые придерживаются более циничной точки зрения, утверждая, что фармацевтические компании получают прибыль, навязывая прибыльные таблетки людям, которые на самом деле в них не нуждаются.
Или, по крайней мере, в Великобритании может быть чем-то заниматься нехватка времени и ресурсов.В идеальном мире люди с депрессией имели бы легкий доступ к КПТ или другим вмешательствам; учитывая, что все пациенты индивидуальны и что для них работает, часто является делом проб и ошибок.


