Сдать кровь на паразиты в организме человека: Анализы на гельминты, цены на платные услуги
Сдать анализ на Паразитарные инвазии в Краснодаре
Определение антител к возбудителям шистосомоза (Schistosoma haemotobium/ mansoni/japonicum) (IgG) , срок исполнения: 7 дней
Записаться
600 ₽
Определение антител класса G (IgG) к токсоплазме (Toxoplasma gondii) в крови , срок исполнения: 1 р.д.
600 ₽
Определение антител классов A, M, G (IgM, IgA, IgG) к лямблиям в крови , срок исполнения: 3 р. д.
д.
Записаться
600 ₽
Токсокара IgG , срок исполнения: 3 р.д.
Записаться
600 ₽
Определение Ig G к Ag трихинелл (T.spiralis) , срок исполнения: 3 р.д.
Записаться
600 ₽
Определение Ig M к Ag трихинелл (T. spiralis) , срок исполнения: 3 р.д.
spiralis) , срок исполнения: 3 р.д.
Записаться
600 ₽
Лямблия IgM , срок исполнения: 3 р.д.
Записаться
600 ₽
Определение антител класса M (IgM) к токсоплазме (Toxoplasma gondii) в крови , срок исполнения: 1 р. д.
д.
Записаться
615 ₽
Определение антител класса G (IgG) к эхинококку однокамерному в крови , срок исполнения: 3 р.д.
Записаться
620 ₽
Определение Ig M к Ag описторхисов (O.felineus) , срок исполнения: 3 р.д.
Записаться
670 ₽
Clonorchis sinensis, IgG (двуустка китайская) , срок исполнения: по вс
Записаться
740 ₽
Определение антител к аскаридам (Ascaris lumbricoides) (IgG) , срок исполнения: 3 р. д.
д.
Записаться
790 ₽
Анизакида IgG , срок исполнения: 3 р.д.
Записаться
855 ₽
Taenia solium, IgG (антитела к цистицеркам свиного цепня, IgG) , срок исполнения: по вс
Записаться
890 ₽
Определение авидности Ig G к токсоплазмам , срок исполнения: 3-4 д.
Записаться
900 ₽
Определение Ig G к Ag описторхисов (O.felineus) , срок исполнения: 3 р.д.
Записаться
900 ₽
Определение антигенов лямблий (Giardia lamblia) в образцах фекалий , срок исполнения: 1-2 р.д.
Записаться
935 ₽
Показать ещё 10
Скачать прайс-лист услуг клиники (PDF)
Продолжая использовать www. clinic23.ru, вы соглашаетесь на использование файлов cookie. Как запретить
использование определенных файлов cookie можно найти в
Политике
clinic23.ru, вы соглашаетесь на использование файлов cookie. Как запретить
использование определенных файлов cookie можно найти в
Политике
Видно ли паразитов на УЗИ брюшной полости? Признаки наличия паразитов в организме, какие методы исследования подходят
Глисты (гельминты) – группа паразитических организмов (червей), которые обитают в человеческом теле и вызывают заболевания и поражение различных органов: печени, желудочно-кишечного тракта и других. Также они могут существовать в частях тел животных, растений.
Заразиться паразитами возможно различными способами:
- При непосредственном контакте с зараженным человеком или животным
- Из-за употребления зараженных продуктов – плохо обработанное мясо, птица, рыба
- Через воду, почву, песок (в том числе во время плавания в открытом водоеме)
- Укусы насекомых (кроме тех, кто таким методом откладывает собственные личинки)
Дети подвержены риску заражения гораздо сильнее, чем взрослые, за счет более слабого иммунитета.
Признаки наличия паразитов в организме
Симптомы заражения гельминтами бывают двух видов: видимые и скрытые.
Первая группа состоит из таких явлений:
- Зуд и жжение в области заднего прохода
- Потеря веса, которая не сопровождается очевидными причинами
- Анемия, слабость
- Постоянная усталость
Вторая же представляет собой обострение ряда иных заболеваний:
- Инфекция – гайморит, стоматит и иные
- Обострение хронических недомоганий
- Признаки аллергии – зуд, высыпания, ринит
- При появлении кишечных паразитов проявляется расстройство желудочно-кишечного тракта – рвота, боли в области живота, понос или запор
- Интоксикация и сопутствующее ей ослабление организма – головокружения, тошнота, мигрень, угнетение нервной системы
Можно ли увидеть гельминтов на УЗИ?
Ультразвуковое исследование – анализ при помощи воздействия звуковых волн высокой частоты, которые испускаются датчиком. Его действие основано на том, что ткани человеческих органов имеют отличную друг от друга структуру и поэтому по-разному отражают такие волны. Результаты отображаются на мониторе врача-диагноста в реальном времени.
Его действие основано на том, что ткани человеческих органов имеют отличную друг от друга структуру и поэтому по-разному отражают такие волны. Результаты отображаются на мониторе врача-диагноста в реальном времени.
Это одно из самых безопасных обследований, которое можно проводить очень часто.
УЗИ брюшной полости позволяет обнаружить паразитов, а также изменения органов, которые эти существа провоцируют. Некоторые виды гельминтов отображаются сами по себе. В иных случаях их можно обнаружить по относительным признакам, которые ультразвук помогает выявить в качестве патологических изменений в органах.
Это могут быть образования или воспаления в печени, поджелудочной железе, желчном пузыре и даже легких и мозге человека.
В отличие от иных способов, данный метод позволяет обнаружить паразитов и в тех случаях, когда они находятся не в желудочно-кишечном тракте. Если ранее наличие глистов уже было установлено, УЗИ можно использовать для нахождения мест их локализации, а также определить обширность поражения.
Какие органы обследуют при подозрении на гельминтов
При обследовании пациента при помощи УЗИ брюшной полости можно обнаружить глистов или результаты их жизнедеятельности. Они располагаются в таких органах, как:
- Печень
- Желчный пузырь и протоки
- Поджелудочная железа
- Желудочно-кишечный тракт
При наличии предпосылок стоит осмотреть при помощи ультразвука и иные органы:
- Мышцы
- Легкие
- Мозг
УЗИ помогает определить структуру вышеперечисленных органов, их однородность, наличие или отсутствие в них новообразований, кист и иных нарушений, а также патологическое увеличение или уменьшение их размеров. При появлении симптомов различных заболеваний данный анализ способствует уточнению клинической картины и более точной постановке диагноза и выяснению причин патологического состояния органов.
Признаки паразитов на ультразвуковой сонограмме
При обследовании организма при помощи УЗИ брюшной полости на наличие глистов врач обращает внимание на следующие изменения в строении органов:
- Увеличение печени – оно может стать свидетельством поражения паразитами, которые могут спровоцировать проявление ранее не диагностированного или обострение уже обнаруженного гепатита
- Проблемы в функционировании желчного пузыря и его протоков
- Наличие плотных, воспаленных кист
- Различного рода уплотнения и узлы в поджелудочной железе
Некоторые признаки поражения могут быть найдены и в виде проблем с иными органами:
- Поражение и воспаление легких
- Нарушения в работе мозга
Какие еще методы исследования следует применять?
Часто на УЗИ брюшной полости отображаются не сами паразиты, а признаки их наличия и жизнедеятельности. Поэтому необходимо провести комплекс анализов, не ограничиваясь только ультразвуком.
Поэтому необходимо провести комплекс анализов, не ограничиваясь только ультразвуком.
В группу обследований при подозрении на гельминтов входят:
- Анализ кала на содержание данных организмов и их яиц
- Забор крови на степень содержания эозинофилов – тип лейкоцитов, который убивает чужеродные белки
- Исследование мочи
- Анализ содержимого кишечника
- Исследование желчного пузыря
- Осмотр мышечной ткани
- Состав отделяющейся мокроты из бронхов и легких
- Компьютерная томография – используют и при поиске паразитов в головном мозге, легких, глазах
- Эндоскопия – с ее помощью можно обнаружить паразитов в кишечнике и желудке
- Рентген – чаще всего необходим при диагностике гельминтов в легких, так как в этом органе они наиболее отчетливо видны на результатах лучевой диагностики
Для постановки наиболее точного диагноза врачи рекомендуют использовать не только УЗИ, но и иные методы. Важнее всего, чтобы больной не занимался самолечением, а вовремя обратился к профессионалам, чтобы не навредить самому себе.
Важнее всего, чтобы больной не занимался самолечением, а вовремя обратился к профессионалам, чтобы не навредить самому себе.
Преимущества проведения процедуры в МЕДСИ
- Сеть клиник МЕДСИ проводит УЗИ брюшной полости для диагностики паразитов в 20-ти отделениях по всей Москве
- Опытные врачи проводят полный комплекс процедур для постановки наиболее точного диагноза и назначения корректного лечения обнаруженных заболеваний
- Для записи на прием существует «горячая линия» (по бесплатному телефону 8 (495) 7-800-500)
- В распоряжении персонала клиник современное оборудование для УЗИ и иных исследований, что повышает качество получаемых результатов и точность диагноза
Не затягивайте с лечением, обратитесь к врачу прямо сейчас:
- УЗИ
- Лечение грыжи живота
- Лечение гастроэзофагеального рефлюкса
Анализ на глисты у детей — сдать кровь / мочу на наличие яиц глист в СПб
Анализ на гельминтозы – лабораторное исследование с целью выявления в организме ребенка глистной инвазии. Его часто называют анализом на яйца глистов, в этом случае для исследования берется кал и соскоб на энтеробиоз. Для иммуноферментного анализа на глисты у детей проводится забор крови.
Его часто называют анализом на яйца глистов, в этом случае для исследования берется кал и соскоб на энтеробиоз. Для иммуноферментного анализа на глисты у детей проводится забор крови.
Общие сведения о гельминтозах
Гельминтозы – общее название группы глистных заболеваний, вызывающихся паразитическими червями. У людей патология чаще вызывается круглыми и плоскими гельминтами, значительно реже – колючеголовыми и кольчатыми. В организме человека способны обитать около 250 видов паразитов, наиболее часто встречаются 50 из них. Согласно статистике, в среднем по России заболеваемость гельминтозами составляет 1-2 %, в некоторых регионах она доходит до 10 %.
К круглым червям относятся нематоды, основные представители которых – аскариды, острицы, трихинеллы, власоглав. Плоских паразитов – сосальщиков и ленточных червей – представляют кошачья и печеночная двуустки, эхинококки, широкий лентец, бычий и свиной цепень.
Симптоматика гельминтозов
В острую стадию глистной инвазии пациенты жалуются на боли в животе, диспепсические явления (тошнота, отрыжка, рвота), повышение температуры, сыпь, увеличение лимфатических узлов. Возможно появление сухого кашля, одышки, увеличение печени. Для болезни характерны апатия, нарушение сна, раздражительность.
Возможно появление сухого кашля, одышки, увеличение печени. Для болезни характерны апатия, нарушение сна, раздражительность.
В хронический период заболевания симптомы обусловлены местом локализации гельминтов. Возможны тяжелые последствия, вплоть до язвенного поражения желудка, массивных кровотечений, кишечной непроходимости, пневмонии, поражений сердечной мышцы. Практически всегда развивается тяжелая анемия.
Осложнения заболевания
Опасность гельминтозов в том, что они способны поражать весь организм, в том числе и жизненно важные органы – сердце, легкие, головной мозг. Паразитируя, размножаясь и развиваясь в организме человека, гельминты выделяют токсины, оказывающие сенсибилизирующее действие. Вследствие этого возникают различные аллергические реакции, ухудшается течение сопутствующих заболеваний, появляется хроническая анемия. Для детей глистные инвазии особенно опасны, так как способствуя снижению аппетита и ухудшению процессов всасывания в кишечнике, они замедляют рост и развитие организма, как физическое, так и умственное.
Гельминтозы снижают эффективность профилактической вакцинации, в результате чего уменьшается уровень иммунитета. Основные вакцины вводятся именно в детском возрасте, поэтому очень важно следить за тем, чтобы ребенок не инфицировался гельминтами, и его организм был в состоянии выработать необходимую защиту от заболеваний.
Анализы для выявления глистов у детей
Для анализа на гельминтозы забирается кал, соскоб на энтеробиоз, кровь.
При исследовании кала определяется наличие яиц гельминтов, частей или отдельных глистов в разных стадиях развития, находящихся преимущественно в нижнем отделе кишечника.
Соскоб на энтеробиоз определяет наличие остриц (аскарид) – наиболее распространенных гельминтов.
Анализ крови позволяет с более высокой точностью выявить присутствие в организме паразитов. Общий анализ крови показывает воспалительные процессы, анемии, вызванные гельминтами, иммуноферментный анализ (ИФА) – присутствие антител к паразитам и их титр.
Показания к исследованию
Анализ кала и соскоб на энтеробиоз назначаются при профилактических осмотрах – при поступлении в детский сад, школу, перед поездками в лагеря, плановой госпитализацией.
Показаниями к более тщательному обследованию, включающему анализы крови, служат имеющиеся симптомы гельминтозов. Это:
- повышенная возбудимость, раздражительность, бессонница;
- кожный зуд, сыпь, другие аллергические проявления;
- снижение аппетита, уменьшение веса;
- анемия, ломкость волос и ногтей;
- зуд в области анального отверстия.
Подготовка к исследованию
Для того чтобы правильно сдать анализ кала на яйца глистов, за несколько дней до исследования из меню ребенка следует исключить свиную и говяжью печень, грибы, маринованные продукты, газированные напитки, большое количество овощей и фруктов. При приеме антибиотиков, лекарств, изменяющих перистальтику кишечника или цвет кала, анализ следует сдавать через неделю после отмены препарата. Вечером, накануне сбора кала для исследования, нужно выпить достаточное количество негазированной воды, можно принять теплую ванну, сделать круговой массаж живота ребенку.
Кал для исследования собирается во время утренней дефекации, перед этим не следует подмываться, вводить слабительные или лечебные свечи. Можно взять кал после вечерней дефекации, до доставки в лабораторию его нужно хранить в холодильнике. Для корректного анализа необходимо собирать кал из трех разных точек одноразовой пластиковой ложкой в специальный контейнер, примерно на 1/3 его объема. Если в фекалиях визуально наблюдаются гельминты или их яйца, необходимо поместить их в контейнер с калом.
Для подготовки к анализу крови на глистов детям на грудном вскармливании желательно не принимать пищу в течение 30-40 минут до забора крови, детям от 1 года до 5 лет – в течение 2-3 часов, старше 5 лет – в течение 8 часов. Можно пить негазированную воду. В течение суток перед исследованием нельзя принимать лекарства. Если они необходимы, следует согласовать этот вопрос с лечащим врачом. Общий анализ крови берется из пальца или из вены, для ИФА необходима венозная кровь.
Для подготовки к соскобу на энтеробиоз нужно исключить прием слабительных препаратов, введение свечей накануне исследования. Утром не следует проводить гигиенические процедуры. Соскоб производится путем снятия мазка-отпечатка с перианальных складок.
Утром не следует проводить гигиенические процедуры. Соскоб производится путем снятия мазка-отпечатка с перианальных складок.
Интерпретация анализов
Обработкой анализов кала и крови на глистов как у детей, так и у взрослых пациентов, занимаются сотрудники клинических лабораторий – лаборанты, врачи лабораторной диагностики. Кал, соскоб на энтеробиоз, общий анализ крови исследуются в общеклинических лабораториях, кровь на ИФА – в биохимической или специализированной лаборатории. Результаты анализов передаются назначившему их врачу – педиатру, терапевту, инфекционисту, или непосредственно пациенту.
В результатах анализа кала и соскоба указывается, обнаружены или не обнаружены гельминты. В общем анализе крови следует обращать внимание на количество эозинофилов, уровень гемоглобина. В результатах иммуноферментного анализа указывается концентрация антител JgA, JgG, JgM в пробе – отрицательная, сомнительная или положительная, также может обозначаться знаками +, -, +/-.
Проводить расшифровку результатов анализов, ставить диагноз и назначать лечение должен врач.
Сдать анализы для выявления глистов у детей можно в «СМ-Клиника». В Санкт-Петербурге имеется пять отделений клиники, в каждом из которых есть центр лабораторной диагностики, работающий ежедневно, без выходных и праздников. Лаборатории центра оснащены современным оборудованием, в них работают высококвалифицированные специалисты, поэтому «СМ-Клиника» гарантирует качество, точность и оперативность в обработке и оформлении результатов самых разнообразных анализов. Пациенты могут получить результаты анализов удобным способом – в регистратуре клиники или по электронной почте.
Наши клиники в Санкт-Петербурге
Малая Балканская, д. 23
(м. Купчино)
Часы работы:
Ежедневно
с 8.00 до 22.00
Дунайский проспект, д. 47
(м. Дунайская)
Часы работы:
Ежедневно
с 9.00 до 22.00
Проспект Ударников, д. 19 корп.1
(м. Ладожская)
Часы работы:
Ежедневно
с 9.00 до 22.00
Выборгское ш., д. 17
(м. Пр‑т Просвещения)
Пр‑т Просвещения)
Часы работы:
Ежедневно
с 9.00 до 22.00
Маршала Захарова, д. 20
(м. Ленинский проспект)
Часы работы:
Ежедневно
с 9.00 до 22.00
Записаться на прием
Запись через сайт является предварительной.
Наш сотрудник свяжется с вами для подтверждения записи к специалисту.
Указать время
Время9:009:3010:0010:3011:0011:3012:0012:3013:0013:3014:0014:3015:0015:3016:0016:3017:0017:3018:0018:3019:0019:3020:0020:3021:0021:30
Указать специалиста
Cпециалист— не знаю —ПедиатрНеонатологДетский аллергологДетский гастроэнтерологДетский гинекологДетский дерматологДетский иммунологДетский кардиологДетский логопедДетский ЛОРДетский неврологДетский нефрологДетский онкологДетский ортопедДетский офтальмологДетский проктологДетский пульмонологДетский ревматологДетский урологДетский эндокринологДетский эндоскопистДетский хирург
Подробнее о гарантии качества медицинских услуг
Обеспечение безопасности переливаний крови от паразитов крови
В США донорство крови считается безопасным, а заражение инфекциями при переливании крови встречается редко. Тщательный скрининг потенциальных доноров с помощью анкетирования и тестирования донорской крови на различные микробы защищает запасы крови. В новом отчете рассматривалось количество инфекций, распространяемых при переливании крови, и было обнаружено, что, хотя такие инфекции встречаются редко, паразит Babesia является одной из наиболее распространенных причин возникновения инфекций.
Тщательный скрининг потенциальных доноров с помощью анкетирования и тестирования донорской крови на различные микробы защищает запасы крови. В новом отчете рассматривалось количество инфекций, распространяемых при переливании крови, и было обнаружено, что, хотя такие инфекции встречаются редко, паразит Babesia является одной из наиболее распространенных причин возникновения инфекций.
По данным Центров по контролю и профилактике заболеваний (CDC), Инфекция Babesia , также называемая бабезиозом, чаще всего распространяется через укусы определенных клещей — тех же клещей, которые переносят болезнь Лайма. Клещи наиболее распространены на северо-востоке и среднем западе США, а также весной и летом. Менее распространенные способы заражения бабезиозом включают передачу через переливание крови и от матери ребенку во время беременности и родов.
Не все заражены 9У паразита 0003 Babesia развиваются симптомы, но у некоторых людей могут быть неспецифические гриппоподобные симптомы, такие как лихорадка, озноб, потливость, головная боль, ломота в теле, потеря аппетита, тошнота и утомляемость. Паразиты заражают эритроциты и могут вызвать их разрыв. У некоторых людей это может привести к серьезному состоянию, называемому гемолитической анемией (от разрушения эритроцитов). Бабезиоз может быть опасен для жизни, особенно у людей, которые:
Паразиты заражают эритроциты и могут вызвать их разрыв. У некоторых людей это может привести к серьезному состоянию, называемому гемолитической анемией (от разрушения эритроцитов). Бабезиоз может быть опасен для жизни, особенно у людей, которые:
- Не имеют селезенки (селезенка помогает очистить кровь от инфицированных эритроцитов)
- Имеют слабую иммунную систему, например, из-за ВИЧ/СПИДа или рака
- Имеют другие серьезные заболевания, такие как заболевания печени или почек
- старше 50 лет
Новый отчет об инфекциях, связанных с переливанием крови, был опубликован в январе в журнале Transfusion Medical Reviews . Он основан на данных Национальной сети безопасности здравоохранения (NHSN), программы CDC. Согласно отчету, в период с 2010 по 2016 год (последний год, за который имеются данные) было перелито 7,9 млн единиц компонентов крови (например, эритроцитов, тромбоцитов). За это время было зарегистрировано в общей сложности 111 подозреваемых случаев заражения в результате переливания крови, 54 из которых были подтверждены в результате тестирования. Из них 30% были связаны с Babesia , единственный зарегистрированный паразит. В целом, на каждые 147 000 перелитых компонентов крови приходилось примерно 1 инфекция.
Из них 30% были связаны с Babesia , единственный зарегистрированный паразит. В целом, на каждые 147 000 перелитых компонентов крови приходилось примерно 1 инфекция.
Несмотря на то, что гемотрансфузионные инфекции встречаются редко, эти инфекции могут быть серьезными и смертельными. Принятие мер, снижающих риск таких инфекций, включая бабезиоз, может снизить заболеваемость и смертность среди реципиентов переливания крови.
В настоящее время потенциальных доноров крови спрашивают о возможной инфекции Babesia в анкете, которую они заполняют перед сдачей крови. Лицам, у которых была подтвержденная или подозреваемая инфекция, не разрешается повторно сдавать кровь (отложено на неопределенный срок, если в будущем не изменятся правила). Однако в отчете отмечается, что, поскольку у многих людей симптомы от укуса клеща не проявляются, они могут не знать, инфицированы ли они.
6 марта 2018 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) одобрило первые два теста для скрининга доноров крови, а также доноров органов и тканей на инфекцию Babesia . В пресс-релизе того времени Питер Маркс, доктор медицинских наук, директор Центра оценки и исследований биологических препаратов FDA, отметил, что «хотя бабезиоз можно как предотвратить, так и вылечить, до сегодняшнего дня не было возможности провести скрининг на инфекций среди доноров крови».
В пресс-релизе того времени Питер Маркс, доктор медицинских наук, директор Центра оценки и исследований биологических препаратов FDA, отметил, что «хотя бабезиоз можно как предотвратить, так и вылечить, до сегодняшнего дня не было возможности провести скрининг на инфекций среди доноров крови».
После этого в июле 2018 года FDA выпустило проект руководства по тестированию донорской крови на бабезиоз. Среди рекомендаций:
- Тестирование каждой донорской крови с использованием недавно утвержденных тестов в четырнадцати штатах и Вашингтоне, округ Колумбия, где наиболее вероятна инфекция Babesia (т. , Род-Айленд, Вермонт, Вирджиния, Висконсин). Тестирование должно проводиться круглый год.
- Людям с положительным результатом теста не разрешается сдавать кровь в течение как минимум двух лет.
- Разрешение донорам с бабезиозом в анамнезе сдавать кровь, если тестирование показывает, что в настоящее время у них нет инфекции.
- В штатах, где доноров не тестируют, потенциальных доноров необходимо спрашивать как о бабезиозе в анамнезе, так и о положительном результате теста (либо при диагностическом тестировании, либо при скрининге доноров в штате, где проводится тестирование).
 Людям с инфекцией в анамнезе не разрешается сдавать кровь, если правила не изменятся.
Людям с инфекцией в анамнезе не разрешается сдавать кровь, если правила не изменятся.
Организации и центры донорства крови, включая AABB, Американский Красный Крест и Американские центры крови, прислали комментарии к проекту руководства. Среди их комментариев есть рекомендация о том, что людям с положительным тестом на бабезиоз запрещается сдавать кровь на более короткий период, чем рекомендовано в проекте руководства (отсрочка на один год по сравнению с двумя годами).
Дата публикации окончательной версии руководства в настоящее время неизвестна. До тех пор FDA понимает, что некоторые учреждения по сдаче крови будут проводить тестирование на бабезиоз, и им рекомендуется уведомить FDA об изменениях в их процедурах для предотвращения распространения бабезиоза.
Связанный контент
На этом сайте
В другом месте в Интернете
- AABB: бабезиоз
Просмотр источников
, 28 сентября 2018 г. Письмо RE «Рекомендации по снижению риска трансфузионно-трансмиссивного бабезиоза», проект руководства, 27 июля. Доступно на сайте http://www.aabb.org/advocacy/comments/Documents/comments1809.28.pdf. По состоянию на 22 февраля 2019 г.
Письмо RE «Рекомендации по снижению риска трансфузионно-трансмиссивного бабезиоза», проект руководства, 27 июля. Доступно на сайте http://www.aabb.org/advocacy/comments/Documents/comments1809.28.pdf. По состоянию на 22 февраля 2019 г.
17 мая 2018 г. Паразиты-бабезиоз. Центры по контролю и профилактике заболеваний. Доступно в Интернете по адресу https://www.cdc.gov/parasites/babesiosis/index.html. По состоянию на 22 февраля 2019 г.
, июль 2018 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов. Рекомендации по снижению риска трансфузионного бабезиоза. Проект руководства для промышленности. Доступно на сайте https://www.fda.gov/downloads/BiologicsBloodVaccines/GuidanceComplianceRegulatoryInformation/Guidances/Blood/UCM614734.pd. По состоянию на 22 февраля 2019 г..
6 марта 2018 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило первые тесты для выявления паразитов, переносимых клещами, в цельной крови и плазме для защиты системы кровоснабжения США. Доступно на сайте https://www.fda.gov/newsevents/newsroom/pressannouncements/ucm599782.htm. По состоянию на 22 февраля 2019 г.
Доступно на сайте https://www.fda.gov/newsevents/newsroom/pressannouncements/ucm599782.htm. По состоянию на 22 февраля 2019 г.
Haass K, et.al. Инфекции, передающиеся при переливании крови, зарегистрированы в модуле надзора за безопасностью Национальной сети здравоохранения (25 января 2019 г.). Доступно в Интернете по адресу https://www.sciencedirect.com/science/article/pii/S088779.6318301044. По состоянию на 25 февраля 2019 г.
(30 января 2019 г.) Бабезии и бактериальное заражение. Наиболее частые инфекции, передающиеся при переливании крови. Новости переливания. Доступно в Интернете по адресу https://transfusionnews.com/2019/01/30/babesia-and-bacterial-contamination-most-frequent-transfusion-transmitted-infections/. По состоянию на 25 февраля 2019 г.
Трансфузионно-трансмиссивные паразитарные инфекции — PMC
Asian J Transfus Sci. 2010 июль; 4(2): 73–77.
doi: 10.4103/0973-6247.67018
Информация об авторе Информация об авторских правах и лицензии Отказ от ответственности
Передача паразитарных организмов при переливании крови происходит относительно редко. Из основных трансфузионно-трансмиссивных заболеваний малярия является основной причиной ТТИП в тропических странах, тогда как бабезиоз и болезнь Шагаса представляют наибольшую угрозу для доноров в США. В обоих случаях это связано с увеличением числа потенциально инфицированных доноров. Не существует надежных серологических тестов для скрининга доноров на любой из этих организмов, и основное внимание в профилактике по-прежнему уделяется соблюдению руководящих принципов скрининга доноров, которые учитывают историю поездок и предшествующую инфекцию этиологическим агентом. Одной из целей является разработка тестов, способных выявлять и выявлять доноров, потенциально заразных паразитарными инфекциями, без отсрочки приема большого числа неинфекционных доноров или значительного увеличения затрат. В идеале, методы инактивации инфекционного организма должны обеспечить дополнительную безопасность системы кровоснабжения.
Из основных трансфузионно-трансмиссивных заболеваний малярия является основной причиной ТТИП в тропических странах, тогда как бабезиоз и болезнь Шагаса представляют наибольшую угрозу для доноров в США. В обоих случаях это связано с увеличением числа потенциально инфицированных доноров. Не существует надежных серологических тестов для скрининга доноров на любой из этих организмов, и основное внимание в профилактике по-прежнему уделяется соблюдению руководящих принципов скрининга доноров, которые учитывают историю поездок и предшествующую инфекцию этиологическим агентом. Одной из целей является разработка тестов, способных выявлять и выявлять доноров, потенциально заразных паразитарными инфекциями, без отсрочки приема большого числа неинфекционных доноров или значительного увеличения затрат. В идеале, методы инактивации инфекционного организма должны обеспечить дополнительную безопасность системы кровоснабжения.
Ключевые слова: Паразиты, трансфузионные, передаваемые
Хотя заболеваемость паразитарными инфекциями, передаваемыми при переливании крови (TTPI), ниже по сравнению с бактериальными и вирусными инфекциями, эти микроорганизмы представляют значительный риск заболевания, особенно у людей с ослабленным иммунитетом. лица. Как мы знаем, бактериальное заражение может произойти во многих точках во время сбора и процесса переливания, но TTPI всегда получают от донора. Наиболее распространенными паразитарными организмами, вызывающими гемотрансфузионные инфекции, являются Plasmodium spp., Trypanosoma cruzi , Babesia microti , Toxoplasma gondii , Leishmania spp. и т. д. Чтобы передаваться при переливании крови, паразиты должны: (i) циркулировать в кровотоке доноров, (ii) обладать определенными физическими характеристиками и сопротивляться этапам обработки, ведущим к получению лабильных продуктов крови (эритроцитарной массы, терапевтических замороженная плазма или концентраты тромбоцитов), (iii) выдерживают консервацию; кроме того, чтобы вызвать инфекцию в приемнике крови, такие паразиты должны сохранять заразность. В этом обзоре обсуждаются этиологические агенты, эпидемиология и методы диагностики, связанные с трансфузионной передачей паразитарных инфекций.
лица. Как мы знаем, бактериальное заражение может произойти во многих точках во время сбора и процесса переливания, но TTPI всегда получают от донора. Наиболее распространенными паразитарными организмами, вызывающими гемотрансфузионные инфекции, являются Plasmodium spp., Trypanosoma cruzi , Babesia microti , Toxoplasma gondii , Leishmania spp. и т. д. Чтобы передаваться при переливании крови, паразиты должны: (i) циркулировать в кровотоке доноров, (ii) обладать определенными физическими характеристиками и сопротивляться этапам обработки, ведущим к получению лабильных продуктов крови (эритроцитарной массы, терапевтических замороженная плазма или концентраты тромбоцитов), (iii) выдерживают консервацию; кроме того, чтобы вызвать инфекцию в приемнике крови, такие паразиты должны сохранять заразность. В этом обзоре обсуждаются этиологические агенты, эпидемиология и методы диагностики, связанные с трансфузионной передачей паразитарных инфекций.
Первый случай гемотрансмиссивной малярии (ТТМ) был зарегистрирован в 1911 году. Обзор мировых данных, зарегистрированных Брюсом-Чваттом с 1911 по 1979 год [2], показал, что зарегистрированная заболеваемость ТТМ увеличилась с 6 до 145 случаев в год. В первые годы наиболее часто упоминаемым видом был P. vivax , но к 1950-м годам преобладал P. malariae , за которым следовали P. vivax , P. falciparum , смешанные инфекции и P. ovale . . В 1970-х годов, P. vivax снова был наиболее распространенным, за ним следовали P. malaria и P. falciparum , причем доля последнего значительно увеличилась. [3,4] В США до 1986 г. было больше случаев P. vivax , чем P. falciparum , но с тех пор P. falciparum стал единственным наиболее распространенным завозным видом. Действительно, общее количество 90 003 P. falciparum 90 004 в настоящее время превышает общее количество трех других видов вместе взятых. В 2004 г. 74% завозной малярии было вызвано P. falciparum . Цифры по завозной малярии с 1985 по 1995 г., представленные другими европейскими центрами, также показывают, что значительная часть случаев была вызвана P. falciparum – 82,2% во Франции и 59,4% в Италии по сравнению с 38,5% в США за тот же период.[5] ]
В 2004 г. 74% завозной малярии было вызвано P. falciparum . Цифры по завозной малярии с 1985 по 1995 г., представленные другими европейскими центрами, также показывают, что значительная часть случаев была вызвана P. falciparum – 82,2% во Франции и 59,4% в Италии по сравнению с 38,5% в США за тот же период.[5] ]
Сообщается, что передача малярии происходит в основном через продукты одного донора: эритроциты, тромбоциты или концентраты лейкоцитов (из-за контаминации остаточными эритроцитами), криопреципитат и замороженные эритроциты после оттаивания и промывания. О передаче инфекции через свежезамороженную плазму одного донора не сообщалось. Передача от криопреципитата происходит редко и, вероятно, отражает метод приготовления и степень бесклеточности исходной плазмы.[6] Есть два основных аспекта, которые следует учитывать при рассмотрении риска малярии и переливания крови: во-первых, риск малярии, связанный с любым отдельным донором, и, во-вторых, способность систем идентифицировать и управлять донором и любым донорством. Именно здесь существуют принципиально разные подходы, применяемые различными службами переливания крови: различия в общих подходах, применяемых между эндемичными и неэндемичными странами, и различия в подходах, применяемых между отдельными неэндемичными странами.
Именно здесь существуют принципиально разные подходы, применяемые различными службами переливания крови: различия в общих подходах, применяемых между эндемичными и неэндемичными странами, и различия в подходах, применяемых между отдельными неэндемичными странами.
В эндемичных районах очень сложно отличить случаи ТТМ от естественных инфекций, поскольку малярия, возникающая после трансфузии, может быть результатом естественного заражения через укус комара, а не в результате переливания крови. Кроме того, в эндемичных районах многие доноры и пациенты уже инфицированы малярией или подвергаются высокому риску заражения малярией. Выявить лиц с низким уровнем риска практически невозможно. Один из подходов заключается в использовании окрашенных по Гимзе толстых мазков или экспресс-тестов (ДЭТ) на малярийный антиген для выявления доноров с более высоким уровнем паразитемии. Однако ясно, что этот подход определяет только долю лиц с паразитемией выше предела обнаружения для этих методов. Однако он не предотвращает передачу от порций крови со слишком низкой паразитемией, чтобы ее можно было обнаружить с помощью микроскопии или ДЭТ. Существуют дополнительные стратегии, которые могут быть реализованы. Например, разделение пожертвований, собранных из районов с низким и высоким уровнем риска, с особым целевым распределением пожертвований от групп доноров с низким уровнем риска к получателям с низким уровнем риска и наиболее уязвимым. В некоторых районах также проводится рутинное противомалярийное лечение реципиентов крови. Такие стратегии представляют собой прагматические подходы, которые не являются абсолютными по своей эффективности, но могут помочь снизить риск ТТМ в таких ситуациях.[7]
Однако он не предотвращает передачу от порций крови со слишком низкой паразитемией, чтобы ее можно было обнаружить с помощью микроскопии или ДЭТ. Существуют дополнительные стратегии, которые могут быть реализованы. Например, разделение пожертвований, собранных из районов с низким и высоким уровнем риска, с особым целевым распределением пожертвований от групп доноров с низким уровнем риска к получателям с низким уровнем риска и наиболее уязвимым. В некоторых районах также проводится рутинное противомалярийное лечение реципиентов крови. Такие стратегии представляют собой прагматические подходы, которые не являются абсолютными по своей эффективности, но могут помочь снизить риск ТТМ в таких ситуациях.[7]
Однако в неэндемичных странах общее число лиц с малярийным риском составляет лишь небольшую долю от общего числа доноров, число этих доноров является кумулятивным, поскольку из года в год доноры либо посещают малярийные районы впервые или лица, родом из малярийных районов, впервые присутствующие в качестве доноров.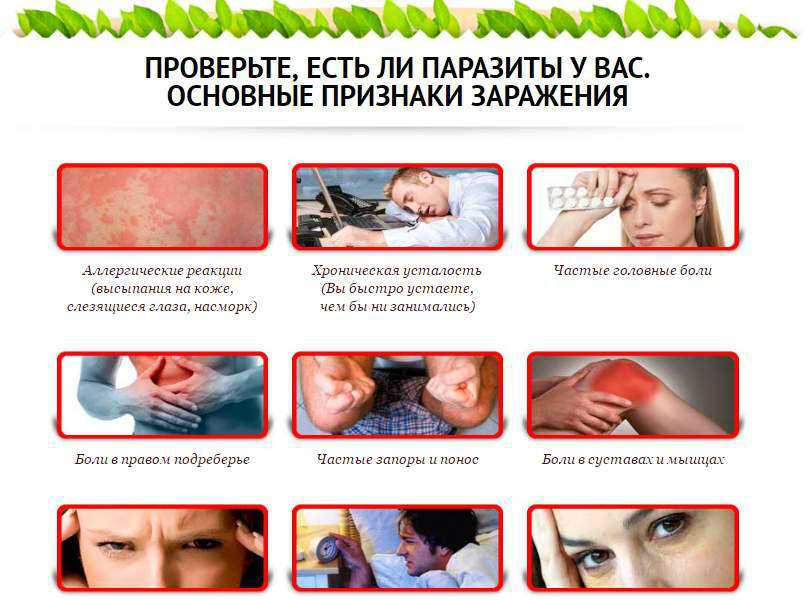 Таким образом, существует большая зависимость от соответствующих руководящих принципов отсрочки доноров, а также от точности и ясности информации, полученной от доноров об их поездках и любом последующем риске малярии.
Таким образом, существует большая зависимость от соответствующих руководящих принципов отсрочки доноров, а также от точности и ясности информации, полученной от доноров об их поездках и любом последующем риске малярии.
Плазмодиальная инфекция, которая может быть вызвана «малярийными» паразитами после трансфузии, может, таким образом, быть либо свободными мерозоитами, внутриэритроцитарными формами паразитов, либо гаметоцитами, причем первые два являются инфекционными, но не последние.[6] Важно отметить, что эти инфекционные стадии паразита находятся в контакте с эритроцитами хозяина, пока этот хозяин не был «подготовлен» рядом более или менее эффективных иммунных событий. Затем может возникнуть очень слабое противодействие или его отсутствие, вызывающее быстрое размножение инфицированных эритроцитов (iRBC), ответственных за заболеваемость и часто смертность от осложнений, таких как недостаточность органов, а не от острой анемии. [8] Каждому из этих шагов, даже быстрому, можно противодействовать врожденными иммунными событиями, которые начались после заражения хозяина.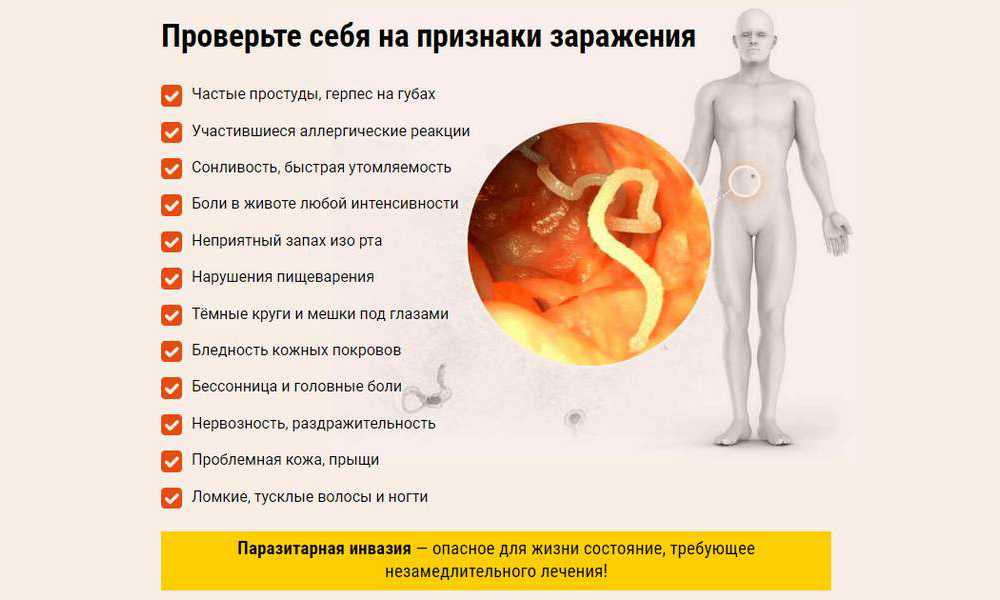
Помимо скрининга доноров, другие варианты выявления инфицированных доноров включают использование тестов, в первую очередь предназначенных для обнаружения паразитов у лиц с симптомами, или скрининговых тестов на антитела. Тесты на обнаружение паразитов включают толстые/тонкие мазки крови, методы флуоресцентного окрашивания, тесты на циркулирующий малярийный антиген или полимеразную цепную реакцию (ПЦР) для обнаружения малярийной ДНК.[9–12] Исследование толстых мазков крови экономически неэффективно для скрининг большого количества доноров, и при этом он недостаточно чувствителен (предел обнаружения составляет примерно десять организмов/мкл) для выявления низких уровней паразитемии, которые могут существовать у доноров. Менее 50% доноров, вовлеченных в исследования, имели положительные мазки, что, вероятно, связано с низким уровнем циркулирующих паразитов. Флуоресцентные красители, такие как акридиновый оранжевый, который окрашивает нуклеиновые кислоты, также можно использовать для исследования толстой пленки на наличие паразитов или в системах, в которых используются капиллярные трубки, заполненные кровью, например. количественный метод лейкоцитарной пленки (QBC) [11].
количественный метод лейкоцитарной пленки (QBC) [11].
В последнее время все шире используются иммунохроматографические тест-полоски для быстрого скрининга/диагностики острой малярии в эндемичных районах. Эти тесты, в которых используются моноклональные антитела, закрепленные на нитроцеллюлозных полосках, обнаруживают циркулирующий антиген P. falciparum , богатый гистидином белок 2 (HRP-2), или лактатдегидрогеназу Plasmodium (pLDH). Уровень обнаружения, необходимый в острых случаях, составляет примерно 500 паразитов/мкл, что может превышать уровень циркулирующих паразитов у бессимптомного донора крови.[13]
С другой стороны, серологические тесты выявляют лиц с положительными антителами, но не указывают на паразитемию, поскольку уровни антител могут оставаться повышенными до 10 лет после заражения. В целом, при использовании в популяции доноров с низкой распространенностью малярии тесты на антитела имеют плохую положительную прогностическую ценность. Однако лаборатории во Франции используют метод непрямых флуоресцентных антител (IFA) для обнаружения антител к Plasmodium sp. у доноров из группы риска. С момента проведения теста в 19 году не было зарегистрировано ни одного случая гемотрансмиссивной малярии.94. [14] Одно исследование, оценивающее тест иммуноферментного анализа (ELISA), в котором использовался антиген P. falciparum , показало, что тест может быть недостаточно чувствительным и специфичным для скрининга антител у доноров из группы риска, история болезни которых указывает на то, что они могли подвергаться воздействию. к малярии.
у доноров из группы риска. С момента проведения теста в 19 году не было зарегистрировано ни одного случая гемотрансмиссивной малярии.94. [14] Одно исследование, оценивающее тест иммуноферментного анализа (ELISA), в котором использовался антиген P. falciparum , показало, что тест может быть недостаточно чувствительным и специфичным для скрининга антител у доноров из группы риска, история болезни которых указывает на то, что они могли подвергаться воздействию. к малярии.
Silvie et al использовали комбинацию теста на антиген P. falciparum HRP-2 и теста на антитела методом иммуноферментного анализа (ИФА) для тестирования образцов плазмы пациентов с подтвержденным Инфекция P. falciparum .[14] Результаты у пациентов с подтвержденной малярийной инфекцией показали, что комбинация тестов выявила больше положительных результатов, чем любой тест по отдельности. Опять же, есть опасения, может ли даже эта комбинация выявить очень низкие уровни паразитемии, часто наблюдаемые у доноров; тем более, что используется небольшое количество крови. [14] Методы ПЦР для обнаружения ДНК или РНК плазмодия могут быть наиболее чувствительными (один паразит/50 мкл) и специфичными, но технически сложными и самыми дорогими. Одно исследование, однако, показало, что даже этот метод может быть не в состоянии обнаружить организмы ниже уровня 10 паразитов/10 мкл крови.
[14] Методы ПЦР для обнаружения ДНК или РНК плазмодия могут быть наиболее чувствительными (один паразит/50 мкл) и специфичными, но технически сложными и самыми дорогими. Одно исследование, однако, показало, что даже этот метод может быть не в состоянии обнаружить организмы ниже уровня 10 паразитов/10 мкл крови.
Бабезиоз является эндемичным заболеванием на северо-востоке и в некоторых частях Среднего Запада США. После малярии это наиболее распространенное паразитарное заболевание, передающееся при переливании крови. [15] Организмы, часто вызывающие инфицирование человека, Babesia microti и B. divergens , передаются при укусе клеща Ixodes sp. WA l-тип был связан с бабезиозом, передающимся при переливании крови.[17]
Большинство естественных инфекций протекают бессимптомно или проявляются в легкой форме. У пациентов с аспленией, пожилых людей или пациентов с ослабленным иммунитетом может развиться тяжелое малярийноподобное заболевание с гемолитической анемией и почечной недостаточностью. Организмы B. microti могут выживать при 4°C и 25°C. Одно исследование показало, что микроорганизмы в крови, хранившейся при 4°C, были жизнеспособны на 17-й день; те, что содержались в крови при температуре 25°C, были жизнеспособны в течение 3 дней.[18] Результаты исследования, в котором наблюдали за инфицированными бабезиями субъектами каждые 3 месяца на протяжении до 27 месяцев, показали присутствие микроорганизмов в кровотоке (мазок крови) примерно в течение недели, но ПЦР-анализ циркулирующей бабезиальной ДНК был положительным в течение 82 дней [19].]
Организмы B. microti могут выживать при 4°C и 25°C. Одно исследование показало, что микроорганизмы в крови, хранившейся при 4°C, были жизнеспособны на 17-й день; те, что содержались в крови при температуре 25°C, были жизнеспособны в течение 3 дней.[18] Результаты исследования, в котором наблюдали за инфицированными бабезиями субъектами каждые 3 месяца на протяжении до 27 месяцев, показали присутствие микроорганизмов в кровотоке (мазок крови) примерно в течение недели, но ПЦР-анализ циркулирующей бабезиальной ДНК был положительным в течение 82 дней [19].]
Как и в случае с малярией и болезнью Шагаса, не существует утвержденных серологических тестов для скрининга доноров, и вопросы донора не всегда могут выявить правильный анамнез, поскольку инфекция часто протекает бессимптомно.[19] Существующие диагностические тесты на бабезиоз не подходят для крупномасштабного скрининга доноров. Исследование мазков периферической крови, непрямые флуоресцентные тесты на антитела, ПЦР для выявления специфических мишеней B. microti или инокуляция животных являются медленными, дорогостоящими и/или трудоемкими методами. Предпринимаются усилия по разработке тестов ИФА для обнаружения бабезиальных антител, которые могли бы подойти для скрининга доноров.[20] В настоящее время любой донор с бабезиозом в анамнезе отстранен на неопределенный срок из-за возможности персистирующей паразитемии.
microti или инокуляция животных являются медленными, дорогостоящими и/или трудоемкими методами. Предпринимаются усилия по разработке тестов ИФА для обнаружения бабезиальных антител, которые могли бы подойти для скрининга доноров.[20] В настоящее время любой донор с бабезиозом в анамнезе отстранен на неопределенный срок из-за возможности персистирующей паразитемии.
Болезнь Шагаса, вызываемая Trypanosoma cruzi , эндемична в Центральной и Южной Америке и некоторых частях Мексики. Передается клопом семейства Reduviidae. Болезнь первоначально приобретается, когда инфекционная стадия трипомастиготы откладывается на коже человека в фекалиях насекомого после того, как оно принимает кровь. Организм попадает в кровоток человека через разрыв кожи. Острая стадия болезни кратковременна и характеризуется лихорадкой, анорексией, гепатоспленомегалией, циркуляцией в крови трипомастиготной формы. Примерно у 10-30% инфицированных разовьется хронический трипаносомоз с внутриклеточной инвазией организма. [21] Эта внутриклеточная стадия амастиготы отвечает за хроническую форму заболевания, которая характеризуется неврологическими расстройствами, прогрессирующим поражением сердечной мышцы, приводящим к кардиомиопатии, или поражением пищеварительной системы, приводящим к мегаколону или мегаэзофагусу. На хронической стадии инфекционные трипомастиготы в небольшом количестве циркулируют в крови человека и делают кровь потенциально способной передавать заболевание при переливании.
[21] Эта внутриклеточная стадия амастиготы отвечает за хроническую форму заболевания, которая характеризуется неврологическими расстройствами, прогрессирующим поражением сердечной мышцы, приводящим к кардиомиопатии, или поражением пищеварительной системы, приводящим к мегаколону или мегаэзофагусу. На хронической стадии инфекционные трипомастиготы в небольшом количестве циркулируют в крови человека и делают кровь потенциально способной передавать заболевание при переливании.
В эндемичных районах серораспространенность заболевания колеблется от менее 1% до 62% (в зависимости от страны) с общим числом инфицированных от 16 до 18 миллионов человек.[22–25] Доноров крови в эндемичных районах обычно тестируют на антител перед донорством, а риск заражения болезнью Шагаса при переливании крови от серопозитивных доноров в эндемичных районах колеблется от 12% до 48%. передающийся и, наконец, трансплацентарный (врожденный). Было зарегистрировано четыре случая гемотрансфузионной болезни Шагаса в США и два в Канаде, причем большинство из них связано с T. cruzi контаминированные тромбоциты. Все реципиенты были с ослабленным иммунитетом, и все доноры, кроме одного, были из страны, эндемичной по T. cruzi . [27]
cruzi контаминированные тромбоциты. Все реципиенты были с ослабленным иммунитетом, и все доноры, кроме одного, были из страны, эндемичной по T. cruzi . [27]
безопасность снабжения кровью США из-за увеличения иммиграции из эндемичных районов. Подсчитано, что от 25 000 до 100 000 латиноамериканских иммигрантов в США могут быть инфицированы 90 003 T. cruzi 9.0004 .[28] Кроме того, было показано, что трипомастиготы остаются жизнеспособными в хранимой цельной крови в течение семи дней, в тромбоцитах в течение 4 дней и в эритроцитах в течение 2 дней при ПЦР-тестировании на ДНК T. cruzi , остающихся положительными на протяжении всего хранения. единиц.[29] Острая инфекция обычно диагностируется при обнаружении трипомастигот в мазке крови, окрашенном Райтом. Однако на хронической стадии циркулирующий уровень трипомастигот слишком низок, чтобы его можно было обнаружить, и поэтому серопозитивность используется в качестве доказательства инфекции. Серологические тесты с использованием методологии ELISA чувствительны и специфичны для выявления паразитемии, когда серопревалентность организма относительно высока, но они не могут легко отличить острую инфекцию от хронической [27]. Другая проблема с современными серологическими тестами заключается в том, что используемые антигены получены из целых организмов, а некоторые антигены могут быть общими с другими паразитами, такими как Leishmania вид. Это приводит к перекрестным реакциям и ложноположительным результатам, что может вызывать большую озабоченность в таких регионах, как Южная и Центральная Америка, где лейшманиоз также является эндемичным. Серологический тест с использованием четырех рекомбинантных антигенов T. cruzi был оценен и показал чувствительность более 99%, специфичность более 98% и возможность его использования при скрининге доноров крови [30].
Другая проблема с современными серологическими тестами заключается в том, что используемые антигены получены из целых организмов, а некоторые антигены могут быть общими с другими паразитами, такими как Leishmania вид. Это приводит к перекрестным реакциям и ложноположительным результатам, что может вызывать большую озабоченность в таких регионах, как Южная и Центральная Америка, где лейшманиоз также является эндемичным. Серологический тест с использованием четырех рекомбинантных антигенов T. cruzi был оценен и показал чувствительность более 99%, специфичность более 98% и возможность его использования при скрининге доноров крови [30].
Leishmania donovani , этиологический агент висцерального лейшманиоза, передается при укусе москита. Организм представляет собой внутриклеточный паразит, который присутствует преимущественно в клетках ретикулоэндотелиальной ткани и клетках мононуклеарной фагоцитарной системы. Поиск литературы выявил только 11 сообщений о лейшманиозе, передающемся при переливании крови. Из них 10 были сообщениями об отдельных случаях, а в одной статье из Бразилии сообщалось о 32 случаях кала-азара у 82 пациентов, находящихся на гемодиализе.[31] Все 10 сообщений об отдельных случаях были из Азии и Европы. Из 10 сообщений пять были младенцами, а четыре пациента — детьми младше 6 лет. Сообщалось только об одном взрослом случае лейшманиоза, передающегося при переливании крови, у 30-летней женщины из Харьяны, Индия.[32] Время между переливанием Зараженная Leishmania кровь и первые клинические проявления были доступны в 10 отчетах; а средний инкубационный период составил 7,4 + 5 месяцев.
Из них 10 были сообщениями об отдельных случаях, а в одной статье из Бразилии сообщалось о 32 случаях кала-азара у 82 пациентов, находящихся на гемодиализе.[31] Все 10 сообщений об отдельных случаях были из Азии и Европы. Из 10 сообщений пять были младенцами, а четыре пациента — детьми младше 6 лет. Сообщалось только об одном взрослом случае лейшманиоза, передающегося при переливании крови, у 30-летней женщины из Харьяны, Индия.[32] Время между переливанием Зараженная Leishmania кровь и первые клинические проявления были доступны в 10 отчетах; а средний инкубационный период составил 7,4 + 5 месяцев.
Скрининг донорской крови путем микроскопического исследования не является чувствительным инструментом, и аспираты из селезенки или костного мозга будут неэтичными. Иммунодиагностические тесты, включая ИФА с использованием рекомбинантных антигенов, таких как rK-39, разработанный из Leishmania chagasi Нового Света, или недавно разработанный рекомбинантный антиген rKE16 из Leishmania donovani из Индии [33,34] и технологию ПЦР можно использовать для массового скрининга образцов донорской крови. Но эти методологии могут иметь финансовые и технические трудности. Можно предложить проводить скрининг всех доноров на наличие специфических антител против лейшмании. Экспресс-тест с использованием антигена rKE16, разработанный нами при финансовой поддержке отдела биотехнологии, теперь коммерчески доступен по очень выгодной цене.
Но эти методологии могут иметь финансовые и технические трудности. Можно предложить проводить скрининг всех доноров на наличие специфических антител против лейшмании. Экспресс-тест с использованием антигена rKE16, разработанный нами при финансовой поддержке отдела биотехнологии, теперь коммерчески доступен по очень выгодной цене.
Токсоплазмоз — зооноз, вызываемый Toxoplasma gondii , паразит, обитающий у кошек и собак и имеющий три формы: трофозоиты, цисты и ооцисты. T. gondii передается несколькими путями: проглатывание ооцист T. gondii , употребление в пищу недоваренной зараженной свинины или говядины, прямое заражение открытых ран и вертикальная передача от матери к ребенку. Кроме того, сообщалось, что возбудитель передается при переливании крови и трансплантации органов.[35] Тем не менее, риск 9Передача 0003 T. gondii при переливании крови чрезвычайно низка, и серологическое тестирование антител к T. gondii у доноров крови представляется ненужным. Было высказано предположение, что люди с повышенным риском токсоплазмоза, такие как лица с ослабленным иммунитетом и беременные женщины, получают для переливания T. gondii антитело-отрицательные компоненты крови. Универсальная программа лейкодеплеции, проводимая в настоящее время в Канаде, может снизить риск гемотрансфузионного токсоплазмоза.
Было высказано предположение, что люди с повышенным риском токсоплазмоза, такие как лица с ослабленным иммунитетом и беременные женщины, получают для переливания T. gondii антитело-отрицательные компоненты крови. Универсальная программа лейкодеплеции, проводимая в настоящее время в Канаде, может снизить риск гемотрансфузионного токсоплазмоза.
Микрофилярии могут передаваться при переливании крови и могут циркулировать в крови реципиента, но не развиваются во взрослых червей. Смертность, связанная с филяриатозной инфекцией, связанной с трансфузией, не документирована, но она может привести к заболеваемости у реципиентов трансфузии с точки зрения аллергической реакции. В исследовании [36], проведенном для изучения связи посттрансфузионных реакций и филяриатозных инфекций в эндемичном районе из примерно 11 752 реципиентов переливания, которые наблюдались в течение 15 месяцев, 47 (0,4%) посттрансфузионных реакций (PTR). Доноры крови с активной историей филяриозной инфекции должны быть отстранены от сдачи крови. По возможности в качестве скринингового теста для доноров крови можно использовать тест на выявление филяриозного антигена.
По возможности в качестве скринингового теста для доноров крови можно использовать тест на выявление филяриозного антигена.
Концепция инактивации патогенов в компонентах крови заключается в снижении остаточного риска известных патогенов и эффективном устранении новых, еще неизвестных патогенов. Однако различные подходы должны повышать безопасность крови без ущерба для эффективности продукта и не вызывая побочных эффектов, поскольку в процессе могут использоваться токсичные или мутагенные химические вещества. Выбор метода снижения количества патогенов зависит от того, используется ли он для обработки компонентов для переливания, таких как эритроциты, тромбоциты и плазма, или для продуктов, изготовленных из плазмы. В Европе для обработки плазмы, предназначенной для переливания, в настоящее время используются два различных метода: метиленовый синий (МС) и растворитель-детергент (СД). MB представляет собой фенотиазиновый краситель, который инактивирует большинство вирусов и бактерий после воздействия видимого света. В то время как его преимущество состоит в том, что он применим для отдельных доз плазмы, его неэффективность против внутриклеточных патогенов и возможное взаимодействие с факторами свертывания крови значительно снижают его эффективность.[37] Подход SD действует, разрушая белки оболочки целевых патогенов, тем самым нарушая целостность патогена и делая его неинфекционным. Этот подход используется на небольших пулах плазмы. Ограничением этого метода является то, что он не активен против безоболочечных патогенов, и что уровни факторов свертывания крови, таких как протеин S, могут быть значительно снижены некоторыми методами лечения ДС [38]. Амотосален HCL (S-59) представляет собой синтетический псорален, который в сочетании с воздействием ультрафиолетового света А [УФА] вызывает постоянную перекрестную связь в цепях бактериальных и вирусных нуклеиновых кислот, тем самым останавливая репликацию патогена. Обширные исследования показали, что этот подход эффективен против всех патогенов, которые в настоящее время исследуются, включая простейших ( T.
В то время как его преимущество состоит в том, что он применим для отдельных доз плазмы, его неэффективность против внутриклеточных патогенов и возможное взаимодействие с факторами свертывания крови значительно снижают его эффективность.[37] Подход SD действует, разрушая белки оболочки целевых патогенов, тем самым нарушая целостность патогена и делая его неинфекционным. Этот подход используется на небольших пулах плазмы. Ограничением этого метода является то, что он не активен против безоболочечных патогенов, и что уровни факторов свертывания крови, таких как протеин S, могут быть значительно снижены некоторыми методами лечения ДС [38]. Амотосален HCL (S-59) представляет собой синтетический псорален, который в сочетании с воздействием ультрафиолетового света А [УФА] вызывает постоянную перекрестную связь в цепях бактериальных и вирусных нуклеиновых кислот, тем самым останавливая репликацию патогена. Обширные исследования показали, что этот подход эффективен против всех патогенов, которые в настоящее время исследуются, включая простейших ( T. cruzi ) [40].
cruzi ) [40].
Донорские лейкоциты, остаточные лейкоциты в переливании тромбоцитов или эритроцитов, связаны с потенциальными побочными реакциями. Лейкоциты с их специфической аллогенной структурой (обнажение на своей поверхности антигенов HLA класса I и класса II) являются основными мишенями иммунной системы реципиента. У некоторых реципиентов после переливания развивается лихорадка в ответ на донорские лейкоциты. Повторное воздействие донорских лейкоцитов может вызвать иммунный ответ, который делает реципиента невосприимчивым к донорским тромбоцитам, таким образом, переливание не приносит пользы. Кроме того, некоторые инфекционные агенты передаются в донорских лейкоцитах, в которых они находятся. В попытке преодолеть эти неблагоприятные эффекты были разработаны методы удаления донорских лейкоцитов — лейкоредукция или лейкодеплеция. Современные технологии позволяют удалять > 99,99% донорских лейкоцитов, обычно путем фильтрации эритроцитов и/или тромбоцитов. Способность лейкоцитарных фильтров удалять из донорской крови загрязняющие бактерии или простейшие, такие как Trypanosoma cruzi , агент, вызывающий болезнь Шагаса [41].
Хотя риск инфекций, передаваемых при переливании крови, сегодня ниже, чем когда-либо, поставки безопасных продуктов крови по-прежнему подвержены контаминации известными и еще не идентифицированными человеческими патогенами. Только постоянное совершенствование и внедрение методов отбора доноров, чувствительных скрининговых тестов и эффективных процедур инактивации могут обеспечить устранение или, по крайней мере, снижение риска заражения инфекциями, передающимися при переливании крови. Кроме того, постоянное обучение и актуальная информация об инфекционных агентах, которые потенциально передаются через компоненты крови, необходимы для продвижения сообщений о нежелательных явлениях, что является важным компонентом эпиднадзора за заболеваниями, передающимися при переливании крови. Таким образом, сотрудничество всех сторон, участвующих в трансфузионной медицине, включая национальные системы гемонадзора, имеет решающее значение для защиты надежных поставок продуктов крови от известных и новых патогенов, передающихся через кровь.
Источник поддержки: Нет
Конфликт интересов: Не объявлено.
1. Garraud O. Механизмы трансфузионной паразитарной инфекции. Трансфус Клин Биол. 2006; 13: 290–7. [PubMed] [Google Scholar]
2. Брюс-Чватт LJ. Трансфузионно-ассоциированные паразитарные инфекции. Прог Клин Биол Рез. 1985; 182: 101–25. [PubMed] [Google Scholar]
3. Chiodini PL, Hartley S, Hewitt PE, Barbara JA, Lalloo K, Bligh J, et al. Оценка ИФА на антитела к малярии и его значение в снижении потенциальных потерь донорских эритроцитов от доноров крови, подвергшихся воздействию малярии, с примечанием о случае малярии, передающейся при переливании крови. Вокс Санг. 1997;73:143–148. [PubMed] [Google Scholar]
4. Китчен А., Мийович А., Хьюитт П. Малярия, передающаяся при переливании крови: текущих рекомендаций по отбору доноров недостаточно. Вокс Санг. 2005; 88: 200–1. [PubMed] [Google Scholar]
5. Шлагенхауф П., Мьютенер П. Завозная малярия. В: Schlagenhauf P, редактор. Малярия путешественников. Гамильтон: BC Decker Inc; 2001. стр. 495–508. [Google Scholar]
В: Schlagenhauf P, редактор. Малярия путешественников. Гамильтон: BC Decker Inc; 2001. стр. 495–508. [Google Scholar]
6. Kitchen AD, Chiodini PL. Малярия и переливание крови. Вокс Санг. 2006; 90:77–84. [PubMed] [Академия Google]
7. Тегтмайер Г.Э. Инфекционные болезни, передающиеся трансфузионным путем: Разное. Вокс Санг. 1994; 67: 179–81. [PubMed] [Google Scholar]
8. Riley EM, Wahl S, Perkins DJ, Schofield L. Регулирование иммунитета к малярии. Иммунол от паразитов. 2006; 28:35–49. [PubMed] [Google Scholar]
9. Warhurst DC, Williams JE. Информационный бюллетень ACP № 148: июль 1996 г.: Лабораторная диагностика малярии. Джей Клин Патол. 1996; 49: 533–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
10. Муди А. Экспресс-тесты на малярийные паразиты. Clin Microbiol Rev. 2002; 15:66–78. [Бесплатная статья PMC] [PubMed] [Google Scholar]
11. Baird JK, Purnomo, Jones TR. Диагностика малярии в полевых условиях с помощью флуоресцентной микроскопии капилляров QBC. Trans R Soc Trop Med Hyg. 1992; 86: 3–5. [PubMed] [Google Scholar]
Trans R Soc Trop Med Hyg. 1992; 86: 3–5. [PubMed] [Google Scholar]
12. Huong NM, Davis TM, Hewitt S, Huong NV, Uyen TT, Nhan DH, et al. Сравнение трех методов обнаружения антигена для диагностики и терапевтического мониторинга малярии: полевое исследование на юге Вьетнама. Троп Мед Int Health. 2002; 7: 304–8. [PubMed] [Google Scholar]
13. Playford EG, Walker J. Оценка ICT малярии P.f/P.v и экспресс-тестов OptiMal на малярию у вернувшихся путешественников с лихорадкой. Дж. Клин Микробиол. 2002; 40:4166–71. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. Silvie O, Thellier M, Rosenheim M, Datry A, Lavigne P, Danis M, et al. Потенциальная ценность обнаружения антигена и антител, ассоциированного с Plasmodium falciparum , для скрининга доноров крови с целью предотвращения малярии, передающейся при переливании крови. Переливание. 2002; 42: 357–62. [PubMed] [Google Scholar]
15. McQuiston JH, Childs JE, Chamberland ME, Tabor E. Передача переносимых клещами возбудителей болезней при переливании крови: обзор известных и потенциальных рисков в Соединенных Штатах. Переливание. 2000;40:274–84. [PubMed] [Академия Google]
Переливание. 2000;40:274–84. [PubMed] [Академия Google]
16. Пантановиц Л., Телфорд С.Р., Кэннон М.Э. Клещевые болезни в трансфузионной медицине. Трансфус Мед. 2002; 12:85–106. [PubMed] [Google Scholar]
17. Persing DH, Herwaldt BL, Glaser C, Lane RS, Thomford JW, Mathiesen D, et al. Заражение бабезиоподобным организмом в северной Калифорнии. N Engl J Med. 1995; 332: 298–303. [PubMed] [Google Scholar]
18. Eberhard ML, Walker EM, Steurer FJ. Выживаемость и инфекционность бабезий в крови сохраняется при 25°С и 2-4°С. J Parasitol. 1995;81:790–2. [PubMed] [Google Scholar]
19. Krause PJ, Spielman A, Telford SR 3rd, Sikand VK, McKay K, Christianson D, et al. Стойкая паразитемия после острого бабезиоза. N Engl J Med. 1998; 339:160–5. [PubMed] [Google Scholar]
20. Houghton RL, Homer MJ, Reynolds LD, Sleath PR, Lodes MJ, Berardi V, et al. Идентификация Babesia microti -специфических иммунодоминантных эпитопов и разработка пептидного ИФА для обнаружения антител в сыворотке. Переливание. 2002; 42: 1488–9.6. [PubMed] [Google Scholar]
Переливание. 2002; 42: 1488–9.6. [PubMed] [Google Scholar]
21. Галель С.А., Кирхгоф Л.В. Факторы риска заражения Trypanosoma cruzi у доноров крови в Калифорнии. Переливание. 1996; 36: 227–31. [PubMed] [Google Scholar]
22. Шмунис Г.А. Trypanosoma cruzi , этиологический агент болезни Шагаса: состояние кровоснабжения в эндемичных и неэндемичных странах. Переливание. 1991; 31: 547–57. [PubMed] [Google Scholar]
23. Schmunis GA, Cruz JR. Безопасность кровоснабжения в Латинской Америке. Clin Microbiol Rev. 2005; 18:12–29.. [PMC free article] [PubMed] [Google Scholar]
24. Шмунис Г.А., Родригес Г., Коенен Дж., Беллорин Э.Г., Джанелла А. Профилактика болезней, передающихся через кровь, в Боливии, 1993-2002 гг. Am J Trop Med Hyg. 2008; 79: 803–8. [PubMed] [Google Scholar]
25. Шмунис Г.А., Цикер Ф., Круз Дж.Р., Кучи П. Безопасность кровоснабжения при инфекционных заболеваниях в странах Латинской Америки, 1994-1997 гг. Am J Trop Med Hyg. 2001; 65: 924–30. [PubMed] [Google Scholar]
2001; 65: 924–30. [PubMed] [Google Scholar]
26. Wendel S, Gonzaga AL. Болезнь Шагаса и переливание крови: проблема Нового Света? Вокс Санг. 1993;64:1–12. [PubMed] [Google Scholar]
27. Лейби Д.А., Ленес Б.А., Тиббалс М.А., Тамес-Олмедо МТ. Проспективная оценка пациента с инфекцией Trypanosoma cruzi , передающейся трансфузионным путем. N Engl J Med. 1999; 341:1237–9. [PubMed] [Google Scholar]
28. Кирхгоф Л.В., Гам А.А., Гиллиам Ф.К. Американский трипаносомоз (болезнь Шагаса) у иммигрантов из Центральной Америки. Am J Med. 1987; 82: 915–20. [PubMed] [Google Scholar]
29. Мелмед Р., Смит Т., Лейби Д.А. Выживание и распространение Trypanosoma cruzi в цельной крови и компонентах крови, хранящихся в условиях банка крови. Переливание. 2000;42:91С. [Google Scholar]
30. Umezawa ES, Bastos SF, Coura JR, Levin MJ, Gonzalez A, Rangel-Aldao R, et al. Усовершенствованный серодиагностический тест на болезнь Шагаса с использованием смеси рекомбинантных антигенов Trypanosoma cruzi . Переливание. 2003;43:91–7. [PubMed] [Google Scholar]
Переливание. 2003;43:91–7. [PubMed] [Google Scholar]
31. Luz KG, da Silva VO, Gomes EM, Machado FC, Araujo MA, Fonseca HE и соавт. Распространенность анти- Антитела к Leishmania donovani среди бразильских доноров крови и пациентов с многократным гемодиализом. Am J Trop Med Hyg. 1997; 57: 168–71. [PubMed] [Google Scholar]
32. Singh S, Chaudhry VP, Wali JP. Кала-азар, передающийся при переливании крови, в Индии. Переливание. 1996; 36: 848–9. [PubMed] [Google Scholar]
33. Сингх С. Новые разработки в диагностике лейшманиоза. Индийская J Med Res. 2006; 123:311–30. [PubMed] [Google Scholar]
34. Сивакумар Р., Шарма П., Чанг К.П., Сингх С. Клонирование, экспрессия и очистка нового рекомбинантного антигена из Leishmania donovani . Protein Expr Purif. 2006; 46: 156–65. [PubMed] [Google Scholar]
35. Шульман И.А. Паразитарные инфекции и их влияние на отбор и тестирование доноров крови. Arch Pathol Lab Med. 1994; 118: 366–70. [PubMed] [Google Scholar]
36. Чоудхури Н., Мурти П.К., Чаттерджи Р.К., Хан М.А., Айягари А. Передача филяриозной инфекции при переливании крови. Индиан Дж. Патол Микробиол. 2003; 46: 367–70. [PubMed] [Google Scholar]
Чоудхури Н., Мурти П.К., Чаттерджи Р.К., Хан М.А., Айягари А. Передача филяриозной инфекции при переливании крови. Индиан Дж. Патол Микробиол. 2003; 46: 367–70. [PubMed] [Google Scholar]
37. Аснар Дж. А., Молина Р., Монторо Дж. М. Комплекс фактор VIII/фактор фон Виллебранда в свежей плазме, обработанной метиленовым синим. Переливание. 1999;39:748–50. [PubMed] [Google Scholar]
38. Pelletier JP, Transue S, Snyder EL. Методы инактивации патогенов. Best Pract Res Clin Haematol. 2006; 19: 205–42. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Амотосален: система аллогенной клеточной иммунотерапии, система плазмы INTERCEPT, система тромбоцитов INTERCEPT, S 59. BioDrugs. 2003; 17:66–8. [PubMed] [Google Scholar]
40. Van Voorhis WC, Barrett LK, Eastman RT, Alfonso R, Dupuis K. Trypanosoma cruzi инактивация концентратов тромбоцитов и плазмы человека псораленом (мотосален HCl) и длинноволновым УФ. Противомикробные агенты Chemother. 2003; 47: 475–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
41. Hebert PC, Fergusson D, Blajchman MA, Wells GA, Kmetic A, Coyle D, et al. Клинические результаты после учреждения канадской универсальной программы лейкоредукции для переливания эритроцитарной массы. ДЖАМА. 2003; 289:1941–9. [PubMed] [Google Scholar]
Справочный материал о соответствии требованиям | Служба крови Красного Креста
Последнее обновление: 03.10.2022
Автор: Иветт Мари Миллер, доктор медицинских наук, главный врач
Автор: Кэтлин М. Грима, доктор медицинских наук, главный врач
Автор: Мэри Энн Плоновски, RN. , BSN
Примечание для пользователей : Со времени последнего обновления этой информации правила участия могли измениться. Для получения актуальной информации обращайтесь в ближайший к вам регион службы крови Американского Красного Креста.
Углубленное обсуждение возраста и донорства крови
Лица моложе 17 лет почти всегда являются несовершеннолетними (еще не достигшими совершеннолетия), которые не могут сами дать согласие на сдачу крови. (Каждый штат определяет свой собственный возраст совершеннолетия, который может быть разным для разных видов деятельности.) Если это разрешено законодательством штата, лица в возрасте 16 лет могут сдавать кровь с согласия родителей. Однако лица моложе 17 лет могут сдавать кровь для своих для собственного использования, перед запланированной операцией или в ситуациях, когда их кровь имеет особое медицинское значение для конкретного пациента, например члена семьи.
(Каждый штат определяет свой собственный возраст совершеннолетия, который может быть разным для разных видов деятельности.) Если это разрешено законодательством штата, лица в возрасте 16 лет могут сдавать кровь с согласия родителей. Однако лица моложе 17 лет могут сдавать кровь для своих для собственного использования, перед запланированной операцией или в ситуациях, когда их кровь имеет особое медицинское значение для конкретного пациента, например члена семьи.
Подробное обсуждение болезни Крейтцфельда-Якоба (БКЯ) и донорства крови
Болезнь Крейтцфельда-Якоба (БКЯ) и донорство крови — это редкое, прогрессирующее и фатальное заболевание головного мозга, которое встречается во всех частях мира и известно уже несколько десятилетий. CJD отличается от варианта CJD, болезни у людей, которая, как считается, связана с коровьим бешенством в Соединенном Королевстве и других странах.
БКЯ является инфекционным заболеванием. Он передается от инфицированных людей пациентам через трансплантацию оболочки головного мозга (твердой мозговой оболочки), использование зараженных мозговых электродов и инъекции гормонов роста, полученных из гипофиза человека. Редко БКЯ связана с наследственной предрасположенностью; то есть это происходит у биологических или «кровных» родственников (лиц одной генетической семьи).
Редко БКЯ связана с наследственной предрасположенностью; то есть это происходит у биологических или «кровных» родственников (лиц одной генетической семьи).
Имеются данные о том, что БКЯ может передаваться от доноров к пациентам при переливании крови. Не существует теста на CJD, который можно было бы использовать для скрининга доноров крови. Это означает, что программы переливания крови должны принимать особые меры предосторожности, чтобы не допустить CJD к поставкам крови, не принимая донорскую кровь от тех, кто мог заразиться этой инфекцией.
Считается, что вы подвергаетесь более высокому риску носительства CJD, если вам пересадили твердую мозговую оболочку (покрывающую головной мозг). Если у вас была трансплантация твердой мозговой оболочки, вы не можете сдавать кровь до тех пор, пока не станет больше известно о БКЯ и риске для кровоснабжения. Если у вас диагностирована вБКЯ, БКЯ или любая другая ТГЭ, или у вашего кровного родственника диагностирована генетическая БКЯ (например, фБКЯ, GSS или FFI), вы не можете стать донором. Если вам сделали инъекцию трупного гипофизарного гормона роста человека (hGH), вы не можете быть донором. ЧГР человеческого трупного гипофиза был доступен в США с 19от 58 до 1985 г. Гормон роста, полученный после 1985 г., приемлем.
Если вам сделали инъекцию трупного гипофизарного гормона роста человека (hGH), вы не можете быть донором. ЧГР человеческого трупного гипофиза был доступен в США с 19от 58 до 1985 г. Гормон роста, полученный после 1985 г., приемлем.
Подробное обсуждение гепатита и донорства крови
«Гепатит» означает воспаление печени. Гепатит может быть вызван многими причинами, включая камни в желчном пузыре, прием лекарств, употребление алкоголя, ожирение и инфекции печени.
Гепатит, вызванный вирусом гепатита В и вирусом гепатита С, может легко передаваться от донора к пациенту при переливании крови. Донор может быть носителем вируса гепатита, даже если он никогда не болел воспалением печени и на момент донорства чувствует себя совершенно хорошо.
Гепатит B и гепатит C передаются между людьми через половой контакт и контакт крови с кровью, например, когда используются общие иглы во время внутривенного употребления наркотиков. Вирусы гепатита также могут передаваться от матерей их нерожденным детям. Однако многие люди, инфицированные вирусом гепатита, не могут определить, как они заразились. Существует вакцина против вирусов гепатита А и В.
Однако многие люди, инфицированные вирусом гепатита, не могут определить, как они заразились. Существует вакцина против вирусов гепатита А и В.
Все доноры крови проверяются на гепатит В и гепатит С с помощью нескольких различных тестов. Но поскольку эти тесты несовершенны, людям, которые могут быть инфицированы вирусами гепатита, по-прежнему важно не сдавать кровь. В некоторых случаях все, что требуется, — это период ожидания после определенного события, такого как контакт с больным гепатитом, чтобы убедиться, что этот человек не инфицирован. В других случаях вероятность гепатита настолько высока, что человек не может быть донором, независимо от того, сколько времени прошло. Доноры, у которых когда-либо был диагностирован гепатит В или С, даже если они получали лечение, не имеют права сдавать кровь.
Подробное обсуждение малярии и донорства крови
Малярия — это инфекция крови, вызываемая паразитом, который может передаваться от донора к пациенту при переливании крови. Можно заразиться малярией, но не иметь симптомов, даже если паразит присутствует в вашей крови. Также возможно чувствовать себя хорошо, но иметь очень легкую форму малярии, особенно если вы жили в течение длительного периода времени в тех частях мира, где встречается малярия.
Можно заразиться малярией, но не иметь симптомов, даже если паразит присутствует в вашей крови. Также возможно чувствовать себя хорошо, но иметь очень легкую форму малярии, особенно если вы жили в течение длительного периода времени в тех частях мира, где встречается малярия.
Центры по контролю и профилактике заболеваний отслеживают места с малярией для международных путешественников из Соединенных Штатов, и эта информация доступна на их веб-сайте. Вы можете узнать, обнаружена ли малярия в том месте, где вы путешествовали или жили, выполнив поиск на веб-сайте CDC. Информацию о малярии по странам можно найти по адресу http://www.cdc.gov/malaria/travelers/country_table/a.html.
Донорская кровь не проверяется на малярию. Поэтому важно, чтобы люди, которые могут быть больны малярией или подверглись воздействию малярии из-за проживания или поездки в страну, где присутствует малярия, не могли сдавать кровь до тех пор, пока не пройдет достаточно времени, чтобы убедиться, что они не инфицированы. с малярией. Это делается путем установления периода ожидания для тех, кто жил, переезжал или путешествовал в местах с малярией.
с малярией. Это делается путем установления периода ожидания для тех, кто жил, переезжал или путешествовал в местах с малярией.
Если вы путешествовали за пределами Соединенных Штатов, ваши пункты назначения будут проверены, чтобы определить, не находились ли вы в зоне риска малярии. Было бы очень полезно, если бы вы были готовы сообщить страну и город или пункты назначения, в которые вы путешествовали, а также даты поездки.
Подробное обсуждение кровяного давления
Когда вы приходите сдавать кровь в Американский Красный Крест, мы измеряем ваше кровяное давление, чтобы определить, имеете ли вы право сдавать кровь. Мы измеряем ваше кровяное давление, пульс, температуру и гемоглобин, потому что результаты дают информацию о вашем текущем состоянии здоровья на момент сдачи крови.
Что такое кровяное давление и что оно означает?
Артериальное давление — это давление крови, прижимаемой сердцем к стенкам артерий. Артерии несут кровь от сердца к другим частям тела.



 Людям с инфекцией в анамнезе не разрешается сдавать кровь, если правила не изменятся.
Людям с инфекцией в анамнезе не разрешается сдавать кровь, если правила не изменятся.