Фенотип это совокупность: 1)Фенотип – это совокупностьа)Рецессивных геновб)Доминантных геновв)Проявившихся внешне признаковг)Генотипов одного вида 2)Генотип – это…
Фенотип
Фенотип — совокупность генетически определяемых признаков и свойств организма.[ …]
Фенотип и генотип животного находятся в тесной взаимозависимости: развитие всех фенотипических признаков обусловлено определенным генотипом.[ …]
Фенотипы — совокупность всех признаков и свойств организма, сформировавшихся в процессе онтогенеза на основе данного генотипа. Дело в том, что при большой скученности (плотности) образуются разные фенотипы за счет того, что в организмах происходят физиологические изменения в результате так называемой стресс-реакции (дистресс), вызываемой неестественно большим скоплением особей. Например, у самок грызунов происходит воспаление надпочечников, что ведет к сокращению рождаемости. Кроме того, нехватка пищи заставляет особей мигрировать на новые участки, что приводит к большой их гибели в пути и на новых участках, в новых условиях, т. е. повышается смертность и сокращается численность.[ …]
Фенотип — совокупность внешних и внутренних признаков организма. [ …]
[ …]
Фенотип популяции, определяющий ее морфофизиологические особенности и характер реакции на среду в данное время, формируется в течение прошедших сезонов. Экологическая обстановка прошедших сезонов определяет возможности реализации в будущем потенции размножения, выживаемости и формирования всех, параметров структуры. Поэтому о тенденциях динамики популяций в следующем году можно судить по их состоянию, сложившемуся в конце вегетационного периода. Основными показателями сложившегося состояния популяций служат их пространственная структура и морфофизиологические особенности. В то же время отмеченное обстоятельство приводит к тому, что реакция популяций на изменение экологической обстановки запаздывает. Поэтому при объективно оптимальных условиях в данное время популяция может быть малочисленной и размножаться слабо, если прошедшие сезоны были неблагоприятными. И наоборот, при объективно неблагоприятной экологической обстановке популяция некоторое время еще может быть многочисленной и р. азмножаться, если предшествующие сезоны были благоприятными.[ …]
азмножаться, если предшествующие сезоны были благоприятными.[ …]
Фенотип — сумма всех внешних и внутренних признаков (свойств) данного организма. У всех организмов различают качественные и количественные признаки. Качественными признаками служат те, которые можно, глядя на них, сфотографировать или описать, причем степень достоверности в описании зависит от умения описывающего. Так К. Линней настолько ярко описал качественные признаки домашней собаки, что эти описания уже два столетия переходят из одного учебника в другой без изменений. Такими признаками организмов являются половые различия, форма тела, строение, масть животного, окраска цветков и плодов, форма семян, плодов и т. д. Особенно разнообразны качественные признаки у человека. Они специфичны применительно к каждому индивидууму.[ …]
Фенотип — весь комплекс внешних и внутренних признаков и свойств организма, проявляющийся в течение его онтогенеза. Фенотип является результатом реализации генотипа в определенных условиях внешней среды. Наследственность — обусловленное генотипом свойство растений сохранять и передавать потомству свои признаки и особенности своего развития. Наследственность обеспечивает материальную преемственность между поколениями организмов.[ …]
Наследственность — обусловленное генотипом свойство растений сохранять и передавать потомству свои признаки и особенности своего развития. Наследственность обеспечивает материальную преемственность между поколениями организмов.[ …]
Фенотип — совокупность всех признаков и свойств организма, сформировавшихся на основе взаимодействия генотипа с условиями внешней среды.[ …]
Фенотип — меняющаяся в процессе индивидуального развития совокупность признаков и свойств организма, формирующаяся на основе наследственности генотипа) и влияния внешней среды..[ …]
В фенотипе животного никогда «е реализуются полностью все генотипические возможности организма. Полагают, что у высших животных в геноме содержится около 300 тыс. генов. Однако в каждый период онтогенеза генетическая информация считывается только с 5% генов, именно тех, которые обусловливают контроль необходимых в данный момент белков. Для реализации их нужны соответствующие условия внешней среды. Следовательно, развитие животного, формирование его признаков и свойств определяются как генотипом данной особи, так и внешними условиями, в которых проходит онтогенез. [ …]
[ …]
Под фенотипом позвоночника мы подразумевали конкретное сочетание числа позвонков в туловищном, пере-ходиомн хвостовом отделах позвоночника. В каждой выборке подсчитывали частоты фенотипов, и полученные распределения сравнивали попарно по критерию идентичности (I) показателя сходства (г) Дивановского 3]. На основании рассчитанных критериев идентичности строили дендрограмму взвешенным цопарно-групповым л методом. Для оценки йкутривыборочной рааиокачественности по данному признаку аналогичным методом сравнивали возрастные группы каждой выборки.[ …]
Что такое фенотип? Фенотип (биологический тип) — есть совокупность всех признаков и свойств организма, сформировавшихся в процессе его индивидуального развития, складывающегося в процессе взаимодействия наследственных свойств организма — генотипа и условий среды обитания.[ …]
Итак, хотя фенотип нельзя свести только к генотипу или среде, различия в фенотипе могут определяться раздельными или совместными различиями генотипа или среды, наследственность и среда постоянно взаимодействуют, определяя свойства организмов. Это, однако, не означает абсолютного влияния среды на проявление всех признаков. Известны отдельные признаки, развитие которых настолько сильно ограничено генотипом, что они не подвержены модификации ни одним из известных факторов среды. Можно сказать, что эти признаки генетически; очень узко детерминированы к существующему разнообразию среды. Примерами таких признаков являются группы крови и цвет глаз у человека. Одновременно есть признаки, которые зависят от внешней среды, например, уродства новорожденных в результате приема ядов или алкоголя беременными женщинами, но такие признаки не имеют прямого отношения к наследственности.[ …]
Это, однако, не означает абсолютного влияния среды на проявление всех признаков. Известны отдельные признаки, развитие которых настолько сильно ограничено генотипом, что они не подвержены модификации ни одним из известных факторов среды. Можно сказать, что эти признаки генетически; очень узко детерминированы к существующему разнообразию среды. Примерами таких признаков являются группы крови и цвет глаз у человека. Одновременно есть признаки, которые зависят от внешней среды, например, уродства новорожденных в результате приема ядов или алкоголя беременными женщинами, но такие признаки не имеют прямого отношения к наследственности.[ …]
Оценку и отбор по фенотипу называют массовым отбором, а оценку и отбор по генотипу — индивидуальным. Строгих разграничений между этими формами отбора не должно быть. Генотип проявляет себя как единая, целостная система, регулирующая все процессы развития. По В. Иогансену, генотип означает норму реакции данного организма на факторы среды в течение онтогенеза. Он обусловливает не только развитие разносторонних особенностей самого животного, но и сохранение их в той или иной степени в потомстве.[ …]
Он обусловливает не только развитие разносторонних особенностей самого животного, но и сохранение их в той или иной степени в потомстве.[ …]
Родословная шире, богаче, а фенотип беднее, уже действительного наследственного содержания животного, так как не вся наследственность предков и даже непосредственных родителей передается потомкам и не все наследственные возможности, присущие особи, полностью реализуются в процессе ее роста и развития (в онтогенезе), т, е. не все, что заложено в генотипе, реализуется в фенотипе.[ …]
Норма реакции — разнообразие фенотипов, возникающих в результате взаимодействия генотипа с разными факторами среды.[ …]
В противоположность генотипу фенотип любого организма изменяется в процессе роста и развития на протяжении всей его жизни. В случае человека изменения фенотипа у отдельного индиви-диума можно проследить по его фотографиям, сделанным в разные периоды жизни. Можно сказать, что фенотип организма является различным в онтогенезе индивидуума, т. е. в эмбриональном периоде, после рождения, во время полового созревания и т. д.[ …]
е. в эмбриональном периоде, после рождения, во время полового созревания и т. д.[ …]
Генотип If. Генотипы if.[ …]
Индивидуальный отбор основан на оценке фенотипа ближайших родственников. Усредненное значение фенотипа родственников отбираемой особи позволяет судить о ее генетической ценности, и поэтому индивидуальный отбор называют отбором по генотипу.[ …]
Другой подход связан с учетом «сторожевых» фенотипов, т. е. с определением фенотипов, возникающих благодаря определенным мутациям, унаследованным доминантно. Примером такого фенотипа является вывих тазобедренного сустава. В отобранной популяции ведется слежение за динамикой частоты интересующих фенотипов среди новорожденных, например, за динамикой частоты вывиха тазобедренного сустава.[ …]
Как видно из табл. 1, сочетание этих вариантов образует 9 фенотипов в московской и шосткинской группах и 8 — в конаковской. Наиболее часто встречались фенотипы АА, АВ, АС, ВО, фенотипы АД ВВ, ВС, СС, £Ш соответственно встречались во всех группах редко. [ …]
[ …]
| Замкнутая цепь коррелятивных связей между генотипами и фенотипами родителей н потомка (по Райту) |
Когда два гена определяют одну и ту же биохимическую реакцию, соотношение фенотипов дает основание предполагать действие генов. Например, два гена, каждый из которых проявляет полное доминирование и оба взаимодействуют во влиянии на один признак, превращают отношение 9 : 3 : 3 : 1 в 9 : 7. Один из генов, гомозиготный по рецессивному признаку, блокирует на каком-то этапе действие другого гена (рис. 131). Такое явление взаимодействия генов называется эпистазом. Различные типы взаимодействия генов создают различные соотношения Г2 как результат слияния различных генотипических классов, имеющих сходные фенотипы.[ …]
Видовой состав сообществ может быть разным, но некоторые виды в них имеют сходные фенотипы и функционально одинаковы. Эти виды называют экологическими двойниками (экологическим эквивалентами).[ …]
Оценка и отбор животных по индивидуальным признакам и свойствам есть оценка и отбор по фенотипу, Хотя фенотип тесно связан с генотипом (все фенотипические особенности развиваются в онтогенезе из определенной наследственной основы) и по фенотипу можно также предположительно судить о генотипических особенностях организма, подобное суждение будет весьма неточным, а часто и ошибочным. Поэтому для более верного суждения о наследственных качествах, генотипических особенностях и племенной ценности животных, оценка по их индивидуальным свойствам должна быть дополнена специальной оценкой по наследственности (генотипу). Изучать наследственность следует одновременно с выявлением условий, благоприятствующих развитию тех или иных признаков и свойств. Наследственность лишь выращенных в таких условиях животных можно правильно оценить по их происхождению и качеству получаемого от них потомства. Подобная оценка животных дает возможность судить о степени устойчивости наследственной основы организма и его способности в той или иной мере передавать свои свойства потомству; она имеет особо важное значение в племенном животноводстве.[ …]
Поэтому для более верного суждения о наследственных качествах, генотипических особенностях и племенной ценности животных, оценка по их индивидуальным свойствам должна быть дополнена специальной оценкой по наследственности (генотипу). Изучать наследственность следует одновременно с выявлением условий, благоприятствующих развитию тех или иных признаков и свойств. Наследственность лишь выращенных в таких условиях животных можно правильно оценить по их происхождению и качеству получаемого от них потомства. Подобная оценка животных дает возможность судить о степени устойчивости наследственной основы организма и его способности в той или иной мере передавать свои свойства потомству; она имеет особо важное значение в племенном животноводстве.[ …]
Генотип организма определяют путем наблюдения его действия (реализации генетической информации) и влияния на фенотип в условиях определенной среды. Когда два или несколько организмов растут и развиваются в одинаковых условиях, но фенотипы их различны, то это означает, что такие организмы имеют разные генотипы.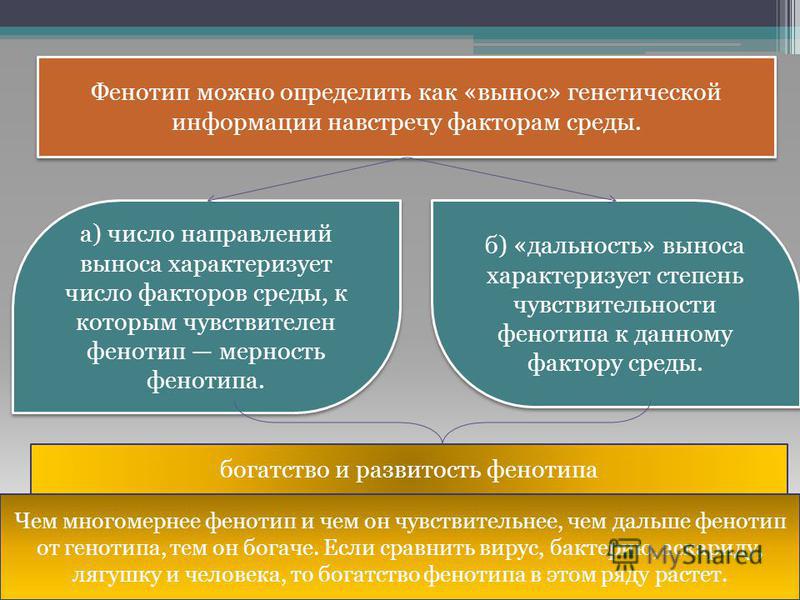 Строго говоря, фенотипы являются результатом взаимодействия различных генов (компонентов генотипа) между собой и генотипа со средой. Поэтому нельзя думать, что организм или ка-кие-либо признаки организма зависят исключительно только от генотипа или только от среды. Два одинаковых генотипа могут развиваться в разных условиях и дать разные фенотипы. Точно так же два разных генотипа могут развиваться в условиях одинаковой среды и дать разные фенотипы. Кроме того, если организмы, развивающиеся в условиях сходной или неодинаковой среды, имеют сходные фенотипы, это еще не означает, что их генотипы одинаковы. В таких случаях часто имеет значение доминантность признаков, которая может осложнять установление генотипа.[ …]
Строго говоря, фенотипы являются результатом взаимодействия различных генов (компонентов генотипа) между собой и генотипа со средой. Поэтому нельзя думать, что организм или ка-кие-либо признаки организма зависят исключительно только от генотипа или только от среды. Два одинаковых генотипа могут развиваться в разных условиях и дать разные фенотипы. Точно так же два разных генотипа могут развиваться в условиях одинаковой среды и дать разные фенотипы. Кроме того, если организмы, развивающиеся в условиях сходной или неодинаковой среды, имеют сходные фенотипы, это еще не означает, что их генотипы одинаковы. В таких случаях часто имеет значение доминантность признаков, которая может осложнять установление генотипа.[ …]
Примером полудоминантной мутации может служить мутационное образование гетерозиготной формы Аа, промежуточной по фенотипу между организмами АА и аа. Это имеет место в случае биохимических признаков, когда вклад в признак обоих аллелей одинаков.[ …]
Преобладание животных морфы striata среди взрослых особей озерной лягушки на городской территории свидетельствует в пользу того, что этот фенотип обладает селективными преимуществами в популяциях техногенной зоны Уральского региона.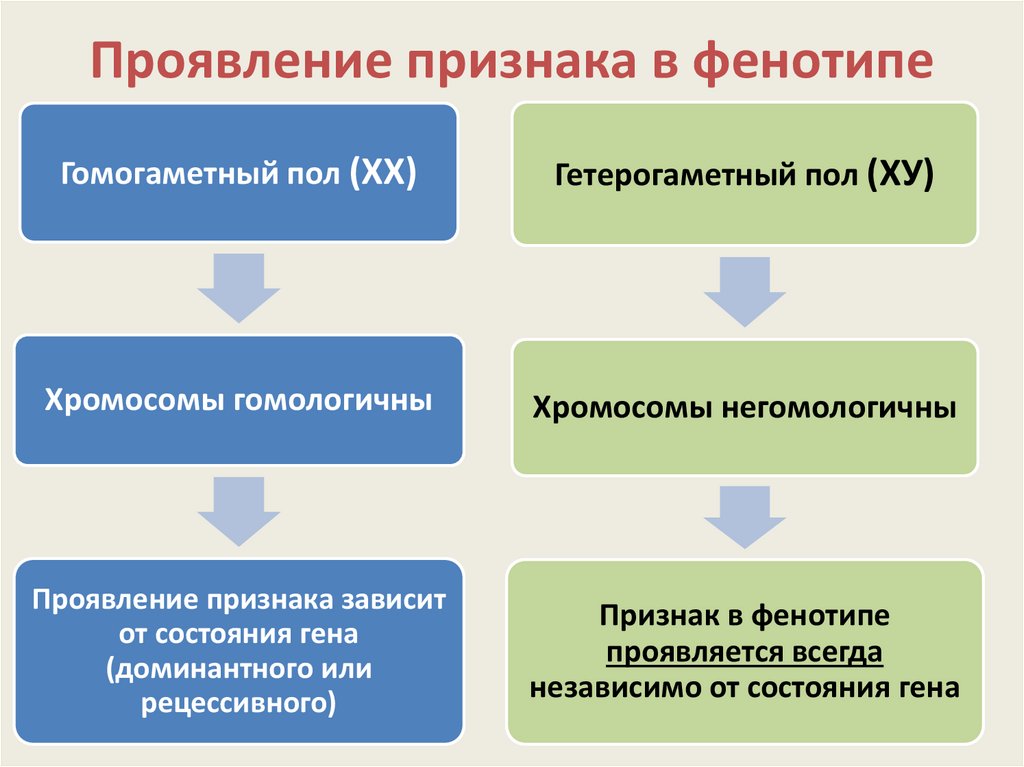 Удалось показать, что успешному освоению новых местообитаний за пределами естественного ареала способствует высокий адаптивный потенциал озерной лягушки, значительную роль в котором играют наследственно обусловленные особенности системы гемопоэза морфы striata (Силс, Вершинин, 2 004).[ …]
Удалось показать, что успешному освоению новых местообитаний за пределами естественного ареала способствует высокий адаптивный потенциал озерной лягушки, значительную роль в котором играют наследственно обусловленные особенности системы гемопоэза морфы striata (Силс, Вершинин, 2 004).[ …]
Большинство генов довольно устойчива по отношению к мутациям, однако известны гены, которые мутируют очень часто. Как правило, мутантный фенотип организмов является одинаковым, независимо от того, наследуется ли генная мутация от отца или матери. Тем не менее небольшое число генов у человека и мышей экспрессируется дифференциально, причем в зависимости от источника наследования мутантного гена (от отца или матери). Во всех случаях один из родительских аллелей полностью инактивируется, тогда как другой аллель является активным. Напоминая инактивацию Х-хромосом, это явление получило название генетического импринтинга. Следовательно, генетический импринтинг представляет собой явление неэквивалентности генных аллелей, активность которых зависит от родительского происхождения. Например, патологический синдром Прадела-Вилли у человека обязан мутации, которая встречается только в отцовском хромосомном гомологе, а синдром Ангельмана у человека возникает в результате мутации в материнском хромосомном гомологе.[ …]
Например, патологический синдром Прадела-Вилли у человека обязан мутации, которая встречается только в отцовском хромосомном гомологе, а синдром Ангельмана у человека возникает в результате мутации в материнском хромосомном гомологе.[ …]
Вся совокупность признаков, отличающих термофилы от мезофилов, наследственно 8акреплена, закодирована в процессе эволюции в генотипе. Эта закодированная информация реализуется в фенотипе только при определенных условиях — при повышенной температуре, т.е. при температура, оптимальной именно для термофлов. Следовательно, термофи-г ды — это особая группа организмов со специфическая, только им присущи-чертами строения, протекания биохимических реакций и условий существования .[ …]
Основное преимущество массового отбора состоит в его относительной простоте. Селекционер работает с многочисленным материалом, что позволяет достигать высокой эффективности отбора. Однако оценка по фенотипу при массовом отборе не позволяет достоверно судить о генетической ценности отбираемой особи. [ …]
[ …]
У клетки это ее особое состояние повышенной резистентности, служащее первой фазой фенотипического приспособительного процесса. В результате стресса в фенотипе клетки проявляются признаки, заложенные в генотипе, пробуждаются (экспрессируются) «спящие» гены. Видимым изображением их деятельности являются: индукция синтеза адаптивных ферментов, модификации и др., т.е. ненасле-дуемые структурно-функциональные изменения. Молекулярный механизм появления последних был разработан Ф. Жакобом и Ж. Мано. Названные изменения возникают в клетке при уровне возмущающего воздействия, который соответствует первому максимуму чувствительности (и несколько выше) дозовой кривой реагирования живой системы (рис. 20). В этих условиях вероятность появления новых мутантных форм, изменение генофонда популяции крайне мала.[ …]
Таким образом, совокупность всех генов организма определяет его генотип; совокупность всех признаков организма, начиная с внешних и кончая особенностями строения и функционирования клеток и органов, составляет фенотип. Следовательно, генотип определяет поведение вида, тогда как фенотип — характеризует только конкретную особь. Фенотип формируется под влиянием генотипа и условий внешней среды.[ …]
Следовательно, генотип определяет поведение вида, тогда как фенотип — характеризует только конкретную особь. Фенотип формируется под влиянием генотипа и условий внешней среды.[ …]
Для общего выражения племенной ценности животного по ряду признаков с учетом их взаимосвязи разработаны так называемые селекционные индексы. Они могут быть основаны либо на показателях оцениваемого животного (на фенотипе пробанда), либо на сочетании показателей пробанда с показателями родственников (матери, сестер, полусестер и т. д.). Для правильного построения индекса по наиболее важным признакам важно знать фенотипическую и генотипическую корреляцию между этими признаками и относительную их экономическую ценность. Подобно наследуемости, селекционный индекс основывается на простых линейных связях и не учитывает эффекта гетерозиса, эпистаза и взаимодействия между генотипом и окружающей средой. Поэтому чем большая доля общей изменчивости обусловлена эффектом такого взаимодействия, тем меньшее значение имеет селекционный индекс.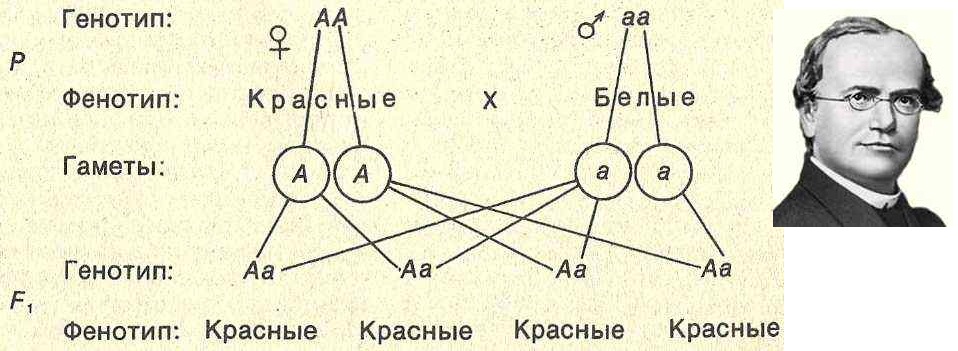 [ …]
[ …]
Третий отбор козликов проводится в возрасте 1-1,5 лет основе данных о происхождении, индивидуальной бонитир« ки и продуктивности (начеса пуха, настрига шерсти и жив массы). Осенью из ремонтной группы выбирают самых л; ших по фенотипу козликов в количестве, превышающем требность в 3 раза.[ …]
Обратные мутации представляют собой реверсии к исходным (диким) типам от мутантных. Эти реверсии бывают двух типов. Одни из реверсий обусловлены повторными мутациями аналогичного сайта или локуса с восстановлением исходного фенотипа и их называют истинными обратными мутациями. Другие реверсии представляют собой мутации в каком-то другом гене, которые изменяют выражение мутантного гена в сторону исходного типа, т. е. повреждение в мутантном гене сохраняется, но он как бы восстанавливает свою функцию, в результате чего восстанавливается фенотип. Как правило, супрессии происходят в результате мутаций генов, кодирующих синтез тРНК и рибосом.[ …]
Формула Харди-Вайнберга пригодна лишь для предельно упрощенной ситуации, для идеальной бесконечно большой популяции (иногда ее называют «менделевской») и при отсутствии давления ка-ких-либо факторов. Кроме того, как известно, на частоту фенотипов оказывает влияние не только частота данного аллеля, но и такие его свойства, как доминантность, рецессивность, пенетрантность и экспрессивность. Таким образом, при анализе природных популяций данная формула применима лишь с большими оговорками.[ …]
Кроме того, как известно, на частоту фенотипов оказывает влияние не только частота данного аллеля, но и такие его свойства, как доминантность, рецессивность, пенетрантность и экспрессивность. Таким образом, при анализе природных популяций данная формула применима лишь с большими оговорками.[ …]
Доминантные мутации характеризуются непосредственным эффектом на организм, полудоминантные мутации заключаются в том, что гетерозиготная форма по фенотипу является промежуточной между формами АА и аа, а для кодоминантных мутаций характерно то, что у гетерозигот А!Аз проявляются признаки обоих аллелей. Рецессивные мутации не проявляются у гетерозигот.[ …]
Разведение тиляпии в нашей стране базируется главным образом на индустриальных методах выращивания. Важное значение при этом приобретает племенная работа. Основным методом селекции тиляпий в настоящее время является массовый отбор, предполагающий сохранение на племя лучших по фенотипу особей. Важнейшими направлениями селекции тиляпии являются: ускорение роста, лучшее использование корма, повышение устойчивости к низким температурам, замедленное половое созревание.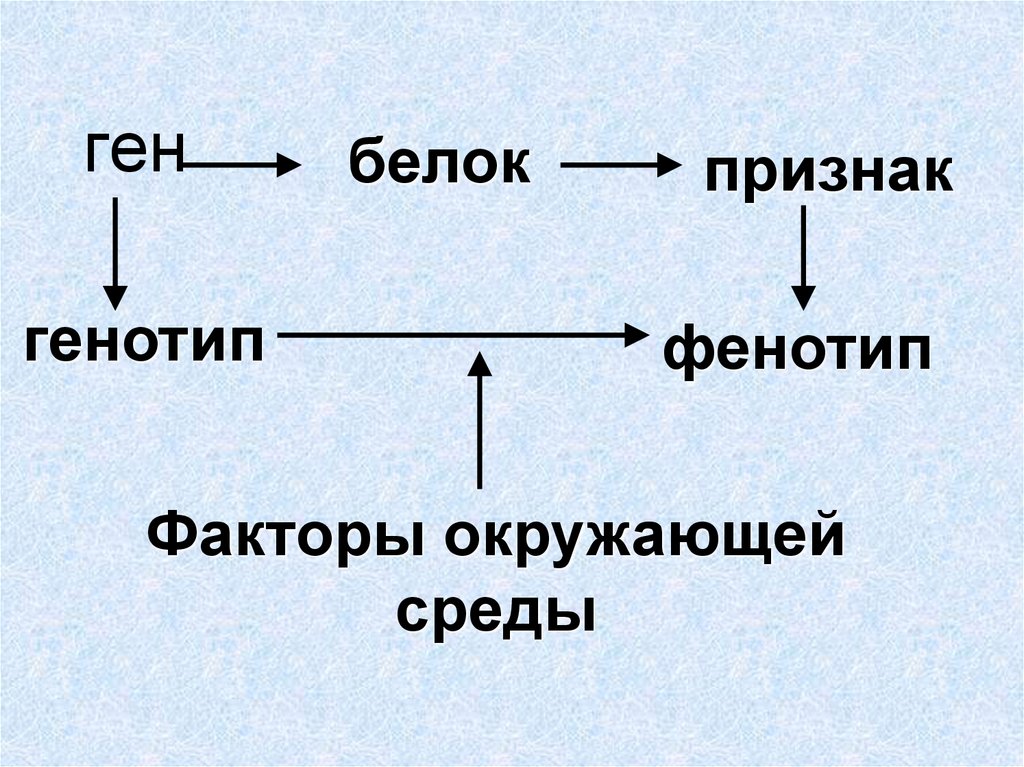 [ …]
[ …]
Для надежной оценки генетической изменчивости популяций или стад животных желательно исследовать до 20 и более белковых локусов.[ …]
Концепция «адаптивной нормы» популяций отвергает типологическое представление о генетической структуре вида и постулирует, что за внешне «нормальными», наиболее приспособленными «средними» фенотипами стоит множество разнообразных генотипов, селективная ценность которых может меняться в условиях изменяющейся среды. Это обеспечиват ет широкую норму реакции популяции как целостной системы на флуктуирующие условия внешней среды, т. е. ее экологическую пластичность. Вопрос же об общем числе полиморфных локусов генома и механизмах поддержания изменчивости — одна из главных проблем в современной популяционной генетике и, соответственно, главный источник противоречий между приверженцами типологической и популяционной, балансовой концепции генетической структуры вида.[ …]
Обусловленный генетическими различиями более высокий уровень гранулоцитов гарантирует от гемодепрессии и определяет высокие адаптивные способности морфы striata в условиях резких изменений среды (Вершинин, 2004). С возрастом, у особей striata (в отличие от бесполосых) значительно растет число эритроцитов и лейкоцитов, что увеличивает их индивидуальный адаптивный потенциал. Наиболее интересным, на наш взгляд, представляется разнонаправленное возрастное изменение доли нейтрофилов для полосатых и бесполосых. Возможно, это является одной из причин резкого преобладания фенотипа striata среди взрослых особей в городских популяциях.[ …]
С возрастом, у особей striata (в отличие от бесполосых) значительно растет число эритроцитов и лейкоцитов, что увеличивает их индивидуальный адаптивный потенциал. Наиболее интересным, на наш взгляд, представляется разнонаправленное возрастное изменение доли нейтрофилов для полосатых и бесполосых. Возможно, это является одной из причин резкого преобладания фенотипа striata среди взрослых особей в городских популяциях.[ …]
Однако данные по внутривидовой аллозимной изменчивости не: могут служить достаточно надежным показателем при оценках, закономерностей генетического процесса и особенностей экологически разнородных групп видов. Они должны быть дополнены анализом структурных и регуляторных особенностей анализируемых изоферментов с целью оценки межвидового разнообразия фаунистических комплексов по данным параметрам. Выделение, структурных вариантов (типов) изоферментов выполнено по показателям относительной электрофоретической подвижности и по числу полос. Гетерозиготные фенотипы у полиморфных по структурным генам видов принимались во внимание, но в анализ вводились только гомозиготные. Варианты регистрировались, если различия между ними были сопоставимы или превышали соответствующие аллельные различия по данному изоферменту (рис. 90).[ …]
Варианты регистрировались, если различия между ними были сопоставимы или превышали соответствующие аллельные различия по данному изоферменту (рис. 90).[ …]
Полученные результаты говорят о том, что между бурозубками из разных биотопов, удаленных друг от друга незначительно, существуют некоторые различия в морфологии черепа. Они едва улавливаются довольно чувствительным методом дискриминантного анализа, но вряд ли являются случайными, так как использовано большое число признаков. Возможно, что эти различия вызваны не разными условиями обитания, а колебаниями численности обыкновенной бурозубки. В весенний период происходит массовая гибель особей. Резкое снижение численности может дать эффект «бутылочного горлышка», когда соотношения долей разных фенотипов в удаленных друг от друга биотопах будет неодинаковым. Данное утверждение требует дальнейшей проработки на более массовом материале, особенно из предгорного района Печоро-Илычского заповедника, где фрагментация рельефа выше и подобная картина может проявиться более четко. [ …]
[ …]
Анализ сыворотки крови карпов семи породных групп и линий из четырех хозяйств показал наличие пяти аллотипов трансферрина. Особи гомо- гетерозиготные по типам белка А, В и С встречались почти во всех группах рыб и количественно преобладали. Вариант О встречался гораздо реже, он был обнаружен у куболт-ских и местных беспородных карпов, что является результатом наследственности амурского сазана. Нарушение закона можно было наблюдать лишь у днестровского и мындыкского карпов, что было вызвано в основном недостатком гомозиготных фенотипов. У остальных групп преобладали гомозиготы, причем у украинских и данченских карпов — тип АА, у местных — ВВ. Этим, видимо, и объясняется высокий гетерозисный эффект при скрещивании нивчанско-го карпа с местными селекционными.[ …]
Таким образом, проведенный анализ показал специфичность нерестовых стад плотвы Рыбинского водохранилища, подтверждённую анализом другой системы признаков, описывающих строение каналов сейсмосенсорной системы головы.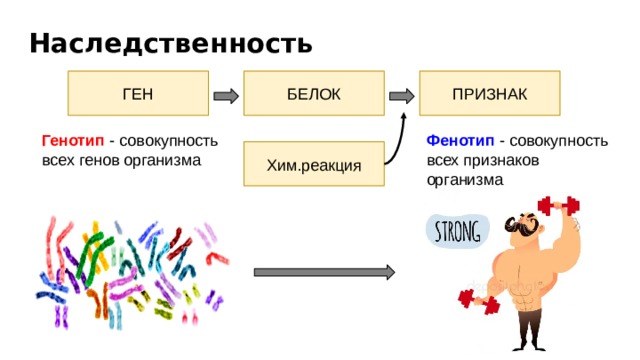 Наиболее сходны выборки из Шекснинского плеса и устья р. Согожи, от них достоверно отличается объединенная выборка из Волжского плеса. .Наибольшим своеобразием обладает выборка из Моложского плеса. По данным признакам различия между возрастными группами, а также самцами и самками в отдельных нерестовых стадах, как правило, недостоверны. Специфичность некоторых возрастных групп в пределах нерестового стада связана, по всей видимости, со сложным миграционным поведением и требует дополнительного исследования. Выявленные фенетические различия между нерестовыми группировками из разных плесов свидетельствуют, об их репродуктивной изоляции я, соответственно, о принадлежности к разным локальным популяциям. Частоты встречаемости различных фенотипов позвоночника являются специфичными; для1 изолированных популяций и могут использоваться в более детальном популяционном анализе плотвы Рыбинского водохранилища.[ …]
Наиболее сходны выборки из Шекснинского плеса и устья р. Согожи, от них достоверно отличается объединенная выборка из Волжского плеса. .Наибольшим своеобразием обладает выборка из Моложского плеса. По данным признакам различия между возрастными группами, а также самцами и самками в отдельных нерестовых стадах, как правило, недостоверны. Специфичность некоторых возрастных групп в пределах нерестового стада связана, по всей видимости, со сложным миграционным поведением и требует дополнительного исследования. Выявленные фенетические различия между нерестовыми группировками из разных плесов свидетельствуют, об их репродуктивной изоляции я, соответственно, о принадлежности к разным локальным популяциям. Частоты встречаемости различных фенотипов позвоночника являются специфичными; для1 изолированных популяций и могут использоваться в более детальном популяционном анализе плотвы Рыбинского водохранилища.[ …]
Разнообразие — более чем приправа к жизни, оно квинтэссенция ее. Различия между садовыми растениями колеблются от очень заметных (водяная лилия и арбуз) до едва различимых, которые могут существовать между двумя растущими рядом яблонями одного и того же клопового сорта. Изменчивость может быть разделена на два типа: вызываемую условиями внешней среды и наследственную. Генетические различия обусловливаются наследственными особенностями организмов. Изменчивость можно проследить по различиям в генах — основных единицах, определяющих наследственность. Изменчивость, возникающая под влиянием условий окружающей среды, может быть обнаружена путем сравнения генетически однородных организмов, выращенных в разных условиях среды. Генетическое строение организма выражается термином генотип, общий внешний вид организма — фенотип. В более точном значении фенотип — производное взаимодействия генотипа с внутренними и внешними факторами окружающей среды.[ …]
Изменчивость может быть разделена на два типа: вызываемую условиями внешней среды и наследственную. Генетические различия обусловливаются наследственными особенностями организмов. Изменчивость можно проследить по различиям в генах — основных единицах, определяющих наследственность. Изменчивость, возникающая под влиянием условий окружающей среды, может быть обнаружена путем сравнения генетически однородных организмов, выращенных в разных условиях среды. Генетическое строение организма выражается термином генотип, общий внешний вид организма — фенотип. В более точном значении фенотип — производное взаимодействия генотипа с внутренними и внешними факторами окружающей среды.[ …]
Генотип и фенотип
Здравствуйте, уважаемые читатели блога репетитора биологии по Скайпу biorepet-ufa.ru.
Вот такая получается «петрушка», если не сказать хуже. Очередной раз сталкиваюсь с тем, что основополагающие понятия генетики в учебниках преподносятся так, что разобраться в них бывает трудно.
Эту статью меня так и подмывало назвать сначала «Фенотип и генотип». Понятно, что фенотип вторичен от генотипа. Но если сам термин «генотип» учащиеся чаще всего могут истолковать правильно, то относительно понятия «фенотипа», как выясняется, нет четкого представления.
Да откуда же ему быть «четкому», если определения фенотипа в учебной литературе носят такой расплывчатый характер.
«Фенотип — совокупность всех внешних признаков организма, определяемых генотипом и условиями окружающей среды». Или «Фенотип — совокупность всех внешних и внутренних признаков и свойств организма, зависящих от генотипа и условий внешней среды».
А если действительно и «внешних», и «внутренних», а это на самом деле так, то в чем тогда отличие фенотипа от генотипа?
Всё же придется начинать не с «хвоста», а с «головы». Уверен, пройдет пара минут и вы, несколько уточнив для себя, что такое «генотип организма», сможете получить более четкое представление и о «фенотипе».
Часто термины «признак» и «ген» мы используем как синонимы
Говорят, «генотип — совокупность всех признаков организма». И вот тут то важно понять самое главное — именно к определению генотипа такое определение вносит дополнительную путаницу. Да, действительно, информация о любом признаке закодирована в каком-либо гене (или совокупности генов) организма.
Но всех генов очень много, весь генотип организма огромен, а в течение жизни данной особи или отдельной клетки реализуется (то есть служит образованию каких-либо определенных признаков) лишь незначительная часть генотипа.
Поэтому правильным будет запомнить, что «генотип — совокупность всех генов организма». А уж какие из этих генов реализуются в течение жизни организма в его фенотипе , то есть послужат образованию каких-либо признаков — это зависит как от взаимодействия множества этих генов, так и от конкретных условий окружающей среды.
Таким образом, если правильно понимать, что собой представляет генотип, то не остается и лазейки для путаницы в терминах, обозначающих, что такое «генотип», а что такое «фенотип».
Понятно, что «фенотип — это совокупность всех реализовавшихся в течение жизни организма генов, послуживших образованию конкретных признаков данного организма в определенных условиях среды».
Поэтому на протяжении жизни организма, под действием меняющихся условий среды, фенотип может изменяться, хотя он и базируется на том же самом неизменном генотипе. А в каких границах может меняться фенотип?
Норма реакцииЭти границы для фенотипа четко очерчены генотипом и носят название «нормы реакции». В фенотипе ведь не может проявиться ничего того, чего бы не было уже «записано» ранее в генотипе.
Чтобы лучше понять, что вкладывается в понятие «нормы реакции», разберем на конкретных примерах возможного проявления «широкой» или «узкой» нормы реакции.
Вес (масса) коровы и удойность коровы, какой признак имеет более широкую, а какой более узкую норму реакции?
Понятно, что вес взрослой коровы определенной породы как ее хорошо ни корми не может превысить, к примеру, 900 кг, а при плохом содержании — не может быть меньше 600 кг.
А удойность? При оптимальном содержании и кормлении удойность может меняться от каких-то максимально возможных для данной породы величин, она может упасть до 0, при неблагоприятных условиях содержания. Значит масса коровы имеет довольно узкую норму реакции, а удойность — очень широкую.
Пример с картофелем. Любому очевидно, что «вершки» имеют довольно узкую норму реакции, а масса клубней — очень широкую.
Думаю, теперь всё «устаканилось». Генотип — множество всех генов организма, это весь его потенциал на что он может быть способен в жизни. А фенотип — лишь проявление небольшой части этого потенциала, реализация лишь части генов организма в ряд конкретных признаков в течение его жизни.
Наглядным примером реализации в течение жизни организма части его генотипа в фенотип, являются однояйцевые близнецы. Имея абсолютно одинаковый генотип, в первые годы жизни они почти неотличимы друг от друга фенотипически. Но взрослея, имея сначала незначительные отличия в поведении, в каких-то привязанностях, отдавая предпочтение тому или иному роду деятельности, эти близнецы становятся довольно отличимыми и фенотипически: по выражению лица, строению тела.
В конце этой заметки, я бы хотел вот на что ещё обратить ваше внимание. Слово генотип для изучающих основы генетики имеет как бы два смысла. Выше мы разобрали значение «генотипа» в широком его понимании.
Но для уяснения законов генетики, при решении генетических задач, под словом генотип подразумевают лишь сочетание каких-то конкретных отдельных аллелей одной (моногибридное скрещивание) или двух (дигибридное скрещивание) пар определенных генов, контролирующих проявление конкретного одного или двух признаков.
То есть, и фенотип то у нас при этом какой-то усеченный, говорим «фенотип организма», а сами изучили механизм наследования лишь одного, двух его признаков. В широком же смысле термин «фенотип» относится к любым морфологическим, биохимическим, физиологическим и поведенческим характеристикам организмов.
P.S. В связи с характеристиками понятий «генотип» и «фенотип», уместным было бы здесь разобрать вопрос о наследственной и ненаследственной формах изменчивости организмов. Ну да ладно, об этом как раз и поговорим в следующей статье.
******************************************************************
У меня на блоге вы можете приобрести ответы на все тесты ОБЗ ФИПИ за все годы проведения экзаменов по ЕГЭ и ОГЭ (ГИА).
10.Фенотип и генотип — их различия
Генотип
— это совокупность всех генов организма,
являющихся его наследственной
основой.
Фенотип — совокупность всех
признаков и свойств организма, которые
выявляются в процессе индивидуального
развития в данных условиях и являются
результатом взаимодействия генотипа
с комплексом факторов внутренней и
внешней среды. Фенотип в общем случае
— это то, что можно увидеть (окрас кошки),
услышать, ощутить (запах), а также
поведение животного.
У гомозиготного
животного генотип совпадает с фенотипом,
а у гетерозиготного — нет.
Каждый
биологический вид имеет свойственный
только ему фенотип. Он формируется в
соответствии с наследственной информацией,
заложенной в генах. Однако в зависимости
от изменений внешней среды состояние
признаков варьирует от организма к
организму, в результате чего возникают
индивидуальные различия — изменчивость.
45.
Цитогенетический мониторинг в
животноводстве.
Фенотип в общем случае
— это то, что можно увидеть (окрас кошки),
услышать, ощутить (запах), а также
поведение животного.
У гомозиготного
животного генотип совпадает с фенотипом,
а у гетерозиготного — нет.
Каждый
биологический вид имеет свойственный
только ему фенотип. Он формируется в
соответствии с наследственной информацией,
заложенной в генах. Однако в зависимости
от изменений внешней среды состояние
признаков варьирует от организма к
организму, в результате чего возникают
индивидуальные различия — изменчивость.
45.
Цитогенетический мониторинг в
животноводстве.
Организация
цитогенетического контроля должна
строиться с учетом ряда основных
принципов. 1. необходимо организация
оперативного обмена информацией межу
учреждениями, занимающимися вопросами
цитогенетического контроля, с этой
целью необходимо создание единого банка
данных, который включал бы сведения о
носителях хромосомной патологии. 2.
включение сведений о цитогенетической
характеристике животного в племенные
документы.
Цитогенетическое обследование в регионах осуществляется с использованием информации о распространенности хромосомных аномалий в породах и линиях:
1) породы и линии, в которых зарегистрированы случаи хромосомной патологии, передающейся по наследству , а также потомки носителей хромосомных аномалий при отсутствии на них цитогенетического паспорта;
2) породы и линии, не исследованные цитогенетически ранее;
3) все случаи массового нарушения репродукции или генетической патологии неясной природы.
В
первую очередь обследованию подлежат
производители и самцы, предназначенные
для ремонта стада, а также племенной
молодняк двух первых категорий.
Хромосомные аберрации можно разделить
на два больших класса: 1.конституциональные
– присущие всем клеткам, унаследованные
от родителей или возникшие в процессе
созревания гамет и 2. соматические –
возникающие в отдельных клетках в ходе
онтогенеза. С учетом генетической
природы и фенотипического проявления
хромосомных аномалий несущие их животные
могут быть подразделены на четыре
группы: 1) носители наследуемых аномалий
с предрасположенностью к снижению
репродуктивных качеств в среднем на 10
%. Теоретически 50 % потомков наследуют
патологию. 2) носители наследуемых
аномалий, приводящих к четко выраженному
снижению репродукции (30-50 %) и врожденной
патологии. Около 50 % потомков наследуют
патологию.
С учетом генетической
природы и фенотипического проявления
хромосомных аномалий несущие их животные
могут быть подразделены на четыре
группы: 1) носители наследуемых аномалий
с предрасположенностью к снижению
репродуктивных качеств в среднем на 10
%. Теоретически 50 % потомков наследуют
патологию. 2) носители наследуемых
аномалий, приводящих к четко выраженному
снижению репродукции (30-50 %) и врожденной
патологии. Около 50 % потомков наследуют
патологию.
3) Животные с аномалиями, возникающими de novo, приводящими к врожденной патологии (моносомии, трисомии и полисомии в системе аутосом и половых хромосом, мозаицизм и химеризм). В подавляющем большинстве случаев такие животные бесплодны. 4) Животные с повышенной нестабильностью кариотипа. Репродуктивная функция снижена, возможна наследственная предрасположенность.
46.
плейтропия (множественное действие
генов)
Плейотропное
действие генов — это зависимость
нескольких признаков от одного гена,
то есть множественное действие одного
гена. Плейотропное действие гена
может быть первичным и вторичным. При
первичной
плейотропии ген проявляет свой
множественный эффект.
При
вторичной
плейотропии есть один первичный
фенотипний проявление гена, вслед за
которым развивается ступенчатый процесс
вторичных изменений, приводящих к
множественным эффектам. При плейотропии,
ген, воздействуя на какой то один основной
признак, может также менять, модифицировать
проявление других генов, в связи с чем
введено понятие о генах-модификаторах.
Последние усиливают или ослабляют
развитие признаков, кодируемых «основным»
геном.
Показателями зависимости
функционирования наследственных
задатков от характеристик генотипа
является пенетрантность и
экспрессивность.
Рассматривая действие
генов, их аллелей необходимо учитывать
и модифицирующее влияние среды, в которой
розвивается организм. Такое колебание
классов при расщеплении в зависимости
от условий среды получило название
пенетрантность — сила фенотипного
проявления. Итак, пенетрантность — это
частота проявления гена, явление
появления или отсутствия признака у
организмов, одинаковых по
генотипу.
Плейотропное действие гена
может быть первичным и вторичным. При
первичной
плейотропии ген проявляет свой
множественный эффект.
При
вторичной
плейотропии есть один первичный
фенотипний проявление гена, вслед за
которым развивается ступенчатый процесс
вторичных изменений, приводящих к
множественным эффектам. При плейотропии,
ген, воздействуя на какой то один основной
признак, может также менять, модифицировать
проявление других генов, в связи с чем
введено понятие о генах-модификаторах.
Последние усиливают или ослабляют
развитие признаков, кодируемых «основным»
геном.
Показателями зависимости
функционирования наследственных
задатков от характеристик генотипа
является пенетрантность и
экспрессивность.
Рассматривая действие
генов, их аллелей необходимо учитывать
и модифицирующее влияние среды, в которой
розвивается организм. Такое колебание
классов при расщеплении в зависимости
от условий среды получило название
пенетрантность — сила фенотипного
проявления. Итак, пенетрантность — это
частота проявления гена, явление
появления или отсутствия признака у
организмов, одинаковых по
генотипу.
Множественное или плейотропное действие генов связывают с тем, на какой стадии онтогенеза проявляются соответствующие аллели. Чем раньше проявится аллель, тем больше эффект плейотропии.
Учитывая плейотропный эффект многих генов, можно предположить, что часто одни гены выступают в роли модификаторов действия других генов.
47.
современные биотехнологии в животноводстве.
Применение селекцион.- ген-ое.значение(исск.осем;
транспл.
Интернет-коллекция ассоциаций генотип-фенотип при наследственных возвратных лихорадках из реестра Eurofever | Orphanet Journal of Rare Diseases
- Исследования
- Открытый доступ
- Опубликовано:
- Риккардо Папа ORCID: orcid.org/0000-0002-9626-5470 1 ,
- Маттео Доглио 1 ,
- Helen J. Lachmann 2 ,
- Seza Ozen 3 ,
- Joost Frenkel 4 ,
- Anna Simon 5 , 9004
- ,
- Anna Simon 5 . -Дшнер 7 ,
- Huri Ozgodan 8 ,
- Roberta Caorsi 1 ,
- Silvia Federici 1 ,
- Martina 1 , 995004 9009 9959004 9000 900499004 900499004 900499004990049900499.
- Jurgen Brunner 10 ,
- Liliana Bezrodnik 11 ,
- Mari Carmen Pinedo Gago 12 ,
- Maria Cristina Maggio 13 , 9.
- . . 15 ,
- Graciela Espada 16 ,
- Anna Shcherbina 17 ,
- Guzide Aksu 18 ,
- Nicolino Ruperto 1 ,
- Alberto Alberto Alberto 1 ,
- Alberto Albertotto 1 ,
- Alberto Albertotto 1 , 9000
- A.0014 19 ,
- Isabella Ceccherini 20 и
- Marco Gattorno 1
- для Международной организации по изучению детской ревматологии (PRINTO) и проекта Eurofever 444 Orphanet Journal of Rare Diseases том 12 , номер статьи: 167 (2017) Процитировать эту статью
3550 Доступ
44 Цитаты
1 Альтметрический
Сведения о показателях
- ЗАГЛАВНЫЕ БУКВЫ:
Криопирин-ассоциированный периодический синдром
- FMF:
Знакомая средиземноморская лихорадка
- HRF:
Наследственные возвратные лихорадки
- МКД:
Дефицит мевалонаткиназы
- ЛОВУШКИ:
Синдром периодической лихорадки, связанный с TNF-рецептором
Milhavet F, Cuisset L, Hoffman HM, et al. Онлайн-реестр аутовоспалительных мутаций infevers: пополнение новыми генами и функциями. Хум Мутат. 2008;29(6): 803–8.
Артикул пабмед Google ученый
Озен С., Френкель Дж., Руперто Н., Гатторно М. Проект Eurofever: на пути к лучшему лечению аутовоспалительных заболеваний. Eur J Педиатр. 2011; 170:445–52.
Артикул пабмед Google ученый
Озен С., Демиркая Е., Амарян Г. и др. Результаты многоцентрового международного регистра семейной средиземноморской лихорадки: влияние окружающей среды на проявление моногенного заболевания у детей.

Артикул пабмед Google ученый
Lachmann HJ, Papa R, Minden K, et al. Фенотип аутовоспалительного синдрома, связанного с TNF-рецептором (TRAPS), при поступлении: серия из 158 случаев из международного регистра Eurofever/EUROTRAPS. Энн Реум Дис. 2014;73:2160–7.
КАС Статья пабмед Google ученый
Леви Р., Жерар Л., Кюммерле-Дешнер Дж. и др. Фенотипические и генотипические характеристики криопирин-ассоциированного периодического синдрома: серия из 136 пациентов из регистра Eurofever. Энн Реум Дис. 2015;74:2043–9.
КАС Статья пабмед Google ученый
Тер Хаар Н.М., Джеяратнам Дж., Лахманн Х.Дж. и др. Фенотип и генотип дефицита мевалонаткиназы: серия из 114 случаев из регистра Eurofever. Артур Реум.
 2016;68:2795–805.
2016;68:2795–805.КАС Статья Google ученый
Черничко Д.О. Жерар-Бланлюэ М., Лежандр М. и др. Анализ внутрисемейной сегрегации аллеля p.E148Q MEFV при семейной средиземноморской лихорадке. Энн Реум Дис. 2006;65:1154–7.
КАС Статья пабмед ПабМед Центральный Google ученый
Райан Дж.Г., Мастерс С.Л., Бути М.Г. и др. Клинические особенности и функциональное значение варианта P369S/R408Q в пирине, белке семейной средиземноморской лихорадки. Энн Реум Дис. 2010;69:1360–3.
Артикул Google ученый
Ravet N, Ruaghe S, Dodè C. и др. Клиническое значение P46L и R9Замены 2Q в гене суперсемейства фактора некроза опухоли 1А. Энн Реум Дис. 2006; 65: 1158–62.
КАС Статья пабмед ПабМед Центральный Google ученый
«>Рибер Н., Гаврилов А., Хофер Л. и др. Функциональный анализ активации воспалительных заболеваний позволяет дифференцировать пациентов с патогенными мутациями NLRP3 и симптоматических пациентов с вариантами с низкой пенетрантностью. Клин Иммунол. 2015; 157:56–64.
КАС Статья пабмед Google ученый
Населли А., Пенко Ф., Кантарини Л. и др. Клинические характеристики пациентов с вариантом Q703K гена NLRP3: 10-летнее многоцентровое национальное исследование.
 J Ревматол. 2016;43:1093–100.
J Ревматол. 2016;43:1093–100.Артикул пабмед Google ученый
Шинар Ю., Обичи Л., Аксентьевич И. и др. Руководство по генетической диагностике наследственных возвратных лихорадок. Энн Реум Дис. 2012;71:1599–605.
КАС Статья пабмед ПабМед Центральный Google ученый
Ammouri W, Cuisset L, Rouaghe S, et al. Диагностическое значение уровня сывороточной иммуноглобулинемии D у пациентов с клиническим подозрением на синдром гипер-IgD. Ревматол (Оксфорд). 2007; 46: 1597–600.
КАС Статья Google ученый
Eular Center of Excellence in Rheumatology 2008-2018, IRCCS ISTITUTU Giannina Gasli, Geno, Roselio, Doberiti, Materilic, Doberili, Doberili, Doberili, Doberili, Doberili, Geno, Gano, Gano, Gano, Gano, Gano, Gano, Gano, Gano, Ganohilic, Geno, Gano, Ganohilic, Matherilic, Geno, Matherilic, Geno, Matherilic, Mato Par. & Marco Gattorno
Национальный центр амилоидоза, кампус Royal Free, Медицинское отделение Университетского колледжа, Лондон, Великобритания
Helen J.
 Lachmann
LachmannКафедра детской нефрологии и ревматологии Университета Хасеттепе, Анкара, Турция
Сеза Озен
Отделение педиатрии Университетского медицинского центра, Утрехт, Нидерланды
Йоост Френкель
5 Центр внутренней медицины для иммунодефицита и аутовоспаления, Radboudumc, Nijmegen, НидерландыНациональный справочный центр по ювенильным артритам, Unite d’Immunologie, Hematologie et Rhumatologie Pediatrique, Universite Paris-Descartes, IMAGINE Institute, Hopital Малад, Париж, Франция
Bénédicte Neven
Rheumatologisches Zentrum/Ambulanzfur Autoimmunerkrankungen, Universitatsklinikum Tubingen, Tubingen, Germany
Jasmin Kuemmerle-Deschner
Ic Hastalıkları ABD, Romatoloji BD, Istanbul Universitesi Cerrahpaşa Tıp Fakültesi, Istanbul, Turkey
Huri Ozgodan
Кафедра педиатрии I, Университет Аристотеля в Салониках, Салоники, Греция
Мария Трахана
Department fur Kinder-und Jugendheilkunde, Klinikfur Padiatrie I, Padiatrische Rheumatologie, Medizinische Universität Innsbruck, Innsbruck, Austria
Jurgen Brunner
Immunology Unit, Hospital de Ninos Ricardo Gutierrez, Buenos Aires, Argentina
Liliana Bezrodnik
Unidad de Reumatologia Pediátrica, Hospital Universitario Cruces, Бильбао, Испания
Мари Кармен Пинедо Гаго
Dipartimento Universitario, Ospedale dei Bambini, Palermo, Italy
Maria Cristina Maggio
Pediatric Rheumatology Unit, 1st Department of Pediatrics, Children’s Hospital Aghia Sophia, University of Athens, Athens, Greece
Elena Tsitsami
Department Педиатрии, Медицинский город короля Абдулазиза, Университет медицинских наук имени короля Сауда бин Абдулазиза, Эр-Рияд, Королевство Саудовская Аравия
Wafaa Al Suwairi
Seccion Reumatologia, Hospital de Niños Ricardo Gutierrez, Buenos Aires, Argentina
Graciela Espada
Research Institute for Paediatric Hematology, Moscow, Russia
Anna Shcherbina
EgeUniversitesi Tıp Fakultesi, Pediatrik Romatoloji, Izmir, Turkey
Гузиде Аксу
Direzione Scientifica, IRCCS Институт Джаннина Гаслини, Генуя, Италия
Альберто Мартини
UOC Medical Genetics, IRCCS Istituto Giannina Gaslini, Genoa, Italy
Isabella Ceccherini
- Riccardo Papa
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Matteo Doglio
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Хелен Дж.
 Лахманн
ЛахманнПосмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Seza Ozen
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Joost Frenkel
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Анна Саймон
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Bénédicte Neven
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Jasmin Kuemmerle-Deschner
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Huri Ozgodan
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Roberta Caorsi
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Silvia Federici
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Martina Finetti
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Мария Трачана
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Jurgen Brunner
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Лилиана Безродник
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Академия
- Мари Кармен Пинедо Гаго
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Maria Cristina Maggio
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Елена Цицами
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Академия
- Wafaa Al Suwairi
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Graciela Espada
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Анна Щербина
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Гузиде Аксу
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Николино Руперто
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Alberto Martini
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Изабелла Чеккерини
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Marco Gattorno
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- 001 ABO [ABO]
Фенотип % Частота А 1 34,9 Б 14,0 О 46,6 АБ 4,5 - 002 МНС [МНС]
Фенотип % Частота ММСС 6 ММСС 9,1 ММС 14,4 МНСС 3 МНС 23,3 МНС 22,7 ННСС 0,4 ННсс 15,6 ННС 5,5 - 003 П1ПК [П1ПК]
Фенотип % Частота П 1 + 74,8 Р 1- 25,2 - 004 правая [правая]
Фенотип % Частота См.  резус-фенотипы
резус-фенотипы- 005 Лютеранский [LU]
Фенотип % Частота Лу(а+б–) 0,2 Lu(a–b+) 92,3 Лу(а+б+) 7,5 Лу(а–б–) Редкий - 006 Келл [КЕЛ]
Фенотип % Частота К– к+ 90,9 К+ к– 0,4 К+ к+ 8,7 Кр(а+б–) <0,1 Кр(а–б+) 97,8 Кр(а+б+) 2,2 - 007 Льюис [LE]
Фенотип % Частота Le(a+b–) 22,4 Le(a–b+) 72,3 Le(a–b–) 5,3 - 008 Даффи [FY]
Фенотип % Частота Fy(a+b–) 19,7 Fy(a–b+) 32,7 Fy(a+b+) 47,6 Fy(a–b–) очень редкий - 009 Кидд [JK]
Фенотип % Частота Джк(а+б–) 26,3 Jk(a–b+) 23,6 Джк(а+б+) 50,1 Jk(a–b–) редкий - 010 Диего [DI]*
Фенотип % Частота Ди(а+б–) <0,01 Ди(а-б+) >99,9 Ди(а+б+) <0,1 Вр(а+) <0,01 Wr(b+) Высокая заболеваемость - 011 Yt [YT] *
Фенотип % Частота Yt(a+b–) 91,9 Yt(a–b+) 0,3 Yt(a+b+) 7,8 - 012 Xg [XG]*
Фенотип % Частота Хг(а+) Мужской-65,6 Женщина-88,7 Хг(а–) Мужской-34,4 Женщина-11,3 - 013 Шанна [SC]*
Фенотип % Частота Sc:1,–2 99 Sc:–1,2 Редкий Шелк:1,2 1 Sc:1,–2,Rd+ Редкий Sc:1,–2,Rd+ Редкий - 014 Домброк [DO]*
Фенотип % Частота Делать(а+б–) 18 Делать(а–б+) 33 Делать(а+б+) 49 Гр(а–) Редкий - 015 Колтон [CO]
Фенотип % Частота Со(а+b–) 90 Co(a–b+) 0,5 Со(а+b+) 9,5 - 016 Ландштайнер-Винер [LW]*
Фенотип % Частота ДВ(а+б–) 97 ДВ(а–б+) Редкий ДВ(а+б+) 3 - 017 Чидо/Роджерс [CH/RG]*
Фенотип % Частота Хидофенотип CH/RG: 1,2,3 88,2 CH/RG: 1,–2,3 4,9 CH/RG: 1,2,–3 3,1 CH/RG: –1,–2,–3 3,8 CH/RG: –1,2,-3 Редкий CH/RG: 1,–2,–3 Редкий Фенотип Роджерса CH/RG: 11,12 95 CH/RG: 11,–12 3 CH/RG: –11, –12 2 - 018 Н [В]*
Фенотип % Частота Н Высокая заболеваемость - 019 Кх [ХК]*
Фенотип % Частота Кх Высокая заболеваемость - 020 Гербих [GE]*
Фенотип % Частота Ge:2,3,4 >99,9 Ge:–2,3,4 (тип Юс) Редкий Ge:–2,–3,4 (тип Гербиха) Редкий Ge:–2,–3,–4 (выщелачивание) Редкий - 021 Кромер [CROM]*
Фенотип % Частота Cr a , Tc a , Dr a , Esa Высокая заболеваемость Тк б , Тк с , WES и Низкая заболеваемость - 022 Ручки [кН]*
Фенотип % Частота Кн(а+б–) 94,5 Кн(а–б+) 1 Кн(а+б+) 4,5 Кн(а+б+) 98 Сл(а+) 98 Ук(а+) 92 - 023 Индийский [IN]*
Фенотип % Частота В(а+б–) Редкий В(а–б+) 99,9 В(а+б+) <0,1 - 024 ОК [ОК]*
Фенотип % Частота Ок(а+) 100 Ок(а–) Редкий - 025 Раф [RAPH]*
Фенотип % Частота МЕР2 92 - 026 Джон Милтон Хаген [JMH]*
Фенотип % Частота ДМХ Высокая заболеваемость - 027 Я [Я]*
Фенотип % Частота Я Высокая заболеваемость - 028 Глобозид [GLOB]*
Фенотип % Частота П Высокая заболеваемость - 029 Джилл [GILL]*
Фенотип % Частота ГИЛ Высокая заболеваемость - 030 Rh-ассоциированный гликопротеин [RHAG]*
Фенотип % Частота Дюкло Высокая заболеваемость - 031 ФОРС [ФОРС]*
Фенотип % Частота Высокая заболеваемость Низкая заболеваемость - 032 JR [JR]*
Фенотип % Частота Младший и Высокая заболеваемость - 033 ЛВС [ЛВС]*
Фенотип % Частота Лан Высокая заболеваемость - 034 Вел [ВЭЛ]*
Фенотип % Частота Вел Высокая заболеваемость - 035 CD59*
Фенотип % Частота CD59.  1
1Высокая заболеваемость - 036 Августин [АВГ]*
Фенотип % Частота 1 августа 9 АВГУСТА 20790 >99% - 037 Канно [КАНО]*
Фенотип % Частота КАННО1 - 038 SID [SID]*
Фенотип % Частота Sd(а+) 90% Sd(a-) 10% - 039 ЦТЛ2 [ЦТЛ2]*
Фенотип % Частота ВЕР Высокая заболеваемость РИФ Высокая заболеваемость - 040 PEL [PEL]*
Фенотип % Частота ПЭЛ Высокая заболеваемость - 041 МАМ [МАМ]*
Фенотип % Частота МАМ Высокая заболеваемость - 042 EMM [EMM]*
Фенотип % Частота Эмм Высокая заболеваемость - 043 ABCC1 [ABCC1]*
Фенотип % Частота - 205 Стоимость [СТОИМОСТЬ]*
Фенотип % Частота Cs а 95% Cs б 34% - 207 ли [I]*
Фенотип % Частота Я <1 - 208 Эр [ER]
Фенотип % Частота Эр а >99 Эр б <1 Er3 >99 - 210
Фенотип % Частота Ле с 1 Ле д 6 - 213 [МН ЧО]
Фенотип % Частота HU М 1 Тм Банка Секс Сж - резус-положительный
Результаты серологии и объединенные данные Фенотип Вероятный генотип Сокращенный символ Приблизительная % частота в Австралии Другие возможные генотипы Д+ С+ Е- с+ е+ КкДи CDe/cde р 1 р 35,3 CDE/CDE
CDE/CDED+ C+ E- c- e+ CCDee CDe/CDe Р 1 Р 1 17,3 CDe/CDE D+ C+ E+ c+ e+ CCDEe КДЭ/КДЭ Р 1 Р 2 13,5 CDe/cdE
cDE/Cde
CDE/cde
cDe/CDE
cDe/CdEД+ С- Е+ с+ е+ ccDEe cDE/cde р 2 р 12,3 cDE/cDe
cDe/cdEД+ С- Е+ с+ е- ccDEE кДЭ/кДЭ Р 2 Р 2 2,3 кДЭ/кДЭ Д+ С- Е- с+ е+ ccDee cDE/cDE р 0 р 1,7 cDe/cDe - Резус отрицательный
Результаты серологии и объединенные данные Фенотип Вероятный генотип Сокращенный символ Приблизительная % частота в Австралии Другие возможные генотипы D-C- E- c+ e+ ccdee код/код рр 16,4 D-C+ E- c+ e+ Копия ссдЕе р’р 0,4 D-C- E+ c+ e+ ссдЕе кДЭ/КДЭ р”р 0,7 - Список журналов
- Рукописи авторов HHS
- PMC3525519
- Алмаси Л., Дайер Т.Д., Блангеро Дж.
 Двумерный количественный анализ сцепления признаков: плейотропия по сравнению с совпадающими связями. Генетический эпидемиол. 1997; 14: 953–958. [PubMed] [Google Scholar]
Двумерный количественный анализ сцепления признаков: плейотропия по сравнению с совпадающими связями. Генетический эпидемиол. 1997; 14: 953–958. [PubMed] [Google Scholar] - Амос К.И., де Андраде М., Чжу Д.К. Сравнение многомерных тестов на генетическое сцепление. Хам Херед. 2001; 51: 133–144. [PubMed] [Академия Google]
- Arya R, Blangero J, Williams K, Almasy L, Dyer TD, Leach RJ, O’Connell P, Stern MP, Duggirala R. Факторы фенотипов, связанных с синдромом резистентности к инсулину, связаны с генетическими локациями на хромосомах 6 и 7 в американцы мексиканского происхождения, не страдающие диабетом. Диабет. 2002; 51: 841–847. [PubMed] [Google Scholar]
- Bailey-Wilson JE, Almasy L, de Andrade M, Bailey J, Bickeböller H, Cordell H, Daw W, Goldin L, Goode E, Gray-Mcguire C, Hening W, Jarvik G, Махер Б., Менделл Н., Патерсон А., Райс Дж., Саттен Г., Суарес Б., Виланд В., Уилкокс М., Чжан Х., Зиглер А., МакКлуер Дж.В. Семинар по генетическому анализу 14: Маркерные локусы микросателлитов и SNP для полногеномного сканирования.
 БМС Генет. 2005;6:С1. [Бесплатная статья PMC] [PubMed] [Google Scholar]
БМС Генет. 2005;6:С1. [Бесплатная статья PMC] [PubMed] [Google Scholar] - Белински С.Дж., Чай Х.С., Патак Дж., Талвалкар Дж.А., Лимбург П.Дж., Гуллеруд Р.Э., Сикотт Х., Клее Э.В., Росс Дж.Л., Кохер Дж.П., Кулло И.Дж., Хейт Дж.А., Петерсен Г.М., де Андраде М., Чут К.Г. Mayo Genome Consortia: ресурс генотип-фенотип для полногеномных ассоциативных исследований с применением для анализа уровней циркулирующего билирубина. Мэйо Клин Proc. 2011; 86: 606–614. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Blangero J, Williams JT, Almasy L. Новые семейные подходы к генетическому риску тромбоза. Джей Тромб Хемост. 2003;1:1391–1397. [PubMed] [Google Scholar]
- Чанг Р.Х., Шмидт С., Мартин Э.Р., Хаузер Э.Р. Анализ упорядоченных подмножеств (OSA) для картирования сложных признаков на основе семейных ассоциаций. Генетический эпидемиол. 2008; 32: 627–637. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Cupples LA, Beyene J, Bickeboeller H, Daw EW, Fallin MD, Gauderman WJ, Ghosh S, Goode EL, Hauser ER, Hinrichs A, Kent JW, Jr, Martin Л.
 Дж., Мартинес М., Нойман Р.Дж., Провинция М., Шимчак С., Уилкокс М.А., Циглер А., МакКлуер Дж.В., Алмаси Л. Семинар 16 по генетическому анализу: стратегии анализа ассоциаций по всему геному. BMC Proc. 2009 г.;3(Приложение 7):S1. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Дж., Мартинес М., Нойман Р.Дж., Провинция М., Шимчак С., Уилкокс М.А., Циглер А., МакКлуер Дж.В., Алмаси Л. Семинар 16 по генетическому анализу: стратегии анализа ассоциаций по всему геному. BMC Proc. 2009 г.;3(Приложение 7):S1. [Бесплатная статья PMC] [PubMed] [Google Scholar] - Денни Дж. К., Кроуфорд, округ Колумбия, Ричи, доктор медицинских наук, Белински С. Дж., Басфорд М. А., Брэдфорд И., Чай Х. С., Бастарах Л., Зувич Р., Пейссиг П., Каррелл Д., Рамирес А. Х., Патак Дж., Уилке Р.А., Расмуссен Л., Ван Х, Пачеко Дж.А., Кхо А.Н., Хейс М.Г., Уэстон Н., Мацумото М., Копп П.А., Ньютон К.М., Ярвик Г.П., Ли Р., Манолио Т.А., Кулло И.Дж., Чут К.Г., Чисхолм Р.Л. , Ларсон Э.Б., Маккарти К.А., Масис Д.Р., Роден Д.М., де Андраде М. Варианты, близкие к FOXE1, связаны с гипотиреозом и другими заболеваниями щитовидной железы: использование электронных медицинских карт для полногеномных и феномных исследований. Am J Hum Genet. 2011;89: 529–542. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Dick DM, Nurnberger J, Jr, Edenberg HJ, Goate A, Crowe R, Rice J, Bucholz KK, Kramer J, Schuckit MA, Smith TL, Porjesz B, Begleiter H, Hesselbrock V, Foroud T.
 Предполагаемое сцепление на хромосоме 1 для количественного фенотипа, связанного с алкоголем. Алкоголь Clin Exp Res. 2002; 26:1453–1460. [PubMed] [Google Scholar]
Предполагаемое сцепление на хромосоме 1 для количественного фенотипа, связанного с алкоголем. Алкоголь Clin Exp Res. 2002; 26:1453–1460. [PubMed] [Google Scholar] - Falconer DS. Количественная генетика. 3-е изд. Уайли; New York: 1989. [Google Scholar]
- Gelernter J, Panhysen C, Wilcox M, Hesselbrock V, Rounsaville B, Poling J, Weiss R, Sonne S, Zhao H, Farrer L, Kranzler HR. Широкогеномное сканирование сцепления на наличие опиоидной зависимости и связанных с ней признаков. Am J Hum Genet. 2006;78:759–769. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Гош С., Бикеболлер Х., Бейли Дж., Бейли-Уилсон Дж., Кантор Р., Калверхаус Р., Доу В., ДеСтефано А., Энгельман С., Хеммельман С., Хинрихс А., Хауинг -Duistermaat J, Koenig I, Kent J, Jr, Pankratz N, Paterson A, Pugh E, Suarez B, Sun Y, Thomas A, Tinttle N, Zhu X, MacCluer J, Almasy L. Идентификация редких вариантов при сканировании экзома: Опыт GAW17. BMC Proc. 2011; 5 (Приложение 9): S1–1. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Glahn DC, Curran JE, Winkler AM, Carless MA, Kent JW, Jr, Charlesworth JC, Johnson MP, Göring HH, Cole SA, Dyer TD, Moses EK, Olvera Р.
 Л., Кочунов П., Дуггирала Р., Фокс П.Т., Алмаси Л., Блангеро Дж. Высокоразмерное ранжирование эндофенотипов в поиске генов риска большой депрессии. Биол психиатрия. 2012;71:6–14. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Л., Кочунов П., Дуггирала Р., Фокс П.Т., Алмаси Л., Блангеро Дж. Высокоразмерное ранжирование эндофенотипов в поиске генов риска большой депрессии. Биол психиатрия. 2012;71:6–14. [Бесплатная статья PMC] [PubMed] [Google Scholar] - Геринг Х. Х., Карран Дж. Э., Джонсон М. П., Дайер Т. Д., Чарлсворт Дж., Коул С. А., Джоветт Дж. Б., Авраам Л. Дж., Рейнуотер Д. Л., Комуззи А. Г., Махани М. С., Алмаси Л., Макклюер Д. В., Киссеба А. Х., Коллиер Г. Р., Моисей Э. К., Блангеро Дж. Открытие экспрессионных QTL с использованием крупномасштабного профилирования транскрипции в лимфоцитах человека. Нат Жене. 2007; 39: 1208–1216. [PubMed] [Google Scholar]
- Gottesman II, Gould TD. Понятие эндофенотипа в психиатрии: этимология и стратегические интенции. Am J Психиатрия. 2003; 160: 636–645. [PubMed] [Академия Google]
- Холл Дж. М., Ли М. К., Ньюман Б., Морроу Д. Э., Андерсон Л. А., Хьюи Б., Кинг М. С. Связь семейного рака молочной железы с ранним началом с хромосомой 17q21. Наука.
 1990; 250:1684–1689. [PubMed] [Google Scholar]
1990; 250:1684–1689. [PubMed] [Google Scholar] - Harvey RC, Mullighan CG, Wang X, Dobbin KK, Davidson GS, Bedrick EJ, Chen IM, Atlast SR, Kang H, Ar K, Wilson CS, Wharton W, Murphy M, Devidas M , Кэрролл А.Дж., Боровиц М.Дж., Боуман В.П., Даунинг Дж.Р., Реллинг М., Ян Дж., Бходжвани Д., Кэрролл В.Л., Камитта Б., Риман Г.Х., Смит М., Голод С.П., Уиллман С.Л. Идентификация новых кластерных групп при педиатрическом остром лимфобластном лейкозе B-предшественника высокого риска с профилированием экспрессии генов: корреляция с изменениями числа копий ДНК по всему геному, клиническими характеристиками и исходом. Кровь. 2010; 116:4874–4884. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Мейр Д., Дельпланк Ж., Шевр Ж.К., Лекёр С., Лоббенс С., Галлина С., Дюран Э., Ватин В., Дегрейв Ф., Проэнса С., Гагет С., Кёрнер А., Ковач П., Кисс В., Тише Ж., Марре М., Хартикайнен А.Л., Хорбер Ф., Поточна Н., Херкберг С., Леви-Маршал С., Патту Ф., Хьюде Б., Таубер М., Маккарти М.И., Блейкмор А.
 И., Монпетит А., Полихронакос С., Вейл Дж., Коин Л.Дж., Ашер Дж., Эллиотт П., Ярвелин М.Р., Висвикис-Сист С., Балкау Б., Сладек Р., Болдинг Д., Уолли А., Дина С., Фрогел П. Исследование ассоциации всего генома раннего и патологического ожирения у взрослых выявило три новых локуса риска в популяциях Европы. Нат Жене. 2009 г.;41:157–159. [PubMed] [Google Scholar]
И., Монпетит А., Полихронакос С., Вейл Дж., Коин Л.Дж., Ашер Дж., Эллиотт П., Ярвелин М.Р., Висвикис-Сист С., Балкау Б., Сладек Р., Болдинг Д., Уолли А., Дина С., Фрогел П. Исследование ассоциации всего генома раннего и патологического ожирения у взрослых выявило три новых локуса риска в популяциях Европы. Нат Жене. 2009 г.;41:157–159. [PubMed] [Google Scholar] - Москвина В., Шмидт К.М. О коррекции методом множественного тестирования в полногеномных ассоциативных исследованиях. Генетический эпидемиол. 2008; 32: 567–573. [PubMed] [Google Scholar]
- Консорциум генетики инфаркта миокарда. Катиресан С., Войт Б.Ф., Перселл С., Мусунуру К., Ардиссино Д., Маннуччи П.М., Ананд С., Энгерт Дж. К., Самани Н. Дж., Шункерт Х., Эрдманн Дж., Рейли М. П., Рейдер Д. Д., Морган Т., Спертус Дж. А., Столл М., Гирелли Д. , Маккеун П.П., Паттерсон К.С., Сисковик Д.С., О’Доннелл К.Дж., Элосуа Р., Пелтонен Л., Саломаа В., Шварц С.М., Меландер О., Альтшулер Д., Ардиссино Д., Мерлини П.А., Берзуини К.
 , Бернардинелли Л., Пейванди Ф., Тубаро М. , Челли П., Феррарио М., Фетиво Р., Марцильяно Н., Казари Г., Галли М., Рибичини Ф., Росси М., Бернарди Ф., Зонзин П., Пьяцца А., Маннуччи П.М., Шварц С.М., Сисковик Д.С., Йи Дж., Фридлендер Ю., Элосуа Р., Марругат Дж., Лукас Дж., Субирана И., Сала Дж., Рамос Р., Катиресан С., Мейгс Дж. Б., Уильямс Дж., Натан Д.М., Макрей К.А., О’Доннелл К.Дж., Саломаа В., Хавулинна А.С., Пелтонен Л., Меландер О., Берглунд Г., Войт Б.Ф., Катиресан С., Хиршхорн Дж.Н., Асселта Р., Дуга С., Спреафико М., Мусунуру К., Дейли М.Дж., Перселл С., Войт Б.Ф., Перселл С., Немеш Дж., Корн Дж.М., Маккэрролл С.А., Шварц С.М., Йи Дж., Катиресан С., Лукас Г., Субирана И., Элосуа Р., Сурти А., Гвидуччи С., Джаннини Л., Мирел Д., Паркин М., Бертт Н., Габриэль С.Б., Самани Н.Дж., Томпсон Дж.Р., Браунд П.С., Райт Б.Дж., Бальмфорт А.Дж., Болл С.Г., Холл А.С., Консорциум по управлению делами Wellcome Trust. Шункерт Х., Эрдманн Дж., Линзель-Нитшке П., Либ В., Циглер А., Кениг И., Хенгстенберг С.
, Бернардинелли Л., Пейванди Ф., Тубаро М. , Челли П., Феррарио М., Фетиво Р., Марцильяно Н., Казари Г., Галли М., Рибичини Ф., Росси М., Бернарди Ф., Зонзин П., Пьяцца А., Маннуччи П.М., Шварц С.М., Сисковик Д.С., Йи Дж., Фридлендер Ю., Элосуа Р., Марругат Дж., Лукас Дж., Субирана И., Сала Дж., Рамос Р., Катиресан С., Мейгс Дж. Б., Уильямс Дж., Натан Д.М., Макрей К.А., О’Доннелл К.Дж., Саломаа В., Хавулинна А.С., Пелтонен Л., Меландер О., Берглунд Г., Войт Б.Ф., Катиресан С., Хиршхорн Дж.Н., Асселта Р., Дуга С., Спреафико М., Мусунуру К., Дейли М.Дж., Перселл С., Войт Б.Ф., Перселл С., Немеш Дж., Корн Дж.М., Маккэрролл С.А., Шварц С.М., Йи Дж., Катиресан С., Лукас Г., Субирана И., Элосуа Р., Сурти А., Гвидуччи С., Джаннини Л., Мирел Д., Паркин М., Бертт Н., Габриэль С.Б., Самани Н.Дж., Томпсон Дж.Р., Браунд П.С., Райт Б.Дж., Бальмфорт А.Дж., Болл С.Г., Холл А.С., Консорциум по управлению делами Wellcome Trust. Шункерт Х., Эрдманн Дж., Линзель-Нитшке П., Либ В., Циглер А., Кениг И., Хенгстенберг С. , Фишер М., Штарк К., Гросшенниг А., Прейсс М., Вихманн Х.Е., Шрайбер С., Шункерт Х., Самани Н.Дж., Эрдманн Дж., Оувеханд В., Хенгстенберг С., Делокас П., Шольц М., Камбьен Ф., Рейли М.П., Ли М., Чен З., Виленски Р., Маттай В., Касим А., Хаконарсон Х.Х., Девани Дж., Бернетт М.С., Пичард А.Д., Кент К.М., Сатлер Л. , Линдси Дж.М., Ваксман Р., Кнуфф К.В., Уотерворт Д.М., Уокер М.С., Мозер В., Эпштейн С.Е., Рейдер Д.Дж., Шеффолд Т., Бергер К., Столл М., Огромный А., Гирелли Д., Мартинелли Н., Оливьери О., Коррочер Р., Морган Т., Спертус Дж. А., МакКаун П., Паттерсон К. С., Шункерт Х., Эрдманн Э., Линзель-Нитшке П., Либ В., Зиглер А., Кениг И. Р., Хенгстенберг С., Фишер М., Старк К., Гросшенниг А., Прейсс М., Вихманн Х. Е., Шрайбер S, Hólm H, Thorleifsson G, Thorsteinsdottir U, Stefansson K, Engert JC, Do R, Xie C, Anand S, Kathiresan S, Ardissino D, Mannucci PM, Siscovick D, O’Donnell CJ, Samani NJ, Melander O, Elosua Р., Пелтонен Л., Саломаа В., Шварц С.М., Альтш uler D. Полногеномная ассоциация раннего инфаркта миокарда с однонуклеотидными полиморфизмами и вариантами числа копий.
, Фишер М., Штарк К., Гросшенниг А., Прейсс М., Вихманн Х.Е., Шрайбер С., Шункерт Х., Самани Н.Дж., Эрдманн Дж., Оувеханд В., Хенгстенберг С., Делокас П., Шольц М., Камбьен Ф., Рейли М.П., Ли М., Чен З., Виленски Р., Маттай В., Касим А., Хаконарсон Х.Х., Девани Дж., Бернетт М.С., Пичард А.Д., Кент К.М., Сатлер Л. , Линдси Дж.М., Ваксман Р., Кнуфф К.В., Уотерворт Д.М., Уокер М.С., Мозер В., Эпштейн С.Е., Рейдер Д.Дж., Шеффолд Т., Бергер К., Столл М., Огромный А., Гирелли Д., Мартинелли Н., Оливьери О., Коррочер Р., Морган Т., Спертус Дж. А., МакКаун П., Паттерсон К. С., Шункерт Х., Эрдманн Э., Линзель-Нитшке П., Либ В., Зиглер А., Кениг И. Р., Хенгстенберг С., Фишер М., Старк К., Гросшенниг А., Прейсс М., Вихманн Х. Е., Шрайбер S, Hólm H, Thorleifsson G, Thorsteinsdottir U, Stefansson K, Engert JC, Do R, Xie C, Anand S, Kathiresan S, Ardissino D, Mannucci PM, Siscovick D, O’Donnell CJ, Samani NJ, Melander O, Elosua Р., Пелтонен Л., Саломаа В., Шварц С.М., Альтш uler D. Полногеномная ассоциация раннего инфаркта миокарда с однонуклеотидными полиморфизмами и вариантами числа копий. Нат Жене. 2009 г.;41:334–41. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Нат Жене. 2009 г.;41:334–41. [Бесплатная статья PMC] [PubMed] [Google Scholar] - Ott J, Rabinowitz D. Подход основных компонентов, основанный на наследственности для объединения информации о фенотипе. Хам Херед. 1999; 49: 106–111. [PubMed] [Google Scholar]
- Pendergrass SA, Brown-Gentry K, Dudek SM, Torstenson ES, Ambite JL, Avery CL, Buyske S, Cai C, Fesinmeyer MD, Haiman C, Heiss G, Hindorff LA, Hsu CN, Джексон Р.Д., Куперберг С., Ле Маршан Л., Лин И., Матиз Т.С., Морленд Л., Монро К., Райнер А.П., Уоллес Р., Уилкенс Л.Р., Кроуфорд Д.К., Ричи М.Д. Использование общефеноменных ассоциативных исследований (PheWAS) для изучения новых взаимосвязей генотип-фенотип и открытия плейотропии. Генетический эпидемиол. 2011; 35:410–422. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Пломин Р., Хаворт К.М., Дэвис О.С. Общими нарушениями являются количественные признаки. Нат Рев Жене. 2009; 10: 872–878. [PubMed] [Google Scholar]
- Qin X, Hauser ER, Schmidt S.
 Упорядоченный анализ подмножества для исследований случай-контроль. Генетический эпидемиол. 2010; 34: 407–417. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Упорядоченный анализ подмножества для исследований случай-контроль. Генетический эпидемиол. 2010; 34: 407–417. [Бесплатная статья PMC] [PubMed] [Google Scholar] - Saint-Pierre A, Kaufman JM, Ostertag A, Cohen-Solal M, Boland A, Toye K, Zelenika D, Lathrop M, de Vernejoul MC, Martinez M. Bivariate анализ ассоциации в выбранных образцах: применение к GWAS двух фенотипов минеральной плотности кости у мужчин с высоким или низким BMC. Eu J Hum Genet. 2011;19: 710–716. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Shi J, Potash JB, Knowles JA, Weissman MM, Coryell W, Scheftner WA, Lawson WB, DePaulo JR, Jr, Gejman PV, Sanders AR, Johnson JK, Adams П., Чаудхури С., Янчич Д., Евграфов О., Звиняцковский А., Эртман Н., Глэдис М., Нейманас К., Гуделл М., Хейл Н., Ней Н., Верма Р., Мирел Д., Холманс П., Левинсон Д.Ф. Полногеномное ассоциативное исследование рецидивирующего большого депрессивного расстройства с ранним началом. Мол Психиатрия. 2011;16:193–201. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- St.
 George-Hyslop PH, Tanzi RE, Polinsky RJ, Haines JL, Nee L, Watkins PC, Myers RH, Feldman RG, Pollen D, Drachman D. Генетический дефект, вызывающий картирование семейной болезни Альцгеймера на хромосоме 21. Наука. 1987; 235: 885–890. [PubMed] [Google Scholar]
George-Hyslop PH, Tanzi RE, Polinsky RJ, Haines JL, Nee L, Watkins PC, Myers RH, Feldman RG, Pollen D, Drachman D. Генетический дефект, вызывающий картирование семейной болезни Альцгеймера на хромосоме 21. Наука. 1987; 235: 885–890. [PubMed] [Google Scholar] - Stein JL, Medland SE, Vasquez AA, Hibar DP, Senstad RE, Winkler AM, Toro R, Appel K, Bartecek R, Bergmann O, Bernard M, Brown AA, Cannon DM, Chakravarty MM , Christoforou A, Domin M, Grimm O, Hollinshead M, Holmes AJ, Homuth G, Hottenga JJ, Langan C, Lopez LM, Hansell NK, Hwang KS, Kim S, Laje G, Lee PH, Liu X, Loth E, Lourdusamy А., Маттингсдал М., Монке С., Маньега С.М., Нхо К., Ньюджент А.С., О’Брайен С., Папмейер М., Пютц Б., Рамасами А., Расмуссен Дж., Рижпкема М., Рисахер С.Л., Родди Дж.С., Роуз Э.Дж., Райтен М., Шен Л., Спроутен Э., Стренгман Э., Тоймер А., Трабзуни Д., Тернер Дж., ван Эйк К., ван Эрп Т.Г., ван Тол М.Дж., Виттфельд К., Вольф С., Вудстра С., Алеман А., Алхусаини С., Алмаси Л., Биндер Э.Б., Брохон Д.
 Г., Кантор Р.М., Карлесс М.А., Корвин А., Чиш М., Карран Дж.Э., Дэвис Г., де Алмейда М.А., Деланти Н., Депонд С., Дуггирала Р., Дайер Т.Д., Эрк С., Фагернесс Дж., Фокс П.Т., Фраймер Н.Б., Гилл М., Геринг Х.Х., Хаглер Д.Дж., Хен Д., Холсбур Ф., Хугман М., Хостен Н., Джаханшад Н., Джонсон М.П., Касперавичют e D, Кент Дж.В., младший, Кочунов П., Ланкастер Дж.Л., Лори С.М., Левальд Д.К., Мандл Р., Матарин М., Маттейсен М., Мейзенцаль Э., Мелле И., Моисей Э.К., Мюлейзен Т.В., Наук М., Нётен М.М., Олвера Р.Л., Пандольфо М., Пайк ГБ, Пульс Р., Рейнванг И., Рентерия М.Э., Ритшель М., Роффман Дж.Л., Ройл Н.А., Ружеску Д., Савиц Дж., Шнак Х.Г., Шнелл К., Зайферт Н., Смит С., Стин В.М., Вальдес Эрнандес М.С., Ван ден Хеувел М., ван дер Ви Н.Дж., Ван Харен Н.Е., Вельтман Дж.А., Вёльцке Х., Уокер Р., Вестли Л.Т., Уилан К.Д., Агарц И., Бумсма Д.И., Каваллери Г.Л., Дейл А.М., Джурович С., Древец В.К., Хагурт П., Холл J, Heinz A, Jack CR, Jr, Foroud TM, Le Hellard S, Macciardi F, Montgomery GW, Poline JB, Porteous DJ, Sisodiya SM, Starr JM, Sussmann J, Toga AW, Veltman DJ, Walter H, Weiner MW, Инициатива нейровизуализации болезни Альцгеймера (ADNI) Консорциум EPIGEN.
Г., Кантор Р.М., Карлесс М.А., Корвин А., Чиш М., Карран Дж.Э., Дэвис Г., де Алмейда М.А., Деланти Н., Депонд С., Дуггирала Р., Дайер Т.Д., Эрк С., Фагернесс Дж., Фокс П.Т., Фраймер Н.Б., Гилл М., Геринг Х.Х., Хаглер Д.Дж., Хен Д., Холсбур Ф., Хугман М., Хостен Н., Джаханшад Н., Джонсон М.П., Касперавичют e D, Кент Дж.В., младший, Кочунов П., Ланкастер Дж.Л., Лори С.М., Левальд Д.К., Мандл Р., Матарин М., Маттейсен М., Мейзенцаль Э., Мелле И., Моисей Э.К., Мюлейзен Т.В., Наук М., Нётен М.М., Олвера Р.Л., Пандольфо М., Пайк ГБ, Пульс Р., Рейнванг И., Рентерия М.Э., Ритшель М., Роффман Дж.Л., Ройл Н.А., Ружеску Д., Савиц Дж., Шнак Х.Г., Шнелл К., Зайферт Н., Смит С., Стин В.М., Вальдес Эрнандес М.С., Ван ден Хеувел М., ван дер Ви Н.Дж., Ван Харен Н.Е., Вельтман Дж.А., Вёльцке Х., Уокер Р., Вестли Л.Т., Уилан К.Д., Агарц И., Бумсма Д.И., Каваллери Г.Л., Дейл А.М., Джурович С., Древец В.К., Хагурт П., Холл J, Heinz A, Jack CR, Jr, Foroud TM, Le Hellard S, Macciardi F, Montgomery GW, Poline JB, Porteous DJ, Sisodiya SM, Starr JM, Sussmann J, Toga AW, Veltman DJ, Walter H, Weiner MW, Инициатива нейровизуализации болезни Альцгеймера (ADNI) Консорциум EPIGEN. Консорциум ИМА-ГЕНЕРАЛ. Saguenay Youth Study Group (SYS) Bis JC, Ikram MA, Smith AV, Gudnason V, Tzourio C, Vernooij MW, Launer LJ, Decarli C, Seshadri S, Cohorts for Heart and Aging Research in Genomic Epidemiology (CHARGE) Consortium. Консорциум по улучшению генетики нейровизуализации посредством метаанализа (ENIGMA). Андреассен О.А., Апостолова Л.Г., Бастин М.Е., Блангеро Дж., Бруннер Х.Г., Бакнер Р.Л., Сичон С., Коппола Г., де Зубикарай Г.И., Дири И.Дж., Донохью Г., де Геус Э.Дж., Эспесет Т., Фернандес Г., Глан Д.К., Грабе Х.Дж., Hardy J, Hulshoff Pol HE, Jenkinson M, Kahn RS, McDonald C, McIntosh AM, McMahon FJ, McMahon KL, Meyer-Lindenberg A, Morris DW, Müller-Myhsok B, Nichols TE, Ophoff RA, Paus T, Pausova Z, Пеннинкс Б.В., Поткин С.Г., Семанн П.Г., Сайкин А.Дж., Шуманн Г., Смоллер Дж.В., Уордлоу Дж.М., Уил М.Е., Мартин Н.Г., Франке Б., Райт М.Дж., Томпсон П.М. Идентификация общих вариантов, связанных с гиппокампальным и внутричерепным объемами человека. Нат Жене. 2012; 44: 552–561.
Консорциум ИМА-ГЕНЕРАЛ. Saguenay Youth Study Group (SYS) Bis JC, Ikram MA, Smith AV, Gudnason V, Tzourio C, Vernooij MW, Launer LJ, Decarli C, Seshadri S, Cohorts for Heart and Aging Research in Genomic Epidemiology (CHARGE) Consortium. Консорциум по улучшению генетики нейровизуализации посредством метаанализа (ENIGMA). Андреассен О.А., Апостолова Л.Г., Бастин М.Е., Блангеро Дж., Бруннер Х.Г., Бакнер Р.Л., Сичон С., Коппола Г., де Зубикарай Г.И., Дири И.Дж., Донохью Г., де Геус Э.Дж., Эспесет Т., Фернандес Г., Глан Д.К., Грабе Х.Дж., Hardy J, Hulshoff Pol HE, Jenkinson M, Kahn RS, McDonald C, McIntosh AM, McMahon FJ, McMahon KL, Meyer-Lindenberg A, Morris DW, Müller-Myhsok B, Nichols TE, Ophoff RA, Paus T, Pausova Z, Пеннинкс Б.В., Поткин С.Г., Семанн П.Г., Сайкин А.Дж., Шуманн Г., Смоллер Дж.В., Уордлоу Дж.М., Уил М.Е., Мартин Н.Г., Франке Б., Райт М.Дж., Томпсон П.М. Идентификация общих вариантов, связанных с гиппокампальным и внутричерепным объемами человека. Нат Жене. 2012; 44: 552–561.
 9.,
9.,Абстрактный
Фон
Наследственные рецидивирующие лихорадки (HRF) представляют собой группу редких моногенных заболеваний, приводящих к рецидивирующим воспалительным вспышкам.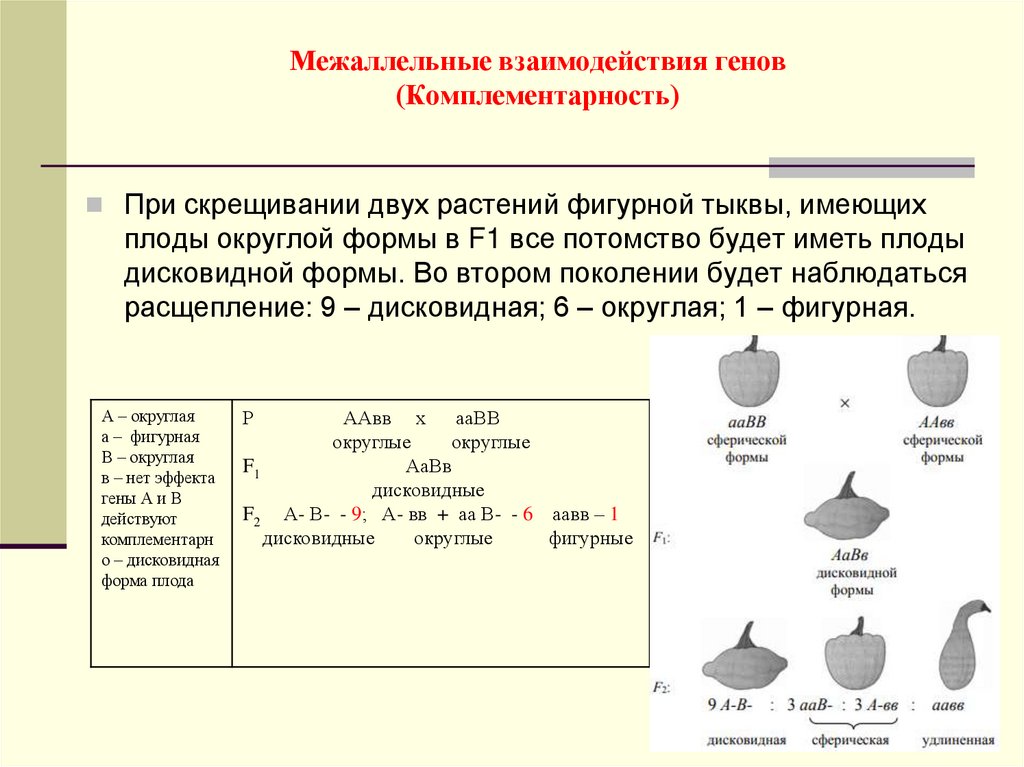 Было описано большое количество вариантов четырех генов, связанных с наиболее известным HRF, а именно MEFV, NLRP3, MVK, TNFRSF1A . База данных Infevers (http://fmf.igh.cnrs.fr/ISSAID/infevers) представляет собой большой международный реестр, в котором собраны варианты, зарегистрированные в этих генах. Однако для каждой мутации не представлены ассоциации генотип-фенотип, а только клинический фенотип первого пациента (пациентов). Целью данного исследования является разработка реестра ассоциаций генотип-фенотип, наблюдаемых у пациентов с HRF, зарегистрированных и валидированных в реестре Eurofever.
Было описано большое количество вариантов четырех генов, связанных с наиболее известным HRF, а именно MEFV, NLRP3, MVK, TNFRSF1A . База данных Infevers (http://fmf.igh.cnrs.fr/ISSAID/infevers) представляет собой большой международный реестр, в котором собраны варианты, зарегистрированные в этих генах. Однако для каждой мутации не представлены ассоциации генотип-фенотип, а только клинический фенотип первого пациента (пациентов). Целью данного исследования является разработка реестра ассоциаций генотип-фенотип, наблюдаемых у пациентов с HRF, зарегистрированных и валидированных в реестре Eurofever.
Результаты
Были ретроспективно проанализированы ассоциации генотип-фенотип, наблюдаемые у всех пациентов с HRF, включенных в регистр Eurofever. Для аутосомно-доминантных заболеваний (CAPS и TRAPS) все мутации анализировали индивидуально. Для аутосомно-рецессивных заболеваний (FMF и MKD) описаны гомозиготные и гетерозиготные комбинации. Также изучались средний возраст дебюта, течение заболевания (рецидивирующее или хроническое), средняя продолжительность эпизодов лихорадки, клинические проявления, связанные с эпизодами лихорадки, атипичные проявления, осложнения и ответ на лечение.
Также изучались средний возраст дебюта, течение заболевания (рецидивирующее или хроническое), средняя продолжительность эпизодов лихорадки, клинические проявления, связанные с эпизодами лихорадки, атипичные проявления, осложнения и ответ на лечение.
Данные наблюдений за 751 пациентом (346 FMF, 133 CAPS, 114 MKD, 158 TRAPS), включенных в регистр Eurofever и проверенных экспертами, были обобщены в таблицах. Всего было описано 149 вариантов: 46 TNFRSF1A и 27 NLRP3 вариантов , , а также различные комбинации 48 MVK и 28 MEFV вариантов.
Выводы
Мы предоставляем потенциально полезный инструмент для врачей, занимающихся HRF, а именно регистр ассоциаций генотип-фенотип для пациентов, включенных в регистр Eurofever. Этот инструмент дополняет базу данных Infevers и будет доступен на веб-сайтах Eurofever и Infevers.
История вопроса
Наследственные рецидивирующие лихорадки (HRF) представляют собой группу аутовоспалительных заболеваний, характеризующихся рецидивирующими эпизодами лихорадки различной продолжительности, связанными с повышением острофазовых реагентов и рядом системных воспалительных проявлений, преимущественно с вовлечением кожи, суставов и серозных поверхностей [ 1]. Наиболее известными HRF являются фамильярная средиземноморская лихорадка (FMF), криопирин-ассоциированный периодический синдром (CAPS), TNF-рецептор-ассоциированный синдром периодической лихорадки (TRAPS) и дефицит мевалонаткиназы (MKD), вызванный мутациями в генов MEFV , NLRP3 , TNFRSF1A и генов MVK соответственно.
Наиболее известными HRF являются фамильярная средиземноморская лихорадка (FMF), криопирин-ассоциированный периодический синдром (CAPS), TNF-рецептор-ассоциированный синдром периодической лихорадки (TRAPS) и дефицит мевалонаткиназы (MKD), вызванный мутациями в генов MEFV , NLRP3 , TNFRSF1A и генов MVK соответственно.
Большое количество общих вариантов или полиморфизмов в этих генах затрудняет оценку ассоциации генотип-фенотип. Кроме того, возможная степень клинических проявлений, связанных с лихорадкой при HRF, все еще в значительной степени неизвестна, и могут присутствовать атипичные симптомы. В базе данных Infevers (доступна по адресу http://fmf.igh.cnrs.fr/ISSAID/infevers/) собраны все зарегистрированные варианты этих генов [2]. Infevers дает краткое описание клинической картины первого пациента (пациентов), зарегистрированных для каждой данной мутации, но без дополнительной связи генотип-фенотип. Проект Eurofever, поддерживаемый Европейским агентством здравоохранения и защиты прав потребителей, направлен на расширение знаний об аутовоспалительных заболеваниях [3]. Одной из основных целей проекта было создание международного регистра, в котором будут собраны полные демографические, генетические и клинические данные обо всех моногенных аутовоспалительных заболеваниях. Целью настоящего исследования является разработка открытого веб-реестра ассоциаций генотип-фенотип, полученных от всех пациентов с HRF, зарегистрированных и подтвержденных в реестре Eurofever.
Одной из основных целей проекта было создание международного регистра, в котором будут собраны полные демографические, генетические и клинические данные обо всех моногенных аутовоспалительных заболеваниях. Целью настоящего исследования является разработка открытого веб-реестра ассоциаций генотип-фенотип, полученных от всех пациентов с HRF, зарегистрированных и подтвержденных в реестре Eurofever.
Методы
Все данные о пациентах были извлечены из регистра Eurofever, который регистрирует пациентов с ноября 2009 г. В участвующих странах было получено независимое этическое одобрение для включения пациентов в регистр в соответствии с местными требованиями. Подробные эпидемиологические, демографические, молекулярные и клинические данные были собраны анонимно. Клинические характеристики включали характер заболевания (определяемый либо рецидивирующими острыми эпизодами, хроническим заболеванием или хроническим течением с острыми обострениями), проявлениями заболевания и реакцией на лечение. Руководящий комитет Eurofever назначил группу опытных клиницистов (SÖ и HÖ для FMF; JF и AS для MKD; HL, MG и PW для TRAPS; BN и JKD для CAPS) для процесса вынесения решения по диагнозу. Вкратце, перед каждым экспертным комитетом была поставлена задача просмотреть всю анонимную демографическую, клиническую и генетическую информацию, доступную для подтверждения/изменения/запроса дополнительной информации/отклонения постановки диагноза лечащим врачом.
Руководящий комитет Eurofever назначил группу опытных клиницистов (SÖ и HÖ для FMF; JF и AS для MKD; HL, MG и PW для TRAPS; BN и JKD для CAPS) для процесса вынесения решения по диагнозу. Вкратце, перед каждым экспертным комитетом была поставлена задача просмотреть всю анонимную демографическую, клиническую и генетическую информацию, доступную для подтверждения/изменения/запроса дополнительной информации/отклонения постановки диагноза лечащим врачом.
Мы создали таблицу для каждого HRF, описывающую ассоциации генотип-фенотип, наблюдаемые у всех пациентов, включенных в регистр Eurofever с ноября 2009 г. по ноябрь 2014 г. и подтвержденные экспертами. Общие особенности каждой когорты больных уже описаны в отдельных работах [4,5,6,7]. Для аутосомно-доминантных заболеваний (CAPS и TRAPS) обо всех мутациях сообщалось индивидуально. Для аутосомно-рецессивных заболеваний (FMF и MKD) описаны гомозиготные и все комбинации гетерозиготных вариантов. Поскольку нельзя исключить сложные аллели, представленные комбинации ни в коем случае не подразумевают сложных гетерозиготных состояний.
Отдельная таблица посвящена описанию клинического фенотипа пациентов с неполным генотипом, таких как гетерозиготные пациенты с аутосомно-рецессивными заболеваниями или пациенты-носители низкопенетрантных мутаций или вариантов/полиморфизмов неопределенного патогенетического значения. В частности, согласно недавней литературе, мы считали неизвестными варианты p.E148Q и p.P369S гена MEFV ; p.P46L, p.R92Q и интронные варианты, кроме c.193-14G > A гена TNFRSF1A ; p.V198 M и p.Q703K гена NLRP3 . p.R202Q гена MEFV также был включен в Таблицу 6, несмотря на то, что этот вариант считается распространенным и нейтральным полиморфизмом, о котором даже не следует сообщать [8,9,10,11,12,13,14].
Пациентов с гетерозиготными мутациями гена MVK включали в исследование только после выявления сниженной активности фермента мевалонаткиназы в лейкоцитах или фибробластах или повышенной экскреции мевалоновой кислоты с мочой [15]. Для каждого варианта или генотипа были показаны следующие элементы: количество пациентов, средний возраст начала заболевания, течение заболевания (рецидивирующее или хроническое), средняя продолжительность и частота эпизодов лихорадки, преобладающие клинические проявления, связанные с эпизодами лихорадки, менее частые проявления, осложнения. и ответ на лечение. Менее распространенные проявления были определены как симптомы, присутствующие менее чем у 30% пациентов, являющихся носителями данного генотипа.
и ответ на лечение. Менее распространенные проявления были определены как симптомы, присутствующие менее чем у 30% пациентов, являющихся носителями данного генотипа.
Ответ на лечение определяли как полный (отсутствие клинических проявлений с нормализацией маркеров воспаления), частичный (общее улучшение клинической картины по заключению лечащего врача без полной нормализации клинических проявлений и/или системного воспаления) ), или неудача (отсутствие ответа по мнению лечащего врача). Различие между лечением по требованию и непрерывным лечением также было возможно.
Результаты
Всего в анализ был включен 751 пациент (346 FMF, 114 MKD, 158 TRAPS, 133 CAPS) (таблица 1). Всего сообщается о 149 вариантах четырех генов, связанных с HRF.
Таблица 1. Демографические характеристики пациентов. 3. В таблицах 4 и 5 показаны основные клинические признаки пациентов с 44 мутаций TNFRSF1A и 25 NLRP3 соответственно. В табл. 6 также приведены данные о 210 больных с неполным или неподтвержденным генотипом. В случае аутосомно-рецессивных заболеваний мы указали как первую мутацию вариант, ближайший к проксимальному концу кодирующей последовательности. Таблица 2. Генотип-фенотипические ассоциации у пациентов с ССЛ
6 также приведены данные о 210 больных с неполным или неподтвержденным генотипом. В случае аутосомно-рецессивных заболеваний мы указали как первую мутацию вариант, ближайший к проксимальному концу кодирующей последовательности. Таблица 2. Генотип-фенотипические ассоциации у пациентов с ССЛ Полная таблица
Таблица 3. Генотип-фенотипические ассоциации у пациентов с МКБПолная таблица
Таблица 4 Ассоциации генотип-фенотип у пациентов с TRAPSПолная таблица
Таблица 5 Ассоциация генотип-фенотип у пациентов с CAPSПолная таблица
Таблица 6 Пациенты с неполным или не подтверждающим генотипомтаблица
Среди 346 пациентов с ССЛ 238 были собраны в таблице 2, 112 из которых были гомозиготными, а 126 носили более одного гетерозиготного варианта. К сожалению, в этих случаях, поскольку мы не знали фазы аллелей, невозможно было оценить подтверждающий генотип.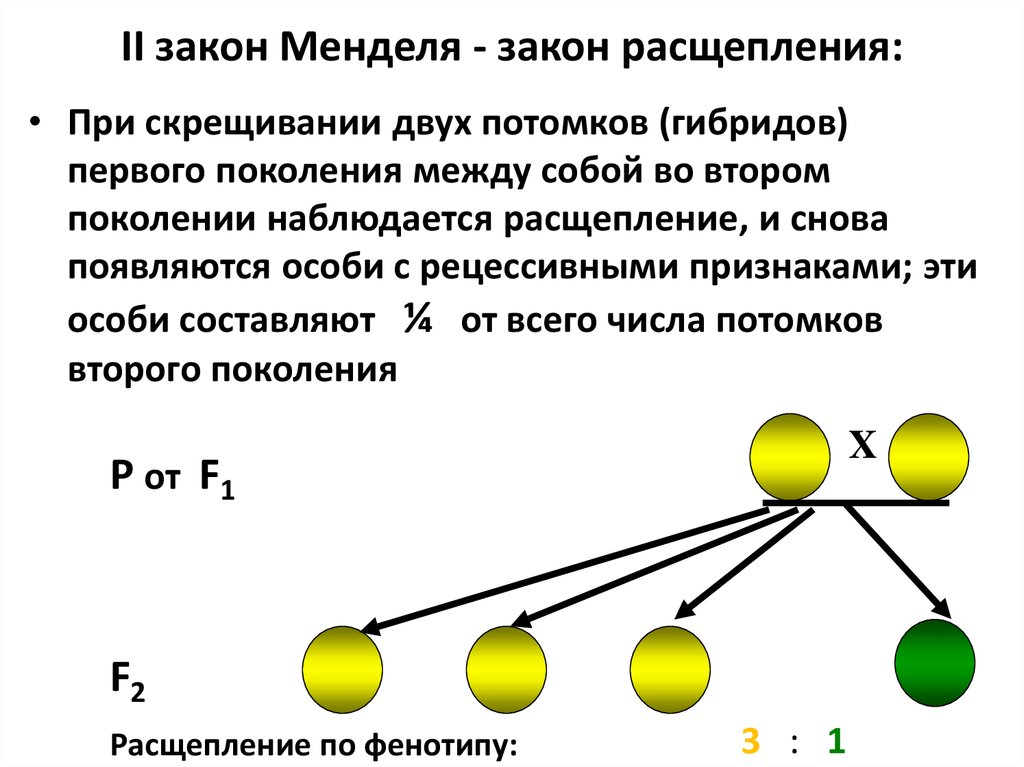 Наиболее частые мутации — p.M69.4 V (192 пациента), p.V726A (48), p.M680IGC (43) и p.E148Q (31). Сто восемь пациентов были классифицированы как ССЛ, несмотря на неполный (гетерозиготный) или не подтверждающий (p.R202Q или варианты неизвестной значимости) генотип. Клинические особенности этих пациентов представлены в таблице 6.
Наиболее частые мутации — p.M69.4 V (192 пациента), p.V726A (48), p.M680IGC (43) и p.E148Q (31). Сто восемь пациентов были классифицированы как ССЛ, несмотря на неполный (гетерозиготный) или не подтверждающий (p.R202Q или варианты неизвестной значимости) генотип. Клинические особенности этих пациентов представлены в таблице 6.
Сообщалось о сорока шести вариантах у 158 пациентов с TRAPS. Из них 4 варианта находятся в интронных областях, 18 связаны с цистеиновыми доменами и 3 являются делециями. Наиболее частыми мутациями являются p.T50 M (16 пациентов) и p.C33Y (12). Клинические характеристики 62 пациентов с вариантами неизвестной значимости, а именно p.R92Q (53) и p.P46L (5), или интронные варианты (4), за исключением c.193-14G > A, представлены в таблице 6. 3. За исключением варианта p.L1016F, расположенного в экзоне 9, все остальные варианты находятся в экзоне 3. Наиболее частыми вариантами являются p.R260W (32 пациента) и p.T348 M (21). Пациенты, несущие варианты неизвестного значения, а именно p.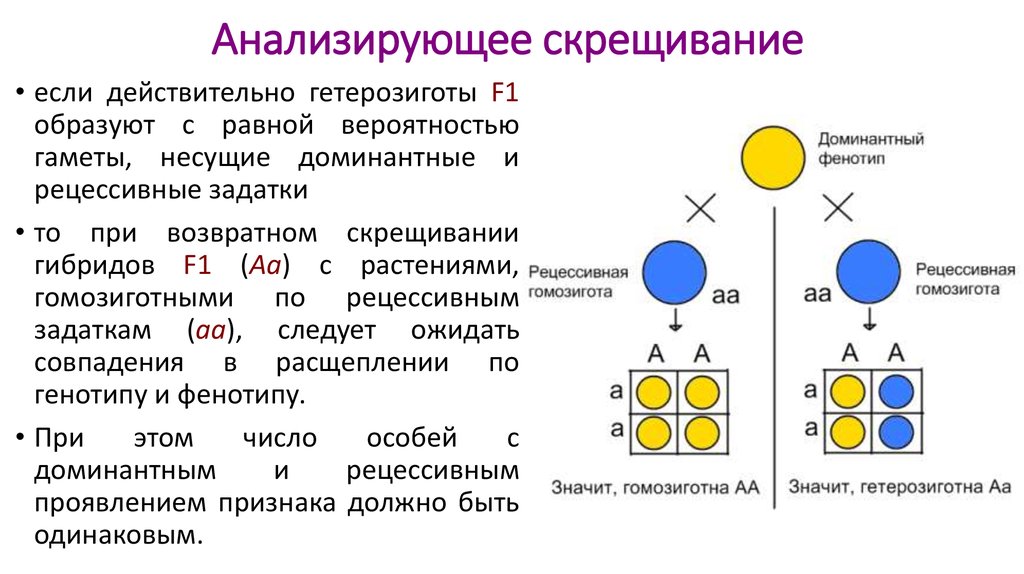 V198 M и p.Q703K, представлены в таблице 6.
V198 M и p.Q703K, представлены в таблице 6.
Наконец, было сообщено о 114 пациентах с MKD. Семнадцать пациентов были гомозиготными и 83 гетерозиготными по более чем одному варианту, показывая 47 различных комбинаций мутаций/делеций (таблица 2). Наиболее часто встречались варианты p.V377I (98 больных) и p.I268T (28). Описаны три делеции. Клинические особенности 14 пациентов с одной мутацией MVK (гетерозиготной) в сочетании с аномальным метаболическим тестом представлены в таблице 6.
Обсуждение
рецидивирующие лихорадки. Цель настоящей работы состояла в том, чтобы предоставить клиницистам и генетикам, работающим в области аутовоспалительных заболеваний, практический инструмент для интерпретации результатов генетического анализа и проверки уже описанных фенотипов с данным генотипом.
До сих пор база данных Infevers была наиболее часто используемым инструментом для определения клинической значимости данного варианта, обнаруженного в генах HRF. Infevers представляет собой реестр всех вариантов, выявленных в связи с аутовоспалительными заболеваниями.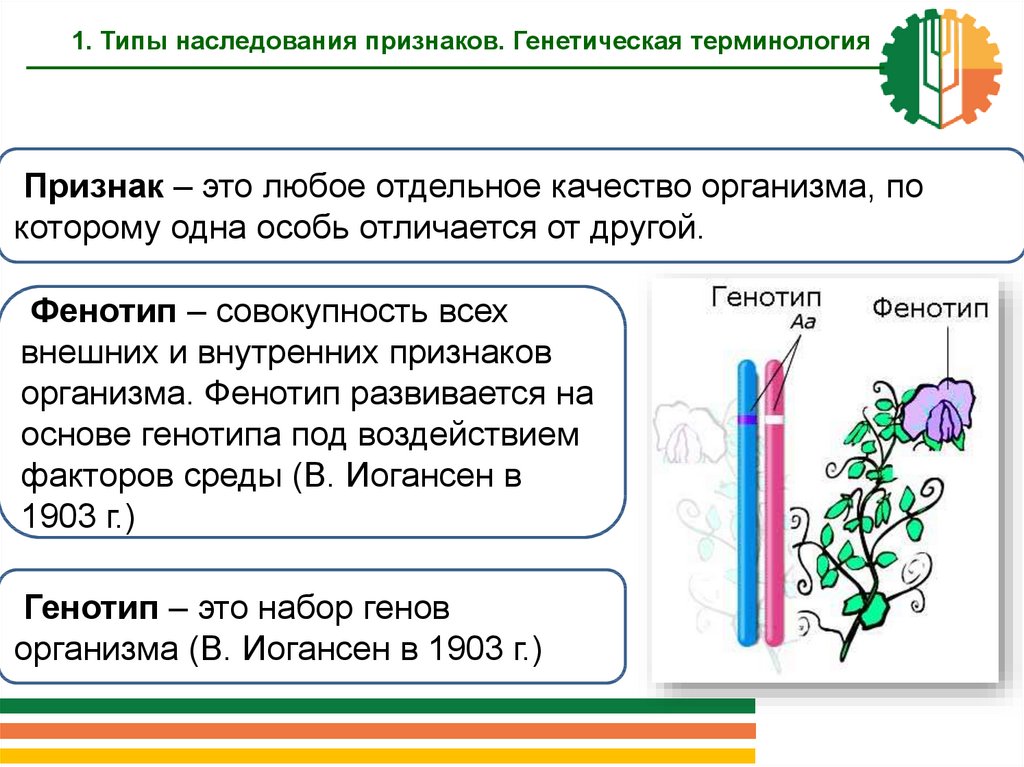 В настоящее время сообщается о 1523 вариантах, связанных с 30 аутовоспалительными заболеваниями. Среди них 317 вариантов для MEFV , 204 для MVK , 150 для TNFRSF1A и 182 для NLRP3 . Для каждого варианта предоставляется ряд входных данных (например, местоположение, последовательность и название белка Общества вариаций генома человека). Кроме того, также предоставляется приблизительное описание клинического фенотипа, описанного у первого пациента (пациентов), у которого был идентифицирован данный вариант. Из-за этого ограничения Infevers рекомендует не использовать базу данных в качестве инструмента для ассоциаций генотип-фенотип.
В настоящее время сообщается о 1523 вариантах, связанных с 30 аутовоспалительными заболеваниями. Среди них 317 вариантов для MEFV , 204 для MVK , 150 для TNFRSF1A и 182 для NLRP3 . Для каждого варианта предоставляется ряд входных данных (например, местоположение, последовательность и название белка Общества вариаций генома человека). Кроме того, также предоставляется приблизительное описание клинического фенотипа, описанного у первого пациента (пациентов), у которого был идентифицирован данный вариант. Из-за этого ограничения Infevers рекомендует не использовать базу данных в качестве инструмента для ассоциаций генотип-фенотип.
Ряд других веб-инструментов предоставляет информацию, касающуюся предсказания in silico функционального воздействия каждого известного варианта и его частоты в различных популяциях (например, https://varsome.com/, http://www.ensembl). .org/index.html и т. д.). В некоторых случаях также могут быть получены ссылки на опубликованные данные о клиническом фенотипе. Однако эти инструменты в основном предназначены для генетиков и не могут быть использованы клиницистами в повседневной клинической практике. С помощью настоящей работы мы хотели бы предоставить простой инструмент для оценки ассоциаций генотип-фенотип, возможно, связанных с различными вариантами, связанными с HRF.
Однако эти инструменты в основном предназначены для генетиков и не могут быть использованы клиницистами в повседневной клинической практике. С помощью настоящей работы мы хотели бы предоставить простой инструмент для оценки ассоциаций генотип-фенотип, возможно, связанных с различными вариантами, связанными с HRF.
Одно важное предостережение заключается в том, что этот набор данных включает только пациентов с подтвержденным диагнозом синдрома наследственной лихорадки. Некоторые из этих пациентов являются носителями известных вариантов с низкой пенетрантностью, таких как p.E148Q и p.P369S в MEFV ; p.R92Q и p.P46L в TNFRSF1A ; p.V198 M и p.Q703K в NLRP3 . Эти генетические варианты часто встречаются в здоровой популяции, хотя они обычно чрезмерно представлены у пациентов, направленных на исследование системных воспалительных симптомов. Поскольку эти пациенты, включенные в исследование Eurofever, представляют лишь меньшинство носителей этих генетических вариантов, представленные данные не следует экстраполировать на описание фенотипа у невыбранных пациентов, прошедших генетическое тестирование.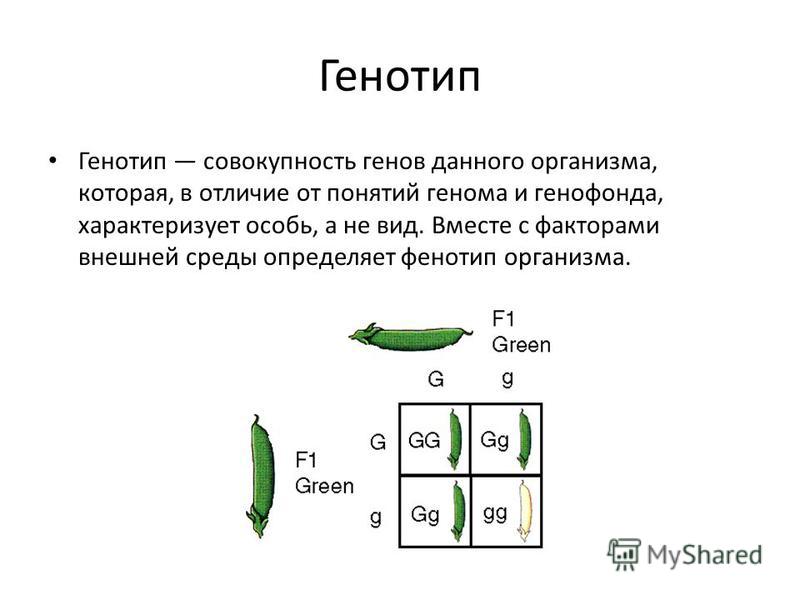 Более того, следует подчеркнуть, что в процессе валидации была отобрана лишь ограниченная часть пациентов с евролихорадкой, несущих эти варианты с низкой пенетрантностью, главным образом потому, что их клинические проявления и ответ на лечение соответствовали родственному заболеванию.
Более того, следует подчеркнуть, что в процессе валидации была отобрана лишь ограниченная часть пациентов с евролихорадкой, несущих эти варианты с низкой пенетрантностью, главным образом потому, что их клинические проявления и ответ на лечение соответствовали родственному заболеванию.
Представленные здесь таблицы будут доступны в Интернете со ссылками на веб-сайты Eurofever (www.printo.it.eurofever) и Infevers. Кроме того, постоянное обновление таблиц будет выполняться для любого нового варианта, связанного с пациентами, включенными в регистр Eurofever.
Выводы
Мы предлагаем потенциально полезный инструмент для врачей, занимающихся HRF, а именно регистр ассоциаций генотип-фенотип для пациентов, включенных в регистр Eurofever. Этот инструмент дополняет базу данных Infevers и будет доступен на веб-сайтах Eurofever и Infevers.
Сокращения
Ссылки
- «>
Gattorno M, Caorsi R, Meini A, et al. Дифференциация синдрома PFAPA от моногенных периодических лихорадок. Педиатр. 2009;124:e721–8.
Артикул Google ученый
Аксентьевич И., Галон Дж., Соарес М. и др. Периодический синдром, связанный с рецептором фактора некроза опухоли: новые мутации в TNFRSF1A, наследственное происхождение, исследования генотипа и фенотипа и доказательства дальнейшей генетической гетерогенности периодических лихорадок. Am J Hum Genet. 2001;69: 301–14.
КАС Статья пабмед ПабМед Центральный Google ученый
Загрузить ссылки
Благодарности
Авторы хотели бы поблагодарить доктора Э. Моши и Э. Патроне за их бесценную секретарскую помощь.
Финансирование
Регистр Eurofever спонсировался Рабочей группой по аутовоспалительным заболеваниям Европейского общества детской ревматологии (PReS) при поддержке Исполнительного агентства по вопросам здравоохранения и защиты прав потребителей (EAHC, проект № 2007332). Novartis и SOBI предоставили неограниченные образовательные гранты.
Novartis и SOBI предоставили неограниченные образовательные гранты.
Наличие данных и материалов
Если вы не являетесь членом сети PRINTO (www.printo.it) и хотите получить дополнительную информацию о реестре Eurofever или других инициативах, связанных с проектом Eurofever, напишите по адресу marcogattorno@ gaslini.org (ИП болезни: Марко Гатторно) или по адресу [email protected] (ассистент-исследователь: Юджиния Моски).
Информация о авторе
Авторы и принадлежности
Anna Simon
Авторы
Consortia
для Международной организации исследований детской ревматологии (PRINTO) и проекта Eurofever
Вклады
RP, MD: участвовал в разработке проекта и подготовке рукописи, . HJL, SO, JF, AS, BN, JKD, HO: участвовали в разработке исследования, собирали данные и помогали составлять рукопись. RC, SF, MF, MT, JB, LB, MCPG, MCM, ET, WAS, GE, AS, GA: собрали данные и помогли составить рукопись. NR, AM, IC, MG: задумали исследование, участвовали в его разработке и координации, а также помогли составить рукопись. Все авторы прочитали и одобрили окончательный вариант рукописи.
HJL, SO, JF, AS, BN, JKD, HO: участвовали в разработке исследования, собирали данные и помогали составлять рукопись. RC, SF, MF, MT, JB, LB, MCPG, MCM, ET, WAS, GE, AS, GA: собрали данные и помогли составить рукопись. NR, AM, IC, MG: задумали исследование, участвовали в его разработке и координации, а также помогли составить рукопись. Все авторы прочитали и одобрили окончательный вариант рукописи.
Автор, ответственный за переписку
Риккардо Папа.
Декларации этики
Этическое одобрение и согласие на участие
Независимое этическое одобрение для включения пациентов в реестр Eurofever и согласие на участие были получены в странах-участницах в соответствии с местными требованиями.
Согласие на публикацию
Независимое согласие на публикацию было получено в странах-участницах в соответствии с местными требованиями.
Конкурирующие интересы
Авторы заявляют, что у них нет конкурирующих интересов.
Примечание издателя
Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Права и разрешения
Открытый доступ Эта статья распространяется в соответствии с условиями международной лицензии Creative Commons Attribution 4.0 (http://creativecommons.org/licenses/by/4.0/), которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии вы должным образом указываете автора (авторов) и источник, предоставляете ссылку на лицензию Creative Commons и указываете, были ли внесены изменения. Отказ от права Creative Commons на общественное достояние (http://creativecommons.org/publicdomain/zero/1.0/) применяется к данным, представленным в этой статье, если не указано иное.
Перепечатки и разрешения
Об этой статье
Фенотипы группы крови | Жизненная кровь
Фенотипы основных групп крови и их частоты
Номер ISBT/системное название/[системный символ]
Коллекции антигенов (серия 200)*
Низкочастотные антигены (серия 700)*
| Фенотип | % Частота |
|---|---|
BY, CHR A , BI, BX A , PT A , RE A , JE A , LI A , MILNE, RASMN, JFV, jfv, jfv, jfv, jfv, jfv, jfv, jfv, jfv, jfv. , HOFM, REIT , HOFM, REIT | <1 |
Антигены высокой частоты (серия 901)*
| Фенотип | % Частота |
|---|---|
| АнВдж, АБТИ, ЛКЭ | >90 |
Примечание. Если не указано иное, частота основана на статистике групп крови австралийских доноров крови.
* Частота обычно основана на данных по европеоидным популяциям, однако существуют вариации некоторых фенотипов в разных этнических группах.
Фенотипы резус-фактора
Частота D-антигена наиболее высока у азиатов (99%) и чернокожих (92%), но реже у представителей европеоидной расы (85%).
Большинство D-положительных фенотипов имеют обычный D-антиген, однако вариации в структуре антигена могут привести либо к слабому D-фенотипу, либо к частичному D-фенотипу (1-2% европеоидов).
Клинически слабые D-индивиды типов 1, 2, 3, 4.0, 4.1 и 5 могут лечиться как D-положительные и им переливают D-положительные эритроциты. Однако пациентов со слабым типом 4.2-11 и 15 следует лечить как D-отрицательных и переливать D-отрицательные эритроциты, поскольку они могут образовывать анти-D при воздействии D-положительных эритроцитов.
Однако пациентов со слабым типом 4.2-11 и 15 следует лечить как D-отрицательных и переливать D-отрицательные эритроциты, поскольку они могут образовывать анти-D при воздействии D-положительных эритроцитов.
Индивидуумы с частичным D могут иметь различную экспрессию эпитопа и индуцировать выработку специфических антител. В результате их следует считать отрицательными и переливать отрицательные эритроциты.
Классификация резус-фенотипа и генотипа
Серологические результаты тестирования эритроцитов с пятью основными резус-антисыворотками, резус-фенотип и вероятный резус-генотип показаны в следующей таблице:
Примечания. Частота основана на статистике групп крови австралийских доноров. Клетки, дающие положительную реакцию на анти-С, могут быть дополнительно разделены путем тестирования на анти-С9.0014 с ; Могут быть обнаружены и другие генотипы Rh, но все они имеют частоту <0,2%.
Частота основана на статистике групп крови австралийских доноров. Клетки, дающие положительную реакцию на анти-С, могут быть дополнительно разделены путем тестирования на анти-С9.0014 с ; Могут быть обнаружены и другие генотипы Rh, но все они имеют частоту <0,2%.
Связанные ресурсы
Группы крови и антитела: основные
Тестирование на антигены и антитела: лабораторная практика переливания крови
Группы крови
Роль фенотипа в открытии генов в эпоху полногеномного секвенирования
Гум Жене. Авторская рукопись; доступно в PMC 2013 1 октября. 2012 Октябрь; 131 (10): 1533–1540.
Опубликовано в Интернете 22 июня 2012 г. doi: 10.1007/s00439-012-1191-1
doi: 10.1007/s00439-012-1191-1
PMCID: PMC3525519
NIHMSID: NIHMS3
922 PMID: 22270125
Информация об авторе Информация об авторских правах и лицензиях Заявление об отказе от ответственности
Поскольку последовательность всего генома становится рутинным компонентом исследований по открытию генов у людей, у нас будет исчерпывающий каталог генетических вариаций, и задача состоит в том, чтобы понять фенотипические последствия этих вариантов. Статистические генетические методы и аналитические подходы, связанные с оптимизацией фенотипов для обнаружения генов сложных признаков, предлагают две основные категории преимуществ. Они могут повысить способность локализовать интересующие гены, а также помочь в интерпретации ассоциаций между генетическими вариантами и исходами заболевания, предлагая потенциальные механизмы и пути, посредством которых гены могут влиять на исходы. Такие подходы к оптимизации фенотипа включают использование родственных фенотипов, таких как симптомы или возраст начала, для уменьшения генетической гетерогенности в наборе случаев, изучение количественных факторов риска или эндофенотипов, совместный анализ родственных фенотипов и получение новых фенотипов, предназначенных для извлечения независимых показателей. лежащие в основе корреляции между набором связанных фенотипов с помощью таких подходов, как основные компоненты. Новые возможности также открывают технологические достижения, которые позволяют эффективно собирать сотни или тысячи фенотипов индивидуума, включая фенотипы, более близкие к уровню действия генов, таким как уровни экспрессии генов, микроРНК или метаболические и протеомные профили.
лежащие в основе корреляции между набором связанных фенотипов с помощью таких подходов, как основные компоненты. Новые возможности также открывают технологические достижения, которые позволяют эффективно собирать сотни или тысячи фенотипов индивидуума, включая фенотипы, более близкие к уровню действия генов, таким как уровни экспрессии генов, микроРНК или метаболические и протеомные профили.
В последние годы в области генетики сложных заболеваний все больше внимания уделялось максимизации генетической информации в наших исследованиях, что в значительной степени обусловлено технологическими достижениями. Мы стремились увеличить мощность генетических исследований, лучше фиксируя ненаблюдаемую лежащую в основе генетическую изменчивость путем разработки микросателлитных карт и карт SNP для изучения сцепления, а затем с помощью плотных панелей SNP, разработанных для максимизации неравновесия по сцеплению с общими вариантами для исследований ассоциации. Точно так же секвенирование экзома представляет собой попытку разумного отбора частей генома, обогащенных функциональными вариантами. Одним из индикаторов направленности разработки методов в области генетики сложных заболеваний является Семинар по генетическому анализу (GAW), форум для разработки, тестирования и сравнения статистических генетических методов, который проводится каждые 2 года. GAW 14 сосредоточилась на переходе от микросателлитов к SNP для сканирования генома (Bailey-Wilson et al. 2005). Общегеномная ассоциация была темой GAW16 (Cupples et al. 2009).), а анализ данных о последовательности экзома был представлен на GAW17 (Ghosh et al.2011). Однако этот размах технологического развития подходит к своему естественному завершению. Затраты на секвенирование всего генома быстро снижаются, и вскоре оно станет стандартным средством сканирования генома для генетики сложных заболеваний человека. Мы начнем наши исследования, зная, что интересующие функциональные варианты будут среди наших генотипированных маркеров, и увеличение мощности за счет улучшения охвата генома перестанет быть ключевым вопросом. Таким образом, задача максимизации мощности для обнаружения интересующих эффектов будет заключаться в более эффективном использовании этих всеобъемлющих данных об вариациях ДНК путем оптимизации других аспектов плана исследования, таких как выбор лиц и фенотипов для изучения.
Одним из индикаторов направленности разработки методов в области генетики сложных заболеваний является Семинар по генетическому анализу (GAW), форум для разработки, тестирования и сравнения статистических генетических методов, который проводится каждые 2 года. GAW 14 сосредоточилась на переходе от микросателлитов к SNP для сканирования генома (Bailey-Wilson et al. 2005). Общегеномная ассоциация была темой GAW16 (Cupples et al. 2009).), а анализ данных о последовательности экзома был представлен на GAW17 (Ghosh et al.2011). Однако этот размах технологического развития подходит к своему естественному завершению. Затраты на секвенирование всего генома быстро снижаются, и вскоре оно станет стандартным средством сканирования генома для генетики сложных заболеваний человека. Мы начнем наши исследования, зная, что интересующие функциональные варианты будут среди наших генотипированных маркеров, и увеличение мощности за счет улучшения охвата генома перестанет быть ключевым вопросом. Таким образом, задача максимизации мощности для обнаружения интересующих эффектов будет заключаться в более эффективном использовании этих всеобъемлющих данных об вариациях ДНК путем оптимизации других аспектов плана исследования, таких как выбор лиц и фенотипов для изучения.
В эпоху GWAS надежды на продвижение в этой области были связаны с максимизацией информативности данных о генотипе, доступных для изучения, при этом фенотип чаще всего упрощался до дихотомии случай/контроль. В эпоху после GWAS внимание теперь будет обращено на фенотипическую половину связи фенотип-генотип. Методы высокой пропускной способности для протеомики, метаболомики и транскриптомики, а также растущие кэши данных в электронных медицинских картах вносят технологические усовершенствования в доступность и полноту информации о фенотипе. Можно сказать, что это начало «феномного проекта», который является естественным преемником проекта человеческого генома, поскольку наличие полного каталога последовательности человеческого генома не говорит нам, что эта последовательность делает. По сути, мы будем иметь генотипы и будем искать фенотипы, на изменчивость которых они влияют. Методологически подходы, изначально разработанные для работы с генетической гетерогенностью или извлечения дополнительной фенотипической информации для повышения мощности в исследованиях сцепления, будут возрождаться по мере их применения в исследованиях GWAS и секвенирования всего генома.
Общепризнано, что на сложные наследуемые фенотипы человека, скорее всего, влияют множественные гены и их взаимодействие друг с другом и с окружающей средой. До сих пор распространенные варианты с частотами аллелей более 1 %, которые хорошо фиксируются с помощью GWAS, по-видимому, объясняют небольшую часть наследуемости сложных признаков. Учитывая эту «отсутствующую наследственность», не учитываемую GWAS, растет понимание того, что на многие сложные человеческие фенотипы, вероятно, влияет набор редких вариантов с разной степенью эффекта и что два человека с одинаковым клиническим диагнозом могут нести совершенно разные аллели риска. Одним из следствий этого является то, что то, что представляет собой отдельное заболевание на клиническом уровне, на самом деле может быть гетерогенной группой потенциально перекрывающихся заболеваний на генетическом или этиологическом уровне. Такая неоднородность создает как проблемы, так и возможности. Все методы локализации генов чувствительны к гетерогенности локуса, при которой разные гены вносят вклад в фенотипическую изменчивость у разных подмножеств индивидуумов, а методы ассоциации также чувствительны к аллельной гетерогенности, при которой разные варианты в одном и том же локусе влияют на изменчивость. В этих случаях гетерогенность снижает возможности локализации генов.
В этих случаях гетерогенность снижает возможности локализации генов.
Один из подходов к решению этой потенциальной сложности состоит в том, чтобы попытаться использовать клинические признаки или количественные показатели для выявления этиологически более однородных подмножеств в группе пациентов с данным диагнозом. Если количество генотипированных или секвенированных индивидуумов является ограничивающим фактором, концентрация этих ограниченных ресурсов на более однородном подмножестве индивидуумов и, таким образом, ограничение как локусной, так и аллельной гетерогенности должно увеличить возможности локализации генов. Классическим примером успешного применения этого подхода является разделение больных на группы с ранним и поздним началом, что облегчило идентификацию АРОЕ как основного очага болезни Альцгеймера (St. George-Hyslop et al. 19).87) и BRCA1 для рака молочной железы (Hall et al., 1990). Холл и др. отметили, что только часть их 23 расширенных семей с множественными случаями рака молочной железы показали признаки сцепления на хромосоме 17, и обнаружили, что сигнал сцепления был самым сильным (LOD = 5,98) в семи семьях, где средний возраст на момент постановки диагноза был ≤45 лет. и связь с одним и тем же местом была формально исключена (LOD < -2) в семьях с более старшим возрастом начала заболевания. Использование возраста на момент начала заболевания для выявления потенциально более однородных подгрупп случаев продолжает применяться в исследованиях GWAS таких признаков, как ожирение (Meyre et al., 2009).), инфаркт миокарда (Консорциум генетики инфаркта миокарда и др., 2009 г.) и большую депрессию (Ши и др., 2011 г.). Консорциум по инфаркту миокарда начал свой GWAS с когорты случаев с ранним началом инфаркта миокарда (ИМ), определяемым как возраст ≤ 50 лет у мужчин или ≤ 60 лет у женщин, а затем с повторными выборками, где случаи были выбраны в возрасте или ниже среднего возраста начала ИМ. Они идентифицировали девять локусов, связанных с ИМ, на полногеномных уровнях значимости. О четырех из этих локусов сообщалось в предыдущем исследовании ИМ GWAS, в котором не учитывался возраст начала заболевания; два локуса ранее были связаны с ЛПНП, количественным фактором риска ИМ; и последние три были новыми.
и связь с одним и тем же местом была формально исключена (LOD < -2) в семьях с более старшим возрастом начала заболевания. Использование возраста на момент начала заболевания для выявления потенциально более однородных подгрупп случаев продолжает применяться в исследованиях GWAS таких признаков, как ожирение (Meyre et al., 2009).), инфаркт миокарда (Консорциум генетики инфаркта миокарда и др., 2009 г.) и большую депрессию (Ши и др., 2011 г.). Консорциум по инфаркту миокарда начал свой GWAS с когорты случаев с ранним началом инфаркта миокарда (ИМ), определяемым как возраст ≤ 50 лет у мужчин или ≤ 60 лет у женщин, а затем с повторными выборками, где случаи были выбраны в возрасте или ниже среднего возраста начала ИМ. Они идентифицировали девять локусов, связанных с ИМ, на полногеномных уровнях значимости. О четырех из этих локусов сообщалось в предыдущем исследовании ИМ GWAS, в котором не учитывался возраст начала заболевания; два локуса ранее были связаны с ЛПНП, количественным фактором риска ИМ; и последние три были новыми.
Для любого данного сложного заболевания может быть множество потенциальных маркеров гетерогенности. Семейная агрегация может быть полезна при выборе среди них. Члены семьи, вероятно, имеют общие варианты, влияющие на интересующий признак, и теоретически фенотипы, указывающие на конкретный лежащий в основе аллель риска, также должны коррелировать среди этих членов семьи. В качестве альтернативы кластерный анализ можно использовать для совместного анализа многочисленных клинических признаков с целью выявления подгрупп пациентов с общим набором характеристик, чтобы их можно было анализировать как отдельную группу. Например, Гелернтер и др. (2006) использовали кластерный анализ переменных симптомов, связанных с употреблением опиоидов, из Полуструктурированной оценки зависимости от наркотиков и алкоголизма, чтобы выделить пять фенотипических подгрупп среди участников исследования связи опиоидной и кокаиновой зависимости. Самый высокий балл LOD, наблюдаемый в их исследовании для условно определенного диагноза опиоидной зависимости, составил 2,43. Напротив, с помощью фенотипов кластерного анализа были получены две оценки LOD > 3: одна со статусом привязанности, определяемым принадлежностью к группе тяжелых потребителей опиоидов, и одна на основе группы неопиоидных потребителей с высоким уровнем кокаиновой зависимости. Недавний вариант этого подхода использует кластерный анализ многомерных протеомных, метаболомных или транскриптомных данных для идентификации подгрупп пациентов. Например, Харви и др. (2010) изучили профили экспрессии генов у 207 детей с острым лимфобластным лейкозом высокого риска B-предшественника, чтобы выделить восемь подгрупп пациентов. Поддерживая идею о том, что эти определяемые мРНК кластеры могут представлять генетически однородные группы пациентов, они показали, что два из кластеров были связаны с ранее идентифицированными транслокациями.
Напротив, с помощью фенотипов кластерного анализа были получены две оценки LOD > 3: одна со статусом привязанности, определяемым принадлежностью к группе тяжелых потребителей опиоидов, и одна на основе группы неопиоидных потребителей с высоким уровнем кокаиновой зависимости. Недавний вариант этого подхода использует кластерный анализ многомерных протеомных, метаболомных или транскриптомных данных для идентификации подгрупп пациентов. Например, Харви и др. (2010) изучили профили экспрессии генов у 207 детей с острым лимфобластным лейкозом высокого риска B-предшественника, чтобы выделить восемь подгрупп пациентов. Поддерживая идею о том, что эти определяемые мРНК кластеры могут представлять генетически однородные группы пациентов, они показали, что два из кластеров были связаны с ранее идентифицированными транслокациями.
Однако попытки уменьшить неоднородность выборки не обходятся без затрат. Одним из очевидных является то, что подгруппирование выборки с помощью кластерного анализа или на основе некоторых клинических признаков обязательно уменьшает размер выборки; для непрерывных переменных требуется выбор порога для разделения выборки, выбор которого не всегда может быть ясен.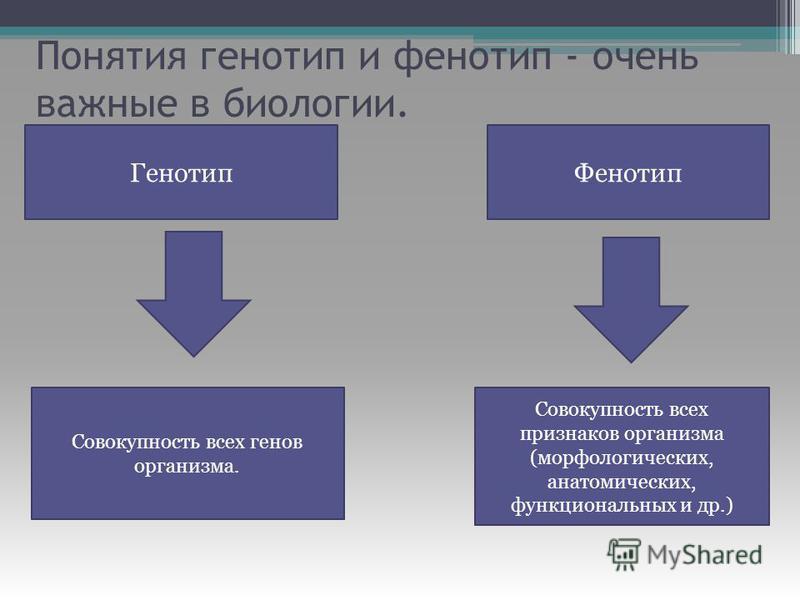 Один из методов борьбы с этой неопределенностью заключается в использовании упорядоченного анализа подмножеств, в котором случаи или семьи упорядочены на основе количественной переменной (например, возраста на момент начала заболевания), и анализ выполняется несколько раз, при этом порог включения систематически повышается или уменьшилось (Чунг и др., 2008; Цинь и др., 2010). Это можно использовать для определения порога, при котором сигнал локализации гена максимизируется; однако это делает интерпретацию статистической значимости проблематичной, поскольку по своей сути увеличивает многократное тестирование. Как правило, перестановка набора данных используется для демонстрации того, что наблюдаемый сигнал вряд ли возникнет случайно в случайных подмножествах данных.
Один из методов борьбы с этой неопределенностью заключается в использовании упорядоченного анализа подмножеств, в котором случаи или семьи упорядочены на основе количественной переменной (например, возраста на момент начала заболевания), и анализ выполняется несколько раз, при этом порог включения систематически повышается или уменьшилось (Чунг и др., 2008; Цинь и др., 2010). Это можно использовать для определения порога, при котором сигнал локализации гена максимизируется; однако это делает интерпретацию статистической значимости проблематичной, поскольку по своей сути увеличивает многократное тестирование. Как правило, перестановка набора данных используется для демонстрации того, что наблюдаемый сигнал вряд ли возникнет случайно в случайных подмножествах данных.
Другая стратегия борьбы с лежащей в основе генетической гетерогенностью и потенциально сложной сетью этиологий, способствующих изменчивости фенотипа, заключается в непосредственном изучении количественных факторов риска, которые могут указывать на различные основные аспекты этиологии заболевания, в надежде, что эти промежуточные фенотипы могут быть генетически менее комплекс с потенциально более сильными генетическими сигналами. Включение количественных факторов риска в генетические исследования сложных заболеваний сильно различается в зависимости от фенотипических областей. Такие исследования имеют долгую и продуктивную историю исследований сердечно-сосудистых заболеваний, где такие фенотипы, как уровень холестерина и кровяное давление, уже давно включены в генетические исследования. Напротив, в психиатрической генетике такие количественные факторы риска были названы эндофенотипами и менее охотно принимались.
Включение количественных факторов риска в генетические исследования сложных заболеваний сильно различается в зависимости от фенотипических областей. Такие исследования имеют долгую и продуктивную историю исследований сердечно-сосудистых заболеваний, где такие фенотипы, как уровень холестерина и кровяное давление, уже давно включены в генетические исследования. Напротив, в психиатрической генетике такие количественные факторы риска были названы эндофенотипами и менее охотно принимались.
Одним из аргументов, используемых против генетических исследований эндофенотипов, является то, что часто наследуемость клинической конечной точки, то есть психического расстройства, выше, чем наследуемость предполагаемого эндофенотипа. Однако, поскольку наследуемость представляет собой совокупность эффектов неизвестного числа генетических локусов с неизвестной величиной индивидуальных эффектов, общая наследуемость признака не обязательно является полезным индикатором способности обнаруживать гены. Важно, чтобы была продемонстрирована ненулевая наследуемость, чтобы поддерживать локализацию гена признака, а общая наследуемость, безусловно, устанавливает верхнюю границу возможных размеров эффекта отдельных локусов. Но гены признака с наследуемостью 80 % могут оказаться более сложными для локализации, чем признак с наследуемостью 40 %, если наследуемость первого признака обусловлена десятками или сотнями локусов с очень небольшим эффектом (например, ростом). , а наследуемость второго признака обусловлена несколькими локусами, некоторые из которых имеют умеренные размеры эффекта (например, уровни экспрессии генов). В общем, чем ближе фенотип к уровню действия гена, тем больше мы можем ожидать генетических эффектов. Если генетический вариант изменяет связывание фактора транскрипции, что приводит к снижению экспрессии генов, что снижает уровень белка, что приводит к нарушению физиологической функции и увеличению риска заболевания, размер эффекта этого варианта является самым большим на связывание фактора транскрипции, все еще весьма существенным на экспрессию генов, умеренным.
Важно, чтобы была продемонстрирована ненулевая наследуемость, чтобы поддерживать локализацию гена признака, а общая наследуемость, безусловно, устанавливает верхнюю границу возможных размеров эффекта отдельных локусов. Но гены признака с наследуемостью 80 % могут оказаться более сложными для локализации, чем признак с наследуемостью 40 %, если наследуемость первого признака обусловлена десятками или сотнями локусов с очень небольшим эффектом (например, ростом). , а наследуемость второго признака обусловлена несколькими локусами, некоторые из которых имеют умеренные размеры эффекта (например, уровни экспрессии генов). В общем, чем ближе фенотип к уровню действия гена, тем больше мы можем ожидать генетических эффектов. Если генетический вариант изменяет связывание фактора транскрипции, что приводит к снижению экспрессии генов, что снижает уровень белка, что приводит к нарушению физиологической функции и увеличению риска заболевания, размер эффекта этого варианта является самым большим на связывание фактора транскрипции, все еще весьма существенным на экспрессию генов, умеренным.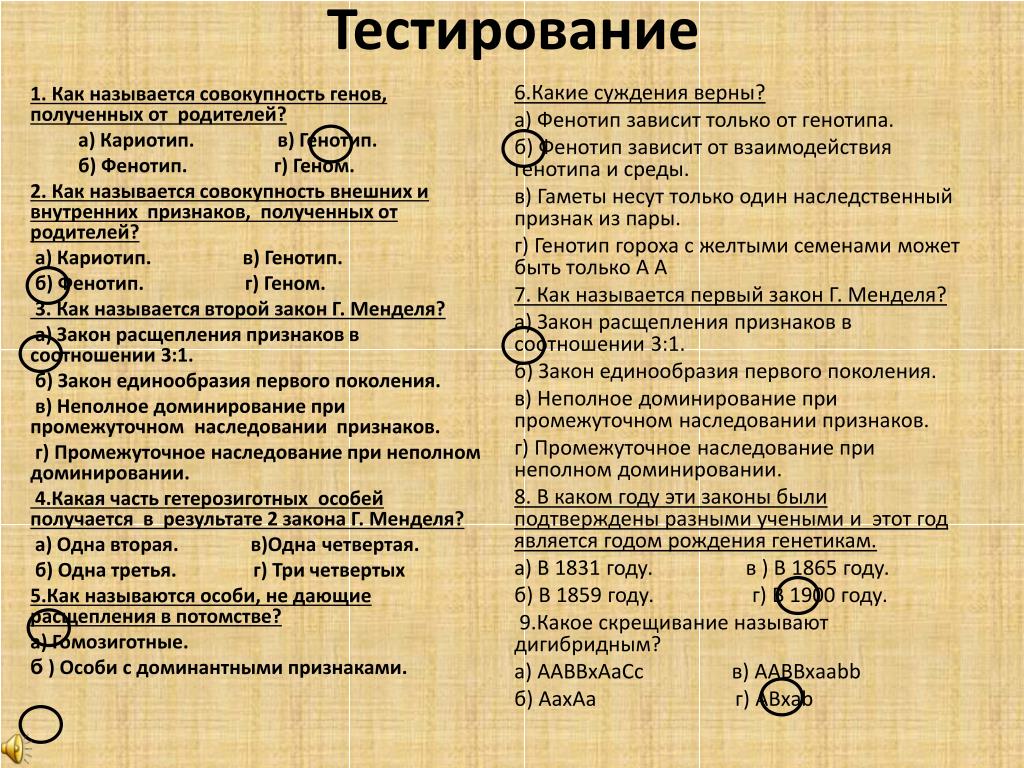 на физиологическую функцию и наименьший на риск заболевания. До сих пор существует относительно немного примеров, непосредственно сравнивающих эффект одного и того же функционального варианта в одном и том же образце на этих разных уровнях физиологического функционирования. Геринг и др. (2007) использовали измерения экспрессии генов для поиска генов, участвующих в регуляции холестерина ЛПВП, и идентифицировали вариант промотора, влияющий на сайт связывания транскрипции выше VNN1 , которые показали исключительно сильную связь с уровнями транскриптов VNN1 ( p = 5,7 × 10 −83 ) и более слабую связь с показателями холестерина ЛПВП (4,0 × 10 −4 ), что согласуется с представлением о том, что эффект размеры являются самыми высокими для фенотипических показателей, наиболее близких к действию варианта. Высокопроизводительные транскриптомные, метаболомные и протеомные подходы теперь предоставляют возможности для скрининга тысяч фенотипов, близких к уровню действия генов, для выявления новых количественных факторов риска.
на физиологическую функцию и наименьший на риск заболевания. До сих пор существует относительно немного примеров, непосредственно сравнивающих эффект одного и того же функционального варианта в одном и том же образце на этих разных уровнях физиологического функционирования. Геринг и др. (2007) использовали измерения экспрессии генов для поиска генов, участвующих в регуляции холестерина ЛПВП, и идентифицировали вариант промотора, влияющий на сайт связывания транскрипции выше VNN1 , которые показали исключительно сильную связь с уровнями транскриптов VNN1 ( p = 5,7 × 10 −83 ) и более слабую связь с показателями холестерина ЛПВП (4,0 × 10 −4 ), что согласуется с представлением о том, что эффект размеры являются самыми высокими для фенотипических показателей, наиболее близких к действию варианта. Высокопроизводительные транскриптомные, метаболомные и протеомные подходы теперь предоставляют возможности для скрининга тысяч фенотипов, близких к уровню действия генов, для выявления новых количественных факторов риска.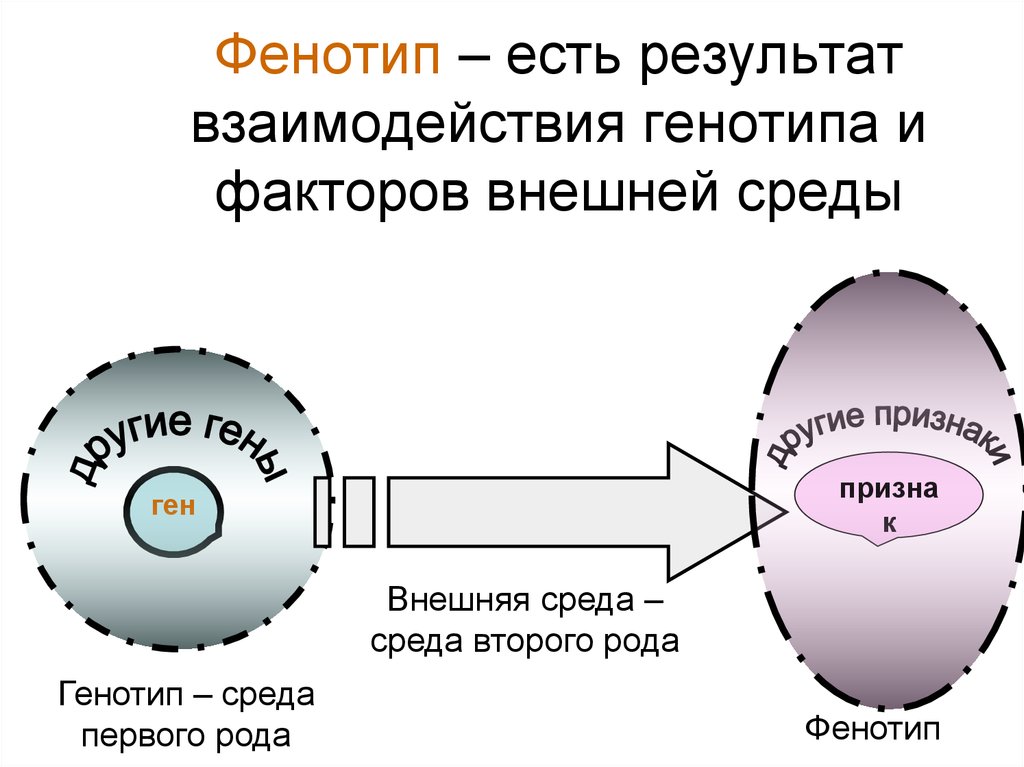
Для более традиционных количественных факторов риска, даже если они не являются генетически более простыми, в большинстве случаев они предлагают лучшую мощность для локализации генов, чем сопоставимые дихотомические фенотипы, просто из-за потери информации, присущей дихотомии, которая по существу является непрерывным процессом. В крайнем случае, прямой анализ индекса массы тела (ИМТ) более эффективен, чем анализ признака ожирения «да/нет», определяемого как пороговое значение в континууме ИМТ. В этом случае очевидно, что вариации ИМТ выше порога дают значимую информацию о тяжести фенотипа среди пораженных людей, а вариации ИМТ ниже порога могут давать информацию о большей и меньшей степени ответственности среди здоровых людей. Блангеро и др. (2003) оценили потерю информации о локализации гена, вызванную дихотомией непосредственно измеряемого количественного фенотипа, и обнаружили, что относительная эффективность дискретной категоризации по сравнению с исходной количественной мерой варьировала от 0,01 до 0,33 в зависимости от преобладания дискретного фенотипа.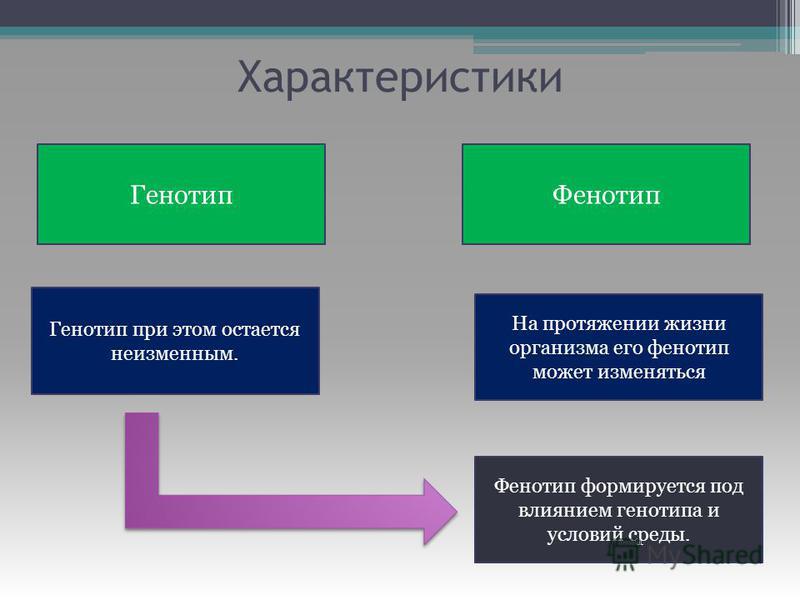 фенотип. Количественные способы измерения интересующего фенотипа также лучше отражают наше понимание генетики сложных человеческих признаков, чем дихотомические фенотипы «да/нет» (Plomin et al. 2009).). В целом, мы концептуализируем распространенные сложные заболевания человека как результат накопления факторов риска в соответствии с моделью «порога ответственности» (Falconer 1989). То есть люди с болезнью и без нее отличаются не по типу, а по степени. Вполне вероятно, что многие здоровые люди несут аллели риска, но их меньше, чем больных людей.
фенотип. Количественные способы измерения интересующего фенотипа также лучше отражают наше понимание генетики сложных человеческих признаков, чем дихотомические фенотипы «да/нет» (Plomin et al. 2009).). В целом, мы концептуализируем распространенные сложные заболевания человека как результат накопления факторов риска в соответствии с моделью «порога ответственности» (Falconer 1989). То есть люди с болезнью и без нее отличаются не по типу, а по степени. Вполне вероятно, что многие здоровые люди несут аллели риска, но их меньше, чем больных людей.
Чтобы установить количественный фактор риска или эндофенотип, необходимо задокументировать, что показатель различается у больных и здоровых лиц и является наследственным (Gottesman and Gould 2003). Кроме того, он должен значимо различаться у здоровых людей, чтобы он дифференцирул степени риска, а не просто резюмировал диагностическую дихотомию «да/нет». А для использования в генетических исследованиях в идеале должно быть практически и экономически целесообразно измерять большое количество людей. Если речь идет об индексации склонности к заболеванию, количественный фактор риска также должен различаться не только между больными и здоровыми людьми, но и между здоровыми родственниками пациентов и здоровыми людьми без семейного анамнеза заболевания. То, что фенотипы у здоровых родственников пациентов должны быть промежуточными между пациентами и контрольной группой, подразумевается существованием плейотропии между количественным фактором риска и заболеванием, которое возникает, когда на два фенотипа влияют перекрывающиеся наборы генов. Хотя демонстрация промежуточных средних значений признаков у здоровых родственников пациентов встречается чаще, более прямым средством установления существования плейотропии является генетическая корреляция между двумя признаками, которая количественно определяет степень перекрытия генетических эффектов на фенотипы (Falconer 19).89).
Если речь идет об индексации склонности к заболеванию, количественный фактор риска также должен различаться не только между больными и здоровыми людьми, но и между здоровыми родственниками пациентов и здоровыми людьми без семейного анамнеза заболевания. То, что фенотипы у здоровых родственников пациентов должны быть промежуточными между пациентами и контрольной группой, подразумевается существованием плейотропии между количественным фактором риска и заболеванием, которое возникает, когда на два фенотипа влияют перекрывающиеся наборы генов. Хотя демонстрация промежуточных средних значений признаков у здоровых родственников пациентов встречается чаще, более прямым средством установления существования плейотропии является генетическая корреляция между двумя признаками, которая количественно определяет степень перекрытия генетических эффектов на фенотипы (Falconer 19).89).
Традиционно время, необходимое для сбора подробного анамнеза или поведенческих данных, или биологических образцов, а также затраты на проведение многочисленных лабораторных анализов ограничивали количество фенотипов, собираемых для генетического исследования. Тем не менее, новые технологии автоматизируют фенотипирование, а также генотипирование, а быстро расширяющиеся возможности для сбора большого количества потенциальных эндофенотипов, клинических показателей и количественных факторов риска, связанных с заболеванием, создают новые проблемы. С появлением электронных медицинских карт можно получить доступ к широкому спектру вспомогательной информации об участниках исследования за небольшую плату или бесплатно для исследования, и новые генетические исследования разрабатываются на клинических популяциях, в которых пациенты дали согласие на использование. своих медицинских карт для генетических исследований (например, Bielinski et al. 2011). В дополнение к более классическим биомедицинским, клиническим и нейропсихологическим измерениям высокопроизводительные «омические» технологии теперь потенциально обеспечивают десятки тысяч количественных факторов риска в форме показателей транскрипции генов, уровней микроРНК, протеомики и метаболомики. Эти меры, вероятно, близки к уровню действия генов, улучшая способность обнаруживать генетические эффекты, но само количество доступных фенотипов усугубляет многочисленные проблемы тестирования, присущие скринингу всего генома, если такие скрининги проводятся для потенциально сотен или тысяч фенотипов.
Тем не менее, новые технологии автоматизируют фенотипирование, а также генотипирование, а быстро расширяющиеся возможности для сбора большого количества потенциальных эндофенотипов, клинических показателей и количественных факторов риска, связанных с заболеванием, создают новые проблемы. С появлением электронных медицинских карт можно получить доступ к широкому спектру вспомогательной информации об участниках исследования за небольшую плату или бесплатно для исследования, и новые генетические исследования разрабатываются на клинических популяциях, в которых пациенты дали согласие на использование. своих медицинских карт для генетических исследований (например, Bielinski et al. 2011). В дополнение к более классическим биомедицинским, клиническим и нейропсихологическим измерениям высокопроизводительные «омические» технологии теперь потенциально обеспечивают десятки тысяч количественных факторов риска в форме показателей транскрипции генов, уровней микроРНК, протеомики и метаболомики. Эти меры, вероятно, близки к уровню действия генов, улучшая способность обнаруживать генетические эффекты, но само количество доступных фенотипов усугубляет многочисленные проблемы тестирования, присущие скринингу всего генома, если такие скрининги проводятся для потенциально сотен или тысяч фенотипов. Значение ранжирования эндофенотипа (ERV; Glahn et al. 2012) представляет собой простой механизм для объективного ранжирования количественных факторов риска для выявления тех, которые могут обеспечить наилучшие возможности для локализации генов с плейотропными эффектами на родственное заболевание человека. ERV основан на стандартизированной генетической ковариации между фактором риска и заболеванием и представляет собой простую комбинацию наследуемости эндофенотипа (hendo2), наследуемости заболевания (hdis2) и генетической корреляции между ними (9).2677 ρ Г ):
Значение ранжирования эндофенотипа (ERV; Glahn et al. 2012) представляет собой простой механизм для объективного ранжирования количественных факторов риска для выявления тех, которые могут обеспечить наилучшие возможности для локализации генов с плейотропными эффектами на родственное заболевание человека. ERV основан на стандартизированной генетической ковариации между фактором риска и заболеванием и представляет собой простую комбинацию наследуемости эндофенотипа (hendo2), наследуемости заболевания (hdis2) и генетической корреляции между ними (9).2677 ρ Г ):
ERV=sqrt(hendo2)sqrt(hdis2)ρG
Варьируясь от нуля до единицы, с более высокими значениями, представляющими более сильный эндофенотип, ERV идентифицирует фенотипы с балансом между сильным генетическим сигналом (наследуемость эндофенотипа) и плейотропией между эндофенотипом и интересующим заболеванием (генетическая корреляция). Идеальный количественный фактор риска имеет как высокую наследуемость, так и высокую генетическую корреляцию с предрасположенностью к заболеванию. Глан и др. (2012) провели скрининг более 11 000 показателей транскрипции РНК в лимфоцитах и выявили восемь генов, уровни экспрессии которых были столь же сильными или более сильными эндофенотипами для рецидивирующей большой депрессии, как в опроснике депрессии Бека (BDI).
Глан и др. (2012) провели скрининг более 11 000 показателей транскрипции РНК в лимфоцитах и выявили восемь генов, уровни экспрессии которых были столь же сильными или более сильными эндофенотипами для рецидивирующей большой депрессии, как в опроснике депрессии Бека (BDI).
Было высказано предположение, что эндофенотипы или количественные факторы риска могут способствовать пониманию и интерпретации локусов, идентифицированных при сканировании генома конечной точки заболевания, помимо их значения для поиска генов. По своей природе сложные заболевания человека, вероятно, включают множество потенциальных биологических путей, посредством которых аллели риска могут влиять на предрасположенность к болезни. Демонстрация связи между определенным генетическим маркером и риском заболевания — это только первый шаг к пониманию того, как ген и его варианты могут влиять на заболевание и, следовательно, какие вмешательства в основные биологические системы могут лечить или предотвращать заболевание.
Подход «обратного эндофенотипа» предполагает использование клинических признаков или количественных показателей промежуточных фенотипов не для поиска генов, а для понимания действия ранее идентифицированных локусов. Рассмотрим локус, связанный с риском сердечно-сосудистых заболеваний. Он может воздействовать на гомеостаз артериального давления, метаболизм липидов, воспаление или любые другие механизмы. Выявление того, какой из этих количественных клинических маркеров также связан с локусом, помогает выяснить, как изменчивость гена влияет на риск заболевания, особенно в случаях, когда функция ассоциированного гена была ранее неизвестна, или в случаях, когда ген с известной функцией мог влиять на один локус. или более ряда основных путей, таких как в случае факторов транскрипции. Это может помочь в будущих функциональных исследованиях гена. Например, Денни и др. (2011) изучили электронные медицинские записи 13 617 человек, чтобы выявить дополнительные фенотипы, также связанные с SNP рядом с FOXE1, который ранее был идентифицирован с помощью анализа случай/контроль гипотиреоза.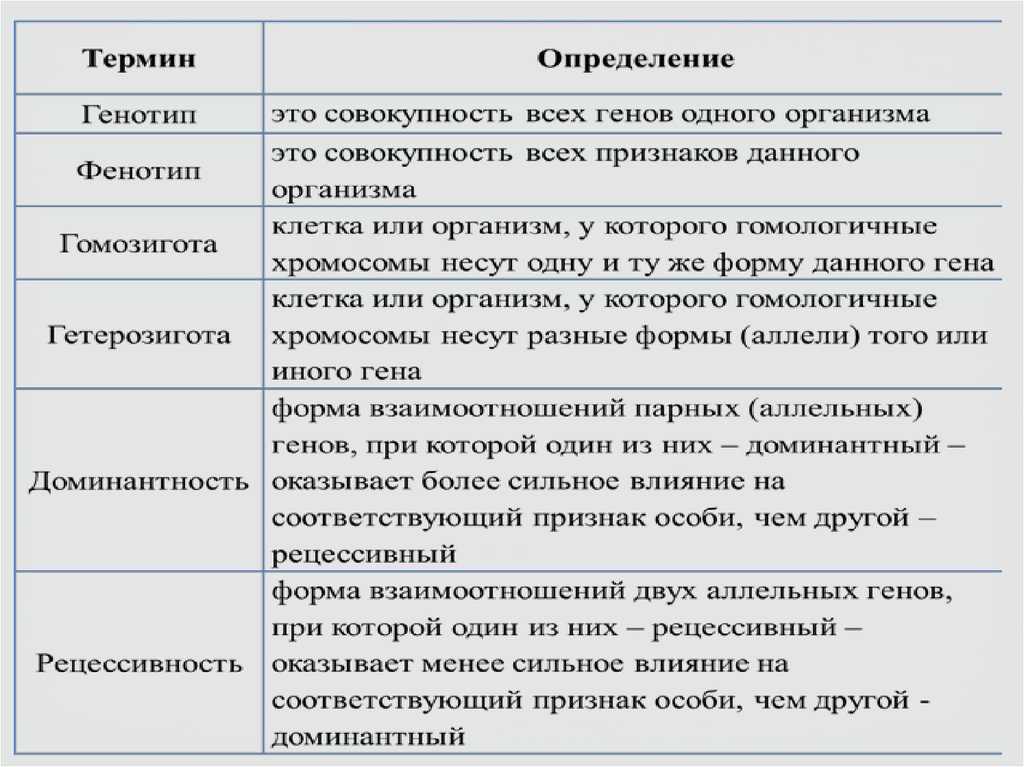 Они обнаружили, что частота тиреоидита, зоба и тиреотоксикоза различалась в зависимости от генотипа SNP, а болезнь Грейвса — нет. Тесно связанной концепцией является исследование ассоциации всего феномена (Pendergrass et al. 2011), в котором отбирается большое количество фенотипов и исследуются закономерности результатов для дополнительного понимания потенциальных плейотропных эффектов.
Они обнаружили, что частота тиреоидита, зоба и тиреотоксикоза различалась в зависимости от генотипа SNP, а болезнь Грейвса — нет. Тесно связанной концепцией является исследование ассоциации всего феномена (Pendergrass et al. 2011), в котором отбирается большое количество фенотипов и исследуются закономерности результатов для дополнительного понимания потенциальных плейотропных эффектов.
Другие описанные выше методы также могут применяться с целью интерпретации существующих сигналов, а не увеличения мощности для локализации. Например, упорядоченный анализ подмножества можно использовать для выявления клинических признаков, связанных с ранее обнаруженным очагом, или для выбора подмножества случаев с наиболее убедительными доказательствами локализации для секвенирования или других последующих исследований.
Даже с применением систем ранжирования, таких как ERV, вполне вероятно, что полногеномный скрининг будет использовать несколько фенотипов. В то время как стоимость секвенирования всего генома быстро снижается, она по-прежнему не является тривиальной, и исследователи, естественно, захотят извлечь максимально возможную научную ценность из этих дорогостоящих и амбициозных исследований, изучая как можно больше соответствующих фенотипов, для которых они имеют достаточную мощность для обнаружения генетических сигналов. . Такой скрининг фенотипа усугубляет и без того огромные проблемы множественного тестирования, присущие полногеномным скринингам последовательностей. Этот вопрос, конечно, не уникален для полногеномной последовательности, и неоднократно поднимался в контексте скрининга сцепления и полногеномной ассоциации. По существу, если тестируется множество фенотипов, но обычный полногеномный p пороговое значение, результаты не так защищены от ложных срабатываний, как можно было бы предположить при значении p . Чем больше число проверенных фенотипов, тем выше шансы превысить этот общегеномный порог значения p только случайно.
. Такой скрининг фенотипа усугубляет и без того огромные проблемы множественного тестирования, присущие полногеномным скринингам последовательностей. Этот вопрос, конечно, не уникален для полногеномной последовательности, и неоднократно поднимался в контексте скрининга сцепления и полногеномной ассоциации. По существу, если тестируется множество фенотипов, но обычный полногеномный p пороговое значение, результаты не так защищены от ложных срабатываний, как можно было бы предположить при значении p . Чем больше число проверенных фенотипов, тем выше шансы превысить этот общегеномный порог значения p только случайно.
Проблема усугубляется тем фактом, что проверяемые фенотипы, как правило, коррелируют друг с другом, поскольку они, вероятно, были выбраны из-за их общего отношения к интересующему заболеванию. Эта корреляция между фенотипами делает поправку Бонферрони чрезмерно консервативной. Существует ряд потенциальных стратегий решения проблем множественного тестирования, возникающих при использовании множественных фенотипов. С аналитической точки зрения проще всего переосмыслить исследование как создание гипотезы, а не проверку гипотезы, и полагаться на воспроизведение небольшого числа конкретных гипотез фенотипа/генотипа в независимой выборке для установления порога значимости. Конечно, это не всегда возможно, особенно для фенотипов, которые обычно не измеряются или требуют больших затрат, и поэтому могут быть недоступны для достаточного количества людей в более чем одном генетическом исследовании. Альтернативой является использование корреляционной структуры между фенотипами для оценки эффективного числа независимых фенотипов, что можно легко сделать с помощью методов, изначально разработанных для оценки числа независимых SNP с учетом характера неравновесия по сцеплению между ними (например, Москвина и Шимидт). 2008). Поправка Бонферрони к желаемому p Значение порога затем может быть сделано на основе эффективного числа независимых фенотипов с учетом корреляций между ними. Штейн и др. (2012) использовали этот подход в мета-анализе GWAS гиппокампального, внутричерепного и общего объемов мозга.
С аналитической точки зрения проще всего переосмыслить исследование как создание гипотезы, а не проверку гипотезы, и полагаться на воспроизведение небольшого числа конкретных гипотез фенотипа/генотипа в независимой выборке для установления порога значимости. Конечно, это не всегда возможно, особенно для фенотипов, которые обычно не измеряются или требуют больших затрат, и поэтому могут быть недоступны для достаточного количества людей в более чем одном генетическом исследовании. Альтернативой является использование корреляционной структуры между фенотипами для оценки эффективного числа независимых фенотипов, что можно легко сделать с помощью методов, изначально разработанных для оценки числа независимых SNP с учетом характера неравновесия по сцеплению между ними (например, Москвина и Шимидт). 2008). Поправка Бонферрони к желаемому p Значение порога затем может быть сделано на основе эффективного числа независимых фенотипов с учетом корреляций между ними. Штейн и др. (2012) использовали этот подход в мета-анализе GWAS гиппокампального, внутричерепного и общего объемов мозга. Они исследовали ассоциации для восьми показателей объема мозга и использовали матрицу взаимных корреляций между фенотипами, которая была рассчитана на основе статистики t для ассоциаций с каждым из этих фенотипов с каждым SNP GWAS. Собственные значения корреляционной матрицы затем использовали для определения того, что эти восемь мер эквивалентны тестированию четырех независимых фенотипов, а желаемый порог значимости для их GWAS был скорректирован Бонферрони на эффективное количество тестируемых независимых фенотипов.
Они исследовали ассоциации для восьми показателей объема мозга и использовали матрицу взаимных корреляций между фенотипами, которая была рассчитана на основе статистики t для ассоциаций с каждым из этих фенотипов с каждым SNP GWAS. Собственные значения корреляционной матрицы затем использовали для определения того, что эти восемь мер эквивалентны тестированию четырех независимых фенотипов, а желаемый порог значимости для их GWAS был скорректирован Бонферрони на эффективное количество тестируемых независимых фенотипов.
Многие исследования количественных факторов риска проводят скрининг генома с помощью этих мер, а затем проверяют, показывают ли ассоциированные маркеры сигнал об интересующем заболевании. В частности, в случае исследований нормальной изменчивости, результаты скрининга генома на множественные признаки, которые, как известно, связаны между собой, могут быть проверены на соответствие результатов по фенотипам. Альтернативой этим последовательным подходам является совместный анализ нескольких фенотипов. Методы совместного анализа нескольких признаков были разработаны для обоих видов сцепления (например, Almasy et al. 1997) и ассоциации (например, Saint-Pierre et al. 2011). Хотя совместные анализы сокращают количество тестов и могут увеличить мощность, они обычно достигаются за счет дополнительных степеней свободы в тестовой статистике. Кроме того, хотя теоретически эти методы многомерного анализа могут быть расширены для включения любого количества фенотипов, на практике они могут стать непомерно вычислительными по мере увеличения числа фенотипов, и редко можно увидеть более двух фенотипов в анализе, и довольно редко найти более трех фенотипов, проанализированных совместно.
Методы совместного анализа нескольких признаков были разработаны для обоих видов сцепления (например, Almasy et al. 1997) и ассоциации (например, Saint-Pierre et al. 2011). Хотя совместные анализы сокращают количество тестов и могут увеличить мощность, они обычно достигаются за счет дополнительных степеней свободы в тестовой статистике. Кроме того, хотя теоретически эти методы многомерного анализа могут быть расширены для включения любого количества фенотипов, на практике они могут стать непомерно вычислительными по мере увеличения числа фенотипов, и редко можно увидеть более двух фенотипов в анализе, и довольно редко найти более трех фенотипов, проанализированных совместно.
Теоретические и симуляционные исследования показывают, что анализ множественных признаков повышает способность локализовать гены, влияющие на интересующий фенотип, в рамках различных генетических моделей, но эта способность максимальна, когда имеется несколько локусов с генетическими корреляциями разных направлений, совместно влияющих на два фенотипа, так что корреляция из-за интересующего локуса и корреляция из-за остаточных генетических эффектов других локусов имеют противоположные направления (Amos et al. , 2001; Saint-Pierre et al., 2011). В дополнение к симуляциям, документирующим повышение мощности их подхода двумерной ассоциации, Saint-Pierre et al. проиллюстрированы потенциальные результаты GWAS минеральной плотности кости, измеренной в поясничном отделе позвоночника и шейке бедра. Все высшие ассоциативные сигналы одномерного GWAS по одному признаку также были обнаружены в двумерном GWAS. Напротив, из 100 лучших ассоциаций двумерного GWAS 52 SNP также имели сильные сигналы по крайней мере от одного из одномерных сканирований, а многие маркеры имели более слабые сигналы, но 16 SNP с сильными сигналами в двумерном GWAS не достигли даже номинальной значимости. ( p <0,05) в любом из одномерных GWAS, предполагая, что двумерный подход может выявить ассоциации, которые в противном случае были бы упущены.
, 2001; Saint-Pierre et al., 2011). В дополнение к симуляциям, документирующим повышение мощности их подхода двумерной ассоциации, Saint-Pierre et al. проиллюстрированы потенциальные результаты GWAS минеральной плотности кости, измеренной в поясничном отделе позвоночника и шейке бедра. Все высшие ассоциативные сигналы одномерного GWAS по одному признаку также были обнаружены в двумерном GWAS. Напротив, из 100 лучших ассоциаций двумерного GWAS 52 SNP также имели сильные сигналы по крайней мере от одного из одномерных сканирований, а многие маркеры имели более слабые сигналы, но 16 SNP с сильными сигналами в двумерном GWAS не достигли даже номинальной значимости. ( p <0,05) в любом из одномерных GWAS, предполагая, что двумерный подход может выявить ассоциации, которые в противном случае были бы упущены.
Альтернативный подход к совместному анализу набора связанных признаков заключается в попытке вывести новый фенотип или фенотипы, которые представляют один или несколько основных общих факторов, общих для набора признаков. В идеале эти новые фенотипы ортогональны друг другу и не коррелированы в надежде, что каждый из них представляет другой основной путь или область генетического влияния. Это обычно делается с помощью факторного анализа и, в частности, анализа основных компонентов. Если набор связанных фенотипов особенно велик, этот подход может значительно сократить многократное тестирование, которое потребовалось бы при проведении отдельных скринингов генома для каждого фенотипа, и в вычислительном отношении более податлив, чем полный многомерный анализ. Вариантом этой стратегии является метод «основных компонентов наследуемости» (PCH), в котором вместо максимизации общей фенотипической изменчивости, объясняемой наибольшими производными компонентами, подход максимизирует наследуемость основных компонентов, т. е. генетическую изменчивость, объясняемую компонента (Отт и Рабинович 1999). Хотя существует множество примеров исследований сцепления, проведенных на основных компонентах, полученных из наборов родственных фенотипов (например, Dick et al.
В идеале эти новые фенотипы ортогональны друг другу и не коррелированы в надежде, что каждый из них представляет другой основной путь или область генетического влияния. Это обычно делается с помощью факторного анализа и, в частности, анализа основных компонентов. Если набор связанных фенотипов особенно велик, этот подход может значительно сократить многократное тестирование, которое потребовалось бы при проведении отдельных скринингов генома для каждого фенотипа, и в вычислительном отношении более податлив, чем полный многомерный анализ. Вариантом этой стратегии является метод «основных компонентов наследуемости» (PCH), в котором вместо максимизации общей фенотипической изменчивости, объясняемой наибольшими производными компонентами, подход максимизирует наследуемость основных компонентов, т. е. генетическую изменчивость, объясняемую компонента (Отт и Рабинович 1999). Хотя существует множество примеров исследований сцепления, проведенных на основных компонентах, полученных из наборов родственных фенотипов (например, Dick et al. , 2002; Arya et al., 2002), этот подход еще не нашел широкого применения в GWAS.
, 2002; Arya et al., 2002), этот подход еще не нашел широкого применения в GWAS.
Описанный выше подход кластерного анализа для выявления более однородных подгрупп пациентов также можно использовать как средство выделения новых фенотипов из набора клинических признаков. В этом приложении вместо того, чтобы относить пациентов к определенной подгруппе, вероятность принадлежности к группе, полученная в результате кластерного анализа, анализируется как количественная характеристика для каждого человека в каждой подгруппе. Например, Уилкокс и соавт. (2009 г.) использовали этот подход в GWAS фенотипов, связанных с сердечно-сосудистыми заболеваниями, в Framingham Heart Study. Они выявили пять кластеров среди участников Framingham Offspring Cohort, в том числе один с высоким уровнем ожирения и один с признаками метаболического синдрома. GWAS случай/контроль, сравнивающий случаи в этих кластерах с контролем в двух других кластерах, привел к одному значимому для всего генома SNP на хромосоме 4. GWAS, используя вероятность принадлежности к кластерам ожирения и метаболического синдрома, также идентифицировал область на хромосоме 4 с более сильным p значений.
GWAS, используя вероятность принадлежности к кластерам ожирения и метаболического синдрома, также идентифицировал область на хромосоме 4 с более сильным p значений.
Методы и схемы исследований, использующие преимущества сложности фенотипа, промежуточных фенотипов или эндофенотипов и множественных родственных фенотипов, предлагают два основных преимущества в эпоху полногеномных исследований секвенирования. Они могут помочь в интерпретации результатов наших исследований по локализации и идентификации генов, помогая понять биологические пути, посредством которых варианты ДНК оказывают свое влияние на изменчивость человека, и позволяя нам формировать более подробные гипотезы для последующих функциональных исследований. Они также могут улучшить возможности исследований локализации и идентификации генов за счет уменьшения или явного моделирования генетической гетерогенности, за счет использования фенотипов, более близких к действию генов, или за счет использования корреляционных структур для идентификации генов, совместно влияющих на наборы родственных фенотипов. Многие из этих подходов были разработаны в эпоху сцепления и до сих пор не нашли широкого применения в GWAS или исследованиях секвенирования. Моделирование для оценки мощности и частоты ложных срабатываний в этих контекстах и дополнительные примеры практического применения этих стратегий потребуются для установления их потенциальной полезности. Что касается фенотипирования, продолжающиеся технологические разработки в области экспрессии генов с высокой пропускной способностью, а также метаболомных и протеомных методов сделали возможным сбор тысяч измерений для каждого человека, что создаст как аналитические проблемы, так и возможности, а также продолжающееся развитие статистических генетических методов для принятия решений. потребуются более богатые и подробные данные о явлениях.
Многие из этих подходов были разработаны в эпоху сцепления и до сих пор не нашли широкого применения в GWAS или исследованиях секвенирования. Моделирование для оценки мощности и частоты ложных срабатываний в этих контекстах и дополнительные примеры практического применения этих стратегий потребуются для установления их потенциальной полезности. Что касается фенотипирования, продолжающиеся технологические разработки в области экспрессии генов с высокой пропускной способностью, а также метаболомных и протеомных методов сделали возможным сбор тысяч измерений для каждого человека, что создаст как аналитические проблемы, так и возможности, а также продолжающееся развитие статистических генетических методов для принятия решений. потребуются более богатые и подробные данные о явлениях.
Эта работа была частично поддержана R01 MH59490 от Национального института психического здоровья и R01 GM31575 от Национального института общих медицинских наук.




 2016;68:2795–805.
2016;68:2795–805. J Ревматол. 2016;43:1093–100.
J Ревматол. 2016;43:1093–100.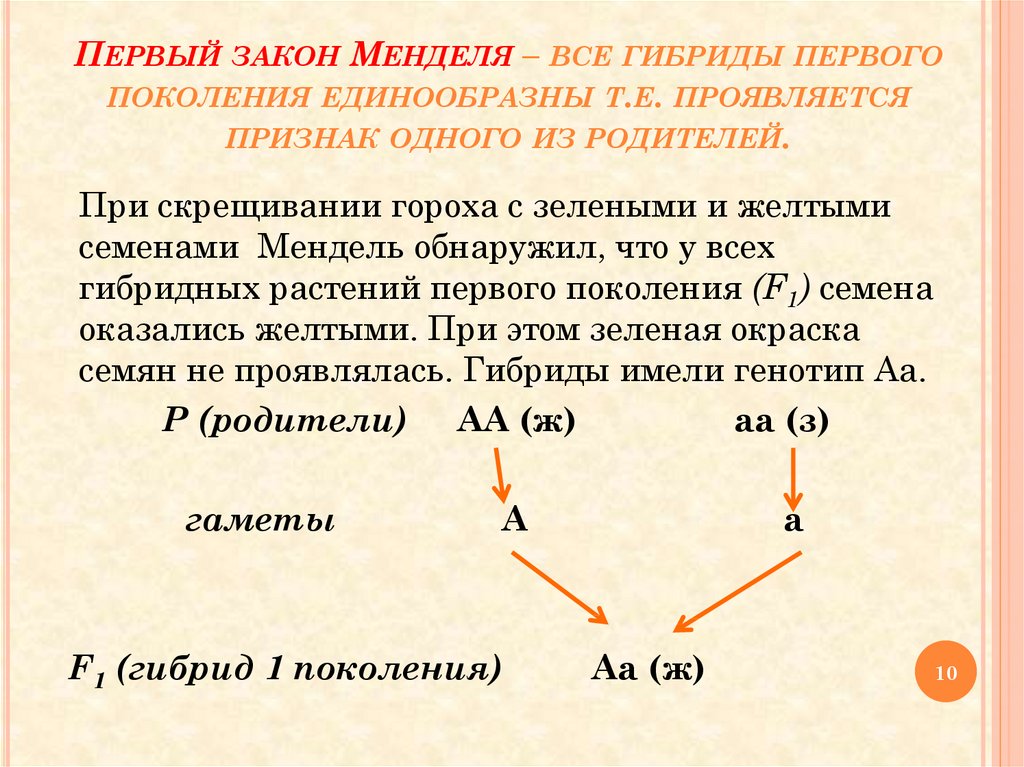 Lachmann
Lachmann Лахманн
Лахманн резус-фенотипы
резус-фенотипы 1
1 Двумерный количественный анализ сцепления признаков: плейотропия по сравнению с совпадающими связями. Генетический эпидемиол. 1997; 14: 953–958. [PubMed] [Google Scholar]
Двумерный количественный анализ сцепления признаков: плейотропия по сравнению с совпадающими связями. Генетический эпидемиол. 1997; 14: 953–958. [PubMed] [Google Scholar] БМС Генет. 2005;6:С1. [Бесплатная статья PMC] [PubMed] [Google Scholar]
БМС Генет. 2005;6:С1. [Бесплатная статья PMC] [PubMed] [Google Scholar] Дж., Мартинес М., Нойман Р.Дж., Провинция М., Шимчак С., Уилкокс М.А., Циглер А., МакКлуер Дж.В., Алмаси Л. Семинар 16 по генетическому анализу: стратегии анализа ассоциаций по всему геному. BMC Proc. 2009 г.;3(Приложение 7):S1. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Дж., Мартинес М., Нойман Р.Дж., Провинция М., Шимчак С., Уилкокс М.А., Циглер А., МакКлуер Дж.В., Алмаси Л. Семинар 16 по генетическому анализу: стратегии анализа ассоциаций по всему геному. BMC Proc. 2009 г.;3(Приложение 7):S1. [Бесплатная статья PMC] [PubMed] [Google Scholar] Предполагаемое сцепление на хромосоме 1 для количественного фенотипа, связанного с алкоголем. Алкоголь Clin Exp Res. 2002; 26:1453–1460. [PubMed] [Google Scholar]
Предполагаемое сцепление на хромосоме 1 для количественного фенотипа, связанного с алкоголем. Алкоголь Clin Exp Res. 2002; 26:1453–1460. [PubMed] [Google Scholar] Л., Кочунов П., Дуггирала Р., Фокс П.Т., Алмаси Л., Блангеро Дж. Высокоразмерное ранжирование эндофенотипов в поиске генов риска большой депрессии. Биол психиатрия. 2012;71:6–14. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Л., Кочунов П., Дуггирала Р., Фокс П.Т., Алмаси Л., Блангеро Дж. Высокоразмерное ранжирование эндофенотипов в поиске генов риска большой депрессии. Биол психиатрия. 2012;71:6–14. [Бесплатная статья PMC] [PubMed] [Google Scholar] 1990; 250:1684–1689. [PubMed] [Google Scholar]
1990; 250:1684–1689. [PubMed] [Google Scholar] И., Монпетит А., Полихронакос С., Вейл Дж., Коин Л.Дж., Ашер Дж., Эллиотт П., Ярвелин М.Р., Висвикис-Сист С., Балкау Б., Сладек Р., Болдинг Д., Уолли А., Дина С., Фрогел П. Исследование ассоциации всего генома раннего и патологического ожирения у взрослых выявило три новых локуса риска в популяциях Европы. Нат Жене. 2009 г.;41:157–159. [PubMed] [Google Scholar]
И., Монпетит А., Полихронакос С., Вейл Дж., Коин Л.Дж., Ашер Дж., Эллиотт П., Ярвелин М.Р., Висвикис-Сист С., Балкау Б., Сладек Р., Болдинг Д., Уолли А., Дина С., Фрогел П. Исследование ассоциации всего генома раннего и патологического ожирения у взрослых выявило три новых локуса риска в популяциях Европы. Нат Жене. 2009 г.;41:157–159. [PubMed] [Google Scholar] , Бернардинелли Л., Пейванди Ф., Тубаро М. , Челли П., Феррарио М., Фетиво Р., Марцильяно Н., Казари Г., Галли М., Рибичини Ф., Росси М., Бернарди Ф., Зонзин П., Пьяцца А., Маннуччи П.М., Шварц С.М., Сисковик Д.С., Йи Дж., Фридлендер Ю., Элосуа Р., Марругат Дж., Лукас Дж., Субирана И., Сала Дж., Рамос Р., Катиресан С., Мейгс Дж. Б., Уильямс Дж., Натан Д.М., Макрей К.А., О’Доннелл К.Дж., Саломаа В., Хавулинна А.С., Пелтонен Л., Меландер О., Берглунд Г., Войт Б.Ф., Катиресан С., Хиршхорн Дж.Н., Асселта Р., Дуга С., Спреафико М., Мусунуру К., Дейли М.Дж., Перселл С., Войт Б.Ф., Перселл С., Немеш Дж., Корн Дж.М., Маккэрролл С.А., Шварц С.М., Йи Дж., Катиресан С., Лукас Г., Субирана И., Элосуа Р., Сурти А., Гвидуччи С., Джаннини Л., Мирел Д., Паркин М., Бертт Н., Габриэль С.Б., Самани Н.Дж., Томпсон Дж.Р., Браунд П.С., Райт Б.Дж., Бальмфорт А.Дж., Болл С.Г., Холл А.С., Консорциум по управлению делами Wellcome Trust. Шункерт Х., Эрдманн Дж., Линзель-Нитшке П., Либ В., Циглер А., Кениг И., Хенгстенберг С.
, Бернардинелли Л., Пейванди Ф., Тубаро М. , Челли П., Феррарио М., Фетиво Р., Марцильяно Н., Казари Г., Галли М., Рибичини Ф., Росси М., Бернарди Ф., Зонзин П., Пьяцца А., Маннуччи П.М., Шварц С.М., Сисковик Д.С., Йи Дж., Фридлендер Ю., Элосуа Р., Марругат Дж., Лукас Дж., Субирана И., Сала Дж., Рамос Р., Катиресан С., Мейгс Дж. Б., Уильямс Дж., Натан Д.М., Макрей К.А., О’Доннелл К.Дж., Саломаа В., Хавулинна А.С., Пелтонен Л., Меландер О., Берглунд Г., Войт Б.Ф., Катиресан С., Хиршхорн Дж.Н., Асселта Р., Дуга С., Спреафико М., Мусунуру К., Дейли М.Дж., Перселл С., Войт Б.Ф., Перселл С., Немеш Дж., Корн Дж.М., Маккэрролл С.А., Шварц С.М., Йи Дж., Катиресан С., Лукас Г., Субирана И., Элосуа Р., Сурти А., Гвидуччи С., Джаннини Л., Мирел Д., Паркин М., Бертт Н., Габриэль С.Б., Самани Н.Дж., Томпсон Дж.Р., Браунд П.С., Райт Б.Дж., Бальмфорт А.Дж., Болл С.Г., Холл А.С., Консорциум по управлению делами Wellcome Trust. Шункерт Х., Эрдманн Дж., Линзель-Нитшке П., Либ В., Циглер А., Кениг И., Хенгстенберг С. , Фишер М., Штарк К., Гросшенниг А., Прейсс М., Вихманн Х.Е., Шрайбер С., Шункерт Х., Самани Н.Дж., Эрдманн Дж., Оувеханд В., Хенгстенберг С., Делокас П., Шольц М., Камбьен Ф., Рейли М.П., Ли М., Чен З., Виленски Р., Маттай В., Касим А., Хаконарсон Х.Х., Девани Дж., Бернетт М.С., Пичард А.Д., Кент К.М., Сатлер Л. , Линдси Дж.М., Ваксман Р., Кнуфф К.В., Уотерворт Д.М., Уокер М.С., Мозер В., Эпштейн С.Е., Рейдер Д.Дж., Шеффолд Т., Бергер К., Столл М., Огромный А., Гирелли Д., Мартинелли Н., Оливьери О., Коррочер Р., Морган Т., Спертус Дж. А., МакКаун П., Паттерсон К. С., Шункерт Х., Эрдманн Э., Линзель-Нитшке П., Либ В., Зиглер А., Кениг И. Р., Хенгстенберг С., Фишер М., Старк К., Гросшенниг А., Прейсс М., Вихманн Х. Е., Шрайбер S, Hólm H, Thorleifsson G, Thorsteinsdottir U, Stefansson K, Engert JC, Do R, Xie C, Anand S, Kathiresan S, Ardissino D, Mannucci PM, Siscovick D, O’Donnell CJ, Samani NJ, Melander O, Elosua Р., Пелтонен Л., Саломаа В., Шварц С.М., Альтш uler D. Полногеномная ассоциация раннего инфаркта миокарда с однонуклеотидными полиморфизмами и вариантами числа копий.
, Фишер М., Штарк К., Гросшенниг А., Прейсс М., Вихманн Х.Е., Шрайбер С., Шункерт Х., Самани Н.Дж., Эрдманн Дж., Оувеханд В., Хенгстенберг С., Делокас П., Шольц М., Камбьен Ф., Рейли М.П., Ли М., Чен З., Виленски Р., Маттай В., Касим А., Хаконарсон Х.Х., Девани Дж., Бернетт М.С., Пичард А.Д., Кент К.М., Сатлер Л. , Линдси Дж.М., Ваксман Р., Кнуфф К.В., Уотерворт Д.М., Уокер М.С., Мозер В., Эпштейн С.Е., Рейдер Д.Дж., Шеффолд Т., Бергер К., Столл М., Огромный А., Гирелли Д., Мартинелли Н., Оливьери О., Коррочер Р., Морган Т., Спертус Дж. А., МакКаун П., Паттерсон К. С., Шункерт Х., Эрдманн Э., Линзель-Нитшке П., Либ В., Зиглер А., Кениг И. Р., Хенгстенберг С., Фишер М., Старк К., Гросшенниг А., Прейсс М., Вихманн Х. Е., Шрайбер S, Hólm H, Thorleifsson G, Thorsteinsdottir U, Stefansson K, Engert JC, Do R, Xie C, Anand S, Kathiresan S, Ardissino D, Mannucci PM, Siscovick D, O’Donnell CJ, Samani NJ, Melander O, Elosua Р., Пелтонен Л., Саломаа В., Шварц С.М., Альтш uler D. Полногеномная ассоциация раннего инфаркта миокарда с однонуклеотидными полиморфизмами и вариантами числа копий. Нат Жене. 2009 г.;41:334–41. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Нат Жене. 2009 г.;41:334–41. [Бесплатная статья PMC] [PubMed] [Google Scholar] Упорядоченный анализ подмножества для исследований случай-контроль. Генетический эпидемиол. 2010; 34: 407–417. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Упорядоченный анализ подмножества для исследований случай-контроль. Генетический эпидемиол. 2010; 34: 407–417. [Бесплатная статья PMC] [PubMed] [Google Scholar] George-Hyslop PH, Tanzi RE, Polinsky RJ, Haines JL, Nee L, Watkins PC, Myers RH, Feldman RG, Pollen D, Drachman D. Генетический дефект, вызывающий картирование семейной болезни Альцгеймера на хромосоме 21. Наука. 1987; 235: 885–890. [PubMed] [Google Scholar]
George-Hyslop PH, Tanzi RE, Polinsky RJ, Haines JL, Nee L, Watkins PC, Myers RH, Feldman RG, Pollen D, Drachman D. Генетический дефект, вызывающий картирование семейной болезни Альцгеймера на хромосоме 21. Наука. 1987; 235: 885–890. [PubMed] [Google Scholar] Г., Кантор Р.М., Карлесс М.А., Корвин А., Чиш М., Карран Дж.Э., Дэвис Г., де Алмейда М.А., Деланти Н., Депонд С., Дуггирала Р., Дайер Т.Д., Эрк С., Фагернесс Дж., Фокс П.Т., Фраймер Н.Б., Гилл М., Геринг Х.Х., Хаглер Д.Дж., Хен Д., Холсбур Ф., Хугман М., Хостен Н., Джаханшад Н., Джонсон М.П., Касперавичют e D, Кент Дж.В., младший, Кочунов П., Ланкастер Дж.Л., Лори С.М., Левальд Д.К., Мандл Р., Матарин М., Маттейсен М., Мейзенцаль Э., Мелле И., Моисей Э.К., Мюлейзен Т.В., Наук М., Нётен М.М., Олвера Р.Л., Пандольфо М., Пайк ГБ, Пульс Р., Рейнванг И., Рентерия М.Э., Ритшель М., Роффман Дж.Л., Ройл Н.А., Ружеску Д., Савиц Дж., Шнак Х.Г., Шнелл К., Зайферт Н., Смит С., Стин В.М., Вальдес Эрнандес М.С., Ван ден Хеувел М., ван дер Ви Н.Дж., Ван Харен Н.Е., Вельтман Дж.А., Вёльцке Х., Уокер Р., Вестли Л.Т., Уилан К.Д., Агарц И., Бумсма Д.И., Каваллери Г.Л., Дейл А.М., Джурович С., Древец В.К., Хагурт П., Холл J, Heinz A, Jack CR, Jr, Foroud TM, Le Hellard S, Macciardi F, Montgomery GW, Poline JB, Porteous DJ, Sisodiya SM, Starr JM, Sussmann J, Toga AW, Veltman DJ, Walter H, Weiner MW, Инициатива нейровизуализации болезни Альцгеймера (ADNI) Консорциум EPIGEN.
Г., Кантор Р.М., Карлесс М.А., Корвин А., Чиш М., Карран Дж.Э., Дэвис Г., де Алмейда М.А., Деланти Н., Депонд С., Дуггирала Р., Дайер Т.Д., Эрк С., Фагернесс Дж., Фокс П.Т., Фраймер Н.Б., Гилл М., Геринг Х.Х., Хаглер Д.Дж., Хен Д., Холсбур Ф., Хугман М., Хостен Н., Джаханшад Н., Джонсон М.П., Касперавичют e D, Кент Дж.В., младший, Кочунов П., Ланкастер Дж.Л., Лори С.М., Левальд Д.К., Мандл Р., Матарин М., Маттейсен М., Мейзенцаль Э., Мелле И., Моисей Э.К., Мюлейзен Т.В., Наук М., Нётен М.М., Олвера Р.Л., Пандольфо М., Пайк ГБ, Пульс Р., Рейнванг И., Рентерия М.Э., Ритшель М., Роффман Дж.Л., Ройл Н.А., Ружеску Д., Савиц Дж., Шнак Х.Г., Шнелл К., Зайферт Н., Смит С., Стин В.М., Вальдес Эрнандес М.С., Ван ден Хеувел М., ван дер Ви Н.Дж., Ван Харен Н.Е., Вельтман Дж.А., Вёльцке Х., Уокер Р., Вестли Л.Т., Уилан К.Д., Агарц И., Бумсма Д.И., Каваллери Г.Л., Дейл А.М., Джурович С., Древец В.К., Хагурт П., Холл J, Heinz A, Jack CR, Jr, Foroud TM, Le Hellard S, Macciardi F, Montgomery GW, Poline JB, Porteous DJ, Sisodiya SM, Starr JM, Sussmann J, Toga AW, Veltman DJ, Walter H, Weiner MW, Инициатива нейровизуализации болезни Альцгеймера (ADNI) Консорциум EPIGEN. Консорциум ИМА-ГЕНЕРАЛ. Saguenay Youth Study Group (SYS) Bis JC, Ikram MA, Smith AV, Gudnason V, Tzourio C, Vernooij MW, Launer LJ, Decarli C, Seshadri S, Cohorts for Heart and Aging Research in Genomic Epidemiology (CHARGE) Consortium. Консорциум по улучшению генетики нейровизуализации посредством метаанализа (ENIGMA). Андреассен О.А., Апостолова Л.Г., Бастин М.Е., Блангеро Дж., Бруннер Х.Г., Бакнер Р.Л., Сичон С., Коппола Г., де Зубикарай Г.И., Дири И.Дж., Донохью Г., де Геус Э.Дж., Эспесет Т., Фернандес Г., Глан Д.К., Грабе Х.Дж., Hardy J, Hulshoff Pol HE, Jenkinson M, Kahn RS, McDonald C, McIntosh AM, McMahon FJ, McMahon KL, Meyer-Lindenberg A, Morris DW, Müller-Myhsok B, Nichols TE, Ophoff RA, Paus T, Pausova Z, Пеннинкс Б.В., Поткин С.Г., Семанн П.Г., Сайкин А.Дж., Шуманн Г., Смоллер Дж.В., Уордлоу Дж.М., Уил М.Е., Мартин Н.Г., Франке Б., Райт М.Дж., Томпсон П.М. Идентификация общих вариантов, связанных с гиппокампальным и внутричерепным объемами человека. Нат Жене. 2012; 44: 552–561.
Консорциум ИМА-ГЕНЕРАЛ. Saguenay Youth Study Group (SYS) Bis JC, Ikram MA, Smith AV, Gudnason V, Tzourio C, Vernooij MW, Launer LJ, Decarli C, Seshadri S, Cohorts for Heart and Aging Research in Genomic Epidemiology (CHARGE) Consortium. Консорциум по улучшению генетики нейровизуализации посредством метаанализа (ENIGMA). Андреассен О.А., Апостолова Л.Г., Бастин М.Е., Блангеро Дж., Бруннер Х.Г., Бакнер Р.Л., Сичон С., Коппола Г., де Зубикарай Г.И., Дири И.Дж., Донохью Г., де Геус Э.Дж., Эспесет Т., Фернандес Г., Глан Д.К., Грабе Х.Дж., Hardy J, Hulshoff Pol HE, Jenkinson M, Kahn RS, McDonald C, McIntosh AM, McMahon FJ, McMahon KL, Meyer-Lindenberg A, Morris DW, Müller-Myhsok B, Nichols TE, Ophoff RA, Paus T, Pausova Z, Пеннинкс Б.В., Поткин С.Г., Семанн П.Г., Сайкин А.Дж., Шуманн Г., Смоллер Дж.В., Уордлоу Дж.М., Уил М.Е., Мартин Н.Г., Франке Б., Райт М.Дж., Томпсон П.М. Идентификация общих вариантов, связанных с гиппокампальным и внутричерепным объемами человека. Нат Жене. 2012; 44: 552–561.