Презентация о толерантности: «Толерантность.». Скачать бесплатно и без регистрации.
Презентация Толерантность доклад, проект
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экономика
Презентация на тему Презентация Толерантность, предмет презентации: Английский язык. Этот материал в формате pptx (PowerPoint) содержит 14 слайдов, для просмотра воспользуйтесь проигрывателем. Презентацию на заданную тему можно скачать внизу страницы, поделившись ссылкой в социальных сетях! Презентации взяты из открытого доступа или загружены их авторами, администрация сайта не отвечает за достоверность информации в них, все права принадлежат авторам презентаций и могут быть удалены по их требованию.
Этот материал в формате pptx (PowerPoint) содержит 14 слайдов, для просмотра воспользуйтесь проигрывателем. Презентацию на заданную тему можно скачать внизу страницы, поделившись ссылкой в социальных сетях! Презентации взяты из открытого доступа или загружены их авторами, администрация сайта не отвечает за достоверность информации в них, все права принадлежат авторам презентаций и могут быть удалены по их требованию.
Толерантность.
Let’s respect each other.
Let’s be tolerant.
We do deserve it, because everybody of us is an individual!
Мы разные – в этом наше богатство. Мы вместе – в этом наша сила.
16 НОЯБРЯ 1995 Г. ПАРИЖ, XXI КОНФЕРЕНЦИЯ
“DECLARATION OF PRINCIPLES ON TOLERANCE”
Article 1-Meaning of tolerance.
Article 2-State level.
Article 3-Social dimensions.
Article 4-Education.
Article 5-Commitment to action.
Article 6-The annual international Day of tolerance.
NOVEMBER,16
Tolerance(англ.)-готовность и способность без протеста воспринимать личность или вещь.
Tolérance(франц.)-уважение свободы другого без образа мысли, поведения, этнических и религиозных взглядов.
公差 (кит.)-позволять, допускать, проявлять великодушие в отношении других.
التسامح (араб.)-прощение, снисходительность, мягкость, сострадание, терпение, расположенность к другим.
تحمل (перс.)-терпение, выносливость, готовность к примирению.
Толерантность(русск.)-способность, умение терпеть, мириться с чужим мнением, быть снисходительным к поступками других.
Дисон Солтмарш. «Твои доводы будут столь же темны для меня, как мои доводы для тебя, пока Господь не откроет нам глаза.»
Оливер Кромвель.
«Я не согласен с тем, что вы говорите, но пожертвую своей жизнью, защищая ваше право высказывать собственное мнение.»
Вольтер.
Толерантность
милосердие
снисходительность
Сферы проявления
Политическая
Научная
Педагогические
Административные
Психологический уровень
естественная
моральная
Политический уровень
Активная позиция невмешательства
Добровольное согласие на взаимную терпимость разных и противодействующих в несогласии субъектов
Демократическая личность.
Мировоззренческая и психологическая открытость
Стойкость и мужество при определенном выборе или принятии решения
Дисциплинированность и ответственность
НЕТЕРПИМОСТЬ.
Нацизм .
Национализм.
Ксенофобия.
Дискриминация.
Геноцид.
Расизм.
Нетерпимость-основная причина войн, религиозных преследований и идеологических противостояний в мире.
Толерантность-делает возможным достижение мира и ведет к культуре мира.
Академик Дмитрий Лихачев.
“Великий народ, народ со своей большой культурой, со своими национальными традициями, обязан быть добрым, особенно, если с ним соединена судьба малого народа. Великий народ должен помогать молодому сохранить себя, свой язык, свою культуру.”
THE HIGHEST RESULT OF EDUCATION IS TOLERANCE.
ТЕСТ НА ОЦЕНКУ УРОВНЯ ТОЛЕРАНТНОСТИ.
Знание себя.(self-esteem)
Т: адекватно оценивает себя и окружающих. Способен относиться к себе критически, старается разобраться в своих проблемах, собственных достоинствах и недостатках.
И: замечает у себя преимущественно достоинства, а у других недостатки, по поводу которых занимает обвинительную позицию.
2. Защищенность. (safety)
Т: Уверен в себе, не сомневается, что справится с любой возникшей задачей.
3. Ответственность.(responsibility)
Т: не перекладывает ответственность на других, сам отвечает за свои поступки.
И: считает, что происходящие события от него не зависят, следовательно, снимает с себя ответственность за происходящее вокруг. Беспричинно подозревает, что ему вредят.
4. Потребность в определении.(selfconfidence)
Т: Стремится к работе, творчеству, самореализации.
И:Склонен отодвигать себя на второй план («пусть кто-нибудь другой, только не я…»)
5. Чувство юмора. (sense of humour)
Т: живо реагирует на шутки, способен посмеяться и над собой.
И: апатично либо мрачно воспринимает юмор. Раздраженно реагирует даже на безобидные шутки в свой адрес.

Авторитаризм.
Т: Предпочитает демократические начала.
Как видим, это не просто отдельно взятое качество, а результирующий фактор. А потому взятая на себя задача «стану терпимым!» может привести только к усилению моральной толерантности.
Тест на определение уважения к чужому мнению.
Отвечать быстро, не задумываясь.
1. Вам предстоит участие в ролевой игре. Что вас устраивает:
а). Чтобы играли те, кто не знает еще правил (0)
б). Чтобы участвовали те, кто признает и знает правила игры (2)
2. Вы спокойно встречаете жизненные неурядицы? а). Да (0) б). Нет (2)
3. Болезненна ли для вас ситуация: когда приходится отказываться от своего проекта, потому что аналогичный проект предложили ваши одноклассники: а). Да (0) б). Нет (2)
4. Вызывает ли у вас неприязнь одноклассники, которые нарушают правила общественного поведения:
а).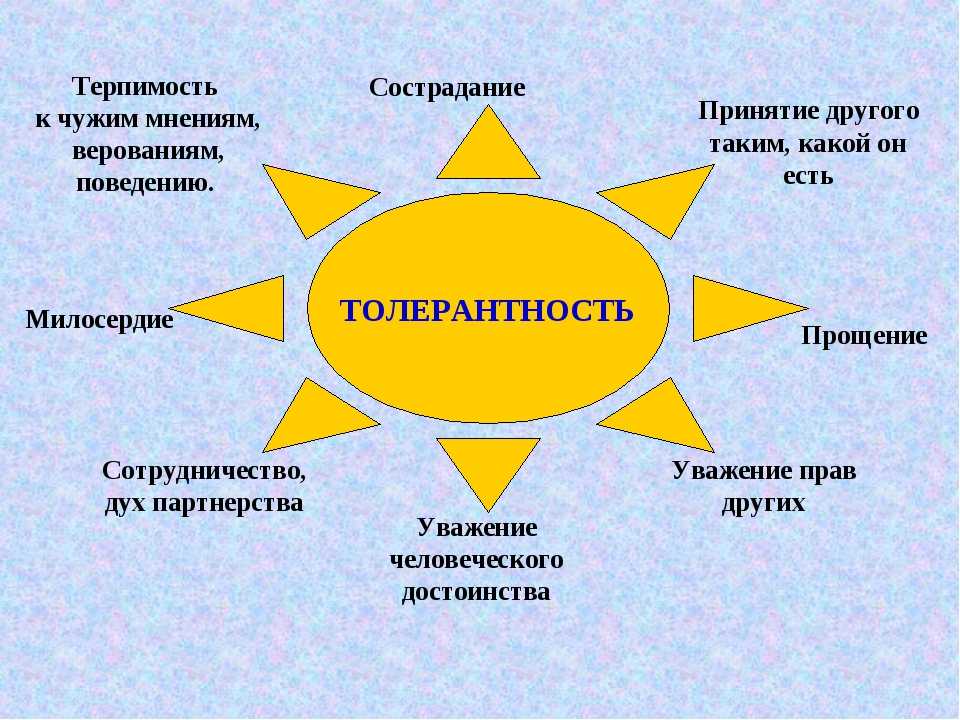
б). Они вам неприятны, потому что не умеют себя контролировать.(0)
5. Можете ли вы легко найти контакт с одноклассниками, которые имеют иные, чем у вас , верования, обычаи, намерения.
а). Вам всегда это трудно сделать.(0)
б). Сравнительно легко.(2)
6. Как вы реагируете на шутку, объектом которой становитесь:
а). Вы не переносите ни шуток, ни самих шутников.(0)
б). Пытаетесь найти ответ в такой же шутливой форме.(2)
7. Согласны ли вы с бытующим в обиходе мнением, что многие одноклассники пытаются делать «не свое дело», стремятся казаться лучше, чем есть: а). Да (2) б). нет. (0)
8. Вы приводите в компанию знакомого, который становится объектом всеобщего внимания. Ваша реакция:
а). Вам неприятно, что внимание уделено ему, а не вам. (0)
б). Рады за знакомого. (2)
Лауреаты Нобелевской премии
Борцы за мир
Мать Тереза
Михаи́л Серге́евич Горбачёв
Кондоли́за Райс
Скачать презентацию
 ru?
ru?Это сайт презентаций, где можно хранить и обмениваться своими презентациями, докладами, проектами, шаблонами в формате PowerPoint с другими пользователями. Мы помогаем школьникам, студентам, учителям, преподавателям хранить и обмениваться учебными материалами.
Для правообладателей
Обратная связь
Email: Нажмите что бы посмотреть
Толерантность — презентация, доклад, проект
Слайд 1
Описание слайда:
Толерантность — путь к миру
Слайд 2
Описание слайда:
Толера́нтность (от лат. tolerantia — терпение, терпеливость, добровольное перенесение страданий) — социологический термин, обозначающий терпимость к иному мировоззрению, образу жизни, поведению и обычаям. Толерантность не равносильна безразличию. Она не означает также принятия иного мировоззрения или образа жизни, она заключается в предоставлении другим права жить в соответствии с собственным мировоззрением
Слайд 3
Описание слайда:
Декларация принципов толерантности (ЮНЕСКО, 1995)
«Толерантность означает уважение, принятие и правильное понимание всего многообразия культур, форм самовыражения и проявления человеческой индивидуальности. Толерантности способствуют знания, открытость, общение и свобода мысли, совести, убеждений.
Толерантность – это единство в многообразии. Это не только моральный долг, но и политическая и правовая потребность.
Толерантность – это то, что делает возможным достижение мира и ведет от культуры войны к культуре мира.
Толерантность – это не уступка, снисхождение или потворство, а, прежде всего, активное отношение на основе признания универсальных прав и свобод человека»
Толерантности способствуют знания, открытость, общение и свобода мысли, совести, убеждений.
Толерантность – это единство в многообразии. Это не только моральный долг, но и политическая и правовая потребность.
Толерантность – это то, что делает возможным достижение мира и ведет от культуры войны к культуре мира.
Толерантность – это не уступка, снисхождение или потворство, а, прежде всего, активное отношение на основе признания универсальных прав и свобод человека»
Слайд 4
Описание слайда:
Толерантность основана на трех позициях: Устойчивость к точке зрения Другого, сохранение и отстаивание собственного мнения; Признание возможности существования иной точки зрения; Предпочтение точки зрения Другого, если в споре человек убедился в своей неправоте
Слайд 5
Описание слайда:
Толерантность выполняет следующие функции:
1) предотвращает межгрупповые и внутригрупповые конфликты, что способствует формированию и поддержанию стабильности группы;
2) создает имидж стабильной и сплоченной группы, что обеспечивает более продуктивное взаимодействие с государственными структурами, с социальными группами и организациями.
Слайд 6
Описание слайда:
Одним из факторов формирования толерантности является приобретение человеком социально значимых норм и правил поведения. Они созданы в ходе исторического развития человека и способствуют его гармоничному и равномерному прогрессу Одним из факторов формирования толерантности является приобретение человеком социально значимых норм и правил поведения. Они созданы в ходе исторического развития человека и способствуют его гармоничному и равномерному прогрессу
Слайд 7
Описание слайда:
Во всем мире существует определенная система ценностей, закрепленная в большинстве стран на законодательном уровне. В нее включены такие нормы как:
Во всем мире существует определенная система ценностей, закрепленная в большинстве стран на законодательном уровне. В нее включены такие нормы как:
презумпция прав человека,
терпимость к недостаткам и ошибкам других людей,
ценность согласия и ненасильственного разрешения конфликтов,
следование нормам права,
сострадание,
сопереживание,
сочувствие,
ценность человеческой жизни
отсутствия физических страданий.
В нее включены такие нормы как:
презумпция прав человека,
терпимость к недостаткам и ошибкам других людей,
ценность согласия и ненасильственного разрешения конфликтов,
следование нормам права,
сострадание,
сопереживание,
сочувствие,
ценность человеческой жизни
отсутствия физических страданий.
Слайд 8
Описание слайда:
Слайд 9
Описание слайда:
Человек с высоким уровнем толерантности обладает характерным комплексом поведения, характеризующееся пониженной агрессивностью.
Человек с высоким уровнем толерантности обладает характерным комплексом поведения, характеризующееся пониженной агрессивностью.
Он менее конфликтен.
Преобладает тенденция к продуктивному ведению и разрешению конфликтов.
Одновременно человек приобретает позитивное отношение к жизни, что увеличивает его стрессоустойчивость и общий жизненный тонус.
Слайд 10
Описание слайда:
Слайд 11
Описание слайда:
Советы по формированию толерантности.
Советы по формированию толерантности.
1.Помните, что самые главные вопросы задаются не людям, а самому себе, но ответы на них следует искать вместе. Познание себя, управление собой должно стать постоянной заботой каждого молодого человека. Особого внимания требует умение управлять своим эмоциональным состоянием.
2.Учитесь путём тренировок отстраняться от своего привычного взгляда и смотреть на проблему и людей беспристрастно, вырабатывайте психологический взгляд стороннего наблюдателя.
3.Становясь старше, всё больше внимания обращайте на появление и преодоление своих возрастных и профессиональных стереотипов. Изменение взглядов, мыслей и поведения требует многих усилий, большой внутренней работы и активности. 4.Помните, если другие не разделяют ваших точек зрения, это не показатель их несостоятельности.
5.Относитесь с иронией к значимости своей персоны, чаще улыбайтесь.
6.Не страдайте от того, что не всё упорядочено, строго, правильно в окружающей действительности и людях, принимайте окружающий мир таким, какой он есть, ведь для нас этот мир — единственный.
4.Помните, если другие не разделяют ваших точек зрения, это не показатель их несостоятельности.
5.Относитесь с иронией к значимости своей персоны, чаще улыбайтесь.
6.Не страдайте от того, что не всё упорядочено, строго, правильно в окружающей действительности и людях, принимайте окружающий мир таким, какой он есть, ведь для нас этот мир — единственный.
Слайд 12
Описание слайда:
7.Взаимоотношения с единомышленниками и оппонентами стимулируют когнитивные и творческие процессы, больше общайтесь с разными людьми.
7.Взаимоотношения с единомышленниками и оппонентами стимулируют когнитивные и творческие процессы, больше общайтесь с разными людьми.
8.Будьте реалистами, не ждите лёгкости в процессе позитивного самоизменения, а главное, не ожидайте изменения окружающих людей, но при обнаружении изменений искренне порадуйтесь.
9.Если вы заинтересованы в продуктивном общении с людьми, обращайтесь к тому позитивному, что в них есть, поворачивайте людей к себе хорошей стороной. Никогда не критикуйте личность, а давайте оценку только негативному поступку (не «ты плохой», а «ты плохо поступил»).
10.Будьте терпимы к человеческим недостаткам и слабостям. В любой конфликтной ситуации учитесь находить и предлагать оптимальное решение. Умейте признавать свою неправоту и при необходимости — извиняться.
11.Делайте выбор самостоятельно, помня, что никто не может нам навязать толерантные отношения, и если вы считаете их малоэффективными и психологически не готовы их принять, это ваше право.
12.Развивайте наблюдательность, воображение, учитесь понимать эмоциональное состояние другого, верно истолковывать его поведение.
Никогда не критикуйте личность, а давайте оценку только негативному поступку (не «ты плохой», а «ты плохо поступил»).
10.Будьте терпимы к человеческим недостаткам и слабостям. В любой конфликтной ситуации учитесь находить и предлагать оптимальное решение. Умейте признавать свою неправоту и при необходимости — извиняться.
11.Делайте выбор самостоятельно, помня, что никто не может нам навязать толерантные отношения, и если вы считаете их малоэффективными и психологически не готовы их принять, это ваше право.
12.Развивайте наблюдательность, воображение, учитесь понимать эмоциональное состояние другого, верно истолковывать его поведение.
Слайд 13
Описание слайда:
Календарь толерантности Календарь толерантности 18 декабря Международный день мигранта 03 декабря Международный день инвалидов 02 декабря Международный день борьбы за отмену рабства 16 ноября Международный день, посвященный терпимости (толерантности) 12 ноября Сахаровская стипендия по правам человека
Слайд 14
Описание слайда:
В книге В. И.Даля «Пословицы русского народа» нет тематического раздела под названием «Терпимость». Есть рубрика « Судьба — терпение — надежда» (около 150 пословиц).
В книге В.И.Даля «Пословицы русского народа» нет тематического раздела под названием «Терпимость». Есть рубрика « Судьба — терпение — надежда» (около 150 пословиц).
Терпенье лучше спасенья.
Оттерпимся, и мы люди будем.
Покорись беде, и беда покорится.
Худое видели, хорошее увидим.
Что ни делается, все к лучшему.
Терпи казак, атаманом будешь
И.Даля «Пословицы русского народа» нет тематического раздела под названием «Терпимость». Есть рубрика « Судьба — терпение — надежда» (около 150 пословиц).
В книге В.И.Даля «Пословицы русского народа» нет тематического раздела под названием «Терпимость». Есть рубрика « Судьба — терпение — надежда» (около 150 пословиц).
Терпенье лучше спасенья.
Оттерпимся, и мы люди будем.
Покорись беде, и беда покорится.
Худое видели, хорошее увидим.
Что ни делается, все к лучшему.
Терпи казак, атаманом будешь
Слайд 15
Описание слайда:
Терпение и труд — все перетрут.
Терпение и труд — все перетрут.
Терпенье дает уменье.
Сам потерпи, а другого не выдай.
На хотенье есть терпенье.
Терпи, голова, в кости скована.
Терпи горе неделю, а царствуй год.
Терпя, в люди выходят.
Девичье терпенье — жемчужно ожерелье. Терпя, и камень треснет.
Тут и у святого терпенье лопнет.
Не стерпела душа молодецкая.
Час терпеть, а век жить.
Три жены имел, а ото всех беды терпел.
Попадешься в руки — натерпишься муки.
Погодить — не устать, было б потерпежное (плата за терпение).
Идти в науку — терпеть муку.
Лучше век терпеть, чем вдруг умереть.
Терпя, и камень треснет.
Тут и у святого терпенье лопнет.
Не стерпела душа молодецкая.
Час терпеть, а век жить.
Три жены имел, а ото всех беды терпел.
Попадешься в руки — натерпишься муки.
Погодить — не устать, было б потерпежное (плата за терпение).
Идти в науку — терпеть муку.
Лучше век терпеть, чем вдруг умереть.
Слайд 16
Описание слайда:
Натерпишься горя — узнаешь, как жить.
Натерпишься горя — узнаешь, как жить.
Бог долго терпит, да больно бьет.
Пошел на службу — терпи и нужду!
Лихо терпеть, а оттерпится — слюбится.
Лучше самому терпеть, чем других обижать.
Тьма свету не любит — злой доброго не терпит.
От того терплю, кого больше люблю.
Носи платье, не складывай; терпи горе, не сказывай!
Русский терпелив до зачина.
Не стерпела душа — на простор пошла.
Запасливый нужды не терпит. Холод не терпит голоду.
Бог терпел да и нам велел.
Лучше умереть, чем неправду терпеть.
Душа не стерпит, так сердце возьмет.
С бедою не перекоряйся, терпи!
Бумага терпит, перо пишет.
Лучше пропасть, чем терпеть злую напасть.
Холод не терпит голоду.
Бог терпел да и нам велел.
Лучше умереть, чем неправду терпеть.
Душа не стерпит, так сердце возьмет.
С бедою не перекоряйся, терпи!
Бумага терпит, перо пишет.
Лучше пропасть, чем терпеть злую напасть.
Слайд 17
Описание слайда:
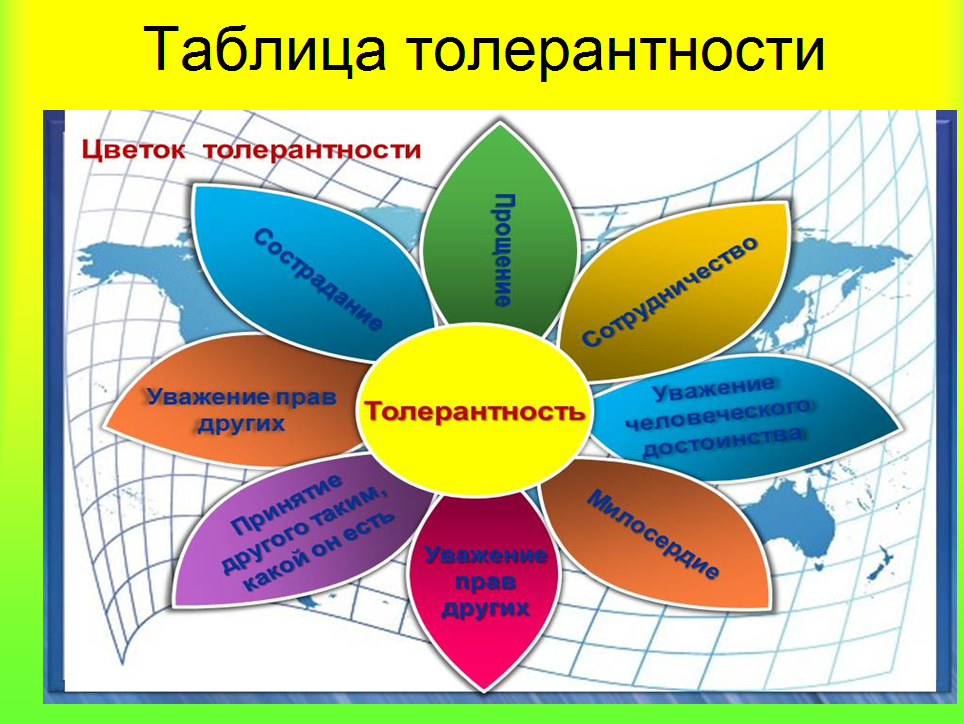
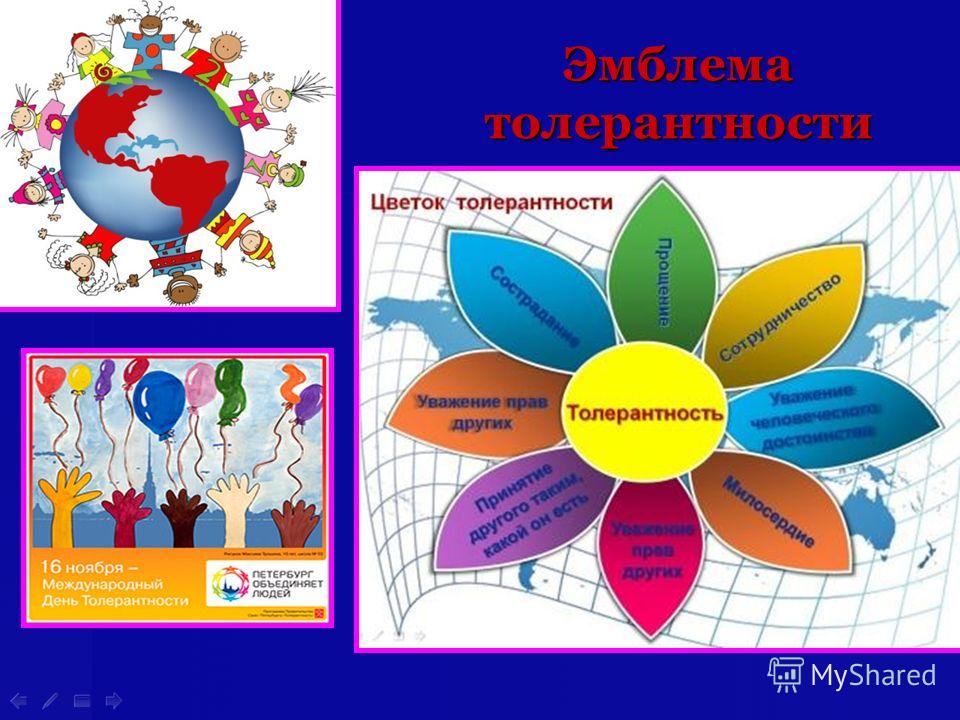
Символы толерантности Символы толерантности
Слайд 18
Описание слайда:
Спасибо за внимание! Будьте терпимее друг к другу
Эскалаторы на нескольких станциях метро будут работать по новой схеме
Эскалаторы на нескольких станциях метро будут работать по новой схеме- mix» data-ping-position=»1″ data-featured-url=»http://wonder-circus.ru/?utm_source=fedin&utm_medium=kudago&utm_campaign=volshebnik» data-item-url=»https://kudago.com/msk/event/teatr-volshebnik-izumrudnogo-goroda-fevral-2022/» data-featured-path=»/msk/news/»>
130 146640
mix» data-ping-position=»3″ data-featured-url=»https://online.kudago.com/list/rasshiryaya-granitsyi-poznavatelnyie/» data-item-url=»https://online.kudago.com/list/rasshiryaya-granitsyi-poznavatelnyie/» data-featured-path=»/msk/news/»>
6 1837
mix» data-ping-position=»1″ data-featured-url=»https://kudago.com/msk/list/samyie-neobyichnyie-svidaniya-fastlife/» data-item-url=»https://kudago.com/msk/list/samyie-neobyichnyie-svidaniya-fastlife/» data-featured-path=»/msk/news/»> 40 200891
com/msk/list/znakomstvo-s-moskvoj/» data-item-url=»https://kudago.com/msk/list/znakomstvo-s-moskvoj/» data-featured-path=»/msk/news/»> 42 97720
com/msk/list/6-kontsertov-dlya-vlyublyonnyih-v/» data-item-url=»https://kudago.com/msk/list/6-kontsertov-dlya-vlyublyonnyih-v/» data-featured-path=»/msk/news/»> 41 93094
com/msk/list/kuda-shodit-s-detmi-9/» data-featured-path=»/msk/news/»> 13 45075
3 1892
com/msk/event/vyistavka-salvador-dali-and-pablo-pikasso/» data-item-url=»https://kudago.com/msk/event/vyistavka-salvador-dali-and-pablo-pikasso/» data-featured-path=»/msk/news/»> 1935 567874
Фото М. Денисова
Фото: mos.ru
Эскалаторы на 13 станциях московского метро начали работать по-новому. Раньше на подъёмнике можно было проехать только наверх, а спускаться приходилось по обычной лестнице. Теперь эскалаторы будут запускать в обе стороны.
Раньше на подъёмнике можно было проехать только наверх, а спускаться приходилось по обычной лестнице. Теперь эскалаторы будут запускать в обе стороны.
Чтобы движение по новой схеме было безопасным, на эти станции направили сотрудников метрополитена. С этой же целью установили ещё несколько камер наблюдения.
Недавно KudaGo рассказывал, что в Москве завершилось строительство тоннеля к аэропорту Внуково.
Хотите быть в курсе всего самого интересного в городе? Подписывайтесь на нас в Яндекс.Дзене, добавляйте в избранное в Яндекс.Новостях. Рекомендации от KudaGo, планы на выходные, интересные события, места и подборки, а также новости без политики — читайте нас там, где вам удобно.
Необычные концерты в Соборе Петра и Павла. 12+
Джаз, средневековая и классическая музыка на органе.
Концерты в сентябре
Если вы нашли опечатку или ошибку, выделите фрагмент текста, содержащий её, и нажмите Ctrl+↵
Массовая посадка леса пройдёт в Подмосковье
Массовая посадка леса пройдёт в Подмосковье- mix» data-ping-position=»1″ data-featured-url=»https://kudago.com/msk/list/samyie-neobyichnyie-svidaniya-fastlife/» data-item-url=»https://kudago.com/msk/list/samyie-neobyichnyie-svidaniya-fastlife/» data-featured-path=»/msk/news/»>
41 93099
mix» data-ping-position=»2″ data-featured-url=»https://kudago.com/msk/list/organnaya-muzyika-v-moskve/» data-item-url=»https://kudago.com/msk/list/organnaya-muzyika-v-moskve/» data-featured-path=»/msk/news/»>
40 200915
com/msk/list/znakomstvo-s-moskvoj/» data-item-url=»https://kudago.com/msk/list/znakomstvo-s-moskvoj/» data-featured-path=»/msk/news/»> 42 97723
com/msk/event/teatr-volshebnik-izumrudnogo-goroda-fevral-2022/» data-featured-path=»/msk/news/»> 6 1837
com/msk/list/kuda-shodit-s-detmi-9/» data-featured-path=»/msk/news/»> 13 45078
130 146654
mix» data-ping-position=»3″ data-featured-url=»https://online.kudago.com/list/rasshiryaya-granitsyi-poznavatelnyie/» data-item-url=»https://online.kudago.com/list/rasshiryaya-granitsyi-poznavatelnyie/» data-featured-path=»/msk/news/»> 3 1895
com/msk/event/vyistavka-salvador-dali-and-pablo-pikasso/» data-item-url=»https://kudago.com/msk/event/vyistavka-salvador-dali-and-pablo-pikasso/» data-featured-path=»/msk/news/»> 1935 567942
Фото: shutterstock.com
Жителей Подмосковья приглашают поучаствовать в акции «Наш лес. Посади своё дерево». Она проходит в области почти весь месяц. Наибольшее количество людей организаторы ждут 17 сентября.
Для посадки подготовят почти 300 площадок. Лопаты, вёдра и другие инструменты выдадут на месте. С собой советуют взять только тёплую одежду и резиновые сапоги. Специалисты будут следить, чтобы деревья сажали по всем правилам.
Также 16 сентября акция пройдёт в Домодедове, Мытищах, Наро-Фоминске, Серпухове и других городских округах. Найти удобную площадку и узнать время проведения акции можно на карте.
Недавно портал KudaGo писал о том, что подмосковный Минтранс предлагает 46 маршрутов для фотосессий.
Хотите быть в курсе всего самого интересного в городе? Подписывайтесь на нас в Яндекс.Дзене, добавляйте в избранное в Яндекс.Новостях. Рекомендации от KudaGo, планы на выходные, интересные события, места и подборки, а также новости без политики — читайте нас там, где вам удобно.
Необычные концерты в Соборе Петра и Павла. 12+
Джаз, средневековая и классическая музыка на органе.
Концерты в сентябре
Если вы нашли опечатку или ошибку, выделите фрагмент текста, содержащий её, и нажмите Ctrl+↵
Сочинение-рассуждение на тему: Что такое толерантность
- Сочинения
- На свободную тему
- Толерантность
Что же такое «толерантность»? Социология рассматривает данное понятие, как терпимость к мировоззрению другого человека, его образу жизни, поведению и обычаям. Но, безусловно, это очень узкое понятие.
Но, безусловно, это очень узкое понятие.
Быть толерантным – значит быть внимательным. Внимательным и уважительным к нуждам, вкусам и убеждениям другого человека. Даже если этот человек – случайный прохожий.
Быть толерантным – значит понимать, что каждая, живущая на планете, личность имеет свои права и личное пространство, которые не должны быть нарушены. Важно осознание того, что все люди разные, но каждый из них (не имеет значения, какого он вероисповедания, национальности, какую имеет политическую и гражданскую позицию, как одевается, какую музыку слушает и.т.д.) имеет возможность жить так, как велит ему сердце (конечно же, если при этом он сам не нарушает ничьих прав и свобод).
Увы, современное общество до сих пор не научилось проявлять к людям достаточную степень толерантности. Пассажиры маршруток по- прежнему хамят друг другу (порой переходя на личности, затрагивая недостатки внешности, национальность человека, говоря плохо о его родителях, которых даже не знают), случайные прохожие могут тыкать пальцами в слишком уж эксцентрично одетого человека или инвалида (чего тоже делать нельзя, ведь первый может одеваться так, как считает нужным, а второй не виноват, что отличается от здоровых людей внешне) и. т.д.
т.д.
Даже при поиске работы человек может столкнуться с отсутствием толерантности. Конечно же, дресс-код компании — это понятное правило. Но важна ли, допустим, прическа работника, если он согласен надеть униформу и будет ответственно исполнять свои обязанности, станет трудолюбивым и усердным сотрудником? По идее, нет. Соответственно, и требования начальства к сотрудникам носить одинаковую прическу также можно назвать отсутствием толерантности. Поскольку, в отличие, от одежды, ее нельзя кардинально сменить после того, как рабочий день уже окончен.
Примером недостатка толерантности можно назвать и оскорбления чужих чувств и верований – допустим, травлю кришнаитов либо афроамериканцев теми, кто не приемлет какие-либо течения и народности. А имеют ли они на это право? Конечно же, нет. Ведь не они создавали этот мир, не они давали жизнь этим людям – соответственно, и вредить их здоровью либо даже лишать жизни по причине «не того» цвета кожи или отличных от общепринятых, взглядов, никто не имеет права.
Что же касается представителей людского рода, порой они склонны испытывать неприязнь либо выражать прямую агрессию по отношению к тому, кто отличается от них в чем-либо. Но почему «инакомыслие» в стиле одежды, в жизненной позиции, нетипичную внешность воспринимают так враждебно? Когда же люди, наконец, поймут, что свободную жизнь на земле, без гнета и гонений заслуживает каждый, если он не причиняет никому вреда?
Сочинение на тему Толерантность
Толерантность — это то, чего не хватает многим людям на сегодняшний день. Прежде чем развивать обсуждение этого понятия, нужно знать его значение. Итак, толерантность — это проявление у человека терпения к отличительным особенностям жизни другого человека. К таким особенностям можно отнести, образ жизни, обычаи, традиции, мировоззрение, ценности и приоритеты жизни. Но толерантность предусматривает, не только проявление терпения, но ещё и принятие этих особенностей, без всякого стороннего осуждения.
Толерантным человеком можно назвать того, кто полностью принимает другого человека со всеми его особенностями. Ведь каждый из нас, вырос в своем маленьком мире, который сначала создавали родители, а потом уже сам человек. И за все годы, у каждого из нас сформировались свои взгляды на жизнь или на какие-то другие ситуации. Толерантный человек всегда будет к этому относиться с пониманием и уважением. Сразу же вспоминается поговорка «Сколько людей-столько и мнений», и она отлично подходит к понятию о толерантности.
Ведь каждый из нас, вырос в своем маленьком мире, который сначала создавали родители, а потом уже сам человек. И за все годы, у каждого из нас сформировались свои взгляды на жизнь или на какие-то другие ситуации. Толерантный человек всегда будет к этому относиться с пониманием и уважением. Сразу же вспоминается поговорка «Сколько людей-столько и мнений», и она отлично подходит к понятию о толерантности.
Определенно, толерантность в человеке не появляется сама по себе, её нужно развивать на протяжении всей жизни, и начинать лучше всего с малых лет. С самого раннего возраста, ребенок, он же маленький человек и уже личность, должен знать, что другие дети могут отличаться друг от друга как внешне, так и внутренним духовным наполнением. Самые главные внешние признаки, это цвет кожи, разрез и цвет глаз, цвет волос и их укладка. И очень часто многие высмеивают внешность человека, абсолютно не понимая, что таким его создала природа, абсолютно не проявляя толерантности и уважения.
Но существование не толерантных людей всё-таки есть, и их поведение обычно характеризуется следующим образом. Превыше всего они ставят своё мнение, которое считают единственным и правильным, и это очень эгоистично. Такие люди часто вступают в серьезные и длительные споры, из-за того, что просто не осознают о существовании мнения других людей. Ну и конечно же частые действия не толерантных людей, это желание навязать другим своё «правильное» мнение. Не толерантному человеку очень трудно находиться в современном обществе среди большого количества разнообразных людей.
Превыше всего они ставят своё мнение, которое считают единственным и правильным, и это очень эгоистично. Такие люди часто вступают в серьезные и длительные споры, из-за того, что просто не осознают о существовании мнения других людей. Ну и конечно же частые действия не толерантных людей, это желание навязать другим своё «правильное» мнение. Не толерантному человеку очень трудно находиться в современном обществе среди большого количества разнообразных людей.
Человек, проявляющий толерантность, живет намного легче и непринужденно. Если же он с легкостью принимает взгляды, мнение и интересы другого человека, то делает огромную пользу для себя же или того другого человека. Польза толерантности в том, что с её помощью можно расширить свой кругозор, просто пообщавшись с человеком, имеющим отличительные особенности.
Я считаю, что толерантность обязательно должна быть в каждом человеке, независимо от его гражданства, национальности, или других внешних и внутренних особенностей. И только так, благодаря проявлении толерантности среди людей будет больше понимания, позитивного общения, дружбы и добра.
Проблема определения
В целом синонимами толерантности выступают такие понятия, как уважение, понимание и принятие.
Толерантностью нельзя назвать уступку, потворство или снисхождение, к тому же она не означает терпимость к несправедливости со стороны другого человека или отказ от собственного мировоззрения и особенностей поведения.
Можно рассмотреть множество определений толерантности, но ни одно из них не будет полностью раскрывать смысл этого процесса ввиду того, что нельзя полностью охватить все стороны человеческой жизнедеятельности. Так что такое толерантность? Определение этого термина можно свести к следующему. Толерантность – это осознанная, чистосердечная терпимость, особая психологическая установка, что ориентирована на уважительное восприятие иных ценностей, убеждений, способов самовыражения и других составляющих человеческой индивидуальности. Это активная позиция, которая помогает достичь взаимопонимания между оппонентами.
Толерантность – это осознанная, чистосердечная терпимость, особая психологическая установка, что ориентирована на уважительное восприятие иных ценностей, убеждений, способов самовыражения и других составляющих человеческой индивидуальности. Это активная позиция, которая помогает достичь взаимопонимания между оппонентами.
Литературные аргументы
Толерантность была одной из любимых тем авторов разного стиля и жанра. Не только в романах, рассказах или повестях встречается эта проблема. Например, в баснях Крылова глубоко просматривается проблема поиска компромисса между персонажами с разными точками зрения. В басне «Лебедь, Рак и Щука» герои не смоли сдвинуть телегу, так как каждый делал то, к чему привык он: Рак пятился назад, Лебедь летел вверх, а Щука прыгала в воду, поэтому «воз и ныне там».
В басне «Слон и моська» маленькая собачка без видимой причины начинает облаивать спокойно шагающего слона, вместо того чтобы просто пройти мимо. Кто-то может сказать, что это всего лишь занятное детское повествование, но, по сути, здесь скрыто нечто другое. Если провести параллель с некоторыми событиями повседневности настоящего времени, то можно увидеть, что в этом незамысловатом произведении скрыта проблема толерантности. Нередко на улицах можно повстречать людей, которые достаточно грубо, надменно или с недовольством высказывают свое мнение другим, совершенно незнакомым людям. Например, ситуация: компания отдыхающих приехала в курортный городок. Их место проживания находилось рядом с вокзалом, так что брать такси не было смысла, хотя сумки у них были и нелегкие. Но на переходе они начали разговаривать между собой о том, что тяжело идти с таким грузом. Женщина, что проходила мимо, услышала эти слова и высказала свое мнение, сказав, что приехали «нищеброды» и не могут позволить себе взять транспорт.
Если провести параллель с некоторыми событиями повседневности настоящего времени, то можно увидеть, что в этом незамысловатом произведении скрыта проблема толерантности. Нередко на улицах можно повстречать людей, которые достаточно грубо, надменно или с недовольством высказывают свое мнение другим, совершенно незнакомым людям. Например, ситуация: компания отдыхающих приехала в курортный городок. Их место проживания находилось рядом с вокзалом, так что брать такси не было смысла, хотя сумки у них были и нелегкие. Но на переходе они начали разговаривать между собой о том, что тяжело идти с таким грузом. Женщина, что проходила мимо, услышала эти слова и высказала свое мнение, сказав, что приехали «нищеброды» и не могут позволить себе взять транспорт.
Ситуация не совсем характерная, но отлично подходит для проведения аналогии с басней «Слон и моська».
Толерантность в современном мире
Современные проблемы толерантности практически ничем не отличаются от тех, что приведены в литературных произведениях классиков. К ним можно отнести и этническое, и социальное, и гендерное недопонимание. Остается усвоить только одно правило: насколько бы не изменился мир, толерантность всегда будет считаться добродетелью.
К ним можно отнести и этническое, и социальное, и гендерное недопонимание. Остается усвоить только одно правило: насколько бы не изменился мир, толерантность всегда будет считаться добродетелью.
Но сейчас, как никогда раньше, первоочередным заданием, которое нужно решить, является проблема формирования толерантности. Это обусловлено следующими причинами:
- Внезапное и динамическое разделение цивилизации по экономическим, этническим, религиозным, социальным и другим критериям. В связи с этим вырос уровень нетерпимости в обществе.
- Рост религиозного экстремизма.
- Локальные войны обострили межнациональные отношения (пример, война Украины и России).
- Проблемы с беженцами.
Чтобы взрастить в ком-то толерантность, необходимы определенные условия, так называемые базовые принципы. К ним относят 5 позиций:
- Насилие никогда не должно быть средством для достижения цели.
- Свобода выбора. Человек должен осознанно прийти к определенному решению.

- Заставить себя, не вынуждая других. Основной принцип толерантности заключается в умении человека оставаться собой, не заставляя при этом другого менять свои взгляды.
- Соблюдение законов, традиций и обычаев является важным фактором в развитии толерантности.
- Принять другого таким, какой он есть, вне зависимости от отличий.
Актуальность проблемы толерантности не поддается сомнению. Ведь, как заметил однажды философ Ю. А. Шрейдер: «Самая страшная катастрофа, что грозит земной цивилизации – уничтожение человечности в человеке». Поэтому о принятии других людей такими, как они есть, так много написано и сказано.
Любовная линия
Не менее красочно описана проблема принятия других в романе М. Шолохова «Тихий Дон». Здесь, в суровых условиях гражданской войны, толерантность представляется чем-то невозможным, но автор вводит дополнительную «переменную», что находится на уровень выше условностей, – это любовь.
Герои романа – Дуняшка Мелехова и Мишка Кошевой — любили друг друга. Но в ходе революции их семьи стояли по разные стороны баррикад, и, когда все военные действия закончились, Мишка Кошевой оказывается врагом для семьи Дуняшки. Но они влюблены, и эта любовь выше всех условностей. Нравственность всегда будет стоять выше идеологических и политических предпочтений.
Но в ходе революции их семьи стояли по разные стороны баррикад, и, когда все военные действия закончились, Мишка Кошевой оказывается врагом для семьи Дуняшки. Но они влюблены, и эта любовь выше всех условностей. Нравственность всегда будет стоять выше идеологических и политических предпочтений.
Толерантность и литература
Чтобы понять всю глубину этой проблемы, лучше прибегнуть к литературным аргументам. В рассказах, романах и повестях описаны разные жизненные ситуации, где на примерах главных героев можно увидеть, чем является толерантность в реальной жизни.
Актуальность проблемы толерантности впервые появилась в литературных произведениях Древней Руси. Странствующий писатель Афанасий Никитин описывал разнообразие религиозных течений в Индии. В своих текстах он зазывал читателя задуматься обо всем многообразии мира и терпимее относиться к людям с другой верой.
Но особого внимания заслуживают произведения классической литературы. Писатели того времени рассказывали о проблемах толерантности, которые существовали в обществе. Так, в произведениях XVIII века проблемы толерантности были распространены в научно-образовательной сфере. Уже в XIX веке начинает возникать проблема классовой толерантности. В частности, об этом свидетельствуют произведения Толстого «Война и мир», Тургенева «Отцы и дети», где рассмотрены основные аргументы проблемы толерантности.
Так, в произведениях XVIII века проблемы толерантности были распространены в научно-образовательной сфере. Уже в XIX веке начинает возникать проблема классовой толерантности. В частности, об этом свидетельствуют произведения Толстого «Война и мир», Тургенева «Отцы и дети», где рассмотрены основные аргументы проблемы толерантности.
Свой и чужой
Проблема толерантности в художественной литературе представлена самыми разнообразными произведениями. Она отображается в детских сказках Андерсена и Пушкина, ее можно наблюдать в рассказах о Винни-Пухе и Карлсоне. Образцами толерантного поведения могут послужить животные из произведения Киплинга «Маугли».
Аргументы проблемы толерантности можно найти в каждом втором литературном произведении. Даже в историях о войне или политических репрессиях есть место для чего-то человеческого. Взять, к примеру, «Альпийскую балладу» В. Быкова. События истории разворачиваются во время Великой Отечественной войны. Из лагеря фашистов сбегают пленники: русский солдат Иван и Джулия, девушка из Италии. У них было всего три дня. Три дня долгожданной свободы, погони и жизни в сложнейших условиях. Когда фашисты настигли беглецов, Иван взял всю вину на себя, за что поплатился жизнью. Джулия всю свою жизнь берегла память о смелом солдате. После окончания войны она отыскала в России его родственников и написала им о гибели Ивана. Она хотела рассказать о подвиге простого солдата, который спас незнакомую иностранку. Они ведь даже не знали языка друг друга.
У них было всего три дня. Три дня долгожданной свободы, погони и жизни в сложнейших условиях. Когда фашисты настигли беглецов, Иван взял всю вину на себя, за что поплатился жизнью. Джулия всю свою жизнь берегла память о смелом солдате. После окончания войны она отыскала в России его родственников и написала им о гибели Ивана. Она хотела рассказать о подвиге простого солдата, который спас незнакомую иностранку. Они ведь даже не знали языка друг друга.
Здесь описана межнациональная проблема толерантности. Аргументы из литературы, что написаны в подобном ключе, раскрывают глубинный смысл терпимости и человечности. Читателю было бы понятнее поведение главного героя, если бы он защитил свою соотечественницу. Но здесь была итальянка, с которой они даже не были знакомы. Так почему он так поступил? Главный герой не делил людей на «русских» и «не русских» и просто сделал то, что мог сделать, если бы на месте итальянки был кто-то другой. Автор пытался показать, что не существует такого понятия, как «свой» и «чужой», есть просто человек, нуждающийся в помощи.
От слов к делу
О толерантности написано очень много, вот только на практике все происходит совсем не так. Красивые истории о принятии людей с другим мировоззрением существуют только в книгах, но никак не в реальном мире. В частности, это касается молодого поколения.
Проблемы толерантности в молодежной среде спровоцированы, прежде всего, асоциальным поведением и коммерциализацией отношений. У подрастающего поколения на первом месте всегда стоят современные девайсы и уже потом все остальное. Уже давно утрачены прежние ценности. Ежедневно создаются новые молодежные группировки и движения, растет количество антиобщественных радикальных организаций. Проще говоря, в кругу подростков и молодежи быть толерантным сейчас «не модно».
В учебных заведения, в частности школах, изучают понятие толерантности. Однако дальше определения дело не идет. Как показывают исследования, уровень принятия других падает. Возможно, всему виной отсутствие положительных примеров, которые могли бы показать, как быть толерантными, возможно, мало кто из учащихся читает русских классиков. Тем не менее рано или поздно каждому из них придется написать сочинение на тему «Проблема толерантности».
Тем не менее рано или поздно каждому из них придется написать сочинение на тему «Проблема толерантности».
И это может стать серьезной проблемой, когда нет четкого понимания проблемы, а сочинение является заданием ЕГЭ.
Чтобы написать сочинение «Проблема толерантности», аргументы из литературы крайне важны. Их можно использовать как основу для проведения аналогий с событиями в современном мире. Как вариант, можно кратко описать произведение и объяснить, почему его мнение является авторитетным. Второй вариант намного легче, но для примера попытаемся объединить два способа написания сочинения.
Со слов классиков
Из страниц классической литературы можно многое узнать о проблеме толерантности. Аргументы, приведенные в произведениях, актуальны даже сегодня. Взять, к примеру, повесть «Дети подземелья» (В. Г. Короленко). Автор рассказывает историю о маленьком мальчике Васе, который не смог найти понимания в родной семье. Несмотря на то что его отец занимал высокое положение в обществе, он всегда был один. Однажды он знакомится с Вальком и Марусей. Эти ребята были выходцами из самого низкого социального слоя населения. Так столкнулись две социальные реальности, которые тесно переплелись между собой. Вася сумел понять и принять чужую боль, он стал лучше понимать взрослых и благодаря этому мог наладить отношения с родным отцом.
Однажды он знакомится с Вальком и Марусей. Эти ребята были выходцами из самого низкого социального слоя населения. Так столкнулись две социальные реальности, которые тесно переплелись между собой. Вася сумел понять и принять чужую боль, он стал лучше понимать взрослых и благодаря этому мог наладить отношения с родным отцом.
В этом произведении раскрыта проблема социального неравенства, и пока будет существовать расслоение общества на классы, она останется актуальной.
Еще один пример из классической литературы можно найти в произведении Толстого «Хождение по мукам». Здесь в основном рассказывается о гендерной толерантности, когда женщина становится равноправной мужчине. Так как на рубеже XIX-ХХ веков эта проблема равенства получила широкое распространение, то она была положена в основу множества литературных произведений.
Проблема межэтнической толерантности хорошо раскрыта в произведении «Морские рассказы» (К. М. Станюкович). Русские моряки однажды подобрали в открытом море мальчика афроамериканского происхождения и отнеслись к нему со всем человеческим состраданием, несмотря на цвет кожи.
Эта проблема раскрывается и в рассказе Л. Н. Толстого «Кавказский пленник». Основная мысль, которую пытался донести автор, заключалась в следующем: «Не существует хороших или плохих наций, есть только хорошие и плохие люди разных наций».
О субъекте учебной деятельности и цифровизации
О целях и задачах конференции рассказал президент Ассоциации исследователей образования, научный руководитель центра психометрики и измерений в образовании НИУ «Высшая школа экономики», доктор педагогических наук Виктор Александрович Болотов.
С приветственным словом к участникам конференции обратился президент Московского государственного психолого-педагогического университета, главный внештатный педагог-психолог Министерства просвещения РФ, академик РАО, доктор психологических наук, профессор Виталий Владимирович Рубцов. Как рассказал В.В. Рубцов, по итогам конференции планируется издание сборника тезисов участников конференции, а также сборника неопубликованных работ В. В. Давыдова.
В. Давыдова.
Работа конференции велась в рамках четырех симпозиумов: «Учебная деятельность в начальной школе и цифровые среды: как инициировать развитие субъекта учебной деятельности», «Формирование субъектности подростка в учебно-исследовательской и проектной деятельности: возможности и ограничения цифровой среды», «Игры в цифровой среде, формирующие групповую и индивидуальную субъектность учащихся при решении учебных и проектно-исследовательских задач»,«Развитие предметного мышления учащихся в процессе учебной деятельности, включающей использование или применение цифровых сред».
Симпозиум «Учебная деятельность в начальной школе и цифровые среды: как инициировать развитие субъекта учебной деятельности» начался докладом «От субъекта — к автору деятельности: вектор преемственности начальной и «подростковой» школы в развивающем образовании» доктора психологических наук, профессора Владимира Товиевича Кудрявцева.
«Может ли ребенок в дошкольном возрасте переваливать через границы своего дошкольного детства без учебной деятельности? Я много обследовал детей… Я этого не наблюдал. Но могу допустить, что существует некий феномен учебной одаренности, а это главная одаренность в человеческой жизни, возможно, это может происходить. Это надо изучать. Во всяком случае учебная одаренность проявляется в первые месяцы пребывания ребенка в первом классе… Но возникает проблема исторически устоявшихся образовательных институтов. Трудно в рамках классно-урочной системы подловить учебную инициативу…», — отметил В.Т. Кудрявцев.
Но могу допустить, что существует некий феномен учебной одаренности, а это главная одаренность в человеческой жизни, возможно, это может происходить. Это надо изучать. Во всяком случае учебная одаренность проявляется в первые месяцы пребывания ребенка в первом классе… Но возникает проблема исторически устоявшихся образовательных институтов. Трудно в рамках классно-урочной системы подловить учебную инициативу…», — отметил В.Т. Кудрявцев.
Академик РАО, доктор психологических наук, профессор Николай Николаевич Нечаев представил доклад «Коммуникация в учебной деятельности: от Л.С. Выготского к П.Я. Гальперину». Николай Николаевич отметил, что в психологии традиционно сохраняется противопоставление деятельности и общения. По словам Н.Н. Нечаева, ключевым понятием, позволяющим преодолеть эту дихотомию, должно стать понятие совместно-распределенной деятельности.
Доктор психологических наук, профессор Борис Даниилович Эльконин выступил с докладом «Эволюция субъектности ученика и педагога в системе развивающего обучения».
«Когда идет речь о субъекте учебной деятельности, надо всерьез отнестись к тому, что полагалось и Д.Б. Элькониным, и В.В. Давыдовым истоком учебной деятельности — к учебной задаче», — подчеркнул Б.Д. Эльконин.
Доктор психологических наук, профессор Галина Анатольевна Цукерман представила доклад «Субъект учебной деятельности — тот, кто умеет учиться». Галина Анатольевна задалась вопросом: «Насколько субъект учебной деятельности это то же самое, что и человек, умеющий учить себя». Г.А. Цукерман выделила две составляющих умения учиться: рефлексивную (Я знаю, чего мне недостает для решения задачи) и поисковую (Я могу найти то, чего мне недостает для решения задачи).
Академик РАО, доктор психологических наук, профессор Виталий Владимирович Рубцов выступил с докладом «Субъектность как переход от совместного к самостоятельному действию: к проблеме проектирования развивающей образовательной среды».
«…на фоне теоретико-методологического осмысления В.В. Давыдов фактически поставил перед исследователями задачу: какие условия должны быть, чтобы ребенок совершил этот шаг в обучении, который даст ему сто шагов в развитии», — отметил В.В. Рубцов.
Виталий Владимирович затронул вопрос двойного опосредования: «Надо быть крайне осторожными. Легко свернуть все операциональные структуры в знаковые. Это говорил и Пиаже. Как только мы это делаем, мы облегчаем движение в операциональных структурах интеллекта, но мы убиваем способность к функционально-смысловому движению, к поиску условий и средств».
«Мы даем какие-то очень мощные инструменты функционирования в виде цифровых систем и цифровых инструментов, но мы стоим перед опасностью ограничения возможностей поиска и решения новых задач. Попытки введения информационных, компьютерных систем не безопасны для становления субъекта учебной деятельности», — отметил В.В. Рубцов.
Кандидат педагогических наук, доцент Алексей Борисович Воронцов представил доклад «Цифровая трансформация развивающего обучения (система Д.Б. Эльконина – В.В. Давыдова)». А.Б. Воронцов разделил понятия цифровизация (как внедрение новых технологий) и цифровая трансформация в образовании, под которой понимается переосмысление содержания способов и форм организации работы педагогов для их эффективного взаимодействия с учащимися и их родителями за счет использования современных технологий, анализа данных и получения новых образовательных результатов. А.Б. Воронцов выделил несколько вариантов влияния цифровизации на современную российскую школу. «Если в результате цифровизации не происходит цифровой трансформации, такая цифровизация образованию не нужна», — подчеркнул А.Б. Воронцов.
А.Б. Воронцов выделил несколько вариантов влияния цифровизации на современную российскую школу. «Если в результате цифровизации не происходит цифровой трансформации, такая цифровизация образованию не нужна», — подчеркнул А.Б. Воронцов.
Кандидат психологических наук, доцент Александр Михайлович Медведев выступил с докладом «Инициация субъектности в условиях дистантного образования».
«Ситуация дистантного компьютерного взаимодействия «иронична»: открывая возможности расширения хронотопа взаимодействия, она упаковывает в строгие формальные рамки как предметные преобразования, так и способы интеракции», — отметил А.М. Медведев.
«Коммуникативные компьютерные среды разрабатывались не для задач коллективной учебной деятельности, — подчеркнул Александр Михайлович. — Возникают опасности редукции: редукции содержания к информации, редукции диалога к информационному обмену, редукции публикации к презентации».
Полная программа докладов на «Давыдовских чтениях».
В сентябре 2020 года на базе Московского государственного психолого-педагогического университета прошла I Международная научно-практическая конференция «Научная школа В. В. Давыдова: традиции и инновации», приуроченная к 90-летию со дня рождения В.В. Давыдова. Участники конференции приняли решение сделать это событие постоянным и один раз в 2 года обсуждать основные идеи научной школы В.В. Давыдова и их влияние на систему обучения, воспитания и развития детей.
В. Давыдова: традиции и инновации», приуроченная к 90-летию со дня рождения В.В. Давыдова. Участники конференции приняли решение сделать это событие постоянным и один раз в 2 года обсуждать основные идеи научной школы В.В. Давыдова и их влияние на систему обучения, воспитания и развития детей.
Организаторы конференции:
Ассоциация исследователей образования
Московский государственный психолого-педагогический университет
Психологический институт Российской академии образования
Источник: Психологическая газета
Толерантность к риску с руководством для фасилитаторов, презентациями и раздаточными материалами
Инструмент проекта
Передовая практика обучения толерантности к риску
Безопасность
Толерантность к риску — это решение человека принять или отвергнуть определенный риск. Эта передовая практика определяет и предоставляет вспомогательные материалы по 10 основным факторам, влияющим на толерантность работника к риску. Презентации и шаблоны сессий фасилитаторов предоставляются для ведущих факторов. Эти инструменты были выпущены в 2015 году по запросу Комитета по безопасности COAA.
Презентации и шаблоны сессий фасилитаторов предоставляются для ведущих факторов. Эти инструменты были выпущены в 2015 году по запросу Комитета по безопасности COAA.
Всегда ли риск равен вознаграждению? Почему работники рискуют, когда дело касается их личной безопасности на работе? Рекомендации COAA по толерантности к риску помогают владельцам и подрядчикам понять 10 факторов, влияющих на толерантность к риску, и способы их устранения.
**Эти файлы загружены в исходном формате. Пользователям рекомендуется удалить логотипы Imperial Oil/ExxonMobil из документов при использовании их для собственного внутреннего использования**
- Презентация передового опыта по допустимому риску
- Видео-презентации о 10 факторах толерантности к риску
o Вступительное обсуждение: https://youtu.be/1fzoTbbBKEA
o Фактор 1: https://youtu.be/ejTsn3myruY
o Фактор 2: https:// youtu.be/2g_XgBbiqUg
o Фактор 3: https://youtu.be/Dq70AkVqljM
o Фактор 4: https://youtu. be/eFSvh5ZyHH0
be/eFSvh5ZyHH0
o Фактор 5: https://youtu.be/MTtpgHzM-rg
o Фактор 6: https://youtu.be/hN4yzaP15Oc
o Фактор 7: https://youtu.be/lLCDKkya_r0
o Фактор 8: https://youtu.be/tMwaEQUPAgM
o Фактор 9: https://youtu.be/jOk1EudQfdk
o Фактор 10: https://youtu.be/hMYhPOyu95I
- Руководство для фасилитаторов
- Подробные презентации Powerpoint по каждому фактору
- Фактор 1 — завышенная оценка возможностей или опыта
- Фактор 2 – Знакомство с задачей – Самоуспокоенность
- Фактор 3 – Серьезность исхода
- Фактор 4 – Добровольные действия и контроль
- Фактор 5 – Личный опыт с результатом
- Фактор 6 — Стоимость несоблюдения
- Фактор 7 – Уверенность в оборудовании
- Фактор 8 – Уверенность в защите и спасении
- Фактор 9 – Потенциальная прибыль или прибыль от действий
- Фактор 10 – Примеры для подражания, принимающие риск
- Раздаточный материал для каждого фактора
- Дополнительные инструменты
- Карточка «Остановись и подумай» — документ Powerpoint
- Остановитесь и подумайте, карточка № 1 — документ Word
- Остановись и подумай, карточка № 2 — документ Word
Скачать пдф
Последнее обновление: 2015
Сопроводительные документы
ppt
Фактор 1 завышенной оценки возможностей или опыта
Презентация
Скачать пп
Последнее обновление: 2015
Поделиться документом
п. п.
п.
Фактор 2 Знакомство с заданием
Презентация
Скачать пп
Последнее обновление: 2015
Общий документ
п.п.
Фактор 3 Серьезность исхода
Презентация
Скачать пп
Последнее обновление: 2015
Поделиться документом
п.п.
Фактор 4 Добровольное действие и контроль
Презентация
Скачать пп
Последнее обновление: 2015
Общий документ
п.п.
Фактор 5 Личный опыт с результатом
Презентация
Скачать пп
Последнее обновление: 2015
Общий документ
п.п.
Фактор 6 Стоимость несоответствия
Презентация
Скачать пп
Последнее обновление: 2015
Общий документ
п. п.
п.
Фактор 7 Уверенность в оборудовании
Презентация
Скачать пп
Последнее обновление: 2015
Общий документ
п.п.
Фактор 8 Уверенность в защите и спасении
Презентация
Скачать пп
Последнее обновление: 2015
Поделиться документом
п.п.
Фактор 9 Потенциальная прибыль или прибыль от действий
Презентация
Скачать пп
Последнее обновление: 2015
Общий документ
п.п.
Фактор 10 Ролевые модели принятия риска
Презентация
Скачать пп
Последнее обновление: 2015
Общий документ
pdf+pptx
Презентация допустимого риска
Презентация
Скачать пдф pptx
Последнее обновление: 2015
Поделиться документом
п. п.
п.
Руководство для фасилитаторов по толерантности к риску
Шаблон
Скачать пп
Последнее обновление: 2015
Общий документ
п.п.
Фактор 1 Рабочий лист и раздаточный материал
Шаблон
Скачать пп
Последнее обновление: 2015
Поделиться документом
п.п.
Фактор 2 Рабочий лист и раздаточный материал
Шаблон
Скачать пп
Последнее обновление: 2015
Общий документ
п.п.
Фактор 3 Рабочий лист и раздаточный материал
Шаблон
Скачать пп
Последнее обновление: 2015
Общий документ
п.п.
Фактор 4 Рабочий лист и раздаточный материал
Шаблон
Скачать пп
Последнее обновление: 2015
Общий документ
п. п.
п.
Фактор 5 Рабочий лист и раздаточный материал
Шаблон
Скачать пп
Последнее обновление: 2015
Общий документ
п.п.
Фактор 6 Рабочий лист и раздаточный материал
Шаблон
Скачать пп
Последнее обновление: 2015
Поделиться документом
п.п.
Рабочий лист и раздаточный материал по фактору 7
Шаблон
Скачать пп
Последнее обновление: 2015
Общий документ
п.п.
Фактор 8 Рабочий лист и раздаточный материал
Шаблон
Скачать пп
Последнее обновление: 2015
Поделиться документом
п.п.
Фактор 9 Рабочий лист и раздаточный материал
Шаблон
Скачать пп
Последнее обновление: 2015
Общий документ
п.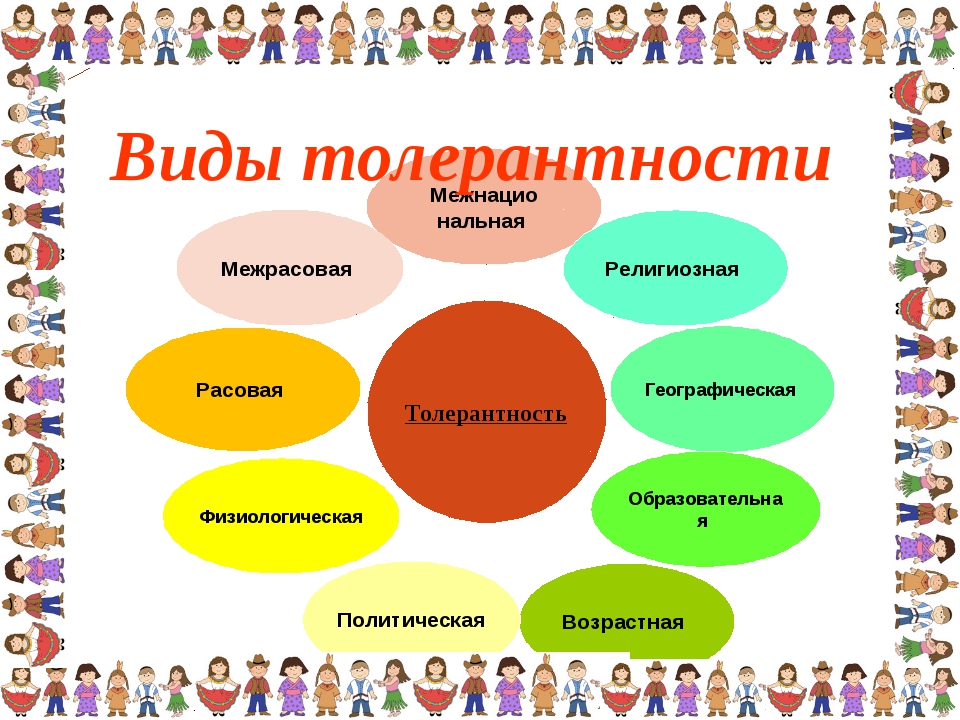 п.
п.
Рабочий лист и раздаточный материал по фактору 10
Шаблон
Скачать пп
Последнее обновление: 2015
Общий документ
пткс
Карточка «Остановись и подумай»
Шаблон
Скачать pptx
Последнее обновление: 2015
Общий документ
документ
Остановись и подумай шаблон 1
Шаблон
Скачать документ
Последнее обновление: 2015
Общий документ
документ
Остановись и подумай, шаблон 2
Шаблон
Скачать документ
Последнее обновление: 2015
Поделиться документом
Обработка, презентация и толерантность антигена: Роль в аутоиммунных заболеваниях кожи
ScienceDirectРегистр. Страницы 750-759
https://doi. org/10.1016/j.jid.2021.05.009Получить права и содержание
org/10.1016/j.jid.2021.05.009Получить права и содержание
Аутореактивные Т-клетки представляют постоянный риск возникновения аутоиммунных заболеваний кожи у генетически предрасположенных лиц, несущих определенный риск HLA аллели. Механизмам иммунной толерантности противостоят обширные аутоиммунопептидомы, представленные HLA, предопределенный репертуар полиспецифических TCR, непрерывная генерация новых специфичностей антител за счет соматической рекомбинации генов Ig в В-клетках и повышенная провоспалительная реактивность. Повышенная презентация аутоантигена молекулами HLA, перекрестная активация патоген-индуцированных Т-клеток против аутологичных структур, измененный метаболизм собственных белков и избыточная продукция провоспалительных сигналов могут способствовать нарушению иммунной толерантности и развитию аутоиммунных заболеваний кожи.
Фрагменты разделов
Йорг Кристоф Принц: http://orcid.org/0000-0002-8857-5495
Автор заявляет об отсутствии конфликта интересов.
Эта работа была поддержана грантом Pr241/5-2 Deutsche Forschungsgemeinschaft (DFG).
Список литературы (152)
- J.C. Prinz
Аутоиммунные аспекты псориаза: наследуемость и аутоантигены
Autoimmune Rev
(2017)
- J. Prinz и т. Д.
Химерное моноклональное антитело к CD4 в лечении генерализованного пустулезного псориаза
Ланцет
(1991)
- B.Z. Пиовезан и др.
Как качественная, так и количественная генетическая изменчивость молекул MHC класса II может влиять на предрасположенность к аутоиммунным заболеваниям: случай эндемической листовидной пузырчатки
Hum Immunol
(2013)
- A. Onoufriadis 9057.etal.
Мутации в IL36RN/IL1F5 связаны с тяжелым эпизодическим воспалительным заболеванием кожи, известным как генерализованный пустулезный псориаз
Am J Hum Genet
(2011)
- C.
 O’huigin et al.
O’huigin et al. Молекулярное происхождение и последствия ухода от регуляции микроРНК аллелями HLA-C
Am J Hum Genet
(2011)
- P. Nikamo et al.
Ассоциация с генетическими вариантами путей IL-23 и NF-κB различает легкую и тяжелую форму псориаза кожи
J Invest Dermatol
(2015)
- C. Münz
Вирус, уклоняющийся от аутофагии
Клеточный микроб-хозяин
(2007)
- G.P. Моммен и др.
Отбор образцов из протеома в лигандом человеческого лейкоцитарного антигена-DR (HLA-DR) осуществляется с помощью высокой специфичности Моббс
и др.Молекулярная основа выбора пептидного репертуара в молекуле человеческого лейкоцитарного антигена (HLA) C*06:02
J Biol Chem
(2017)
- M. Miyara et al.
Регуляторные Т-клетки FoxP3+ человека при системных аутоиммунных заболеваниях
Autoimmun Rev
(2011)
 Melki et al.
Melki et al. Новые моногенные заболевания, вызывающие аутоиммунитет человека
Curr Opin Immunol
(2015)
Очень высокий уровень перекрестной реактивности является важной характеристикой Т-клеточного рецептора
Immunol Today
(1998)
Однонуклеотидный полиморфизм -35 т.п.н. T>C (rs
42) тесно связан с вульгарным псориазом в зависимости от HLA-Cw(∗)06Hum Immunol
(2014)
Дендритные клетки при аутоиммунных заболеваниях
Curr Opin Immunol
(2001)
Распознавание собственного антигена Т-клетками с низкой авидностью позволяет избежать центральной толерантности Джордан
и др.PSORS2 обусловлен мутациями в CARD14
Am J Hum Genet
(2012)

Плазмин играет роль в образовании in vitro линейного дерматозного антигена IgA LADB97
J Invest Dermatol
(2009)
Регуляторные Т-клетки при аутоиммунных заболеваниях: вызовы, противоречия и — пока — вопросы без ответов [опубликованное исправление опубликовано в Autoimmun Rev 2015; 14:845–6] Джанфрани
и др.Уровень экспрессии генов риска МНС класса II является фактором предрасположенности к аутоиммунитету: новые идеи
J Аутоиммун
(2018)
Синергическая индукция IL-23 под действием TNFα, IL-17A и EGF в кератиноцитах
Цитокин
(2021)
Генетика иммуноопосредованных заболеваний: общая основа патогенеза
Trends Immunol
(2013)
Пептидом главного комплекса гистосовместимости II дендритных клеток (MHC II) происходит из различных путей процессинга и включает пептиды с широким спектром чувствительности к HLA-DM
J Biol Chem
(2016)
 Bouneaud et al.
Bouneaud et al. Влияние отрицательного отбора на репертуар Т-клеток, реагирующих на аутопептид: большая часть клонов Т-клеток избегает клональной делеции Бишоп
и др.Активация В-лимфоцитов путем контактно-опосредованных взаимодействий с Т-лимфоцитами
Curr Opin Immunol
(2001)
Деконструкция пептид-MHC-специфичности распознавания Т-клеток
Cell
(2014)
Масс-спектрометрия пептидомов лейкоцитарного антигена класса I человека выявила сильное влияние изобилия и оборота белка на презентацию антигена0578 и др.
Непротиворечивая активность IL-36 способствует клональному CD4
+ Т-клеточный ответ с продукцией IL-17A при генерализованном пустулезном псориазеИсточник представленных пептидов МНС класса I и его значение
Curr Opin Immunol
(2016)
 Admon
AdmonERAP1 формирует только часть иммунопептидома
Hum Immunol
(2019)
Полногеномный метаанализ выявил общие новые локусы при системных серопозитивных ревматических заболеваниях
Терапевтическая эффективность блокады интерлейкина 12/интерлейкина 23 при генерализованном пустулезном псориазе независимо от статуса мутации IL36RN
JAMA Dermatol
(2016)
Меланоцитарный антиген вызывает аутоиммунитет при псориазе человека Арстила
и др.Прямая оценка разнообразия Т-клеточных рецепторов алфавита человека
Science
(1999)
Вызванная воспалением репрессия хроматина, связанного фактором транскрипции Foxp3 в регуляторных Т-клетках
Nat Immunol
(2014)
Экспрессия HLA-DR на кератиноцитах является общим признаком пораженной кожи
Br J Dermatol
(1986)
 Bacchetta et al.
Bacchetta et al. От синдрома IPEX к мутации FOXP3: урок иммунной дисрегуляции
Ann N Y Acad Sci
(2018)
Ингибирование метаболического пути интерлейкина-36 для лечения генерализованного пустулезного псориаза
N Engl J Med
(2019)
Различные мотивы связывания молекул HLA DQ2.5, DQ2.2 и DQ7.5, ассоциированных с глютеновой болезнью, выявленные с помощью относительной количественной протеомики репертуаров эндогенных пептидов
и др.Эзрин, маспин, пероксиредоксин 2 и белок теплового шока 27: потенциальные мишени стрептококкового аутоиммунного ответа при псориазе
Дж. Иммунол
(2010)
Пути процессинга антигена
Annu Rev Immunol
(2013)
Аутореактивные Т-лимфоциты при воспалительных заболеваниях кожи
Фронт Иммунол
(2019)
 J.Bovenschen et al.
J.Bovenschen et al. Регуляторные Т-клетки Foxp3+ больных псориазом легко дифференцируются в клетки, продуцирующие IL-17A, и обнаруживаются в пораженной коже
J Invest Dermatol
(2011)
Генерализованный пустулезный псориаз, вызванный системными глюкокортикостероидами: четыре случая и рекомендации по лечению Buckner
Механизмы нарушения регуляции регуляторными Т-клетками CD4(+)CD25(+)FOXP3(+) при аутоиммунных заболеваниях человека
Nat Rev Immunol
(2010)
Идентификация и характеристика аутореактивных Т-клеточных ответов на антиген 2 буллезного пемфигоида у пациентов и здоровых людей
J Clin Invest
(1998)
26S протеасомы и иммунопротеасомы продуцируют в основном N-удлиненные версии антигенного пептида
EMBO J
(2001)
 Castela et al.
Castela et al. Влияние малых доз рекомбинантного интерлейкина 2 на стимулирование Т-регуляторных клеток при очаговой алопеции
JAMA Dermatol
(2014)
Регуляторные Т-клетки, полученные из тимуса, способствуют толерантности к комменсальной микробиоте
Nature
(2013)
CD8
+ Т-клетки памяти (CD44high, Ly-6C+) более чувствительны, чем наивные клетки, к (CD44low, Ly-6C-) к передаче сигналов TCR/CD8 в ответ на антигенДж Иммунол
(1998)
Гены Т-клеточного антигенного рецептора и распознавание Т-клеток [опубликовано исправление в Nature; 1988; 335:744]
Nature
(1988)
Исследовательская статья
3 Предположение о переломах костей в анамнезе как возможном факторе, связанном с выработкой аутоантител против BP180
Journal of Investigative Dermatology, том 142, выпуск 3, часть B, 2022, стр.
 984-987.e3
984-987.e3Исследовательская статья
Стареющие клетки-предшественники в коже пациентов с кожной красной волчанкой
Journal of Investigative Dermatology, том 142, выпуск 3, часть B, 2022, стр. 90e-98.
Исследовательская статья. , стр. 980-984.e4
Исследовательская статья
Механизмы фоточувствительности при аутоиммунитете
Journal of Investigative Dermatology, Volume 142, Issue 3, Part B, 2022, pp. 849-856 к формированию кожных поражений и активации системного воспаления при некоторых аутоиммунных заболеваниях, особенно системной красной волчанке. В то время как воздействие УФ-излучения на кожу изучалось в течение десятилетий, только недавно были раскрыты некоторые механизмы, способствующие аномальной реакции на УФ-излучение у пациентов с аутоиммунными заболеваниями. В этом обзоре будет обсуждаться биология УФ-излучения в эпидермисе и обсуждаются аномальные эпидермальные и воспалительные механизмы, которые способствуют фоточувствительности.
 Необходимы дальнейшие исследования, чтобы полностью понять, как нормализовать УФ-опосредованное воспаление у пациентов с аутоиммунными заболеваниями.
Необходимы дальнейшие исследования, чтобы полностью понять, как нормализовать УФ-опосредованное воспаление у пациентов с аутоиммунными заболеваниями.Исследовательская статья
Человеческие десмоколлин-3-специфические антитела IgG являются патогенными в гуманизированной модели трансгенной мыши HLA класса II пузырчатки
Журнал исследовательской дерматологии, том 142, выпуск 3, часть B, 2022, стр. 915- 923.e3
Пузырчатка представляет собой потенциально летальное аутоиммунное буллезное заболевание кожи, которое связано с аутоантителами IgG против десмоглеина (DSG) 3 и DSG1. Примечательно, что у части пациентов с пузырчаткой наблюдается сходный клинический фенотип при отсутствии анти-ДСГ IgG, что предполагает наличие сывороточного IgG, реагирующего с десмосомными компонентами, отличными от ДСГ1 или ДСГ3. Мы и другие ранее показали, что у таких пациентов есть сывороточные аутоантитела IgG против десмоколлина 3 (DSC3), компонента десмосом, которые вызывают потерю адгезии кератиноцитов ex vivo.
 Кроме того, гипоморфные мыши DSC3 демонстрируют выраженный фенотип образования пузырей на слизистой оболочке, что очень характерно для пузырчатки. Эти результаты побудили нас изучить индукцию и регуляцию IgG против DSC3 человека у гуманизированных мышей, трансгенных по HLA-DRB1∗04:02, который является широко распространенным гаплотипом при пузырчатке. Мы показываем, что IgG из сыворотки иммунизированных мышей индуцирует акантолиз в анализе диссоциации кератиноцитов на основе диспазы посредством активации p38 MAPK и EGFR. Пассивный перенос IgG от мышей, иммунизированных рекомбинантным DSC3 человека, новорожденным не вызывал потери внутриэпидермальной адгезии, предположительно из-за отсутствия гомологии между DSC3 человека и мыши. Стимуляция ex vivo спленоцитов мышей, иммунизированных DSC3, человеческим DSC3 приводит к значительному пролиферативному ответу Т-клеток IFN-γ и IL-4, который ограничивается HLA-DR/HLA-DQ. Эти данные свидетельствуют о том, что индукция патогенных анти-DSC3 IgG связана с DSC3-специфичными Т-клетками, которые распознают DSC3 в ассоциации с HLA-DRB1∗04:02.
Кроме того, гипоморфные мыши DSC3 демонстрируют выраженный фенотип образования пузырей на слизистой оболочке, что очень характерно для пузырчатки. Эти результаты побудили нас изучить индукцию и регуляцию IgG против DSC3 человека у гуманизированных мышей, трансгенных по HLA-DRB1∗04:02, который является широко распространенным гаплотипом при пузырчатке. Мы показываем, что IgG из сыворотки иммунизированных мышей индуцирует акантолиз в анализе диссоциации кератиноцитов на основе диспазы посредством активации p38 MAPK и EGFR. Пассивный перенос IgG от мышей, иммунизированных рекомбинантным DSC3 человека, новорожденным не вызывал потери внутриэпидермальной адгезии, предположительно из-за отсутствия гомологии между DSC3 человека и мыши. Стимуляция ex vivo спленоцитов мышей, иммунизированных DSC3, человеческим DSC3 приводит к значительному пролиферативному ответу Т-клеток IFN-γ и IL-4, который ограничивается HLA-DR/HLA-DQ. Эти данные свидетельствуют о том, что индукция патогенных анти-DSC3 IgG связана с DSC3-специфичными Т-клетками, которые распознают DSC3 в ассоциации с HLA-DRB1∗04:02.
Исследовательская статья
Личный взгляд на специальный выпуск
Journal of Investigative Dermatology, Volume 142, Issue 3, Part B, 2022, pp. Опубликовано Elsevier, Inc. от имени Общества исследовательской дерматологии.
Механизмы индукции толерантности дендритными клетками In Vivo
Введение
Дендритные клетки (ДК) представляют собой гетерогенную популяцию, полученную из различных гемопоэтических клонов костномозгового происхождения, характеризующуюся специфическими паттернами самонаведения и специализированными иммунными функциями (1–4) . ДК играют ключевую роль в иммунных реакциях и толерантности. Эффективное праймирование Т-клеток DC, приводящее к иммунным ответам, требует дополнительных сигналов от провоспалительной среды, которые могут восприниматься DC через специфические рецепторы распознавания образов, включая toll-подобные рецепторы (TLR) (зрелые DC; mDC). Напротив, отсутствие праймирования Т-клеток в отсутствие провоспалительных стимулов первоначально привело к характеристике ДК как потенциально толерогенных незрелых свидетелей в стационарных условиях (незрелые ДК; iDC).
 Полу-мДК, индуцированные апоптозными клетками, особой цитокиновой средой, такой как IL-10 и TGF-β, или фармакологическими агентами, также проявляют толерогенные свойства (5–7). Толерогенные ДК (tolDC) в организме играют важную роль в центральной и периферической толерантности, что приводит к разрешению текущих иммунных реакций и предотвращению аутоиммунитета. ДК способствуют иммунной толерантности за счет отрицательного отбора аутореактивных Т-клеток и образования регуляторных Т-клеток (Treg) в тимусе во время приобретения центральной толерантности. Они также ограничивают дифференцировку эффекторных Т-клеток и способствуют дифференцировке Treg на периферии с помощью различных механизмов. Нарушение этих функций приводит к аутоиммунным заболеваниям. Кожа и кишечник действуют как большие барьерные органы для внешней среды, подвергаясь воздействию широкого спектра антигенов окружающей среды, таких как пищевые продукты, комменсальные бактерии и патогены. В обоих органах ДК играют решающую роль в балансе иммунных реакций, приводя к гомеостазу и предотвращению ненужного воспаления (8).
Полу-мДК, индуцированные апоптозными клетками, особой цитокиновой средой, такой как IL-10 и TGF-β, или фармакологическими агентами, также проявляют толерогенные свойства (5–7). Толерогенные ДК (tolDC) в организме играют важную роль в центральной и периферической толерантности, что приводит к разрешению текущих иммунных реакций и предотвращению аутоиммунитета. ДК способствуют иммунной толерантности за счет отрицательного отбора аутореактивных Т-клеток и образования регуляторных Т-клеток (Treg) в тимусе во время приобретения центральной толерантности. Они также ограничивают дифференцировку эффекторных Т-клеток и способствуют дифференцировке Treg на периферии с помощью различных механизмов. Нарушение этих функций приводит к аутоиммунным заболеваниям. Кожа и кишечник действуют как большие барьерные органы для внешней среды, подвергаясь воздействию широкого спектра антигенов окружающей среды, таких как пищевые продукты, комменсальные бактерии и патогены. В обоих органах ДК играют решающую роль в балансе иммунных реакций, приводя к гомеостазу и предотвращению ненужного воспаления (8). Соответственно, важно проанализировать роль ДК в механизме иммунной толерантности. В этом обзоре представлен обзор нашего текущего понимания механизмов индукции толерантности ДК в организме.
Соответственно, важно проанализировать роль ДК в механизме иммунной толерантности. В этом обзоре представлен обзор нашего текущего понимания механизмов индукции толерантности ДК в организме.DC Происхождение, дифференцировка и субпопуляции
Дендритные клетки происходят из CD34 + гемопоэтических клеток-предшественников в костном мозге, которые затем дифференцируются далее через общих макрофагов/DC-предшественников в линию моноцитов/макрофагов или общие DC-предшественники ( CDP) (рис. 1А) (9). CDP дают начало как плазмоцитоидным DC (pDC), так и предобычным DC (cDC) предшественникам. Fms-like tyrosine kinase 3 ligand (FLT3L) и его рецептор, FLT3, играют инструктивную роль в детерминации гемопоэтических предшественников в DC-рестриктированном клоне и их последующем развитии (10, 11). FLT3L достаточно, чтобы управлять дифференцировкой DC от мышиных и человеческих предшественников, поскольку экспрессия FLT3 ограничена линией DC (11). Прежде чем они мигрируют в кровоток, pDCs завершают свой последний этап созревания в костном мозге, прежде чем они мигрируют в кровоток.
 Пре-кДК предшественники затем мигрируют через сосудистую систему к их конечному местоположению в тканях или лимфоидных органах, прежде чем завершить свою дифференцировку в иДК, состоящие из двух различных подмножеств кДК, CD8α + /CD103 + DC [обычные DC 1 (cDC1s)] и CD11b + DC [обычные DC 2 (cDC2s)] (3). С другой стороны, моноцитарные DCs (moDCs) могут дифференцироваться от моноцитов CD14 + под влиянием комбинации стимулов, включая GM-CSF, TNF-α и IL-4, во время воспаления тканей (12, 13). ). ДК более многочисленны в лимфоидных органах и эпителии и могут экспрессировать различные молекулярные маркеры в зависимости от их локализации. Следовательно, cDC1, cDC2 и pDC присутствуют в разных тканях. На рисунке 1B показан кластер cDC, к которому принадлежит каждый тип клеток. В этом контексте необходимо учитывать фенотип и конкретное расположение ДК при рассмотрении их функции в конкретных тканях (9).).
Пре-кДК предшественники затем мигрируют через сосудистую систему к их конечному местоположению в тканях или лимфоидных органах, прежде чем завершить свою дифференцировку в иДК, состоящие из двух различных подмножеств кДК, CD8α + /CD103 + DC [обычные DC 1 (cDC1s)] и CD11b + DC [обычные DC 2 (cDC2s)] (3). С другой стороны, моноцитарные DCs (moDCs) могут дифференцироваться от моноцитов CD14 + под влиянием комбинации стимулов, включая GM-CSF, TNF-α и IL-4, во время воспаления тканей (12, 13). ). ДК более многочисленны в лимфоидных органах и эпителии и могут экспрессировать различные молекулярные маркеры в зависимости от их локализации. Следовательно, cDC1, cDC2 и pDC присутствуют в разных тканях. На рисунке 1B показан кластер cDC, к которому принадлежит каждый тип клеток. В этом контексте необходимо учитывать фенотип и конкретное расположение ДК при рассмотрении их функции в конкретных тканях (9).).Рисунок 1 .
 Развитие DC (A) и расположение и фенотипы обычных DC 1 мыши (cDC1s) и обычных DC 2 (cDC2s) (B). (A) DC, дендритные клетки; HSC, гемопоэтические стволовые клетки; MP, миелоидный прокурсор; MDP, предшественник макрофагов/ДК; CDP, общий предшественник DC; cDC, обычный DC; pDC, плазмацитоидные DC; moDC, ДК моноцитарного происхождения. (B) Расположение и фенотипы мышиных cDC1 (красный) и cDC2 (синий).
Развитие DC (A) и расположение и фенотипы обычных DC 1 мыши (cDC1s) и обычных DC 2 (cDC2s) (B). (A) DC, дендритные клетки; HSC, гемопоэтические стволовые клетки; MP, миелоидный прокурсор; MDP, предшественник макрофагов/ДК; CDP, общий предшественник DC; cDC, обычный DC; pDC, плазмацитоидные DC; moDC, ДК моноцитарного происхождения. (B) Расположение и фенотипы мышиных cDC1 (красный) и cDC2 (синий).У мышей, CD8α, резидентный в лимфоидных органах + ДК и мигрирующие тканерезидентные CD103 + ДК имеют общее происхождение (9). Их развитие зависит от FLT3L, ингибитора ДНК-связывающего белка 2, регуляторного фактора транскрипции интерферона 8 (IRF8) и основного транскрипционного фактора лейциновой молнии ATF-подобного 3 (BATF3) (9). Функциональное и фенотипическое сравнение показало, что человеческим аналогом мышиных CD8α + /CD103 + ДК являются CD141 (BDCA-3)-положительные ДК (14).
 CD8α + /CD103 + ДК имеют общие рецепторы, такие как хемокиновый рецептор XCR1 и лектиновый рецептор CLEC9A (15–17). CD8α + /CD103 + DC ответственны за эффективную перекрестную презентацию антигена и стимуляцию CD8 + Т-клеточного иммунитета посредством секреции IL-12, тем самым способствуя дифференцировке Th2 (18, 19). Напротив, в невоспаленном кишечнике CD103 + DC в собственной пластинке экспрессируют высокие уровни TGF-β и ретинальдегиддегидрогеназы 2 (RALDh3), что приводит к индукции Treg (20). Таким образом, CD8α + /CD103 + ДК индуцируют либо толерантность слизистых оболочек, либо перекрестно-презентативный CD8 + Т-клеточный иммунитет на основе местного микроокружения.
CD8α + /CD103 + ДК имеют общие рецепторы, такие как хемокиновый рецептор XCR1 и лектиновый рецептор CLEC9A (15–17). CD8α + /CD103 + DC ответственны за эффективную перекрестную презентацию антигена и стимуляцию CD8 + Т-клеточного иммунитета посредством секреции IL-12, тем самым способствуя дифференцировке Th2 (18, 19). Напротив, в невоспаленном кишечнике CD103 + DC в собственной пластинке экспрессируют высокие уровни TGF-β и ретинальдегиддегидрогеназы 2 (RALDh3), что приводит к индукции Treg (20). Таким образом, CD8α + /CD103 + ДК индуцируют либо толерантность слизистых оболочек, либо перекрестно-презентативный CD8 + Т-клеточный иммунитет на основе местного микроокружения.У мышей CD11b + ДК присутствуют во всех основных лимфоидных и нелимфоидных органах. Развитие CD11b + DCs зависит от различных транскрипционных факторов, включая гомолог нейрогенного локуса notch, белок 2, гомолог B вирусного онкогена V-Rel avian reticuloendotheliosis и IRF4 (9).
 Человеческий аналог мышиного CD11b + ДК являются CD1c (BDCA-1)-положительными ДК (21). CD11b + DC в селезенке экспрессируют CD4 + и могут быть подразделены в соответствии с их экспрессией молекулы адгезии, селективной к эндотелиальным клеткам (22). Селезеночные CD11b + DC демонстрируют более высокую экспрессию MHC класса II, чем CD8α + DC, и могут более эффективно представлять антиген CD4 + T-клеткам как в равновесном состоянии, так и во время воспаления (23). Напротив, CD11b + ДК в коже и CD11b + CD103 + DCs в lamina propria, как сообщается, индуцируют дифференцировку Treg через метаболизм ретиноевой кислоты (RA) (20, 24, 25). И CD8α + /CD103 + DC, и CD11b + DC индуцируют толерантность или CD4 + пролиферацию Т-клеток в зависимости от местного микроокружения.
Человеческий аналог мышиного CD11b + ДК являются CD1c (BDCA-1)-положительными ДК (21). CD11b + DC в селезенке экспрессируют CD4 + и могут быть подразделены в соответствии с их экспрессией молекулы адгезии, селективной к эндотелиальным клеткам (22). Селезеночные CD11b + DC демонстрируют более высокую экспрессию MHC класса II, чем CD8α + DC, и могут более эффективно представлять антиген CD4 + T-клеткам как в равновесном состоянии, так и во время воспаления (23). Напротив, CD11b + ДК в коже и CD11b + CD103 + DCs в lamina propria, как сообщается, индуцируют дифференцировку Treg через метаболизм ретиноевой кислоты (RA) (20, 24, 25). И CD8α + /CD103 + DC, и CD11b + DC индуцируют толерантность или CD4 + пролиферацию Т-клеток в зависимости от местного микроокружения.Мышиные pDC определяются как CD11c +, MHC-II +, B220 +/CD45R +, BST2 + и SiglecH + и зависят от фактора транскрипции E2-2 в своем развитии (26).
 pDC экспрессируют высокие уровни TLR7 и 9, которые при лигировании вирусными продуктами стимулируют секрецию большого количества IFN I типа. pDC могут повышать экспрессию MHC класса II, позволяя индуцировать пролиферацию Т-клеток. С другой стороны, pDC мыши индуцируют дифференцировку Т-клеток в Т-клетки регуляторного типа 1 (Tr1) (27). Сообщалось, что наивная стимуляция Т-клеток с использованием pDC человека, стимулированных олигонуклеотидами CpG, приводит к появлению Treg с супрессивными свойствами (28). Фенотипические маркеры подмножеств ДК мыши и человека приведены в таблице 1.
pDC экспрессируют высокие уровни TLR7 и 9, которые при лигировании вирусными продуктами стимулируют секрецию большого количества IFN I типа. pDC могут повышать экспрессию MHC класса II, позволяя индуцировать пролиферацию Т-клеток. С другой стороны, pDC мыши индуцируют дифференцировку Т-клеток в Т-клетки регуляторного типа 1 (Tr1) (27). Сообщалось, что наивная стимуляция Т-клеток с использованием pDC человека, стимулированных олигонуклеотидами CpG, приводит к появлению Treg с супрессивными свойствами (28). Фенотипические маркеры подмножеств ДК мыши и человека приведены в таблице 1.Таблица 1 . Фенотипические маркеры подмножеств дендритных клеток (ДК) мыши и человека.
Индукция толерантности в тимусе и на периферии
Центральная толерантность
Дендритные клетки вместе с медуллярными эпителиальными клетками тимуса (mTEC) играют решающую роль в индукции центральной толерантности в тимусе путем элиминации собственных антиген-реактивных тимоцитов и образования Treg (2, 29).
 Это подтверждается тем фактом, что у мышей, лишенных ДК, наблюдается заметное накопление CD4-9.0878 + тимоцитов без негативной селекции, что приводит к фатальному аутоиммунитету (30). Three thymic DC subsets contribute to central tolerance: resident DCs (CD8α + SIRPα − ), migratory DCs (CD8α − CD11b + SIRPα + ), and pDCs (CD11c int CD45RA int ). Резидентные ДК, которые развиваются из лимфоидных предшественников тимуса, являются наиболее распространенной подгруппой (> 50%) и локализуются в основном в мозговом веществе (31, 32). Они способствуют элиминации аутореактивных тимоцитов, презентируя широко экспрессируемые аутоантигены и перекрестно презентируя как антигены крови, так и тканеспецифические антигены из mTEC (33, 34). С другой стороны, мигрирующие ДК и пДК развиваются на периферии и мигрируют в кортикомедуллярное периваскулярное пространство, которое свободно проницаемо для циркулирующих антигенов через интегрин CCR2/α4 и интегрин CCR9/α4 соответственно (35, 36).
Это подтверждается тем фактом, что у мышей, лишенных ДК, наблюдается заметное накопление CD4-9.0878 + тимоцитов без негативной селекции, что приводит к фатальному аутоиммунитету (30). Three thymic DC subsets contribute to central tolerance: resident DCs (CD8α + SIRPα − ), migratory DCs (CD8α − CD11b + SIRPα + ), and pDCs (CD11c int CD45RA int ). Резидентные ДК, которые развиваются из лимфоидных предшественников тимуса, являются наиболее распространенной подгруппой (> 50%) и локализуются в основном в мозговом веществе (31, 32). Они способствуют элиминации аутореактивных тимоцитов, презентируя широко экспрессируемые аутоантигены и перекрестно презентируя как антигены крови, так и тканеспецифические антигены из mTEC (33, 34). С другой стороны, мигрирующие ДК и пДК развиваются на периферии и мигрируют в кортикомедуллярное периваскулярное пространство, которое свободно проницаемо для циркулирующих антигенов через интегрин CCR2/α4 и интегрин CCR9/α4 соответственно (35, 36). Благодаря этому стратегическому расположению мигрирующие DC и pDC эффективно захватывают и представляют антигены, полученные из крови. Все подмножества DC вносят вклад в иммунную толерантность, представляя аутоантигены и индуцируя негативную селекцию тимоцитов с высоким сродством к аутоантигенам. Затем резидентные ДК обеспечивают незрелые Т-клетки отчетливым аутоантигенным репертуаром, в то время как мигрирующие ДК и пДК специализируются на презентации периферических антигенов.
Благодаря этому стратегическому расположению мигрирующие DC и pDC эффективно захватывают и представляют антигены, полученные из крови. Все подмножества DC вносят вклад в иммунную толерантность, представляя аутоантигены и индуцируя негативную селекцию тимоцитов с высоким сродством к аутоантигенам. Затем резидентные ДК обеспечивают незрелые Т-клетки отчетливым аутоантигенным репертуаром, в то время как мигрирующие ДК и пДК специализируются на презентации периферических антигенов.Дендритные клетки тимуса также важны для развития Tregs. Резидентные и мигрирующие DC способны индуцировать Tregs из тимоцитов in vitro с помощью различных механизмов (37, 38). Резидентные DC способствуют выживанию Treg через их экспрессию CD70, в то время как CD70-дефицитные мигрирующие DC эффективно индуцируют Treg через неопределенный путь (38). Тимический стромальный лимфопоэтин (TSLP), экспрессируемый тельцами Гассаля в мозговом веществе тимуса, индуцирует толерогенный фенотип на происходящих из костного мозга DC, делая их способными преобразовывать наивные Т-клетки в функциональные Treg 9.
 1229 in vitro (39, 40). Однако мыши с дефицитом рецепторов TSLP имеют нормальное количество Treg в тимусе, указывая на то, что передача сигналов TSLP не является существенной для развития Treg (29, 41). Тимические pDC также могут индуцировать Treg (42, 43), которые являются более эффективными продуцентами IL-10, чем те, которые индуцируются другими тимическими DC. Эти данные показывают, что все подмножества DC в тимусе необходимы для поддержания центральной толерантности.
1229 in vitro (39, 40). Однако мыши с дефицитом рецепторов TSLP имеют нормальное количество Treg в тимусе, указывая на то, что передача сигналов TSLP не является существенной для развития Treg (29, 41). Тимические pDC также могут индуцировать Treg (42, 43), которые являются более эффективными продуцентами IL-10, чем те, которые индуцируются другими тимическими DC. Эти данные показывают, что все подмножества DC в тимусе необходимы для поддержания центральной толерантности.Недавно было изучено, как mTECs и CD8α + -резидентные DC способствуют толерантности тимуса при использовании мышей, лишенных mTEC и/или резидентных DC (44). Хотя мыши, лишенные резидентных DC, были нормальными, а у мышей с истощением mTEC развивалось воспаление печени, истощение как резидентных DC, так и mTEC приводило к полиорганному аутоиммунитету. Истощение mTEC значительно снижало продукцию тимических Treg, но не оказывало дополнительного влияния на тимические Treg, когда отсутствовали как mTEC, так и резидентные DC.
 Оба CD4 + и CD8 + Т-клетки в тимусе были увеличены у мышей, лишенных как mTEC, так и резидентных DC. Эти результаты свидетельствуют о том, что mTEC и резидентные DC действуют для предотвращения аутоиммунитета за счет истощения T-клеток тимуса кооперативным образом, тогда как mTEC играют неповторяющуюся роль в продукции Treg тимуса. Т.о., mTEC и резидентные DC играют уникальную роль в индукции толерантности, которая не может быть компенсирована оставшимися мигрирующими DC и pDC.
Оба CD4 + и CD8 + Т-клетки в тимусе были увеличены у мышей, лишенных как mTEC, так и резидентных DC. Эти результаты свидетельствуют о том, что mTEC и резидентные DC действуют для предотвращения аутоиммунитета за счет истощения T-клеток тимуса кооперативным образом, тогда как mTEC играют неповторяющуюся роль в продукции Treg тимуса. Т.о., mTEC и резидентные DC играют уникальную роль в индукции толерантности, которая не может быть компенсирована оставшимися мигрирующими DC и pDC.Рецептор лимфотоксина β (LTβR), член надсемейства рецепторов TNF, является ключевым регулятором микроокружения тимуса и внутритимусной толерантности, и его экспрессия обнаруживается во множестве подмножеств mTEC (45, 46). Взаимосвязь между LTβR и координацией mTECs и DCs для отрицательного отбора и развития Treg была недавно исследована с использованием мышей с дефицитом LTβR (47). У мышей с дефицитом LTβR размер пула ДК тимуса был уменьшен из-за уменьшения количества как пДК, так и кДК тимуса, особенно мигрирующих ДК.
 Кроме того, у мышей с дефицитом LTβR наблюдалось большее снижение количества CD4 + CD8 − тимоциты и каспаза-3 + CD5 + CD69 + тимоциты, представляющие собой клетки, подвергшиеся отрицательному отбору, хотя они не показали изменений в генерации Treg по сравнению с контрольными мышами. Эти данные указывают на то, что LTβR контролирует толерантность тимуса, регулируя частоту и состав внутритимусных DC, необходимых для эффективной отрицательной селекции тимоцитов, а не генерации Treg.
Кроме того, у мышей с дефицитом LTβR наблюдалось большее снижение количества CD4 + CD8 − тимоциты и каспаза-3 + CD5 + CD69 + тимоциты, представляющие собой клетки, подвергшиеся отрицательному отбору, хотя они не показали изменений в генерации Treg по сравнению с контрольными мышами. Эти данные указывают на то, что LTβR контролирует толерантность тимуса, регулируя частоту и состав внутритимусных DC, необходимых для эффективной отрицательной селекции тимоцитов, а не генерации Treg.Периферическая толерантность
Хотя селекция тимуса эффективно удаляет большинство аутоантиген-реактивных Т-клеток, некоторые остаются и мигрируют на периферию. Следовательно, периферическая толерантность имеет решающее значение для поддержания иммунного гомеостаза на протяжении всей жизни. Tregs тимического происхождения и периферические DC играют решающую роль в индуцировании толерантности к антигенам в стационарных условиях (рис.
 2) (1, 48). Популяция tolDC состоит из iDC (наивные DC) и альтернативно активированных DC (полузрелых), которые проявляют устойчивость к созреванию в присутствии индуцирующего сигнала (5, 48). ИДК, полученные из костного мозга, конститутивно мигрируют по периферии и лимфатической системе и распределяются в периферических тканях. iDCs плохо иммуногенны, так как они демонстрируют низкую поверхностную экспрессию костимулирующих молекул и имеют лишь скромные уровни MHC класса II (1, 48). Основной функциональной характеристикой iDCs является их способность к эндоцитозу и фагоцитозу, включая как чужеродные антигены, так и апоптотические клетки, которые происходят постоянно в стационарном состоянии. Поддержание ДК в незрелом состоянии из-за отсутствия стимулов созревания связано с толерантностью за счет индукции делеции Т-клеток, анергии и поляризации в сторону регуляторного фенотипа (4). Нагруженные антигеном iDCs в дренирующих вторичных лимфоидных органах более эффективны в индукции антиген-специфических популяций Treg, чем резидентные лимфоидные DCs in vivo (49).
2) (1, 48). Популяция tolDC состоит из iDC (наивные DC) и альтернативно активированных DC (полузрелых), которые проявляют устойчивость к созреванию в присутствии индуцирующего сигнала (5, 48). ИДК, полученные из костного мозга, конститутивно мигрируют по периферии и лимфатической системе и распределяются в периферических тканях. iDCs плохо иммуногенны, так как они демонстрируют низкую поверхностную экспрессию костимулирующих молекул и имеют лишь скромные уровни MHC класса II (1, 48). Основной функциональной характеристикой iDCs является их способность к эндоцитозу и фагоцитозу, включая как чужеродные антигены, так и апоптотические клетки, которые происходят постоянно в стационарном состоянии. Поддержание ДК в незрелом состоянии из-за отсутствия стимулов созревания связано с толерантностью за счет индукции делеции Т-клеток, анергии и поляризации в сторону регуляторного фенотипа (4). Нагруженные антигеном iDCs в дренирующих вторичных лимфоидных органах более эффективны в индукции антиген-специфических популяций Treg, чем резидентные лимфоидные DCs in vivo (49). Это подтверждает роль мигрирующих iDCs в обеспечении периферической толерантности в стационарных условиях. Более того, повторная стимуляция Т-клеток с помощью iDCs может конвертировать наивные Т-клетки в Tregs (50, 51). Поглощение апоптотических клеток поляризует DC до толерогенного состояния, что приводит к усилению анергии и гибели Т-клеток и индукции Tregs посредством секреции TGF-β1 (52, 53). Эти данные указывают на то, что апоптотические клетки, вероятно, являются недостаточным стимулом для полного созревания ДК.
Это подтверждает роль мигрирующих iDCs в обеспечении периферической толерантности в стационарных условиях. Более того, повторная стимуляция Т-клеток с помощью iDCs может конвертировать наивные Т-клетки в Tregs (50, 51). Поглощение апоптотических клеток поляризует DC до толерогенного состояния, что приводит к усилению анергии и гибели Т-клеток и индукции Tregs посредством секреции TGF-β1 (52, 53). Эти данные указывают на то, что апоптотические клетки, вероятно, являются недостаточным стимулом для полного созревания ДК.Рисунок 2 . Индукция толерантности периферическими дендритными клетками (ДК) в стационарных условиях. Резидентные в тканях незрелые ДК захватывают собственные антигены из апоптотических клеток, комменсальных бактерий и пищевых антигенов. В стационарных условиях эти ДК мигрируют в дренирующие лимфатические узлы без достаточного созревания. Антигенпрезентирующие незрелые или полузрелые ДК обеспечивают недостаточные стимулирующие сигналы для Т-клеток и, следовательно, вызывают анергию наивных Т-клеток и их дифференцировку в регуляторные Т-клетки и регуляторные Т-клетки типа 1 (Tr1).

Субпопуляции дендритных клеток, которые дифференцируются с помощью лигандов TLR или в специфической среде цитокинов, могут участвовать в толерантности, а не в активации Т-клеток (1, 48). Этот тип DC имеет полузрелый фенотип со сниженной экспрессией MHC класса II и костимулирующих молекул по сравнению с полностью mDC. Semi-mDCs дифференцируются в присутствии IL-6 или при стимуляции лигандами TLR в низких концентрациях (54, 55). Стимуляция iDCs лигандами TLR2 или TLR4 в низкой концентрации с помощью комменсальной бактерии Bacteroides vulgatus , который колонизирует кишечный тракт, приводит к секреции IL-6, но не IL-12 или TNF-α (56). Сами эти DCs дифференцируются в semi-mDCs через аутокринную петлю, а воздействие на iDCs IL-6 (паракринная петля) запускает их дифференцировку в semi-mDCs. Более того, толерогенные полумДК индуцируются в присутствии только IL-10 или TNF-α (57–60).
Несколько исследований показали, какие подтипы ДК способствуют индукции периферических Treg путем комбинирования методов доставки антигена в ДК с различными генетическими моделями мышей, в которых отсутствуют определенные подтипы ДК (1).
 Нацеливание антигенов на CD8α + /CD103 + ДК с использованием рекомбинантных химерных антител, таких как DEC205, CLEC9A и лангерин, приводит к индукции периферических Treg (49, 61–63). Кроме того, периферическая индукция Treg нарушается за счет снижения доли CD8α + /CD103 + DCs у мышей с дефицитом BATF3 и мышей с дефицитом IRF8; оба являются факторами транскрипции, которые необходимы для развития CD8α + /CD103 + DCs (64, 65). Напротив, индукция Treg восстанавливается у мышей с дефицитом IRF4, фактора транскрипции, который управляет CD11b + ДС разработки. Эти данные показывают, что CD8α + / CD103 + DC скорее, чем CD11b + DCs, способствуют периферической индукции Treg.
Нацеливание антигенов на CD8α + /CD103 + ДК с использованием рекомбинантных химерных антител, таких как DEC205, CLEC9A и лангерин, приводит к индукции периферических Treg (49, 61–63). Кроме того, периферическая индукция Treg нарушается за счет снижения доли CD8α + /CD103 + DCs у мышей с дефицитом BATF3 и мышей с дефицитом IRF8; оба являются факторами транскрипции, которые необходимы для развития CD8α + /CD103 + DCs (64, 65). Напротив, индукция Treg восстанавливается у мышей с дефицитом IRF4, фактора транскрипции, который управляет CD11b + ДС разработки. Эти данные показывают, что CD8α + / CD103 + DC скорее, чем CD11b + DCs, способствуют периферической индукции Treg.Толерогенные дендритные клетки демонстрируют экспрессию иммуномодулирующих молекул и продуцируют иммуносупрессивные факторы, такие как IL-10, TGF-β, IL-35 и индоламин-2,3-диоксигеназу (IDO), что приводит к анергии и апоптозу Т-клеток и индукции Tregs ( 2, 48).
 В следующем разделе описаны эти механизмы.
В следующем разделе описаны эти механизмы.Механизмы иммунной толерантности ДК
Т-клеточная анергия
Анергия — это гипореактивное состояние, при котором Т-клетки остаются неактивными в условиях, когда иммунная активация нежелательна, что обеспечивает распознавание аутоантигенов и поддержание стабильного состояния (66). Анергия индуцируется в Т-клетках, которые распознают антиген в отсутствие костимулирующих сигналов, возникающих в результате связывания CD28 на их поверхности с его лигандом, CD80/CD86, на ДК. Следовательно, продукция IL-2 блокируется, и Т-клетки не могут пролиферировать тот же самый антиген (5, 67). Анергия также может быть вызвана коингибирующими сигналами, такими как рецептор программируемой гибели клеток-1 (PD-1) и цитотоксический антиген 4 Т-лимфоцитов (CTLA-4) (68, 69).). PD-1 связывается с лигандом PD-1 (PD-L1) и PD-L2 на DC, тогда как CTLA-4 взаимодействует с CD80/CD86 на DC.
Несколько исследований показали, что tolDCs могут индуцировать антиген-специфическую анергию с помощью различных механизмов (70–73).
 tolDC, созданные с помощью IL-10, индуцировали гипореактивность клона Т-клеток CD4 + , специфичного к столбнячному токсину (TT), в отношении повторной стимуляции с помощью TT-импульсных DC (70). Это ингибирование пролиферации Т-клеток было связано не с высвобождением растворимых ингибиторных факторов из tolDC, а с механизмом клеточного контакта. Тюттенберг и др. продемонстрировали, что индукция анергии в CD4 + Т-клеток с помощью tolDCs, модулированных IL-10, был основан на межклеточном контакте посредством взаимодействия индуцибельного костимулятора Т-клеток (ICOS)–лиганда ICOS (ICOS-L) (71). Торрес-Агилар и др. показали, что tlDC, генерируемые различными комбинациями цитокинов IL-10, TGF-β и IL-6, индуцируют анергию ТТ-специфических CD4 + Т-клеток посредством экспрессии тромбоспондина-1 и продукции простагландинов и аденозина tlDC (72) . Недавно Родригес и соавт. сообщили, что взаимодействие специфической для дендритных клеток молекулы межклеточной адгезии-3, захватывающей не-интегрин, с патогенами запускает специфические сигнальные события, которые модулируют созревание и активность ДК, что приводит к индукции анергии Т-клеток (73).
tolDC, созданные с помощью IL-10, индуцировали гипореактивность клона Т-клеток CD4 + , специфичного к столбнячному токсину (TT), в отношении повторной стимуляции с помощью TT-импульсных DC (70). Это ингибирование пролиферации Т-клеток было связано не с высвобождением растворимых ингибиторных факторов из tolDC, а с механизмом клеточного контакта. Тюттенберг и др. продемонстрировали, что индукция анергии в CD4 + Т-клеток с помощью tolDCs, модулированных IL-10, был основан на межклеточном контакте посредством взаимодействия индуцибельного костимулятора Т-клеток (ICOS)–лиганда ICOS (ICOS-L) (71). Торрес-Агилар и др. показали, что tlDC, генерируемые различными комбинациями цитокинов IL-10, TGF-β и IL-6, индуцируют анергию ТТ-специфических CD4 + Т-клеток посредством экспрессии тромбоспондина-1 и продукции простагландинов и аденозина tlDC (72) . Недавно Родригес и соавт. сообщили, что взаимодействие специфической для дендритных клеток молекулы межклеточной адгезии-3, захватывающей не-интегрин, с патогенами запускает специфические сигнальные события, которые модулируют созревание и активность ДК, что приводит к индукции анергии Т-клеток (73).
Индукция и поддержание анергии Т-клеток зависят от активации убиквитинлигаз семейства E3: Casitas B-линии лимфомы-b (Cbl-b), гомолога убиквитинпротеинлигазы Itchy E3 (Itch) и гена, связанного с анергией в лимфоцитах (ГРААЛЬ) (74). Эти ферменты действуют главным образом посредством индукции протеолиза молекул, участвующих в передаче сигналов TCR (66, 67). Т-клетки мышей с дефицитом Cbl-b или Itch были гиперреактивны и продуцировали повышенное количество IL-2 (75–78). GRAIL активировался в анергическом CD4 + Т-клеток (79). Кроме того, экспрессия этих убиквитинлигаз в анергических Т-клетках связана с транскрипционными факторами раннего ответа роста (Egr) 2 и 3 типа (80). Блокада Egr2 и Egr3 устойчива к индукции анергии, в то время как трансгенная экспрессия этих факторов подавляет передачу сигналов TCR (81, 82). Кроме того, анергические Т-клетки также могут действовать как клетки Tr1, продуцирующие Treg и IL-10 (83–86).
Клональная делеция
Клональная делеция, которая включает элиминацию Т-клеток посредством апоптоза, является важным процессом для поддержания самотолерантности на периферии (87).
 Пути апоптоза могут запускаться внешними (рецептор-зависимыми) и внутренними (митохондриально-зависимыми) стимулами (88, 89).). Оба пути включают каскад каспаз, активация которых обрекает клетки на гибель. Внешний путь апоптоза инициируется связыванием рецепторов смерти, таких как Fas и рецептор TNF. Лигирование FasL, TNF или связанного с TNF лиганда, индуцирующего апоптоз (TRAIL), с рецепторами смерти приводит к активации каспазы 8 и нижестоящих каспаз и, в конечном счете, к гибели клеток. tolDC также могут индуцировать апоптоз наивных Т-клеток и Т-клеток памяти за счет взаимодействия между FasL и Fas (90), взаимодействия TRAIL с рецепторами TRAIL (91) и катаболизм триптофана за счет продукции IDO (92, 93).
Пути апоптоза могут запускаться внешними (рецептор-зависимыми) и внутренними (митохондриально-зависимыми) стимулами (88, 89).). Оба пути включают каскад каспаз, активация которых обрекает клетки на гибель. Внешний путь апоптоза инициируется связыванием рецепторов смерти, таких как Fas и рецептор TNF. Лигирование FasL, TNF или связанного с TNF лиганда, индуцирующего апоптоз (TRAIL), с рецепторами смерти приводит к активации каспазы 8 и нижестоящих каспаз и, в конечном счете, к гибели клеток. tolDC также могут индуцировать апоптоз наивных Т-клеток и Т-клеток памяти за счет взаимодействия между FasL и Fas (90), взаимодействия TRAIL с рецепторами TRAIL (91) и катаболизм триптофана за счет продукции IDO (92, 93).Толерогенные ДК индуцируют обширный апоптоз Т-клеток в зависимости от взаимодействия между ДК FasL и Fas, экспрессируемыми лимфоцитами-мишенями. Недавно сообщалось о новом иммуносупрессивном действии ДК через сигнал Fas (94). Обученные строме селезенки tolDC экспрессировали высокий уровень Fas, и лигирование Fas было способно более значительно способствовать ингибированию пролиферации CD4 + Т-клеток с помощью tolDC.
 Кроме того, лигирование Fas предпочтительно индуцировало tolDCs для продукции IL-10. Кроме того, активированные Т-клетки стимулировали секрецию большего количества IL-10 tlDC через FasL. Это показывает, что, по крайней мере, от активированных Т-клеток сигнал Fas может способствовать иммуносупрессивному действию Fas-экспрессирующих tolDC, открывая новый путь для регуляции адаптивного иммунитета с помощью tolDC. Клеточные и молекулярные механизмы Fas-независимого апоптоза Т-клеток, индуцированного ДК, также были исследованы in vitro и анализы in vivo на мышах MRL/ lpr (95). Это показало, что FAS-независимый апоптоз Т-клеток может быть индуцирован прямым взаимодействием между рецептором TRAIL 2 на Т-клетках и TRAIL на Fas-дефицитных DC у мышей MRL/ lpr .
Кроме того, лигирование Fas предпочтительно индуцировало tolDCs для продукции IL-10. Кроме того, активированные Т-клетки стимулировали секрецию большего количества IL-10 tlDC через FasL. Это показывает, что, по крайней мере, от активированных Т-клеток сигнал Fas может способствовать иммуносупрессивному действию Fas-экспрессирующих tolDC, открывая новый путь для регуляции адаптивного иммунитета с помощью tolDC. Клеточные и молекулярные механизмы Fas-независимого апоптоза Т-клеток, индуцированного ДК, также были исследованы in vitro и анализы in vivo на мышах MRL/ lpr (95). Это показало, что FAS-независимый апоптоз Т-клеток может быть индуцирован прямым взаимодействием между рецептором TRAIL 2 на Т-клетках и TRAIL на Fas-дефицитных DC у мышей MRL/ lpr .Индоламин 2,3-диоксигеназа представляет собой фермент, ограничивающий скорость, который катализирует расщепление триптофана до различных метаболитов, которые впоследствии ингибируют пролиферацию Т-клеток, нарушая механизм клеточного цикла и стимулируя апоптоз (48, 9).
 2, 93, 96, 97). IDO не экспрессируется конститутивно в DC и требует индукции различными медиаторами, включая IFN-γ, TGF-β и эндотоксин (97). Известно, что у грызунов CD103 + DC в брыжеечных лимфатических узлах (MLN) и слизистой оболочке кишечника экспрессируют IDO. Когда активность IDO ингибируется, клетки Th2 и Th27 индуцируются in vivo , предотвращая развитие Treg, специфичных к пероральным антигенам (98). Напротив, триптофановое голодание увеличивает экспрессию ингибирующих рецепторов, иммуноглобулиноподобных транскриптов 3 (ILT3) и ILT4, на DC, что приводит к усилению функции Treg. Это явление связано с опосредованным киназой GCN2 путем ответа на стресс (9).9).
2, 93, 96, 97). IDO не экспрессируется конститутивно в DC и требует индукции различными медиаторами, включая IFN-γ, TGF-β и эндотоксин (97). Известно, что у грызунов CD103 + DC в брыжеечных лимфатических узлах (MLN) и слизистой оболочке кишечника экспрессируют IDO. Когда активность IDO ингибируется, клетки Th2 и Th27 индуцируются in vivo , предотвращая развитие Treg, специфичных к пероральным антигенам (98). Напротив, триптофановое голодание увеличивает экспрессию ингибирующих рецепторов, иммуноглобулиноподобных транскриптов 3 (ILT3) и ILT4, на DC, что приводит к усилению функции Treg. Это явление связано с опосредованным киназой GCN2 путем ответа на стресс (9).9).Галектины, семейство белков, связывающих β-галактозид, экспрессируются на ДК и также индуцируют апоптоз Т-клеток (100–103). В частности, галектин 9 преимущественно индуцирует апоптоз активированных CD4 + Т-клеток посредством пути кальций-кальпаин-каспаза 1 (101). Галектин 9 является лигандом молекулы 3 (Tim-3), содержащей Т-клеточный иммуноглобулин и домен муцина, экспрессируемой в клетках Th2, и вызываемая галектином 9 гибель клеток в клетках Th2 зависит от Tim-3 (104).

Внутренний путь апоптоза может запускаться различными стимулами, такими как гамма-облучение, патогены, стероидные гормоны и активные радикалы кислорода, а также костимулирующей блокадой с помощью CTLA-4 (88, 89)., 105, 106). Этот путь индуцируется изменением потенциала митохондриальной мембраны, вызванным семейством белков Bcl-2 (89). Затем цитохром c высвобождается митохондриями, связывается с фактором 1, активирующим апоптозную протеазу, и образует апоптосому, которая запускает активацию каспазы 9, что приводит к гибели клеток. Bcl-x L и Bcl-2 нарушают внутренний апоптоз, поддерживая целостность митохондрий (88). Сообщалось, что трансгенные мыши Bcl-x L были устойчивы к индукции толерантности к трансплантации посредством костимуляторной блокады, тогда как Bcl-2/Bcl-x 9Ингибитор 1467 L (АВТ-737) в сочетании с костимулирующей блокадой и донорскими клетками костного мозга вызывал полную периферическую делецию аллореактивных Т-клеток (105, 107, 108).
 С другой стороны, белок семейства Bcl-2 Bim, присутствующий на митохондриальных мембранах, участвует в TCR-индуцированном апоптозе, поскольку дефицит Bim нарушает апоптоз аутореактивных тимоцитов и зрелых Т-клеток (109, 110). В совокупности эти данные указывают на то, что внутренний путь апоптоза играет критическую роль не только в гомеостазе периферических Т-клеток, но и в центральной толерантности.
С другой стороны, белок семейства Bcl-2 Bim, присутствующий на митохондриальных мембранах, участвует в TCR-индуцированном апоптозе, поскольку дефицит Bim нарушает апоптоз аутореактивных тимоцитов и зрелых Т-клеток (109, 110). В совокупности эти данные указывают на то, что внутренний путь апоптоза играет критическую роль не только в гомеостазе периферических Т-клеток, но и в центральной толерантности.Индукция Tregs
Толерогенные ДК могут индуцировать несколько подтипов Treg, таких как CD4 + CD25 + Foxp3 + Т-клетки и Tr1-клетки. Это может быть достигнуто с помощью ряда механизмов, включая прямую передачу сигналов, зависящую от межклеточного контакта , через поверхностные молекулы , а также путем изменения судьбы Treg посредством секреторных белков (3). Известно, что DC опосредуют генерацию Treg через несколько поверхностных молекул, включая CD80/CD86 (111, 112), ICOS-L (113), ILT3 и ILT4 (114) и PD-L1 или PD-L2 (115–117).
 ). Толерантность может быть вызвана презентацией антигена MHC класса II DC без какого-либо дополнительного костимулирующего сигнала, такого как CD80/CD86 и ICOS-L, или в сочетании с коингибирующим сигналом, таким как PD-L1/2 и ILT3/4. Кроме того, лигирование CD80/CD86 с помощью CTLA-4 стимулирует дифференцировку Treg, тогда как недостаточное лигирование CD80/CD86 с помощью CD28 приводит к индукции толерантности. ICOS-L, экспрессируемый DCs, связывается со своим рецептором на Т-клетках и поддерживает гомеостаз Treg.
). Толерантность может быть вызвана презентацией антигена MHC класса II DC без какого-либо дополнительного костимулирующего сигнала, такого как CD80/CD86 и ICOS-L, или в сочетании с коингибирующим сигналом, таким как PD-L1/2 и ILT3/4. Кроме того, лигирование CD80/CD86 с помощью CTLA-4 стимулирует дифференцировку Treg, тогда как недостаточное лигирование CD80/CD86 с помощью CD28 приводит к индукции толерантности. ICOS-L, экспрессируемый DCs, связывается со своим рецептором на Т-клетках и поддерживает гомеостаз Treg.Недавно было продемонстрировано, что ДК требуется аттенюатор В- и Т-лимфоцитов (BTLA), белок суперсемейства доменов иммуноглобулина, для индукции Treg (64). BTLA специфически экспрессируется в DC DEC205 + CD8α + . Антитело против BTLA, которое предотвращает связывание BTLA со своим лигандом, медиатором проникновения вируса герпеса (HVEM), экспрессируемым на Т-клетках, резко снижает конверсию Treg. Кроме того, у мышей с дефицитом BTLA индукция Treg также снижена.
 BTLA опосредует активацию экспрессии CD5 в Т-клетках за счет увеличения фосфорилирования митоген-активируемой протеинкиназы (MEK) с участием HVEM. МЕК увеличивает экспрессию Cd5-положительного регулятора ETS1 и ингибирует экспрессию Cd5-негативного регулятора TCF-3. CD5 экспрессируется на всех Т-клетках и является общепризнанным негативным регулятором передачи сигналов TCR. CD5 способствует превращению Treg в ответ на собственные и толерантные периферические антигены путем блокирования активации механистической мишени рапамицина (118).
BTLA опосредует активацию экспрессии CD5 в Т-клетках за счет увеличения фосфорилирования митоген-активируемой протеинкиназы (MEK) с участием HVEM. МЕК увеличивает экспрессию Cd5-положительного регулятора ETS1 и ингибирует экспрессию Cd5-негативного регулятора TCF-3. CD5 экспрессируется на всех Т-клетках и является общепризнанным негативным регулятором передачи сигналов TCR. CD5 способствует превращению Treg в ответ на собственные и толерантные периферические антигены путем блокирования активации механистической мишени рапамицина (118).Дендритные клетки секретируют множество факторов, которые, как известно, вызывают толерантность и образование Treg. IL-10, продуцируемый в окружающей среде в толерогенных условиях, может запускать развитие iDCs в полузрелые tolDCs в периферических тканях. В свою очередь, эти tolDCs приобретают способность генерировать IL-10 и мигрировать в соседние лимфоидные органы, где продуцируемый DCs IL-10 регулирует развитие и пролиферацию CD4 + CD25 + Foxp3 + Т-клеток и Tr1-клеток.
 (48, 117). IL-10 также играет ключевую роль в регуляции экспрессии иммуноингибирующих молекул. IL-10 повышает экспрессию ILT3 и ILT4 на поверхности (114), PD-L1 (119) и CD95L (120) на ДК, что приводит к регуляторной функции и апоптозу.
(48, 117). IL-10 также играет ключевую роль в регуляции экспрессии иммуноингибирующих молекул. IL-10 повышает экспрессию ILT3 и ILT4 на поверхности (114), PD-L1 (119) и CD95L (120) на ДК, что приводит к регуляторной функции и апоптозу.TGF-β способствует превращению периферических наивных Т-клеток в Treg посредством индукции экспрессии Foxp3 (121). Сходным образом, несколько исследований продемонстрировали, что DCs способствуют экстратимической дифференцировке Treg TGF-β-зависимым образом (72, 122). Ингибирование специфичной для Т-клеток передачи сигналов TGF-β посредством экспрессии доминантно-негативного TGFβRII блокирует дифференцировку Treg (62). Совместное культивирование Treg с DCs приводит к секреции IL-10, IL-27 и TGF-β DCs, что приводит к дифференцировке клеток Tr1 (123). IL-27, полученный из DC, подавляет секрецию IL-1β и IL-23, индуцирует продукцию IL-10 и блокирует дифференцировку Th27 (124). Через активацию STAT1 и STAT3 IL-27, полученный из DC, управляет транскрипцией IL-10 и активирует промотор IL-10, тем самым индуцируя дифференцировку Tr1 (125).
 Более того, IL-27 индуцирует экспрессию иммунорегуляторной молекулы CD39., что приводит к подавлению ответов Т-клеток и аутоиммунитету (126). Расположенные в кишечнике DC являются основным источником RA, который способствует образованию Treg, одновременно ингибируя клетки Th27 (127, 128).
Более того, IL-27 индуцирует экспрессию иммунорегуляторной молекулы CD39., что приводит к подавлению ответов Т-клеток и аутоиммунитету (126). Расположенные в кишечнике DC являются основным источником RA, который способствует образованию Treg, одновременно ингибируя клетки Th27 (127, 128).Толерогенные ДК секретировали противовоспалительный цитокин, IL-35, и его продукция усиливалась при стимуляции IFN-γ, LPS или лигандом CD40 (129). Наоборот, IL-35 индуцировал превращение кДК в толДК (130). Помимо tolDCs, IL-35 также секретируется Treg и регуляторными В-клетками (131–134). IL-35 является членом семейства IL-12, состоящего из субъединицы IL-12α p35 и субъединицы IL-27β, индуцированного вирусом Эпштейна-Барр, гена 3, и способствует контролю гомеостатической пролиферации путем подавления пролиферации и функции Т-клеток (131, 132, 135). IL-35 может индуцировать дифференцировку наивных Т-клеток в IL-35-продуцирующие Foxp3-индуцированные Tregs, которые поддерживают самотолерантность и способствуют инфекционной толерантности (131).
 IL-35 также играет важную роль в балансе между клетками Th27 и Treg посредством подавления дифференцировки Th27 (132, 136). Более того, недавнее исследование показало, что у мышей, вакцинированных ДК, продуцирующими IL-35, наблюдалось усиление роста опухоли и улучшение течения аутоиммунного энцефалита (130). В совокупности эти данные свидетельствуют о том, что IL-35 играет важную роль в регуляции иммунной толерантности.
IL-35 также играет важную роль в балансе между клетками Th27 и Treg посредством подавления дифференцировки Th27 (132, 136). Более того, недавнее исследование показало, что у мышей, вакцинированных ДК, продуцирующими IL-35, наблюдалось усиление роста опухоли и улучшение течения аутоиммунного энцефалита (130). В совокупности эти данные свидетельствуют о том, что IL-35 играет важную роль в регуляции иммунной толерантности.Плазмацитоидные ДК индуцируют дифференцировку Treg в периферических лимфатических узлах (137). Хотя в стационарном состоянии pDC экспрессируют очень низкие уровни MHC класса II и костимулирующих молекул, активированные pDC активируют MHC класса II и мигрируют в область Т-клеток, вызывая образование Treg. IFN типа I и IL-10, продуцируемые pDC, способствуют образованию Treg. pDC также могут продуцировать IDO и экспрессировать PD-L1, и это коррелирует с увеличением количества Treg (115, 138).
Регуляторные Т-клетки также могут влиять на функцию ДК. Взаимное взаимодействие между DC и Treg необходимо для поддержания иммунной толерантности: tolDC индуцируют Treg, и, наоборот, Treg подготавливают DC к иммуносупрессивной роли, тем самым расширяя иммуносупрессивную функцию Treg.
 Например, IL-10 и TGF-β, локально секретируемые Treg, способны подавлять созревание DCs и придавать им толерогенность (139).). Другая ключевая роль Tregs заключается в их иммуносупрессивном эффекте при контакте с DC. Недавно отдельные события взаимодействия Treg-DC в лимфатических узлах были исследованы in vivo с использованием методов визуализации (140). Эндогенные Treg демонстрировали повышенную адгезию к антигенпрезентирующим DC, опосредуя, таким образом, активацию обычных CD4 + T-клеток (T conv-клеток) в дренирующих лимфатических узлах. Последующие эксперименты с использованием адоптивного переноса Treg и ДК с дефицитом MHC класса II продемонстрировали, что эта повышенная адгезия Treg-DC может быть повышена только за счет воздействия IL-2 без необходимости распознавания MHC. Важно отметить, что физический контакт с поликлональными Treg значительно снижает способность DCs образовывать стабильные конъюгаты с родственными T conv-клетками in vivo , что приводит к нарушению праймирования Т-клеток.
Например, IL-10 и TGF-β, локально секретируемые Treg, способны подавлять созревание DCs и придавать им толерогенность (139).). Другая ключевая роль Tregs заключается в их иммуносупрессивном эффекте при контакте с DC. Недавно отдельные события взаимодействия Treg-DC в лимфатических узлах были исследованы in vivo с использованием методов визуализации (140). Эндогенные Treg демонстрировали повышенную адгезию к антигенпрезентирующим DC, опосредуя, таким образом, активацию обычных CD4 + T-клеток (T conv-клеток) в дренирующих лимфатических узлах. Последующие эксперименты с использованием адоптивного переноса Treg и ДК с дефицитом MHC класса II продемонстрировали, что эта повышенная адгезия Treg-DC может быть повышена только за счет воздействия IL-2 без необходимости распознавания MHC. Важно отметить, что физический контакт с поликлональными Treg значительно снижает способность DCs образовывать стабильные конъюгаты с родственными T conv-клетками in vivo , что приводит к нарушению праймирования Т-клеток. Эти результаты предполагают, что Tregs любой специфичности TCR могут подавлять DC контактно-зависимым и независимым от MHC класса II образом. Более того, динамические компоненты цитоскелета, лежащие в основе контактно-зависимой Treg-опосредованной супрессии DC, были проанализированы с помощью визуализации (141). Это показало, что Treg, а не T conv-клетки, проявляют сильную внутреннюю адгезию к DC. Эта адгезия Treg вызывает секвестрацию Fascin-1, связывающего актин белка, необходимого для образования иммунологических синапсов, и смещает Fascin-1-зависимую поляризацию актина в DCs в сторону зоны адгезии Treg. Эта секвестрация привела к тому, что DC стали вялыми, что привело к снижению праймирования Т-клеток. Механизмы иммунной толерантности tolDC представлены в таблице 2.
Эти результаты предполагают, что Tregs любой специфичности TCR могут подавлять DC контактно-зависимым и независимым от MHC класса II образом. Более того, динамические компоненты цитоскелета, лежащие в основе контактно-зависимой Treg-опосредованной супрессии DC, были проанализированы с помощью визуализации (141). Это показало, что Treg, а не T conv-клетки, проявляют сильную внутреннюю адгезию к DC. Эта адгезия Treg вызывает секвестрацию Fascin-1, связывающего актин белка, необходимого для образования иммунологических синапсов, и смещает Fascin-1-зависимую поляризацию актина в DCs в сторону зоны адгезии Treg. Эта секвестрация привела к тому, что DC стали вялыми, что привело к снижению праймирования Т-клеток. Механизмы иммунной толерантности tolDC представлены в таблице 2.Таблица 2 . Механизмы ДК-индуцированной иммунной толерантности.
Индукция иммунной толерантности ДК в коже и кишечнике
Кожа
Кожа является крупнейшим барьерным органом, отделяющим внутреннюю среду от внешней среды.
 Он подвергается не только физическому стрессу, но и огромному количеству антигенов окружающей среды, включая химические вещества, комменсальные бактерии и патогены. Следовательно, иммунная система кожи должна обнаруживать и различать эти разнообразные антигены и индуцировать соответствующие толерогенные или защитные реакции (142). Кожа состоит из двух анатомически различных слоев, эпидермиса и дермы, которые разделены базальной мембраной. Клетки Лангерганса (LC), экспрессирующие лектин лангерин С-типа (CD207), представляют собой единственную тканерезидентную популяцию ДК в эпидермисе, в то время как несколько субпопуляций ДК находятся в дерме, включая CD103 + кДК, CD11b + кДК и CD103 — CD11b — кДК. Кроме того, во время воспаления в дерму рекрутируются moDCs (8). LC очень подвижны, хотя их больше всего в шиповатом слое эпидермиса. LC постоянно мигрируют из кожи в дренирующие лимфатические узлы даже в стационарных условиях. В целом, LC индуцируют иммунитет эффекторного типа к патогенам и чужеродным белкам (143, 144).
Он подвергается не только физическому стрессу, но и огромному количеству антигенов окружающей среды, включая химические вещества, комменсальные бактерии и патогены. Следовательно, иммунная система кожи должна обнаруживать и различать эти разнообразные антигены и индуцировать соответствующие толерогенные или защитные реакции (142). Кожа состоит из двух анатомически различных слоев, эпидермиса и дермы, которые разделены базальной мембраной. Клетки Лангерганса (LC), экспрессирующие лектин лангерин С-типа (CD207), представляют собой единственную тканерезидентную популяцию ДК в эпидермисе, в то время как несколько субпопуляций ДК находятся в дерме, включая CD103 + кДК, CD11b + кДК и CD103 — CD11b — кДК. Кроме того, во время воспаления в дерму рекрутируются moDCs (8). LC очень подвижны, хотя их больше всего в шиповатом слое эпидермиса. LC постоянно мигрируют из кожи в дренирующие лимфатические узлы даже в стационарных условиях. В целом, LC индуцируют иммунитет эффекторного типа к патогенам и чужеродным белкам (143, 144). С другой стороны, недавние данные свидетельствуют о том, что LC могут участвовать в индукции периферической толерантности. В мышиной модели контактной гиперчувствительности (КГС) было продемонстрировано, что отсутствие LC приводит к увеличению количества гаптен-специфических CD4 + и CD8 + Т-клетки. Это выявило механизм иммунной регуляции в коже, благодаря которому взаимодействие с CD4 + Т-клетками позволяет LC подавлять антиген-специфические ответы посредством продукции IL-10 (145). Другое исследование CHS, включающее экспериментальное истощение и адоптивный перенос, продемонстрировало, что LC обеспечивают защиту от развития CHS посредством механизма, включающего как анергию, так и делецию аллерген-специфических CD8 + T-клеток и активацию популяции T-клеток, идентифицированной как ICOS 9.0878 + CD4 + Foxp3 + Tregs (146). На модели инфекции Leishmania у мышей было продемонстрировано, что отсутствие LC приводит к уменьшению иммиграции Treg, что указывает на супрессивную роль эпидермальных LC посредством стимулирования Treg (147).
С другой стороны, недавние данные свидетельствуют о том, что LC могут участвовать в индукции периферической толерантности. В мышиной модели контактной гиперчувствительности (КГС) было продемонстрировано, что отсутствие LC приводит к увеличению количества гаптен-специфических CD4 + и CD8 + Т-клетки. Это выявило механизм иммунной регуляции в коже, благодаря которому взаимодействие с CD4 + Т-клетками позволяет LC подавлять антиген-специфические ответы посредством продукции IL-10 (145). Другое исследование CHS, включающее экспериментальное истощение и адоптивный перенос, продемонстрировало, что LC обеспечивают защиту от развития CHS посредством механизма, включающего как анергию, так и делецию аллерген-специфических CD8 + T-клеток и активацию популяции T-клеток, идентифицированной как ICOS 9.0878 + CD4 + Foxp3 + Tregs (146). На модели инфекции Leishmania у мышей было продемонстрировано, что отсутствие LC приводит к уменьшению иммиграции Treg, что указывает на супрессивную роль эпидермальных LC посредством стимулирования Treg (147). Недавно использование модели трансгенных мышей облегчило анализ иммунных функций LC in vivo без каких-либо изменений в сложном составе подмножеств кожных DC (148). Когда овальбумин был представлен стационарными LC или активированными LC, у них развивалась антиген-специфическая толерантность CTL из-за увеличения Treg или реакции памяти CTL соответственно. Принятие этого решения зависит от состояния представленных LC.
Недавно использование модели трансгенных мышей облегчило анализ иммунных функций LC in vivo без каких-либо изменений в сложном составе подмножеств кожных DC (148). Когда овальбумин был представлен стационарными LC или активированными LC, у них развивалась антиген-специфическая толерантность CTL из-за увеличения Treg или реакции памяти CTL соответственно. Принятие этого решения зависит от состояния представленных LC.Все дермальные кДК происходят из кДК-предшественников гемопоэтических стволовых клеток, пре-кДК, которые постоянно заселяют дерму. В основном, четыре подмножества CDCS проживают в Dermis: Langerin + CD103 + , Langerin — CD11B + , Langerin — CD11B – — — CD11B – — — — CD11B – — — — CD11B 7-——-110878- и
-11087 878-
CD118 и и 7878 гг. ). Langerin + CD103 + кДК включают 10–20% дермальных ДК и экспрессируют XCR1. Ланжерин + CD103 + кДК эффективно перекрестно представляют вирусные и собственные антигены, а у мышей с дефицитом лангерина + CD103 + наблюдается нарушение праймирования CD8 + Т-клеток (18, 148, 149). С другой стороны, кДК лангерина + CD103 + способны генерировать Treg (150). Когда кДК лангерина + CD103 + были истощены у мышей Lang-DTR, опосредованная анти-DE205 антиген-специфическая доставка в ДК больше не могла индуцировать антиген-специфические Treg, что приводило к потере иммунной толерантности (49)., 150). Было показано, что человеческие BDCA-3 + DC, аналог мышиного лангерина + CD103 + , продуцируют большое количество IL-10, презентируют собственные антигены и индуцируют Tregs (151). Langerin − CD11b + кДК включают 70–80% кожных ДК. Langerin — CD11b + кДК могут примировать наивные CD4 + Т-клетки к дифференцировке Th3 и играть роль в иммунном ответе посредством передачи сигналов IL-23/IL-17 (152–156).
Ланжерин + CD103 + кДК эффективно перекрестно представляют вирусные и собственные антигены, а у мышей с дефицитом лангерина + CD103 + наблюдается нарушение праймирования CD8 + Т-клеток (18, 148, 149). С другой стороны, кДК лангерина + CD103 + способны генерировать Treg (150). Когда кДК лангерина + CD103 + были истощены у мышей Lang-DTR, опосредованная анти-DE205 антиген-специфическая доставка в ДК больше не могла индуцировать антиген-специфические Treg, что приводило к потере иммунной толерантности (49)., 150). Было показано, что человеческие BDCA-3 + DC, аналог мышиного лангерина + CD103 + , продуцируют большое количество IL-10, презентируют собственные антигены и индуцируют Tregs (151). Langerin − CD11b + кДК включают 70–80% кожных ДК. Langerin — CD11b + кДК могут примировать наивные CD4 + Т-клетки к дифференцировке Th3 и играть роль в иммунном ответе посредством передачи сигналов IL-23/IL-17 (152–156). RA-продуцирующий CD11b + кДК могут индуцировать Treg при миграции в дренирующие лимфатические узлы (157). Интересно, что недавно было продемонстрировано, что направленная делеция IKKβ, главного активатора NF-kB, в ДК предотвращает накопление кожных мигрирующих ДК в дренирующих лимфатических узлах в стационарных условиях, тем самым нарушая конверсию Treg (158). Таким образом, передача сигналов NF-κB, по-видимому, играет критическую роль в иммунитете и толерантности, поскольку NF-κB является ключевым регулятором индуцированного TLR созревания DC и продукции провоспалительных цитокинов. В совокупности данные свидетельствуют о том, что LC и дермальные DCs играют ключевую роль не только в иммунном ответе, но и в иммунной толерантности кожи.
RA-продуцирующий CD11b + кДК могут индуцировать Treg при миграции в дренирующие лимфатические узлы (157). Интересно, что недавно было продемонстрировано, что направленная делеция IKKβ, главного активатора NF-kB, в ДК предотвращает накопление кожных мигрирующих ДК в дренирующих лимфатических узлах в стационарных условиях, тем самым нарушая конверсию Treg (158). Таким образом, передача сигналов NF-κB, по-видимому, играет критическую роль в иммунитете и толерантности, поскольку NF-κB является ключевым регулятором индуцированного TLR созревания DC и продукции провоспалительных цитокинов. В совокупности данные свидетельствуют о том, что LC и дермальные DCs играют ключевую роль не только в иммунном ответе, но и в иммунной толерантности кожи.Кишечник
В кишечном тракте индуцируется продукция антител IgA и иммунный ответ эффекторными Т-клетками против патогенных микроорганизмов. С другой стороны, иммунная толерантность также индуцируется, чтобы избежать ненужных воспалительных реакций на пищевые антигены и комменсальные бактерии.
 DCs играют критическую роль в кишечном иммунном ответе и иммунной толерантности. В слизистой оболочке кишечника ДК рассеяны диффузно по всей собственной пластинке кишечника, в ассоциированных с кишечником лимфоидных тканях, включая пейеровы бляшки и солитарные лимфоидные ткани кишечника (ИЛТ), а также в дренирующих лимфатических узлах кишечника, таких как MLN (159)., 160). Миграция кишечных ДК играет важную роль в иммунном надзоре и гомеостазе кишечника. Мигрирующие кишечные ДК могут происходить из трех разных мест: собственной пластинки, пейеровых бляшек и ИЛ, представленных в слизистой оболочке тонкой кишки.
DCs играют критическую роль в кишечном иммунном ответе и иммунной толерантности. В слизистой оболочке кишечника ДК рассеяны диффузно по всей собственной пластинке кишечника, в ассоциированных с кишечником лимфоидных тканях, включая пейеровы бляшки и солитарные лимфоидные ткани кишечника (ИЛТ), а также в дренирующих лимфатических узлах кишечника, таких как MLN (159)., 160). Миграция кишечных ДК играет важную роль в иммунном надзоре и гомеостазе кишечника. Мигрирующие кишечные ДК могут происходить из трех разных мест: собственной пластинки, пейеровых бляшек и ИЛ, представленных в слизистой оболочке тонкой кишки.Собственная пластинка тонкой кишки мышей содержит по крайней мере три различные популяции кДК: CD103 + CD11b — , CD103 + CD11b + и CD103 — + 7890 CD11110879 ДК. Эти три подтипа cDC способны мигрировать через афферентные лимфатические пути в дренирующие MLN, процесс, который требует передачи сигналов CCR7 (161).
 cDCs в lamina propria приобретают антигены путем передачи, либо от эпителиальных бокаловидных клеток, либо от макрофагов CX3CR1 high (162, 163). CD103 + CD11b + кДК в собственной пластинке мигрируют в эпителий и захватывают патогенные бактерии, присутствующие в просвете кишечника, путем удлинения их дендритов (164). После поглощения антигена кДК собственной пластинки входят в зону Т-клеток дренирующих кишечник MLN для взаимодействия ДК-Т-клеток. Двойной отрицательный CD103 — CD11b — кДК, которые могут происходить исключительно из пейеровых бляшек и ИЛ, также, как сообщалось, переносят антигены через афферентные лимфатические сосуды в MLN (165).
cDCs в lamina propria приобретают антигены путем передачи, либо от эпителиальных бокаловидных клеток, либо от макрофагов CX3CR1 high (162, 163). CD103 + CD11b + кДК в собственной пластинке мигрируют в эпителий и захватывают патогенные бактерии, присутствующие в просвете кишечника, путем удлинения их дендритов (164). После поглощения антигена кДК собственной пластинки входят в зону Т-клеток дренирующих кишечник MLN для взаимодействия ДК-Т-клеток. Двойной отрицательный CD103 — CD11b — кДК, которые могут происходить исключительно из пейеровых бляшек и ИЛ, также, как сообщалось, переносят антигены через афферентные лимфатические сосуды в MLN (165).Что касается адаптивного иммунитета, мигрирующие субпопуляции DC, происходящие из lamina propria, проявляют некоторую специализацию в образовании отдельных субпопуляций Th-клеток. CD103 + CD11b + кДК, активированные TLR, продуцируют высокие уровни IL-6 и индуцируют IL-6-зависимую дифференцировку Th27, в то время как CD103 + CD11b — и CD103 — CD11b + кДК могут управлять дифференцировкой Th2, а не CD103 + CD11b + кДК (165–168).
CD11b — и CD103 + CD11b + кДК (170). В целом данные свидетельствуют о том, что за счет продукции RA и TGF-β кишечные кДК CD103 + индуцируют дифференцировку Treg и помещают их в слизистую оболочку кишечника для контроля толерантности. С другой стороны, кДК в собственной пластинке и MLN, особенно популяция кДК CD103 + , играют центральную роль в усилении толерантности к пищевым антигенам и комменсальным бактериям в стационарных условиях. Многие исследования показали, что кишечные кДК CD103 + сильно индуцируют Treg посредством механизма, опосредованного TGF-β и RA (20, 159)., 169). Treg индуцируются TGF-β, а RA усиливает индукцию Treg только в присутствии TGF-β. TGF-β секретируется кишечными CD103 + кДК, Treg и стромальными клетками кишечника. Кишечные CD103 + кДК в высокой степени экспрессируют RALDh3, которые превращают витамин А в RA, что приводит к продукции RA из CD103 + кДК. Помимо индукции Treg, RA также индуцирует рецепторы, направляющие кишечник, CCR9 для хемокина тонкого кишечника CCL25 и интегрин α4β7 для адрессина сосудов слизистой оболочки, MAdCAM1. Кроме того, недавно было продемонстрировано, что RA оказывает внутренне клеточное действие на развитие кишечно-тропных предслизистых DC, запуская дифференцировку и управляя специализированной ролью кишечного CD103 9 .
С другой стороны, кДК в собственной пластинке и MLN, особенно популяция кДК CD103 + , играют центральную роль в усилении толерантности к пищевым антигенам и комменсальным бактериям в стационарных условиях. Многие исследования показали, что кишечные кДК CD103 + сильно индуцируют Treg посредством механизма, опосредованного TGF-β и RA (20, 159)., 169). Treg индуцируются TGF-β, а RA усиливает индукцию Treg только в присутствии TGF-β. TGF-β секретируется кишечными CD103 + кДК, Treg и стромальными клетками кишечника. Кишечные CD103 + кДК в высокой степени экспрессируют RALDh3, которые превращают витамин А в RA, что приводит к продукции RA из CD103 + кДК. Помимо индукции Treg, RA также индуцирует рецепторы, направляющие кишечник, CCR9 для хемокина тонкого кишечника CCL25 и интегрин α4β7 для адрессина сосудов слизистой оболочки, MAdCAM1. Кроме того, недавно было продемонстрировано, что RA оказывает внутренне клеточное действие на развитие кишечно-тропных предслизистых DC, запуская дифференцировку и управляя специализированной ролью кишечного CD103 9 . 0878 +
0878 + Подход с условным нокаутом, позволяющий удалять определенные подмножества CD103 + кДК, продемонстрировал, что кишечные CD103 + CD11b − кДК обладают наибольшей способностью индуцировать дифференцировку Treg, в то время как CD11b + подмножеств DC довольно неэффективны (65). Более того, экспрессия PD-L1 и PD-L2 с помощью MNL DC участвует в индукции оральной толерантности посредством регуляции Treg-компартмента (171). Сравнение между четырьмя отдельными подмножествами DC в MLNS-CD103 + CD11B + PD-L1 HIGH , CD103 + CD11B — PD-L1 HILY , CD103 903 903
.
 , — PD-L1 , — PD-L1 , — PD-L1 , — PD-L1 , —. низкий и CD103 — CD11b + PD-L1 int — показало, что CD103 + CD11b — PD-L1 high DC обладают высокой способностью индуцировать дифференцировку Treg посредством передачи сигналов TGF-β (172). Сообщалось, что интегрин αvβ8, активатор латентного TGF-β, преимущественно экспрессируется на CD103 + CD11b − кДК в собственной пластинке и MLN, и что экспрессирующие интегрин αvβ8 DC индуцируют Treg посредством TGF-β. активация (173). Однако остается неясным, является ли CD103 + CD11b + PD-L1 высокий ДК и ДК, экспрессирующие интегрин αvβ8, представляют одну и ту же популяцию. В стационарных условиях CD103 + кДК в собственной пластинке являются толерогенными. Напротив, при воспалительных состояниях CD103 + кДК в MLN являются иммуногенными.
, — PD-L1 , — PD-L1 , — PD-L1 , — PD-L1 , —. низкий и CD103 — CD11b + PD-L1 int — показало, что CD103 + CD11b — PD-L1 high DC обладают высокой способностью индуцировать дифференцировку Treg посредством передачи сигналов TGF-β (172). Сообщалось, что интегрин αvβ8, активатор латентного TGF-β, преимущественно экспрессируется на CD103 + CD11b − кДК в собственной пластинке и MLN, и что экспрессирующие интегрин αvβ8 DC индуцируют Treg посредством TGF-β. активация (173). Однако остается неясным, является ли CD103 + CD11b + PD-L1 высокий ДК и ДК, экспрессирующие интегрин αvβ8, представляют одну и ту же популяцию. В стационарных условиях CD103 + кДК в собственной пластинке являются толерогенными. Напротив, при воспалительных состояниях CD103 + кДК в MLN являются иммуногенными. Было показано, что MLN CD103 + кДК мышей с колитом вызывают Th2-ответы с высоким уровнем продукции IL-6 (174). При воспалении кишечника MLN CD103 + кДК приобретают эти провоспалительные свойства без каких-либо онтогенетических изменений. Следовательно, как и ДК в коже, кДК CD103 + в кишечнике также могут быть иммуногенными или толерогенными из-за микроокружения.
Было показано, что MLN CD103 + кДК мышей с колитом вызывают Th2-ответы с высоким уровнем продукции IL-6 (174). При воспалении кишечника MLN CD103 + кДК приобретают эти провоспалительные свойства без каких-либо онтогенетических изменений. Следовательно, как и ДК в коже, кДК CD103 + в кишечнике также могут быть иммуногенными или толерогенными из-за микроокружения.Известно, что некоторые питательные вещества, помимо витамина А, оказывают заметное влияние на толерантность кишечника. Триптофан является диетическим элементом, необходимым для IDO-зависимых толерогенных эффектов кишечных ДК (175). Пищевой триптофан метаболизируется в агонисты арилуглеводородного рецептора (AhR) посредством серии совместных биохимических реакций, катализируемых ферментами, продуцируемыми кишечными комменсальными бактериями и хозяином (176). Лиганды AhR, полученные из триптофана, индуцируют продукцию IL-10 и IL-27 DCs, способствуя образованию клеток Treg и Tr1. Липидные медиаторы диетического происхождения могут активировать γ-рецептор, активируемый пролифератором пероксисом (PPARγ), а ДК, подвергшиеся воздействию PPARγ, могут быть толерогенными (7, 177).
 Слизистая оболочка кишечника пронизана сложной нервной системой и поэтому подвергается локальному высвобождению нейротрансмиттеров. Вазоактивный интестинальный пептид (ВИП) вырабатывается энтероэндокринными и иммунными клетками кишечника и действует как вазодилататор и регулятор проницаемости эпителия. VIP подавляет индуцированное ЛПС созревание ДК и способствует дифференцировке клеток Treg и Tr1 (178, 179).). Взятые вместе, эти данные свидетельствуют о том, что метаболиты, поступающие с пищей и кишечной флорой, действуют совместно с эндогенными сигналами, регулирующими способность ДК контролировать ответы Т-клеток и тканевый гомеостаз. Механизмы индукции tolDC в кишечнике представлены на рисунке 3.
Слизистая оболочка кишечника пронизана сложной нервной системой и поэтому подвергается локальному высвобождению нейротрансмиттеров. Вазоактивный интестинальный пептид (ВИП) вырабатывается энтероэндокринными и иммунными клетками кишечника и действует как вазодилататор и регулятор проницаемости эпителия. VIP подавляет индуцированное ЛПС созревание ДК и способствует дифференцировке клеток Treg и Tr1 (178, 179).). Взятые вместе, эти данные свидетельствуют о том, что метаболиты, поступающие с пищей и кишечной флорой, действуют совместно с эндогенными сигналами, регулирующими способность ДК контролировать ответы Т-клеток и тканевый гомеостаз. Механизмы индукции tolDC в кишечнике представлены на рисунке 3.Рисунок 3 . Механизмы индукции толерогенных ДК в кишечнике. MLN, брыжеечный лимфатический узел; AhR, арильный углеводородный рецептор; PPARγ, рецептор γ, активируемый пролифератором пероксисом; VIP, вазоактивный интестинальный пептид; IDO, индоламин-2,3-диоксигеназа; РА, ретиноевая кислота.

Заключение
Дендритные клетки играют ключевую роль в иммунной толерантности и гомеостазе организма. В этом обзоре мы представляем обзор нашего текущего понимания механизмов индукции толерантности ДК в организме: происхождение, дифференцировка и подмножества ДК; индукция толерантности в тимусе и на периферии; механизмы иммунной толерантности ДК; и индукция иммунной толерантности DCs в коже и кишечнике. Однако, поскольку анализ вышеуказанных механизмов в норме и болезни еще недостаточен, необходимы дальнейшие исследования. Глубокое понимание механизмов, контролирующих иммунную толерантность, поможет в разработке новых стратегий лечения аутоиммунитета.
Вклад автора
HH разработал исследование и подготовил рукопись. ТМ отредактировал рукопись.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.

Финансирование
Эта работа была поддержана грантом (15K09551) для научных исследований от Министерства образования, культуры, спорта, науки и технологий Японии.
Ссылки
1. Iberg CA, Jones A, Hawiger D. Дендритные клетки как индукторы периферической толерантности. Trends Immunol (2017) 38(11):793–804. doi:10.1016/j.it.2017.07.007
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
2. Audiger C, Rahman MJ, Yun TJ, Tarbell KV, Lesage S. Значение дендритных клеток в поддержании иммунной толерантности. J Immunol (2017) 198(6):2223–31. doi:10.4049/jimmunol.1601629
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
3. Вайсман А., Лукас Д., Клаузен Б.Е., Йогев Н. Дендритные клетки как привратники толерантности. Semin Immunopathol (2017) 39(2):153–63. doi:10.1007/s00281-016-0583-z
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
4.
 Horton C, Shanmugarajah K, Fairchild PJ. Использование свойств дендритных клеток для достижения иммунологической толерантности. Biomed J (2017) 40(2):80–93. doi:10.1016/j.bj.2017.01.002
Horton C, Shanmugarajah K, Fairchild PJ. Использование свойств дендритных клеток для достижения иммунологической толерантности. Biomed J (2017) 40(2):80–93. doi:10.1016/j.bj.2017.01.002PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
5. Гарсия-Гонсалес П., Убилла-Олгин Г., Каталан Д., Шиннерлинг К., Агильон Х.С. Толерогенные дендритные клетки для перепрограммирования ответов лимфоцитов при аутоиммунных заболеваниях. Autoimmun Rev (2016) 15(11):1071–80. doi:10.1016/j.autrev.2016.07.032
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
6. Adnan E, Matsumoto T, Ishizaki J, Onishi S, Suemori K, Yasukawa M, et al. Толерогенные дендритные клетки человека, полученные с помощью ингибитора протеинкиназы С, оптимальны для функциональной регуляторной индукции Т-клеток – сравнительное исследование. Clin Immunol (2016) 173:96–108. doi:10.1016/j.clim.2016.09.007
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
7.
 Мацумото Т., Хасэгава Х., Ониши С., Ишизаки Дж., Суэмори К., Ясукава М. Ингибитор протеинкиназы С генерирует стабильные толерогенные дендритные клетки человека. J Immunol (2013) 191(5):2247–57. doi:10.4049/jimmunol.1203053
Мацумото Т., Хасэгава Х., Ониши С., Ишизаки Дж., Суэмори К., Ясукава М. Ингибитор протеинкиназы С генерирует стабильные толерогенные дендритные клетки человека. J Immunol (2013) 191(5):2247–57. doi:10.4049/jimmunol.1203053PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
8. Ворбс Т., Хаммершмидт С.И., Фёрстер Р. Миграция дендритных клеток в норме и при патологии. Nat Rev Immunol (2017) 17(1):30–48. doi:10.1038/nri.2016.116
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
9. Haniffa M, Collin M, Ginhoux F. Онтогенез и функциональная специализация дендритных клеток у человека и мыши. Adv Immunol (2013) 120:1–49. doi:10.1016/b978-0-12-417028-5.00001-6
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
10. Brasel K, De Smedt T, Smith JL, Maliszewski CR. Получение мышиных дендритных клеток из культур костного мозга, дополненных лигандом flt3. Кровь (2000) 96(9):3029–39.

Реферат PubMed | Google Scholar
11. Карсунки Х., Мерад М., Коццио А., Вайсман И.Л., Манц М.Г. Лиганд Flt3 регулирует развитие дендритных клеток от лимфоидных и миелоидных предшественников Flt3 + до Flt3 + дендритных клеток in vivo. J Exp Med (2003) 198(2):305–13. doi:10.1084/jem.20030323
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
12. Леон Б., Лопес-Браво М., Ардавин С. Дендритные клетки моноцитного происхождения, образующиеся в месте заражения, контролируют индукцию защитных Т-хелперных ответов 1 против Лейшмания . Иммунитет (2007) 26(4):519–31. doi:10.1016/j.immuni.2007.01.017
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
13. Сербина Н.В., Салазар-Мазер Т.П., Бирон К.А., Кузиэль В.А., Памер Э.Г. Дендритные клетки, продуцирующие TNF/iNOS, опосредуют врожденную иммунную защиту от бактериальной инфекции. Иммунитет (2003) 19(1):59–70.
 doi:10.1016/S1074-7613(03)00171-7
doi:10.1016/S1074-7613(03)00171-7PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
14. Haniffa M, Shin A, Bigley V, McGovern N, Teo P, See P, et al. Ткани человека содержат CD141 hi , перекрестно представляющие дендритные клетки с функциональной гомологией мышиным CD103 + нелимфоидным дендритным клеткам. Иммунитет (2012) 37(1):60–73. doi:10.1016/j.immuni.2012.04.012
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
15. Crozat K, Guiton R, Contreras V, Feuillet V, Dutertre CA, Ventre E, et al. Хемокиновый рецептор XC 1 представляет собой консервативный селективный маркер клеток млекопитающих, гомологичных дендритным клеткам мыши CD8alpha + . J Exp Med (2010) 207(6):1283–92. doi:10.1084/jem.20100223
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
16. Caminschi I, Proietto AI, Ahmet F, Kitsoulis S, Shin Teh J, Lo JC и другие.
 Лектин C-типа Clec9A, ограниченный подтипом дендритных клеток, является мишенью для улучшения вакцины. Кровь (2008) 112(8):3264–73. doi:10.1182/blood-2008-05-155176
Лектин C-типа Clec9A, ограниченный подтипом дендритных клеток, является мишенью для улучшения вакцины. Кровь (2008) 112(8):3264–73. doi:10.1182/blood-2008-05-155176PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
17. Huysamen C, Willment JA, Dennehy KM, Brown GD. CLEC9A представляет собой новый активационный лектиноподобный рецептор C-типа, экспрессируемый на дендритных клетках BDCA3 + и подмножестве моноцитов. J Biol Chem (2008) 283(24):16693–701. doi:10.1074/jbc.M709
0
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
18. Бедуи С., Уитни П.Г., Уэйтман Дж., Эйдсмо Л., Ваким Л., Камински И. и др. Перекрестная презентация вирусных и собственных антигенов дендритными клетками CD103 + кожного происхождения. Nat Immunol (2009) 10(5):488–95. doi:10.1038/ni.1724
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
19. Машаехи М., Сандау М.
 М., Дунай И.Р., Фриккель Э.М., Хан А., Гольдшмид Р.С. и др. Дендритные клетки CD8α(+) являются критическим источником интерлейкина-12, который контролирует острую инфекцию, вызываемую тахизоитами Toxoplasma gondii . Иммунитет (2011) 35(2):249–59. doi:10.1016/j.immuni.2011.08.008
М., Дунай И.Р., Фриккель Э.М., Хан А., Гольдшмид Р.С. и др. Дендритные клетки CD8α(+) являются критическим источником интерлейкина-12, который контролирует острую инфекцию, вызываемую тахизоитами Toxoplasma gondii . Иммунитет (2011) 35(2):249–59. doi:10.1016/j.immuni.2011.08.008PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
20. Coombes JL, Siddiqui KR, Arancibia-Cárcamo CV, Hall J, Sun CM, Belkaid Y, et al. Функционально специализированная популяция слизистой CD103 + ДК индуцируют регуляторные Т-клетки Foxp3 + через механизм, зависящий от TGF-бета и ретиноевой кислоты. J Exp Med (2007) 204(8):1757–64. doi:10.1084/jem.20070590
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
21. Schlitzer A, Ginhoux F. Организация сети DC мыши и человека. Curr Opin Immunol (2014) 26:90–9. doi:10.1016/j.coi.2013.11.002
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
22.
 Льюис К.Л., Катон М.Л., Богунович М., Гретер М., Грайковска Л.Т., Нг Д. и соавт. Передача сигналов рецептора Notch3 контролирует функциональную дифференцировку дендритных клеток в селезенке и кишечнике. Иммунитет (2011) 35(5):780–91. doi:10.1016/j.immuni.2011.08.013
Льюис К.Л., Катон М.Л., Богунович М., Гретер М., Грайковска Л.Т., Нг Д. и соавт. Передача сигналов рецептора Notch3 контролирует функциональную дифференцировку дендритных клеток в селезенке и кишечнике. Иммунитет (2011) 35(5):780–91. doi:10.1016/j.immuni.2011.08.013PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
23. Dudziak D, Kamphorst AO, Heidkamp GF, Buchholz VR, Trumpfheller C, Yamazaki S, et al. Дифференциальный процессинг антигена субпопуляциями дендритных клеток in vivo. Science (2007) 315(5808):107–11. doi:10.1126/science.1136080
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
24. Sun CM, Hall JA, Blank RB, Bouladoux N, Oukka M, Mora JR, et al. Дендритные клетки lamina propria тонкой кишки способствуют образованию de novo клеток Foxp3 T reg через ретиноевую кислоту. J Exp Med (2007) 204(8):1775–85. doi:10.1084/jem.20070602
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
25.
 Guilliams M, Crozat K, Henri S, Tamoutounour S, Grenot P, Devilard E, et al. Дренирующие кожу лимфатические узлы содержат происходящие из дермы дендритные клетки CD103(-), которые конститутивно продуцируют ретиноевую кислоту и индуцируют регуляторные Т-клетки Foxp3(+). Кровь (2010) 115(10):1958–68. doi:10.1182/blood-2009-09-245274
Guilliams M, Crozat K, Henri S, Tamoutounour S, Grenot P, Devilard E, et al. Дренирующие кожу лимфатические узлы содержат происходящие из дермы дендритные клетки CD103(-), которые конститутивно продуцируют ретиноевую кислоту и индуцируют регуляторные Т-клетки Foxp3(+). Кровь (2010) 115(10):1958–68. doi:10.1182/blood-2009-09-245274PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
26. Рейзис Б., Бунин А., Гош Х.С., Льюис К.Л., Сисирак В. Плазмацитоидные дендритные клетки: последние достижения и открытые вопросы. Annu Rev Immunol (2011) 29:163–83. doi:10.1146/annurev-immunol-031210-101345
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
27. Wakkach A, Fournier N, Brun V, Breittmayer JP, Cottrez F, Groux H. Характеристика дендритных клеток, которые индуцируют толерантность и Т-регуляторную дифференцировку 1-клеток in vivo. Иммунитет (2003) 18(5):605–17. doi:10.1016/S1074-7613(03)00113-4
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
28.
 Moseman EA, Liang X, Dawson AJ, Panoskaltsis-Mortari A, Krieg AM, Liu YJ, et al. Плазмоцитоидные дендритные клетки человека, активированные олигодезоксинуклеотидами CpG, индуцируют образование регуляторных Т-клеток CD4 + CD25 + . J Immunol (2004) 173(7):4433–42. doi:10.4049/jimmunol.173.7.4433
Moseman EA, Liang X, Dawson AJ, Panoskaltsis-Mortari A, Krieg AM, Liu YJ, et al. Плазмоцитоидные дендритные клетки человека, активированные олигодезоксинуклеотидами CpG, индуцируют образование регуляторных Т-клеток CD4 + CD25 + . J Immunol (2004) 173(7):4433–42. doi:10.4049/jimmunol.173.7.4433PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
29. О Дж., Шин Дж.С. Роль дендритных клеток в центральной толерантности. Immune Netw (2015) 15(3):111–20. doi:10.4110/in.2015.15.3.111
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
30. Ohnmacht C, Pullner A, King SB, Drexler I, Meier S, Brocker T, et al. Конститутивное удаление дендритных клеток нарушает самотолерантность Т-клеток CD4 и приводит к спонтанному фатальному аутоиммунитету. J Exp Med (2009) 206(3):549–59. doi: 10.1084/jem.20082394
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
31.
 Vremec D, Pooley J, Hochrein H, Wu L, Shortman K. Экспрессия CD4 и CD8 подтипами дендритных клеток в тимусе и селезенке мышей. J Immunol (2000) 164(6):2978–86. doi:10.4049/jimmunol.164.6.2978
Vremec D, Pooley J, Hochrein H, Wu L, Shortman K. Экспрессия CD4 и CD8 подтипами дендритных клеток в тимусе и селезенке мышей. J Immunol (2000) 164(6):2978–86. doi:10.4049/jimmunol.164.6.2978PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
32. Porritt HE, Gordon K, Petrie HT. Кинетика стационарной дифференцировки и картирование внутритимусной сигнальной среды при трансплантации стволовых клеток у необлученных мышей. J Exp Med (2003) 198(6):957–62. doi:10.1084/jem.20030837
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
33. Атибалентья Д.Ф., Мерфи К.М., Унануэ Э.Р. Функциональная избыточность между обычными дендритными клетками CD8α тимуса + и Sirpα + в презентации лизоцима крови белками MHC класса II. J Immunol (2011) 186(3):1421–31. doi:10.4049/jimmunol.1002587
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
34. Ardouin L, Luche H, Chelbi R, Carpentier S, Shawket A, Montanana Sanchis F, et al.
 Широкие и в значительной степени согласованные молекулярные изменения характеризуют толерогенное и иммуногенное созревание дендритных клеток в тимусе и на периферии. Иммунитет (2016) 45(2):305–18. doi:10.1016/j.immuni.2016.07.019
Широкие и в значительной степени согласованные молекулярные изменения характеризуют толерогенное и иммуногенное созревание дендритных клеток в тимусе и на периферии. Иммунитет (2016) 45(2):305–18. doi:10.1016/j.immuni.2016.07.019PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
35. Bonasio R, Scimone ML, Schaerli P, Grabie N, Lichtman AH, von Andrian UH. Клональная делеция тимоцитов циркулирующими дендритными клетками, направляющимися в тимус. Nat Immunol (2006) 7(10):1092–100. doi:10.1038/ni1385
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
36. Baba T, Nakamoto Y, Mukaida N. Решающий вклад обычных дендритных клеток Sirp alpha + тимуса в центральную толерантность к антигенам, передающимся через кровь, в зависимости от CCR2. J Immunol (2009) 183(5):3053–63. doi:10.4049/jimmunol.0
8- Опубликовано:
- Уильям Р. Хит 1 и
- Фрэнсис Р. Карбон 2
10 тыс. обращений
326 цитирований
9 Альтметрический
Сведения о показателях
Т-лимфоциты можно разделить на две субпопуляции на основе их экспрессии CD4 и CD8.
 CD4 9Подгруппа 0878 + в первую очередь отвечает за оказание помощи другим иммунным клеткам, тогда как Т-клетки CD8 + наиболее известны своей способностью убивать инфицированные вирусом клетки.
CD4 9Подгруппа 0878 + в первую очередь отвечает за оказание помощи другим иммунным клеткам, тогда как Т-клетки CD8 + наиболее известны своей способностью убивать инфицированные вирусом клетки.Перекрестная презентация определяется как процессинг экзогенных антигенов в пути главного комплекса гистосовместимости (MHC) класса I. Кросс-примирование и перекрестная толерантность относятся к индукции иммунитета или толерантности цитотоксических Т-лимфоцитов (ЦТЛ), соответственно, которые индуцируются перекрестно представленными антигенами.
Несмотря на открытие перекрестного праймирования в середине 1970-х гг., только недавно была идентифицирована антигенпрезентирующая клетка, ответственная за этот процесс. Беван и его коллеги предоставили доказательства того, что это CD8 + дендритная клетка (DC).
Несмотря на то, что существует несколько путей перекрестной презентации, наше текущее понимание того, какие пути работают in vivo для перекрестной презентации клеточно-ассоциированных антигенов, происходящих из инфицированных вирусом клеток или собственных тканей, минимальна.

Сообщалось, что перекрестная презентация не только обеспечивает механизм выработки иммунитета к внутриклеточным инфекциям, но и участвует в индукции толерантности. Такая перекрестная толерантность, скорее всего, опосредована ДК и приводит к делеции аутореактивных ЦТЛ.
Уровни экспрессии антигена, место экспрессии, время экспрессии и доступность помощи в решающей степени определяют, вызывают ли аутоантигены перекрестную толерантность.
Существует несколько исследований, которые однозначно показывают, что перекрестное праймирование имеет решающее значение для естественного защитного иммунитета ЦТЛ. Это не означает, что перекрестное праймирование не играет роли в естественном иммунитете, только то, что по-прежнему трудно различить роль перекрестного представления и прямого представления в естественном праймировании ЦТЛ.

Было показано, что иммунитет к вирусоспецифическим ЦТЛ зависит от клеток костного мозга (предположительно ДК) в отношении нескольких инфекций, включая вирус гриппа, вирус коровьей оспы, полиовирус и вирус лимфоцитарного хориоменингита, что согласуется с ролью перекрестного праймирования в вирусном иммунитете.
Можно предположить, что кросс-примирование играет важную роль в случаях, когда вирусная инфекция локализована в периферических нелимфоидных компартментах, например, при папилломавирусной инфекции эпителиальных клеток кожи. Кроме того, перекрестное праймирование может быть важным, когда вирусы развили механизмы, которые специфически нарушают иммунные функции ДК.
Miller, B.J., Appel, M.C., O’Neil, J.J. & Wicker, L.S. Для переноса диабета у не страдающих ожирением мышей с диабетом необходимы как Lyt-2+, так и L3T4+ T-клетки. Дж. Иммунол. 140 , 52–58 (1988).
КАС пабмед Google ученый
Bendelac, A., Carnaud, C., Boitard, C. & Bach, JF. Сингенный перенос аутоиммунного диабета от диабетических мышей NOD к здоровым новорожденным. Потребность как в L3T4+, так и в Lyt-2+ Т-клетках. Дж. Эксп. Мед. 166 , 823–832 (1987).
КАС пабмед Google ученый
Kurts, C., Kosaka, H., Carbone, F.R., Miller, J.F. & Heath, W.R. Класс I-ограниченная перекрестная презентация экзогенных аутоантигенов приводит к делеции аутореактивных CD8 + Т-клеток.
 Дж. Экспл. Мед. 186 , 239–245 (1997). Предоставляет доказательства того, что аутоантигены могут быть перекрестно представлены и что это приводит к делеционной толерантности.
Дж. Экспл. Мед. 186 , 239–245 (1997). Предоставляет доказательства того, что аутоантигены могут быть перекрестно представлены и что это приводит к делеционной толерантности. КАС пабмед ПабМед Центральный Google ученый
Schonrich, G. et al. Подавляющая регуляция Т-клеточных рецепторов на аутореактивных Т-клетках как новый механизм индукции экстратимической толерантности. Cell 65 , 293–304 (1991).
КАС пабмед Google ученый
Schonrich, G. et al. Индукция толерантности как многоэтапный процесс. евро. Дж. Иммунол. 24 , 285–293 (1994).
КАС пабмед Google ученый
Oldstone, M.B., Nerenberg, M., Southern, P., Price, J. & Lewicki, H. Вирусная инфекция вызывает инсулинозависимый сахарный диабет в трансгенной модели: роль антиаутоиммунного (вирусного) иммунного ответа .
 Cell 65 , 319–331 (1991).
Cell 65 , 319–331 (1991).КАС пабмед Google ученый
Охаси, П. С. и др. Абляция «толерантности» и индукция диабета вирусной инфекцией у трансгенных мышей с вирусным антигеном. Cell 65 , 305–317 (1991).
КАС пабмед Google ученый
Ридж, Дж. П., Ди Роза, Ф. и Матцингер, П. Кондиционированная дендритная клетка может быть временным мостом между CD4 + Т-хелпером и Т-киллерной клеткой. Природа 393 , 474–478 (1998).
КАС пабмед Google ученый
Bennett, S. R. et al. Помощь в ответах цитотоксических Т-клеток опосредована передачей сигналов CD40. Природа 393 , 478–480 (1998).
КАС пабмед Google ученый
Schoenberger, S.
 P., Toes, R.E., van der Voort, E.I., Offringa, R. & Melief, C.J. Т-клеточная помощь цитотоксическим Т-лимфоцитам опосредована взаимодействием CD40–CD40L. Nature 393 , 480–483 (1998).
P., Toes, R.E., van der Voort, E.I., Offringa, R. & Melief, C.J. Т-клеточная помощь цитотоксическим Т-лимфоцитам опосредована взаимодействием CD40–CD40L. Nature 393 , 480–483 (1998).КАС Статья пабмед Google ученый
Salio, M., Cella, M., Suter, M. & Lanzavecchia, A. Подавление созревания дендритных клеток вирусом простого герпеса. евро. Дж. Иммунол. 29 , 3245–3253 (1999).
КАС пабмед Google ученый
Servet-Delprat, C. et al. Вирус кори индуцирует аномальную дифференцировку дендритных клеток человека, активированных лигандом CD40. Дж. Иммунол. 164 , 1753–1760 (2000).
КАС пабмед Google ученый
Fugier-Vivier, I. et al. Вирус кори подавляет клеточный иммунитет, нарушая выживание и функции дендритных и Т-клеток.
 Дж. Экспл. Мед. 186 , 813–823 (1997).
Дж. Экспл. Мед. 186 , 813–823 (1997).КАС пабмед ПабМед Центральный Google ученый
Габрилович Д.И. и др. Мышиный ретровирус индуцирует дефекты функции дендритных клеток на ранних стадиях инфекции. Клеточный иммунол. 158 , 167–181 (1994).
КАС пабмед Google ученый
Игнатиус Р. и др. Индуцированное вирусом оспы канареек созревание дендритных клеток опосредуется апоптотической гибелью клеток и секрецией фактора некроза опухоли альфа. Дж. Вирол. 74 , 11329–11338 (2000).
КАС пабмед ПабМед Центральный Google ученый
Engelmayer, J. et al. Вирус коровьей оспы ингибирует созревание дендритных клеток человека: новый механизм уклонения от иммунитета. Дж. Иммунол.
 163 , 6762–6768 (1999).
163 , 6762–6768 (1999).КАС пабмед Google ученый
Севилья, Н. и др. Иммуносупрессия и, как следствие, персистенция вируса за счет специфического нацеливания вируса на дендритные клетки. Дж. Эксп. Мед. 192 , 1249–1260 (2000).
КАС пабмед ПабМед Центральный Google ученый
Беван, М. Дж. Распознавание антигена. Классовая дискриминация в мире иммунологии. Природа 325 , 192–194 (1987).
КАС пабмед Google ученый
Bevan, M. J. Перекрестное примирование вторичного цитотоксического ответа на второстепенные антигены H с конгенными клетками H-2, которые не реагируют перекрестно в цитотоксическом анализе. Дж. Эксп. Мед. 143 , 1283–1288 (1976).
КАС пабмед Google ученый
Pooley, J.
 L., Heath, W. R. & Shortman, K. Передовой опыт: внутривенный растворимый антиген презентируется CD4 T-клеткам CD8 − дендритными клетками, но перекрестно презентируется CD8 T-клеткам CD8 + дендритными клетками. клетки. Дж. Иммунол. 166 , 5327–5330 (2001). Доказывает, что CD8 + дендритные клетки (ДК) ответственны за перекрестную презентацию растворимого овальбумина. Это также показывает, что CD8 − CD4 − DC могут перекрестно присутствовать при воздействии липополисахарида.
L., Heath, W. R. & Shortman, K. Передовой опыт: внутривенный растворимый антиген презентируется CD4 T-клеткам CD8 − дендритными клетками, но перекрестно презентируется CD8 T-клеткам CD8 + дендритными клетками. клетки. Дж. Иммунол. 166 , 5327–5330 (2001). Доказывает, что CD8 + дендритные клетки (ДК) ответственны за перекрестную презентацию растворимого овальбумина. Это также показывает, что CD8 − CD4 − DC могут перекрестно присутствовать при воздействии липополисахарида. КАС пабмед Google ученый
den Haan, J.M., Lehar, S.M. & Bevan, M.J. CD8 + , но не CD8 − дендритные клетки, перекрестно примированные цитотоксические Т-клетки in vivo . Дж. Экспл. Мед. 192 , 1685–1696 (2000). Первый отчет, показывающий, что CD8 + дендритные клетки перекрестно представляют клеточно-ассоциированные антигены.

КАС пабмед ПабМед Центральный Google ученый
Huang, A.Y. et al. Роль клеток, происходящих из костного мозга, в представлении опухолевых антигенов, ограниченных MHC класса I. Наука 264 , 961–965 (1994).
КАС Статья пабмед Google ученый
Bennett, S. R., Carbone, F. R., Karamalis, F., Miller, J. F. & Heath, W. R. Индукция ответа цитотоксических Т-лимфоцитов CD8 + путем перекрестного праймирования требует помощи родственных CD4 + Т-клеток. Дж. Экспл. Мед. 186 , 65–70 (1997).
КАС пабмед ПабМед Центральный Google ученый
Norbury, C. C., Chambers, B. J., Prescott, A. R., Ljunggren, H. G. & Watts, C. Конститутивный макропиноцитоз позволяет TAP-зависимому главному комплексу гистосовместимости класса I презентировать экзогенный растворимый антиген дендритными клетками, происходящими из костного мозга.
 евро. Дж. Иммунол. 27 , 280–288 (1997).
евро. Дж. Иммунол. 27 , 280–288 (1997).КАС пабмед Google ученый
Regnault, A. et al. Опосредованная рецептором Fcγ индукция созревания дендритных клеток и рестриктированная классом I главного комплекса гистосовместимости антигенная презентация после интернализации иммунного комплекса. Дж. Эксп. Мед. 189 , 371–380 (1999).
КАС пабмед ПабМед Центральный Google ученый
Ke, Y. & Kapp, J. A. Экзогенные антигены получают доступ к основному пути процессинга класса I комплекса гистосовместимости в В-клетках посредством захвата, опосредованного рецептором. Дж. Экспл. Мед. 184 , 1179–1184 (1996).
КАС пабмед Google ученый
Рок, К. Л., Гэмбл, С. и Ротштейн, Л. Презентация экзогенного антигена молекулами главного комплекса гистосовместимости класса I.
 Наука 249 , 918–921 (1990).
Наука 249 , 918–921 (1990).КАС пабмед Google ученый
Ковачович-Банковски М., Кларк К., Бенасерраф Б. и Рок К.Л. Эффективный главный комплекс гистосовместимости класса I презентации экзогенного антигена при фагоцитозе макрофагами. Проц. Натл акад. науч. США 90 , 4942–4946 (1993).
КАС пабмед ПабМед Центральный Google ученый
Albert, M.L., Sauter, B. & Bhardwaj, N. Дендритные клетки приобретают антиген из апоптотических клеток и индуцируют ЦТЛ, рестриктированные по классу I. Природа 392 , 86–89 (1998).
КАС пабмед Google ученый
Хит, В. Р. и Карбон, Ф. Р. Перекрестная презентация, дендритные клетки, толерантность и иммунитет. год. Преподобный Иммунол. 19 , 47–64 (2001).

КАС пабмед Google ученый
Carbone, F. R. & Bevan, M. J. Ограниченный класс I процессинг и презентация экзогенного ассоциированного с клеткой антигена in vivo . Дж. Экспл. Мед. 171 , 377–387 (1990).
КАС пабмед Google ученый
Времец, Д. и др. Поверхностный фенотип дендритных клеток, выделенных из тимуса и селезенки мышей: исследование экспрессии CD8 субпопуляцией дендритных клеток. Дж. Экспл. Мед. 176 , 47–58 (1992).
КАС пабмед Google ученый
Kurts, C., Cannarile, M., Klebba, I. & Brocker, T. Дендритных клеток достаточно для кросс-презентации аутоантигенов Т-лимфоцитам CD8 in vivo . Дж. Иммунол. 166 , 1439–1442 (2001).
КАС пабмед Google ученый
Юделл, Дж.
 В., Норбери, К. С. и Беннинк, Дж. Р. Механизмы презентации экзогенного антигена молекулами МНС класса I in vitro и in vivo : последствия для генерирования ответов CD8+ Т-клеток на инфекционные агенты, опухоли, трансплантаты, и вакцины. Доп. Иммунол. 73 , 1–77 (1999).
В., Норбери, К. С. и Беннинк, Дж. Р. Механизмы презентации экзогенного антигена молекулами МНС класса I in vitro и in vivo : последствия для генерирования ответов CD8+ Т-клеток на инфекционные агенты, опухоли, трансплантаты, и вакцины. Доп. Иммунол. 73 , 1–77 (1999).КАС пабмед Google ученый
Юделл Дж. В., Беннинк Дж. Р. и Хосака Ю. Клетки обрабатывают экзогенные белки для распознавания цитотоксическими Т-лимфоцитами. Наука 239 , 637–640 (1988).
КАС пабмед Google ученый
Финелли, А. и др. MHC класса I ограничивал Т-клеточный ответ до Listeria monocytogenes , внутриклеточный бактериальный патоген. Иммунол. Рез. 19 , 211–223 (1999).
КАС пабмед Google ученый
Ширмбек, Р.
 , Мелбер, К. и Райманн, Дж. Небольшие частицы поверхностного антигена вируса гепатита В обрабатываются новым эндосомальным путем для презентации эпитопа, ограниченного классом I главного комплекса гистосовместимости. евро. Дж. Иммунол. 25 , 1063–1070 (1995).
, Мелбер, К. и Райманн, Дж. Небольшие частицы поверхностного антигена вируса гепатита В обрабатываются новым эндосомальным путем для презентации эпитопа, ограниченного классом I главного комплекса гистосовместимости. евро. Дж. Иммунол. 25 , 1063–1070 (1995).КАС пабмед Google ученый
Bachmann, M. F. et al. TAP1-независимая загрузка молекул класса I экзогенными вирусными белками. евро. Дж. Иммунол. 25 , 1739–1743 (1995).
КАС пабмед Google ученый
Harding, C.V. & Song, R. Фагоцитарная обработка экзогенных антигенов в виде частиц макрофагами для представления молекулами MHC класса I. Дж. Иммунол. 153 , 4925–4933 (1994).
КАС пабмед Google ученый
Сривастава, П.К., Удоно, Х.
 , Блашер, Н.Е. и Ли, З. Белки теплового шока переносят пептиды во время процессинга антигена и примирования ЦТЛ. Immunogenetics 39 , 93–98 (1994).
, Блашер, Н.Е. и Ли, З. Белки теплового шока переносят пептиды во время процессинга антигена и примирования ЦТЛ. Immunogenetics 39 , 93–98 (1994).КАС пабмед Google ученый
Wolfers, J. et al. Опухолевые экзосомы являются источником общих антигенов отторжения опухоли для перекрестного примирования ЦТЛ. Природа Мед. 7 , 297–303 (2001).
КАС пабмед Google ученый
Zitvogel, L. et al. Эрадикация укоренившихся опухолей мышей с использованием новой бесклеточной вакцины: экзосом, полученных из дендритных клеток. Природа Мед. 4 , 594–600 (1998).
КАС пабмед Google ученый
Лу, З. и др. CD40-независимые пути Т-клеток помогают примировать CD8 + цитотоксических Т-лимфоцитов.
 Дж. Экспл. Мед. 191 , 541–550 (2000).
Дж. Экспл. Мед. 191 , 541–550 (2000).КАС пабмед ПабМед Центральный Google ученый
Huang, A.Y., Bruce, A.T., Pardoll, D.M. & Levitsky, H.I. In vivo кросс-праймирование антигенов, рестриктированных MHC класса I, требует переносчика TAP. Иммунитет 4 , 349–355 (1996).
КАС пабмед Google ученый
Kurts, C. et al. Экзогенная презентация аутоантигенов in vivo , ограниченная конститутивным классом I. Дж. Экспл. Мед. 184 , 923–930 (1996). Первая статья, в которой сообщается о перекрестной презентации тканевых антигенов и показано, что этот процесс является конститутивным.
КАС пабмед Google ученый
Сигал, Л. Дж., Кротти, С., Андино, Р. и Рок, К.
 Л. Цитотоксический Т-клеточный иммунитет к инфицированным вирусом некроветворным клеткам требует презентации экзогенного антигена. Nature 398 , 77–80 (1999). Первая статья, предоставляющая прямые доказательства того, что иммунитет ЦТЛ к вирусам может быть вызван перекрестным праймированием.
Л. Цитотоксический Т-клеточный иммунитет к инфицированным вирусом некроветворным клеткам требует презентации экзогенного антигена. Nature 398 , 77–80 (1999). Первая статья, предоставляющая прямые доказательства того, что иммунитет ЦТЛ к вирусам может быть вызван перекрестным праймированием. КАС пабмед Google ученый
Kurts, C., Miller, J.F., Subramaniam, R.M., Carbone, F.R. & Heath, W.R. Перекрестная презентация, ограниченная классом I главного комплекса гистосовместимости, смещена в сторону высоких доз антигенов и антигенов, высвобождаемых при разрушении клеток. Дж. Эксп. Мед. 188 , 409–414 (1998). Обеспечивает важное наблюдение, что доза антигена имеет жизненно важное значение для перекрестной презентации тканевого антигена. Также показано, что повреждение тканей усиливает перекрестную презентацию.
КАС пабмед ПабМед Центральный Google ученый
Беллоне, М.
 и др. Процессинг поглощенных апоптотических телец дает Т-клеточные эпитопы. Дж. Иммунол. 159 , 5391–5399 (1997).
и др. Процессинг поглощенных апоптотических телец дает Т-клеточные эпитопы. Дж. Иммунол. 159 , 5391–5399 (1997).КАС пабмед Google ученый
Arrode, G. et al. Входящий цитомегаловирус человека pp65 (UL83), содержащийся в апоптотически инфицированных фибробластах, перекрестно презентируется CD8 + Т-клеткам дендритными клетками. Дж. Вирол. 74 , 10018–10024 (2000).
КАС пабмед ПабМед Центральный Google ученый
Debrick, J.E., Campbell, P.A. & Staerz, U.D. Макрофаги как вспомогательные клетки для иммунных реакций, ограниченных MHC класса I. Дж. Иммунол. 147 , 2846–2851 (1991).
КАС пабмед Google ученый
Huang, F. P. et al. Дискретная субпопуляция дендритных клеток транспортирует апоптотические эпителиальные клетки кишечника в области Т-клеток брыжеечных лимфатических узлов.
 Дж. Экспл. Мед. 191 , 435–444 (2000). Показывает, что связанные с кишечником дендритные клетки конститутивно захватывают апоптотические эпителиальные клетки и транспортируют их в брыжеечный лимфатический узел.
Дж. Экспл. Мед. 191 , 435–444 (2000). Показывает, что связанные с кишечником дендритные клетки конститутивно захватывают апоптотические эпителиальные клетки и транспортируют их в брыжеечный лимфатический узел. КАС пабмед ПабМед Центральный Google ученый
Миллер, Дж. Ф. и др. Индукция периферической CD8 + Т-клеточной толерантности путем перекрестной презентации собственных антигенов. Иммунол. 165 , 267–277 (1998).
КАС пабмед Google ученый
Kurts, C. et al. Игнорирование или толерантность CD8 Т-клеток к островковым антигенам зависит от дозы антигена. Проц. Натл акад. науч. США 96 , 12703–12707 (1999).
КАС пабмед ПабМед Центральный Google ученый
Morgan, D.
 J., Kreuwel, H.T. & Sherman, L.A. Концентрация антигена и частота предшественников определяют скорость CD8 + Толерантность Т-клеток к периферически экспрессируемым антигенам. Дж. Иммунол. 163 , 723–727 (1999).
J., Kreuwel, H.T. & Sherman, L.A. Концентрация антигена и частота предшественников определяют скорость CD8 + Толерантность Т-клеток к периферически экспрессируемым антигенам. Дж. Иммунол. 163 , 723–727 (1999).КАС пабмед Google ученый
Ли, М. и др. Ассоциированный с клеткой овальбумин перекрестно представлен намного эффективнее, чем растворимый овальбумин in vivo . Дж. Иммунол. 166 , 6099–6103 (2001).
КАС пабмед Google ученый
Harshyne, L. A., Watkins, S. C., Gambotto, A. & Barratt-Boyes, S. M. Дендритные клетки приобретают антигены из живых клеток для перекрестной презентации ЦТЛ. Дж. Иммунол. 166 , 3717–3723 (2001). Первая статья, показывающая, что дендритные клетки могут захватывать и перекрестно представлять антигены из других клеток, не убивая донорские клетки.

КАС пабмед Google ученый
von Boehmer, H. & Hafen, K. Минорные, но не главные антигены гистосовместимости эпителия тимуса толеризуют предшественников цитолитических Т-клеток. Nature 320 , 626–628 (1986).
КАС пабмед Google ученый
Merkenschlager, M., Power, M.O., Pircher, H. & Fisher, A.G. Внутритимусная делеция MHC класса I-рестриктированных цитотоксических Т-клеточных предшественников путем конститутивной перекрестной презентации экзогенного антигена. евро. Дж. Иммунол. 29 , 1477–1486 (1999).
КАС пабмед Google ученый
Adler, A.J. et al. CD4 + Толерантность Т-клеток к паренхиматозным аутоантигенам требует представления антигенпрезентирующими клетками костного мозга.
 Дж. Экспл. Мед. 187 , 1555–1564 (1998).
Дж. Экспл. Мед. 187 , 1555–1564 (1998).КАС пабмед ПабМед Центральный Google ученый
Forster, I. & Lieberam, I. Периферическая толерантность Т-клеток CD4 после локальной активации у мышей-подростков. Евро. Дж. Иммунол. 26 , 3194–3202 (1996).
КАС пабмед Google ученый
Hoglund, P. et al. Инициация аутоиммунного диабета за счет регулируемой в процессе развития презентации антигенов островковых клеток в лимфатических узлах поджелудочной железы. Дж. Экспл. Мед. 189 , 331–339 (1999).
КАС пабмед ПабМед Центральный Google ученый
Морган, Д. Дж. и др. Онтогенез толерантности Т-клеток к периферически экспрессируемым антигенам. Проц. Натл акад. науч. США 96 , 3854–3858 (1999).

КАС пабмед ПабМед Центральный Google ученый
Gooding, L. R. & Edwards, C. B. Требования к антигену H-2 в индукции in vitro SV40-специфических цитотоксических Т-лимфоцитов. Дж. Иммунол. 124 , 1258–1262 (1980).
КАС пабмед Google ученый
Schoenberger, S.P. et al. Перекрестное примирование ответов ЦТЛ in vivo не требует наличия антигенных пептидов в эндоплазматическом ретикулуме иммунизирующих клеток. Дж. Иммунол. 161 , 3808–3812 (1998).
КАС пабмед Google ученый
Sigal, L.J. & Rock, K.L. Антигенпрезентирующие клетки, полученные из костного мозга, необходимы для генерирования ответов цитотоксических Т-лимфоцитов на вирусы и используют переносчик, связанный с презентацией антигена (TAP), зависимый и независимый пути презентации антигена .
 Дж. Эксп. Мед. 192 , 1143–1150 (2000).
Дж. Эксп. Мед. 192 , 1143–1150 (2000).КАС пабмед ПабМед Центральный Google ученый
Ленц, Л. Л., Бутц, Э. А. и Беван, М. Дж. Требования к антигенпрезентирующим клеткам костного мозга для запуска цитотоксических Т-клеточных ответов на внутриклеточные патогены. Дж. Экспл. Мед. 192 , 1135–1142 (2000).
КАС пабмед ПабМед Центральный Google ученый
Norbury, C.C. et al. Множественные пути антиген-специфического процессинга для активации наивных CD8 + Т-клеток in vivo . Дж. Иммунол. 166 , 4355–4362 (2001).
КАС пабмед Google ученый
Tindle, R. W. & Frazer, I. H. Иммунный ответ на вирусы папилломы человека и перспективы специфической иммунизации против вируса папилломы человека.
 Курс. Верхний. микробиол. Иммунол. 186 , 217–253 (1994).
Курс. Верхний. микробиол. Иммунол. 186 , 217–253 (1994).КАС пабмед Google ученый
Tortorella, D., Gewurz, B.E., Furman, M.H., Schust, D.J. & Ploegh, H.L. Вирусная подрывная деятельность иммунной системы. год. Преподобный Иммунол. 18 , 861–926 (2000).
КАС пабмед Google ученый
Хилл, А. и др. Вирус простого герпеса отключает TAP, чтобы избежать иммунитета хозяина. Nature 375 , 411–415 (1995).
КАС пабмед Google ученый
Ан, К. и др. Цитомегаловирус человека ингибирует презентацию антигена посредством последовательного многоэтапного процесса. Проц. Натл акад. науч. США 93 , 10990–10995 (1996).
КАС пабмед ПабМед Центральный Google ученый
Фру, К.
 и др. Вирусный ингибитор пептидных транспортеров для презентации антигена. Nature 375 , 415–418 (1995).
и др. Вирусный ингибитор пептидных транспортеров для презентации антигена. Nature 375 , 415–418 (1995).КАС пабмед Google ученый
Gilbert, M.J., Riddell, S.R., Plachter, B. & Greenberg, P.D. Цитомегаловирус избирательно блокирует процессинг антигена и презентацию своего непосредственно раннего генного продукта. Природа 383 , 720–722 (1996).
КАС пабмед Google ученый
Левицкая Дж., Шарипо А., Леончикс А., Чехановер А. и Масуччи М. Г. Ингибирование убиквитин/протеасомозависимой деградации белка повторным доменом Gly-Ala ядерного антигена 1 вируса Эпштейна-Барр Проц. Натл акад. науч. США 94 , 12616–12621 (1997).
КАС пабмед ПабМед Центральный Google ученый
Паабо, С.
 и др. Аденовирусные белки и экспрессия MHC. Доп. Рак Рез. 52 , 151–163 (1989).
и др. Аденовирусные белки и экспрессия MHC. Доп. Рак Рез. 52 , 151–163 (1989).КАС пабмед Google ученый
Ronchetti, A. et al. Иммуногенность апоптотических клеток in vivo : роль антигенной нагрузки, антигенпрезентирующих клеток и цитокинов. Дж. Иммунол. 163 , 130–136 (1999).
КАС пабмед Google ученый
Chiodoni, C. et al. Дендритные клетки, инфильтрирующие опухоли, котрансдуцированные гранулоцитарно-макрофагальным колониестимулирующим фактором (GM-CSF) и генами лиганда CD40, поглощают и представляют эндогенные антигены, ассоциированные с опухолью, и примируют наивных мышей для ответа цитотоксических Т-лимфоцитов. Дж. Эксп. Мед. 190 , 125–133 (1999).
КАС пабмед ПабМед Центральный Google ученый
Kundig, T.
 M. et al. Фибробласты как эффективные антигенпрезентирующие клетки лимфоидных органов. Наука 268 , 1343–1347 (1995).
M. et al. Фибробласты как эффективные антигенпрезентирующие клетки лимфоидных органов. Наука 268 , 1343–1347 (1995).КАС пабмед Google ученый
Ochsenbein, A. F. et al. Роль локализации опухоли, вторичных сигналов и перекрестного запуска в индукции цитотоксических Т-клеток. Nature 411 , 1058–1064 (2001).
КАС пабмед Google ученый
Vremec, D., Pooley, J., Hochrein, H., Wu, L. & Shortman, K. Экспрессия CD4 и CD8 подтипами дендритных клеток в тимусе и селезенке мышей. Дж. Иммунол. 164 , 2978–2986 (2000).
КАС пабмед Google ученый
Kamath, A. T. et al. Развитие, созревание и скорость оборота популяций дендритных клеток селезенки мыши. Дж. Иммунол. 165 , 6762–6770 (2000).

КАС пабмед Google ученый
Де Смедт, Т. и др. Регуляция количества и созревания дендритных клеток липополисахаридом in vivo . Дж. Экспл. Мед. 184 , 1413–1424 (1996).
КАС пабмед Google ученый
Пулендран, Б. и др. Пути развития дендритных клеток in vivo : различные функции, фенотип и локализация субпопуляций дендритных клеток у мышей, обработанных лигандом FLT3. Дж. Иммунол. 159 , 2222–2231 (1997).
КАС пабмед Google ученый
Отделение иммунологии, Институт Уолтера и Элизы Холл, P.O. Королевская больница Мельбурна, Парквилл, 3050, Виктория, Австралия
Уильям Р. Хит
Кафедра микробиологии и иммунологии Мельбурнского университета, Парквилл, 3052, Виктория, Австралия
Фрэнсис Р. Карбоне Автор
- William R. Heath
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Francis R. Carbone
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- ПЕРЕКЛЮЧЕНИЕ ИЗОТИПОВ
Когда В-клетки изменяют свой класс продукции антител (иммуноглобулина) с одного изотипа на другой, например, с IgM на IgG.

- ВЫБОР ТИМУСА
Процесс выбора тимоцитов для развития в зрелые Т-клетки на основе специфичности их Т-клеточных рецепторов.
- ПЕРИФЕРИЙНЫЙ ДОПУСК
Генерация толерантности к себе у зрелых Т-клеток, которые покинули тимус и рециркулируют на периферии.
- ЦЕНТРАЛЬНЫЙ ДОПУСК
Генерация толерантности к себе во время развития Т-клеток в тимусе.
- АЛЛОГЕННЫЕ
Особи одного вида, экспрессирующие аллельно вариантные гены, приводящие к отторжению трансплантированной ткани.
Нановакцина для самопрезентации антигена и устранения иммуносупрессии как персонализированная стратегия иммунотерапии рака
- Чао Лю
- Сюэ Лю
- Ган Лю
Природа Нанотехнологии (2022)
Вирусоподобные частицы: получение, иммуногенность и их роль в качестве нановакцин и наноносителей лекарственных средств
- Саги Нураи
- Хоура Бахрулолум
- Голамреза Ахмадян
Журнал нанобиотехнологий (2021)
Дисфункция TAP в дендритных клетках делает возможной неканоническую перекрестную презентацию для праймирования Т-клеток.

- Гаэтан Барбет
- Приянка Наир-Гупта
- Дж. Магариан Блендер
Природа Иммунология (2021)
Индукция иммунной толерантности с помощью наномедицинских препаратов, нацеленных на дендритные клетки
- Анна Сифуэнтес-Риус
- анал Десаи
- Николас Х.

PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
37. Proietto AI, van Dommelen S, Zhou P, Rizzitelli A, D’Amico A, Steptoe RJ, et al. Дендритные клетки в тимусе способствуют индукции Т-регуляторных клеток. Proc Natl Acad Sci USA (2008) 105(50):19869–74. doi:10.1073/pnas.0810268105
Proietto AI, van Dommelen S, Zhou P, Rizzitelli A, D’Amico A, Steptoe RJ, et al. Дендритные клетки в тимусе способствуют индукции Т-регуляторных клеток. Proc Natl Acad Sci USA (2008) 105(50):19869–74. doi:10.1073/pnas.0810268105
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
38. Coquet JM, Ribot JC, Babała N, Middendorp S, van der Horst G, Xiao Y, et al. Эпителиальные и дендритные клетки в мозговом веществе тимуса способствуют развитию регуляторных Т-клеток CD4 + Foxp3 + через путь CD27-CD70. J Exp Med (2013) 210(4):715–28. doi:10.1084/jem.20112061
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
39. Ватанабэ Н., Ван Ю.Х., Ли Х.К., Ито Т., Цао В., Лю Ю.Дж. Тельца Гассаля инструктируют дендритные клетки индуцировать CD4 + CD25 + регуляторные Т-клетки в тимусе человека. Природа (2005) 436 (7054): 1181–5. doi:10.1038/nature03886
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
40. Besin G, Gaudreau S, Ménard M, Guindi C, Dupuis G, Amrani A. Стромальный лимфопоэтин тимуса и дендритные клетки, обусловленные стромальным лимфопоэтином тимуса, индуцируют регуляторную дифференцировку Т-клеток и защиту мышей NOD от диабета. Диабет (2008) 57(8):2107–17. doi:10.2337/db08-0171
Besin G, Gaudreau S, Ménard M, Guindi C, Dupuis G, Amrani A. Стромальный лимфопоэтин тимуса и дендритные клетки, обусловленные стромальным лимфопоэтином тимуса, индуцируют регуляторную дифференцировку Т-клеток и защиту мышей NOD от диабета. Диабет (2008) 57(8):2107–17. doi:10.2337/db08-0171
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
41. Mazzucchelli R, Hixon JA, Spolski R, Chen X, Li WQ, Hall VL, et al. Развитие регуляторных Т-клеток требует стимуляции IL-7Rальфа с помощью IL-7 или TSLP. Кровь (2008) 112(8):3283–92. doi:10.1182/blood-2008-02-137414
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
42. Мартин-Гайо Э., Сьерра-Филарди Э., Корби А.Л., Торибио М.Л. Плазмацитоидные дендритные клетки, находящиеся в тимусе человека, стимулируют естественное развитие клеток Treg. Кровь (2010) 115(26):5366–75. doi:10.1182/blood-2009-10-248260
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
43. Ханабучи С., Ито Т., Парк В.Р., Ватанабэ Н., Шоу Дж.Л., Роман Э. и др. Активированные лимфопоэтином стромальные плазмацитоидные дендритные клетки индуцируют образование регуляторных Т-клеток FOXP3 + в тимусе человека. J Immunol (2010) 184(6):2999–3007. doi:10.4049/jimmunol.0804106
Ханабучи С., Ито Т., Парк В.Р., Ватанабэ Н., Шоу Дж.Л., Роман Э. и др. Активированные лимфопоэтином стромальные плазмацитоидные дендритные клетки индуцируют образование регуляторных Т-клеток FOXP3 + в тимусе человека. J Immunol (2010) 184(6):2999–3007. doi:10.4049/jimmunol.0804106
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
44. Herbin O, Bonito AJ, Jeong S, Weinstein EG, Rahman AH, Xiong H, et al. Медуллярные эпителиальные клетки тимуса и дендритные клетки CD8α(+) скоординировано регулируют центральную толерантность, но клетки CD8α(+) незаменимы для производства регуляторных Т-клеток тимуса. J Autoimmun (2016) 75:141–9. doi:10.1016/j.jaut.2016.08.002
Полный текст CrossRef | Google Scholar
45. Takaba H, Morishita Y, Tomofuji Y, Danks L, Nitta T, Komatsu N, et al. Fezf2 управляет программой экспрессии аутоантигена тимуса для иммунной толерантности. Cell (2015) 163(4):975–87. doi:10.1016/j. cell.2015.10.013
cell.2015.10.013
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
46. Lucas B, James KD, Cosway EJ, Parnell SM, Tumanov AV, Ware CF, et al. Рецептор лимфотоксина β контролирует проникновение предшественников Т-клеток в тимус. J Immunol (2016) 197(7):2665–72. doi:10.4049/jimmunol.1601189
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
47. Cosway EJ, Lucas B, James KD, Parnell SM, Carvalho-Gaspar M, White AJ, et al. Переопределение специализации мозгового вещества вилочковой железы для центральной толерантности. J Exp Med (2017) 214(11):3183–95. doi:10.1084/jem.20171000
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
48. Деви К.С., Анандасабапати Н. Происхождение ДК и способность к иммунологической толерантности в центральных и периферических тканях. Semin Immunopathol (2017) 39(2):137–52. doi:10.1007/s00281-016-0602-0
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
49. Idoyaga J, Fiorese C, Zbytnuik L, Lubkin A, Miller J, Malissen B, et al. Специализированная роль мигрирующих дендритных клеток в индукции периферической толерантности. J Clin Invest (2013) 123(2):844–54. doi:10.1172/jci65260
Idoyaga J, Fiorese C, Zbytnuik L, Lubkin A, Miller J, Malissen B, et al. Специализированная роль мигрирующих дендритных клеток в индукции периферической толерантности. J Clin Invest (2013) 123(2):844–54. doi:10.1172/jci65260
Резюме PubMed | Полный текст перекрестной ссылки | Google Scholar
50. Jonuleit H, Schmitt E, Schuler G, Knop J, Enk AH. Индукция непролиферирующих CD4(+) Т-клеток, продуцирующих интерлейкин-10, с регуляторными свойствами путем повторной стимуляции аллогенными незрелыми дендритными клетками человека. J Exp Med (2000) 192(9):1213–22. doi:10.1084/jem.192.9.1213
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
51. Левингс М.К., Грегори С., Тресольди Э., Каззанига С., Бонини С., Ронкароло М.Г. Дифференцировка клеток Tr1 незрелыми дендритными клетками требует IL-10, но не CD25 + CD4 + Tr клеток. Кровь (2005) 105(3):1162–9. doi:10.1182/blood-2004-03-1211
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
52. Kushwah R, Wu J, Oliver JR, Jiang G, Zhang J, Siminovitch KA, et al. Поглощение апоптотических DC превращает незрелые DC в толерогенные DC, которые индуцируют дифференцировку Foxp3 + Трег. Eur J Immunol (2010) 40(4):1022–35. doi:10.1002/eji.200
Kushwah R, Wu J, Oliver JR, Jiang G, Zhang J, Siminovitch KA, et al. Поглощение апоптотических DC превращает незрелые DC в толерогенные DC, которые индуцируют дифференцировку Foxp3 + Трег. Eur J Immunol (2010) 40(4):1022–35. doi:10.1002/eji.200
2
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
53. Глейснер М.А., Роземблатт М., Фиерро Дж.А., Боно М.Р. Доставка аллоантигенов через апоптотические клетки приводит к образованию дендритных клеток с незрелым толерогенным фенотипом. Transplant Proc (2011) 43(6):2325–33. doi:10.1016/j.transproceed.2011.06.007
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
54. Hegde S, Pahne J, Smola-Hess S. Новые иммунодепрессивные свойства интерлейкина-6 в дендритных клетках: ингибирование связывающей активности NF-kappaB и экспрессии CCR7. FASEB J (2004) 18(12):1439–41. doi:10.1096/fj.03-0969fje
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
55. Geisel J, Kahl F, Müller M, Wagner H, Kirschning CJ, Autenrieth IB, et al. IL-6 и созревание регулируют индуцированную TLR2 и TLR4 толерантность к агонистам TLR и перекрестную толерантность в дендритных клетках. J Immunol (2007) 179(9):5811–8. doi:10.4049/jimmunol.179.9.5811
Geisel J, Kahl F, Müller M, Wagner H, Kirschning CJ, Autenrieth IB, et al. IL-6 и созревание регулируют индуцированную TLR2 и TLR4 толерантность к агонистам TLR и перекрестную толерантность в дендритных клетках. J Immunol (2007) 179(9):5811–8. doi:10.4049/jimmunol.179.9.5811
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
56. Frick JS, Zahir N, Müller M, Kahl F, Bechtold O, Lutz MB, et al. Колитогенные и неколитогенные комменсальные бактерии по-разному запускают созревание DC и поляризацию Th-клеток: важную роль играет IL-6. Eur J Immunol (2006) 36(6):1537–47. doi:10.1002/eji.200635840
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
57. Steinbrink K, Wolfl M, Jonuleit H, Knop J, Enk AH. Индукция толерантности дендритными клетками, обработанными IL-10. J Immunol (1997) 159(10):4772–80.
Реферат PubMed | Google Scholar
58. Menges M, Rossner S, Voigtlander C, Schindler H, Kukutsch NA, Bogdan C, et al. Повторные инъекции дендритных клеток, созревших с фактором некроза опухоли альфа, индуцируют антигенспецифическую защиту мышей от аутоиммунитета. J Exp Med (2002) 195(1):15–21. doi:10.1084/jem.20011341
Повторные инъекции дендритных клеток, созревших с фактором некроза опухоли альфа, индуцируют антигенспецифическую защиту мышей от аутоиммунитета. J Exp Med (2002) 195(1):15–21. doi:10.1084/jem.20011341
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
59. Лутц М.Б., Шулер Г. Незрелые, полузрелые и полностью зрелые дендритные клетки: какие сигналы вызывают толерантность или иммунитет? Trends Immunol (2002) 23(9):445–9. doi:10.1016/S1471-4906(02)02281-0
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
60. Knödler A, Schmidt SM, Bringmann A, Weck MM, Brauer KM, Holderried TA, et al. Посттранскрипционная регуляция адапторных молекул с помощью IL-10 ингибирует TLR-опосредованную активацию антигенпрезентирующих клеток. Лейкемия (2009) 23(3):535–44. doi:10.1038/leu.2008.301
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
61. Joffre OP, Sancho D, Zelenay S, Keller AM, Reis e Sousa C. Эффективное и универсальное манипулирование периферическим компартментом CD4 + T-клеток путем нацеливания антигена на DNGR-1/CLEC9A. Eur J Immunol (2010) 40(5):1255–65. doi:10.1002/eji.201040419
Эффективное и универсальное манипулирование периферическим компартментом CD4 + T-клеток путем нацеливания антигена на DNGR-1/CLEC9A. Eur J Immunol (2010) 40(5):1255–65. doi:10.1002/eji.201040419
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
62. Кречмер К., Апостолоу И., Хавигер Д., Хазайе К., Нуссенцвейг М.С., фон Бемер Х. Индукция и расширение популяций регуляторных Т-клеток чужеродным антигеном. Nat Immunol (2005) 6(12):1219–27. doi:10.1038/ni1265
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
63. Ring S, Maas M, Nettelbeck DM, Enk AH, Mahnke K. Нацеливание аутоантигенов на дендритные клетки DEC205(+) in vivo подавляет экспериментальный аллергический энцефаломиелит у мышей. J Immunol (2013) 191(6):2938–47. doi:10.4049/jimmunol.1202592
Полный текст CrossRef | Google Scholar
64. Джонс А., Бурк Дж., Кем Л., Опеджин А., Тиг Р.М., Гросс С. и др. Иммуномодулирующие функции BTLA и HVEM регулируют индукцию экстратимических регуляторных Т-клеток и толерантность дендритных клеток. Иммунитет (2016) 45(5):1066–77. doi:10.1016/j.immuni.2016.10.008
Иммунитет (2016) 45(5):1066–77. doi:10.1016/j.immuni.2016.10.008
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
65. Esterházy D, Loschko J, London M, Jove V, Oliveira TY, Mucida D. Классические дендритные клетки необходимы для диетической антиген-опосредованной индукции периферических T(reg)-клеток и толерантности. Nat Immunol (2016) 17(5):545–55. doi:10.1038/ni.3408
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
66. Maggi J, Schafer C, Ubilla-Olguin G, Catalan D, Schinnerling K, Aguillon JC. Терапевтический потенциал гипореактивных CD4(+) Т-клеток при аутоиммунитете. Фронт Иммунол (2015) 6:488. doi:10.3389/fimmu.2015.00488
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
67. Куклина Е.М. Молекулярные механизмы Т-клеточной анергии. Биохимия (Москва) (2013) 78(2):144–56. doi:10.1134/S0006297003X
Полный текст CrossRef | Google Scholar
68. Гринвальд Р.Дж., Буссиотис В.А., Лорсбах Р.Б., Аббас А.К., Шарп А.Х. CTLA-4 регулирует индукцию анергии in vivo. Иммунитет (2001) 14(2):145–55. дои: 10.1016/S1074-7613(01)00097-8
Гринвальд Р.Дж., Буссиотис В.А., Лорсбах Р.Б., Аббас А.К., Шарп А.Х. CTLA-4 регулирует индукцию анергии in vivo. Иммунитет (2001) 14(2):145–55. дои: 10.1016/S1074-7613(01)00097-8
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
69. Bishop KD, Harris JE, Mordes JP, Greiner DL, Rossini AA, Czech MP, et al. Истощение рецептора запрограммированной смерти-1 полностью устраняет установившуюся клональную анергию в CD4(+) Т-лимфоцитах посредством интерлейкин-2-зависимого механизма. Cell Immunol (2009) 256(1–2):86–91. doi:10.1016/j.cellimm.2009.01.008
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
70. McBride JM, Jung T, de Vries JE, Aversa G. IL-10 изменяет функцию DC посредством модуляции молекул клеточной поверхности, что приводит к нарушению Т-клеточного ответа. Cell Immunol (2002) 215(2):162–72. doi:10.1016/S0008-8749(02)00007-2
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
71. Tuettenberg A, Huter E, Hubo M, Horn J, Knop J, Grimbacher B, et al. Роль ICOS в управлении ответами Т-клеток: ICOS-зависимая индукция анергии Т-клеток толерогенными дендритными клетками. J Immunol (2009) 182(6):3349–56. doi:10.4049/jimmunol.0802733
Tuettenberg A, Huter E, Hubo M, Horn J, Knop J, Grimbacher B, et al. Роль ICOS в управлении ответами Т-клеток: ICOS-зависимая индукция анергии Т-клеток толерогенными дендритными клетками. J Immunol (2009) 182(6):3349–56. doi:10.4049/jimmunol.0802733
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
72. Torres-Aguilar H, Aguilar-Ruiz SR, Gonzalez-Perez G, Munguia R, Bajana S, Meraz-Rios MA, et al. Толерогенные дендритные клетки, генерируемые различными иммуносупрессивными цитокинами, индуцируют антиген-специфическую анергию и регуляторные свойства в CD4+ Т-клетках памяти. J Immunol (2010) 184(4):1765–75. doi:10.4049/jimmunol.0
3
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
73. Rodriguez E, Kalay H, Noya V, Brossard N, Giacomini C, van Kooyk Y, et al. Fasciola hepatica гликоконъюгирует с иммунорегулирующими дендритными клетками через специфичную для дендритных клеток молекулу межклеточной адгезии-3-захватывающий неинтегрин, индуцирующий анергию Т-клеток. научный представитель (2017) 7:46748. doi:10.1038/srep46748
научный представитель (2017) 7:46748. doi:10.1038/srep46748
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
74. Мюллер Д.Л. Убиквитинлигазы Е3 как факторы анергии Т-клеток. Nat Immunol (2004) 5(9):883–90. doi:10.1038/ni1106
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
75. Bachmaier K, Krawczyk C, Kozieradzki I, Kong YY, Sasaki T, Oliveira-dos-Santos A, et al. Негативная регуляция активации лимфоцитов и аутоиммунитета молекулярным адаптером Cbl-b. Nature (2000) 403(6766):211–6. doi:10.1038/35003228
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
76. Чон М.С., Атфилд А., Венупрасад К., Кравчик С., Сарао Р., Элли С. и др. Существенная роль убиквитинлигазы E3 Cbl-b в индукции анергии Т-клеток. Иммунитет (2004) 21(2):167–77. doi:10.1016/j.immuni.2004.07.013
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
77. Fang D, Elly C, Gao B, Fang N, Altman Y, Joazeiro C, et al. Нарушение регуляции функции Т-лимфоцитов у зудящих мышей: роль зуда в дифференцировке Th3. Nat Immunol (2002) 3(3):281–7. doi:10.1038/ni763
Fang D, Elly C, Gao B, Fang N, Altman Y, Joazeiro C, et al. Нарушение регуляции функции Т-лимфоцитов у зудящих мышей: роль зуда в дифференцировке Th3. Nat Immunol (2002) 3(3):281–7. doi:10.1038/ni763
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
78. Heissmeyer V, Macian F, Im SH, Varma R, Feske S, Venuprasad K, et al. Кальциневрин вызывает невосприимчивость Т-клеток посредством целенаправленного протеолиза сигнальных белков. Nat Immunol (2004) 5(3):255–65. doi:10.1038/ni1047
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
79. Anandasabapathy N, Ford GS, Bloom D, Holness C, Paragas V, Seroogy C, et al. GRAIL: убиквитинлигаза Е3, ингибирующая транскрипцию генов цитокинов, экспрессируется в анергических CD4+ Т-клетках. Иммунитет (2003) 18(4):535–47. doi:10.1016/S1074-7613(03)00084-0
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
80. Safford M, Collins S, Lutz MA, Allen A, Huang CT, Kowalski J, et al. Egr-2 и Egr-3 являются негативными регуляторами активации Т-клеток. Nat Immunol (2005) 6(5):472–80. doi:10.1038/ni1193
Egr-2 и Egr-3 являются негативными регуляторами активации Т-клеток. Nat Immunol (2005) 6(5):472–80. doi:10.1038/ni1193
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
81. Harris JE, Bishop KD, Phillips NE, Mordes JP, Greiner DL, Rossini AA, et al. Ген-2 ответа на ранний рост, фактор транскрипции цинкового пальца, необходим для полной индукции клональной анергии в CD4+ Т-клетках. J Immunol (2004) 173(12):7331–8. doi:10.4049/jimmunol.173.12.7331
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
82. Коллинз С., Лутц М.А., Зарек П.Е., Андерс Р.А., Керш Г.Дж., Пауэлл Д.Д. Противоположная регуляция функции Т-клеток с помощью Egr-1/NAB2 и Egr-2/Egr-3. Eur J Immunol (2008) 38(2):528–36. doi:10.1002/eji.200737157
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
83. Buer J, Lanoue A, Franzke A, Garcia C, von Boehmer H, Sarukhan A. Секреция интерлейкина 10 и нарушение эффекторной функции Т-клеток, рестриктированных по классу II, главного комплекса гистосовместимости, анергированных in vivo. J Exp Med (1998) 187(2):177–83. doi:10.1084/jem.187.2.177
J Exp Med (1998) 187(2):177–83. doi:10.1084/jem.187.2.177
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
84. Steinbrink K, Graulich E, Kubsch S, Knop J, Enk AH. CD4(+) и CD8(+) анергические Т-клетки, индуцированные обработанными интерлейкином-10 дендритными клетками человека, проявляют антигенспецифическую супрессорную активность. Кровь (2002) 99(7):2468–76. doi:10.1182/blood.V99.7.2468
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
85. Kubsch S, Graulich E, Knop J, Steinbrink K. Супрессорная активность анергических Т-клеток, индуцированная обработанными IL-10 дендритными клетками человека: ассоциация с IL-2- и CTLA-4-зависимой остановкой G1 клеточный цикл регулируется p27Kip1. Eur J Immunol (2003) 33(7):1988–97. doi:10.1002/eji.200323600
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
86. Pletinckx K, Vaeth M, Schneider T, Beyersdorf N, Hunig T, Berberich-Siebelt F, et al. Незрелые дендритные клетки превращают анергические нерегуляторные Т-клетки в регуляторные Т-клетки Foxp3-IL-10+ путем вовлечения CD28 и CTLA-4. Eur J Immunol (2015) 45(2):480–91. doi:10.1002/eji.201444991
Незрелые дендритные клетки превращают анергические нерегуляторные Т-клетки в регуляторные Т-клетки Foxp3-IL-10+ путем вовлечения CD28 и CTLA-4. Eur J Immunol (2015) 45(2):480–91. doi:10.1002/eji.201444991
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
87. Hawiger D, Inaba K, Dorsett Y, Guo M, Mahnke K, Rivera M, et al. Дендритные клетки индуцируют невосприимчивость периферических Т-клеток в стационарных условиях in vivo. J Exp Med (2001) 194(6):769–79. doi:10.1084/jem.194.6.769
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
88. Дункл А., Хе Ю.В. Апоптоз и аутофагия в регуляции функции Т-лимфоцитов. Immunol Res (2011) 49(1–3):70–86. doi:10.1007/s12026-010-8195-5
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
89. Гронски М.А., Вейнем М. Пути смерти в гомеостазе Т-клеток и их роль в аутоиммунном диабете. Rev Diabet Stud (2006) 3(2):88–95. doi:10.1900/RDS.2006.3.88
doi:10.1900/RDS.2006.3.88
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
90. Süss G, Shortman K. Подкласс дендритных клеток убивает CD4 T-клетки посредством Fas/Fas-лиганд-индуцированного апоптоза. J Exp Med (1996) 183(4):1789–96. doi:10.1084/jem.183.4.1789
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
91. Фангер Н.А., Малишевский Ч.Р., Скули К., Гриффит Т.С. Дендритные клетки человека опосредуют клеточный апоптоз через лиганд, индуцирующий апоптоз, связанный с фактором некроза опухоли (TRAIL). J Exp Med (1999) 190(8):1155–64. doi:10.1084/jem.190.8.1155
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
92. Grohmann U, Fallarino F, Bianchi R, Belladonna ML, Vacca C, Orabona C, et al. ИЛ-6 ингибирует толерогенную функцию CD8 альфа + дендритных клеток, экспрессирующих индоламин-2,3-диоксигеназу. J Immunol (2001) 167(2):708–14. doi:10.4049/jimmunol. 167.2.708
167.2.708
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
93. Hwu P, Du MX, Lapointe R, Do M, Taylor MW, Young HA. Продукция индоламин-2,3-диоксигеназы дендритными клетками человека приводит к ингибированию пролиферации Т-клеток. J Immunol (2000) 164(7):3596–9. doi:10.4049/jimmunol.164.7.3596
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
94. Qian C, Qian L, Yu Y, An H, Guo Z, Han Y, et al. Сигнал Fas способствует иммуносупрессивной функции регуляторных дендритных клеток посредством пути ERK/β-катенина. J Biol Chem (2013) 288(39):27825–35. doi:10.1074/jbc.M112.425751
Полный текст CrossRef | Google Scholar
95. Изава Т., Кондо Т., Куросава М., Оура Р., Мацумото К., Танака Э. и др. Fas-независимый апоптоз Т-клеток дендритными клетками контролирует аутоиммунный артрит у мышей MRL/lpr. PLoS One (2012) 7(12):e48798. doi:10.1371/journal.pone.0048798
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
96. Jürgens B, Hainz U, Fuchs D, Felzmann T, Heitger A. Активируемая гамма-интерфероном компетенция индоламин-2,3-диоксигеназы в дендритных клетках, происходящих из моноцитов человека, индуцирует регуляторную активность в аллогенных Т-клетках. Кровь (2009) 114(15):3235–43. doi:10.1182/blood-2008-12-195073
Jürgens B, Hainz U, Fuchs D, Felzmann T, Heitger A. Активируемая гамма-интерфероном компетенция индоламин-2,3-диоксигеназы в дендритных клетках, происходящих из моноцитов человека, индуцирует регуляторную активность в аллогенных Т-клетках. Кровь (2009) 114(15):3235–43. doi:10.1182/blood-2008-12-195073
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
97. Манн Д.Х., Меллор А.Л. Индоламин-2,3-диоксигеназа и метаболический контроль иммунных реакций. Trends Immunol (2013) 34(3):137–43. doi:10.1016/j.it.2012.10.001
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
98. Matteoli G, Mazzini E, Iliev ID, Mileti E, Fallarino F, Puccetti P, et al. Дендритные клетки CD103+ кишечника экспрессируют индоламин-2,3-диоксигеназу, которая влияет на баланс Т-регуляторных/Т-эффекторных клеток и индукцию пероральной толерантности. Гут (2010) 59(5): 595–604. doi:10.1136/gut.2009.185108
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
99. Brenk M, Scheler M, Koch S, Neumann J, Takikawa O, Häcker G, et al. Депривация триптофана индуцирует ингибирующие рецепторы ILT3 и ILT4 на дендритных клетках, способствуя индукции человеческих CD4 + CD25 + Foxp3 + Т-регуляторных клеток. J Immunol (2009) 183(1):145–54. doi:10.4049/jimmunol.0803277
Brenk M, Scheler M, Koch S, Neumann J, Takikawa O, Häcker G, et al. Депривация триптофана индуцирует ингибирующие рецепторы ILT3 и ILT4 на дендритных клетках, способствуя индукции человеческих CD4 + CD25 + Foxp3 + Т-регуляторных клеток. J Immunol (2009) 183(1):145–54. doi:10.4049/jimmunol.0803277
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
100. Вада Дж., Ота К., Кумар А., Валлнер Э.И., Канвар Ю.С. Регуляция развития, экспрессия и апоптотический потенциал галектина-9, лектина, связывающего бета-галактозид. J Clin Invest (1997) 99(10):2452–61. doi:10.1172/JCI119429
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
101. Kashio Y, Nakamura K, Abedin MJ, Seki M, Nishi N, Yoshida N, et al. Галектин-9 индуцирует апоптоз по пути кальций-кальпаин-каспаза-1. J Immunol (2003) 170(7):3631–6. Дои: 10.4049/jиммунол.170.7.3631
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
102. Seki M, Oomizu S, Sakata KM, Sakata A, Arikawa T, Watanabe K, et al. Галектин-9 подавляет образование Th27, способствует индукции регуляторных Т-клеток и регулирует экспериментальный аутоиммунный артрит. Clin Immunol (2008) 127(1):78–88. doi:10.1016/j.clim.2008.01.006
Seki M, Oomizu S, Sakata KM, Sakata A, Arikawa T, Watanabe K, et al. Галектин-9 подавляет образование Th27, способствует индукции регуляторных Т-клеток и регулирует экспериментальный аутоиммунный артрит. Clin Immunol (2008) 127(1):78–88. doi:10.1016/j.clim.2008.01.006
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
103. Mobergslien A, Sioud M. Замалчивание генов галектина-1 и -3 в незрелых и зрелых дендритных клетках усиливает активацию Т-клеток и продукцию гамма-интерферона. J Leukoc Biol (2012) 91(3):461–7. doi:10.1189/jlb.0711361
Полный текст CrossRef | Google Scholar
104. Zhu C, Anderson AC, Schubart A, Xiong H, Imitola J, Khoury SJ, et al. Лиганд Tim-3 галектин-9 негативно регулирует иммунитет Т-хелперов 1 типа. Nat Immunol (2005) 6(12):1245–52. doi:10.1038/ni1271
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
105. Wells AD, Li XC, Li Y, Walsh MC, Zheng XX, Wu Z, et al. Необходимость апоптоза Т-клеток для индукции толерантности к периферической трансплантации. Nat Med (1999) 5(11):1303–7. doi:10.1038/15260
Необходимость апоптоза Т-клеток для индукции толерантности к периферической трансплантации. Nat Med (1999) 5(11):1303–7. doi:10.1038/15260
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
106. Wekerle T, Kurtz J, Sayegh M, Ito H, Wells A, Bensinger S, et al. Периферическая делеция после трансплантации костного мозга с костимулирующей блокадой имеет черты как индуцированной активацией гибели клеток, так и пассивной гибели клеток. J Immunol (2001) 166(4):2311–6. doi:10.4049/jimmunol.166.4.2311
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
107. Cippa PE, Gabriel SS, Chen J, Bardwell PD, Bushell A, Guimezanes A, et al. Ориентация на апоптоз для индукции стабильного смешанного гемопоэтического химеризма и долгосрочной выживаемости аллотрансплантата без миелосупрессивного кондиционирования у мышей. Кровь (2013) 122(9):1669–77. doi:10.1182/blood-2012-09-453944
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
108. Зубер Дж., Сайкс М. Механизмы толерантности к трансплантатам на основе смешанного химеризма. Тенденции Иммунол (2017) 38(11):829–43. doi:10.1016/j.it.2017.07.008
Зубер Дж., Сайкс М. Механизмы толерантности к трансплантатам на основе смешанного химеризма. Тенденции Иммунол (2017) 38(11):829–43. doi:10.1016/j.it.2017.07.008
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
109. Bouillet P, Purton JF, Godfrey DI, Zhang LC, Coultas L, Puthalakath H, et al. Член семейства Bcl-2 Bim, содержащий только Bh4, необходим для апоптоза аутореактивных тимоцитов. Nature (2002) 415 (6874): 922–6. doi:10.1038/415922a
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
110. Davey GM, Kurts C, Miller JF, Bouillet P, Strasser A, Brooks AG, et al. Периферическая делеция аутореактивных CD8 Т-клеток путем перекрестной презентации собственного антигена происходит посредством Bcl-2-ингибируемого пути, опосредованного Bim. J Exp Med (2002) 196(7):947–55. doi:10.1084/jem.20020827
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
111. Salomon B, Lenschow DJ, Rhee L, Ashourian N, Singh B, Sharpe A, et al. Костимуляция B7/CD28 необходима для гомеостаза CD4 + CD25 + иммунорегуляторных Т-клеток, которые контролируют аутоиммунный диабет. Иммунитет (2000) 12(4):431–40. doi:10.1016/S1074-7613(00)80195-8
Костимуляция B7/CD28 необходима для гомеостаза CD4 + CD25 + иммунорегуляторных Т-клеток, которые контролируют аутоиммунный диабет. Иммунитет (2000) 12(4):431–40. doi:10.1016/S1074-7613(00)80195-8
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
112. Bar-On L, Birnberg T, Kim KW, Jung S. Дефицит CD80/86, ограниченный дендритными клетками, приводит к снижению периферических регуляторных Т-клеток, но не связан с гиперактивацией лимфоцитов. Eur J Immunol (2011) 41(2):291–8. doi:10.1002/eji.201041169
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
113. Akbari O, Freeman GJ, Meyer EH, Greenfield EA, Chang TT, Sharpe AH, et al. Антиген-специфические регуляторные Т-клетки развиваются по пути ICOS-ICOS-лиганд и ингибируют вызванную аллергеном гиперреактивность дыхательных путей. Nat Med (2002) 8(9):1024–32. doi:10.1038/nm745
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
114. Manavalan JS, Rossi PC, Vlad G, Piazza F, Yarilina A, Cortesini R, et al. Высокая экспрессия ILT3 и ILT4 является общей чертой толерогенных дендритных клеток. Transpl Immunol (2003) 11(3–4):245–58. doi:10.1016/s0966-3274(03)00058-3
Manavalan JS, Rossi PC, Vlad G, Piazza F, Yarilina A, Cortesini R, et al. Высокая экспрессия ILT3 и ILT4 является общей чертой толерогенных дендритных клеток. Transpl Immunol (2003) 11(3–4):245–58. doi:10.1016/s0966-3274(03)00058-3
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
115. Ван Л., Пино-Лагос К., де Врис В.К., Гулерия И., Сайех М.Х., Ноэль Р.Дж. Передача сигналов лиганда запрограммированной смерти 1 регулирует генерацию адаптивных регуляторных Т-клеток Foxp3+CD4+. Proc Natl Acad Sci U S A (2008) 105(27):9331–6. doi:10.1073/pnas.0710441105
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
116. Франсиско Л.М., Салинас В.Х., Браун К.Е., Вангури В.К., Фриман Г.Дж., Кухроо В.К. и др. PD-L1 регулирует развитие, поддержание и функцию индуцированных регуляторных Т-клеток. J Exp Med (2009) 206(13):3015–29. doi:10.1084/jem.200
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
117. Файф Б.Т., Паукен К.Е., Игар Т.Н., Обу Т., Ву Дж., Танг К. и др. Взаимодействия между PD-1 и PD-L1 способствуют толерантности, блокируя индуцированный TCR стоп-сигнал. Nat Immunol (2009) 10(11):1185–92. doi:10.1038/ni.1790
Файф Б.Т., Паукен К.Е., Игар Т.Н., Обу Т., Ву Дж., Танг К. и др. Взаимодействия между PD-1 и PD-L1 способствуют толерантности, блокируя индуцированный TCR стоп-сигнал. Nat Immunol (2009) 10(11):1185–92. doi:10.1038/ni.1790
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
118. Henderson JG, Opejin A, Jones A, Gross C, Hawiger D. CD5 инструктирует развитие экстратимических регуляторных Т-клеток в ответ на собственные и толерантные антигены. Иммунитет (2015) 42(3):471–83. doi:10.1016/j.immuni.2015.02.010
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
119. Кейр М.Е., Франсиско Л.М., Шарп А.Х. PD-1 и его лиганды в Т-клеточном иммунитете. Curr Opin Immunol (2007) 19(3):309–14. doi:10.1016/j.coi.2007.04.012
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
120. Schmidt M, Lügering N, Pauels HG, Schulze-Osthoff K, Domschke W, Kucharzik T. IL-10 индуцирует апоптоз в моноцитах человека с участием рецептора/лиганда CD95. Eur J Immunol (2000) 30(6):1769–77. doi:10.1002/1521-4141(200006)30:6<1769::aid-immu1769>3.0.co;2-9
Eur J Immunol (2000) 30(6):1769–77. doi:10.1002/1521-4141(200006)30:6<1769::aid-immu1769>3.0.co;2-9
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
121. Chen W, Jin W, Hardegen N, Lei KJ, Li L, Marinos N, et al. Преобразование периферических CD4 + CD25 — наивных Т-клеток в CD4 + CD25 + регуляторных Т-клеток с помощью TGF-бета-индукции фактора транскрипции Foxp3. J Exp Med (2003) 198(12):1875–86. doi:10.1084/jem.20030152
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
122. Yamazaki S, Bonito AJ, Spisek R, Dhodapkar M, Inaba K, Steinman RM. Дендритные клетки являются специализированными вспомогательными клетками наряду с TGF- для дифференцировки регуляторных Т-клеток Foxp3+ CD4+ из периферических предшественников Foxp3. Кровь (2007) 110(13):4293–302. doi:10.1182/blood-2007-05-088831
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
123. Awasthi A., Carrier Y., Peron JP., Bettelli E., Kamanaka M., Flavell RA, et al. Доминирующая функция интерлейкина 27 в создании противовоспалительных Т-клеток, продуцирующих интерлейкин 10. Nat Immunol (2007) 8(12):1380–9. doi:10.1038/ni1541
Awasthi A., Carrier Y., Peron JP., Bettelli E., Kamanaka M., Flavell RA, et al. Доминирующая функция интерлейкина 27 в создании противовоспалительных Т-клеток, продуцирующих интерлейкин 10. Nat Immunol (2007) 8(12):1380–9. doi:10.1038/ni1541
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
124. Sweeney CM, Lonergan R, Basdeo SA, Kinsella K, Dungan LS, Higgins SC, et al. IL-27 опосредует ответ на терапию IFN-β у пациентов с рассеянным склерозом путем ингибирования клеток Th27. Brain Behav Immun (2011) 25(6):1170–81. doi:10.1016/j.bbi.2011.03.007
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
125. Wang H, Meng R, Li Z, Yang B, Liu Y, Huang F и другие. IL-27 индуцирует дифференцировку Tr1-подобных клеток из человеческих наивных CD4 + Т-клеток посредством фосфорилирования STAT1 и STAT3. Immunol Lett (2011) 136(1):21–8. doi:10.1016/j.imlet.2010.11.007
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
126. Mascanfroni ID, Yeste A, Vieira SM, Burns EJ, Patel B, Sloma I, et al. IL-27 действует на DC, подавляя Т-клеточный ответ и аутоиммунитет, индуцируя экспрессию иммунорегуляторной молекулы CD39. Nat Immunol (2013) 14(10):1054–63. doi:10.1038/ni.2695
Mascanfroni ID, Yeste A, Vieira SM, Burns EJ, Patel B, Sloma I, et al. IL-27 действует на DC, подавляя Т-клеточный ответ и аутоиммунитет, индуцируя экспрессию иммунорегуляторной молекулы CD39. Nat Immunol (2013) 14(10):1054–63. doi:10.1038/ni.2695
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
127. Ивата М., Хиракияма А., Эшима Ю., Кагечика Х., Като С., Сонг С.Ю. Ретиноевая кислота придает Т-клеткам специфичность по возвращению в кишечник. Иммунитет (2004) 21(4):527–38. doi:10.1016/j.immuni.2004.08.011
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
128. Mucida D, Park Y, Kim G, Turovskaya O, Scott I, Kronenberg M, et al. Реципрокная дифференцировка Th27 и регуляторных Т-клеток, опосредованная ретиноевой кислотой. Science (2007) 317(5835):256–60. doi:10.1126/science.1145697
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
129. Dixon KO, van der Kooij SW, Vignali DA, van Kooten C. Толерогенные дендритные клетки человека продуцируют IL-35 в отсутствие других членов семейства IL-12. Eur J Immunol (2015) 45(6):1736–47. doi:10.1002/eji.201445217
Толерогенные дендритные клетки человека продуцируют IL-35 в отсутствие других членов семейства IL-12. Eur J Immunol (2015) 45(6):1736–47. doi:10.1002/eji.201445217
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
130. Haller S, Duval A, Migliorini R, Stevanin M, Mack V, Acha-Orbea H. CD8alpha(+) дендритные клетки, продуцирующие интерлейкин-35, приобретают толерогенное состояние и регулируют функцию Т-клеток. Фронт Иммунол (2017) 8:98. doi:10.3389/fimmu.2017.00098
Полный текст CrossRef | Google Scholar
131. Collison LW, Workman CJ, Kuo TT, Boyd K, Wang Y, Vignali KM, et al. Ингибирующий цитокин IL-35 способствует регуляторной функции Т-клеток. Nature (2007) 450(7169):566–9. doi:10.1038/nature06306
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
132. Niedbala W, Wei XQ, Cai B, Hueber AJ, Leung BP, McInnes IB, et al. IL-35 представляет собой новый цитокин с терапевтическим действием против индуцированного коллагеном артрита за счет экспансии регуляторных Т-клеток и подавления клеток Th27. Eur J Immunol (2007) 37(11):3021–9. doi:10.1002/eji.200737810
Eur J Immunol (2007) 37(11):3021–9. doi:10.1002/eji.200737810
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
133. Wang RX, Yu CR, Dambuza IM, Mahdi RM, Dolinska MB, Sergeev YV, et al. Интерлейкин-35 индуцирует регуляторные В-клетки, подавляющие аутоиммунное заболевание. Nat Med (2014) 20(6):633–41. doi:10.1038/nm.3554
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
134. Shen P, Roch T, Lampropoulou V, O’Connor RA, Stervbo U, Hilgenberg E, et al. В-клетки, продуцирующие ИЛ-35, являются критическими регуляторами иммунитета при аутоиммунных и инфекционных заболеваниях. Природа (2014) 507(7492):366–70. doi:10.1038/nature12979
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
135. Guan SY, Leng RX, Khan MI, Qureshi H, Li XP, Ye DQ, et al. Интерлейкин-35: потенциальный терапевтический агент для аутоиммунных заболеваний. Воспаление (2017) 40(1):303–10. doi:10.1007/s10753-016-0453-9
doi:10.1007/s10753-016-0453-9
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
136. Уайтхед Г.С., Уилсон Р.Х., Накано К., Берч Л.Х., Накано Х., Кук Д.Н. Продукция IL-35 индуцируемыми костимуляторами (ICOS)-позитивными регуляторными Т-клетками обращает вспять установленное IL-17-зависимое аллергическое заболевание дыхательных путей. J Allergy Clin Immunol (2012) 129(1):207–15.e1–5. doi:10.1016/j.jaci.2011.08.009
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
137. Kohli K, Janssen A, Förster R. Плазмацитоидные дендритные клетки индуцируют толерантность преимущественно за счет доставки антигена в лимфатические узлы. Eur J Immunol (2016) 46(11):2659–68. doi:10.1002/eji.201646359
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
138. Manches O, Munn D, Fallahi A, Lifson J, Chaperot L, Plumas J, et al. ВИЧ-активированные плазмацитоидные ДК человека индуцируют Tregs через механизм, зависимый от индоламин-2,3-диоксигеназы. J Clin Invest (2008) 118(10):3431–9. doi:10.1172/jci34823
J Clin Invest (2008) 118(10):3431–9. doi:10.1172/jci34823
Резюме PubMed | Полный текст перекрестной ссылки | Google Scholar
139. Манке К., Джонсон Т.С., Ринг С., Энк А.Х. Толерогенные дендритные клетки и регуляторные Т-клетки: двусторонняя связь. J Dermatol Sci (2007) 46(3):159–67. doi:10.1016/j.jdermsci.2007.03.002
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
140. Yan J, Liu B, Shi Y, Qi H. Независимая от MHC класса II супрессивная адгезия дендритных клеток регуляторными Т-клетками in vivo. J Exp Med (2017) 214(2):319–26. doi:10.1084/jem.20160629
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
141. Chen J, Ganguly A, Mucsi AD, Meng J, Yan J, Detampel P, et al. Сильная адгезия регуляторных Т-клеток вызывает поляризацию цитоскелета дендритных клеток и контактно-зависимую летаргию. J Exp Med (2017) 214(2):327–38. doi:10.1084/jem.20160620
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
142. Clausen BE, Stoitzner P. Функциональная специализация субпопуляций дендритных клеток кожи в регуляции ответов Т-клеток. Фронт Иммунол (2015) 6:534. doi:10.3389/fimmu.2015.00534
Clausen BE, Stoitzner P. Функциональная специализация субпопуляций дендритных клеток кожи в регуляции ответов Т-клеток. Фронт Иммунол (2015) 6:534. doi:10.3389/fimmu.2015.00534
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
143. Идьярто Б.З., Хейли К., Ортнер Д., Бобр А., Джерами-Неджад М., Эдельсон Б.Т. и др. Субпопуляции резидентных в коже мышиных дендритных клеток способствуют различному и противоположному ответу антиген-специфических Т-хелперных клеток. Иммунитет (2011) 35(2):260–72. doi:10.1016/j.immuni.2011.06.005
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
144. Nakajima S, Igyártó BZ, Honda T, Egawa G, Otsuka A, Hara-Chikuma M, et al. Клетки Лангерганса играют решающую роль в эпикожной сенсибилизации белковым антигеном посредством передачи сигналов стромального лимфопоэтинового рецептора тимуса. J Allergy Clin Immunol (2012) 129(4):1048–55.e6. doi:10.1016/j.jaci.2012.01.063
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
145. Igyarto BZ, Jenison MC, Dudda JC, Roers A, Müller W, Koni PA, et al. Клетки Лангерганса подавляют реакции контактной гиперчувствительности за счет родственного взаимодействия с CD4 и IL-10, полученного из клеток Лангерганса. J Immunol (2009) 183(8):5085–93. doi:10.4049/jimmunol.04
Igyarto BZ, Jenison MC, Dudda JC, Roers A, Müller W, Koni PA, et al. Клетки Лангерганса подавляют реакции контактной гиперчувствительности за счет родственного взаимодействия с CD4 и IL-10, полученного из клеток Лангерганса. J Immunol (2009) 183(8):5085–93. doi:10.4049/jimmunol.04
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
146. Гомес де Агуэро М., Вокансон М., Хачини-Рачинель Ф., Тайлардет М., Спарвассер Т., Киссенпфенниг А. и соавт. Клетки Лангерганса защищают мышей от аллергического контактного дерматита, повышая толерантность к CD8(+) Т-клеткам и активируя регуляторные Т-клетки Foxp3(+). J Clin Invest (2012) 122(5):1700–11. doi:10.1172/jci59725
Резюме PubMed | Полный текст перекрестной ссылки | Google Scholar
147. Kautz-Neu K, Noordegraaf M, Dinges S, Bennett CL, John D, Clausen BE, et al. Клетки Лангерганса являются негативными регуляторами анти- Ответ Leishmania . J Exp Med (2011) 208(5):885–91. doi:10.1084/jem.20102318
doi:10.1084/jem.20102318
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
148. Strandt H, Pinheiro DF, Kaplan DH, Wirth D, Gratz IK, Hammerl P, et al. Экспрессия неоантигена в стационарных клетках Лангерганса индуцирует толерантность ЦТЛ. J Immunol (2017) 199(5):1626–34. doi:10.4049/jimmunol.1602098
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
149. Henri S, Poulin LF, Tamoutounour S, Ardouin L, Guilliams M, de Bovis B, et al. CD207 + CD103 + Дермальные дендритные клетки перекрестно представляют антигены, полученные из кератиноцитов, независимо от присутствия клеток Лангерганса. J Exp Med (2010) 207(1):189–206. doi:10.1084/jem.200
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
150. Мерфи Т.Л., Туссиванд Р., Мерфи К.М. Специфичность благодаря сотрудничеству: взаимодействия BATF-IRF контролируют иммунорегуляторные сети. Nat Rev Immunol (2013) 13(7):499–509. дои: 10.1038/nri3470
дои: 10.1038/nri3470
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
151. Chu CC, Ali N, Karagiannis P, Di Meglio P, Skowera A, Napolitano L, et al. Резидентные CD141 (BDCA3) + дендритные клетки кожи человека продуцируют IL-10 и индуцируют регуляторные Т-клетки, которые подавляют воспаление кожи. J Exp Med (2012) 209(5):935–45. doi:10.1084/jem.20112583
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
152. Mollah SA, Dobrin JS, Feder RE, Tse SW, Matos IG, Cheong C, et al. Зависимость от Flt3L помогает определить нехарактерное подмножество мышиных кожных дендритных клеток. J Invest Dermatol (2014) 134(5):1265–75. doi:10.1038/jid.2013.515
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
153. Китадзима М., Циглер С.Ф. Передний край: выявление субпопуляции тимусных стромальных лимфопоэтин-чувствительных дендритных клеток, критической для инициации контактной гиперчувствительности 2 типа. J Immunol (2013) 191(10):4903–7. doi:10.4049/jimmunol.1302175
J Immunol (2013) 191(10):4903–7. doi:10.4049/jimmunol.1302175
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
154. Kumamoto Y, Linehan M, Weinstein JS, Laidlaw BJ, Craft JE, Iwasaki A. CD301b+ дермальные дендритные клетки управляют Т-хелперным 2-клеточным иммунитетом. Иммунитет (2013) 39(4):733–43. doi:10.1016/j.immuni.2013.08.029
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
155. Wohn C, Ober-Blöbaum JL, Haak S, Pantelyushin S, Cheong C, Zahner SP, et al. Обычные дендритные клетки Лангерина (neg) продуцируют IL-23, который стимулирует образование псориатических бляшек у мышей. Proc Natl Acad Sci U S A (2013) 110(26):10723–8. doi:10.1073/pnas.1307569110
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
156. Йошики Р., Кабашима К., Хонда Т., Накамизо С., Савада Ю., Сугита К. и др. IL-23 из клеток Лангерганса необходим для развития имиквимод-индуцированного псориазоподобного дерматита путем индукции γδ-Т-клеток, продуцирующих IL-17A. J Invest Dermatol (2014) 134(7):1912–21. doi:10.1038/jid.2014.98
J Invest Dermatol (2014) 134(7):1912–21. doi:10.1038/jid.2014.98
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
157. Танака Ю., Нагашима Х., Бандо К., Лу Л., Одзаки А., Морита Ю. и др. Оральные CD103(-)CD11b(+) классические дендритные клетки презентируют подъязычный антиген и индуцируют регуляторные Т-клетки Foxp3(+) в дренирующих лимфатических узлах. Mucosal Immunol (2017) 10(1):79–90. doi:10.1038/mi.2016.46
Полный текст CrossRef | Google Scholar
158. Баратин М., Форей С., Демария О., Хаббеддин М., Поллет Э., Маурицио Дж. и др. Гомеостатическая передача сигналов NF-κB в стационарных мигрирующих дендритных клетках регулирует иммунный гомеостаз и толерантность. Иммунитет (2015) 42(4):627–39. doi:10.1016/j.immuni.2015.03.003
Полный текст CrossRef | Google Scholar
159. Алиберти Дж. Иммунитет и толерантность, индуцированные дендритными клетками слизистой оболочки кишечника. Медиаторы Inflamm (2016) 2016:3104727. doi:10.1155/2016/3104727
doi:10.1155/2016/3104727
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
160. Бекиарис В., Перссон Э.К., Агаче В.В. Кишечные дендритные клетки в регуляции слизистого иммунитета. Immunol Rev (2014) 260(1):86–101. doi:10.1111/imr.12194
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
161. Пабст О., Хербранд Х., Фридрихсен М., Велага С., Дорш М., Берхардт Г. и др. Адаптация солитарной лимфоидной ткани кишечника в ответ на передачу сигналов микробиотой и хемокиновым рецептором CCR7. J Immunol (2006) 177(10):6824–32. doi:10.4049/jimmunol.177.10.6824
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
162. Niess JH, Brand S, Gu X, Landsman L, Jung S, McCormick BA, et al. CX3CR1-опосредованный доступ дендритных клеток к просвету кишечника и бактериальный клиренс. Наука (2005) 307(5707):254–8. doi:10.1126/science.1102901
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
163. McDole JR, Wheeler LW, McDonald KG, Wang B, Konjufca V, Knoop KA, et al. Бокаловидные клетки доставляют люминальный антиген к CD103 + дендритных клеток в тонкой кишке. Природа (2012) 483(7389):345–9. doi:10.1038/nature10863
McDole JR, Wheeler LW, McDonald KG, Wang B, Konjufca V, Knoop KA, et al. Бокаловидные клетки доставляют люминальный антиген к CD103 + дендритных клеток в тонкой кишке. Природа (2012) 483(7389):345–9. doi:10.1038/nature10863
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
164. Farache J, Koren I, Milo I, Gurevich I, Kim KW, Zigmond E, et al. Люминальные бактерии рекрутируют CD103 + дендритных клеток в кишечный эпителий для отбора проб бактериальных антигенов для презентации. Иммунитет (2013) 38(3):581–95. doi:10.1016/j.immuni.2013.01.009
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
165. Cerovic V, Houston SA, Scott CL, Aumeunier A, Yrlid U, Mowat AM, et al. Дендритные клетки CD103(-) кишечника мигрируют в лимфу и первичные эффекторные Т-клетки. Mucosal Immunol (2013) 6(1):104–13. doi:10.1038/mi.2012.53
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
166. Denning TL, Norris BA, Medina-Contreras O, Manicassamy S, Geem D, Madan R, et al. Функциональная специализация интестинальных субпопуляций дендритных клеток и макрофагов, которые контролируют ответы Th27 и регуляторных Т-клеток, зависит от соотношения Т-клетки/АРС, источника мышиного штамма и региональной локализации. J Immunol (2011) 187(2):733–47. doi:10.4049/jimmunol.1002701
Denning TL, Norris BA, Medina-Contreras O, Manicassamy S, Geem D, Madan R, et al. Функциональная специализация интестинальных субпопуляций дендритных клеток и макрофагов, которые контролируют ответы Th27 и регуляторных Т-клеток, зависит от соотношения Т-клетки/АРС, источника мышиного штамма и региональной локализации. J Immunol (2011) 187(2):733–47. doi:10.4049/jimmunol.1002701
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
167. Fujimoto K, Karuppuchamy T, Takemura N, Shimohigoshi M, Machida T, Haseda Y, et al. Новая субпопуляция CD103 + CD8альфа + дендритных клеток в тонкой кишке экспрессирует TLR3, TLR7 и TLR9 и индуцирует ответ Th2 и активность CTL. J Immunol (2011) 186(11):6287–95. doi:10.4049/jimmunol.1004036
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
168. Persson EK, Uronen-Hansson H, Semmrich M, Rivollier A, Hägerbrand K, Marsal J, et al. Зависимые от фактора транскрипции IRF4 дендритные клетки CD103(+)CD11b(+) управляют дифференцировкой Т-хелперов 17 слизистой оболочки. Иммунитет (2013) 38(5):958–69. doi:10.1016/j.immuni.2013.03.009
Иммунитет (2013) 38(5):958–69. doi:10.1016/j.immuni.2013.03.009
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
169. Скотт К.Л., Оменье А.М., Моват А.М. Кишечные CD103 + дендритных клеток: основные регуляторы толерантности? Trends Immunol (2011) 32(9):412–9. doi:10.1016/j.it.2011.06.003
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
170. Zeng R, Bscheider M, Lahl K, Lee M, Butcher EC. Генерация и транскрипционное программирование дендритных клеток кишечника: важная роль ретиноевой кислоты. Mucosal Immunol (2016) 9(1):183–93. doi:10.1038/mi.2015.50
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
171. Фукая Т., Такаги Х., Сато Ю., Сато К., Эйдзуми К., Тая Х. и др. Решающая роль B7-h2 и B7-DC, экспрессируемых на дендритных клетках мезентериальных лимфатических узлов, в образовании антиген-специфических CD4 + Foxp3 + регуляторные Т-клетки в установлении оральной толерантности. Кровь (2010) 116(13):2266–76. doi:10.1182/blood-2009-10-250472
Кровь (2010) 116(13):2266–76. doi:10.1182/blood-2009-10-250472
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
172. Shiokawa A, Kotaki R, Takano T, Nakajima-Adachi H, Hachimura S. Брыжеечный лимфатический узел CD11b(-) CD103(+) PD-L1(High) дендритные клетки сильно индуцируют регуляторные Т-клетки. Иммунология (2017) 152(1):52–64. doi:10.1111/imm.12747
Полный текст CrossRef | Академия Google
173. Букар-Журден М., Куглер Д., Эндейл Аханда М.Л., Этот С., Де Калисто Дж., Чжан А. и соавт. Экспрессия интегрина β8 и активация TGF-β дендритными клетками кишечника определяются как тканевым микроокружением, так и клеточным происхождением. J Immunol (2016) 197(5):1968–78. doi:10.4049/jimmunol.1600244
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
174. Laffont S, Siddiqui KR, Powrie F. Воспаление кишечника устраняет толерогенные свойства MLN CD103 + дендритных клеток. Eur J Immunol (2010) 40(7):1877–83. doi:10.1002/eji.2007
Eur J Immunol (2010) 40(7):1877–83. doi:10.1002/eji.2007
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
175. Fallarino F, Grohmann U, You S, McGrath BC, Cavener DR, Vacca C, et al. Комбинированные эффекты триптофанового голодания и катаболитов триптофана подавляют дзета-цепь Т-клеточного рецептора и индуцируют регуляторный фенотип в наивных Т-клетках. J Immunol (2006) 176(11):6752–61. doi:10.4049/jиммунол.176.11.6752
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
176. Zelante T, Iannitti RG, Cunha C, De Luca A, Giovannini G, Pieraccini G, et al. Катаболиты триптофана из микробиоты взаимодействуют с арильными углеводородными рецепторами и уравновешивают реактивность слизистой оболочки через интерлейкин-22. Иммунитет (2013) 39(2):372–85. doi:10.1016/j.immuni.2013.08.003
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
177. Klotz L, Dani I, Edenhofer F, Nolden L, Evert B, Paul B, et al. Гамма-контроль рецептора, активируемого пролифератором пероксисом, функции дендритных клеток способствует развитию анергии CD4+ Т-клеток. J Immunol (2007) 178(4):2122–31. doi:10.4049/jimmunol.178.4.2122
Гамма-контроль рецептора, активируемого пролифератором пероксисом, функции дендритных клеток способствует развитию анергии CD4+ Т-клеток. J Immunol (2007) 178(4):2122–31. doi:10.4049/jimmunol.178.4.2122
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
178. Дельгадо М., Гонсалес-Рей Э., Ганеа Д. Нейропептид вазоактивный интестинальный пептид генерирует толерогенные дендритные клетки. J Immunol (2005) 175(11):7311–24. doi:10.4049/jimmunol.175.11.7311
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
179. Чорни А., Гонсалес-Рей Э., Фернандес-Мартин А., Позо Д., Ганеа Д., Дельгадо М. Вазоактивный кишечный пептид индуцирует регуляторные дендритные клетки с терапевтическим действием при аутоиммунных расстройствах. Proc Natl Acad Sci U S A (2005) 102(38):13562–7. doi:10.1073/pnas.0504484102
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Перекрестная презентация вирусного иммунитета и самопереносимости
Перекрестная презентация вирусного иммунитета и самопереносимости
Скачать PDF
Скачать PDF
Природа Обзоры Иммунология том 1 , страницы 126–134 (2001 г.)Процитировать эту статью
Ключевые точки
Abstract
Т-лимфоциты распознают пептидные антигены, представленные молекулами класса I и класса II, кодируемыми главным комплексом гистосовместимости (MHC). Классические исследования презентации антигена показали, что молекулы MHC класса I представляют собой пептиды, полученные из белков, синтезируемых внутри клетки, тогда как молекулы MHC класса II представляют собой экзогенные белки, захваченные из окружающей среды. Появляющиеся данные указывают, однако, что дендритные клетки обладают специализированной способностью процессировать экзогенные антигены в пути MHC класса I. Эта функция, известная как перекрестная презентация, обеспечивает иммунную систему важным механизмом для выработки иммунитета к вирусам и толерантности к себе.
Классические исследования презентации антигена показали, что молекулы MHC класса I представляют собой пептиды, полученные из белков, синтезируемых внутри клетки, тогда как молекулы MHC класса II представляют собой экзогенные белки, захваченные из окружающей среды. Появляющиеся данные указывают, однако, что дендритные клетки обладают специализированной способностью процессировать экзогенные антигены в пути MHC класса I. Эта функция, известная как перекрестная презентация, обеспечивает иммунную систему важным механизмом для выработки иммунитета к вирусам и толерантности к себе.
Основной
Т-лимфоциты можно разделить на две субпопуляции на основе их экспрессии маркеров клеточной поверхности CD4 и CD8. Подмножество CD4 + в первую очередь отвечает за оказание помощи другим иммунным клеткам посредством прямых межклеточных взаимодействий или секреции цитокинов. Сотрудничество с В-клетками, например, приводит к ПЕРЕКЛЮЧЕНИЮ ИЗОТИПА и увеличению выработки антител. CD4 + Т-клетки также играют важную роль в индукции воспалительных реакций и генерации CD8 + Т-клеточный иммунитет. Эффективное праймирование Т-клеток CD8 + приводит к их развитию в зрелые цитотоксические Т-лимфоциты (ЦТЛ), наиболее известные своей способностью убивать инфицированные вирусом клетки. В этом обзоре для простоты мы будем называть Т-клетки CD4 + «вспомогательными Т-клетками», а Т-клетки CD8 + — «ЦТЛ».
CD4 + Т-клетки также играют важную роль в индукции воспалительных реакций и генерации CD8 + Т-клеточный иммунитет. Эффективное праймирование Т-клеток CD8 + приводит к их развитию в зрелые цитотоксические Т-лимфоциты (ЦТЛ), наиболее известные своей способностью убивать инфицированные вирусом клетки. В этом обзоре для простоты мы будем называть Т-клетки CD4 + «вспомогательными Т-клетками», а Т-клетки CD8 + — «ЦТЛ».
Хелперные Т-клетки и ЦТЛ используют свои Т-клеточные рецепторы для распознавания пептидных антигенов, представленных молекулами, кодируемыми MHC. Хелперные Т-клетки распознают пептиды, представленные молекулами МНС класса II, тогда как ЦТЛ ограничены молекулами МНС класса I. Это предпочтение различных классов молекул MHC связано с разграничением путей процессинга антигенов, которые поставляют пептиды. Молекулы MHC класса II обычно представляют собой пептиды, полученные из экзогенных антигенов, которые проникают в клетку эндоцитарным путем, тогда как молекулы MHC класса I представляют антигены эндогенного происхождения, обычно синтезируемые внутри клетки, представляющей антиген (рис. 1a,b). Нацеливание ЦТЛ на эндогенно синтезированные антигены важно, поскольку оно гарантирует, что вирусспецифические ЦТЛ убивают только те клетки, которые непосредственно инфицированы вирусом. Клетки-свидетели, которые просто эндоцитируют вирусный дебрис из инфицированных соседних клеток, не будут процессировать этот антиген в путь MHC класса I и, следовательно, не будут мишенью для ЦТЛ.
1a,b). Нацеливание ЦТЛ на эндогенно синтезированные антигены важно, поскольку оно гарантирует, что вирусспецифические ЦТЛ убивают только те клетки, которые непосредственно инфицированы вирусом. Клетки-свидетели, которые просто эндоцитируют вирусный дебрис из инфицированных соседних клеток, не будут процессировать этот антиген в путь MHC класса I и, следовательно, не будут мишенью для ЦТЛ.
и | Молекулы MHC класса I представляют собой пептиды, которые в основном происходят из эндогенно синтезированных белков собственного или патогенного происхождения. Эти белки расщепляются протеасомами до пептидов, а затем транспортируются через транспортеры молекул, обрабатывающих антиген (TAP), в эндоплазматический ретикулум для загрузки молекул MHC класса I. б | Напротив, молекулы MHC класса II представляют белки, которые проникают в клетку эндоцитарным путем. Во время созревания молекул МНС класса II предотвращается их связывание с эндогенными антигенами в эндоплазматическом ретикулуме за счет ассоциации с инвариантной цепью (Ii). Комплексы инвариантная цепь-MHC класса II (MHC II-Ii) перемещаются через аппарат Гольджи в компартмент MIIC/CIIV, где инвариантная цепь деградирует до CLIP (для пептида с инвариантной цепью, ассоциированного с классом II). Затем CLIP удаляют из комплексов CLIP-MHC класса II (MHC-CLIP) и заменяют антигенным пептидом. с | Дендритные клетки могут эндоцитировать антигены из других клеток и перекрестно презентовать их CD8 + цитотоксическим Т-лимфоцитам. TAP-зависимость такой перекрестной презентации 44,52 указывает на то, что она включает отклонение клеточных антигенов в обычный путь МНС класса I, хотя механизм(ы) этого отклонения пока не определен. В большинстве случаев эти антигены также будут процессироваться в пути представления MHC класса II для распознавания CD4 9.0878 + хелперных Т-клеток.
Во время созревания молекул МНС класса II предотвращается их связывание с эндогенными антигенами в эндоплазматическом ретикулуме за счет ассоциации с инвариантной цепью (Ii). Комплексы инвариантная цепь-MHC класса II (MHC II-Ii) перемещаются через аппарат Гольджи в компартмент MIIC/CIIV, где инвариантная цепь деградирует до CLIP (для пептида с инвариантной цепью, ассоциированного с классом II). Затем CLIP удаляют из комплексов CLIP-MHC класса II (MHC-CLIP) и заменяют антигенным пептидом. с | Дендритные клетки могут эндоцитировать антигены из других клеток и перекрестно презентовать их CD8 + цитотоксическим Т-лимфоцитам. TAP-зависимость такой перекрестной презентации 44,52 указывает на то, что она включает отклонение клеточных антигенов в обычный путь МНС класса I, хотя механизм(ы) этого отклонения пока не определен. В большинстве случаев эти антигены также будут процессироваться в пути представления MHC класса II для распознавания CD4 9.0878 + хелперных Т-клеток. (MIIC, загрузочное отделение MHC II; CIIV, везикулы MHC II.)
(MIIC, загрузочное отделение MHC II; CIIV, везикулы MHC II.)
Изображение с полным размером
Хотя ЦТЛ выполняют очень важную функцию уничтожения клеток, инфицированных вирусами или внутриклеточными бактериями, их способность разрушать ткани-мишени имеет свою цену. ЦТЛ со специфичностью к аутоантигенам могут иногда атаковать нормальные ткани хозяина и вызывать аутоиммунитет 1,2 . По этой причине очень важно поддерживать жесткий контроль над образованием эффекторных ЦТЛ, максимизируя их способность бороться с патогенами и сводя к минимуму их аутоиммунный потенциал. Хотя это в первую очередь достигается во время ТИМИЧЕСКОЙ СЕЛЕКЦИИ, при которой удаляется большинство аутореактивных Т-клеток, важны и другие элементы управления. Самореактивные ЦТЛ могут, например, регулироваться механизмами ПЕРИФЕРИЧЕСКОЙ ДОПУСТИМОСТИ 3,4,5,6,7 , а также контрольными точками, препятствующими их созреванию в отсутствие сигналов от хелперных Т-клеток 8,9,10 (рис. 2). В этом обзоре мы рассмотрим роль кросс-презентации в формировании иммунитета ЦТЛ (кросс-прайминг) и в поддержании аутотолерантности (кросс-толерантность).
2). В этом обзоре мы рассмотрим роль кросс-презентации в формировании иммунитета ЦТЛ (кросс-прайминг) и в поддержании аутотолерантности (кросс-толерантность).
и | Для примирования наивных цитотоксических Т-лимфоцитов (ЦТЛ) дендритным клеткам (ДК) сначала требуется сигнал, зависящий от хелперных Т-клеток, через CD40/CD40L (CD154) (ссылки 8–10). б | Такое CD40-зависимое лицензирование, однако, не всегда необходимо, поскольку сигналы, полученные от патогенов, такие как вирусные продукты, также могут лицензировать DC 8 . В любом случае контроллеры домена должны быть лицензированы, прежде чем они смогут запускать наивные CTL. При отсутствии лицензирования наивные CTL не могут быть запущены DC ( c ).
Полноразмерное изображение
Что такое перекрестное представление?
Наивные Т-клетки рециркулируют во вторичном лимфоидном компартменте, перемещаясь между лимфатическими узлами, кровью и селезенкой. Эта ограниченная картина рециркуляции означает, что многие патогены попадают в организм в местах, где они не будут напрямую сталкиваться с наивными Т-клетками. Для своего первоначального столкновения с антигеном Т-клетки полагаются на дендритные клетки (ДК), чтобы захватить продукты патогена из места инфекции и транспортировать их в дренирующие лимфатические узлы. Таким образом, наивные Т-клетки могут сканировать весь организм на наличие патогенов, просто сканируя антигены, представленные на ДК, которые мигрируют во вторичный лимфоидный компартмент. Помимо транспорта антигена, ДК экспрессируют костимулирующие молекулы, которые позволяют им активировать наивные Т-клетки, классифицируя их как профессиональные антигенпрезентирующие клетки (АРС). Итак, как только происходит специфическое столкновение между Т-клеткой и DC, Т-клетки активируются, пролиферируют и дифференцируются, а затем способны проникать в периферические ткани для борьбы с вторгшимся патогеном.
Эта ограниченная картина рециркуляции означает, что многие патогены попадают в организм в местах, где они не будут напрямую сталкиваться с наивными Т-клетками. Для своего первоначального столкновения с антигеном Т-клетки полагаются на дендритные клетки (ДК), чтобы захватить продукты патогена из места инфекции и транспортировать их в дренирующие лимфатические узлы. Таким образом, наивные Т-клетки могут сканировать весь организм на наличие патогенов, просто сканируя антигены, представленные на ДК, которые мигрируют во вторичный лимфоидный компартмент. Помимо транспорта антигена, ДК экспрессируют костимулирующие молекулы, которые позволяют им активировать наивные Т-клетки, классифицируя их как профессиональные антигенпрезентирующие клетки (АРС). Итак, как только происходит специфическое столкновение между Т-клеткой и DC, Т-клетки активируются, пролиферируют и дифференцируются, а затем способны проникать в периферические ткани для борьбы с вторгшимся патогеном.
Для ответов, ограниченных MHC класса II, которые направлены на экзогенные антигены, легко представить, как DC могут захватывать продукты патогенов и представлять их Т-хелперным Т-клеткам, ограниченным MHC класса II, в дренирующих лимфатических узлах. Для ответов, ограниченных MHC класса I, которые, как обычно полагают, нацелены на антигены, которые синтезируются в клетке, представляющей антиген, становится немного сложнее описать роль DC. В простейшем случае ДК сами могут быть инфицированы патогеном, что позволяет ограничивать презентацию антигенов, происходящих от патогена, по MHC класса I. Однако известно, что не все патогены инфицируют ДК, а инфицированные патогенами ДК часто функционально нарушены 11,12,13,14,15,16,17 . Следовательно, как предположил несколько лет назад Bevan 18 , может быть необходим экзогенный путь процессинга MHC class I-рестриктированных антигенов внутри DCs. На самом деле, гипотеза Бевана исходит из его открытия такого пути праймирования иммунитета ЦТЛ 19 . Он показал, что белковые антигены (в данном случае минорные антигены гистосовместимости), которые были синтезированы в одной клетке, могут быть захвачены APC как экзогенные антигены, обработаны в пути презентации антигена MHC класса I и использованы для запуска иммунитета ЦТЛ.
Для ответов, ограниченных MHC класса I, которые, как обычно полагают, нацелены на антигены, которые синтезируются в клетке, представляющей антиген, становится немного сложнее описать роль DC. В простейшем случае ДК сами могут быть инфицированы патогеном, что позволяет ограничивать презентацию антигенов, происходящих от патогена, по MHC класса I. Однако известно, что не все патогены инфицируют ДК, а инфицированные патогенами ДК часто функционально нарушены 11,12,13,14,15,16,17 . Следовательно, как предположил несколько лет назад Bevan 18 , может быть необходим экзогенный путь процессинга MHC class I-рестриктированных антигенов внутри DCs. На самом деле, гипотеза Бевана исходит из его открытия такого пути праймирования иммунитета ЦТЛ 19 . Он показал, что белковые антигены (в данном случае минорные антигены гистосовместимости), которые были синтезированы в одной клетке, могут быть захвачены APC как экзогенные антигены, обработаны в пути презентации антигена MHC класса I и использованы для запуска иммунитета ЦТЛ. Bevan назвал это «кросс-праймированием», а мы впоследствии определили процессинг антигена, связанный с кросс-праймированием, как «кросс-презентацию». Перекрестная презентация ранее использовалась в литературе в двух контекстах. В первом случае это просто означало процессинг экзогенных антигенов в путь МНС класса I. Второе определение относится к захвату и представлению ассоциированного с клеткой антигена в путях МНС класса I или МНС класса II. Оба определения имеют свои достоинства, но пришло время выбрать, какое из них следует использовать. Наиболее распространенная точка зрения, по-видимому, заключается в том, что перекрестная презентация описывает процессинг экзогенного антигена в пути МНС класса I. В этом случае кросс-прайминг и кросс-толерантность могут действительно использоваться только в отношении ответа ЦТЛ, а не хелперных Т-клеток, что является некоторым ограничением, но приемлемо. Как обсуждается ниже, это свойство в первую очередь ограничено подмножеством контроллеров домена 9.
Bevan назвал это «кросс-праймированием», а мы впоследствии определили процессинг антигена, связанный с кросс-праймированием, как «кросс-презентацию». Перекрестная презентация ранее использовалась в литературе в двух контекстах. В первом случае это просто означало процессинг экзогенных антигенов в путь МНС класса I. Второе определение относится к захвату и представлению ассоциированного с клеткой антигена в путях МНС класса I или МНС класса II. Оба определения имеют свои достоинства, но пришло время выбрать, какое из них следует использовать. Наиболее распространенная точка зрения, по-видимому, заключается в том, что перекрестная презентация описывает процессинг экзогенного антигена в пути МНС класса I. В этом случае кросс-прайминг и кросс-толерантность могут действительно использоваться только в отношении ответа ЦТЛ, а не хелперных Т-клеток, что является некоторым ограничением, но приемлемо. Как обсуждается ниже, это свойство в первую очередь ограничено подмножеством контроллеров домена 9. 0878 20,21 . Это имеет смысл, поскольку неизбирательная способность всех клеток презентировать экзогенные антигены в пути МНС класса I (перекрестная презентация) потенциально нацелена на неинфицированные клетки ткани, которые эндоцитозировали вирусный дебрис, для разрушения вирус-специфическими ЦТЛ. Таким образом, DC были наделены особым свойством, позволяющим им перекрестно презентовать антигены, полученные из других клеток, для стимуляции наивных CTL (Fig. 1c).
0878 20,21 . Это имеет смысл, поскольку неизбирательная способность всех клеток презентировать экзогенные антигены в пути МНС класса I (перекрестная презентация) потенциально нацелена на неинфицированные клетки ткани, которые эндоцитозировали вирусный дебрис, для разрушения вирус-специфическими ЦТЛ. Таким образом, DC были наделены особым свойством, позволяющим им перекрестно презентовать антигены, полученные из других клеток, для стимуляции наивных CTL (Fig. 1c).
Идентификация кросс-праймера APC
Несмотря на открытие кросс-прайминга в середине 1970-х годов 19 , фенотип APC, ответственный за этот процесс, оставался неуловимым в течение четверти века. Хотя эта клетка явно имела костномозговое происхождение 22,23 и профессиональный APC (т.е. способный активировать наивные Т-клетки) 18 , исследователи не смогли напрямую идентифицировать конкретное подмножество, ответственное за перекрестное представление. Несколько групп представили доказательства того, что ДК, макрофаги и даже В-клетки способны перекрестно презентировать антигены in vitro при определенных обстоятельствах 24,25,26,27,28,29 , но in vivo попытки выделить перекрестно представленный APC 30 не принесли большого успеха. Однако недавно Bevan и соавт. 21 изучили три известных подмножества DC селезенки (Table 1) и предоставили первые доказательства того, что CD8 + DCs ответственны за кросс-прайминг in vivo . В этих исследованиях мышам вводили клетки, несущие овальбумин (OVA) (известно, что они индуцируют ЦТЛ путем перекрестного праймирования 31 ), оставляли на 14 часов, чтобы их DC могли захватить и процессировать антиген, а затем субпопуляции DC выделяли из селезенки и исследовали in vitro на их способность активировать OVA-специфические ЦТЛ. Только субпопуляция CD8 + DC перекрестно представляла OVA в этих условиях, несмотря на доказательства захвата антигена всеми тремя субпопуляциями DC.
Несколько групп представили доказательства того, что ДК, макрофаги и даже В-клетки способны перекрестно презентировать антигены in vitro при определенных обстоятельствах 24,25,26,27,28,29 , но in vivo попытки выделить перекрестно представленный APC 30 не принесли большого успеха. Однако недавно Bevan и соавт. 21 изучили три известных подмножества DC селезенки (Table 1) и предоставили первые доказательства того, что CD8 + DCs ответственны за кросс-прайминг in vivo . В этих исследованиях мышам вводили клетки, несущие овальбумин (OVA) (известно, что они индуцируют ЦТЛ путем перекрестного праймирования 31 ), оставляли на 14 часов, чтобы их DC могли захватить и процессировать антиген, а затем субпопуляции DC выделяли из селезенки и исследовали in vitro на их способность активировать OVA-специфические ЦТЛ. Только субпопуляция CD8 + DC перекрестно представляла OVA в этих условиях, несмотря на доказательства захвата антигена всеми тремя субпопуляциями DC. Shortman и коллеги 20 позже сообщили, что растворимый OVA, введенный внутривенно, также перекрестно представлен CD8 + ДК. Опять же, все три подмножества селезеночных DC захватили OVA, но только подмножество CD8 + перекрестно представило его CTL. Интересно, что двойные отрицательные ДК (CD8 — CD4 — ) могут быть индуцированы к перекрестному представлению OVA при воздействии бактериального продукта, липополисахарида, хотя их способность к перекрестному представлению была низкой по сравнению с CD8 + . Подмножество постоянного тока.
Shortman и коллеги 20 позже сообщили, что растворимый OVA, введенный внутривенно, также перекрестно представлен CD8 + ДК. Опять же, все три подмножества селезеночных DC захватили OVA, но только подмножество CD8 + перекрестно представило его CTL. Интересно, что двойные отрицательные ДК (CD8 — CD4 — ) могут быть индуцированы к перекрестному представлению OVA при воздействии бактериального продукта, липополисахарида, хотя их способность к перекрестному представлению была низкой по сравнению с CD8 + . Подмножество постоянного тока.
Полная таблица
Итак, почему же потребовалось так много времени, чтобы идентифицировать CD8 + DC как APC перекрестного запуска? Во-первых, CD8 + DC сами по себе были идентифицированы как подмножество DC только в 1992 г. (Ref. 32), они не были обнаружены до этого из-за их чувствительности к процедурам выделения. Во-вторых, способность этого подмножества захватывать антигены in vivo и затем перекрестно презентировать их in vitro очень неэффективна 21 . Следовательно, хрупкость в сочетании с in vitro 9Неэффективность презентации 1230 помешала ранним попыткам идентифицировать APC с перекрестной презентацией. Хотя CD8 + ДК в настоящее время, по-видимому, являются преобладающим перекрестно-презентирующим подмножеством, присутствие липополисахарида делает возможным перекрестное представление двойным отрицательным ДК 20 . Таким образом, возможно, разные подмножества DC будут перекрестно представлены в разных условиях.
Во-вторых, способность этого подмножества захватывать антигены in vivo и затем перекрестно презентировать их in vitro очень неэффективна 21 . Следовательно, хрупкость в сочетании с in vitro 9Неэффективность презентации 1230 помешала ранним попыткам идентифицировать APC с перекрестной презентацией. Хотя CD8 + ДК в настоящее время, по-видимому, являются преобладающим перекрестно-презентирующим подмножеством, присутствие липополисахарида делает возможным перекрестное представление двойным отрицательным ДК 20 . Таким образом, возможно, разные подмножества DC будут перекрестно представлены в разных условиях.
Как подробно описано ниже, перекрестное представление связано как с иммунитетом, так и с толерантностью. До сих пор не удалось идентифицировать толерогенный перекрестный APC, хотя Куртс и его коллеги 33 недавно сообщил, что это клетка CD11c + , что подтверждает идею о ее происхождении из DC. Более точное фенотипическое определение этого подмножества DC должно ожидаться в будущих исследованиях.
Антигены и перекрестная презентация
То, как экзогенные антигены входят в путь MHC класса I, было подробно рассмотрено в другом месте 34 , но были определены три основных механизма. Первый включает прямую «инъекцию» антигенного материала патогенного происхождения в цитозоль АПК хозяина (опосредованную вирусами 9).0878 35 и некоторые бактерии, такие как Listeria monocytogenes 36 ), что позволяет обрабатывать белки патогена с помощью нормального цитозольного механизма для MHC класса I. Второй механизм включает эндосомальный процессинг. Это включает либо прямую эндосомальную загрузку предварительно сформированных молекул МНС класса I пептидными детерминантами, которые образуются в эндосомальном компартменте 37,38 , либо «регургитацию» пептидного антигена из эндосомального компартмента на клеточную поверхность для ассоциации с предварительно сформированным МНС класса I. молекулы 39 . Третий механизм кросс-презентации включает «цитозольную диверсию» еще не определенными путями. В этом случае экзогенные белки направляются либо из эндосомального компартмента, либо непосредственно из внеклеточной жидкости в цитозоль для процессинга в обычном пути MHC class I. Эта третья ситуация может быть представлена одним механизмом или несколькими различными процессами, но включает перекрестную презентацию белков теплового шока 40 , комплексов антител 25 , экзосомы 41,42 , апоптотические клетки 29 , некротические клетки 43 и макропиноцитоз 24 .
Третий механизм кросс-презентации включает «цитозольную диверсию» еще не определенными путями. В этом случае экзогенные белки направляются либо из эндосомального компартмента, либо непосредственно из внеклеточной жидкости в цитозоль для процессинга в обычном пути MHC class I. Эта третья ситуация может быть представлена одним механизмом или несколькими различными процессами, но включает перекрестную презентацию белков теплового шока 40 , комплексов антител 25 , экзосомы 41,42 , апоптотические клетки 29 , некротические клетки 43 и макропиноцитоз 24 .
Хотя существует несколько путей перекрестной презентации, наше текущее понимание того, какие пути действуют in vivo для перекрестной презентации клеточно-ассоциированных антигенов, полученных из инфицированных вирусом клеток или собственных тканей, является минимальным. Сообщалось, что многие типы белковых антигенов представлены перекрестно, включая ядерные 44 , цитоплазматические и клеточные поверхностные 45 , чужеродные 31 и собственные 45 , а также вирусные 46 , бактериальные 31 и эукариотические
8 19 9. Уровень экспрессии донорской клеткой, по-видимому, очень важен для успешной перекрестной презентации 47 . Уровни экспрессии в решающей степени определяют, будет ли достаточное количество антигена перекрестно представлено для стимуляции ЦТЛ. В нормальных условиях перекрестная презентация, вероятно, менее эффективна, чем прямая презентация, поскольку перекрестная презентация требует дополнительной стадии переноса из одной клетки в другую. Таким образом, для обнаружения кросс-презентации в модельной системе важно, чтобы донорская ткань экспрессировала достаточное количество антигена (более подробное обсуждение этого важного вопроса см. в Ref. 30).
Уровень экспрессии донорской клеткой, по-видимому, очень важен для успешной перекрестной презентации 47 . Уровни экспрессии в решающей степени определяют, будет ли достаточное количество антигена перекрестно представлено для стимуляции ЦТЛ. В нормальных условиях перекрестная презентация, вероятно, менее эффективна, чем прямая презентация, поскольку перекрестная презентация требует дополнительной стадии переноса из одной клетки в другую. Таким образом, для обнаружения кросс-презентации в модельной системе важно, чтобы донорская ткань экспрессировала достаточное количество антигена (более подробное обсуждение этого важного вопроса см. в Ref. 30).
Сообщалось, что апоптотические клетки являются хорошим источником антигена для перекрестной презентации in vitro 29,48,49 , и в то время как первоначально считалось, что некротические клетки исключены из перекрестной презентации 29 , недавние исследования показывают что это не так 43 . Хотя есть некоторые доказательства того, что некротические клетки могут перекрестно активироваться in vivo , как показано на способности обработанного ультразвуком клеточного детрита индуцировать ЦТЛ 50 , прямого in vivo свидетельствуют о перекрестном представлении апоптотических клеток. McPherson и коллеги 51 сообщают, что подмножество крысиных DCs конститутивно переносят апоптотические кишечные эпителиальные клетки в мезентериальные лимфатические узлы. Им еще предстоит исследовать презентацию антигена, но их исследования формально показывают, что DCs могут захватывать и транспортировать апоптотические клетки in vivo . В наших собственных исследованиях 47 островки поджелудочной железы, которые трансгенно экспрессируют небольшое количество OVA, не смогли обеспечить антиген для перекрестной презентации в дренирующих лимфатических узлах, если только они не были сначала подвергнуты воздействию активированных ЦТЛ, которые разрушили ткань островка.
Хотя есть некоторые доказательства того, что некротические клетки могут перекрестно активироваться in vivo , как показано на способности обработанного ультразвуком клеточного детрита индуцировать ЦТЛ 50 , прямого in vivo свидетельствуют о перекрестном представлении апоптотических клеток. McPherson и коллеги 51 сообщают, что подмножество крысиных DCs конститутивно переносят апоптотические кишечные эпителиальные клетки в мезентериальные лимфатические узлы. Им еще предстоит исследовать презентацию антигена, но их исследования формально показывают, что DCs могут захватывать и транспортировать апоптотические клетки in vivo . В наших собственных исследованиях 47 островки поджелудочной железы, которые трансгенно экспрессируют небольшое количество OVA, не смогли обеспечить антиген для перекрестной презентации в дренирующих лимфатических узлах, если только они не были сначала подвергнуты воздействию активированных ЦТЛ, которые разрушили ткань островка. Следовательно, уничтожение островковых клеток усиливает перекрестную презентацию. Было ли это связано с образованием апоптотических клеток или просто с высвобождением антигена, еще предстоит решить 9.0878 52 .
Следовательно, уничтожение островковых клеток усиливает перекрестную презентацию. Было ли это связано с образованием апоптотических клеток или просто с высвобождением антигена, еще предстоит решить 9.0878 52 .
Несмотря на данные о том, что разрушение клеток может способствовать перекрестному представлению, существуют ситуации, в которых ни апоптоз, ни некроз кажутся необходимыми. Например, несколько линий трансгенных мышей экспрессируют антигены в панкреатических островках, которые перекрестно представлены в дренирующих лимфатических узлах при явном отсутствии апоптоза 47,53,54 . Итак, как может происходить перекрестная презентация без разрушения клеток? Одна простая возможность заключается в том, что антигены секретируются, а затем захватываются в дренирующих узлах DCs, способными к перекрестной презентации. Однако тщательный анализ реакции на растворимый и ассоциированный с клеткой OVA привел нас к заключению, что даже когда островки экспрессируют секретируемый OVA, перекрестная презентация требует захвата антигена в ассоциированной с клеткой форме, возможно, непосредственно из островковых клеток 55 . Подтверждением механизма, с помощью которого DCs могут напрямую захватывать клеточные антигены из живых клеток, является недавно описанный процесс, который мы называем ‘nibbling’ 56 . В этих исследованиях ДК культивировали с различными другими типами клеток, помеченными красителями. Во всех случаях материал был захвачен немечеными ДК путем откусывания мелких везикул от донорских клеток. Пример этого переноса показан на рис. 3. Было обнаружено, что он специфичен для ДК, без признаков поедания не-ДК типами клеток, такими как макрофаги. Эти наблюдения подтверждают возможность того, что DCs, находящиеся в тканях, могут перемещаться от клетки к клетке, покусывая кусочки клеток ткани, не вызывая повреждений. Затем этот материал можно было транспортировать в дренирующий лимфатический узел для перекрестной презентации наивным Т-клеткам.
Подтверждением механизма, с помощью которого DCs могут напрямую захватывать клеточные антигены из живых клеток, является недавно описанный процесс, который мы называем ‘nibbling’ 56 . В этих исследованиях ДК культивировали с различными другими типами клеток, помеченными красителями. Во всех случаях материал был захвачен немечеными ДК путем откусывания мелких везикул от донорских клеток. Пример этого переноса показан на рис. 3. Было обнаружено, что он специфичен для ДК, без признаков поедания не-ДК типами клеток, такими как макрофаги. Эти наблюдения подтверждают возможность того, что DCs, находящиеся в тканях, могут перемещаться от клетки к клетке, покусывая кусочки клеток ткани, не вызывая повреждений. Затем этот материал можно было транспортировать в дренирующий лимфатический узел для перекрестной презентации наивным Т-клеткам.

ДК, полученные из обезьяньих CD14 + моноцитов путем культивирования в гранулоцитарно-макрофагальном колониестимулирующем факторе (ГМ-КСФ) и интерлейкине-4 в течение 4 дней, метили либо 1,1′-диоктадецил-3,3, 3′,3′-тетраметилиндодикарбоцианина перхлорат (ложно окрашенный в зеленый цвет) или 5-хлорметилфлуоресцеиндиацетат (ложно окрашенный в красный цвет) и совместно культивированные в камере для микроскопии живых клеток 56 . Это изображение было получено через 160 минут. По мере взаимодействия одиночных меченых клеток небольшие количества метки переносятся от донорских клеток к реципиентным ДК. Стрелка указывает на пример переданного материала. Мы благодарим доктора С. Барратт-Бойс и доктора Л. Харшайн за предоставление этого изображения.
Полноразмерное изображение
Роль перекрестной презентации в самотерпимости
Сообщалось, что перекрестная презентация не только обеспечивает механизм выработки иммунитета к внутриклеточным инфекциям, но и участвует в индукции толерантности. Лаборатория фон Бемера впервые сообщила о роли перекрестной презентации в CENTRAL TOLERANCE 9.0878 57 , показывая, что минорные антигены гистосовместимости перекрестно представлены в тимусе, где они толерантны к ЦТЛ; позже было показано, что процесс происходит путем удаления 58 . Они назвали этот процесс «перекрестной толерантностью». Совсем недавно наблюдалась перекрестная толерантность к антигенам, которые экспрессировались внетимусно в органах, таких как поджелудочная железа и почки 3,59 . Эти исследования были инициированы открытием того, что панкреатические и почечные антигены могут конститутивно перекрестно презентироваться в дренирующих лимфатических узлах с помощью APC костного мозга.0878 45 , скорее всего DC 33 . Такая перекрестная презентация индуцировала пролиферацию наивных CD8 Т-клеток, но в конечном итоге приводила к их делеции 3 (рис. 4). В родственных исследованиях было показано, что хелперные Т-клетки вызывают толерантность за счет ограниченной MHC класса II презентации тканевых антигенов 59,60 .
Лаборатория фон Бемера впервые сообщила о роли перекрестной презентации в CENTRAL TOLERANCE 9.0878 57 , показывая, что минорные антигены гистосовместимости перекрестно представлены в тимусе, где они толерантны к ЦТЛ; позже было показано, что процесс происходит путем удаления 58 . Они назвали этот процесс «перекрестной толерантностью». Совсем недавно наблюдалась перекрестная толерантность к антигенам, которые экспрессировались внетимусно в органах, таких как поджелудочная железа и почки 3,59 . Эти исследования были инициированы открытием того, что панкреатические и почечные антигены могут конститутивно перекрестно презентироваться в дренирующих лимфатических узлах с помощью APC костного мозга.0878 45 , скорее всего DC 33 . Такая перекрестная презентация индуцировала пролиферацию наивных CD8 Т-клеток, но в конечном итоге приводила к их делеции 3 (рис. 4). В родственных исследованиях было показано, что хелперные Т-клетки вызывают толерантность за счет ограниченной MHC класса II презентации тканевых антигенов 59,60 . Хотя в данном случае это не является строго перекрестной презентацией, поскольку антигены входят в обычный путь МНС класса II, процесс толерантности, скорее всего, опосредован одними и теми же ДК посредством одних и тех же толерогенных сигналов.
Хотя в данном случае это не является строго перекрестной презентацией, поскольку антигены входят в обычный путь МНС класса II, процесс толерантности, скорее всего, опосредован одними и теми же ДК посредством одних и тех же толерогенных сигналов.
Дендритные клетки (ДК) захватывают антиген из периферических тканей, таких как β-клетки поджелудочной железы, и затем перекрестно представляют их аутореактивным цитотоксическим Т-лимфоцитам (ЦТЛ) в дренирующем лимфатическом узле. Это приводит к пролиферации с последующей делецией аутореактивных ЦТЛ, что приводит к толерантности к аутоантигенам. В настоящее время неясно, захватывает ли ДК антиген непосредственно из клеток ткани или просто находится в дренирующем лимфатическом узле, где захватывает антигены.
Изображение в натуральную величину
Уровни экспрессии антигена в значительной степени определяют, будут ли аутоантигены перекрестно представлены в количестве, достаточном для того, чтобы вызвать делецию ЦТЛ 53 . Таким образом, доза антигена строго определяет состояние толерантности к себе, при этом высокие дозы антигенов вызывают делеционную толерантность путем перекрестной презентации, а низкие дозы антигенов игнорируются. Даже когда экспрессируется достаточное количество антигена, чтобы вызвать перекрестную презентацию, скорость делеции может зависеть от дозы. Шерман и коллеги 54 сообщили о более быстрой делеции гемагглютинин-специфических ЦТЛ у гомозиготных трансгенных мышей по сравнению с гетерозиготными из-за повышенной экспрессии гемагглютинина в поджелудочной железе. Интересно, что они показали, что процесс делеции был довольно медленным, при этом удаление 10 3 адоптивно перенесенных ЦТЛ требовало 2-4 недель. Этой скорости, однако, было бы более чем достаточно для работы с несколькими самореактивными ЦТЛ, которые, как ожидается, будут генерироваться в нормальном репертуаре.
Таким образом, доза антигена строго определяет состояние толерантности к себе, при этом высокие дозы антигенов вызывают делеционную толерантность путем перекрестной презентации, а низкие дозы антигенов игнорируются. Даже когда экспрессируется достаточное количество антигена, чтобы вызвать перекрестную презентацию, скорость делеции может зависеть от дозы. Шерман и коллеги 54 сообщили о более быстрой делеции гемагглютинин-специфических ЦТЛ у гомозиготных трансгенных мышей по сравнению с гетерозиготными из-за повышенной экспрессии гемагглютинина в поджелудочной железе. Интересно, что они показали, что процесс делеции был довольно медленным, при этом удаление 10 3 адоптивно перенесенных ЦТЛ требовало 2-4 недель. Этой скорости, однако, было бы более чем достаточно для работы с несколькими самореактивными ЦТЛ, которые, как ожидается, будут генерироваться в нормальном репертуаре.
Помимо дозы антигена, место экспрессии и возраст хозяина влияют на перекрестную презентацию собственных антигенов 61 и, следовательно, на перекрестную толерантность 62 . Это понимание началось с наблюдения, что презентация островкового антигена у не страдающих ожирением мышей с диабетом не начиналась примерно до третьей недели жизни 61 . Точно так же и OVA 61 , и гемагглютинин 62 , трансгенно экспрессированные в островковых β-клетках, до этого времени не могли перекрестно презентироваться. Это, по-видимому, не связано с отсутствием экспрессии антигена 62 , подтверждая идею о подавлении перекрестной презентации панкреатических антигенов в ювенильном периоде. Однако это не является общим явлением для всех тканей, т.к. OVA, экспрессируемый в почках, перекрестно представлен в самое раннее время исследования (10-й день) (Ref. 61). Важным следствием позднего начала перекрестной презентации антигенов поджелудочной железы является то, что у молодых мышей не происходит делеции специфических для островков ЦТЛ. У мышей, экспрессирующих гемагглютинин в качестве трансгенного антигена в островках поджелудочной железы, например, заражение молодых мышей вирусом гриппа индуцировало гемагглютинин-специфические ЦТЛ, которые вызывали аутоиммунный диабет 62 .
Это понимание началось с наблюдения, что презентация островкового антигена у не страдающих ожирением мышей с диабетом не начиналась примерно до третьей недели жизни 61 . Точно так же и OVA 61 , и гемагглютинин 62 , трансгенно экспрессированные в островковых β-клетках, до этого времени не могли перекрестно презентироваться. Это, по-видимому, не связано с отсутствием экспрессии антигена 62 , подтверждая идею о подавлении перекрестной презентации панкреатических антигенов в ювенильном периоде. Однако это не является общим явлением для всех тканей, т.к. OVA, экспрессируемый в почках, перекрестно представлен в самое раннее время исследования (10-й день) (Ref. 61). Важным следствием позднего начала перекрестной презентации антигенов поджелудочной железы является то, что у молодых мышей не происходит делеции специфических для островков ЦТЛ. У мышей, экспрессирующих гемагглютинин в качестве трансгенного антигена в островках поджелудочной железы, например, заражение молодых мышей вирусом гриппа индуцировало гемагглютинин-специфические ЦТЛ, которые вызывали аутоиммунный диабет 62 . Это не относится к взрослым мышам, у которых делетированы их гемагглютинин-специфические ЦТЛ путем перекрестного представления, и они были устойчивы к индукции диабета инфекцией вируса гриппа. Эти наблюдения поднимают важный вопрос о том, связан ли ювенильный диабет у людей с аналогичной неспособностью перекрестно представлять островковые антигены в первые годы нашей жизни. Эти данные указывают на то, что перекрестная презентация тканевых антигенов и, следовательно, перекрестная толерантность могут регулироваться как во времени, так и на региональном уровне. Теперь необходимо рассмотреть, как происходит это регулирование.
Это не относится к взрослым мышам, у которых делетированы их гемагглютинин-специфические ЦТЛ путем перекрестного представления, и они были устойчивы к индукции диабета инфекцией вируса гриппа. Эти наблюдения поднимают важный вопрос о том, связан ли ювенильный диабет у людей с аналогичной неспособностью перекрестно представлять островковые антигены в первые годы нашей жизни. Эти данные указывают на то, что перекрестная презентация тканевых антигенов и, следовательно, перекрестная толерантность могут регулироваться как во времени, так и на региональном уровне. Теперь необходимо рассмотреть, как происходит это регулирование.
В целом, несколько исследований ясно показывают, что перекрестная презентация может привести к периферической самопереносимости 3,54,59,60,62 . Важными оставшимися без ответа вопросами являются: (i) как толерантны Т-клетки, (ii) какое подмножество DC ответственно за эту индукцию толерантности и, что наиболее важно, (iii) играет ли эта форма толерантности значительную роль в естественном поддержании самотерпимость? Что касается последнего вопроса, в большинстве исследований использовались трансгенно экспрессированные антигены для мониторинга периферической толерантности, и будет важно проверить роль кросс-презентации в самотолерантности к природным антигенам.
Роль перекрестной презентации в вирусном иммунитете
Перекрестная презентация была впервые обнаружена из-за ее роли в создании иммунитета ЦТЛ (кросс-примирование) к минорным антигенам гистосовместимости, экспрессируемым трансплантированными АЛЛОГЕННЫМИ клетками 19 . Сообщалось, что другие ассоциированные с клеткой антигены, в том числе экспрессируемые опухолями 22 и вирусами 46 , перекрестно праймируются. Тем не менее, есть несколько исследований, которые однозначно показывают, что перекрестное праймирование жизненно важно для естественного защитного иммунитета ЦТЛ. Это не означает, что перекрестное праймирование не играет роли в естественном иммунитете, только то, что по-прежнему трудно различить роль перекрестного представления и прямого представления в естественном праймировании ЦТЛ. В этом обзоре мы сосредоточились на роли перекрестного праймирования в вирусном иммунитете, хотя есть убедительные доказательства того, что этот механизм также участвует в иммунологическом надзоре за опухолями (вставка 1).
За прошедшие годы было показано, что многие вирусные антигены могут быть перекрестно представлены 22,43,44,62,63,64 , хотя в этих случаях вирусные белки не экспрессировались во время вирусных инфекций, а трансформировались или трансфицировались клеток или внутри трансгенных мышей. Было показано, что вирусспецифический иммунитет ЦТЛ зависит от клеток костного мозга (предположительно ДК) в отношении нескольких инфекций, включая вирус гриппа 65 , вирус коровьей оспы 46,66 , полиовирус 46 и вирус лимфоцитарного хориоменингита 65 , что согласуется с ролью перекрестного запуска в вирусном иммунитете. Однако в этих случаях трудно исключить прямую презентацию инфицированными вирусом ДК.
Независимо от их предпочтительной клеточной тропности к продуктивной репликации, многие вирусы обладают более широким диапазоном инфекционности, в котором даже частичное или абортивное инфицирование может привести к совершенно хорошим детерминантам ЦТЛ. Следовательно, необходимы активные меры для однозначного исключения возможности прямой презентации, даже если формально не известно, что вирус инфицирует ДК. В одной из попыток исключить прямую презентацию Норбери и его коллеги 67 использовали комбинацию химической и УФ-обработки, чтобы ограничить инфекцию введенной негемопоэтической клеточной линией и, таким образом, продемонстрировать вирус-специфическое перекрестное заражение ЦТЛ. Вероятно, наиболее убедительные доказательства того, что перекрестного праймирования достаточно для активации иммунитета ЦТЛ во время вирусной инфекции, получены Rock и его коллегами 46 . Они предоставили прямые доказательства перекрестного примирования ЦТЛ к полиовирусу на мышиной модели, в которой прямое заражение ДК было невозможно. Мыши не являются естественным хозяином полиовируса, поскольку у них отсутствует рецептор, обнаруженный на клетках человека, необходимый для заражения вирусом. Но путем трансгенной экспрессии этого рецептора только в компартменте, не происходящем из костного мозга, Сигал и его коллеги 46 смогли гарантировать, что APC костного мозга не могут быть инфицированы.
Следовательно, необходимы активные меры для однозначного исключения возможности прямой презентации, даже если формально не известно, что вирус инфицирует ДК. В одной из попыток исключить прямую презентацию Норбери и его коллеги 67 использовали комбинацию химической и УФ-обработки, чтобы ограничить инфекцию введенной негемопоэтической клеточной линией и, таким образом, продемонстрировать вирус-специфическое перекрестное заражение ЦТЛ. Вероятно, наиболее убедительные доказательства того, что перекрестного праймирования достаточно для активации иммунитета ЦТЛ во время вирусной инфекции, получены Rock и его коллегами 46 . Они предоставили прямые доказательства перекрестного примирования ЦТЛ к полиовирусу на мышиной модели, в которой прямое заражение ДК было невозможно. Мыши не являются естественным хозяином полиовируса, поскольку у них отсутствует рецептор, обнаруженный на клетках человека, необходимый для заражения вирусом. Но путем трансгенной экспрессии этого рецептора только в компартменте, не происходящем из костного мозга, Сигал и его коллеги 46 смогли гарантировать, что APC костного мозга не могут быть инфицированы. Демонстрация того, что для иммунитета ЦТЛ требуется презентация антигена клеткой костного мозга, несмотря на неспособность полиовируса инфицировать такие клетки, свидетельствует о перекрестном примировании в индукции иммунитета ЦТЛ к этому вирусу. Хотя этот пример прямо показывает, что вирусный иммунитет может быть опосредован перекрестным праймированием, он не рассматривает вклад перекрестного праймирования по сравнению с прямым праймированием, когда доступны оба пути. Таким образом, остается формальная возможность того, что кросспрайминг наблюдался только потому, что другие пути были недоступны.
Демонстрация того, что для иммунитета ЦТЛ требуется презентация антигена клеткой костного мозга, несмотря на неспособность полиовируса инфицировать такие клетки, свидетельствует о перекрестном примировании в индукции иммунитета ЦТЛ к этому вирусу. Хотя этот пример прямо показывает, что вирусный иммунитет может быть опосредован перекрестным праймированием, он не рассматривает вклад перекрестного праймирования по сравнению с прямым праймированием, когда доступны оба пути. Таким образом, остается формальная возможность того, что кросспрайминг наблюдался только потому, что другие пути были недоступны.
В целом, эти исследования показывают, что перекрестное заражение широко наблюдается в экспериментальных системах, подтверждая идею о том, что этот процесс существует и, вероятно, важен для естественных инфекций. Можно предположить, что кросс-примирование будет играть важную роль в случаях, когда вирусная инфекция действительно локализована в периферическом нелимфоидном компартменте, например, в случае вируса папилломы, когда инфекция ограничивается эпителиальными клетками кожи . 68 . Кроме того, перекрестное праймирование может иметь важное значение в тех случаях, когда вирусы развили механизмы, которые специфически ингибируют обычный процессинг и презентацию антигена, ограниченного MHC класса I 9.0878 69,70,71,72,73,74,75 . В этих ситуациях перекрестная презентация могла бы привести к успешному праймированию ЦТЛ перед лицом ингибирующих механизмов, которые иначе препятствовали бы прямой презентации инфицированными ДК. В дополнение к специфическому нацеливанию на презентацию антигена появляются примеры вирусов, которые ингибируют различные аспекты функции DC. В последнее время несколько вирусов, в том числе вирус простого герпеса 11 , вирус кори 12,13 , ретровирус 14 , вирус оспы канареек 15 , вирус коровьей оспы 16 и вирус лимфоцитарного хориоменингита 17 , как было показано, оказывают вредное воздействие на ДК. Учитывая, что профессиональные АПК, такие как ДК, необходимы для праймирования вирусных ответов, но некоторые из этих же вирусов (например, вирус коровьей оспы) могут «деактивировать» ДК во время инфекции, логический вывод состоит в том, что иммунитет индуцируется перекрестным праймированием.
68 . Кроме того, перекрестное праймирование может иметь важное значение в тех случаях, когда вирусы развили механизмы, которые специфически ингибируют обычный процессинг и презентацию антигена, ограниченного MHC класса I 9.0878 69,70,71,72,73,74,75 . В этих ситуациях перекрестная презентация могла бы привести к успешному праймированию ЦТЛ перед лицом ингибирующих механизмов, которые иначе препятствовали бы прямой презентации инфицированными ДК. В дополнение к специфическому нацеливанию на презентацию антигена появляются примеры вирусов, которые ингибируют различные аспекты функции DC. В последнее время несколько вирусов, в том числе вирус простого герпеса 11 , вирус кори 12,13 , ретровирус 14 , вирус оспы канареек 15 , вирус коровьей оспы 16 и вирус лимфоцитарного хориоменингита 17 , как было показано, оказывают вредное воздействие на ДК. Учитывая, что профессиональные АПК, такие как ДК, необходимы для праймирования вирусных ответов, но некоторые из этих же вирусов (например, вирус коровьей оспы) могут «деактивировать» ДК во время инфекции, логический вывод состоит в том, что иммунитет индуцируется перекрестным праймированием. (рис. 5). За счет перекрестной презентации вирусных антигенов нет необходимости в том, чтобы DC были инфицированы (и подвергались связанным с этим опасностям), чтобы примировать наивные ЦТЛ к вирусным антигенам, ограниченным MHC класса I. Таким образом, представляется, что поддержание перекрестного запуска иммунной системой может быть оправдано двумя различными причинами: во-первых, как предположил Беван 18 , это может быть очень важно для выработки иммунитета ЦТЛ к тканеспецифическим вирусам, которые не инфицируют ДК; и, кроме того, это может быть жизненно важно для выработки иммунитета к вирусам, которые заражают DC, но затем подавляют их функцию.
(рис. 5). За счет перекрестной презентации вирусных антигенов нет необходимости в том, чтобы DC были инфицированы (и подвергались связанным с этим опасностям), чтобы примировать наивные ЦТЛ к вирусным антигенам, ограниченным MHC класса I. Таким образом, представляется, что поддержание перекрестного запуска иммунной системой может быть оправдано двумя различными причинами: во-первых, как предположил Беван 18 , это может быть очень важно для выработки иммунитета ЦТЛ к тканеспецифическим вирусам, которые не инфицируют ДК; и, кроме того, это может быть жизненно важно для выработки иммунитета к вирусам, которые заражают DC, но затем подавляют их функцию.
Некоторые вирусы нарушают функцию дендритных клеток (ДК) во время инфекции, например, ингибируя презентацию МНС класса I или блокируя миграцию ДК. В этих обстоятельствах вирусное ингибирование инфицированных ДК предотвращает стимуляцию цитотоксических Т-лимфоцитов (ЦТЛ) прямым путем МНС класса I. Однако перекрестная презентация антигенов, полученных из инфицированных клеток, неинфицированными ДК, вероятно, приведет к возникновению иммунитета к ЦТЛ перед лицом ингибирующих механизмов. Хотя опосредованное вирусом ингибирование экспрессии MHC класса I в клетке-мишени также будет нарушать эффекторную фазу ответов, индуцированных перекрестным праймированием, маловероятно, что это полностью заблокирует распознавание эффекторными ЦТЛ.
Однако перекрестная презентация антигенов, полученных из инфицированных клеток, неинфицированными ДК, вероятно, приведет к возникновению иммунитета к ЦТЛ перед лицом ингибирующих механизмов. Хотя опосредованное вирусом ингибирование экспрессии MHC класса I в клетке-мишени также будет нарушать эффекторную фазу ответов, индуцированных перекрестным праймированием, маловероятно, что это полностью заблокирует распознавание эффекторными ЦТЛ.
Полноразмерное изображение
Текущий вердикт по перекрестному представлению
За последнее десятилетие был сделан ряд важных шагов к пониманию перекрестной презентации и ее последствий — перекрестного прайминга и перекрестной толерантности. Опираясь на более ранние усилия Бевана и многих других, Пардолл и его коллеги ясно показали роль перекрестного запуска в иммунитете к экспериментальным опухолям, тогда как лаборатория Рока представила первые убедительные доказательства вирусоспецифического перекрестного запуска. Расширяя исследования лаборатории von Boehmer по перекрестной толерантности тимуса, несколько групп предоставили убедительные доказательства того, что антигены периферических тканей могут перекрестно презентироваться в дренирующих лимфатических узлах для индукции периферической самотолерантности. Кроме того, были сделаны важные наблюдения о природе антигенного материала, предназначенного для перекрестной презентации, включая доказательства того, что перекрестная презентация может быть нацелена на белки теплового шока, апоптотические и некротические клетки, экзосомы или даже иммунные комплексы. Наконец, с появлением методов очистки подмножеств DC, в значительной степени впервые разработанных Шортманом и его коллегами, лаборатория Бевана снова смогла оказать значительное влияние на область кросс-праймирования через 25 лет после его первоначального открытия, сообщив, что это прежде всего CD8 + Подмножество DC, отвечающее за этот процесс. Несмотря на всю эту новую и захватывающую информацию, наше понимание перекрестной презентации все еще находится в зачаточном состоянии.
Расширяя исследования лаборатории von Boehmer по перекрестной толерантности тимуса, несколько групп предоставили убедительные доказательства того, что антигены периферических тканей могут перекрестно презентироваться в дренирующих лимфатических узлах для индукции периферической самотолерантности. Кроме того, были сделаны важные наблюдения о природе антигенного материала, предназначенного для перекрестной презентации, включая доказательства того, что перекрестная презентация может быть нацелена на белки теплового шока, апоптотические и некротические клетки, экзосомы или даже иммунные комплексы. Наконец, с появлением методов очистки подмножеств DC, в значительной степени впервые разработанных Шортманом и его коллегами, лаборатория Бевана снова смогла оказать значительное влияние на область кросс-праймирования через 25 лет после его первоначального открытия, сообщив, что это прежде всего CD8 + Подмножество DC, отвечающее за этот процесс. Несмотря на всю эту новую и захватывающую информацию, наше понимание перекрестной презентации все еще находится в зачаточном состоянии. Наши новые знания о том, какие подмножества DC отвечают за этот процесс, чрезвычайно помогут нам в будущих усилиях по детальному пониманию механизма кросс-презентации. Наконец, это будет дизайн экспериментальных моделей, которые могут учитывать природу толерантности к естественным аутоантигенам и вклад прямой и перекрестной презентации в иммунитет, что будет важно, если мы хотим определить степень, в которой мы зависим. по перекрестной презентации на иммунитет и толерантность.
Наши новые знания о том, какие подмножества DC отвечают за этот процесс, чрезвычайно помогут нам в будущих усилиях по детальному пониманию механизма кросс-презентации. Наконец, это будет дизайн экспериментальных моделей, которые могут учитывать природу толерантности к естественным аутоантигенам и вклад прямой и перекрестной презентации в иммунитет, что будет важно, если мы хотим определить степень, в которой мы зависим. по перекрестной презентации на иммунитет и толерантность.
Коробка 1 | Перекрестное примирование и иммунитет к опухолям
Для создания иммунитета цитотоксических Т-лимфоцитов (ЦТЛ) к опухолям на самом деле есть только две возможности: либо ЦТЛ примируются прямым распознаванием антигена на опухолевых клетках, либо опухолевые антигены перекрестно представлены на дендритных клетках хозяина. В настоящее время появляется все больше данных, указывающих на то, что перекрестное праймирование может индуцировать иммунитет к опухолям 22,41,44,63,64,76,77 , и столь же убедительный набор данных показывает, что он не может 22,41,44,63,64,76,77 9087 19,78,79 . В некоторых случаях, когда перекрестное праймирование отсутствует, CTL-иммунитет может быть получен путем обеспечения доступа опухоли к вторичному лимфоидному компартменту для прямого контакта с наивными Т-клетками 78,79 . Вопрос о том, участвует ли кросс-прайминг в естественном иммунном надзоре за спонтанными опухолями, остается нерешенным. Определенно, некоторые опухоли индуцируются вирусами, что повышает вероятность того, что, по крайней мере, в этих случаях вирус-специфический перекрестный прайминг может ограничивать онкогенез. Однако трудно оценить значение перекрестного праймирования в естественном противоопухолевом иммунитете, поскольку обнаруживаемые опухоли должны были ускользнуть от иммунного надзора, чтобы возникнуть. Таким образом, хотя отказ некоторых опухолей от кросс-праймирования можно рассматривать как доказательство того, что кросс-прайминг не участвует в естественном иммунитете к опухолям, это в равной степени может означать, что опухоли возникают только в том случае, если они разрушают кросс-прайминг.
В некоторых случаях, когда перекрестное праймирование отсутствует, CTL-иммунитет может быть получен путем обеспечения доступа опухоли к вторичному лимфоидному компартменту для прямого контакта с наивными Т-клетками 78,79 . Вопрос о том, участвует ли кросс-прайминг в естественном иммунном надзоре за спонтанными опухолями, остается нерешенным. Определенно, некоторые опухоли индуцируются вирусами, что повышает вероятность того, что, по крайней мере, в этих случаях вирус-специфический перекрестный прайминг может ограничивать онкогенез. Однако трудно оценить значение перекрестного праймирования в естественном противоопухолевом иммунитете, поскольку обнаруживаемые опухоли должны были ускользнуть от иммунного надзора, чтобы возникнуть. Таким образом, хотя отказ некоторых опухолей от кросс-праймирования можно рассматривать как доказательство того, что кросс-прайминг не участвует в естественном иммунитете к опухолям, это в равной степени может означать, что опухоли возникают только в том случае, если они разрушают кросс-прайминг. В настоящее время мы не можем провести различие между этими двумя альтернативами.
В настоящее время мы не можем провести различие между этими двумя альтернативами.
Ссылки
Ссылки на скачивание
Благодарности
Авторы благодарят нескольких человек за их предложения при чтении черновиков этой рукописи, в том числе д-ра Г. Дэйви, д-ра Г. Белз, д-ра Дж. Вилладангос, д-ра Г. Беренс, г-жи Дж. , Минтерн, г-жа М. Ли и д-р М. Беван.
Беван.
Информация об авторе
Авторы и организации
s
Автор, ответственный за корреспонденцию
Уильям Р. Хит.
Ссылки по теме
Ссылки по теме
БАЗЫ ДАННЫХ
ЛокусЛинк
CD4
CD8
CD40
CD40L
КЛИП
ГМ-КСФ
Вирус простого герпеса
Вирус кори
НАЖМИТЕ
Вирус коровьей оспы
Глоссарий
Права и разрешения
Перепечатка и разрешения




 В. Рубцов.
В. Рубцов. be/eFSvh5ZyHH0
be/eFSvh5ZyHH0  O’huigin et al.
O’huigin et al.  984-987.e3
984-987.e3 Необходимы дальнейшие исследования, чтобы полностью понять, как нормализовать УФ-опосредованное воспаление у пациентов с аутоиммунными заболеваниями.
Необходимы дальнейшие исследования, чтобы полностью понять, как нормализовать УФ-опосредованное воспаление у пациентов с аутоиммунными заболеваниями. Кроме того, гипоморфные мыши DSC3 демонстрируют выраженный фенотип образования пузырей на слизистой оболочке, что очень характерно для пузырчатки. Эти результаты побудили нас изучить индукцию и регуляцию IgG против DSC3 человека у гуманизированных мышей, трансгенных по HLA-DRB1∗04:02, который является широко распространенным гаплотипом при пузырчатке. Мы показываем, что IgG из сыворотки иммунизированных мышей индуцирует акантолиз в анализе диссоциации кератиноцитов на основе диспазы посредством активации p38 MAPK и EGFR. Пассивный перенос IgG от мышей, иммунизированных рекомбинантным DSC3 человека, новорожденным не вызывал потери внутриэпидермальной адгезии, предположительно из-за отсутствия гомологии между DSC3 человека и мыши. Стимуляция ex vivo спленоцитов мышей, иммунизированных DSC3, человеческим DSC3 приводит к значительному пролиферативному ответу Т-клеток IFN-γ и IL-4, который ограничивается HLA-DR/HLA-DQ. Эти данные свидетельствуют о том, что индукция патогенных анти-DSC3 IgG связана с DSC3-специфичными Т-клетками, которые распознают DSC3 в ассоциации с HLA-DRB1∗04:02.
Кроме того, гипоморфные мыши DSC3 демонстрируют выраженный фенотип образования пузырей на слизистой оболочке, что очень характерно для пузырчатки. Эти результаты побудили нас изучить индукцию и регуляцию IgG против DSC3 человека у гуманизированных мышей, трансгенных по HLA-DRB1∗04:02, который является широко распространенным гаплотипом при пузырчатке. Мы показываем, что IgG из сыворотки иммунизированных мышей индуцирует акантолиз в анализе диссоциации кератиноцитов на основе диспазы посредством активации p38 MAPK и EGFR. Пассивный перенос IgG от мышей, иммунизированных рекомбинантным DSC3 человека, новорожденным не вызывал потери внутриэпидермальной адгезии, предположительно из-за отсутствия гомологии между DSC3 человека и мыши. Стимуляция ex vivo спленоцитов мышей, иммунизированных DSC3, человеческим DSC3 приводит к значительному пролиферативному ответу Т-клеток IFN-γ и IL-4, который ограничивается HLA-DR/HLA-DQ. Эти данные свидетельствуют о том, что индукция патогенных анти-DSC3 IgG связана с DSC3-специфичными Т-клетками, которые распознают DSC3 в ассоциации с HLA-DRB1∗04:02.
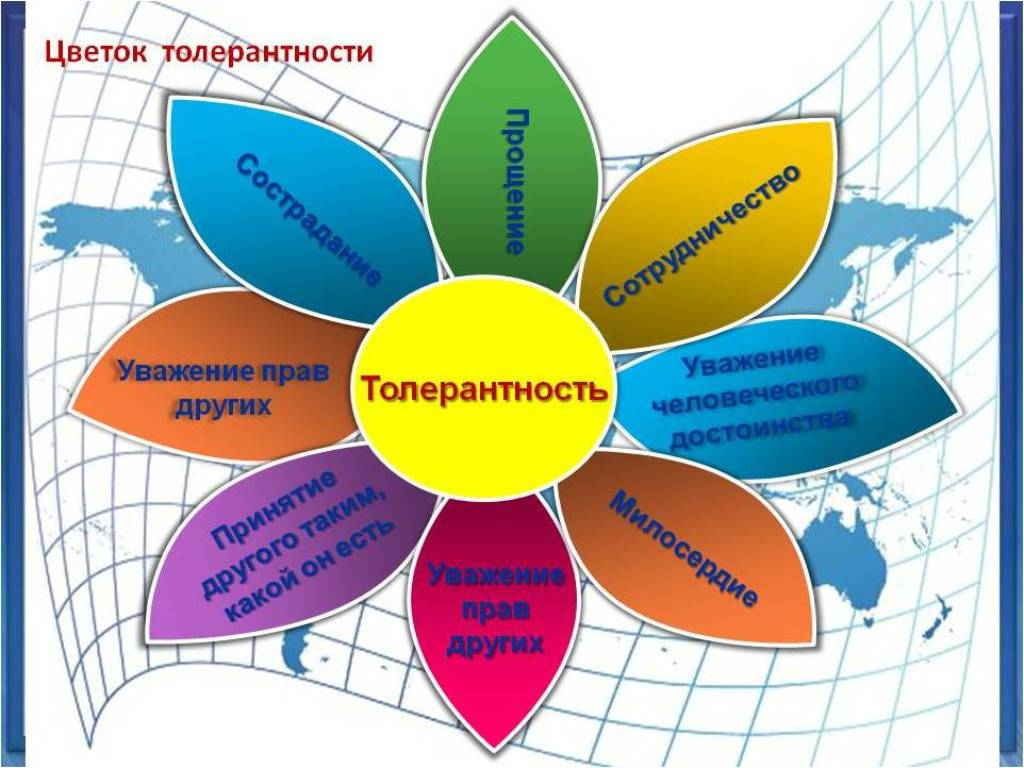 Полу-мДК, индуцированные апоптозными клетками, особой цитокиновой средой, такой как IL-10 и TGF-β, или фармакологическими агентами, также проявляют толерогенные свойства (5–7). Толерогенные ДК (tolDC) в организме играют важную роль в центральной и периферической толерантности, что приводит к разрешению текущих иммунных реакций и предотвращению аутоиммунитета. ДК способствуют иммунной толерантности за счет отрицательного отбора аутореактивных Т-клеток и образования регуляторных Т-клеток (Treg) в тимусе во время приобретения центральной толерантности. Они также ограничивают дифференцировку эффекторных Т-клеток и способствуют дифференцировке Treg на периферии с помощью различных механизмов. Нарушение этих функций приводит к аутоиммунным заболеваниям. Кожа и кишечник действуют как большие барьерные органы для внешней среды, подвергаясь воздействию широкого спектра антигенов окружающей среды, таких как пищевые продукты, комменсальные бактерии и патогены. В обоих органах ДК играют решающую роль в балансе иммунных реакций, приводя к гомеостазу и предотвращению ненужного воспаления (8).
Полу-мДК, индуцированные апоптозными клетками, особой цитокиновой средой, такой как IL-10 и TGF-β, или фармакологическими агентами, также проявляют толерогенные свойства (5–7). Толерогенные ДК (tolDC) в организме играют важную роль в центральной и периферической толерантности, что приводит к разрешению текущих иммунных реакций и предотвращению аутоиммунитета. ДК способствуют иммунной толерантности за счет отрицательного отбора аутореактивных Т-клеток и образования регуляторных Т-клеток (Treg) в тимусе во время приобретения центральной толерантности. Они также ограничивают дифференцировку эффекторных Т-клеток и способствуют дифференцировке Treg на периферии с помощью различных механизмов. Нарушение этих функций приводит к аутоиммунным заболеваниям. Кожа и кишечник действуют как большие барьерные органы для внешней среды, подвергаясь воздействию широкого спектра антигенов окружающей среды, таких как пищевые продукты, комменсальные бактерии и патогены. В обоих органах ДК играют решающую роль в балансе иммунных реакций, приводя к гомеостазу и предотвращению ненужного воспаления (8). Соответственно, важно проанализировать роль ДК в механизме иммунной толерантности. В этом обзоре представлен обзор нашего текущего понимания механизмов индукции толерантности ДК в организме.
Соответственно, важно проанализировать роль ДК в механизме иммунной толерантности. В этом обзоре представлен обзор нашего текущего понимания механизмов индукции толерантности ДК в организме. Пре-кДК предшественники затем мигрируют через сосудистую систему к их конечному местоположению в тканях или лимфоидных органах, прежде чем завершить свою дифференцировку в иДК, состоящие из двух различных подмножеств кДК, CD8α + /CD103 + DC [обычные DC 1 (cDC1s)] и CD11b + DC [обычные DC 2 (cDC2s)] (3). С другой стороны, моноцитарные DCs (moDCs) могут дифференцироваться от моноцитов CD14 + под влиянием комбинации стимулов, включая GM-CSF, TNF-α и IL-4, во время воспаления тканей (12, 13). ). ДК более многочисленны в лимфоидных органах и эпителии и могут экспрессировать различные молекулярные маркеры в зависимости от их локализации. Следовательно, cDC1, cDC2 и pDC присутствуют в разных тканях. На рисунке 1B показан кластер cDC, к которому принадлежит каждый тип клеток. В этом контексте необходимо учитывать фенотип и конкретное расположение ДК при рассмотрении их функции в конкретных тканях (9).).
Пре-кДК предшественники затем мигрируют через сосудистую систему к их конечному местоположению в тканях или лимфоидных органах, прежде чем завершить свою дифференцировку в иДК, состоящие из двух различных подмножеств кДК, CD8α + /CD103 + DC [обычные DC 1 (cDC1s)] и CD11b + DC [обычные DC 2 (cDC2s)] (3). С другой стороны, моноцитарные DCs (moDCs) могут дифференцироваться от моноцитов CD14 + под влиянием комбинации стимулов, включая GM-CSF, TNF-α и IL-4, во время воспаления тканей (12, 13). ). ДК более многочисленны в лимфоидных органах и эпителии и могут экспрессировать различные молекулярные маркеры в зависимости от их локализации. Следовательно, cDC1, cDC2 и pDC присутствуют в разных тканях. На рисунке 1B показан кластер cDC, к которому принадлежит каждый тип клеток. В этом контексте необходимо учитывать фенотип и конкретное расположение ДК при рассмотрении их функции в конкретных тканях (9).). Развитие DC (A) и расположение и фенотипы обычных DC 1 мыши (cDC1s) и обычных DC 2 (cDC2s) (B). (A) DC, дендритные клетки; HSC, гемопоэтические стволовые клетки; MP, миелоидный прокурсор; MDP, предшественник макрофагов/ДК; CDP, общий предшественник DC; cDC, обычный DC; pDC, плазмацитоидные DC; moDC, ДК моноцитарного происхождения. (B) Расположение и фенотипы мышиных cDC1 (красный) и cDC2 (синий).
Развитие DC (A) и расположение и фенотипы обычных DC 1 мыши (cDC1s) и обычных DC 2 (cDC2s) (B). (A) DC, дендритные клетки; HSC, гемопоэтические стволовые клетки; MP, миелоидный прокурсор; MDP, предшественник макрофагов/ДК; CDP, общий предшественник DC; cDC, обычный DC; pDC, плазмацитоидные DC; moDC, ДК моноцитарного происхождения. (B) Расположение и фенотипы мышиных cDC1 (красный) и cDC2 (синий). CD8α + /CD103 + ДК имеют общие рецепторы, такие как хемокиновый рецептор XCR1 и лектиновый рецептор CLEC9A (15–17). CD8α + /CD103 + DC ответственны за эффективную перекрестную презентацию антигена и стимуляцию CD8 + Т-клеточного иммунитета посредством секреции IL-12, тем самым способствуя дифференцировке Th2 (18, 19). Напротив, в невоспаленном кишечнике CD103 + DC в собственной пластинке экспрессируют высокие уровни TGF-β и ретинальдегиддегидрогеназы 2 (RALDh3), что приводит к индукции Treg (20). Таким образом, CD8α + /CD103 + ДК индуцируют либо толерантность слизистых оболочек, либо перекрестно-презентативный CD8 + Т-клеточный иммунитет на основе местного микроокружения.
CD8α + /CD103 + ДК имеют общие рецепторы, такие как хемокиновый рецептор XCR1 и лектиновый рецептор CLEC9A (15–17). CD8α + /CD103 + DC ответственны за эффективную перекрестную презентацию антигена и стимуляцию CD8 + Т-клеточного иммунитета посредством секреции IL-12, тем самым способствуя дифференцировке Th2 (18, 19). Напротив, в невоспаленном кишечнике CD103 + DC в собственной пластинке экспрессируют высокие уровни TGF-β и ретинальдегиддегидрогеназы 2 (RALDh3), что приводит к индукции Treg (20). Таким образом, CD8α + /CD103 + ДК индуцируют либо толерантность слизистых оболочек, либо перекрестно-презентативный CD8 + Т-клеточный иммунитет на основе местного микроокружения. Человеческий аналог мышиного CD11b + ДК являются CD1c (BDCA-1)-положительными ДК (21). CD11b + DC в селезенке экспрессируют CD4 + и могут быть подразделены в соответствии с их экспрессией молекулы адгезии, селективной к эндотелиальным клеткам (22). Селезеночные CD11b + DC демонстрируют более высокую экспрессию MHC класса II, чем CD8α + DC, и могут более эффективно представлять антиген CD4 + T-клеткам как в равновесном состоянии, так и во время воспаления (23). Напротив, CD11b + ДК в коже и CD11b + CD103 + DCs в lamina propria, как сообщается, индуцируют дифференцировку Treg через метаболизм ретиноевой кислоты (RA) (20, 24, 25). И CD8α + /CD103 + DC, и CD11b + DC индуцируют толерантность или CD4 + пролиферацию Т-клеток в зависимости от местного микроокружения.
Человеческий аналог мышиного CD11b + ДК являются CD1c (BDCA-1)-положительными ДК (21). CD11b + DC в селезенке экспрессируют CD4 + и могут быть подразделены в соответствии с их экспрессией молекулы адгезии, селективной к эндотелиальным клеткам (22). Селезеночные CD11b + DC демонстрируют более высокую экспрессию MHC класса II, чем CD8α + DC, и могут более эффективно представлять антиген CD4 + T-клеткам как в равновесном состоянии, так и во время воспаления (23). Напротив, CD11b + ДК в коже и CD11b + CD103 + DCs в lamina propria, как сообщается, индуцируют дифференцировку Treg через метаболизм ретиноевой кислоты (RA) (20, 24, 25). И CD8α + /CD103 + DC, и CD11b + DC индуцируют толерантность или CD4 + пролиферацию Т-клеток в зависимости от местного микроокружения. pDC экспрессируют высокие уровни TLR7 и 9, которые при лигировании вирусными продуктами стимулируют секрецию большого количества IFN I типа. pDC могут повышать экспрессию MHC класса II, позволяя индуцировать пролиферацию Т-клеток. С другой стороны, pDC мыши индуцируют дифференцировку Т-клеток в Т-клетки регуляторного типа 1 (Tr1) (27). Сообщалось, что наивная стимуляция Т-клеток с использованием pDC человека, стимулированных олигонуклеотидами CpG, приводит к появлению Treg с супрессивными свойствами (28). Фенотипические маркеры подмножеств ДК мыши и человека приведены в таблице 1.
pDC экспрессируют высокие уровни TLR7 и 9, которые при лигировании вирусными продуктами стимулируют секрецию большого количества IFN I типа. pDC могут повышать экспрессию MHC класса II, позволяя индуцировать пролиферацию Т-клеток. С другой стороны, pDC мыши индуцируют дифференцировку Т-клеток в Т-клетки регуляторного типа 1 (Tr1) (27). Сообщалось, что наивная стимуляция Т-клеток с использованием pDC человека, стимулированных олигонуклеотидами CpG, приводит к появлению Treg с супрессивными свойствами (28). Фенотипические маркеры подмножеств ДК мыши и человека приведены в таблице 1. Это подтверждается тем фактом, что у мышей, лишенных ДК, наблюдается заметное накопление CD4-9.0878 + тимоцитов без негативной селекции, что приводит к фатальному аутоиммунитету (30). Three thymic DC subsets contribute to central tolerance: resident DCs (CD8α + SIRPα − ), migratory DCs (CD8α − CD11b + SIRPα + ), and pDCs (CD11c int CD45RA int ). Резидентные ДК, которые развиваются из лимфоидных предшественников тимуса, являются наиболее распространенной подгруппой (> 50%) и локализуются в основном в мозговом веществе (31, 32). Они способствуют элиминации аутореактивных тимоцитов, презентируя широко экспрессируемые аутоантигены и перекрестно презентируя как антигены крови, так и тканеспецифические антигены из mTEC (33, 34). С другой стороны, мигрирующие ДК и пДК развиваются на периферии и мигрируют в кортикомедуллярное периваскулярное пространство, которое свободно проницаемо для циркулирующих антигенов через интегрин CCR2/α4 и интегрин CCR9/α4 соответственно (35, 36).
Это подтверждается тем фактом, что у мышей, лишенных ДК, наблюдается заметное накопление CD4-9.0878 + тимоцитов без негативной селекции, что приводит к фатальному аутоиммунитету (30). Three thymic DC subsets contribute to central tolerance: resident DCs (CD8α + SIRPα − ), migratory DCs (CD8α − CD11b + SIRPα + ), and pDCs (CD11c int CD45RA int ). Резидентные ДК, которые развиваются из лимфоидных предшественников тимуса, являются наиболее распространенной подгруппой (> 50%) и локализуются в основном в мозговом веществе (31, 32). Они способствуют элиминации аутореактивных тимоцитов, презентируя широко экспрессируемые аутоантигены и перекрестно презентируя как антигены крови, так и тканеспецифические антигены из mTEC (33, 34). С другой стороны, мигрирующие ДК и пДК развиваются на периферии и мигрируют в кортикомедуллярное периваскулярное пространство, которое свободно проницаемо для циркулирующих антигенов через интегрин CCR2/α4 и интегрин CCR9/α4 соответственно (35, 36). Благодаря этому стратегическому расположению мигрирующие DC и pDC эффективно захватывают и представляют антигены, полученные из крови. Все подмножества DC вносят вклад в иммунную толерантность, представляя аутоантигены и индуцируя негативную селекцию тимоцитов с высоким сродством к аутоантигенам. Затем резидентные ДК обеспечивают незрелые Т-клетки отчетливым аутоантигенным репертуаром, в то время как мигрирующие ДК и пДК специализируются на презентации периферических антигенов.
Благодаря этому стратегическому расположению мигрирующие DC и pDC эффективно захватывают и представляют антигены, полученные из крови. Все подмножества DC вносят вклад в иммунную толерантность, представляя аутоантигены и индуцируя негативную селекцию тимоцитов с высоким сродством к аутоантигенам. Затем резидентные ДК обеспечивают незрелые Т-клетки отчетливым аутоантигенным репертуаром, в то время как мигрирующие ДК и пДК специализируются на презентации периферических антигенов. 1229 in vitro (39, 40). Однако мыши с дефицитом рецепторов TSLP имеют нормальное количество Treg в тимусе, указывая на то, что передача сигналов TSLP не является существенной для развития Treg (29, 41). Тимические pDC также могут индуцировать Treg (42, 43), которые являются более эффективными продуцентами IL-10, чем те, которые индуцируются другими тимическими DC. Эти данные показывают, что все подмножества DC в тимусе необходимы для поддержания центральной толерантности.
1229 in vitro (39, 40). Однако мыши с дефицитом рецепторов TSLP имеют нормальное количество Treg в тимусе, указывая на то, что передача сигналов TSLP не является существенной для развития Treg (29, 41). Тимические pDC также могут индуцировать Treg (42, 43), которые являются более эффективными продуцентами IL-10, чем те, которые индуцируются другими тимическими DC. Эти данные показывают, что все подмножества DC в тимусе необходимы для поддержания центральной толерантности. Оба CD4 + и CD8 + Т-клетки в тимусе были увеличены у мышей, лишенных как mTEC, так и резидентных DC. Эти результаты свидетельствуют о том, что mTEC и резидентные DC действуют для предотвращения аутоиммунитета за счет истощения T-клеток тимуса кооперативным образом, тогда как mTEC играют неповторяющуюся роль в продукции Treg тимуса. Т.о., mTEC и резидентные DC играют уникальную роль в индукции толерантности, которая не может быть компенсирована оставшимися мигрирующими DC и pDC.
Оба CD4 + и CD8 + Т-клетки в тимусе были увеличены у мышей, лишенных как mTEC, так и резидентных DC. Эти результаты свидетельствуют о том, что mTEC и резидентные DC действуют для предотвращения аутоиммунитета за счет истощения T-клеток тимуса кооперативным образом, тогда как mTEC играют неповторяющуюся роль в продукции Treg тимуса. Т.о., mTEC и резидентные DC играют уникальную роль в индукции толерантности, которая не может быть компенсирована оставшимися мигрирующими DC и pDC. Кроме того, у мышей с дефицитом LTβR наблюдалось большее снижение количества CD4 + CD8 − тимоциты и каспаза-3 + CD5 + CD69 + тимоциты, представляющие собой клетки, подвергшиеся отрицательному отбору, хотя они не показали изменений в генерации Treg по сравнению с контрольными мышами. Эти данные указывают на то, что LTβR контролирует толерантность тимуса, регулируя частоту и состав внутритимусных DC, необходимых для эффективной отрицательной селекции тимоцитов, а не генерации Treg.
Кроме того, у мышей с дефицитом LTβR наблюдалось большее снижение количества CD4 + CD8 − тимоциты и каспаза-3 + CD5 + CD69 + тимоциты, представляющие собой клетки, подвергшиеся отрицательному отбору, хотя они не показали изменений в генерации Treg по сравнению с контрольными мышами. Эти данные указывают на то, что LTβR контролирует толерантность тимуса, регулируя частоту и состав внутритимусных DC, необходимых для эффективной отрицательной селекции тимоцитов, а не генерации Treg. 2) (1, 48). Популяция tolDC состоит из iDC (наивные DC) и альтернативно активированных DC (полузрелых), которые проявляют устойчивость к созреванию в присутствии индуцирующего сигнала (5, 48). ИДК, полученные из костного мозга, конститутивно мигрируют по периферии и лимфатической системе и распределяются в периферических тканях. iDCs плохо иммуногенны, так как они демонстрируют низкую поверхностную экспрессию костимулирующих молекул и имеют лишь скромные уровни MHC класса II (1, 48). Основной функциональной характеристикой iDCs является их способность к эндоцитозу и фагоцитозу, включая как чужеродные антигены, так и апоптотические клетки, которые происходят постоянно в стационарном состоянии. Поддержание ДК в незрелом состоянии из-за отсутствия стимулов созревания связано с толерантностью за счет индукции делеции Т-клеток, анергии и поляризации в сторону регуляторного фенотипа (4). Нагруженные антигеном iDCs в дренирующих вторичных лимфоидных органах более эффективны в индукции антиген-специфических популяций Treg, чем резидентные лимфоидные DCs in vivo (49).
2) (1, 48). Популяция tolDC состоит из iDC (наивные DC) и альтернативно активированных DC (полузрелых), которые проявляют устойчивость к созреванию в присутствии индуцирующего сигнала (5, 48). ИДК, полученные из костного мозга, конститутивно мигрируют по периферии и лимфатической системе и распределяются в периферических тканях. iDCs плохо иммуногенны, так как они демонстрируют низкую поверхностную экспрессию костимулирующих молекул и имеют лишь скромные уровни MHC класса II (1, 48). Основной функциональной характеристикой iDCs является их способность к эндоцитозу и фагоцитозу, включая как чужеродные антигены, так и апоптотические клетки, которые происходят постоянно в стационарном состоянии. Поддержание ДК в незрелом состоянии из-за отсутствия стимулов созревания связано с толерантностью за счет индукции делеции Т-клеток, анергии и поляризации в сторону регуляторного фенотипа (4). Нагруженные антигеном iDCs в дренирующих вторичных лимфоидных органах более эффективны в индукции антиген-специфических популяций Treg, чем резидентные лимфоидные DCs in vivo (49). Это подтверждает роль мигрирующих iDCs в обеспечении периферической толерантности в стационарных условиях. Более того, повторная стимуляция Т-клеток с помощью iDCs может конвертировать наивные Т-клетки в Tregs (50, 51). Поглощение апоптотических клеток поляризует DC до толерогенного состояния, что приводит к усилению анергии и гибели Т-клеток и индукции Tregs посредством секреции TGF-β1 (52, 53). Эти данные указывают на то, что апоптотические клетки, вероятно, являются недостаточным стимулом для полного созревания ДК.
Это подтверждает роль мигрирующих iDCs в обеспечении периферической толерантности в стационарных условиях. Более того, повторная стимуляция Т-клеток с помощью iDCs может конвертировать наивные Т-клетки в Tregs (50, 51). Поглощение апоптотических клеток поляризует DC до толерогенного состояния, что приводит к усилению анергии и гибели Т-клеток и индукции Tregs посредством секреции TGF-β1 (52, 53). Эти данные указывают на то, что апоптотические клетки, вероятно, являются недостаточным стимулом для полного созревания ДК.